植入物涂敷器的制作方法
该专利公开文件的申请描述了包括多种新颖创新的发明方面(下文中称为“公开内容或公开”),并且包含受版权、掩膜作品和/或其他知识产权的保护的材料。这些知识产权的各自所有者不反对任何人对公开的专利局文件/记录中出现的公开内容进行摹真复制,但除此之外保留所有权利。本公开内容的实施方式涉及针设计和相关的植入物递送设备,例如用于将药物递送到患者的眼睛。
背景技术:
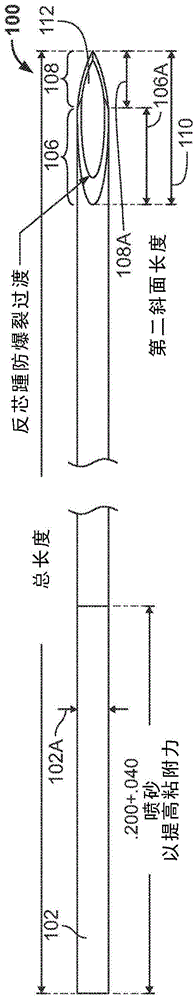
:眼内注射的使用在世界范围内越来越普遍,并且2015年是在美国最常进行的眼科手术。目前,大多数眼内注射在玻璃体内施用抗血管内皮生长因子(抗vegf)剂(诸如玻璃体内施用贝伐单抗(bevacizumab)、兰尼单抗(ranibizumab)和阿柏西普(aflibercept))以用于治疗年龄相关性黄斑变性(amd)和糖尿病性黄斑水肿(dme)。发明概述本文描述的实施方式总体上涉及医疗植入物递送装置和方法。在一些实施方式中,前房内注射器针(intracameralinjectorneedle)具有基本上圆柱形的主体,所述主体在其中限定纵向流动路径。所述主体具有近端、远端、外周面和斜面区域,其中纵向流动路径从近端延伸到远端。斜面区域的第一斜面具有相对于外周面的第一斜面角。斜面区域的第二斜面从第一斜面延伸到近端。第二斜面包括前房内注射器针的尖端,并且具有相对于外周面的第二斜面角,其中第二斜面角与第一斜面角不同,第一斜面和第二斜面限定了两者之间的过渡(transition)。斜面区域具有锥状的(tapered)宽度。该过渡是下列中的至少一种:(1)纵向定位在前房内注射器针的尖端与斜面区域的最大宽度的位置之间;以及(2)垂直设置在低于斜面区域的最大高度的50%的位置。相对于外周面的第一斜面角可以在约7.5°至约11.5°之间,例如约9.5°。相对于外周面的第二斜面角可在约18°至约22°之间,例如约20°。过渡可以位于针的尖端的大于或小于角膜厚度的距离处。例如,过渡可以位于距离前房内注射器针的尖端小于500μm和大于600μm之一。在一些实施方式中,眼内注射设备包括具有基本上圆柱形的主体的前房内注射器针,所述主体在其中限定纵向流动路径。所述主体具有近端、远端、外周面和斜面区域,其中纵向流动路径从近端延伸到远端。斜面区域的第一斜面具有相对于外周面的第一斜面角。斜面区域的第二斜面从第一斜面延伸到近端。第二斜面包括前房内注射器针的尖端,并且具有相对于外周面的第二斜面角,其中第二斜面角与第一斜面角不同,第一斜面和第二斜面限定了两者之间的过渡。斜面区域具有锥状的宽度。该过渡是下列中的至少一种:(1)纵向定位在前房内注射器针的尖端与斜面区域的最大宽度的位置之间;以及(2)垂直设置在低于斜面区域的最大高度的50%的位置。相对于外周面的第一斜面角可以在约7.5°至约11.5°之间,例如约9.5°。相对于外周面的第二斜面角可以在约18°至约22°之间,例如约20°。过渡可以位于针的尖端的大于或小于角膜厚度的距离处。例如,过渡可以位于距离前房内注射器针的尖端小于500μm和大于600μm之一。在一些实施方式中,眼内注射设备还包括:具有近端、远端和纵向轴线的盖,所述盖包括至少部分地设置在其中的在其远端的刷毛(bristle)保持器,所述刷毛保持器具有至少部分地设置在其中的刷毛;至少部分地设置在所述盖内的针座(needlehub);设置在所述针座的座套内的所述前房内注射器针;连接到所述针座的涂敷器;以及设置在所述前房内注射器针内的至少一个植入物,所述前房内注射器针和所述至少一个植入物沿着所述盖的纵向轴线基本上彼此对齐。在一些实施方式中,一种向患者施用植入物的方法包括:提供眼内注射设备,所述眼内注射设备包括预装载的针座组件和涂敷器手柄,所述预装载的针座组件包括:权利要求1或权利要求7所述的前房内注射器针、植入物,以及设置在刷毛保持器内的刷毛;向所述前房内注射器针施加力以穿透生物膜;以及致动(actuating)所述涂敷器手柄使得所述植入物通过所述前房内注射器针线性地前进。附图说明本领域技术人员将理解,附图主要是出于说明性目的,并且不旨在限制本文描述的发明主题的范围。附图不一定按比例绘制;在一些情况下,附图中可夸大或放大地示出本文公开的发明主题的多个方面,以便于理解不同的特征。在附图中,类似的附图标记通常表示类似的特征(例如,功能相似和/或结构相似的元件)。图1a-1g是根据一些实施方式的第一前房内注射器针设计(设计a)的示意图。图2a-2g是根据一些实施方式的第二前房内注射器针设计(设计b)的示意图。图3是第一磨削角(grindangle)与第二磨削角之间的过渡的示意图。图4是图1a-1e的针设计的前视图的示意图。图5是图2a-2e的针设计的前视图的示意图。图6是图1a-1e的针设计的侧视图的示意图。图7是图2a-2e的针设计的侧视图的示意图。图8是图1a-1e的针设计的俯视图的示意图。图9是图2a-2e的针设计的俯视图的示意图。图10a-10g是对比针设计(设计d)的示意图。图11是图10a-10e的针设计的前视图的示意图。图12是图10a-10e的针设计的侧视图的示意图。图13是图10a-10e的针设计的俯视图的示意图。图14是图1a-1e的针设计的针插入力的图。图15是根据一些实施方式的涂敷器针座组件的分解图。图16是根据一些实施方式的与图15的涂敷器针座组件兼容的涂敷器手柄的分解图。图17是根据一些实施方式的针长度的概率图。图18是根据一些实施方式的针入度的概率图。图19a是图1的针设计的充血评分图。图19b是由tsklaboratory制造的商业针的充血评分图。图19c是由bectondickinson制造的商业针的充血评分图。图20a示出了根据一些实施方式的在注射到眼睛中期间针过渡的定位。图20b示出了根据一些实施方式的在注射到眼睛中期间针过渡的定位。一些实施方式的详细描述已经设计了多种新型眼科疗法以经由透明外周角膜注射通过前房内注射被施用到眼睛的前房,以利用眼内压(iop)降低剂治疗青光眼。此类疗法的实例包括延长释放的前房内比马前列素或env515延长释放的前房内曲伏前列素(env515)(目前正在临床开发中)。此外,对于前房穿刺术以例如在急性闭角型青光眼期间释放升高的眼内压,以在白内障手术期间建立侧端口和/或对于需要进行经角膜注射或需要建立经角膜通道时的其他应用,需要专门针对通过透明外周角膜进行注射而优化的新型眼内针设计。注射针的进入位置和易于穿透是确定基于注射的治疗引起的眼组织损伤程度的重要因素。例如,眼睛的某些部分中的瘢痕形成可导致视敏度的降低。本公开的一些实施方式涉及改进的针设计和用于将药物递送到患者眼睛的相关植入物递送设备。这样的设计和设备可以促进患者中经角膜药物植入的改善的耐受性。具有出色锐度(sharpness)的新型针设计env515被设计为通过透明外周角膜经由前房内注射进行施用,注射部位在角膜缘内大约为1,000μm(角膜与结膜之间的过渡)。为了支持通过其他眼内注射(包括但不限于玻璃体内注射)的env515和所有其他眼内治疗的有效前房内施用,发明人惊奇地发现针设计a(参考图1、图4、图6和图8通过示例方式示出并进行描述)和针设计b(参考图2、图5、图7和图9通过示例方式示出并进行描述)(在本文中也被称为“前房内注射器针”)具有出色锐度,因此对于env515及其他眼内治疗的前房内注射、经角膜注射和递送特别有用。不希望受理论束缚,根据设计a和b制造的针的出乎意料的锐度被认为至少部分归因于针设计a和b的新颖结构特征,其中,针斜面的第一磨削与第二磨削之间的过渡发生在针斜面宽度达到针管的外径之前(这里,方向性被描述为从针的尖端开始并沿着针从针的尖端纵向移动到磨削之间的过渡,随后移动到针踵(needleheel)——参见下面图3的概览讨论)。换句话说,在示例性针设计a和b中,第一磨削和第二磨削之间的过渡位于针的尖端与沿着针的纵向轴线的针斜面达到其最大宽度的位置之间。最大斜面宽度可以等于或基本上等于针管的外径。在一些实施方式中,过渡位于距离前房内注射器针的尖端的这样的距离处:该距离不同于人角膜的厚度,以控制过渡何时(即,在注射过程中的哪个阶段)穿过角膜。例如,过渡可以位于距离前房内注射器针的尖端小于500μm(例如,450μm)或大于600μm(例如,650μm)。通过在图3中圈出318来示出示例的过渡。对于设计a和b,分别在图4和图5中提供了针的斜面内的过渡的示例的尺寸和定位,并且其在与设计a和b相关的所有附图和示意图中也作为结构特征存在。设计a和b的附加侧视图和俯视图在图6-9中示出,如下面更详细地讨论的。由于此过渡发生在针斜面宽度达到针管外径之前,出现第二设计特征,其也有助于针锐度。在设计a和b中,该过渡点相对于针的底部发生在低于针的整个高度的50%的高度(所述整个高度也可以被称为针体或轴的直径,排除斜面区域)。过渡点相对于针的高度的这种定位在图4中针对设计a并且在图5中针对设计b被示出并明确标注尺寸。针构造术语图3示出了根据一些实施方式的注射器针的结构特征的概览。如图3所示,针300包括主体或“轴”部分302,其宽度为302a(垂直于针的纵向尺寸,在本文中也被称为“高度”或“直径”),并且具有尖(或“近”)端314。“斜面”区域包括针的从针踵320延伸到尖端314的部分。斜面区域限定内腔312(在本文中也被称为孔口或孔),并且包括从针踵320延伸到过渡318的第一磨削角306。斜面区域还包括从尖端314延伸到过渡318的第二磨削角308。注意,在针内腔312的两侧(例如,左侧和右侧)都有第一磨削和第二磨削之间的过渡。设计a的说明现在转到图1,示出了针构造100。图1a示出了具有主体或“轴”部分102的针,其宽度为102a(垂直于针的纵向尺寸,在本文中也被称为“高度”或“直径”),并且具有远端150和尖(或“近”)端114。图1a示出了针的俯视图,示出了近端的内腔112,在斜面区域内限定的内腔112包括第一斜面106(在本文中也被称为“第一磨削”)和第二斜面108(在本文中也被称为“第二磨削”)。第一斜面具有长度106a,并且第二斜面具有长度108a。第一斜面长度106a和第二斜面长度108a共同限定“点长度(pointlength)”110。图1b是设计a针的第一侧视图,示出了第一斜面角106b(在本文中也被称为“第一磨削角”)以及第一斜面与第二斜面之间的过渡点118。图1c是设计a针的第二透视侧视图,示出了第二斜面角108b(在本文中也被称为“第二磨削角”)和针的尖端114。图1d是针的反/背视图。图1e示出了沿着图1b的截面a-a观察的针的端视图。图1f是针的反/背视图的放大视图,示出了相对于针横截面的中线的第二斜面旋转角。第二斜面旋转角是因变量,其实例在图1g中示出。图1g中所示的制造规格用于制造临床用的设计a针。图4示出了具有轴102的设计a针的端视图,其中针宽度(或高度)102a约为0.0163英寸(0.0163"),并且过渡118位于针横截面中线下方0.0005"至0.0015"之间。内腔112居中定位,并且还示出了第一斜面106和第二斜面108。图6示出了设计a针的透视图,还示出了过渡118、内腔(或“孔口”)112以及第一斜面106和第二斜面108。图8是设计a针的俯视图,还示出了过渡118、内腔(或“孔口”)112以及第一斜面106和第二斜面108。斜面区域外的针轴的直径在图8中被示出为约0.01634",并且斜面区域的最大宽度102a被示出为0.01631",其根据设计小于针的最大外径。内腔112的最大宽度为0.01129"。设计b的说明参考图2,示出了针构造200。图2a示出了具有主体或“轴”部分202的针,其宽度为202a(垂直于针的纵向尺寸,在本文中也被称为“高度”或“直径”),并且具有远端250和尖(或“近”)端214。图2a示出了针的俯视图,示出了近端的内腔212,在斜面区域内限定的内腔212包括第一斜面206(在本文中也被称为“第一磨削”)和第二斜面208(在本文中也被称为“第二磨削”)。第一斜面具有长度206a,并且第二斜面具有长度208a。第一斜面长度206a和第二斜面长度208a共同限定“点长度”210(其也可以被称为整体斜面长度)。图2b是设计b针的第一侧视图,示出了第一斜面角206b(在本文中也被称为“第一磨削角”)以及第一斜面与第二斜面之间的过渡点218。图2c是设计b针的第二透视侧视图,示出了第二斜面角208b(在本文中也被称为“第二磨削角”)和针的尖端214。图2d是针的反/背视图。图2e示出了沿着图2b的截面a-a观察的针的端视图。图2f是针的反/背视图的放大视图,示出了相对于针横截面的中线的第二斜面旋转角。第二斜面旋转角是因变量,其实例在图2g中示出。图2g中所示的制造规格用于制造临床用的设计b针。图5示出了具有轴202的设计b针的端视图,其中针宽度(或高度)202a约为0.0163英寸(0.0163"),并且过渡218位于针横截面中线下方0.0010"至0.0020"之间。内腔(或“孔口”)212居中定位,并且还示出了第一斜面206和第二斜面208。图7示出了设计b针的透视图,还示出了过渡218、内腔(或“孔”)212以及第一斜面206和第二斜面208。图9是设计b针的俯视图,还示出了过渡218、内腔(或“孔口”)212以及第一斜面206和第二斜面208。斜面区域外的针轴的直径在图9中被示出为约0.01634",并且斜面区域的最大宽度102a被示出为0.01620",其按照设计小于针的最大外径。内腔212的最大宽度为0.01163"。与现有针设计的比较将针设计a和b的性能与参考“设计d”进行比较,其中设计d的针缺乏上述结构特征(即,斜面的磨削表面之间的过渡不是参照本文所述的实施方式所描述的那样定位)。针设计d与针设计a和b相比较不锋利,因为第一角磨削与第二角磨削之间的过渡在斜面中发生在斜面达到(或纵向超出)其最大宽度之后,如当从尖端到针踵纵向横断针时所测量的,以及在针斜面宽度达到针管的外径之后。在针设计d中,这种过渡发生在针踵(参见图3中的附图标记320)与斜面达到其最大宽度的点之间。针对针设计d的所有结构尺寸,请参见图10-13。结果,设计d中的过渡点相对于针的底部发生在高于针的整个高度的50%。该几何图如图11-12所示。设计d针构造400在图10a-10f中示出。图10a示出了具有主体或“轴”部分402的针,其宽度为402a(垂直于针的纵向尺寸,在本文中也被称为“高度”或“直径”),并且具有远端450和尖(或“近”)端414。图10a示出了针的俯视图,示出了近端的内腔412,在斜面区域内限定的内腔412包括第一斜面406(在本文中也被称为“第一磨削”)和第二斜面408(在本文中也被称为“第二磨削”)。第一斜面具有长度406a,并且第二斜面具有长度408a。第一斜面长度406a和第二斜面长度408a共同限定“点长度”410。图10b是设计d针的第一侧视图,示出了第一斜面角406b(在本文中也被称为“第一磨削角”)以及第一斜面与第二斜面之间的过渡点418。图10c是设计d针的第二透视侧视图,示出了第二斜面角408b(在本文中也被称为“第二磨削角”)和针的尖端414。图10d是针的反/背视图。图10e示出了沿着图10b的截面a-a观察的针的端视图。图10f是针的反/背视图的放大视图,示出了相对于针横截面的中线的第二斜面旋转角。第二斜面旋转角是因变量,其实例在图10g中示出。图10g中所示的制造规格用于制造设计d针。图11示出了设计d针的端视图,其中针宽度(或高度)402a约为0.0163",并且过渡418位于针横截面中线上方0.0010"至0.0018"之间。内腔(或“孔口”)412居中定位,并且还示出了第一斜面406和第二斜面408。图12是设计d针的侧视图,示出了轴402、过渡418、第一斜面406和第二斜面408以及尖端414。图13是设计d针的俯视图,还示出了轴402、过渡418、内腔(或“孔口”)412以及第一斜面406和第二斜面408。斜面区域外的针轴的直径在图13中示出为约0.01634",并且在从第一斜面到第二斜面的过渡中的斜面区域的宽度402a被示出为0.01595"。内腔412的最大宽度为0.01214"。通过力测量进行锐度评估通过以恒定穿透速度(100mm/min)的针插入力测量来评估针锐度。将每个针插入到模拟人角膜的人造膜中,并测量插入力。针设计a的力曲线如图14所示。存在与在插入膜期间针的不同结构特征相关的若干个瞬时力峰值:·f0-针的尖端进入人造膜·f1-第一磨削与第二磨削之间的过渡进入膜·f2-第一磨削过渡到全针直径·滑动力源于全针外径间的摩擦为了比较,使用美国fda510k批准并商业销售的针作为对照——由bectondickinson(bd)销售的27规格(gauge,ga)常规壁针。针设计a、b和d按照图1-9中所示的规格由已建立的商业针制造商制造为27ga针,并测试针插入力。针对针设计a的全力曲线如图14所示,并且对于针设计a、b、d和对照27ga常规壁bd针,在表1中提供了关键力(包括f0、f1、f2和滑动力,如上所定义)的表格。表1:插入力测量(所有测量为牛顿(n))测量力和f1力的相关性先前已经确定,在env515施用期间,在人类患者的前房内注射期间,f1插入力对于人外周角膜的穿透特别重要。此前对人类患者用针进行前房内注射的f1被测量为~1.2n。这种针在前房内注射期间不能很好地穿透人角膜,并且可能导致角膜的组织损伤。对单独的一组人类患者用针进行前房内注射的f1被测量为~0.69n。这样的针表现良好。基于对人类患者的这些观察,在前房内注射和env515前房内施用期间,f1穿透力小于0.69n的针会在人类患者中表现良好,并且具有较小的f1力的针会比具有较大f1力的针表现更好。基于针设计a和b的~0.46n和~0.47n的f1力(参见上面的表1),当与对照bd针相比时,这些针对于前房内注射应用和env515施用是更优的。针设计a和b对于前房内注射、其他眼内注射和一般而言的任何注射是特别优选的。兔眼中的前房内注射根据设计a、b、d制造的和对照bd针以及摘出的兔眼由经过眼科专业培训的医生以及熟练的研发(r&d)人员(都经过前房内注射训练)使用以通过前房内注射对摘出的兔眼进行注射。基于在前房内注射期间的插入容易性(或穿透力)发现,对于前房内注射,针设计a和b比针设计d和对照bd针更优。实验结果——前房内植入物插入使用被称为env515第3代植入物涂敷器(其接替env515阶段2b-3a植入物涂敷器)的插入工具将env515(曲伏前列素)前房内植入物插入到眼睛的前房中。涂敷器是用于递送env515(曲伏前列素)前房内植入物的平台。示例的植入物涂敷器在相关的国际专利申请no.pct/us2016/021081中示出并描述,其全部内容在此通过援引明确并入本文中。涂敷器作为一次性使用的无菌27规格针式仪器提供,用于将env515植入物递送到前房中。涂敷器包括两个独立的零件并且在两个单独的无菌包装中提供:一个包含env515第3代植入物涂敷器针座组件(零件号10539-325-211revfenv515第3代植入物涂敷器——针座组件)和一个包含env515阶段2b-3a植入物涂敷器手柄(零件号10539-325-149手柄组件)。env515阶段2b-3a植入物涂敷器手柄经过设计和测试从而可与多种针座组件一起使用,包括env515阶段2b-3a植入物涂敷器针座组件和env515第3代植入物涂敷器针座组件。env515第3代植入物涂敷器使用定制的(根据设计a,参考图1a-1g所示并描述的)27规格的由已建立的皮下注射针制造商ispg,inc制造的单腔皮下注射针,以递送env515-3-2(曲伏前列素)前房内植入物。图1g中所示的制造规格用于制造临床用的设计a针。env515阶段第3代植入物涂敷器针座组件和手柄在组装和包装后通过γ辐射进行最终灭菌。对于env515-01阶段2a临床研究第3组(env515-01阶段2a包含修订05的研究方案),env515第3代植入物涂敷器(包括env515第3代植入物涂敷器针座组件和env515阶段2b-3a植入物涂敷器手柄)和env515-3-2(曲伏前列素)前房内植入物被分开包装,并且植入物在施用于患有青光眼的患者之前在无菌区域中被装载到涂敷器中。考虑到涂敷器可以以这样的方式使用,使得无菌env515植入物被预装载到无菌植入物涂敷器中,其中植入物涂敷器的针座组件用作植入物的容器封闭件。植入物涂敷器的设计、制造和使用如上所述,env515第3代植入物涂敷器被设计成利用定制的27规格单腔皮下注射针,该针由已建立的皮下注射针制造商ispg,inc制造,并且模制、机加工或现成的组件由医疗级材料制成。通过滚轮驱动的不锈钢金属轴使杆状env515植入物从针的内腔前进。根据21cfr820建立并维护了完整的设计历史文件,这些设计历史文件包括:设计和开发规划、设计输入、设计输出、设计评审、试验设计验证、设计转移和设计变更历史,并且包括:用户需求和要求报告、涂敷器用户反馈、危害分析、设计失效模式和影响分析(dfmea)以及设计符合性证书。本文参照图16描述了env515阶段2b-3a植入物涂敷器手柄(零件号10539-325-149手柄组件)的设计。设计历史文件包括符合组件质量计划和组件符合性证书的所有采购或制造组件的检查以及符合eg-gilero制造商的组件和子组件质量控制计划和组装符合性证书的设备组装的检查。env515阶段第3代植入物涂敷器被设计并制造为滚轮驱动的干燥涂敷器,该干燥涂敷器利用不锈钢轴从涂敷器针的内腔推出env515(曲伏前列素)前房内植入物。env515阶段第3代植入物涂敷器在两个单独的无菌包装中提供:一个包含env515第3代植入物涂敷器针座组件(零件号10539-325-211revfenv515第3代植入物涂敷器——针座组件)和一个包含env515阶段2b-3a植入物涂敷器手柄(零件号10539-325-149手柄组件)。env515阶段2b-3a植入物涂敷器手柄经过设计和测试从而可与多种针座组件一起使用,包括env515阶段2b-3a植入物涂敷器针座组件和env515第3代植入物涂敷器针座组件。env515第3代植入物涂敷器被制造用于根据目前的ind(env515-01阶段2a包含修订05的研究方案)提交的env515-01阶段2a第3组临床研究。在env515-01阶段2a第3组临床研究中,env515-3-2(曲伏前列素)前房内植入物将由在env515-01阶段2a第3组临床研究中的受训人员(在装载和注射程序的强制性培训之后)在临使用之前装载到env515第3代植入物涂敷器中。env515阶段第3代植入物涂敷器的设计由以下组成:env515第3代植入物涂敷器针座组件(零件号10539-325-211revfenv515第3代植入物涂敷器——针座组件)和env515阶段2b-3a植入物涂敷器手柄(零件号10539-325-149手柄组件)。env515第3代植入物涂敷器针座组件的设计被包括在图15中。env515第3代植入物涂敷器针座组件中使用的材料参见下表2。env515阶段2b-3a植入物涂敷器手柄的设计被包括在图16中。env515阶段2b-3a植入物涂敷器手柄中使用的材料参见表2。图15是根据一些实施方式的涂敷器针座组件的分解图,示出了其内部组件。如图15所示,涂敷器针座组件500a包括近端盖516、远端盖526、套式推杆连接器518、延长的第二推杆520、针座522和针524(例如,图1a-1e或图2a-2e的前房内注射器针)。表2:env515第3代植入物涂敷器针座组件中使用的材料(10539-325-211revfenv515第3代植入物涂敷器——针座组件)图16是根据一些实施方式的与图15的涂敷器针座组件兼容的涂敷器手柄的分解图。如图16所示,涂敷器手柄500b包括左手柄528a和右手柄530a,左手柄和右手柄被构造成通过例如圆柱头盖螺钉532a和532b以及螺纹嵌件548a和548b彼此连接并固定。一旦左手柄528a和右手柄530a连接在一起,连接器区域就由530a部分和530b部分形成,并且该连接器区域可以被构造成与涂敷器针座组件配合。涂敷器手柄500b还包括轮缘544a和544b、轮轴540和轮毂541(统称为“轮子组件”)、凯夫拉线538、第一推杆534、穿梭基座552、狗骨弹簧(dogbonespring)550、狗骨锚固件554、穿梭封闭件546和棘爪536。在使用期间(例如,当涂敷器手柄500b连接到图15的涂敷器针座组件并且一个或多个植入物被装载到针的内腔中时),涂敷器手柄的轮子组件可以被滚轮驱动以推进推杆534并从针的内腔中推出一个或多个植入物。表3:在env515阶段2b-3a植入物涂敷器手柄(零件号10539-325-149手柄组件)中使用的材料env515第3代植入物涂敷器零件直接与人类受试者或env515(曲伏前列素)前房内植入物接触在植入物插入眼睛的前房期间与植入物和人受试者直接接触的env515第3代植入物涂敷器零件由27gxtw9.5度第一磨削角针(10539-325-232revd27gxtw9.5度第一磨削角针)和延长的不锈钢第二推杆(10539-325-233reva延长的第二推杆)组成(图1和表1)。env515(曲伏前列素)前房内植入物在临使用之前通过针的斜面被装载到env515阶段第3代涂敷器中。在施用过程中,通过透明的外周角膜进行注射,在此期间针和涂敷器轴与透明的外周角膜接触少于20秒。27gxtw9.5度第一磨削角针是定制的27规格单腔皮下注射针,由已建立的皮下注射针制造商ispg,inc制造,如上所述。在将针组装到其针座上之后,进行目视检查以验证针斜面的边缘质量,然后进行大量测试。延长的二次推杆包括304不锈钢的拉直杆(图1和表1)。表4中示出了根据一些实施方式的用于制造env515第3代植入物涂敷器的过程的顺序步骤。表4:env515第3代植入物涂敷器的制造步骤总之,在一些实施方式中,可以采购、注塑和/或机加工组件。在一些实施方式中,针可以由已建立的皮下注射针制造商按照本文公开的方法和/或设计进行精确制造。在一些实施方式中,一些或所有组件经过检查并在组装之前被放行。针座组件的患者接触部件用去离子水、乙醇等进行彻底洗涤。针和推杆还可以经过去除热原,然后可以完全组装植入物涂敷器。根据一些实施方式,每个植入物涂敷器针座组件和手柄分开且单独地包装在例如tyvektm小袋中(热封涂层cr271073b杜邦tyvek和48gapet/1.5milpe(35791-e)-bemis),并且与适当的文件一起运至合同灭菌者以通过验证的灭菌程序进行灭菌。灭菌的植入物涂敷器可以进行以下测试:灭菌验证和无菌测试、包装完整性(密封剥离和气泡排放测试)、生物相容性(细胞毒性、溶血、致敏,急性全身毒性和刺激)、内毒素、颗粒物、酸性限度和碱性限度以及可提取金属的限度、尺寸测量和功能评估(env515植入物的装载和推出以及针入度测量),如本文所述。在加速老化条件下和如本文所述的仓库条件下进行另外的测试(参见“稳定性总结和结论[env515阶段第3代植入物涂敷器]”)。env515第3代植入物涂敷器的标签适用于tyvek小袋的标签由envisiatherapeutics设计,并且在最低限度上包含以下信息:·批号·有效期限·制造商信息·仅限处方获取·无菌·一次性使用·损坏警告·无热原下面提供标签的代表性示例。env515第3代植入物涂敷器可用于env515-01阶段2a第3组临床研究,并且作为临床试验材料试剂盒(包含env515(曲伏前列素)前房内植入物和env515第3代植入物涂敷器)提供给研究部位。下面提供了试剂盒、植入物和植入物涂敷器的示例的标签。env515试剂盒标签env515(曲伏前列素)前房内植入物无菌小瓶标签env515第3代植入物涂敷器标签制造商表5中提供了制造商列表,包括分包商。表5:药物产品制造商容器封闭件在组装和检查后,env515第3代植入物涂敷器被包装在tyvektm小袋中(用于针座和针组件二者的热封涂层cr271073b杜邦tyvek和48gapet/1.5milpe(35791-e)-bemis),并且根据经验证的灭菌方法通过γ辐射进行最终灭菌。在完成组装、包装、灭菌、环境调节/模拟运输和加速老化之后测试小袋的完整性。另外,根据本文在“稳定性总结和结论[env515第3代植入物涂敷器]”中描述的时间表进行进一步测试。env515阶段第3代植入物涂敷器在两个单独的无菌包装中提供:一个包含env515第3代植入物涂敷器针座组件(零件号10539-325-211revfenv515第3代植入物涂敷器——针座组件)和一个包含env515阶段2b-3a植入物涂敷器手柄(零件号10539-325-149手柄组件)。在组装后,env515第3代植入物涂敷器被包装在tyvektm小袋中(热封涂层cr271073b杜邦tyvek和48gapet/1.5milpe(35791-e)-bemis),并且根据经验证的灭菌方法通过γ辐射进行最终灭菌。如验证测试部分所述,在运输之后进行调节并且在升高的温度下加速老化之后测试小袋的完整性。验证测试env515阶段第3代植入物涂敷器(由env515第3代植入物涂敷器针座组件(零件号10539-325-211revfenv515第3代植入物涂敷器-针座组件)和env515阶段2b-3a植入物涂敷器手柄(零件号10539-325-149手柄组件)构成)进行设计验证测试以确保制造的设备满足设计规范。在完成组装、包装、灭菌、环境调节/模拟运输和本文所述的加速老化之后,env515阶段2b-3a植入物涂敷器已经过并通过放行检测(或试验设计验证测试)。完成组装、包装、灭菌、环境调节和模拟运输后的放行检测由以下测试组成:灭菌验证和无菌测试、包装完整性(密封剥离和气泡排放测试)、生物相容性(细胞毒性、溶血、致敏,急性全身毒性和刺激)、内毒素、颗粒物、酸性限度和碱性限度以及可提取金属的限度、尺寸测量和功能评估(env515植入物的装载和推出以及针入度测量)。模拟9个月保质期的加速老化后的测试由以下组成:包装完整性测试(密封剥离和气泡排放测试)和功能评估(env515植入物的装载和推出以及针入度测量)植入物涂敷器批次指定批次的env515阶段第3代植入物涂敷器针座组件被制造用于env515-01阶段2a第3组临床研究:针座组件零件号10539-325-211revfenv515第3代植入物涂敷器——针座组件,批号3976。指定批次的env515阶段2b-3a植入物涂敷器手柄被制造用于env515-01阶段2a第2和3组临床研究:手柄组件零件号10539-325-149/revf,批号2594。所有测试均使用这些单批env515阶段第3代植入物涂敷器针座组件和env515阶段2b-3a植入物涂敷器手柄进行。在本文的“药物产品的控制[env515第3代植入物涂敷器]”中和在“稳定性总结和结论[env515第3代植入物涂敷器]”部分中提供的数据是利用在用于env515-01阶段2a第3组临床研究的单一临床批次中制造的env515阶段第3代植入物涂敷器针座组件并且利用在用于env515-01阶段2a第2和3组临床研究的单一临床批次中制造的env515阶段2b-3a植入物涂敷器手柄生成的。设计验证-简介eg-gilero正在为envisiatherapeutics开发env515第3代针座组件(nha)和手柄组件提供支撑。以下部分总结了通过客观证据证实在加速老化至9个月的等效老化后临床评估可接受这些设备的活动和责任。env515第3代针座组件(nha)和手柄组件是在临要临床使用之前单独包装并连接的无菌设备。范围下面总结的数据包括以下测试的结果,根据方案10539-440-08prevaenv515第3代试验设计验证方案——t=8个月(注意该方案要求至少8个月加速老化。在执行方案期间,样品被加速老化9个月,从而满足测试的该最低条件要求。):·针座组件(零件号10539-325-211,批号3976):加速老化测试(t=9个月)目的以下数据的目的客观地确定了envisiatherapeuticsenv515第3代nha在t=9个月时满足产品要求。为了抽空nha样品,需要在测试期间连接手柄组件样品。在执行方案期间连接到nha样品的手柄组件样品在实时测试后被重新使用(参见针对手柄组件结果的10539-440-07r)。本文测试的材料仅用于临床,通过envisiatherapeutics在ind控制下进行。参考文献·iso7864:2016一次性使用无菌皮下注射针,第三版测试的设备·iso9626:2016医疗设备制造用不锈钢针管·astm-f1886-16通过目视检查测定软性包装密封件完整性的标准试验方法·astmf88/f88m-15软性隔栅材料的密封强度的标准试验方法·astmf2096-11用内增压法检测包装中总泄漏的标准试验方法(气泡试验)·iso11137-1:2006(e)医疗保健产品的灭菌-辐照-开发要求·10539-340-03revdenvisia涂敷器模拟使用试验方法·10001-340-02revb柔性隔栅材料密封强度试验方法·10001-340-03reva目视检查测定柔性包装材料密封件的完整性的试验方法(astmf1886)·10001-340-04reva用内增压法检测泄漏——气泡试验(astmf2096-11)·10001-340-05rev01针入度试验方法·10001-340-06revaiso7864皮下注射针试验方法出于所有目的,以上参考文献中的每一个在此通过引用明确地整体并入本文中。制备构成env515第3代针座的组件总结在附图中的设备材料清单(零件号10539-325-211revf)。在10539-325-126reva(nha小袋)和10539-325-131reva(托运人)中规定了包装。材料信息记录在定制组件的单独图纸中。在文件10539-440-07r中提供了在测试期间使用的手柄组件样品的信息。生产或生产等效组件和材料用于制造用于本文报告的测试的设备。测试以下制造批次:表6:设备批次信息用于t=9个月测试的nha组件用γ射线最大剂量灭菌(40kgy-48kgy)。预调节用于测试的针座组件在50℃下加速老化49天,相当于9个月保质期。装置在eg-gilero环境室中老化,使用a0181温度数据记录仪进行监测。然后根据astmf1886、astmf88和astmf2096测试nha包装的包装完整性。包装完整性测试的结果在单独的报告中提供(参见10539-345-10r第3代nha包装完整性报告t=9个月)。模拟使用测试结果进行模拟使用测试。使用纹理分析仪收集的数据属于测试设备的新校准周期,其在恢复测试之前完成。植入物的装载和推出(ejection)、推出的视觉指示将envisiatherapeutics提供的新植入物(envisia舱口号16066-4)(约210μmx250μmx1500μm)装载到39个针座组件的每个中,以验证植入物是否适合针并且能够通过使用手柄致动推杆来成功地从nha推出。以与将在临床研究中使用的相同方式制备并装载用于测试植入物装载和推出的设备。用镊子在放大条件下将两个新的植入物装载到每个测试样品中。植入物未被重复使用。通过评估植入物是否在过针踵处可见来评估植入物深度。将针座组件样品封端盖解封,然后将植入物从设备中推出。通过确认针末端的推杆的可见性来验证推出。所有样品设备都通过了对于植入物的装载和推出以及推出的视觉指示测试。结果总结在表8中。表8:在每个装置中装载并推出两个植入物的结果针长度使用视觉测量系统测量从针座的端部到针的尖端的针长度。验收标准为15mm+0.3mm。表9:用于针长度的装置装置micro-vu(a0010)表10:针长度数据样品id记录针长度(mm)3976-t9-0114.9033976-t9-0215.0073976-t9-0314.9953976-t9-0415.0733976-t9-0514.9273976-t9-0615.0113976-t9-0714.9613976-t9-0814.9813976-t9-0914.9973976-t9-1015.0173976-t9-1114.9373976-t9-1214.8613976-t9-1314.9453976-t9-1414.9533976-t9-1515.0173976-t9-1614.8853976-t9-1714.9953976-t9-1814.8873976-t9-1914.9773976-t9-2114.9193976-79-2214.9553976-t9-2314.8833976-t9-2415.0173976-t9-2515.0193975-t9-2614.9673976-t9-2715.0073976-t9-2814.9733976-t9-2914.9353976-t9-3015.0353978-t9-6014.963收集针长度作为变量数据。检查数据的正态性,然后进行分析以确保中等严格程度的95%置信区间。对于这些验收标准,使用的k值是2.140(对于双侧间隔)。使用minitab分析结果并确定结果正常。图17是根据一些实施方式的针长度的概率图。在下表11中提供lcl/ucl计算。表11:lcl和ucl计算结果lsl14.7mmlcl14.9mmusl15.3mmucl15.1mm为了可以接受,ucl<usl并且lcl>lsl。针长度数据符合中等严格程度并且是中等严格程度的可接受变量数据。装置无碎片碎片的目视检查是在正常视力或矫正视力的情况下进行的。在从无菌包装中取出后立即检查设备。任何可见的碎片都被视为失效。表12:碎片检查结果针穿刺力以100mm/min的穿透速度测量针入度。将针座组件装载到力分析仪的十字准线并缓慢降低以穿透0.4mm聚氨酯膜。测量仅用于提供信息,结果见表14。表13:用于针入度的装置装置质构分析仪(a0031)质构分析仪(a0031)5kg测力传感器(a0035)5kg测力传感器(a0035)表14:针穿刺力结果样品idf1的力(牛顿)3976-t9-010.42813976-79-020.36903976-t9-030.41643976-t9-040.45963976-t9-050.37563976-t9-060.38553976-t9-070.37163976-t9-080.38103976-t9-090.41763976-t9-110.36713976-t9-120.42973976-t9-130.36333976-t9-140.36933976-t9-150.38123976-t9-160.42513976-t9-170.39143976-t9-180.43273976-t9-210.4450397e-t9-230.41263976-t9-250.40873976-t9-250.37773976-t9-270.39793976-t9-290.44133976-t9-300.39263976-t9-310.47253976-t9-320.49603976-t9-330.44113976-t9-350.42743976-t9-360.42523976-t9-370.4251针穿刺力的要求有待确定,因为产品处于临床开发阶段。0.667n用于此统计分析的规格上限,仅用于提供信息。收集针入度作为变量数据。如方案中所述,检查数据的正态性,然后进行分析以确保严格标准的95%置信区间。由于针入度是单侧规格,因此k值2.220用于单侧间隔。使用minitab分析结果并确定结果正常。图18是根据一些实施方式的针入度的概率图。下表15中提供了ucl计算。表15:ucl计算结果usl0.667nucl0.486n为了可接受,ucl<usl。针入度的数据符合严格标准并且是严格标准的可接受的变量数据。润滑剂和针的尖端目视检查根据iso7864第11.4节(润滑剂)和第12节(针的尖端)检查nha的针。润滑剂检查要求在针的表面上没有可见的液滴状的润滑剂。针的尖端检查要求针在2.5倍放大率下(olympussz61显微镜)显得尖锐,没有羽毛边、毛刺和钩。表16:针的尖端检查结果结论在完成的试验设计验证测试中,env5152b-3a第3代涂敷器符合允许其在青光眼患者中临床使用的标准。药物产品的控制[env515第3代植入物涂敷器]envisiatherapeutics遵循依照21cfr820部分的设计控制规定。已建立并维护完整的设计历史文件,这些设计历史文件涵盖:设计和开发规划、设计输入、设计输出、设计评审、试验设计验证、设计转移和设计变更历史。env515第3代植入物涂敷器由以下组成:与之前制造并测试的env515阶段2b-3a植入物涂敷器手柄(零件号10539-325-149手柄组件)配对的新设计并制造的env515第3代针座组件(零件号10539-325-211revfenv515第3代植入物涂敷器-针座组件)。在完成组装、包装、灭菌、环境调节/模拟运输和加速老化之后,env515第3代针座组件已经过并通过放行检测(或批次性能验证检测)。在完成组装、包装、灭菌、环境调节/模拟运输和本文所述的加速老化之后,env515阶段2b-3a植入物涂敷器手柄此前已经过并通过放行检测(或批次性能验证检测)。完成组装、包装、灭菌、环境调节和模拟运输后的放行检测由以下测试组成:灭菌验证和无菌测试、包装完整性(密封剥离和气泡排放测试)、生物相容性(细胞毒性、溶血、致敏、急性全身毒性和刺激)、内毒素、颗粒物、酸性和碱性限度以及可提取金属的限度、尺寸测量和功能评估(env515植入物的装载和推出以及针入度测量)。加速老化后的测试由以下组成:包装完整性测试(目视检查、密封剥离和气泡排放测试)和功能评估(env515植入物的装载和推出以及针入度测量)。涂敷器以两个独立的无菌包装供应:一个包含env515第3代针座组件(零件号10539-325-211针座组件)和一个包含env515阶段2b-3a植入物涂敷器手柄(零件号10539-325-149手柄组件)。指定批次的env515第3代针座组件被制造用于env515-02阶段2b第3组临床研究:针座组件零件号10539-325-211,修订版f,批号3976。指定批次的env515阶段2b-3a涂敷器手柄被制造用于env515-01阶段2a第2组临床研究:手柄组件零件号10539-325-149,修订版f,批号2594。该批次的手柄组件也将用于env515-02阶段2b第3组临床研究。以下所有测试和数据均使用用于env515-01阶段2a第3组临床研究的临床批次中制造的env515第3代针座组件生成。在完成下述放行检测后,颁发符合性证书,以证明env515第3代针座组件放行检测通过了所有设计验证测试(测试coc)。灭菌验证和分析使用ansi/aami/iso13004:2013vdmax25指南对通过伽马辐射的env515第3代针座组件的灭菌进行验证。灭菌分析包括三个组成部分:生物负载测定、亚致死剂量验证和无菌测试。生物负载测定随机选择来自env515第3代针座组件临床批次的10个未照射样品进行生物负载测试并送至biotestlaboratories。对每个涂敷器样品进行需氧、真菌、孢子和专性厌氧负荷计数,并使用产品接种测定生物负载回收效率。平均调整的生物负载<每个针座组件5.2cfu。基于平均生物负载结果并参考ansi/aami/iso13137-2:2013中的表9选择验证剂量(sal10-1)。使用等于或大于平均生物负载的最接近的数字。针座组件的验证剂量为6.5kgy±10%。亚致死剂量验证在建立验证剂量之后,准备来自env515第3代针座组件的临床批次的13个针座组件样品(10个样品用于无菌测试和3个样品用于抑细菌/真菌)用于测试并且将其发送到steris。对于无菌样品,测试单元的辐射的递送剂量范围为6.20kgy至6.25kgy,对于抑细菌/抑真菌样品,递送剂量范围为42.30kgy至44.15kgy。然后处理这些样品并运送到biotestlaboratories进行测试。无菌和抑细菌/抑真菌测试biotestlaboratories在iso6级洁净室中的iso5级罩中对env515第3代针座组件的临床批次进行无菌测试。使用浸渍法在大豆酪蛋白消化培养液中进行10个env515第3代针座组件的gmp无菌试验,在30℃下孵育14天;在该测试中,没有测试样品显示出生长。对来自亚致死剂量验证的3个样品进行抑细菌/抑真菌测试。尚未发现env515第3代针座组件是抑细菌的或抑真菌的。对于临床批次的env515第3代针座组件,这两项测试的结果证实最小剂量为25kgy,无菌保证水平为10-6。通过env515第3代临床批次的γ辐射进行灭菌在27.5kgy至40.0kgy的生产剂量下通过env515第3代针座组件的γ照射进行灭菌。实际递送剂量被测量为31.0kgy至33.7kgy(灭菌证书)。灭菌验证概要γ辐射灭菌被steris验证为env515第3代植入物涂敷器针座组件的可接受灭菌方法[报告16-069tt(env515第3代针座)和灭菌证书]。遵循ansi/aami/iso1137-2:2013(vdmax25)指南以达到10-6的无菌保证水平。ansi/aami/iso13004:2013vdmax25指南也用于对通过伽马辐射的env515阶段2b-3a植入物涂敷器手柄的灭菌进行验证。γ辐射灭菌被steris验证(例如,通过灭菌分析,包括生物负载测定、亚致死剂量验证和/或无菌测试)为env515阶段2b-3a植入物涂敷器手柄的可接受的灭菌方法。环境调节(environmentalconditioning)和模拟运输按照istap2a(测试coc)对env515第3代针座组件进行环境调节。按照astmd4169-14,dc13,保证等级i(测试coc)进行模拟运输(分布模拟)。如本文所述,此前对env515阶段2a-3b植入物涂敷器手柄进行环境调节和模拟运输。在完成组装、包装、灭菌和环境调节/模拟运输后的env515第3代植入物涂敷器测试包装完整性测试按照astmf1886、astmf88和astmf2096,通过目视检查测试、密封件剥离测试和气泡排放试验对包装的env515第3代针座组件进行包装完整性测试。指定四十(40)个样品进行测试。十(10)个样品用于目视检查和剥离强度,而其余30个样品用于气泡排放测试。所有测试物品均通过目视检查、剥离强度和气泡排放测试。在之前通过目视检查、密封件剥离和气泡排放测试对包装的env515阶段2b-3a植入物涂敷器手柄进行包装完整性测试,并且所有测试的env515阶段2b-3a植入物涂敷器手柄样品通过包装完整性测试。生物相容性测试根据iso10993-1:2009,对env515第3代针座组件进行了评估以确保生物相容性。env515第3代针座组件的大部分接触面仅由针构成,这是定制设计并制造的针,该针由化学合规性符合iso9626:1991的皮下注射医用级不锈钢304制成(见图1g-10539-325-232修订版d27gxtw9.5度第一磨削角针)。细胞毒性、皮内刺激和皮肤致敏、急性全身毒性试验和溶血作为保守试验进行。该生物相容性筛选用于确认envisia材料、制造工艺和通过γ辐射循环的最终灭菌不会引入意料之外的生物相容性效应。这些评估是根据表17中列出的iso标准进行的。wuxiapptec根据goodlaboratorypractices(21cfr58)对env515第3代针座组件进行生物相容性测试。所有测试均符合定义的验收标准,总结在下表17中。表17:env515第3代针座组件的生物相容性结果此前对env515阶段2b-3a植入物涂敷器进行了细胞毒性测试,并且所有测试的env515阶段2b-3a植入物涂敷器手柄样品都通过了上表17中列出的细胞毒性测试验收标准。致热原性测试致热原性测试按照usp<85>细菌内毒素测试、usp<161>“输血和输液组件和类似医疗器械”和fda工业指导“致热原和内毒素测试:问题和解答”逐批次进行作为env515第3代针座组件放行过程的一部分。env515第3代针座组件符合env515第3代植入物涂敷器的预期用途的测试(报告号1053088),<0.05eu/针座组件。此前按照usp<85>细菌内毒素测试、usp<161>“输血和输液组件和类似医疗器械”和fda工业指导“致热原和内毒素测试:问题和解答”对env515阶段2b-3植入物涂敷器手柄进行致热原性测试。所有测试的env515阶段2b-3a植入物涂敷器手柄的样品符合其预期用途的测试。颗粒物测试wuxiapptec按照usp<788>注射剂中的颗粒物-光遮蔽法测试env515第3代针座组件的颗粒物含量(测试代码400710.1,报告42413)。环境和分辨率测试的结果表明有效的测定。在提取的针座组件样品中测试的颗粒数量保持≥10μm、≥25μm和≥50μm的低的跨颗粒尺寸范围(测试代码400710.1,报告42413)。酸性、碱性和可提取金属的测试按照iso7864(附录a、第5和第6节)测试env515第3代针座组件的酸性、碱性和可提取金属。测试样品符合在对照内的一个ph单位内的规格(在5.058测量对照的ph值;测试样品的ph值4.970(报告1762675)。所有测试样品低于单独测试的可提取金属(cd、fe、pb、sn、zn)的定量水平,并且在pb、zn、sn和fe的组合测试中低于定量水平(报告1762675)。尺寸测试env515第3代针座组件的尺寸特征(包括针长度)经过验证并发现符合要求(testcoc)。进行env515阶段2b-3a植入物涂敷器手柄的尺寸测试。发现env515阶段2b-3a植入物涂敷器手柄的所有尺寸特征均符合要求。定制针测试env515第3代针座组件使用由商业皮下注射针制造商ispg制造的定制的27规格单腔皮下注射针,并且因此按照iso7864:2016-一次性使用无菌皮下注射针中描述的要求进行测试。要求包括测试清洁度、针管合规性、针管长度公差、润滑剂检查、针尖检查、无缺陷和针内腔通畅。发现env515第3代针座组件符合所有iso7846:2016测试要求(测试coc)。功能测试envisia已经对env515第3代针座组件进行功能测试,功能测试由以下构成:对来自临床构建批次的env515第3代针座组件的代表性样品的针插入力测试,以及对完全组装并准备的env515第3代植入物涂敷器的模拟使用功能测试。模拟使用功能测试由以下构成:将两个env515-3-2植入物装载到env515第3代植入物涂敷器中并且致动涂敷器以验证该装置在启动滚轮触发器后按设计推出env515-3-2植入物。以与临床给药期间将使用的相同方式制备并装载植入物涂敷器。发现env515第3代植入物涂敷器组装设备(由env515第3代针座组件和env515阶段2b-3a植入物涂敷器手柄组成)符合(测试coc)。对env515阶段2b-3a植入物涂敷器手柄进行功能测试,发现env515阶段2b-3a植入物涂敷器手柄的所有功能测试结果都符合。env515阶段2b-3a植入物涂敷器手柄的另外的测试正在进行中。env515第3代植入物涂敷器在完成组装、包装、灭菌和加速老化后的测试在最终组装、包装和灭菌后,env515第3代针座组件在升高的温度下暴露于加速老化,模拟9个月的保质期。加速老化后的测试由以下组成:完整性测试(目视检查、密封剥离和气泡排放测试)(报告10539-345-10r)和功能评估(env515植入物的装载和推出以及针入度测量)(报告10539-440-08r)。所有用于测试的样品在50℃下加速老化49天,相当于9个月保质期。暴露于加速老化的env515第3代植入物涂敷器的包装完整性测试按照astmf1886、astmf88和astmf2096,通过目视检查测试、密封件剥离测试和气泡排放试验对包装的且经过加速老化的env515第3代针座组件进行包装完整性测试(报告10539-345-10r)。指定40个针座组件样品进行测试。10个样品用于目视检查和剥离强度,而其余30个样品用于气泡排放测试。所有测试的针座组件样品均通过了目视检查、剥离强度和气泡排放测试(报告10539-345-10r)。在加速老化后,对包装的env515阶段2b-3a植入物涂敷器手柄进行包装完整性测试,所有测试的env515阶段2b-3a植入物涂敷器手柄都通过了目视检查、剥离强度和气泡排放测试。env515阶段2b-3a植入物涂敷器暴露于加速老化的功能测试env515第3代针座组件在加速老化后的功能测试由针插入力测试和模拟使用功能测试构成(报告10539-440-08r)。模拟使用功能测试由以下构成:将两个env515-3-2植入物装载到完全组装且准备的env515第3代植入物涂敷器(由加速老化的env515第3代针座组件和env515阶段2b-3a植入物涂敷器手柄组成)中并且启动涂敷器以验证该设备在启动滚轮触发器后按设计推出env515-3-2植入物(报告10539-440-08r)。以与临床给药期间将使用的相同方式制备并装载植入物涂敷器。发现env515第3代针座组件符合(报告10539-440-08r)。此前进行了env515阶段2b-3a植入物涂敷器手柄在加速老化后的功能测试,并且发现所有结果都符合。另外的env515第3代植入物涂敷器测试另外的功能测试在仓库条件存储下正在进行(参见题为“稳定性总结和结论[env515第3代植入物涂敷器]”的部分),包括以下步骤:在仓库条件下存储,然后根据预定的时间表进行包装完整性和功能测试。稳定性总结和结论[env515第3代植入物涂敷器]env515阶段第3代植入物涂敷器保质期仅用于运输和存储后的包装完整性和完整设备功能性,因为该装置中没有组件具有有限的使用寿命。通过加速老化研究和仓库条件实时研究,提供了包络使用env515阶段2b-3a植入物涂敷器给药期间的稳定性覆盖。为了评估保质期,进行了加速老化研究并支持9个月的保质期。此外,仓库条件储存下的实时老化正在进行中,完全覆盖env515-01阶段2a第3组临床研究的给药阶段(包含修订05的env515-01阶段2a研究方案)。此外,支持env515阶段2a植入物涂敷器的稳定性研究报告了维持所有通过结果30个月的数据。稳定性测试env515阶段第3代植入物涂敷器由env515第3代植入物涂敷器针座组件(零件号10539-325-211revfenv515第3代植入物涂敷器——针座组件)和env515阶段2b-3a植入物涂敷器手柄(零件号10539-325-149手柄组件)组成。保质期测试包括在加速老化条件和仓库条件下储存env515阶段第3代植入物涂敷器。在两种条件下对制造的用于env515-01阶段2a第3组临床研究中的env515第3代植入物涂敷器的最终完全组装、包装并灭菌的批次进行这些保质期研究。在运输并且在加速和仓库条件下老化后,使用仓库和加速老化条件进行以下测试:通过气泡排放测试的小袋完整性、通过密封件剥离测试的密封件完整性以及设备功能评估。根据iso11607-1:2006最终灭菌医疗设备的包装——第1部分:材料、无菌屏障系统和包装系统的要求,这些稳定性测试挑战随着时间的推移的产品和包装的设计以确保设计输出符合设计记录中规定的设计输入。对制造的用于env515-01阶段2a第3组临床研究中的env515第3代植入物涂敷器的最终完全组装、包装并灭菌的批次按照表18所示的时间表进行这些测试。表18:稳定性研究条件和测试时间表组id老化条件温度时间1时间0-实时b典型的仓库条件(15-30℃)0个月23个月-实时a典型的仓库条件(15-30℃)3个月36个月-实时a典型的仓库条件(15-30℃)6个月49个月-实时a典型的仓库条件(15-30℃)9个月512个月-实时a典型的仓库条件(15-30℃)12个月624个月-实时a典型的仓库条件(15-30℃)24个月79个月-加速b50℃49天a研究正在进行中b研究完成设计仓库条件和加速老化研究二者的目的在于为计划的env515-01阶段2a临床研究的给药阶段提供包络稳定性覆盖。在完成时间0实时仓库条件和加速条件测试之后并且在3个月实时测试之前,计划将用env515-01阶段2a第3组临床研究中的env515第3代植入物涂敷器给药的第一名患者。在仓库条件研究的3个月样品评估之前预料到最后一名患者的最后剂量(表1,第2组,3个月时间点)。完成时间0实时测试和加速老化研究(参见“药物产品的控制[env515第3代植入物涂敷器]”部分),并且提供了从利用env515第3代植入物涂敷器对第一名患者给药前开始延伸超过计划的最后一名患者的最后计量的9个月的覆盖。由于env515(曲伏前列素)前房内植入物未预装载到env515阶段第3代植入物涂敷器中,并被单独包装,env515(曲伏前列素)前房内植入物评估(包括稳定性)在适当的容器封闭件系统中单独进行(参见本文的“容器封闭件”部分)。图19a是如图1所示的针设计a的充血评分的基于时间的图。充血或眼睛发红通过使用高分辨率彩色照片量表来定义,其提供没有充血的人眼图像和代表各数字分数的图像,数字越大表示更大程度和更严重的充血。为了比较的目的,图19b示出了由tsklaboratory制造的商业针的充血评分图,并且图19c示出了由bectondickinson制造的商业针的充血评分图。在图19a-19c的每一个中,每个绘制的充血评分包括对应于平均值的标准误差(sem)的叠加误差条。如在参考图19a-19c中可以观察到的,与历史对照相比,在使用设计aenv515针进行眼内注射后,所有长期组中的充血评分始终较低。在所有长期研究中,与历史局部pga对照相比,充血也始终减少。因此,使用改进的注射器针设计a已经显示出导致注射后充血(第3组低剂量)的严重性降低和/或更快速消解(即,恢复更快)。图20a-20b示出了根据一些实施方式的在注射到眼睛中期间针过渡的定位。注意,在图20a中,当针的尖端开始穿透内角膜层时,过渡位于外角膜层与内角膜层之间。在图20b中,当针的尖端开始穿透内角膜层时,过渡位于外角膜层和内角膜层之外(即,过渡不位于外角膜层与内角膜层之间,也不穿透外角膜层)。这样,在图20a和20b所示的每种配置中,针过渡穿过外角膜层的穿透与针的尖端穿透内角膜层不一致。虽然本文中的针设计被描述为27规格,但也可以考虑其他的针规格,并且可以受益于本文所述的新颖结构特征。不同的针规格可需要不同的斜面长度。在一些实施方式中,有利的是,在针的尖端正在穿透最内层的角膜时,第一斜面与第二斜面之间的过渡存在在角膜外部。在另一些实施方式中,有利的是,在针的尖端正在穿透最内层的角膜时,第一斜面与第二斜面之间的过渡存在在角膜内侧,而正常的人角膜厚度为~500μm至600μm。一些另外的实施方式在一些实施方式中,一种装置,其包括:第一盖;第二盖,所述第二盖包括近端、远端和纵向轴线;连接到所述第二盖的针座;设置在所述针座内的推杆连接器和推杆(pusherwire);以及前房内注射器针。所述前房内注射器针包括:基本上圆柱形的主体,所述主体在其中限定纵向流动路径,所述主体包括近端、远端、外周面和斜面区域,所述纵向流动路径从所述近端延伸到所述远端,所述斜面区域的第一斜面,其具有相对于所述外周面的第一斜面角;以及所述斜面区域的第二斜面,其从所述第一斜面延伸到所述近端,所述第二斜面:(1)包括所述前房内注射器针的尖端,并且(2)具有相对于所述外周面的第二斜面角,所述第二斜面角与所述第一斜面角不同,所述第一斜面和所述第二斜面限定两者之间的过渡,所述斜面区域具有锥状的宽度。在一些这样的实施方式中,所述过渡纵向定位在所述前房内注射器针的尖端与所述斜面区域的最大宽度的位置之间。可替代地或另外,所述过渡可以垂直设置在低于所述斜面区域的最大高度的50%的位置。所述前房内注射器针的近端被构造成接收植入物,并且所述前房内注射器针的远端设置在针座的座套(hubpocket)内。所述第一盖连接到所述针座并且设置在所述第二盖的近端,并且所述推杆、所述推杆连接器和所述前房内注射器针沿着所述第二盖的纵向轴线彼此基本对齐。所述推杆的尺寸可以使得它可以被容纳在所述前房内注射器针的筒中。所述推杆可以被构造成在附接到涂敷器时并且在使用期间与涂敷器的致动器接合。在一些实施方式中,一种涂敷器包括轮并且被配置为接收一种装置,所述装置包含:第一盖;第二盖,所述第二盖包括近端、远端和纵向轴线;连接到所述第二盖的针座;设置在所述针座内的推杆连接器和推杆;以及前房内注射器针。所述前房内注射器针包括:基本上圆柱形的主体,所述主体在其中限定纵向流动路径,所述主体包括近端、远端、外周面和斜面区域,所述纵向流动路径从所述近端延伸到所述远端,所述斜面区域的第一斜面,其具有相对于所述外周面的第一斜面角;以及所述斜面区域的第二斜面,其从所述第一斜面延伸到所述近端,所述第二斜面:(1)包括所述前房内注射器针的尖端,并且(2)具有相对于所述外周面的第二斜面角,所述第二斜面角与所述第一斜面角不同,所述第一斜面和所述第二斜面限定两者之间的过渡,所述斜面区域具有锥状的宽度。在一些这样的实施方式中,所述过渡纵向定位在所述前房内注射器针的尖端与所述斜面区域的最大宽度的位置之间。可替代地或另外,所述过渡可以垂直设置在低于所述斜面区域最大高度的50%的位置。所述前房内注射器针的近端被构造成接收植入物,并且所述前房内注射器针的远端设置在针座的座套内。所述第一盖连接到所述针座并且设置在所述第二盖的近端,并且所述推杆、所述推杆连接器和所述前房内注射器针沿着所述第二盖的纵向轴线彼此基本对齐。所述推杆的尺寸可以使得它可以被容纳在所述前房内注射器针的筒中。所述推杆可以被构造成在附接到涂敷器时并且在使用期间与涂敷器的致动器接合。所述涂敷器被构造成在使用期间通过轮的预定部分旋转使单个植入物通过所述针的近端前进。在一些实施方式中,一种装置,其包括:第一盖;具有近端、远端和纵向轴线的第二盖,所述第二盖包括在其远端至少部分地设置在其中的刷毛保持器,所述刷毛保持器具有至少部分地设置在其中的刷毛;至少部分地设置在所述第二盖内的针座;包括近端和远端的针,所述远端设置在所述针座的座套内;以及设置在所述针内的至少一个植入物,所述第一盖连接到所述针座并设置在所述第二盖的近端,所述针和所述至少一个植入物沿所述第二盖的纵向轴线基本上彼此对齐。所述针是前房内注射器针,所述前房内注射器针包括:基本上圆柱形的主体,所述主体在其中限定纵向流动路径,所述主体包括外周面和斜面区域,所述纵向流动路径从所述近端延伸到所述远端,所述斜面区域的第一斜面,其具有相对于所述外周面的第一斜面角;以及所述斜面区域的第二斜面,其从所述第一斜面延伸到所述近端,所述第二斜面:(1)包括所述前房内注射器针的尖端,并且(2)具有相对于所述外周面的第二斜面角,所述第二斜面角与所述第一斜面角不同,所述第一斜面和所述第二斜面限定两者之间的过渡,所述斜面区域具有锥状的宽度。在一些这样的实施方式中,所述过渡纵向定位在所述前房内注射器针的尖端与所述斜面区域的最大宽度的位置之间。可替代地或另外,所述过渡可以垂直设置在低于所述斜面区域最大高度的50%的位置。所述设备还可以包括推杆,所述推杆设置在所述针座内并且被构造成在附接到涂敷器时并且在使用期间与所述涂敷器的致动器接合。所述刷毛保持器可以包括刷毛保持器座,所述刷毛保持器座在其外表面上具有一个或多个肋,所述一个或多个肋被构造成与所述第二盖过盈配合。所述针座可以在其外表面上包括一个或多个肋,所述一个或多个肋被构造成与所述第二盖过盈配合。所述针和所述针座彼此连接(例如,用粘合剂)。所述刷毛可以部分地固定在刷毛保持器内(例如,用粘合剂)。在一些实施方式中,一种方法包括:将装载工具的细长部分插入到针子组件中,使得所述装载工具的细长部分基本上与所述针子组件的纵向轴线对齐;将植入物插入到所述装载工具的第一开口中;将推杆工具的细长部分插入到所述装载工具的第一开口中,使得所述植入物至少部分地被容纳在所述针子组件的针的筒内;并且从所述针子组件去除装载工具。所述装载工具的细长部分在所述针子组件的近端处被插入到所述针子组件中,所述方法还包括在从所述针子组件去除所述装载工具之后将盖连接到所述针子组件的近端。在一些实施方式中,递送设备包括细长的主体构件,其中所述细长的主体构件沿其最长尺寸限定长轴,限定用于接合使用者的顶平面,并且当使用者接合时,包括最靠近所述使用者的近端和离所述使用者最远的远端;以及套管,所述套管具有内径并限定沿所述套管的中心线的长轴,其中所述长轴基本上被定向成与所述细长的主体构件的长轴平行,并且其中所述套管的长轴在所述细长主体构件的远端附近的细长主体构件的顶平面下方不超过7毫米。在一些实施方式中,一种装置包括:具有近端、远端和纵向轴线的盖,所述盖包括在其远端至少部分地设置在其中的刷毛保持器,所述刷毛保持器具有至少部分地设置在其中的刷毛;至少部分地设置在所述盖内的针座;包括近端和远端的针,所述近端包括斜面区域并且所述远端被设置在所述针座的座套内;连接到所述针座的涂敷器;以及设置在所述针内的至少一个植入物,所述针和所述至少一个植入物沿所述盖的纵向轴线基本上彼此对齐。所述针可以是前房内注射器针,所述前房内注射器针包括:基本上圆柱形的主体,所述主体在其中限定纵向流动路径,所述主体包括近端、远端、外周面和斜面区域,所述纵向流动路径从所述近端延伸到所述远端,所述斜面区域的第一斜面,其具有相对于所述外周面的第一斜面角;以及所述斜面区域的第二斜面,其从所述第一斜面延伸到所述近端,所述第二斜面:(1)包括所述前房内注射器针的尖端,并且(2)具有相对于所述外周面的第二斜面角,所述第二斜面角与所述第一斜面角不同,所述第一斜面和所述第二斜面限定两者之间的过渡,所述斜面区域具有锥状的宽度。在一些这样的实施方式中,所述过渡纵向定位在所述前房内注射器针的尖端与所述斜面区域的最大宽度的位置之间。可替代地或另外,所述过渡可以垂直设置在低于所述斜面区域最大高度的50%的位置。在一些实施方式中,一种装置,其包括:包括近端、远端和纵向轴线的盖;预装载的针座组件,所述预装载的针座组件包括(a)针和(b)设置在刷毛保持器内的刷毛;其中所述针座组件连接到涂敷器手柄。所述针可以是前房内注射器针,所述前房内注射器针包括:基本上圆柱形的主体,所述主体在其中限定纵向流动路径,所述主体包括近端、远端、外周面和斜面区域,所述纵向流动路径从所述近端延伸到所述远端,所述斜面区域的第一斜面,其具有相对于所述外周面的第一斜面角;以及所述斜面区域的第二斜面,其从所述第一斜面延伸到所述近端,所述第二斜面:(1)包括所述前房内注射器针的尖端,并且(2)具有相对于所述外周面的第二斜面角,所述第二斜面角与所述第一斜面角不同,所述第一斜面和所述第二斜面限定两者之间的过渡,所述斜面区域具有锥状的宽度。在一些这样的实施方式中,所述过渡纵向定位在所述前房内注射器针的尖端与所述斜面区域的最大宽度的位置之间。可替代地或另外,所述过渡可以垂直设置在低于所述斜面区域最大高度的50%的位置。所述设备还可以包括推杆和推杆连接器,其被设置在所述针座组件内并且被构造成使得在使用中所述推杆与设置在所述针的筒内的一个或多个植入物接合。所述涂敷器手柄可以被构造成致动,并且所述推杆被构造成使得在使用期间每次致动涂敷器手柄时,设置在所述针的筒内的单个植入物线性地前进。在提供一系列值的情况下,应理解每个中间值(至下限单位的十分之一,除非上下文另有明确规定)在该范围的上限与下限之间并且在所述范围内的任何其他陈述或介入值包括在本公开内容中。这些较小范围的上限和下限可以独立地包括在也包括在本公开内容中的较小范围内,受所述范围中任何明确排除的限制。在所述范围包括一个或两个限制的情况下,排除那些包括的限制之一或两者的范围也包括在本公开中。如本文所用,术语“约”和“大约”通常表示所述值±10%,例如,约250μm将包括225μm至275μm,约1,000μm将包括900μm至1,100μm。虽然本文已经描述并图示了多种发明实施方式,但是本领域普通技术人员将容易想到用于执行功能和/或获得结果和/或本文描述的一个或多个优点的各种其他手段和/或结构,并且这些变化和/或修改中的每一个被认为是在本文描述的发明实施方式的范围内。更一般地,本领域技术人员将容易理解,本文描述的所有参数、尺寸、材料和配置旨在是示例性的,并且实际参数、尺寸、材料和/或配置将取决于使用本发明教导的一个或多个特定应用。本领域技术人员将认识到或能够使用不超过常规的实验确定本文所述的具体发明实施方式的许多等同物。因此,应该理解,前述实施方式仅以示例的方式呈现,并且在所附权利要求及其等同物的范围内;除了所具体描述和所要求保护的之外,本发明的实施方式可以以其他方式实施。本公开的发明实施方式涉及本文描述的每个单独的特征、系统、物品、材料、试剂盒和/或方法。此外,两个或更多个这样的特征、系统、物品、材料、试剂盒和/或方法的任何组合(如果这些特征、系统、物品、材料、试剂盒和/或方法不相互矛盾)被包括在本公开的发明范围内。上述实施方式可以以多种方式中的任何一种来实施。例如,可以使用各种材料和方法来实施(例如,设计和/或利用所公开的针的)实施方式。此外,应当理解,本发明的针以及制造并操作针的方法可以与计算机结合使用,这可以以多种形式中的任何形式实施。另外,各种发明构思可以体现为一种或多种方法(已经提供了这些方法实例)。作为方法的一部分执行的动作可以以任何合适的方式排序。因此,可以构造其中以不同于所示顺序的顺序执行动作的实施方式,实施方式可以包括同时执行一些动作,即使在示例性实施方式中示出为顺序动作。如本文中定义并使用的所有定义应理解为控制字典定义、通过引用并入的文献中的定义和/或定义的术语的普通含义。流程图的使用并不意味着限制所执行的操作的顺序。本文中描述的主题有时示出包含在不同的其他组件内或与不同的其他组件连接的不同组件。应当理解的是,这样描绘的架构仅仅是示例性的,并且实际上可以实施实现相同功能的许多其他架构。在概念意义上,实现相同功能的任何组件布置有效地“关联”,使得实现期望的功能。因此,本文中组合以实现特定功能的任何两个组件可以被视为彼此“关联”,使得实现期望的功能,而不管架构或中间组件。同样地,这样关联的任何两个组件也可以被视为彼此“可操作地连接”或“可操作地耦接”以实现期望的功能,并且能够这样关联的任何两个组件也可以被视为彼此“可操作地耦接”以实现期望的功能。可操作耦接的具体实例包括但不限于可物理配合和/或物理相互作用的组分。除非明确相反指出,否则本说明书和权利要求书中不使用数量词修饰时应理解为表示“至少一个/种”。本说明书和权利要求书中使用的短语“和/或”应理解为表示这样结合的元件中的“一个或两个”,即,在某些情况下结合存在并在其他情况下分离存在的元素。用“和/或”列出的多个元素应以相同的方式解释,即,这样结合的“一个或多个”元素。除了与“和/或”分句明确标识的元素之外,可以可选地存在其他元素,无论是与具体标识的那些元素相关还是不相关。因此,作为非限制性示例,当与诸如“包括”的开放式语言结合使用时,对“a和/或b”的引用在一个实施方式中可以仅指代a(可选地包括除b之外的元素);在另一个实施方式中可以仅指代b(可选地包括除a之外的元素);在又一个实施方式中,可以指代a和b两者(任选地包括其他元素);等等。如本文所用,“或”应理解为具有与如上所定义的“和/或”相同的含义。例如,当分隔列表中的项目时,“或”或“和/或”应被解释为包含性的,即包含至少一个,但也包括多个元素或元素列表中的多于一个元素以及(可选地)其他未列出的项目。只有明确表示相反的术语,诸如“仅一个”或“恰好一个”,或者,当在权利要求中使用时,“由...组成”将指的是包含多个元素或元素列表的恰好一个元素。一般而言,本文中使用的术语“或”当前面有排他性术语(诸如“任一”、“之一”、“仅一个”或“恰好一个”)时应当仅解释为指示排他性替代选择(即,“一个或另一个,但不是两者”)。“基本上由...组成”当在权利要求中使用时应具有其在专利法领域中使用的普通含义。如本说明书和权利要求书中所用,短语“至少一个”(关于一个或多个元素的列表)应理解为表示从元素列表中的任何一个或多个元素中选择的至少一个元素,但不一定包括元素列表中明确列出的每个和每一个元素中的至少一个元素,并且不排除元素列表中元素的任何组合。该定义还允许除了在短语“至少一个”所指的元素列表内明确标识的元素之外,可选地存在元素,无论是与明确标识的那些元素相关还是不相关。因此,作为非限制性实例,“a和b中的至少一个”(或等效地,“a或b中的至少一个”,或等效地,“a和/或b中的至少一个”)可以在一个实施方式中指代至少一个(任选地包括多于一个)a,不存在b(并且任选地包括除b之外的元素);在另一个实施方式中,可以指代至少一个(任选地包括多于一个)b,不存在a(并且任选地包括除a之外的元素);在又一个实施方式中,可以指代至少一个(任选地包括多于一个)a以及至少一个(任选地包括多于一个)b(和任选地包括其他元素);等等。所有过渡性短语,诸如“包括”、“包含”、“携带”、“具有”、“含有”、“涉及”、“持有”、“由......构成”等都应被理解为开放式的,即表示包括但不限于。只有过渡短语“由...组成”和“基本上由......组成”应分别为封闭式或半封闭式过渡短语,如美国专利局专利审查程序手册第2111.03节所述。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1