使用基于MRI的温度不确定度图利用动态解剖边界的热疗法的制作方法
本发明涉及基于源自mri温度测定系统和数据的动态热不确定度图、通过治疗设备向解剖边界内的靶组织递送的热疗法。
背景技术:
磁共振成像(mri)在组织消融过程中获得温度相关数据的使用例如在chopra(美国专利no.7,771,418)中被讨论,该专利特此通过引用被并入。mri温度测定法、所得的温度测量及其温度不确定度图、以及相关的考虑被本申请人例如在公布的申请us2015/0038883a1中讨论,该申请也通过引用被并入本文。
一般来说,使用mri法的温度测量容易受到来自本领域技术人员已知的各种来源的误差的影响。当温度测量被用作用于热能递送的反馈系统的一部分时,这些误差造成目标区域的意外加热或缺乏加热。使用mri法的治疗期间的温度测量中的误差包括瞬态运动,诸如整体患者运动、局部性前列腺运动(例如,由于肌肉或神经的加热)、和/或直肠移位。例如,瞬态运动可以在温度测量中引起显著的误差,这些误差目前通过等待(例如,20分钟)被测身体温度返回到大致恒定的值来解决。这导致从患者舒适角度来讲不太理想的治疗疗程、以及降低的患者周转量、或mri热疗法治疗设施、人员和设备的不太经济的使用。
技术实现要素:
这里描述的方法计算并且显示其中温度可以被可靠地测量的区域。临床医生然后可以基于周围结构对于意外加热的敏感性来做出知情决策来治疗这些区域或规划治疗以避开它们。
本发明的一方面针对一种用于动态地向患者的身体内的靶体积递送热疗法的方法。方法包括:确定与靶体积相对应的解剖边界,用以向靶体积递送热疗法;使用包括超声换能器阵列的热疗法敷帖器,向所述靶体积递送热疗法剂量;在计算机中,接收与患者的身体的一部分相对应的像素的n个温度数据集合,每个温度数据集合对应于使用磁共振成像(mri)装置捕获的相位图像的相应的捕获时间,其中n大于或等于m,并且m是滚动捕获时间窗口;在计算机中,对于过去的m个捕获时间中的每个捕获时间,确定每个像素处的经校正的温度;在计算机中,对于每个像素,基于过去的m个捕获时间中的每个捕获时间时的所述经校正的温度来计算温度不确定度;以及在计算机中,只有当解剖边界的一部分的温度不确定度低于阈值温度不确定度时,才修改解剖边界的所述部分。
在一个或更多个实施方案中,温度不确定度对应于在过去的m个捕获时间上在每个像素处的所述经校正的温度的标准差。在一个或更多个实施方案中,方法还包括在修改解剖边界的所述部分之前暂停热疗法剂量的递送。在一个或更多个实施方案中,方法还包括修改热疗法敷帖器中心的位置。
在一个或更多个实施方案中,方法还包括在计算机中,对解剖边界进行验证以确认解剖边界的所述部分的温度不确定度低于阈值温度不确定度。在一个或更多个实施方案中,方法还包括在计算机中,当解剖边界的所述部分的温度不确定度大于阈值温度不确定度时,生成警告。
在一个或更多个实施方案中,方法还包括在计算机中,计算在过去的m个捕获时间上在沿着解剖边界的每个点处的的标准差。在一个或更多个实施方案中,方法还包括在计算机中,生成温度不确定度图,温度不确定度图包括每个像素的温度不确定度。在一个或更多个实施方案中,方法还包括在耦合到计算机的显示器上显示温度不确定度图。
在一个或更多个实施方案中,方法还包括使在过去的m个捕获时间上在每个像素处的经校正的温度去趋势化以形成去趋势化的温度数据。在一个或更多个实施方案中,方法还包括执行在过去的m个捕获时间上在每个像素处的经校正的温度的线性回归。在一个或更多个实施方案中,方法还包括计算每个像素处的去趋势化的温度数据的标准差。在一个或更多个实施方案中,方法还包括基于每个像素处的去趋势化的温度数据的标准差来确定温度不确定度。
在一个或更多个实施方案中,方法还包括:在计算机中,接收与患者的身体的所述部分相对应的像素的新的温度数据集合;以及基于过去的m个捕获时间来计算更新的温度不确定度,过去的m个捕获时间包括新的温度数据集合。
附图说明
为了更充分地理解本发明的性质和优点,参照优选实施方案的结合附图的以下详细描述,在附图中:
图1图示说明mri温度不确定度图的截面的表示,示出前列腺边界和靶边界;
图2图示说明示例性治疗工作流程过程;
图3图示说明用于计算温度不确定度图的示例性过程;
图4是用于动态地计算靶体积中的温度的温度不确定度图的流程图;
图5a、图5b和图5c图示说明根据图4的流程图可以产生的温度不确定度图的示例;
图6是用于更新前列腺边界的方法的流程图;
图7、图8、图9和图10图示说明用于动态地计算靶体积中的温度的温度不确定度图的流程图;
图11是图示说明使温度数据去趋势化的效果的曲线图;并且
图12图示说明一些实施方案中使用的坐标系的示例。
具体实施方式
本公开提供了用于克服这样的温度测量不确定度的影响并且避免由于这样的温度不确定度而导致的误差的系统和方法。因此,mri引导式热疗法的递送的改进的准确性和效率变为可能。对于这样的疗法的一个应用是治疗病变的男性前列腺。
本发明的实施方案涉及在治疗期间动态地改变并且验证前列腺轮廓和超声敷帖器中心。在治疗期间,由于可能使基线治疗参数(例如,前列腺边界和超声敷帖器中心)无效的瞬态运动,前列腺轮廓和/或敷帖器中心可能需要被调整(手动地或自动地)。瞬态运动的示例包括整体患者运动、局部性前列腺运动(例如,由于肌肉或神经的加热)、和/或直肠移位。如果噪声破坏边界的一些区段,则前列腺轮廓也可能需要被调整。例如,可能存在由于直肠中的气体而导致的或者由于瞬态运动而导致的低信号区域。此外,前列腺轮廓可能需要被调整以避免区域的治疗(例如,区段被治疗一次,并且再次治疗是不期望的)。超声敷帖器中心可能因为超声敷帖器中心的对齐在治疗方案中或者由于瞬态运动是错误的而需要被调整。
为了考虑到瞬态运动,在治疗期间的滚动时间窗口上的给定的数据捕获时间,回溯性地计算每个像素处的温度和时间温度不确定度。
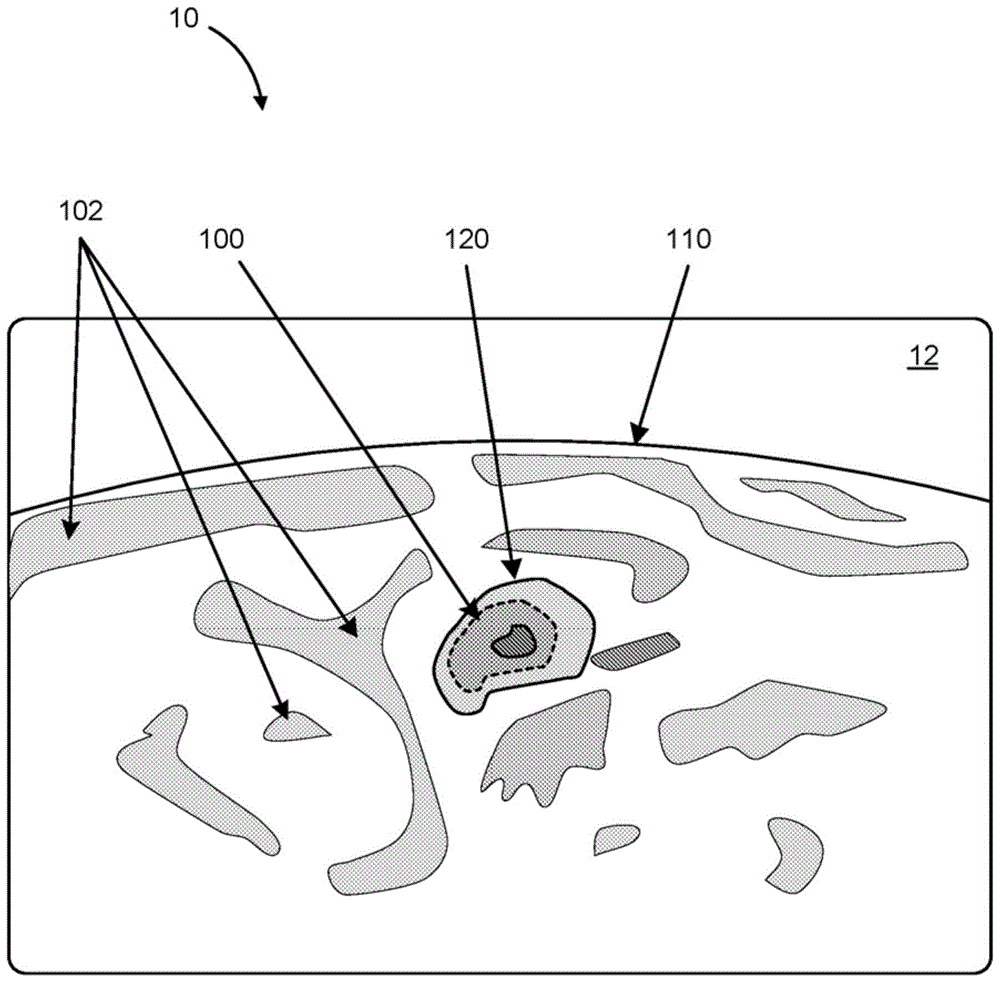
图1图示说明在治疗靶体积的附近使用成像模态(诸如患者的身体的一部分的mri成像)获取的截面图。所示的场景包括例如视觉输出装置(诸如计算机监控器屏幕10)或用于显示图像12的计算机应用程序的应用窗口。患者的身体的表面(例如,他的腹部的表面)以110示出,而患者的身体中的各种区域102被用图像12内的它们的温度和/或温度不确定度的视觉表示示出。区域102可以作为有色的轮廓、轮廓绘图、灰阶强度或温度不确定度的其他视觉表示显示在屏幕10上。经绘制且经表示的值被如以下描述的那样确定。
图像12示出靶体积(诸如男性前列腺或其一部分120)的边界。这是图像12上的外形线,其可以是计算机绘制的,或者通过操作者在屏幕10上的帮助绘制。治疗靶边界100被进一步示出在图像12上,其可以是另一颜色的轮廓、虚线轮廓或其他表示。靶边界100是预期边界,在预期边界内,热治疗过程的能量基本上被控制为设置点温度(或热剂量),确保由靶边界100限定的体积的内部内的病变细胞的快速的且足够的细胞死亡。热量可以被传导出靶边界100的外部,传导到前列腺120的边界,前列腺120的边界可以被测量和控制以实现适当的热疗法,同时合理地避免对于邻近所述病变位置的非病变的组织和器官的损害。靶边界外部的组织和器官即使被加热,也将不会超过致命的热剂量或温度限制。
用于确定和控制作为这样的边界100处的温度或期望温度的函数的热疗法治疗的强度的方法被本发明人在公众可获得的出版物和专利申请中描述,这些出版物和专利申请特此通过引用被并入。
总之,图1因此示出了温度不确定度图。温度不确定度图的三维表示可以从附加的层、切片或截面图(比如图1所示的截面图)构造。不失一般性地,本文中所描述的方法因此可以通过并排地堆叠诸如图1所示的切片以形成3d体积而被推广到三维空间。
图2图示说明示例性过程20,示例性过程20使得能够在mri引导式环境中进行热治疗,并且考虑到该过程的mri温度测定部分中的温度不确定度。该过程从200开始,并且在步骤202进行热疗法装置在患者中或在患者上的自动化的或操作者驱动的定位。在示例中,超声(u/s)热疗法敷帖器被经尿道插入到病变男性前列腺器官,并且被定位为向病变器官递送热疗法。在另一方面,患者被放置在mri成像容积或机器腔(bore)中,并且使用mri温度测定的温度扫描被逐个切片地、通过靶区域获得以生成该靶区域的热影像和/或温度不确定度图。
在步骤204获得靶区域附近的患者或患者的部分的解剖图像。在206处,系统可以自动地或半自动地确定热疗法敷帖器是否在正确的位置以向靶区域递送期望的热疗法。如果热疗法敷帖器不在正确的位置,则过程返回到202处的定位热疗法敷帖器。
一旦热疗法敷帖器装置在正确的位置,就在208处收集温度不确定度图像(比如图1中描绘的那些温度不确定度图像)。存储器或数字存储设备可以被用来存储如此收集的数据以用于分析或其他目的。
系统接着在步骤210计算并且显示如以上描绘的温度不确定度图。这些优选地被输出到计算机输出或显示装置,诸如与整个热疗法控制系统中的成像和疗法装置连接的计算机工作站监控器。
通过使用温度数据和温度不确定度图,在步骤212,确定热疗法治疗方案,并且识别靶点或靶区域。
在步骤214,从热疗法敷帖器(例如,期望的靶区域中或期望的靶区域附近的超声换能器阵列装置)递送热疗法本身。在热疗法期间,如以下所讨论的,采集并且显示附加的温度不确定度图像。
一旦热疗法过程完成,系统或操作者就在216处终止过程20。
图3图示说明示例性计算机实现的方法30中的另一组步骤,该组步骤用于在图像引导式热疗法的情况下采集图像、进行适当的校正、以及生成用于该情况的输出。
过程从300开始,并且从患者被放置于其中的核磁共振或mri装置采集一个或更多个相位图像。在实施方案中,几个(例如,三个到十个)相位图像在步骤302被采集,并且被存储在机器可读存储装置(诸如计算机存储器装置)中。mri装置可以被配置、布置、编程和操作为运行序列以实时地输出幅值和相位图像。输出图像根据需要通过信号连接或网络连接被输出到例如与mri装置耦合的另外的计算机装置,在该另外的计算机装置中,mri数据的后续计算和处理可以被执行。
在示例中,epi序列被用来采集信道未组合的相位图像。其他序列可以被如本领域技术人员将理解的那样使用,例如,gre序列。
在使用超声换能器系统的一些热疗法中,多个超声换能器元件被部署在放置在病变组织体积内的超声阵列中。对于多换能器超声疗法系统,多个图像切片可以被获取以使得一个图像切片被每一疗法敷帖器系统、每一超声换能器获取。在又一方面,监控切片图像可以在成像切片的任一端被获取以用于充分监控。序列在实施方案中被设置为自动地重复以使得相位图像的叠层在整个热疗法治疗中被连续地生成。
在步骤304,使用来自先前步骤中采集的相位图像的数据来创建参考相位图像。该参考相位图像是从热疗法过程发起加热之前的相位图像。为了增大信噪比,参考相位图像被计算为用于图像中的每个像素的几个(例如,5个)参考图像上的平均相位。
在热疗法过程之前和/或在热疗法过程期间,在步骤306收集测量图像。系统然后在步骤308计算未经校正的温度。在示例中,计算并且缩放所有信道上的相位差的加权和以便确定温度。在一方面,mri装置可以被编程为输出用于所有线圈的组合相位。在这种情况下,系统只需要计算与将被缩放的参考图像的相位差以输出感兴趣区域中的温度。
在步骤310,系统校正漂移。如前所述,漂移可能是由于时间变化或mri机器的主b0磁场中的漂移而导致的。漂移可以导致错误的(通常是较低的)温度测量,如果没有被校正的话。因此,根据本方面,我们校正图像的一个或更多个区域处的这样的漂移影响。这些区域处的温度被假定是患者身体的核心温度的温度,该温度在整个疗法治疗中基本上不变。对每个测量切片图像计算漂移的二维线性插值,并且将该插值与图像中的每个像素处的温度相加以生成漂移校正的温度图像。
在步骤312中,在耦合到计算机的显示器上显示视觉温度图。
图4是用于动态地计算靶体积中的温度的温度不确定度图的流程图40。在步骤400中,如以上所讨论的,从热疗法敷帖器(例如,期望的靶区域中或期望的靶区域附近的超声换能器阵列装置)递送热疗法。热疗法可以利用例如如以上关于图2讨论的治疗方案来递送。在步骤410中,在收集时间段(例如,动态)期间从mri装置收集mri相位图像。动态或收集时间段可以基于时间(例如,3秒到5秒)和/或收集的相位图像的数量(例如,25个到50个相位图像)。在步骤420中,通过计算(a)相位图像收集时间段期间的平均相位(平均测量相位)和(b)用于图像中的每个像素的几个(例如,5个)参考图像上的平均相位(例如,如以上所讨论的相位)之间的相位差、然后校正漂移来确定每个像素处的经校正的温度,类似于图3中描述的方式。在步骤430中,生成温度图,并且可选地显示给用户,例如,如以上关于图3讨论的那样。
在步骤440中,计算机确定存储在存储器中的温度图的数量。如果温度图的数量(n)小于m,则流程图返回到步骤410以在另外的收集时间段期间收集附加的mri相位图像(并且生成对应的温度图)。该过程重复,直到n大于或等于m,其中m是用于计算温度不确定度图的温度图的滚动窗口,如以下讨论的那样。因此,m是大于或等于2的整数,并且优选地至少为5。
当n大于或等于m时,流程图40继续进行到步骤450,在步骤450中,计算时间温度不确定度图。时间温度不确定度图是通过计算在最后m个温度图上在每个像素处的温度的标准差而形成的。例如,如果存在10个温度图(n=10)并且温度图的滚动窗口为5(m=5),则只有最后5个温度图被用来计算时间温度不确定度图。可替换地,过去的温度图中的每个基于加权平均值而被使用,其中最近的温度图具有比较旧的温度图更高的权重。
在步骤460中,在耦合到计算机的显示器上视觉地显示时间温度不确定度图。时间温度不确定度图可以根据不同的温度不确定度范围而被颜色编码。例如,蓝色的阴影可以被分配给低于第一阈值(例如,小于2℃)的温度不确定度,黄色和红色的阴影被用于第一阈值和第二阈值之间(例如,2-4℃之间)的温度不确定度,紫色的阴影被用于大于第二阈值(例如,大于4℃)的温度不确定度。
在步骤460之后,流程图40返回到步骤410以在下一个收集时间段期间收集附加的mri相位图像。在遍历流程图40的下一次迭代中,生成新的温度图(n+1),并且基于温度图m的当前滚动窗口中的温度图来计算温度不确定度图。换句话说,在下一次迭代中,温度图m的当前滚动窗口包括最新的温度图(n+1),但是不包括最后一次迭代中使用的最旧的温度图。可替换地,如以上所讨论的,所有的温度图基于加权平均值而被使用。
在一些实施方案中,在滚动窗口m上对每个像素处的温度执行线性回归,这可以减小加热(或冷却)对温度不确定度图的影响。然后在步骤450中使用去趋势化的数据来计算温度不确定度图。
滚动窗口m可以减小瞬态运动对温度不确定度图的影响。例如,瞬态运动可以在给定的温度图中的温度中引起偏移,因为例如超声敷帖器中心已经相对于基线图像移动。然而,这样的偏移的影响可以通过将偏移的温度图与还可能具有温度的偏移的随后的温度图进行比较而被随着时间的过去减小。
根据流程图40可以产生的温度不确定度图的示例在图5a-5c中被图示说明。图5a图示说明与第一时间收集时间段(例如,时间段10)相对应的第一温度不确定度图50a。在温度不确定度图50a中,存在高温度不确定度的几个区域500。温度不确定度图50a的其余部分具有低温度不确定度。高温度不确定度的区域500被设置在前列腺边界510的外部和火焰520处的前列腺边界510的内部,火焰520对应于通过敷帖器530生成的热疗法。
图5b图示说明与第二时间收集时间段(例如,时间段20)相对应的温度不确定度图50b,第二时间收集时间段发生在瞬态运动之后。可以看出,高温度不确定度的区域500在温度不确定度图50b中大于温度不确定度图50a。另外,高温度不确定度的区域500被设置为与前列腺边界510相邻。系统或操作者可以以修改的位置低于阈值(例如,2℃)的计算机验证为约束条件来修改前列腺边界510或敷帖器中心530的任何位置。
图5c图示说明与第三时间收集时间段(例如,时间段30)相对应的温度不确定度图50c。可以看出,高温度不确定度的区域500在温度不确定度图50c中、在由于本文中所讨论的滚动时间窗口m而导致的时间段之后减少。
图6是用于更新前列腺边界的方法的流程图60。在步骤600中,在耦合到计算机的显示器上显示时间温度不确定度图。在可选的步骤610中,操作者手动地或计算机自动地暂停治疗。治疗可以被暂停,例如,用以提供用于附加的时间收集时间段的时间以减小温度不确定度(例如,如以上所讨论的那样)。在步骤620中,操作者手动地或计算机自动地修改前列腺边界和/或超声敷帖器中心的位置(例如,以补偿瞬态运动)。在可选的步骤630中,操作者手动地或计算机自动地重新开始治疗。在步骤640中,计算机验证新的前列腺边界以确认前列腺边界在高温度不确定度的位置处尚未被修改。
图7是用于动态地计算靶体积中的温度的温度不确定度图的流程图70。在步骤700中,如以上所讨论的,从热疗法敷帖器(例如,期望的靶区域中或期望的靶区域附近的超声换能器阵列装置)递送热疗法。热疗法可以利用例如如以上关于图2讨论的治疗方案来递送。在步骤702中,在收集时间段(例如,动态)期间从mri装置收集mri相位图像。动态或收集时间段可以基于时间(例如,3秒到5秒)和/或收集的相位图像的数量(例如,25个到50个相位图像)。在步骤704中,对在动态期间收集的相位图像进行处理以形成温度图(例如,如以上关于图4描述的温度图)。在步骤706中,将温度图存储在具有m个温度图(对应于m个动态)的宽度的缓冲器中,其中m是用于计算温度不确定度图的温度图或动态的滚动窗口。因此,m是大于或等于2的整数,并且优选地至少为5。
如果温度图或动态的数量(n)小于或等于m,则流程图返回到步骤702以接收另外的动态,并且在步骤704中对对应的温度图进行处理,该温度图然后在步骤706中被添加到缓冲器。该过程重复,直到在步骤708中n大于m为止。
当n大于m时,流程图70继续进行到步骤710,在步骤710中,从缓冲器弃去最旧的温度图(对应于最旧的动态)。因此,缓冲器仅包含最后m个温度图或动态。在步骤710之后,流程图70继续进行到占位符a,占位符a也出现在图8中。注意,新的动态的获取和处理在整个流程图70中发生,因此温度不确定度图可以在流程图70的任何步骤期间被动态地更新。
从图8上的占位符a开始,流程图70继续进行到步骤712以对缓冲器堆中的每个像素、切片和动态执行线性回归(例如,一阶线性回归)。一阶线性回归可以使用公式t估计(x,y,z)=a1(x,y,z)t+b1(x,y,z)+ε来计算,该公式估计作为线性趋势,在最后m个动态上、对于每个像素来说温度都升高。在该方程中,x和y是指像素的坐标,z是指由n个切片构成的动态的体积上的坐标(例如,切片数量),a1对应于一阶回归的斜率,b1对应于一阶回归的截距,ε对应于数据的噪声。坐标x、y和z也在图12中被图示说明。
在步骤714中,根据公式t去趋势化(x,y,z)=t(x,y,z)-t估计(x,y,z)来使数据去趋势化,其中t(x,y,z)是通过mri温度测定法测得的温度,t估计(x,y,z)是在步骤712中计算的。图示说明使温度数据去趋势化的效果的曲线图的示例在图11中被图示说明,其中线1110表示像素的测得的加热数据,线1120表示线1110的一阶拟合,线1130表示来自像素的去趋势化的温度数据。可以看出,线1130不包括线1110的加热分量,因此改进了标准差计算。
在步骤716中,在最后m个动态上,对于每个像素计算去趋势化的数据的标准差。每个像素的标准差然后在步骤718中被显示为温度不确定度图。
在步骤720中,计算机确定用户是否已经尝试修改前列腺边界或超声敷帖器中心位置。在一些实施方案中,不管给定的点或像素处的温度不确定度如何,前列腺边界都可以被修改。如果是,则流程图70继续进行到占位符b,占位符b也出现在图9中。如果不是,则流程图70继续进行到步骤724以确定是否存在前列腺边界可能太不确定(例如,由于运动或噪声)的任何指示。如果是,则流程图70继续进行到占位符b。另外,如果系统在步骤724中确定存在前列腺边界可能太不确定的任何指示,则系统可以触发警报或暂停治疗。如果不是,则流程图70继续进行到占位符c,占位符c也出现在图10中。
从图9上的占位符b开始,流程图700继续进行到步骤728以计算前列腺边界的每个点的标准差,类似于上述方式。在步骤730中,计算机(例如,在经颜色编码的图上)显示具有高温度不确定度(例如,大于2℃)的前列腺边界区段。
在步骤732中,用户被允许修改前列腺边界上的任何点和/或移动超声敷帖器中心。在步骤734中,显示前列腺边界的经修改的区段和/或超声敷帖器的新的位置。
在步骤736中,用户被要求确认在步骤732中做出的改变(即,对于前列腺边界和/或超声敷帖器中心的修改)。如果用户没有确认改变,则流程图70返回到步骤702以接收新的动态。如果用户确认改变,则流程图70继续进行到步骤738,在步骤738中,计算前列腺边界的经修改的区段中的温度的标准差。在步骤738之后,流程图70继续进行到占位符d,占位符d出现在图10中。
从图10上的占位符d开始,流程图70继续进行到步骤740以确定每个像素的标准差是否小于2℃。如果是,则控制器被更新为使用在步骤732中修改的新的前列腺边界和/或新的超声敷帖器中心。如果在步骤740中,任何像素的标准差大于或等于2℃,则流程图70在步骤742确定用户是否已经确认和承认这个大的标准差。如果用户已经确认和承认所述大的标准差,则如以上所讨论的,流程图70继续进行到步骤744以用新的前列腺边界和/或新的超声敷帖器中心来更新控制器。如果在步骤742中,用户尚未确认和承认所述大的标准差,则流程图70返回到图9中的占位符b,此时,在步骤728中计算前列腺边界的每个点的标准差。如果经修改的前列腺边界的区段太不确定(即,大于2℃),则用户可以要么(a)等待超声敷帖器射束通过,如果用户已经修改了当前正被加热的区段的话;(b)暂停治疗并且等待温度不确定度图稳定;(c)将前列腺边界重新绘制到不同的位置(例如,以避开高温度不确定度区域);(d)承认和确认前列腺边界的至少一些区段具有高温度不确定度;要么(d)弃去对于前列腺边界的改变并且继续使用初始前列腺边界。
在控制器在步骤744中被更新之后,流程图70继续进行到步骤746以用于使控制器基于新的边界和/或新的ua中心(如果从步骤744进来)或者基于现有的边界和/或ua中心(如果从占位符c进来)来执行热疗法治疗。如以上所讨论的,流程图70还从在步骤724之后到达的占位符c继续进行到步骤746。
因此,本发明不应被认为限于上述特定实施方案。对于本发明针对的领域的技术人员来说,在阅览本公开时,本发明可以适用于的各种修改、等同过程以及许多结构将是显而易见的。
- 还没有人留言评论。精彩留言会获得点赞!