一种治疗过敏性鼻炎中药组合物的制备方法与流程
本发明涉及一种中药组合物的制备方法,具体涉及一种治疗过敏性鼻炎的中药组合物的制备方法,属于医药领域。
背景技术:
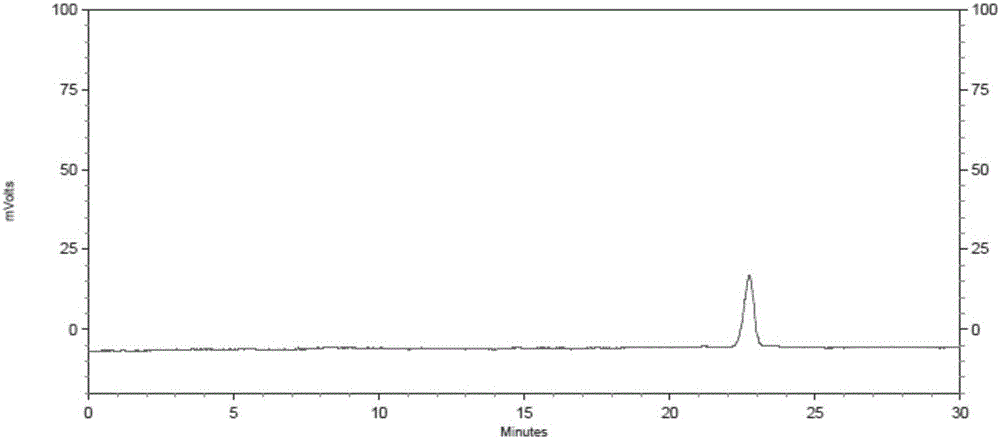
:过敏性鼻炎(allergicrhinitis,ar)即变应性鼻炎,是指特应性个体接触变应原后主要由ige介导的介质(主要是组织胺)释放,并有多种免疫活性细胞和细胞因子等参与的鼻黏膜非感染性炎性疾病。ar是最常见的过敏性疾病之一,且近年来发病率呈明显上升趋势,大约影响到全球10%-25%的人群,尤其在工业发达的国家其患病率更高。保守估计全球ar患者超过5亿。我国11个中心城市电话问卷调查显示ar患病率约为11%。ar可导致很多疾病及劳动力丧失,已经成为全球性公共健康问题。西医治疗ar以免疫疗法和药物治疗为主,存在着不足:免疫疗法变应原较难确定而且标准难一致,起效慢,疗程长,不宜坚持,难以治愈;药物治疗主要有减充血剂、抗组胺药、糖皮质激素、抗胆碱能药、肥大细胞稳定剂、白三烯受体拮抗剂等,以对症治疗、缓解症状为主,虽然缓解症状较快,但目前尚无理想的根治方法。中医治疗ar,治法集中于解表通窍、利湿化瘀等,也稍兼顾扶正。但主要以祛除表证为主,对人体正气固护不全面;对病机本质的整体性及系统性理解不足,认识水平有待提高;治疗效果尚有欠缺,不能满足临床需求。技术实现要素:为解决现有技术存在的问题,本发明提供一种治疗过敏性鼻炎的中药组合物及其制备方法。作为本发明的一个方面,本发明提供一种治疗过敏性鼻炎的中药组合物,该中药组合物由如下原料药制成:黄芪、桂枝、辛夷、防风、白术、干姜、肉桂、白芍、乌梅、五味子、知母、甘草。在具体的实施方式中,所述中药组合物由如下原料药制成:黄芪5-50重量份、桂枝3-27重量份、辛夷2-20重量份、防风3-24重量份、白术3-27重量份、干姜2-20重量份、肉桂1-8重量份、白芍2-20重量份、乌梅4-30重量份、五味子2-20重量份、知母2-20重量份、甘草2-20重量份。在优选的实施方式中,所述中药组合物由如下原料药制成:黄芪8-40重量份、桂枝4-22重量份、辛夷3-16重量份、防风4-18重量份、白术4-22重量份、干姜3-16重量份、肉桂1-6重量份、白芍3-16重量份、乌梅6-24重量份、五味子3-16重量份、知母3-16重量份、甘草3-16重量份。在进一步优选的实施方式中,所述中药组合物由如下原料药制成:黄芪10-30重量份、桂枝5-18重量份、辛夷4-12重量份、防风5-14重量份、白术5-18重量份、干姜4-12重量份、肉桂2-5重量份、白芍4-12重量份、乌梅8-20重量份、五味子4-12重量份、知母4-12重量份、甘草4-12重量份。在进一步优选的实施方式中,所述中药组合物由如下原料药制成:黄芪15-25重量份、桂枝7-12重量份、辛夷5-8重量份、防风6-9重量份、白术7-12重量份、干姜5-8重量份、肉桂2-4重量份、白芍5-8重量份、乌梅10-15重量份、五味子5-8重量份、知母5-8重量份、甘草5-8重量份。在最优选的实施方式中,所述中药组合物由如下原料药制成:黄芪21重量份、桂枝9重量份、辛夷6重量份、防风7重量份、白术9重量份、干姜6重量份、肉桂3重量份、白芍6重量份、乌梅12重量份、五味子6重量份、知母6重量份、甘草6重量份;或,所述中药组合物由如下原料药制成:黄芪16重量份、桂枝11重量份、辛夷5重量份、防风8重量份、白术8重量份、干姜7重量份、肉桂2重量份、白芍7重量份、乌梅11重量份、五味子7重量份、知母5重量份、甘草7重量份;或,所述中药组合物由如下原料药制成:黄芪24重量份、桂枝8重量份、辛夷7重量份、防风6重量份、白术11重量份、干姜5重量份、肉桂4重量份、白芍5重量份、乌梅14重量份、五味子5重量份、知母7重量份、甘草5重量份。作为优选的实施方式,所述黄芪为生黄芪;所述白术为炒白术;所述甘草为生甘草。本发明所述中药组合物可以是各原料药粉碎后混合而成的组合物,也可以混合或单独提取后得到的提取物,或者是提取物进一步精制纯化得到的有效部位,还可以是加入药学上可接受的辅料制成的常规剂型。其中,所述提取方法包括煎煮提取、回流提取、浸渍提取、超声提取、渗漉提取、微波提取等;所述纯化方法包括水提醇沉、碱溶酸沉以及各种柱色谱纯化方法,如大孔树脂柱、硅胶柱、凝胶柱、反相柱等;所述常规剂型包括但不限于注射剂、胶囊剂、片剂、颗粒剂、凝胶剂、缓释剂、口服液、滴丸剂或纳米制剂;所述药学可接受的辅料包括:填充剂、崩解剂、润滑剂、助悬剂、粘合剂、甜味剂、矫味剂、防腐剂、基质等。填充剂包括:淀粉、预胶化淀粉、乳糖、甘露醇、甲壳素、微晶纤维素、蔗糖等;崩解剂包括:淀粉、预胶化淀粉、微晶纤维素、羧甲基淀粉钠、交联聚乙烯吡咯烷酮、低取代羟丙纤维素、交联羧甲基纤维素钠等;润滑剂包括:硬脂酸镁、十二烷基硫酸钠、滑石粉、二氧化硅等;助悬剂包括:聚乙烯吡咯烷酮、微晶纤维素、蔗糖、琼脂、羟丙基甲基纤维素等;粘合剂包括,淀粉浆、聚乙烯吡咯烷酮、羟丙基甲基纤维素等。作为本发明的第二个方面,本发明提供所述中药组合物在制备治疗过敏性鼻炎的药物中的应用。作为本发明的第三个方面,本发明提供所述中药组合物在制备具有抗炎作用的药物中的应用。作为本发明的第四个方面,本发明提供所述中药组合物在制备具有抗过敏作用的药物中的应用。作为本发明的第五个方面,本发明提供所述中药组合物的制备方法,该方法包括如下步骤:选取如下原料药:黄芪5-50重量份、桂枝3-27重量份、辛夷2-20重量份、防风3-24重量份、白术3-27重量份、干姜2-20重量份、肉桂1-8重量份、白芍2-20重量份、乌梅4-30重量份、五味子2-20重量份、知母2-20重量份、甘草2-20重量份;将上述原料药直接粉碎或提取,制备临床可接受的剂型。在具体的实施方式中,所述制备方法包括如下步骤:步骤a,桂枝、干姜、肉桂、辛夷四味提取挥发油,得挥发油、水提液和药渣;步骤b,将步骤a得到的药渣单独采用常规溶剂提取,或者与黄芪、防风、白术、白芍、乌梅、五味子、知母、甘草八味合并采用常规溶剂提取;步骤c,将步骤a、b得到的提取液合并,再加入步骤a得到的挥发油,即得。其中,步骤a优选水蒸气蒸馏法提取挥发油;挥发油优选采用倍他环糊精包合;挥发油与倍他环糊精的比例为1∶(5~10);优选1∶(6~9);最优选1∶8;步骤b所述常规溶剂包括水、甲醇、乙醇;优选采用水提取;步骤c将提取液合并后还包括醇沉除杂的过程,即提取液浓缩后加乙醇至含醇量为50%~70%,取滤液回收乙醇。在优选的实施方式中,所述制备方法包括如下步骤:步骤a,取桂枝、干姜、肉桂、辛夷四味,采用水蒸气蒸馏法提取挥发油,得到挥发油a、蒸馏后的水液b和药渣c;步骤b,将挥发油a用倍他环糊精包合,挥发油与倍他环糊精的比例为1∶8;药渣c加水提取,得提取液d;步骤c,取黄芪、防风、白术、白芍、乌梅、五味子、知母、甘草八味,加水提取,得提取液e;步骤d,将提取液d、e和步骤a蒸馏后的水液b合并,加乙醇至含醇量为60%,取滤液回收乙醇,干燥,粉碎,与倍他环糊精包合物混匀,即得。本发明中药组合物可进一步加入常规辅料制成口服剂型,优选颗粒剂。因此本发明进一步提供所述中药组合物颗粒剂的制备方法,所述方法包括:取中药组合物,与赋形剂按3∶(1~2)的比例混和,采用湿法制粒,干燥,得颗粒剂。在具体的实施方式中,所述赋形剂选自糊精、乳糖、可溶性淀粉中的任意一种或几种,优选为糊精;所述润湿剂为90%~95%的乙醇溶液,优选为94%的乙醇溶液。所述组合物浸膏粉与赋形剂比例优选为3∶2。在具体的实施方式中,所述制粒过程中环境相对湿度在74%以下。作为本发明的第六个方面,本发明提供所述中药组合物颗粒剂的检测方法,所述方法包括:含量测定a:测定条件:以十八烷基硅烷键和硅胶为填充剂;以乙腈-水(25~35):(65~75)为流动相;对照品溶液的配制:取黄芪甲苷对照品,有机溶剂溶解,得对照品溶液;供试品溶液的配制:取中药组合物颗粒剂,有机溶剂提取,得供试品溶液;测定法:分别吸取对照品溶液和供试品溶液,注入液相色谱仪,测定。含量测定b:测定条件:以十八烷基硅烷键和硅胶为填充剂;以甲醇-水(10~20)∶(80~90)为流动相;对照品溶液的制备:取芍药苷对照品,有机溶剂溶解,得对照品溶液;供试品溶液的制备:取中药组合物颗粒剂,有机溶剂提取,得供试品溶液;测定法:分别吸取对照品溶液和供试品溶液,注入液相色谱仪,测定。在具体的实施方式中,所述有机溶剂选自甲醇、丙酮、正丁醇、乙酸乙酯、石油醚、氯仿中的任意一种;所述提取方法选自超声提取、回流提取、冷浸提取、渗漉提取、微波提取等方法。在优选的实施方式中,含量测定a供试品溶液制备中,采用甲醇回流提取;更进一步,供试品溶液的制备方法如下:取中药组合物颗粒剂,加甲醇冷浸过夜,回流提取,滤液回收溶剂并浓缩至干,残渣加水溶解,用水饱和正丁醇振摇提取,正丁醇提取液液用氨试液洗涤,氨试液弃去,洗涤后的正丁醇液蒸干,残渣加甲醇使溶解,即得。在优选的实施方式中,含量测定a中流动相为乙腈-水(31∶69);含量测定b中流动相为甲醇-水(15∶85)。在具体的实施方式中,所述检测方法还包括如下鉴别中的一种或几种:鉴别a:供试品溶液制备:取中药组合物颗粒剂,有机溶剂提取,得供试品溶液;对照药材溶液制备:取黄芪对照药材,有机溶剂提取,得对照药材溶液;检测:分别吸取供试品溶液和对照药材溶液,点于同一硅胶板上,以三氯甲烷-甲醇-水(10~15)∶(5~9)∶(1~3)为展开剂,展开,以10%硫酸乙醇溶液显色,在105℃加热至斑点显色清晰;鉴别b:供试品溶液制备:取中药组合物颗粒剂,有机溶剂提取,得供试品溶液;对照品溶液制备:取芍药苷对照品,有机溶剂溶解,得对照品溶液;检测:分别吸取供试品溶液和对照品溶液,点于同一硅胶板上,以三氯甲烷-乙酸乙酯-甲醇-甲酸(5~10)∶(1~3)∶(2~7)∶(0.1~0.3)为展开剂,展开,以5%香草醛硫酸溶液显色,在105℃加热至斑点显色清晰;鉴别c:供试品溶液制备:取中药组合物颗粒剂,有机溶剂提取,得供试品溶液;对照药材溶液制备:取防风对照药材,有机溶剂提取,得对照药材溶液;对照品溶液制备:取5-o-甲基维斯阿米醇苷对照品,有机溶剂溶解,得对照品溶液;检测:分别吸取供试品溶液、对照药材溶液和对照药材溶液,点于同一硅胶板上,以三氯甲烷-甲醇(3~8)∶(0.5~2)为展开剂,展开,置紫外灯(254nm)下检视;鉴别d:供试品溶液制备:取中药组合物颗粒剂,有机溶剂提取,得供试品溶液;对照药材溶液制备:取五味子对照药材,有机溶剂提取,得对照药材溶液;对照品溶液制备:取五味子醇甲对照品,有机溶剂溶解,得对照品溶液;检测:分别吸取供试品溶液、对照药材溶液和对照药材溶液,点于同一硅胶板上,以石油醚-甲酸乙酯-甲酸(12~18)∶(4~8)∶(0.5~2)为展开剂,展开,置紫外灯(254nm)下检视;鉴别e:供试品溶液制备:取中药组合物颗粒剂,有机溶剂提取,得供试品溶液;对照药材溶液制备:取甘草对照药材,有机溶剂提取,得对照药材溶液;检测:分别吸取供试品溶液和对照药材溶液,点于同一硅胶板上,以乙酸乙酯-甲酸-冰醋酸-水(12~18)∶(0.5~2)∶(0.5~2):(1~3)为展开剂,展开,以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰;在具体的实施方式中,所述有机溶剂选自甲醇、丙酮、正丁醇、乙酸乙酯、石油醚、氯仿中的任意一种;所述提取方法选自超声提取、回流提取、冷浸提取、渗漉提取、微波提取等方法。在优选的实施方式中,鉴别a供试品溶液制备方法为:取中药组合物颗粒剂,加甲醇超声提取,滤液回收溶剂并浓缩至干,残渣加水溶解,用水饱和正丁醇振摇提取,正丁醇提取液液用氨试液洗涤,氨试液弃去,洗涤后的正丁醇液蒸干,残渣加甲醇使溶解,即得。本发明所述各原料药均收载于《中国药典》2015版,炮制方法为《药典》记载方法。本发明组方中黄芪,甘、温,归肺、脾经,补气固表、健脾益肺;桂枝,辛,甘,温,归心、肺、膀胱经,温通经脉、助阳化气;二药共图温阳健脾益肺之功,用为君药。臣药一(辛夷),辛、温,归肺、胃经,功善发散风寒、通鼻窍、鼻塞,鼻渊之要药;臣药二(防风),辛、甘、微温,归膀胱、肝、脾经,祛风解表,其具升清燥湿之性,可用于脾虚湿盛,清阳不升;臣药三(白术),苦,甘,温,归脾、胃经,健脾益气;臣药四(干姜),辛、热,归脾、胃、肾、心、肺经,温中散寒,回阳通脉,燥湿消痰;臣药五(肉桂),辛、甘,大热。归肾、脾、心、肝经,补火助阳,散寒止痛,温经通脉,引火归源;五药或走表达窍、或温经通脉、或健脾益气助肺共为臣药。佐药一(白芍),苦、酸、微寒,归肝、脾经,养血敛阴、柔肝止痛、平抑肝阳,敛肺阴固肺体、畅气机益气血;佐药二(乌梅),酸、涩,平,归肝、脾、肺、大肠经,敛肺止咳,涩肠止泻,生津止渴,佐药三(五味子),酸、甘,温,归肺,心、肾经,收敛固涩,益气生津,补肾宁心,善治久嗽虚喘,津伤口渴,短气脉虚,内热消渴,心悸失眠;佐药四(知母),苦、甘,寒,归肺、胃、肾经,清热泻火,生津润燥,防肺脾两虚郁热内生;上述四药,收敛气阴,促成健脾益肺,殊途同归相合用为佐药。甘草,甘,平,归心、肺、脾、胃经,补脾益气,清热解毒,祛痰止咳,调和诸药,用为使药。全方合“温润辛金培本”原理,辛甘化阳、酸甘化阴、寒温散收并用,治病求本,共奏健脾益肺、温通利窍之功。临床研究表明,100例ar患者经本发明中药组合物治疗后,显效76例,有效15例,无效9例,有效率91%。治疗后症状体征积分、vas量表积分及血清过敏原总ige均较治疗前显著降低(p<0.01)。表明本发明中药组合物能够改善ar患者的临床症状和体征,降低患者血清过敏原总ige水平,疗效显著。附图说明图1为黄芪甲苷对照品溶液色谱图图2为中药组合物供试品溶液色谱图图3为黄芪阴性供试品溶液色谱图图4为芍药苷对照品溶液色谱图图5为中药组合物供试品溶液色谱图图6为白芍阴性供试品溶液色谱图具体实施方式实施例1中药组合物汤剂组方:黄芪21g、桂枝9g、辛夷6g、防风7g、白术9g、干姜6g、肉桂3g、白芍6g、乌梅12g、五味子6g、知母6g、甘草6g;制备方法:按比例取各原料药,水煎煮提取,得中药组合物汤剂。实施例2中药组合物汤剂组方:黄芪16g、桂枝11g、辛夷5g、防风8g、白术8g、干姜7g、肉桂2g、白芍7g、乌梅11g、五味子7g、知母5g、甘草7g;制备方法:按比例取各原料药,水煎煮提取,得中药组合物汤剂。实施例3中药组合物汤剂组方:黄芪24g、桂枝8g、辛夷7g、防风6g、白术11g、干姜5g、肉桂4g、白芍5g、乌梅14g、五味子5g、知母7g、甘草5g;制备方法:按比例取各原料药,水煎煮提取,得中药组合物汤剂。实施例4中药组合物颗粒剂组方:黄芪21g、桂枝9g、辛夷6g、防风7g、白术9g、干姜6g、肉桂3g、白芍6g、乌梅12g、五味子6g、知母6g、甘草6g;制备方法:桂枝、干姜、肉桂、辛夷提取挥发油10小时,挥发油用倍他环糊精包合,蒸馏后的水液备用,药渣加8倍量水提取1小时,滤过,滤液另器储存备用;其余黄芪、白芍等八味加水煎煮三次,每次1.5小时,合并煎液,滤过,滤液与上述二液合并,浓缩至相对密度为1.15~1.20(60℃)的清膏,加乙醇使含醇量达60%,搅拌,静置过夜,滤液回收乙醇,滤液浓缩至适量,减压干燥,粉碎成细粉,与上述倍他环糊精包合物混匀,得组合物浸膏粉;将组合物浸膏粉与糊精按3∶2的药辅比混合均匀,湿法制粒,以94%乙醇为润湿剂,环境相对湿度控制在74%以下,制备颗粒,干燥、包装即得成品颗粒。本发明研究发现,制粒过程中要严格控制环境相对湿度在74%以下,如果相对湿度高于74%,则会造成物料吸潮,制粒困难。实施例5中药组合物颗粒剂组方:黄芪16g、桂枝11g、辛夷5g、防风8g、白术8g、干姜7g、肉桂2g、白芍7g、乌梅11g、五味子7g、知母5g、甘草7g;制备方法同实施例4。实施例6中药组合物颗粒剂组方:黄芪24g、桂枝8g、辛夷7g、防风6g、白术11g、干姜5g、肉桂4g、白芍5g、乌梅14g、五味子5g、知母7g、甘草5g;制备方法同实施例4。实施例7中药组合物颗粒剂组方:黄芪18g、桂枝10g、辛夷5g、防风9g、白术7g、干姜8g、肉桂3g、白芍5g、乌梅12g、五味子5g、知母8g、甘草5g;制备方法:桂枝、干姜、肉桂、辛夷提取挥发油12小时,挥发油用倍他环糊精包合,蒸馏后的水液备用,药渣加10倍量水提取1小时,滤过,滤液另器储存备用;其余黄芪、白芍等八味加水煎煮三次,每次1.5小时,合并煎液,滤过,滤液与上述二液合并,浓缩至相对密度为1.15~1.20(60℃)的清膏,加乙醇使含醇量达70%,搅拌,静置过夜,滤液回收乙醇,滤液浓缩至适量,减压干燥,粉碎成细粉,与上述倍他环糊精包合物混匀,得组合物浸膏粉;将组合物浸膏粉与糊精按3∶1的药辅比混合均匀,湿法制粒,以94%乙醇为润湿剂,环境相对湿度控制在74%以下,制备颗粒,干燥、包装即得成品颗粒。实施例8中药组合物颗粒剂组方:黄芪23g、桂枝7g、辛夷8g、防风6g、白术10g、干姜5g、肉桂3g、白芍8g、乌梅10g、五味子8g、知母5g、甘草8g;制备方法同实施例7。实施例9中药组合物颗粒剂组方:黄芪12g、桂枝15g、辛夷4g、防风12g、白术6g、干姜10g、肉桂2g、白芍10g、乌梅9g、五味子10g、知母4g、甘草10g;制备方法同实施例7。实施例10中药组合物颗粒剂组方:黄芪27g、桂枝6g、辛夷10g、防风5g、白术15g、干姜4g、肉桂5g、白芍4g、乌梅18g、五味子4g、知母10g、甘草4g;制备方法:桂枝、干姜、肉桂、辛夷提取挥发油8小时,挥发油用倍他环糊精包合,蒸馏后的水液备用,药渣加15倍量水提取1小时,滤过,滤液另器储存备用;其余黄芪、白芍等八味加水煎煮三次,每次1.5小时,合并煎液,滤过,滤液与上述二液合并,浓缩至相对密度为1.15~1.20(60℃)的清膏,加乙醇使含醇量达50%,搅拌,静置过夜,滤液回收乙醇,滤液浓缩至适量,减压干燥,粉碎成细粉,与上述倍他环糊精包合物混匀,得组合物浸膏粉;将组合物浸膏粉与糊精按3∶2的药辅比混合均匀,湿法制粒,以95%乙醇为润湿剂,环境相对湿度控制在74%以下,制备颗粒,干燥、包装即得成品颗粒。实施例11中药组合物颗粒剂组方:黄芪9g、桂枝20g、辛夷3g、防风16g、白术4g、干姜14g、肉桂1g、白芍14g、乌梅7g、五味子14g、知母3g、甘草14g;制备方法同实施例10。实施例12中药组合物颗粒剂组方:黄芪35g、桂枝4g、辛夷14g、防风4g、白术20g、干姜3g、肉桂6g、白芍3g、乌梅22g、五味子3g、知母14g、甘草3g;制备方法同实施例10。实施例13中药组合物汤剂组方:黄芪7g、桂枝25g、辛夷2g、防风22g、白术3g、干姜18g、肉桂1g、白芍18g、乌梅5g、五味子18g、知母2g、甘草18g;制备方法:按比例取各原料药,水煎煮提取,得中药组合物汤剂。实施例14中药组合物汤剂组方:黄芪45g、桂枝3g、辛夷18g、防风3g、白术25g、干姜2g、肉桂7g、白芍3g、乌梅26g、五味子2g、知母18g、甘草2g;制备方法:按比例取各原料药,水煎煮提取,得中药组合物汤剂。实施例15中药组合物汤剂组方:黄芪15g、桂枝12g、辛夷5g、防风9g、白术7g、干姜8g、肉桂2g、白芍8g、乌梅10g、五味子8g、知母5g、甘草8g;制备方法:按比例取各原料药,水煎煮提取,得中药组合物汤剂。实施例16中药组合物片剂组方:黄芪25g、桂枝7g、辛夷8g、防风6g、白术12g、干姜5g、肉桂4g、白芍5g、乌梅15g、五味子5g、知母8g、甘草5g;制备方法:桂枝、干姜、肉桂、辛夷提取挥发油10小时,挥发油用倍他环糊精包合,蒸馏后的水液备用,药渣加8倍量水提取1小时,滤过,滤液另器储存备用;其余黄芪、白芍等八味加水煎煮三次,每次1.5小时,合并煎液,滤过,滤液与上述二液合并,浓缩至相对密度为1.15~1.20(60℃)的清膏,加乙醇使含醇量达60%,搅拌,静置过夜,滤液回收乙醇,滤液浓缩至适量,减压干燥,粉碎成细粉,与上述倍他环糊精包合物混匀,得组合物浸膏粉;将组合物浸膏粉加入常规片剂辅料制成片剂。实施例17中药组合物片剂组方:黄芪30g、桂枝5g、辛夷12g、防风5g、白术18g、干姜4g、肉桂5g、白芍4g、乌梅20g、五味子4g、知母12g、甘草4g;制备方法同实施例16。实施例18中药组合物片剂组方:黄芪10g、桂枝18g、辛夷4g、防风14g、白术5g、干姜12g、肉桂2g、白芍12g、乌梅8g、五味子12g、知母4g、甘草12g;制备方法同实施例16。实施例19组方:黄芪提取物21g、桂枝提取物9g、辛夷提取物6g、防风提取物7g、白术提取物9g、干姜提取物6g、肉桂提取物3g、白芍提取物6g、乌梅提取物12g、五味子提取物6g、知母提取物6g、甘草提取物6g。实施例20组方:黄芪提取物16g、桂枝提取物11g、辛夷提取物5g、防风提取物8g、白术提取物8g、干姜提取物7g、肉桂提取物2g、白芍提取物7g、乌梅提取物11g、五味子提取物7g、知母提取物5g、甘草提取物7g。实施例21组方:黄芪提取物24g、桂枝提取物8g、辛夷提取物7g、防风提取物6g、白术提取物11g、干姜提取物5g、肉桂提取物4g、白芍提取物5g、乌梅提取物14g、五味子提取物5g、知母提取物7g、甘草提取物5g。实施例22组方:黄芪提取物18g、桂枝提取物10g、辛夷提取物5g、防风提取物9g、白术提取物7g、干姜提取物8g、肉桂提取物3g、白芍提取物5g、乌梅提取物12g、五味子提取物5g、知母提取物8g、甘草提取物5g。实施例23组方:黄芪提取物23g、桂枝提取物7g、辛夷提取物8g、防风提取物6g、白术提取物10g、干姜提取物5g、肉桂提取物3g、白芍提取物8g、乌梅提取物10g、五味子提取物8g、知母提取物5g、甘草提取物8g。以上实施例19-23所述桂枝提取物、干姜提取物、肉桂提取物、辛夷提取物分别为桂枝、干姜、肉桂、辛夷的挥发油提取物;所述黄芪提取物、防风提取物、白术提取物、白芍提取物、乌梅提取物、五味子提取物、知母提取物、甘草提取物分别为黄芪、防风、白术、白芍、乌梅、五味子、知母、甘草经水提醇沉工艺制备的提取物,所述醇沉浓度为60%。实施例24临床效果实验1资料与方法1.1一般资料对照组:2009年10月至2010年7月就诊于中日友好医院、符合气虚证(肺脾两虚)的ar患者病例资料20例,年龄(42.1±12.3)岁,其中男12例,女8例。实验组:2010年10月至2014年10月就诊于中日友好医院、符合气虚证(肺脾两虚)的ar患者病例资料100例,年龄(44.2±14.1)岁,其中男57例,女43例。1.2诊断标准ar的诊断标准参照中华耳鼻咽喉头颈外科杂志编委会、中华医学会耳鼻咽喉头颈外科学分会鼻科学组制定的《变应性鼻炎诊断和治疗指南(2009)》拟定。中医辨证诊断标准参照中华人民共和国国家标准gb/t16751.2-1997《中医临床诊疗术语·证候部分》结合临床研究并积累专家共识三者结合制定,具体表现为:肺脾两虚、肺窍失利所致鼻塞、喷嚏频作、流涕似水;或伴倦怠乏力,或伴怕冷、畏风,或伴皮肤风团,或纳谷不香,或食后腹胀,或伴大便不调、溏、排出无力,或睡眠不实或多梦,或口干,或口干苦,或伴咳嗽,或伴咯白黏痰;舌胖大有齿痕,舌苔白或白微腻或白微黄;脉细弱或沉细。纳入标准①诊断为ar并符合中医气虚证(肺脾两虚)之证型者;②年龄在18-70岁之间,性别不限;③病程在1年以上。排除标准①妊娠或哺乳期妇女;②伴有其它严重疾病患者;③合并精神疾病或严重神经官能症患者;④不能表达主观不适症状者;⑤同时接受吸入皮质类固醇治疗,或有鼻部其他异常而可能干扰疗效评估者。1.3疗效指标1.3.1主要疗效指标医生记录患者症状积分联合观察患者体征积分(二者积分相加,为治疗总积分)。1.3.1.1症状积分标准:见表1。表1症状积分标准分级记分鼻痒喷嚏*流涕**鼻塞0分无无无无1分间断3-5<4有意识吸气时感觉2分蚁行感,但可忍受6-105-9间歇性或交互性3分蚁行感,难忍>11>10几乎全天用口呼吸注:*1次连续喷嚏个数;**每日擤鼻次数。1.3.1.2体征积分标准:见表2。表2体征积分标准1.3.2次要疗效指标1.3.2.1患者自行评估其症状的视觉模拟评分量表(visualanalogscale,vas)记分:嘱病人根据最近1周的症状表现,在标尺上标出该症状所得的分数,具体项目为鼻痒、鼻塞、喷嚏、流涕,眼部症状包括眼痒、眼红肿、流泪、眼痛、憋气、喘息、咳嗽、胸部压迫感。vas制成卡尺状,两面各有10cm长的横向刻度,卡尺一面在横线的两端有微笑和痛苦两种不同卡通表情,卡尺另一面横线一端标0,表示无症状;另一端为10,表示症状极为严重;中间数字表示不同程度。问卷调查时,研究者将卡尺卡表情一面向着患者,让患者自我评估鼻炎及相关症状严重程度,移动卡尺上的移标,研究者记录卡尺另一侧相对应数值。计算各症状vas(multi-vas)评分之和。另记录患者总症状vas(uni-vas,总症状vas为患者在标记了0-10的卡尺上自我评估其总体不适感,一般由研究者询问患者“您总体感觉您的疾病痛苦程度如何”并让患者指定卡尺上的数字进行评估)。1.3.2.2血清过敏原总ige测定:治疗前后的血清过敏原总ige由中日友好医院呼吸科检验室进行检测,<60ku/l判断为阴性;≥60ku/l判断为阳性。1.4疗效判定标准参照2009年《变应性鼻炎诊断和治疗指南(2009)》的疗效判定标准。根据治疗前后记分的总和,疗效按下列公式评定:(治疗前总积分-治疗后总积分)/治疗前总积分×100%。≥51%为显效,50%-21%为有效,≤20%为无效。1.5方法1.5.1药物对照药物:生黄芪21g,桂枝9g,防风6g,辛夷6g,炒白术9g,干姜6g,白芍6g,生甘草6g;实验药物:黄芪21g、桂枝9g、辛夷6g、防风7g、白术9g、干姜6g、肉桂3g、白芍6g、乌梅12g、五味子6g、知母6g、甘草6g。1.5.2服用方法每日1剂,水煎分2次服,7d为1个疗程,连服2个疗程,共14d。1.5.3统计学方法使用spss17.0对各项资料进行统计、分析,各项参数以x-±s表示,采用配对wilcoxon符号秩和检验,以p<0.05为差异有统计学意义。2实验结果2.1有效率结果结果见表1。表3临床疗效结果样本量显效率有效率对照组204(20%)15(75%)实验组10076(76%)15(15%)结果表明,对照组20人的实验中显效率20%,有效率75%;实验组扩大了样本量,同时对组方进行了优化,改良组方对患者临床症状的更明显的改善和缓解,其中100个患者中显效率为76%,总有效率91%。2.2实验组治疗前后症状积分结果结果见表4。表4实验组100例患者治疗前后状体征积分比较(x-±s,分)项目治疗前治疗后鼻痒2.58±0.501.20±0.55**喷嚏1.97±0.860.08±0.27**流涕2.72±0.530.06±0.23**鼻塞2.44±0.770.76±0.71**体征计分2.04±0.270.89±0.72**注:与治疗前比较,**p<0.01。下表同。2.3实验组治疗前后vas总积分、总症状vas比较结果见表5。治疗后vas总积分与总症状vas均显著低于治疗前,差异有统计学意义(p<0.01)。表5100例患者治疗前后vas及过敏原总ige比较(x-±s,分)项目治疗前治疗后vas总积分16.43±2.635.21±2.57**总症状vas8.24±1.903.17±3.20**ige77.56±11.1659.63±9.63*2.4实验组治疗前后过敏原总ige值比较。过敏原总ige治疗后显著降低,甚至可降至正常水平(<60ku/l),差异有统计学意义(p<0.01)。ar病机本质呈现虚实寒热错杂,证候特征以肺脾两虚为主,涉及多个脏器的功能虚损,故而,只有进行“以肺脾为核心的脏腑整体辨证”,运用“温润辛金培本”的治疗原理,才能彻底治愈ar。本研究通过对100例ar患者自身前后对照临床研究观察,说明本发明中药组合物治疗ar临床疗效较好,治疗后主、次要疗效指标均优于治疗前,总有效率达到91%;充分继承了中医的整体观念和脏腑辨证理论,反映了ar患者以肺脾为核心的脏腑功能失调、身体机能状态整体下降的本质问题;弥补了目前中成药多从实证着手,以祛除表证为主,稍兼顾扶正,总体对人体正气固护不全面的缺陷。实施例25药效学研究本研究基于本发明中药组合物功效主治及ar发病机制,建立tdi所致豚鼠ar模型、卵蛋白所致ar模型、二甲苯致小鼠耳肿胀模型、大鼠棉球肉芽肿模型、大鼠同种被动皮肤过敏反应模型及小鼠耳异种被动皮肤过敏反应模型,观察本发明中药组合物对ar的治疗作用,以期为其进一步临床应用提供实验依据。1对tdi所致豚鼠变应性鼻炎的影响采用10%tdi橄榄油溶液滴鼻法建立ar豚鼠模型,模型成功后,连续给药14d后,观察各组行为学并进行评分,酶联免疫吸附法(elisa)检测血清ige、ifn-γ、il-12、il-4、il-6、tnf-α以及鼻黏膜his的含量,免疫组织化学染色法检测鼻黏膜组织il-6、tnf-α、ifn-γ含量。光学显微镜下观察鼻黏膜组织病理学变化及病理评分,并进行嗜酸性粒细胞(eos)计数。1.1材料与方法1.1.1材料1.1.1.1动物及分组spf级豚鼠,70只(北京维通利华实验动物技术有限公司),动物许可证号为scxk(京)2012-0001,体质量220~240g,随机分为正常组、模型组、鼻炎康组(0.41g/kg)、氯雷他定组(0.91mg/kg)、中药组合物高剂量组(3.04g/kg)、中剂量组(1.52g/kg)、低剂量组(0.76g/kg),每组10只,雌雄各5只。1.1.1.2药物与试剂氯雷他定片(西安杨森,产品批号:050218967);鼻炎康片(国药集团,产品批号:14272);本发明中药组合物颗粒剂(按实施例4方法制备,1g相当于5.7577g生药量,蒸馏水配置成0.304g/ml备用);2,4-甲苯二异氰酸酯(tdi,sigma公司,bw-d0007);橄榄油(国药集团,产品批号:20140725);豚鼠ige、il-4、il-6、il-12、tnf-α、ifn-γ、his试剂盒(蓝基生物科技有限公司,产品批号:20150724);乙醇(北京市化工厂,产品批号:20140607);甲醛溶液(天津市福晨化学试剂厂,产品批号:20141020);二甲苯(北京市通广精细化工公司,产品批号:20140719);哈瑞氏苏木素染液(北京世济合力生物科技有限公司,产品批号:20141203);哈瑞氏伊红染液(北京世济合力生物科技有限公司,产品批:20141203);dab(dako,产品批号:k5007);anti-tnfalpha抗体(abcam,产品批号:ab6671);il-6polyclonalantibody(proteintech,产品批号:21865-1-ap);interferongammapolyclonalantibody(proteintech,产品批号:15365-1-ap)。1.1.1.3实验仪器显微镜(日本olympus公司),图像分析软件(mias);采图软件nikonnis-elementsd3.2(日本尼康公司);asp300脱全自动多功能酶标仪:multiskanmk3(thermo公司);gl-21m高速冷冻离心机(上海卢湘仪离心机仪器有限公司);bx51水机(德国leica公司);eg1150h包埋机(德国leica公司);rm2235切片机(德国leica公司);hi1210摊片机(德国leica公司)。1.2方法1.2.1模型建立采用10%tdi橄榄油溶液对豚鼠双侧鼻孔滴鼻(每侧5μl),每日1次,连续7d后改为隔日1次。每日滴鼻完成后,按照以下评分标准评分:①鼻痒:轻度:轻擦鼻几次,1分;重度:抓挠鼻面不止,2分。②喷嚏:1~3个1分,4~10个2分,11个以上3分。③流涕:流至前鼻孔,1分;超出前鼻孔,2分;流涕满面3分。观察30min内各组豚鼠的过敏性症状,各症状积分叠加,总分大于5分者为造模成功。正常组以橄榄油替代10%tdi橄榄油溶液,其方法和步骤同致敏组。1.2.2分组及给药造模第8天,根据行为学评分结果,重新分组灌胃给药,连续给药14d,每日1次,tdi改为隔日滴鼻以维持过敏症状直至实验结束,滴鼻后继续观察症状并评分。模型组和正常组给予等量的蒸馏水灌胃。1.2.3检测指标及方法1.2.3.1行为学观察给药14d后观察各组豚鼠的过敏性症状,并评分记录。1.2.3.2生化及免疫学指标检测末次激发24h后,10%水合氯醛(300mg/kg)腹腔注射麻醉,腹主动脉取血,3500r/min,离心10min。分离血清,置于-80℃冰箱下保存。根据elisa试剂盒说明书步骤检测血清ige、ifn-γ、il-4、il-6、il-12、tnf-α水平。取豚鼠鼻黏膜生理盐水匀浆,elisa法检测其his含量。1.2.3.3鼻黏膜组织病理学观察每组选取5只豚鼠,迅速打开鼻背,剥去上颌骨部皮肤,沿右侧鼻中隔外侧前庭壁剪断,向上翻开暴露鼻中隔及双侧鼻腔,之后立即取双侧鼻中隔黏膜,固定于10%中性甲醛溶液中固定,石蜡包埋,切片,he染色,观察鼻黏膜病理变化,并进行eos计数。he染色操作步骤:10%中性福尔马林固定的标本,常规酒精脱水,二甲苯处理,石蜡包埋,3μm连续切片,烤干备用。二甲苯i、ii脱腊15min。无水乙醇i、无水乙醇ii、95%乙醇、80%乙醇逐级水化各2min,流水冲洗,苏木素染色10min,水洗3min,分色液10s,水洗3次,0.25%返蓝液40s,水洗3次,1%伊红染色1min,水洗3次。95%乙醇i、95%乙醇ii逐级脱水1min,无水乙醇i、ii逐级脱水2min,二甲苯i2min,二甲苯ii、iii透明5min,中性树胶封固。病理评分标准:0级,纤毛完整整齐,柱状上皮正常,少量杯状细胞,记0分;i级,杯状细胞增多,少数散在的炎症细胞,膜固有层的腺体增生占黏膜固有层的1/3以下,记1分;ii级,杯状细胞密布,纤毛倒伏不整齐、偶见脱落,较多嗜酸性细胞游出,膜固有层的腺体增生占黏膜固有层的1/3~2/3,记2分;iii级,杯状细胞密布,纤毛大量脱落,上皮层破坏或组织纹理紊乱,大量嗜酸性细胞游出占全部上皮炎症细胞的2/3以上,膜固有层的腺体增生占黏膜固有层的2/3以上,记3分。1.2.3.4免疫组化染色免疫组化染色(ihc)法检测鼻黏膜组织ifn-γ、il-6、tnf-α表达。操作步骤:鼻黏膜石蜡切片2μm经常规脱蜡(同he染色)至水,用蒸馏水洗2次,用pbs(磷酸盐缓冲液)漂洗1次,每次5min,高压锅抗原修复,pbs漂洗2~3次,每次5min;3%h2o2室温静置10min;用pbs漂洗2~3次,每次5min。滴加一抗37℃孵育2h,pbs漂洗3次,每次5min;滴加二抗室温孵育50min,dab(二氨基联苯胺)显色3~5min,在显微镜下掌握染色程度,自来水冲洗,苏木精复染2min,盐酸酒精分化,脱水,二甲苯透明,中性树胶封片。高倍镜下每张图片随机选取5个视野,胞浆内棕色颗粒为阳性标记,采用image-proplusversion6.0分析软件,分析图像面积,根据公式(iod/area),求得阳性表达光密度值。1.2.4统计方法所有数据均以均数±标准差表示,用sas9.3统计软件处理,数据服从正态分布采用方差分析,两两比较采用t检验,数据不服从正态分布或方差不齐采用非参数检验,其中豚鼠鼻黏膜病变程度采用ridit方法分析,以p<0.05或p<0.01为差异有统计学意义。1.3实验结果1.3.1对ar豚鼠行为学的影响致敏豚鼠第1d滴鼻后,30min内出现了鼻痒、喷嚏症状,表现程度轻重不同,但无明显的流涕症状,从第4d开始,随着滴鼻次数的增加,各组出现清涕,行为学症状也越来越明显,正常对照组则无明显行为学症状,提示模型复制成功。从第8天开始给药,给药14d后,除低剂量组外,各给药组与模型组比较症状均明显减轻(p<0.01或p<0.05)。结果见表6。表6各组豚鼠鼻部行为学症状评分(n=10)注:与正常组比较,▲p<0.05,▲▲p<0.01;与模型组比较,*p<0.05,**p<0.01。1.3.2对ar豚鼠血清生化免疫学指标的影响1.3.2.1对ar豚鼠血清ige的影响与正常组比较,模型组血清ige水平明显升高(p<0.05)。与模型组比较,各给药组血清ige水平均明显降低(p<0.01)。结果见表7。表7elisa法检测血清ige变化注:与正常组比较,▲p<0.05,▲▲p<0.01;与模型组比较,*p<0.05,**p<0.01。1.3.2.2本发明中药组合物对ar豚鼠血清ifn-γ的影响与正常组相比,模型组豚鼠血清ifn-γ水平显著下降(p<0.05)。与模型组比较,高、中剂量组血清ifn-γ水平具有显著升高(p<0.05或0.01),结果见表8。表8elisa法检测血清ifn-γ变化(n=10)组别剂量(g/kg)ifn-γ(pg/ml)正常组-119.03±41.32模型组-82.99±21.87▲氯雷他定组0.00091116.02±41.35*鼻炎康组0.405123.79±22.87**中药组合物高剂量组3.04107.80±13.36**中药组合物中剂量组1.52107.93±22.03*中药组合物低剂量组0.7689.04±30.11注:与正常组比较,▲p<0.05,▲▲p<0.01;与模型组比较,*p<0.05,**p<0.01.1.3.2.3本发明中药组合物对ar豚鼠血清il-12的影响与正常组相比,模型组豚鼠血清il-12水平显著下降(p<0.05)。与模型组比较,本发明中药组合物高剂量组豚鼠血清il-12水平显著升高(p<0.01),结果见表9。表9elisa法检测血清il-12变化(n=10)组别剂量(g/kg)il-12(pg/ml)正常组_120.85±45.36模型组_77.32±23.15▲氯雷他定组0.00091123.37±47.77*鼻炎康组0.405123.97±25.43**中药组合物高剂量组3.04111.25±19.09**中药组合物中剂量组1.5299.83±32.28中药组合物低剂量组0.7686.00±34.71注:与正常组比较,▲p<0.05,▲▲p<0.01;与模型组比较,*p<0.05,**p<0.01.1.3.2.4对ar豚鼠血清il-4的影响与正常对照组比较,模型组豚鼠血清il-4水平具有升高趋势,但无显著差异(p>0.05)。与模型组比较,各剂量组血清il-4水平明显降低(p<0.01或p<0.05)。结果见表10。表10elisa法检测血清il-4变化组别剂量(g/kg)nil-4(pg/ml)正常组_9673.71±74.31模型组_10683.91±77.51氯雷他定组0.0009110631.83±85.98鼻炎康组0.40510603.26±82.55*中药组合物高剂量组3.0410502.14±1116.91**中药组合物中剂量组1.5210555.37±121.31*中药组合物低剂量组0.7610507.89±90.96**注:与正常组比较,▲p<0.05,▲▲p<0.01;与模型组比较,*p<0.05,**p<0.01.1.3.2.5对ar豚鼠血清il-6的影响与正常组比较,模型组豚鼠血清il-6水平显著升高(p<0.01)。与模型组比较,各给药组血清il-6水平均有明显降低(p<0.01或p<0.05)。结果见表11。表11elisa法检测血清il-6变化组别剂量(g/kg)nil-6(pg/ml)正常组-9326.10±96.20模型组-10449.09±57.58▲▲氯雷他定组0.0009110342.84±52.10**鼻炎康组0.40510336.00±103.38**中药组合物高剂量组3.0410350.48±70.70**中药组合物中剂量组1.5210364.32±94.72*中药组合物低剂量组0.7610292.24±54.60**注:与正常组比较,▲p<0.05,▲▲p<0.01;与模型组比较,*p<0.05,**p<0.01.1.3.2.6对ar豚鼠血清tnf-α的影响与正常组比较,模型组血清tnf-α水平明显升高(p<0.01)。与模型组比较,本发明中药组合物各给药组血清tnf-α水平均有明显降低(p<0.01或p<0.05)。结果见表12。表12elisa法检测血清tnf-α变化组别剂量(g/kg)ntnf-α(pg/ml)正常组_9281.20±71.23模型组_10364.32±70.09▲氯雷他定组0.0009110319.42±83.85鼻炎康组0.40510302.96±67.95中药组合物高剂量组3.0410302.99±61.55*中药组合物中剂量组1.5210277.03±83.57**中药组合物低剂量组0.7610266.06±42.30**注:与正常组比较,▲p<0.05,▲▲p<0.01;与模型组比较,*p<0.05,**p<0.01.1.3.2.7对ar豚鼠鼻黏膜his的影响与正常组比较,模型组鼻黏膜his水平具有升高趋势,但差异不显著(p>0.05);与模型组比较,本发明中药组合物组鼻黏膜his水平均有一定降低趋势,但差异不明显(p>0.05)。结果见表13。表13elisa法检测鼻黏膜his变化(n=5)注:与正常组比较,▲p<0.05,▲▲p<0.01;与模型组比较,*p<0.05,**p<0.01.1.3.3对ar豚鼠鼻黏膜炎性指标的影响1.3.3.1对ar豚鼠鼻黏膜ifn-γ表达的影响光镜下观察豚鼠鼻黏膜免疫组化染色切片,被染成棕褐色颗粒的区域即是ifn-γ阳性表达区域。结果显示,正常组大鼠鼻黏膜上皮细胞间存在大量棕褐色颗粒,提示ifn-γ大量存在于正常鼻黏膜上皮细胞间,且豚鼠鼻黏膜ifn-γ阳性表达量明显高于模型组(p<0.05);与模型组相比,各给药组豚鼠鼻黏膜ifn-γ表达量显著升高(p<0.05);结果见表14。表14本发明中药组合物对ar豚鼠鼻黏膜ifn-γ表达的影响(n=5)组别剂量(g/kg)光密度值正常组-0.156±0.080模型组-0.046±0.041▲氯雷他定组0.000910.151±0.016**鼻炎康组0.4050.198±0.080**中药组合物高剂量组3.0400.113±0.043*中药组合物中剂量组1.5200.159±0.048*中药组合物低剂量组0.7600.115±0.029*注:与正常组比较,▲p<0.05,▲▲p<0.01;与模型组比较,*p<0.05,**p<0.01.1.3.3.2对ar豚鼠鼻黏膜il-6表达的影响光镜下观察豚鼠鼻黏膜免疫组化染色切片,被染成棕褐色颗粒的区域即是il-6阳性表达区域。与正常组相比,模型组豚鼠鼻黏膜il-6光密度值显著升高(p<0.05);与模型组比较,各给药组鼻黏膜il-6阳性表达光密度值显著降低(p<0.05,结果见表15。表15本发明中药组合物对ar豚鼠鼻黏膜il-6表达的影响(n=5)组别剂量(g/kg)光密度值正常组-0.048±0.034模型组-0.149±0.064▲氯雷他定组0.000910.067±0.027*鼻炎康组0.4050.020±0.008**中药组合物高剂量组3.0400.061±0.018*中药组合物中剂量组1.5200.063±0.029*中药组合物低剂量组0.7600.050±0.014*注:与正常组比较,▲p<0.05,▲▲p<0.01;与模型组比较,*p<0.05,**p<0.011.3.3.3对ar豚鼠鼻黏膜tnf-α表达的影响光镜下观察豚鼠鼻黏膜免疫组化染色切片,被染成棕褐色颗粒的区域即是tnf-α阳性表达区域。与正常组相比,模型组豚鼠鼻黏膜tnf-α可见明显的阳性表达产物,光密度值显著升高(p<0.05);与模型组比较,各给药组鼻黏膜tnf-α阳性表达光密度值显著降低(p<0.05),表明本发明中药组合物可以降低tnf-α在鼻黏膜中的阳性表达,结果见表16。表16本发明中药组合物对ar豚鼠鼻黏膜tnf-α表达的影响(n=5)组别剂量(g/kg)光密度值正常组-0.042±0.038模型组-0.312±0.210▲氯雷他定组0.000910.032±0.029*鼻炎康组0.4050.033±0.022*中药组合物高剂量组3.0400.027±0.019*中药组合物中剂量组1.5200.210±0.099*中药组合物低剂量组0.7600.041±0.038*注:与正常组比较,▲p<0.05,▲▲p<0.01;与模型组比较,*p<0.05,**p<0.011.3.4对ar豚鼠鼻黏膜组织病理学的影响1.3.4.1鼻黏膜eos计数每张切片随机选取5个高倍视野(×400),进行eos计数。与正常组比较,模型组eos浸润明显(p<0.01);与模型组比较,除本发明中药组合物低剂量组外,其他各组eos浸润情况均减轻(p<0.01或p<0.05)。表明本发明中药组合物可以降低ar豚鼠鼻黏膜eos浸润,减轻鼻黏膜炎症反应,结果见表17。表17鼻黏膜eos计数平均值(n=5)组别剂量(g/kg)eos计数(个)正常组-2.28±1.28模型组-17.04±7.20▲▲氯雷他定组0.000912.32±0.84**鼻炎康组0.4053.64±2.17**中药组合物高剂量组3.045.48±2.30**中药组合物中剂量组1.527.12±4.39*中药组合物低剂量组0.769.80±5.24注:与正常组比较,▲p<0.05,▲▲p<0.01;与模型组比较,*p<0.05,**p<0.01.1.3.4.2鼻黏膜病理观察及评分正常组鼻黏膜组织为由假复层纤毛柱状上皮细胞、杯状细胞、支持细胞及基底细胞等组成,黏膜下层的致密纤维结缔组织很薄,黏膜上皮结构完整,排列整齐,纤毛粗细一致,未见明显炎性细胞浸润;模型组鼻黏膜组织上皮不完整,有脱落现象,腺体增生明显,黏膜固有层见大量eos;氯雷他定组黏膜上皮基本完好,少量炎症细胞浸润,鼻炎康组黏膜上皮部分脱落,部分腺体增生,未见炎性细胞浸润;本发明中药组合物高剂量组黏膜上皮较完好,可见部分炎性细胞浸润;中剂量组黏膜基本完好,有少量炎症细胞浸润;低剂量组黏膜部分脱落,腺体增生明显,炎症细胞浸润较明显。与正常组比较,模型组病理评分明显升高(p<0.01)。与模型组比较,氯雷他定组、鼻炎康组评分明显降低(p<0.05),本发明中药组合物治疗14d后,高剂量组鼻黏膜病理评分明显降低(p<0.05)。结果见表18。表18豚鼠鼻黏膜病理分级评分(n=5)注:与正常组比较,▲p<0.05,▲▲p<0.01;与模型组比较,*p<0.05,**p<0.012对卵蛋白所致大鼠变应性鼻炎的影响采用卵蛋白注射及鼻黏膜刺激法制备ar大鼠模型,模型成功建立后,观察各组行为学并进行评分,elisa法检测血清ige、ifn-γ,il-4、il-6、tnf-α、il-17的含量,免疫组织化学染色法检测鼻黏膜组织il-6、tnf-α、ifn-γ表达,光学显微镜下进行鼻腔分泌物eos计数,观察鼻黏膜组织病理学变化并进行评分。2.1材料与方法2.1.1材料2.1.1.1动物及分组spf级sd大鼠70只,雌雄各半,体质量200~300g,购于北京维通利华实验动物技术有限公司,动物许可证号:scxk(京)2012-0001。采用随机法将动物分为正常组、模型组、氯雷他定组(1.17mg/kg)、鼻炎康组(0.6g/kg),本发明中药组合物高剂量组(4.6g/kg),本发明中药组合物中剂量组(2.3g/kg),本发明中药组合物低剂量组(1.15g/kg),每组10只。2.1.1.2药物与试剂卵蛋白(ovalbumin,ova,批号:slbk6455v,美国sigma公司);本发明中药组合物颗粒剂(按实施例4方法制备成,1g相当于5.7577g生药量,蒸馏水配置成0.304g/ml备用);氯雷他定片(西安杨森,产品批号:050218967);鼻炎康片(佛山德众药业有限公司,产品批号:14272);氢氧化铝凝胶(thermo公司,产品批号:pc197962);氯化钠注射液(石家庄四药有限公司,产品批号:1511023204);ratigeelisa试剂盒(欣博盛,产品批号:r160322-117b);ratil-4elisa试剂盒(欣博盛,产品批号:r160415-002a);ratil-17aelisa试剂盒(欣博盛,产品批号:r160415-17a);rattnf-αelisa试剂盒(欣博盛,产品批号:r160415-102a);ratifn-γelisa试剂盒(欣博盛,产品批号:r160415-101a);ratil-6试剂盒(csb,产品批号:d10033395);anti-tnfalpha抗体(abcam,产品批号:ab6671);il-6polyclonalantibody(proteintech,产品批号:21865-1-ap);interferongammapolyclonalantibody(proteintech,产品批号:15365-1-ap);乙醇(北京市化工厂,产品批号:20140607);甲醛溶液(天津市福晨化学试剂厂,产品批号:20141020);二甲苯(北京市通广精细化工公司,产品批号:20140719);哈瑞氏苏木素染液(北京世济合力生物科技有限公司,产品批号:20141203);哈瑞氏伊红染液(北京世济合力生物科技有限公司,产品批号:20141203);dab(dako,产品批号:k5007)。2.1.1.3实验仪器显微镜(日本olympus公司),图像分析软件(mias);采图软件nikonnis-elementsd3.2(日本尼康公司);asp300脱全自动多功能酶标仪:multiskanmk3(thermo公司);gl-21m高速冷冻离心机(上海卢湘仪离心机仪器有限公司);bx51水机(德国leica公司);eg1150h包埋机(德国leica公司);rm2235切片机(德国leica公司);hi1210摊片机(德国leica公司)。2.2方法2.2.1模型复制2.2.1.1基础致敏实验组:将1mgova与30mgal(oh)3凝胶佐剂溶解于1ml生理盐水配成混悬液,于第1d、第5d、第10d将0.2mlova佐剂混悬液分别注射于大鼠两侧腹股沟,两侧后足趾,腹腔。正常组以等量生理盐水替代致敏佐剂,方法和步骤同实验组。2.2.1.2局部致敏除正常组外,于第15d起,以10%ova生理盐水溶液双侧滴鼻,每侧50ul,滴鼻7d。正常组以等量生理盐水代替10%ova混悬液,方法和步骤同实验组。2.2.2给药模型成功后,模型组隔日1次滴鼻维持对鼻黏膜的刺激,给药组在每日滴鼻前1h灌胃给药。连续灌胃给药14d,每7d观察一次,记录症状并评分。2.2.3观测指标2.2.3.1行为学观察局部激发后30min内观察鼻部症状,按评分标准计算行为学总分(大于5分为动物模型成功)。评分标准:①0分:无喷嚏、挠鼻及鼻分泌物;②1分:喷嚏<4个,轻度挠鼻,前鼻孔有鼻分泌物;③2分:喷嚏4~10个,频繁挠鼻,鼻分泌物超过前鼻孔;④3分:喷嚏>11个,持续挠鼻、摩擦,脸部布满鼻分泌物。2.2.3.2生化及免疫指标检测末次激发24h后,10%水合氯醛(350mg/kg)腹腔注射麻醉,腹主动脉取血,3500r/min,离心10min。分离血清,置于-80℃冰箱下保存。根据elisa试剂盒说明书步骤检测ige、ifn-γ、il-4、il-6、tnf-α、il-17水平。2.2.3.3鼻腔分泌物eos计数迅速打开鼻背,剥去上颌骨部皮肤,沿右侧鼻中隔外侧前庭壁剪断,向上翻开暴露鼻中隔及双侧鼻腔,先用棉签蘸取分泌物,沿同一方向涂于载玻片上,行he染色(每组选取5只),光学显微镜下(400)随机选取5个视野(面积大小为677.3mm×508mm),进行eos计数。2.2.3.4观察鼻黏膜组织病理学变化取大鼠双侧鼻中隔黏膜,固定于10%中性甲醛溶液中,石蜡包埋,he染色观察鼻黏膜病理变化并评分(操作步骤同第一部分)。病理评分标准:0级,纤毛完整整齐,柱状上皮正常,少量杯状细胞,记0分;i级,杯状细胞增多,少数散在的炎症细胞,膜固有层的腺体增生占黏膜固有层的1/3以下,记1分;ii级,杯状细胞密布,纤毛倒伏不整齐、偶见脱落,较多嗜酸性细胞游出,膜固有层的腺体增生占黏膜固有层的1/3~2/3,记2分;iii级,杯状细胞密布,纤毛大量脱落,上皮层破坏或组织纹理紊乱,大量嗜酸性细胞游出占全部上皮炎症细胞的2/3以上,膜固有层的腺体增生占黏膜固有层的2/3以上,记3分。2.2.3.5免疫组化染色免疫组化染色(ihc)法检测鼻黏膜组织ifn-γ、il-6、tnf-α表达。高倍镜下每张图片随机选取5个视野,采用image-proplusversion6.0分析软件,分析图像面积,根据公式(iod/area),求得阳性表达光密度值。操作步骤同第一部分。2.2.4统计分析实验数据均以均数±标准差表示,采用sas9.3统计软件处理。若各组服从正态分布且方差齐,采用单因素方差分析,两组比较采用t检验;若各组不服从正态分布或方差不齐,采用非参数检验。2.3实验结果2.3.1本发明中药组合物对ar大鼠行为学的影响给药前,实验组大鼠与正常组相比,喷嚏、挠鼻、流涕等行为学症状评分明显增加(p<0.01),提示模型复制成功。给药治疗14d后,模型组与正常组相比,行为学评分明显增加(p<0.01);本发明中药组合物各剂量组与模型组相比,行为学评分明显降低(p<0.01),提示本发明中药组合物可明显改善ar大鼠鼻部症状。结果见表19。表19给药后行为学评分记录表(n=10)注:与正常组比较,▲p<0.05,▲▲p<0.01;与模型组比较,*p<0.05,**p<0.012.3.2本发明中药组合物对ar大鼠生化及免疫学指标的影响2.3.2.1本发明中药组合物对ar大鼠血清ige的影响给药治疗14d后,模型组与正常组相比,大鼠血清ige水平明显上升(p<0.01);本发明中药组合物高剂量组与模型组相比,大鼠血清ige水平明显降低(p<0.01或0.05),结果见表20。表20elisa法检测血清ige变化注:与正常组比较,▲p<0.05,▲▲p<0.01;与模型组比较,*p<0.05,**p<0.012.3.2.2本发明中药组合物对ar大鼠血清ifn-γ的影响给药治疗14d后,模型组与正常组相比,大鼠血清ifn-γ水平明显下降(p<0.01);本发明中药组合物高、低剂量组与模型组相比,大鼠血清ifn-γ水平明显升高(p<0.01或0.05),结果见表21。表21elisa法检测血清ifn-γ变化组别剂量(g/kg)nifn-γ(pg/ml)正常组-1012.99±5.79模型组-107.92±1.53▲▲氯雷他定组0.0009199.35±0.76**鼻炎康组0.4051011.06±3.63*中药组合物高剂量组3.04910.40±2.05**中药组合物中剂量组1.52108.65±1.50中药组合物低剂量组0.761010.88±2.24**注:与正常组比较,▲p<0.05,▲▲p<0.01;与模型组比较,*p<0.05,**p<0.01.2.3.2.3本发明中药组合物对ar大鼠血清il-4的影响给药治疗14d后,模型组与正常组相比,大鼠血清il-4水平明显上升(p<0.01);本发明中药组合物中剂量组与模型组相比,大鼠血清il-4水平明显下降(p<0.05),结果见表22。表22elisa法检测血清il-4变化组别剂量(g/kg)nil-4(pg/ml)正常组_105.33±1.97模型组_1010.33±5.78▲▲氯雷他定组0.00091105.86±2.10**鼻炎康组0.405108.00±2.30中药组合物高剂量组3.04106.74±1.49中药组合物中剂量组1.52105.91±1.97*中药组合物低剂量组0.76109.60±4.42注:与正常组比较,▲p<0.05,▲▲p<0.01;与模型组比较,*p<0.05,**p<0.01.2.3.2.4本发明中药组合物对ar大鼠血清il-6的影响给药治疗14d后,模型组与正常组相比,大鼠血清il-6水平呈上升趋势,但无显著性差异(p>0.05);本发明中药组合物各剂量组与模型组相比,大鼠血清il-6水平无显著性变化(p>0.05),结果见表23。表23elisa法检测血清il-6变化组别剂量(g/kg)nil-6(pg/ml)正常组_1017.78±3.94模型组_1021.15±6.21氯雷他定组0.000911018.91±2.88鼻炎康组0.4051020.58±7.87中药组合物高剂量组3.041020.59±4.47中药组合物中剂量组1.521022.63±6.58中药组合物低剂量组0.761025.22±8.18注:与正常组比较,▲p<0.05,▲▲p<0.01;与模型组比较,*p<0.05,**p<0.01.2.3.2.5本发明中药组合物对ar大鼠血清tnf-α的影响给药治疗14d后,模型组与正常组相比,大鼠血清tnf-α水平呈现上升趋势,但无显著差异(p>0.05);本发明中药组合物高、中剂量组与模型组相比,大鼠血清tnf-α水平明显下降(p<0.05或0.01),结果见表24。表24elisa法检测血清tnf-α变化组别剂量(g/kg)ntnf-α(pg/ml)正常组_1074.80±14.13模型组_1086.68±9.64氯雷他定组0.00091976.49±9.28*鼻炎康组0.4051065.49±16.54**中药组合物高剂量组3.04974.29±12.92*中药组合物中剂量组1.521072.25±9.26**中药组合物低剂量组0.761077.18±17.32注:与正常组比较,▲p<0.05,▲▲p<0.01;与模型组比较,*p<0.05,**p<0.01.2.3.2.6本发明中药组合物对ar大鼠血清il-17的影响给药治疗14d后,模型组与正常组相比,大鼠血清il-17水平明显上升(p<0.01);本发明中药组合物低剂量组与模型组相比,大鼠血清il-17水平明显下降(p<0.05),结果见表25。表25elisa法检测血清il-17变化组别剂量(g/kg)nil-17(pg/ml)正常组_108.45±3.17模型组_1014.91±7.58▲氯雷他定组0.0009199.03±3.55*鼻炎康组0.4051011.76±2.55中药组合物高剂量组3.04914.33±4.89中药组合物中剂量组1.521011.29±3.16中药组合物低剂量组0.76109.20±3.88*注:与正常组比较,▲p<0.05,▲▲p<0.01;与模型组比较,*p<0.05,**p<0.01.2.3.3本发明中药组合物对ar大鼠鼻黏膜ifn-γ、il-6、tnf-α表达的影响2.3.3.1本发明中药组合物对ar大鼠鼻黏膜ifn-γ表达的影响光镜下观察大鼠鼻黏膜免疫组化染色切片,结果显示,与正常组相比,模型组大鼠鼻黏膜ifn-γ阳性表达光密度值明显降低(p<0.05);与模型组相比,中药高、低剂量组大鼠鼻黏膜光密度值显著升高(p<0.05或0.01);结果见表26。表26本发明中药组合物对ar大鼠鼻黏膜ifn-γ表达的影响(n=5)组别剂量(g/kg)光密度值正常组-0.126±0.058模型组-0.044±031▲氯雷他定组0.00170.056±0.02*鼻炎康组0.600.168±0.014**中药组合物高剂量组4.600.161±0.026**中药组合物中剂量组2.300.128±0.062中药组合物低剂量组1.150.160±0.028**注:与正常组比较,▲p<0.05,▲▲p<0.01;与模型组比较,*p<0.05,**p<0.01.2.3.3.2本发明中药组合物对ar大鼠鼻黏膜il-6表达的影响光镜下观察大鼠鼻黏膜免疫组化染色切片,结果显示,与正常组相比,模型组大鼠鼻黏膜il-6阳性表达光密度值显著升高(p<0.01);与模型组比较,中药高、中剂量组鼻黏膜il-6光密度值显著降低(p<0.01),结果见表27。表27本发明中药组合物对ar大鼠鼻黏膜il-6表达的影响(n=5)组别剂量(g/kg)平均光密度值正常组-0.052±0.031模型组-0.142±0.029▲▲氯雷他定组0.00170.057±0.013**鼻炎康组0.600.039±0.033**中药组合物高剂量组4.600.050±0.014**中药组合物中剂量组2.300.042±0.022**中药组合物低剂量组1.150.086±0.042注:与正常组比较,▲p<0.05,▲▲p<0.01;与模型组比较,*p<0.05,**p<0.01.2.3.3.3本发明中药组合物对ar大鼠鼻黏膜tnf-α表达的影响光镜下观察大鼠鼻黏膜免疫组化染色切片,结果表明,与正常组相比,模型组大鼠鼻黏膜tnf-α阳性表达光密度值显著升高(p<0.01);与模型组比较,中药高剂量组鼻黏膜tnf-α阳性表达光密度值显著降低(p<0.05或0.01),表明本发明中药组合物可以降低tnf-α在鼻黏膜中的阳性表达,结果见表28。表28本发明中药组合物对ar大鼠鼻黏膜tnf-α表达的影响(n=5)组别剂量(g/kg)光密度值正常组-0.013±0.009模型组-0.084±0.029▲▲氯雷他定组0.00170.010±0.014**鼻炎康组0.600.027±0.021**中药组合物高剂量组4.600.037±0.016**中药组合物中剂量组2.300.051±0.023中药组合物低剂量组1.150.049±0.025注:与正常组比较,▲p<0.05,▲▲p<0.01;与模型组比较,*p<0.05,**p<0.01.2.3.4本发明中药组合物对ar大鼠鼻黏膜组织病理学的影响2.3.4.1本发明中药组合物对ar大鼠鼻腔分泌物eos的影响给药14d后,模型组与正常组比较,鼻腔分泌物eos数量明显升高(p<0.01)。本发明中药组合物各剂量组与模型组比较,eos数量明显降低(p<0.05或0.01)。氯雷他定组、鼻炎康组与模型组比较,eos浸润明显下降(p<0.05或0.01),结果见表29。表29大鼠鼻腔分泌物eos计数(n=5)注:与正常组比较,▲p<0.05,▲▲p<0.01;与模型组比较,*p<0.05,**p<0.01.2.3.4.2本发明中药组合物对ar大鼠组织病理学的影响he染色后光镜下可见,正常组鼻黏膜上皮完好,呈柱状排列,未见血管充血及组织水肿、炎症细胞浸润、腺体增生;模型组部分黏膜上皮损伤脱落,杯状细胞较多,固有层血管扩张充血,伴较多嗜酸性粒细胞及其他炎症细胞浸润,黏膜下腺体增生,与正常组比较,病理评分具有显著性差异(p<0.01);氯雷他定组、鼻炎康组黏膜上皮基本完好,少量炎症细胞浸润,黏膜下腺体有轻度增生,与模型组比较,病理评分明显下降(p<0.05或0.01);本发明中药组合物各剂量组黏膜上皮基本完好,部分可见腺体增生,血管轻度充血、少量嗜酸性粒细胞浸润,与模型组比较,病理评分明显下降(p<0.05或0.01),结果见表30。表30大鼠鼻黏膜病理分级评分注:与正常组比较,▲p<0.05,▲▲p<0.01;与模型组比较,*p<0.05,**p<0.013本发明中药组合物抗炎、抗过敏作用研究采用二甲苯致小鼠耳肿胀法与大鼠棉球肉芽肿形成法,研究本发明中药组合物的抗炎作用;采用大鼠同种被动皮肤过敏反应法与小鼠耳异种被动皮肤过敏反应法观察本发明中药组合物的抗过敏作用。3.1材料与方法3.1.1实验材料3.1.1.1动物选用spf级昆明小鼠100只,雌雄各半,体重18~22g。spf级sd大鼠110只,雌雄各半,体重180~200g。以上动物均购于北京维通利华实验动物技术有限公司,动物许可证号:scxk(京)2012-0001。3.1.1.2药物与试剂本发明中药组合物颗粒剂(按实施例4方法制备,1g相当于4.8804g生药量);氯雷他定(西安杨森制药有限公司,批号:150923784);醋酸地塞米松片(天津力生制药股份有限公司,批号:1501006);二甲苯(北京化工厂,批号:20150506);双抗(corning,青链霉素的混悬液,批号:30-002-ci);卵蛋白(美国sigma公司,批号:slbk6455v);吸附百白破疫苗(长春长生生物科技股份有限公司,批号:20150918-02);伊文思蓝(国药集团化学试剂有限公司,批号:wc20070607);丙酮(北京化工厂,批号:20150316);氢氧化钾粉末(北京化工厂,批号:20141118);磷酸(国药集团化学试剂有限公司,批号:20160127)。3.1.1.3仪器labofuge低温离心机(德国heraeus公司);打孔器(直径6.5mm);电子分析天平(美国ohaus公司);wfj2000型紫外可见分光光度计(尤尼柯上海仪器有限公司);ql-901漩涡振荡器(海门市其林贝尔仪器制造有限公司);电热恒温鼓风干燥箱(黄石市恒丰医疗器械有限公司);立式压力蒸汽灭菌锅(上海博迅实业有限公司医疗设备厂)。3.2实验方法3.2.1二甲苯致小鼠耳肿胀实验随机将动物分为对照组,地塞米松组(5mg/kg),本发明中药组合物高剂量组(7.86g/kg)、中剂量组(3.93g/kg)、低剂量组(1.96g/kg),每组10只,雌雄各半。按上述分组方式,连续给药5d,1次/日。于第5天给药45min后,在小鼠右耳两面均匀涂抹50μl二甲苯致炎,涂抹20min后,颈椎脱臼致死,沿耳廓边缘剪下左右两耳,用打孔器打相同部位的左右耳片,然后立即称重。以两耳片重量之差作为肿胀度,计算药物的抑制百分率。抑制率(%)=(对照组肿胀度-用药组肿胀度)/对照组肿胀度×100%。对照组给予等量的蒸馏水,方法和步骤同实验组。3.2.2大鼠棉球肉芽肿实验随机分为对照组,本发明中药组合物剂高剂量组(4.6g/kg)、中剂量组(2.3g/kg)、低剂量组(1.15g/kg),地塞米松组(0.79mg/kg),每组10只,雌雄各半。大鼠用水合氯醛(350mg/kg)麻醉,75%乙醇腹部消毒,在腹部中间作一开口,用止血钳剥离皮肤至腹股沟处,将预先高压灭菌并50mg棉球(加入双抗100μl)植入大鼠腹股沟处,缝合皮肤,待动物清醒后开始给药。除对照组灌胃给予蒸馏水外,其他各给药组灌胃给予相应药物,每日1次,1ml/100g,连续7d。末次给药后1h,脱颈椎处死大鼠,打开腹部皮肤,仔细剥离棉球,置于电子天平上称重,即为棉球湿重。将棉球置于60℃烘箱中,干燥12h,取出称量即为干重。3.2.3大鼠被动皮肤过敏反应实验3.2.3.1大鼠抗血清的制备实验中选取sd大鼠雌雄各5只,每鼠后肢肌注5%卵蛋白生理盐水溶液0.2ml,同时腹腔注射百白破疫苗0.2ml。正常饲养13d后,麻醉,腹主动脉取血,3500r/min离心15min,静置2h后,分离大鼠血清,置于-20℃冰箱保存。即制备抗卵蛋白大鼠血清。3.2.3.2被动皮肤过敏反应sd大鼠分为对照组,本发明中药组合物高剂量组(4.6g/kg)、中剂量组(2.3g/kg)、低剂量组(1.15g/kg),氯雷他定组(1.16mg/kg),每组10只,雌雄各5只。按上述分组方法,氯雷他定组和中药各组连续灌胃给药7d,每日1次,未次给药45min后给予抗原攻击。对照组灌胃蒸馏水。给药第6天,在水合氯醛的麻醉下剪去背中线两侧距脊柱1.5~2cm处的毛(每侧3cm×3cm),并将上述抗血清用生理盐水稀释成1∶2和1∶6,皮内注射于大鼠脊柱两侧剃毛部分,每个稀释度注射两点,每点0.1ml。给药第7天,末次给药1h后尾静脉注射卵白蛋白(2%)和伊文思蓝(0.5%)生理盐水混合溶液1ml。3.2.3.3标本采集及指标检测30min后断头处死,将大鼠背部皮肤翻转,剪下背部蓝斑皮肤,剪碎,以5ml丙酮-生理盐水(7:3)浸泡,置于37℃水浴中加热48h,离心,取上清液,以紫外可见分光光度计于波长620nm测定od值。3.2.4小鼠耳异种被动皮肤过敏反应将小鼠随机分为对照组,本发明中药组合物剂高剂量组(7.86g/kg)、中剂量组(3.93g/kg)、低剂量组(1.96g/kg),氯雷他定组(2mg/kg),每组10只,雌雄各半。连续灌胃给药7d,给药体积0.2ml/10g,1次/日,末次灌胃45min后给予抗原攻击。给药第6天,小鼠两只耳廓各注射大鼠抗血清25μl。24h后抗原攻击,尾静脉注射2%卵白蛋白和0.5%伊文思蓝溶液0.25ml。30min后,将小鼠颈椎脱臼处死,剪下小鼠耳廓(蓝染部位)。将所剪耳廓置于试管中,加入0.75ml的氢氧化钾溶液(1mol/l)浸泡,37℃过夜进行消化。次日加3.75ml磷酸(0.6mol/l)与丙酮混合液(5∶13,v/v),经漩涡振荡器震摇,再以2500r/min离心15min,将上清液取出,紫外可见分光光度计在波长640nm下测定od值,计算药物的抑制率。抑制率(%)=(对照组od值-用药组od值)/对照组od值×100%。3.2.5统计方法实验数据采用表示,采用sas9.3统计软件处理。若各组服从正态分布且方差齐则采用方差检验,两两比较采用lsd检验,若各组不服从正态分布则采用非参数检验。以p<0.05为差异有统计学意义。3.3实验结果3.3.1本发明中药组合物对二甲苯致小鼠耳肿胀的影响与对照组比较,地塞米松组及本发明中药组合物高、中、低剂量组可显著降低二甲苯致小鼠耳廓肿胀(p<0.05或0.01),表明本发明中药组合物可抑制二甲苯所致小鼠耳廓炎症反应。结果见表31。表31本发明中药组合物对二甲苯致小鼠耳肿胀的影响(n=10)组别剂量肿胀度mg抑制率%对照组-9.60±1.42-地塞米松组5mg/kg2.60±2.22**72.91%中药组合物高剂量组7.86g/kg6.00±3.97*37.50%中药组合物中剂量组3.93g/kg6.50±1.50**32.29%中药组合物低剂量组1.96g/kg5.80±2.15**39.58%注:与对照组比较,*p<0.05,**p<0.01.3.3.2本发明中药组合物剂对大鼠棉球肉芽肿形成的影响与对照组比较,地塞米松组可显著减低棉球肉芽肿重量(p<0.01),本发明中药组合物各剂量组大鼠棉球干重、湿重无显著差异(p>0.05),提示本发明中药组合物对棉球所致大鼠肉芽组织增生无明显的抑制作用,结果见表32。表32本发明中药组合物对大鼠棉球肉芽肿的影响(n=10)组别剂量棉球湿重/mg棉球干重/mg对照组-1416.0±907.3215.9±25.4地塞米松组0.79mg/kg1128.0±575.2**173.1±12.7**中药组合物高剂量组4.60g/kg1363.8±177.1212.8±29.7中药组合物中剂量组2.30g/kg1395.6±794.4216.5±20.3中药组合物低剂量组1.15g/kg1398.7±103.3212.9±16.2注:与对照组比较,**p<0.01.3.3.3本发明中药组合物对大鼠同种被动皮肤过敏反应的影响与对照组比较,氯雷他定组、本发明中药组合物各组均可明显降低大鼠蓝斑od值(p<0.05或0.01),表明本发明中药组合物对卵蛋白所致大鼠同种被动皮肤过敏反应具有一定的抑制作用。结果见表33。表33本发明中药组合物对大鼠被动皮肤过敏反应的影响(n=10)组别剂量od抑制率对照组-0.134±0.081-氯雷他定组1.16mg/kg0.059±0.039*55.97%中药组合物高剂量组4.6g/kg0.036±0.018*73.13%中药组合物中剂量组2.3g/kg0.048±0.045*64.18%中药组合物低剂量组1.15g/kg0.024±0.020**82.09%注:与对照组比较,*p<0.05,**p<0.01.3.3.4本发明中药组合物对小鼠耳异种被动皮肤过敏反应的影响与对照组比较,氯雷他定组可明显减轻小鼠耳廓蓝斑od值(p<0.01),本发明中药组合物高剂量组可显著降低小鼠耳廓蓝染程度(p<0.05),提示本发明中药组合物可明显抑制卵蛋白所致小鼠耳异种被动皮肤过敏反应,结果见表34。表34本发明中药组合物对小鼠耳异种被动皮肤过敏反应的影响(n=10)注:与对照组比较,*p<0.05,*p<0.01.实施例26颗粒剂制备方法考察1干法制粒干法制粒的一大优点是能降低辅料的用量,进而减少患者服用量,故取适量组合物浸膏粉分别加糊精、乳糖,以3∶1的比例混合均匀,用gzl20型干法制粒机进行干压制粒,干法制粒结果见表35。组合物浸膏粉按如下方法制备:桂枝、干姜、肉桂、辛夷提取挥发油10小时,挥发油用倍他环糊精包合,蒸馏后的水液备用,药渣加8倍量水提取1小时,滤过,滤液另器储存备用;其余黄芪、白芍等八味加水煎煮三次,每次1.5小时,合并煎液,滤过,滤液与上述二液合并,浓缩至相对密度为1.15~1.20(60℃)的清膏,加乙醇使含醇量达60%,搅拌,静置过夜,滤液回收乙醇,滤液浓缩至适量,减压干燥,粉碎成细粉,与上述倍他环糊精包合物混匀,得组合物浸膏粉。表35干法制粒实验结果赋形剂轧轮转速(hz)轧轮压力(mpa)一次成型率(%)浸膏粉:糊精15+444.85浸膏粉:乳糖15+436.00实验结果表明,轧轮压力为4mpa时,颗粒细粉较多,一次成型率较低,均小于50,且浸膏粉粘性较强,制粒过程中出现粘轧轮现象,制粒较困难,无法满足生产要求,故改用湿法制粒。2湿法制粒2.1润湿剂的选择湿法制粒的常用润湿剂为乙醇,故选择乙醇为润湿剂,并考察不同乙醇浓度对制粒情况的影响。2.2辅料种类考察将浸膏粉与糊精、乳糖、可溶性淀粉分别按3∶1混匀,喷入95%乙醇制粒,以软材性状、颗粒的成型率、制粒难易程度以及颗粒的色泽、细粉、粘结情况等为评价指标,结果见表36。表36辅料种类考察赋形剂软材性状制粒难易程度成型率(%)浸膏粉:糊精松散,无团块可完全通过筛网60.08浸膏粉:乳糖松散,无团块可完全通过筛网47.20浸膏粉:可溶性淀粉松散,无团块可完全通过筛网53.74由结果可知,三种辅料均能使颗粒成型,制粒容易,但加入糊精时颗粒的成型率最高,且糊精相比乳糖和可溶性淀粉价格低廉、稳定性好,流动性好,故选择糊精为辅料。2.3辅料的用量及润湿剂乙醇浓度的考察将适量浸膏粉与糊精分别按3∶1、3∶2、1∶1的比例混合均匀,分别喷适量浓度为90%、94%、95%的乙醇制粒,制粒情况结果见表37。表37颗粒剂成型工艺优选试验结果由以上结果可以看出,浸膏粉对湿较敏感,选用90%乙醇为润湿剂时,团块较多,制粒困难;选用95%乙醇为润湿剂,制得颗粒较松散,细粉较多,成型率较低;选用94%乙醇为润湿剂时,容易制粒,颗粒粒度均匀,且成型率较高。药辅比为3∶1、3∶2时,均能制得颗粒,故选用吸湿率为指标,进一步确定最佳药辅比。2.4药辅比例的确定以颗粒的吸湿性为评价指标,筛选颗粒的最优药辅比例,称取浸膏粉和糊精适量,分别按照3∶1和3∶2混匀,以94%乙醇为润湿剂进行制粒,测定其吸湿百分率,绘制吸湿曲线。从颗粒的吸湿性结果可以看出,制粒后颗粒的吸湿性相较于浸膏粉均得到改善,比较药辅比为3∶1与3∶2的颗粒,药辅比3∶1制得的颗粒吸湿率较高,且3∶1制粒较困难,团块较多,药辅比为3∶2时,制粒容易,与药辅比3∶1相比,服用量差异不大,故最终选择药辅比为3∶2,94%乙醇为润湿剂,制粒容易,且颗粒成型率高。实施例27中药组合物颗粒剂的薄层鉴别鉴别a:供试品溶液的制备:取实施例4制备的中药组合物颗粒剂4g,研细,加甲醇60ml,超声处理30分钟,滤过,滤液置水浴锅上蒸干,残渣加水50ml溶解,用水饱和正丁醇振搖提取4次,每次50ml,合并正丁醇液,用氨试液洗涤两次,每次50ml,氨试液弃去,正丁醇液蒸干,残渣加甲醇5ml使溶解,作为供试品溶液。对照药材溶液的制备:取黄芪对照药材4g,加水200ml煎煮1小时,滤过,滤液适当浓缩(约20ml),用水饱和正丁醇振搖提取4次,每次20ml,合并正丁醇液,用氨试液洗涤两次,每次20ml,氨试液弃去,正丁醇液蒸干,残渣加甲醇5ml溶解,作为对照药材溶液。阴性对照溶液的制备:按处方比例,自配不含黄芪的群药,按制剂工艺制成阴性空白制剂,同供试品溶液的制备方法制成阴性对照溶液。薄层色谱鉴别:吸取上述三种溶液各10μl,分别点于同一硅胶g薄层板上,以三氯甲烷-甲醇-水(13∶7∶2)的下层溶液为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰,置紫外灯(365nm)下检视。试验结果:供试品色谱中,在与对照药材色谱相应的位置上,日光下显相同的棕褐色斑点阴性样品没有干扰。鉴别b:试品溶液的制备:取实施例4制备的中药组合物颗粒剂1g,研细,加甲醇20ml,超声处理20分钟,滤过,滤液置水浴锅上蒸干,残渣加甲醇1ml使溶解,作为供试品溶液。对照品溶液的制备:取芍药苷对照品,加甲醇制成每1ml含0.6mg的溶液,作为对照品溶液。阴性对照溶液的制备:按处方比例,自配不含白芍的群药,按制剂工艺制成阴性空白制剂,同供试品溶液的制备方法制成阴性对照溶液。薄层色谱鉴别:吸取对照品溶液4μl,供试品溶液、阴性对照溶液各10μl,分别点于同一硅胶g薄层板上,以三氯甲烷-乙酸乙酯-甲醇-甲酸(8∶2∶5∶0.2)为展开剂,展开,取出,晾干,喷以5%香草醛硫酸溶液,在105℃加热至斑点显色清晰。试验结果:供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点;阴性样品没有干扰。鉴别c供试品溶液的制备:取实施例4制备的中药组合物颗粒剂4g,研细,加丙酮20ml,超声处理20分钟,滤过;滤液置水浴锅上蒸干,残渣加甲醇1ml使溶解,作为供试品溶液。对照品溶液的制备:取5-o-甲基维斯阿米醇苷对照品,加甲醇制成每1ml含0.5mg的溶液,作为对照品溶液。对照药材溶液的制备:取防风对照药材2g,加丙酮20ml,超声处理20分钟,滤过,滤液置水浴锅上蒸干,残渣加甲醇1ml使溶解,作为对照药材溶液。阴性对照溶液的制备:按处方比例,自配不含防风的群药,按制剂工艺制成阴性空白制剂,同供试品溶液的制备方法制成阴性对照溶液。薄层色谱鉴别:吸取对照品溶液4μl,对照药材溶液、供试品溶液、阴性对照溶液各10μl,分别点于同一硅胶gf254薄层板上,以三氯甲烷-甲醇(5∶1)为展开剂,展开,取出,晾干,置紫外灯(254nm)下检视。试验结果:供试品色谱中,在与对照品和对照药材色谱相应的位置上,显相同颜色的斑点;阴性样品没有干扰。鉴别d供试品溶液的制备:取实施例4制备的中药组合物颗粒剂2g,研细,加三氯甲烷25ml,超声处理30分钟,滤过,滤液置水浴锅上蒸干,残渣加二氯甲烷1ml使溶解,作为供试品溶液。对照品溶液的制备:取五味子醇甲对照品,加甲醇制成每1ml含0.5mg的溶液,作为对照品溶液。对照药材溶液的制备:取五味子对照药材1g,加三氯甲烷25ml,超声处理30分钟,滤过,滤液置水浴锅上蒸干,残渣加二氯甲烷1ml使溶解,作为对照药材溶液。阴性对照溶液的制备:按处方比例,自配不含五味子的群药,按制剂工艺制成阴性空白制剂,同供试品溶液的制备方法制成阴性对照溶液。薄层色谱鉴别:吸取上述三种溶液各10μl,分别点于同一硅胶gf254薄层板上,以石油醚(30~60℃)-甲酸乙酯-甲酸(15∶6∶1)的上层溶液为展开剂,展开,取出,晾置紫外灯(254nm)下检视。试验结果:供试品色谱中,在与对照品和对照药材色谱相应的位置上,显相同颜色的斑点;阴性样品没有干扰。鉴别e供试品溶液的制备:取实施例4制备的中药组合物颗粒剂3g,研细,加甲醇30ml,超声处理30分钟,滤过,滤液置水浴锅上蒸干,残渣加水20ml溶解,用乙酸乙酯振搖提取2次,每次20ml,合并乙酸乙酯液,蒸干,残渣加甲醇10ml使溶解,作为供试品溶液。对照药材溶液的制备:取甘草对照药材2g,加水200ml煎煮1小时,滤过,滤液适当浓缩(约20ml),用乙酸乙酯振搖提取2次,每次20ml,合并乙酸乙酯液,蒸干,残渣加甲醇10ml使溶解,作为对照药材溶液。阴性对照溶液的制备:按处方比例,取缺甘草的提取物混合,制成阴性空白制剂,同供试品溶液的制备方法制成阴性对照溶液。薄层色谱鉴别:吸取对照药材溶液5μl,供试品溶液和阴性对照溶液各10μl,分别点于同一硅胶g薄层板上,以乙酸乙酯-甲酸-冰醋酸-水(15∶1∶1∶2)为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰。试验结果:供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点;阴性样品没有干扰。本发明尝试以桂皮醛作为指标建立检测方法,但是桂枝和肉桂的主要有效成分均为桂皮醛,专属性不强,因此未建立该检测方法;另外,本发明还考察了辛夷中樟脑作为指标成分,但发现有阴性干扰,专属性不强,由于指标成分较难确定或不易得到对照品,因此本发明未建立相应的检测方法;桂枝、干姜、肉桂、辛夷四味,供试品中未显相同颜色的斑点,白术的主要有效成分苍术酮未显现斑点,对应其它成分有阴性干扰,故上述几味药不作为检测本发明中药组合物的指标。实施例28中药组合物颗粒剂的含量测定1黄芪甲苷色谱条件的建立1.1色谱条件的建立色谱条件:agilentzorbaxsb-c18色谱柱(4.6mm×250mm,5μm),乙腈-水(31∶69)为流动相,流速1.0ml·min-1,柱温30℃,elsd参数:漂移管温度100℃,载气(压缩空气)流速2.7l·min-1,进样量10μl。1.2溶液的制备及测定(1)对照品溶液的制备取黄芪甲苷对照品适量,精密称定,加甲醇制成每1ml含黄芪甲苷0.30225mg的溶液,即得。(2)供试品溶液的制备(2.1)提取方法的考察实验中发现,供试品中指标成分黄芪甲苷直接用水溶解时,用正丁醇萃取时容易出现乳化现象,且常用的破乳方法均不能很好的使乳化层消除,本发明尝试先用甲醇提取以除去一部分杂质,再用正丁醇萃取时,即无乳化现象。考察回流法和超声法对黄芪甲苷提取的影响,具体操作如下:回流法:取中药组合物颗粒剂4g,精密称定,置具塞锥形瓶中,加甲醇60ml,冷浸过夜,回流提取1小时,放冷,过滤,滤液浓缩至干,残渣加水40ml使溶解,用水饱和正丁醇振搖提取4次,每次50ml,合并正丁醇液,用氨试液洗涤2次,每次50ml,正丁醇液,蒸干,残渣加甲醇使溶解,定容至5ml容量瓶,摇匀,即得。超声法:取中药组合物颗粒剂4g,精密称定,置具塞锥形瓶中,加甲醇60ml,超声提取30分钟、45分钟,放冷,过滤,其余操作同回流法。分别取上述两种供试品溶液各10μl,依法测定,计算黄芪甲苷的含量,结果见表38。表38提取方法考察方法黄芪甲苷mg/g回流1小时0.44超声30分钟0.39超声45分钟0.34结果可知,回流法提取黄芪甲苷的含量高于超声法,且超声30分钟时高于45分钟,提示超声时间过长黄芪甲苷的含量反而下降,故确定黄芪甲苷的提取方法为回流法。(2.2)提取时间的考察为最大限度的提取中药组合物颗粒剂中的黄芪甲苷,进一步考察回流时间对黄芪甲苷含量的影响,实验考察了回流1小时、2小时、3小时,其余操作同回流法,制备供试品溶液,进样10μl,依法测定,计算黄芪甲苷的含量,结果见表39。表39提取时间考察提取时间(小时)黄芪甲苷mg/g回流1小时0.44回流1小时0.45回流3小时0.47结果:回流提取3小时,黄芪甲苷的含量最高,确定回流提取3小时为样品的制备方法。上述实验过程中还考察了回流、超声结束后沉淀中黄芪甲苷的含量,测定结果显示在沉淀中可能由于含量太低未能检测到黄芪甲苷的色谱峰。综上,确定供试品溶液溶液的制备方法如下:取本品,研细,取约4g,精密称定,置具塞锥形瓶中,加甲醇60ml,冷浸过夜,回流提取3小时,放冷,过滤,用少量甲醇(约30ml)分次洗涤容器和残渣,合并洗液和滤液,回收溶剂并浓缩至干,残渣加水40ml使溶解,用水饱和正丁醇振搖提取4次,每次50ml,合并正丁醇液,用氨试液充分洗涤2次,每次50ml,氨试液弃去,合并正丁醇液,蒸干,残渣加甲醇使溶解并转移至5ml量瓶中,用甲醇定容至刻度,摇匀,滤过,取续滤液,即得。阴性供试品溶液的制备:自制不含黄芪的空白样品,制备成阴性供试品溶液。测定法:分别精密吸取对照品溶液10μl、20μl,供试品溶液10μl,注入液相色谱仪,依法测定。1.3方法学考察(1)专属性实验分别精密吸取对照品溶液10μl、20μl,供试品溶液10μl,阴性供试品溶液10μl,hplc测定。结果见图1-3。结果表明,阴性供试品溶液在与黄芪甲苷对照品相同的保留时间处未见色谱峰,阴性没有干扰。(2)线性关系考察对照品溶液的制备:取黄芪甲苷对照品适量,精密称定,加甲醇制成每1ml含黄芪甲苷1.209mg的溶液,即得对照品储备液。精密吸取黄芪甲苷储备液适量,置10ml容量瓶,加甲醇稀释成浓度分别为0.0755625mg/ml、0.151125mg/ml、0.30225mg/ml、0.43524mg/ml、0.6045mg/ml、0.7254mg/ml的溶液。分别精密吸取20μl,注入高效液相色谱仪,记录峰面积,以黄芪甲苷峰面积对数(y)为纵坐标,黄芪甲苷进样量对数(x)为横坐标做图,得黄芪甲苷的回归方程为y=1.6908x+11.362(r2=0.9993)。结果表明黄芪甲苷在0.0755625mg/ml~0.7254mg/ml内线性关系良好。(3)精密度试验精密吸取黄芪甲苷对照品溶液20μl,连续进样测定6次,测定对照品的峰面积结果见表40。表40精密度试验结果(n=6)结果表明:相对标准偏差rsd<3%,表明精密度良好。(4)稳定性试验取中药组合物颗粒剂(研细),取约4g,精密称定,依法制备中药组合物颗粒剂供试品溶液,分别在制备后的0、2、4、6、8、12、24小时依法测定,在24小时内黄芪甲苷含量的平均值为0.4518mg/g,rsd=2.76%,证明中药组合物颗粒剂样品在24小时内稳定性良好,结果见表41。表41稳定性试验结果(5)重现性试验取同一批中药组合物颗粒剂样品,按照中药组合物颗粒剂供试品溶液制备方法,制备供试品溶液,平行操作6份,进hplc分析,记录对应峰面积,计算黄芪甲苷含量,结果见表42。表42重现性试验结果(n=6)结果表明:测得供试品中黄芪甲苷的含量平均值为0.4865mg/g,其rsd<3%,表明重现性良好。(6)加样回收率试验取6份已知含量的中药组合物颗粒剂样品,研细,每份约2g,精密称定,分别加入浓度为0.976mg/ml的黄芪甲苷对照品溶液1.0ml,制备供试品溶液,测定含量,计算加样回收率,结果见表43。表43加样回收率试验结果(n=6)结果表明:黄芪甲苷的平均回收率为98.05%,rsd=2.93%,n=6,加样回收率符合要求。结论:综上,黄芪甲苷方法的精密度、线性、重现性、稳定性、准确度等均符合要求,说明该含量测定方法稳定可行。2芍药苷色谱条件的建立2.1色谱条件的建立色谱条件:waterssymmetryshieldtmrp18色谱柱(4.6mm×150mm,5μm);甲醇-水(15∶85)为流动相,流速1.0ml·min-1,柱温30℃,进样量为10μl,检测波长:230nm。2.2溶液的制备及测定对照品溶液的制备:取芍药苷对照品适量,精密称定,加甲醇制成每1ml含黄芪甲苷0.04112mg的溶液即得。供试品溶液溶液的制备:取本品,研细,取约1g,精密称定,置具塞锥形瓶中,精密加入甲醇50ml,密塞,称定重量,超声处理(功率100w,频率40khz)30分钟,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。阴性供试品溶液的制备:按处方中药味比例,自配不含白芍的群药,按制备工艺制备成空白制剂,再按供试品溶液制备方法制备,即得阴性供试品溶液。测定法:分别精密吸取对照品溶液、供试品溶液及阴性供试品溶液各10μl,注入液相色谱仪,测定。芍药苷含量测定方法建立中发现,使用2015版《中国药典》白芍项下含量测定方法测定芍药苷时,芍药苷峰拖尾;后又分别尝试了不同流动相条件(①wondasiltmc18色谱柱(250mm×4.6mm,5μm),乙腈-0.1%磷酸溶液为流动相,梯度洗脱,检测波长分别为230、286nm,流速1.0ml·min-1;②eclipsexdb-c18色谱柱(250mm×4.6mm,5μm),乙腈-0.1%磷酸水溶液(14∶86)为流动相,流速:1.0ml·min-1,检测波长:230nm;③安捷伦zorbaxsbc18(4.6mm×250mm,5μm)色谱柱,乙腈-0.1%磷酸水为流动相,梯度洗脱,流速为1.0ml·min-1,柱温25℃,检测波长:230nm)、不同供试品制备除杂方法,结果发现芍药苷峰拖尾亦没有得到改善;最后发现使用waterssymmetryshieldtmrp18色谱柱(4.6mm×150mm,5μm)时,流动相不加酸亦能改善芍药苷峰的拖尾因子,故最终选择waterssymmetryshieldtmrp18来测定芍药苷。2.3方法学考察(1)专属性考察分别精密吸取对照品溶液、阴性供试品溶液和供试品溶液10μl,注入液相色谱仪,测定。结果见图4-6。结果表明,阴性样品在与芍药苷对照品相同的保留时间内,无色谱峰,故认为阴性没有干扰。(2)线关系性考察对照品溶液的制备:取芍药苷对照品适量,精密称定,加甲醇制成每1ml含芍药苷0.1028mg的溶液,即得对照品储备液。精密吸取芍药苷储备液适量,置10ml容量瓶,加甲醇稀释成浓度分别为0.01028mg/ml、0.02056mg/ml、0.04112mg/ml、0.049344mg/ml、008224mg/ml、0.1028mg/ml的标准品溶液。分别精密吸取10μl,注入高效液相色谱仪,测定,绘制芍药苷标准曲线,得芍药苷的回归方程为y=107x-19813(r2=0.9999)。结果表明芍药苷在0.01028mg/ml~0.1028mg/ml内线性关系良好。(3)精密度试验精密吸取芍药苷对照品溶液10μl,连续进样6次,测定对照品的峰面积,结果见表44。表44精密度试验结果(n=6)结果表明:相对标准偏差rsd<3%,表明精密度良好。(4)稳定性试验制备中药组合物颗粒剂供试品溶液,分别在制备后的2、4、6、8、10、12、14、16、18、24小时进样分析,在24小时内芍药苷含量的平均值为1.86mg/g,rsd=2.55%,表明样品在24小时内稳定性良好,结果见表45。表45稳定性试验结果(5)重现性试验取同一批中药组合物颗粒剂样品按照供试品制备方法制备供试品溶液6份,测得峰面积,计算芍药苷含量,结果见表46。表46重现性试验结果(n=6)结果表明:测得供试品中芍药苷的含量平均值为1.7184mg/g,其rsd<3%,表明重现性良好。(6)加样回收率试验取6份已知含量的中药组合物颗粒剂样品,研细,每份约0.5g,精密称定,分别加入芍药苷对照品0.879mg,制备成供试品溶液,测定含量,计算加样回收率,结果见表47。表47加样回收率试验结果(n=6)结果表明:芍药苷的平均加样回收率为102.27,rsd=2.28%,n=6,表明该法加样回收率符合要求。结论:综上,芍药苷的方法学符合要求,说明该含量测定方法稳定可行。三批样品含量测定制备三批中药组合物颗粒样品,按上述建立的含量测定方法测定含量,计算黄芪甲苷和芍药苷的含量。结果见表48。表48三批样品含量测定结果批次黄芪甲苷mg/g芍药苷mg/g201505280.541.68201506280.491.88201507280.501.81平均值0.511.79结果:本发明组合物颗粒中,黄芪甲苷的平均含量为0.51mg/g,芍药苷的平均含量为1.79mg/g。拟制定含量限度为:本品每1g含黄芪以黄芪甲苷(c31h68o14)计,不得少于0.41mg。本品每1g含白芍以芍药苷(c23h28o11)计,不得少于1.43mg。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1