用于具有灵活扫描模式的全身连续床运动参数化PET的系统和方法与流程
本公开一般地涉及医学成像,并且更具体地涉及利用连续床运动正电子发射断层摄影的参数化成像。
背景技术
正电子发射断层摄影(pet)是一种核医学模态,用于通过采用从由患者摄入或注入患者体内的放射性药物发出的伽玛光子来对代谢过程进行成像。在多个方向上拍摄多个pet图像以生成/重构三维pet图像和/或pet图像的多个切片。在图像重构之前,pet原始图像数据处于投影/正弦图空间中。pet扫描通常提供有关身体组织和系统(诸如心血管系统、呼吸系统和/或其他系统)的功能状况的有用信息。pet扫描对于指示软组织肿瘤的存在或到身体的特定器官或区域的血流降低是有用的。通常,在成像阶段期间在多个床位置采集大量的pet数据采集物(例如,帧)。
参数化pet成像的目标是基于动态数据随着时间对示踪剂动力学特性进行成像,并有可能比传统标准吸收值(suv)成像提供更多的组织病理信息。血液输入函数是参数化pet中的关键组成部分,血液输入函数表征血液中放射性药物随着时间的浓度。可以使用基于图像的方法从pet扫描仪获得血液输入函数,或者血液输入函数可以由用户通过基于人口的方法提供。
pet扫描仪具有小于患者全身高度的受限视场(fov)。最近,已经提出了连续床运动(cbm)pet系统。cbmpet系统能够采集全身图像。在cbm系统中,床相对于所述pet扫描仪移动。例如,以恒定的速率从开始位置(例如从头部开始)被移动到结束位置(例如患者的脚部)。从开始位置到结束位置连续收集pet数据。
与通过步进和发射扫描获得的体积图像不同,在cbm扫描中获得的图像中的轴向切片具有不同的时间信息。在cbmpet中,在采集数据的同时移动床,因此来自每个轴向切片的数据在相对于注入的不同时间处被采集,并且吸收模型的动力学分量可能受到影响。如果没有适当地计及床运动效果,这可能会导致发生图像不均匀和不正确量化。这增加了cbmpet图像处理的复杂性。
技术实现要素:
在一些实施例中,一种处理和重构动态正电子发射断层摄影(pet)正弦图数据的方法,包括:使用具有变化速度的连续床运动来采集pet正弦图数据;在采集pet正弦图数据的同时记录多个位置-时间坐标对;基于所述多个位置-时间坐标对来确定图像的多个切片中每个切片的相应切片采集时间;以及为所述多个切片中的每个相应切片重构相应参数化图像。
在一些实施例中,用于处理动态正电子发射断层摄影(pet)正弦图数据的系统,包括:处理器,能够执行指令;以及非临时性机器可读存储介质,被编码有程序代码并且耦合到所述处理器。所述存储介质包括:用于控制pet扫描仪使用具有变化速度的连续床运动来采集pet正弦图数据的代码;用于在所述pet扫描仪采集所述pet正弦图数据的同时记录多个位置-时间坐标对的代码;用于基于所述多个位置-时间坐标来确定所述图像的多个切片中的每个切片的相应采集时间的代码;以及用于为所述多个切片中的每个相应切片重构相应参数化图像的代码。
在一些实施例中,一种非临时性机器可读存储介质被编码有用于处理动态正电子发射断层摄影(pet)正弦图数据的程序代码,所述程序代码包括:用于控制pet扫描仪使用具有变化速度的连续床运动来采集pet正弦图数据的代码;用于在所述pet扫描仪采集所述pet正弦图数据的同时记录多个位置-时间坐标对的代码;用于基于所述多个位置-时间坐标来确定所述图像的多个切片中的每个切片的相应采集时间的代码;以及用于为所述多个切片中的每个相应切片重构相应参数化图像的代码。
附图说明
图1是根据一些实施例的参数化pet扫描系统的示意图。
图2是操作图1的pet扫描系统的方法的流程图。
图3是示出用于操作图1的pet扫描系统的单向多轮回扫描模式的示意图。
图3a-3c示出了图1的系统中床的运动的速度分布的非排他性示例。
图4是示出用于操作图1的pet扫描系统的双向扫描模式的示意图。
图5是示出用于操作图1的pet扫描系统的混合单向多轮回和双向扫描模式的示意图。
图6是操作图1的pet扫描系统的方法的流程图,该流程图具有参数计算的细节。
图7是示例性血液输入函数及其积分的图。
图8a是使用图1的系统以及图2和6的方法获得的代谢率(ki)图像的示例。
图8b是从与图8a的图像中所示的相同受试者获得的分布体积(dv)图像的示例。
图8c是相对于图2和6的方法针对每个切片使用相同的轮回平均时间的模型的偏差的图。
图9是图1的系统的框图,包括数据处理系统的细节。
图10a-10c示出了展示使用参数化图像来检测肿瘤与使用传统suv图像相比的优点的示例。
具体实施方式
示例性实施例的这种描述旨在结合附图来阅读,附图被认为是整个书面描述的一部分。在描述中,诸如“下”、“上”、“水平”、“竖直”、“高于”、“低于”、“向上”、“向下”、“顶”和“底”之类的相对术语以及其衍生词(例如,“水平地”、“向下地”、“向上地”等)应当被解释为指代取向,如随后被描述的或如在讨论的附图中示出的。这些相对术语是为了便于描述,并且不要求该设备以特定取向被构造或操作。关于诸如“连接”和“互连”之类的附接、耦合等的术语指代各结构被直接或通过介入结构间接彼此固定或附接的关系以及二者都可移动或刚性附接或关系,除非另有明确描述。
准确成像时间信息对于参数化pet的准确结果是重要的,因为动力学参数(例如,代谢率)与时间信息密切相关。因此,对于能够执行参数化成像的pet系统,非常希望具有用于跟踪动态扫描过程的时间信息并同步血液输入函数和动态pet数据的机制。
与步进和发射采集相比,具有连续床运动(cbm)的临床正电子发射断层摄影(pet)扫描仪在扫描范围、扫描方向和扫描速度方面提供了极大的灵活性来采集用于参数化成像的动态数据。在本文描述的各种实施例中,使用cbm,技术人员可以利用各种扫描模式执行多轮回动态扫描。cbm扫描模式可以包括但不限于:单向多扫描运动、双向运动或者在扫描的第一部分期间的单向多扫描运动与在轮回的第二部分期间的双向运动的组合。这些扫描模式中的每个均可以包括各种速度分布。
理想情况下,由不同扫描模式获得的参数化图像应该是相同的,因为基础生理机能与扫描无关。但是,如果未准确地跟踪扫描且未正确地计及时间信息,则在不同动态cbm扫描模式之间得到参数化图像的一致量化结果是有挑战的。
本公开提供了一种基于精细采样的“床标签”来计算参数化pet的不同扫描轮回的图像切片基准时间的方法。床标签是坐标对,该坐标对在整个扫描中准确编码床的位置和时间信息。在示例性cbmpet系统中,患者的床(也称为工作台)的速度和/或加速度可以是恒定的,或者可以随着时间变化,因此不容易计算作为时间函数的床的位置。因此,两个不同的轴向切片可能分别具有不同的成像开始时间、不同的持续时间和不同的基本函数。在一些实施例中,周期性地记录床标签,以提供位置与时间的准确记录。例如,可以以固定间隔(例如每100毫秒)记录床标签。
在大多数情况下,切片边界和切片中点不同于记录床标签的时间和位置。对于每个图像切片,成像开始时间基于床标签被计算作为切片进入扫描仪视场(fov)的点。类似地,对于每个图像切片,基于床标签将成像结束时间计算为切片离开扫描仪fov的点。切片的成像持续时间被定义为切片的成像开始时间和成像结束时间之间的差。然后在假设由于示踪剂动力学特性而在该持续时间期间没有活动性改变时,图像切片基准时间被计算为由于示踪剂衰变而发生平均活动性的时间点。例如,该切片基准时间用于获得血液输入函数值,并且基于patlak模型计算来自针对全身cbm参数化pet的拟合血液输入函数的曲线下面的面积。跟踪动态扫描和计算参数化pet的时间信息的这种方案可以容易地应用于不同的cbm扫描模式,并解决在不同器官和不同轮回上的非均匀时间采样。与肿瘤检测的标准吸收值(suv)图像相比,该方法具有潜在优势。
存在用于参数化成像的许多动力学模型。一些实施例采用线性patlak模型来生成两个参数化图像:一个用于代谢率(缩写为“ki”)并且一个用于分布体积(缩写为“dv”)。具有连续床运动(cbm)的临床扫描仪在扫描范围、扫描方向和扫描速度方面提供了极大的灵活性来采集用于参数化成像的动态数据。除了在不同器官上实现可变床速度的其灵活性之外,cbm扫描也可以在特定量的时间内采集更多计数,因为cbm不会在逐床转换上浪费时间,在逐床转换期间不会采集计数。具有cbm能力的pet扫描仪可用于以顺次的相同方向、双向或混合扫描模式来实现多轮回动态扫描。
为了计算动力学速率,示例性cbm系统记录准确时间和位置信息。本方法通过正确地计及时间信息来提供针对参数化图像的一致量化结果。在cbm体积中,成像开始时间和成像持续时间(用于在血液输入函数中拾取时间点)可能逐体素而变化。在示例性方法中,逐切片计算开始成像时间和成像持续时间,以计及可变扫描速度和各种不同扫描模式。本公开提供了基于精细采样的床标签来计算cbm参数化pet的时间信息并对patlak重构应用该时间信息的方法,精细采样的床标签准确地编码床的位置和时间信息。该方法可以容易地应用于不同的扫描模式,并解决不同轴向位置处的非均匀时间采样问题。通过这些方法收集的参数化图像可能是肿瘤检测的更好替代方案。
图1是pet系统101的示意视图,pet系统101包括:扫描仪100,被配置用于cbm扫描;以及计算机系统900,被配置用于控制扫描仪100并处理和重构由扫描仪100采集的数据。扫描仪100包括pet台架102,pet台架102相对于床106上的患者104定位。在一些实施例中,对于切片z,台架102从处于初始时间ts的初始位置zs连续移动到处于结束时间te的结束位置ze。在一些实施例中,台架102是静止的,并且床106从初始位置zs到结束位置ze连续移动经过台架102。在一些实施例中,zs对应于床106的头部,并且ze对应于床106的脚部。在一些实施例中,zs和/或ze可以对应于床106相对于台架102的任何相对位置。台架102(或床106)以增量移动,该增量可随着床106与台架102之间的相对速度变化而变化。扫描仪100可以是宾夕法尼亚州马尔文的西门子医疗解决方案美国公司的“biographmctflowtm”pet系统。下面描述计算机系统900。
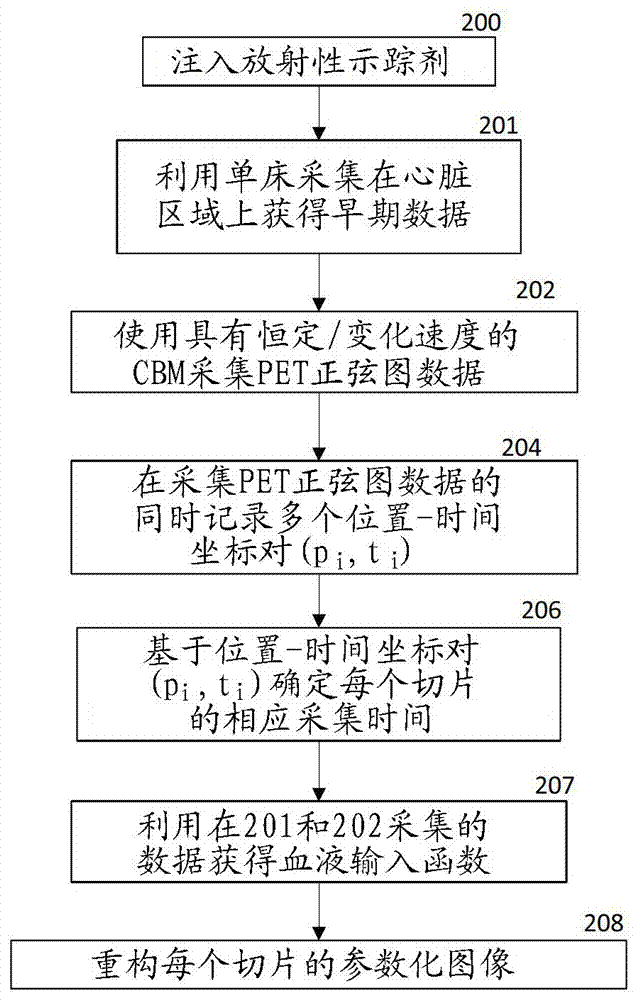
图2是处理和重构正电子发射断层摄影(pet)动态正弦图数据的示例性方法的流程图。
在步骤200,放射性示踪剂材料(诸如氟去氧葡萄糖)被注入到患者体内用于功能性成像。
在步骤201,该系统利用单床模式在心脏区域上采集动态pet正弦图数据。
在步骤202,扫描仪100使用具有恒定/变化速度的连续床运动来采集pet正弦图数据。可以按照如下模式利用床106和台架102之间的相对运动来操作扫描仪100:单向多轮回模式、双向模式或包括在一个或多个轮回的第一部分期间的单向运动和在一个或多个轮回的第二部分期间按照双向模式的混合模式。速度可以作为时间的连续函数(例如,锯齿或正弦)而变化,或作为时间的不连续函数(例如,交替阶跃函数)而变化。速度可以具有更复杂的分布;例如,加速度(速度的时间导数)可以是连续函数,或者可以具有一个或多个间断,所述加速度在所述间断处跳跃。
在步骤204,系统101在采集pet正弦图数据的同时将多个床标签(位置-时间坐标对)记录在非临时性机器可读存储介质中。对于每个床标签,相对于初始状况(p0,t0)(诸如在注入示踪剂的时间t0=0处z=0.0的位置p0)确定位置和时间。该位置可以由位置传感器(例如,激光干涉仪或类似物)准确地确定。在一些实施例中,床标签以均匀时间间隔(例如,10毫秒或100毫秒)被收集。在其他实施例中,床标签之间的时间间隔随速度而变化(例如,当速度小于阈值时,间隔可以是100毫秒,而当速度大于阈值时,时间间隔可以是10毫秒)。
在步骤206,系统101基于多个位置-时间坐标确定图像的多个切片中每个切片的相应采集时间。在床106与台架102之间的相对速度在连续床运动期间发生变化的情况下,各对相继床标签之间的距离不是恒定的。因为切片被选择为具有共同厚度,所以每个切片的初始位置zs和结束位置ze通常不与任何床标签的位置坐标重合。在各种实施例中,可以使用各种方法来为每个切片选择代表性采集时间。例如,针对每个相应切片发生平均活动性的相应时间点可以被计算作为该切片的代表性采集时间。下面描述确定代表性采集时间的方法。
在步骤207,系统基于在步骤201和步骤202采集的数据获得参数化血液输入函数。
在步骤208,系统101为多个切片中的每个相应切片重构相应图像。每个切片的基准时间是在步骤206确定的代表性采集时间。
图3-5示出了由图1的系统和图2的方法支持的cbm扫描模式的三个非限制性示例。
图3示意性地示出了单向多轮回扫描模式。根据该扫描模式,患者104从头部开始移动通过扫描仪100的台架102的视场(fov),直到患者的全身穿过fov(替代地,台架102沿着患者身体的长度从头部到脚部移动)。在每个轮回结束时,患者104(或台架102)返回到其原始位置,并且下一个轮回开始,其中患者104和台架102之间的相对运动与前一轮回中的方向相同。虽然图3示出了患者从头部开始移动经过fov的示例,但患者可以替代地从脚部开始移动经过fov。
图3中的箭头指示方向,并且大致指示床的轴向运动范围,但未示出速度。图3中的运动速度可以在一个或多个轮回期间发生变化。例如,在一些实施例中,如图3a中所示,速度可以在轮回的开始从零线性增加到最大速度,在轮回中间维持该最大速度,并且在轮回的结束线性减小到零。在其他实施例中,如图3b中所示,速度分布在每个轮回的开始和结束具有弯曲形状(例如,正弦、抛物线或对数)。在另一示例中,如图3c中所示,速度可以以最大速度开始,当感兴趣的器官(例如,脑部、心脏、肝脏或前列腺)处于扫描仪100的fov内时,速度可以减小至较慢速度,并且针对扫描的其余部分返回至最大速度。速度分布在每个轮回中可以是相同的。在另一示例中,扫描仪100在两个不同的轮回中可以使用两个不同的速度分布。
图4示意性地示出了双向扫描模式。根据该扫描模式,患者104从头部开始移动经过扫描仪100的台架102的视场(fov),直到患者的全身穿过fov,然后从脚部开始返回经过台架102同时进行扫描。(替代地,台架102沿着患者身体长度从头部到脚部移动,然后从脚部返回到头部同时进行扫描)。在每个偶数编号的轮回结束时,患者104和台架102)处于它们的原始位置,准备重复来回序列。按图4模式的运动的速度可以变化。例如,在一些实施例中,如针对图3的模式所描述的那样,速度分布在每个轮回的开始和结束处可以具有线性形状或弯曲形状(例如,正弦、抛物线或对数)。关于图3-3c的模式讨论的任何速度分布可以在图4的模式中使用。
图5示意性地示出了混合扫描模式,其中恒定/变化速度包括在床运动的轴向范围的第一部分(t1到t2和/或t7到t8)上的单向运动和在床运动的轴向范围的第二部分(t2至t7)上的双向运动的组合。根据该扫描模式,从时间t1直到时间t2,患者104在第一方向上从头部开始移动经过扫描仪100的台架102的视场(fov)。(替代地,台架102在头部开始沿患者身体的长度移动)。从时间t2直到时间t7,患者104在双向扫描模式中跨患者104的身体的第二部分移动。从时间t3到时间t4,患者104(或台架102)反转方向并且按照与第一方向相反的第二方向朝向原始位置移动部分路径。在时间t5和t6,患者104(或台架102)再次反转方向并且移动部分路径经过fov。在时间t7,患者(或台架102)恢复单向扫描,直到患者104的身体的其余部分在t8处被扫描。这只是一个示例,并且可以使用单向和双向模式的任何组合。速度可以根据以上关于图3-3c和4讨论的任何一个或多个速度分布而变化。
图6是动态pet正弦图数据采集、处理和参数化图像重构的详细示例的流程图。
在步骤300,放射性示踪剂材料(诸如氟去氧葡萄糖)被注入到患者体内用于功能性成像。
在步骤301,系统101利用单床模式(因为一个pet轴向fov能够覆盖整个心脏)在患者的心脏区域上采集pet正弦图数据。
在步骤302,系统101使用具有恒定/变化速度的连续床运动来采集pet正弦图数据。
在步骤304,系统101在采集pet正弦图数据的同时将多个床标签(位置-时间坐标对)记录在非临时性机器可读存储介质中。在这个示例中,该床标签被分离开恒定时间间隔(例如,100毫秒)。因此,位置-时间坐标对中的接续坐标对的时间坐标被彼此分离开恒定时间间隔,并且位置-时间坐标对的位置坐标被彼此分离开恒定/变化的位置间隔。
在步骤305,系统101基于在步骤301和步骤302采集的数据获得参数化/拟合血液输入函数。
在步骤306,针对扫描仪100的每个轮回,重复包含步骤308-318的循环。
在步骤308,针对每个图像切片重复包含步骤310-318的循环。
在步骤310,基于等式(1)和(2)确定切片相对于扫描仪100的台架102的切片进入时间ts和切片离开时间te:
其中,ts(轮回,z)是以z为中心的切片进入扫描仪100的fov的切片开始时间(相对于轮回开始时间);te(轮回,z)是以z为中心的切片离开扫描仪100的fov的切片结束时间(相对于轮回开始时间);zs(z)是切片的开始边缘的z坐标;并且ze(z)是切片的结束边缘的z坐标,轮回开始时间是当前轮回开始的时间(相对于注入),床标签包括时间和位置坐标对,该坐标对具有在切片内的位置和/或在切片外部的最接近的相邻床标签的位置。扫描模式是由操作者选择的操作扫描仪100的预定模式之一(例如,如上所讨论的)。函数f可以是内插函数,用于基于切片开始时间之前和之后的最接近的床标签以及切片结束时间之前和之后的最接近的床标签来确定切片开始时间。例如,可以使用线性、二次或三次内插。
在步骤312,根据等式(3)确定切片持续时间sd(轮回,z)(即,切片处于扫描仪100的视场内的时间长度):
在步骤314,系统101确定针对每个切片的相应平均采集时间。在一些实施例中,确定平均采集时间包括:确定发生切片的平均示踪剂活动性的基准时间(相对于切片开始时间ts)。这个时间可以根据等式(4)计算。
其中tav是由于衰变而在sd中发生平均活动性的时间点,假设没有动力学特性的改变;并且λ是注入材料的同位素衰变常数。
在步骤316,相对于注入的平均活动性的时间由等式(5)给出:
其中tref是基准时间;ts(轮回,z)是相对于注入的轮回开始时间;并且tav(轮回,z)是基于等式(4)的以z为中心的切片内平均活动性的时间。
在步骤318,系统确定与每个相应切片的基准时间对应的正被成像患者的血液输入函数cp(t)的相应值以及与每个相应切片对应的血液输入函数的相应积分。血液输入函数cp(t)是patlak模型的组成部分,patlak模型是使用线性回归来识别和分析涉及不可逆吸收的示踪剂药物代谢动力学特性的技术。下面描述patlak模型。
在步骤320,系统重构每个切片的代谢率ki图像和分布体积dv图像。
一些实施例使用如等式(6)中所描述的线性patlak模型:
其中ki是代谢率(即,每单位时间物质被从其完全去除的血浆体积),并且dv是分布体积(即,在血浆中观察到的相同浓度处将包含所给药物的总量的理论体积));x(t)是suv中的组织活动性,cp(t)是参数化血液输入函数,t*是达到动力学模型稳态的时间。
两侧都除以cp(t)得出:
等式(7)中的未知参数ki和dv可以通过线性回归求解,并且它们在每个体素处的相应值提供针对每个切片的ki和dv图像。
假设t=0为注入时间。在参数化之后,cp(t)变成连续曲线,该曲线在大于注入时间的任何时间点t都可用。在将patlak模型应用于多帧动态数据时,该方法针对每个帧使用特定/离散时间点tref,如等式(5)所定义的。时间tref被用作帧基准或采集时间。在cbm扫描中,针对每个轮回在切片级别计算tref。这个时间点表示为tref(轮回,z)。
为了准确地计算cbm扫描的时间信息,多个床标签(pi,ti)被记录到pet数据集中,其中pi是床的位置并且ti是当第i个标签被记录时相对于轮回开始时间的时间。利用床标签,可以针对各种不同的扫描模式计算以z为中心的每个离散图像切片的时间信息。图6图示了如何计算扫描轮回中每个图像切片的这个时间点tref,如上所述。等式(1)至(5)用于获得每个切片的tref(轮回,z)。在计算每个切片的tref后,tref可以用于根据参数化血液输入函数计算每个切片的cp(t)和cp(t)的积分,并且tref随后被应用到patlak图像重构。
图7示出了血液摄取函数cp(t)及其积分
所计算的切片基准时间可以应用于间接和直接参数化重构二者。间接重构方法涉及重构一时间序列的pet图像(从相应单个动态pet帧重构每个图像),然后将动力学模型拟合至每个体素时间活动性曲线(tac)。直接重构方法将动力学模型并入重构算法本身中,从而直接从来自完整动态pet数据集的投影数据产生参数化图像。直接重构方法对噪声不太敏感。
直接重构方法包括:从具有两个或更多图像帧的pet图像数据集直接重构参数化图像。patlak重构中的切片相关基本函数可以从应用的方程(8)和(9)确定。
应用这些基本函数,可以使用方程(10)和(11)的线性表示对每个体素的时间-活动性曲线进行建模。每个基本函数对应于一个参数化图像。基本函数b1对应于dv图像,并且基本函数b2对应于ki图像。主循环包括执行等式(10)的多个循环。在执行方程(10)的每个实例期间,等式(11)的多个嵌套循环被执行。
其中xjt是体素的时间活动性,并且
在间接重构的情况下,可以使用方程(12)和(13)的线性表示来对每个体素的时间-活动性曲线进行建模。等式(12)用于独立地重构轮回/帧图像。然后使用等式(13)对多个帧执行后重构线性拟合。
图8a示出了来自健康对照受试者的ki图像,并且图8b示出来自同一受试者的对应dv图像。区域802(图8a)和812(图8b)示出心脏活动性,并且区域804(图8a)和814(图8b)示出前列腺活动性。分布体积图像(图8b)中的心脏812(图8b)和前列腺814(图8b)周围的热区域是由于患者运动引起的。如果将全局时间应用于整个轮回(例如,从注入时间直到轮回的中间时间点),而不是如等式(5)中定义的逐切片时间信息,则全球时间的使用将导致轴向方向的量化偏差。
图8c是通过使用逐片时间信息获得的参数化图像与通过全球时间获得的参数化图像之间的比率的绘图。在存在零偏差并且两种方法都产生相同结果的理想情况下,比率曲线将是处于y=1.0处的水平线。与单位1的任何偏离都指示通过全局时间获得的参数化图像的偏差。图8c示出了ki和dv比率图像上的20像素宽区域的轴向分布绘图。ki和dv参数化图像二者的值在使用逐片时间和使用全球时间之间移位,特别是在脑部和膀胱区域。这种效果在dv图像中更为明显。如果动态扫描在不同的轴向切片上具有非均匀时间采样,则移位的量值将更加显著,这可能在床速度随时间变化并且不均匀的情况下发生。
具有cbm能力的临床扫描仪提供用于动力学建模和形成参数化图像的巨大潜力。提供具有灵活扫描模式的准确参数化成像。扫描时间信息被跟踪并正确应用。该方法可以基于床标签准确地计算全身cbm参数化pet的时间信息。基于精细采样的床标签来计算时间信息的这种方案可以被容易地应用于不同扫描模式,并解决不同轴向图像切片上的非均匀时间采样问题。所计算的时间信息可以应用于使用线性patlak模型的全身参数化成像。如果应用全局时间而不是逐片时间信息来计算基本函数,则将导致参数化图像量化的不准确性/偏差。由于应用全局时间信息而导致的不准确性的程度取决于扫描协议(诸如扫描模式)以及不同轮回期间身体不同区域上的可变扫描速度。参数化图像可以成为suv图像的替代物来用于肿瘤检测。
图9是包括扫描仪100和计算机系统900的系统101的框图。计算机系统900可以在一些实施例中使用,例如用于实现控制扫描仪100的处理器。计算机系统900可以包括一个或多个处理器902。每个处理器902连接到通信基础设施906(例如,通信总线,交叉条(cross-overbar)或网络)。处理器900可以被实现为中央处理单元、嵌入式处理器或微控制器,或专用集成电路(asic)。计算机系统900可以包括显示接口922,显示接口922转发来自通信基础设施906(或来自帧缓冲器,未示出)的图形、文本和其他数据以在显示单元924上向用户显示。
计算机系统900还可以包括主存储器904(诸如随机存取存储器(ram))以及辅助存储器908。主存储器904和/或辅助存储器908包括动态随机存取存储器(dram)。辅助存储器908可以包括例如硬盘驱动器(hdd)910和/或可移动存储驱动器912,硬盘驱动器(hdd)910和/或可移动存储驱动器912可表示固态存储器、光盘驱动器、闪存驱动器、磁带驱动器或类似物。可移动存储驱动器912从可移动存储单元916读取和/或写入可移动存储单元916。可移动存储单元916可以是光盘、磁盘、软盘、磁带或类似物。可移动存储单元916可以包括计算机可读存储介质,该计算机可读存储介质具有有形地存储在其中(或体现在其上)数据和/或计算机软件指令,例如用于使(一个或多个)处理器执行各种操作。
在替代实施例中,辅助存储器908可以包括用于允许计算机程序或其他指令被加载到计算机系统900中的其它装置。辅助存储器908可以包括可移动存储单元918和对应的可移动存储接口914,可移动存储接口914可以类似于可移动存储驱动器912,具有其自己的可移动存储单元916。这种可移动存储单元的示例包括但不限于通用串行总线(usb)或闪存驱动器,其允许软件和数据从可移动存储单元916、918被传输到计算机系统900。
计算机系统900还可以包括通信接口(例如,联网接口)920。通信接口920允许指令和数据在计算机系统900和扫描仪100之间传输。通信接口920还提供与其它外部装置的通信。通信接口920的示例可以包括调制解调器、以太网接口、无线网络接口(例如射频、ieee802.11接口、蓝牙接口等)、个人计算机存储器卡国际协会(pcmcia)插槽和卡等。经由通信接口920传输的指令和数据可以采用信号形式,信号形式可以是能够被通信接口920接收的电子、电磁、光学等等。这些信号可以经由通信路径(例如,信道)被提供给通信接口920,通信路径可以使用电线、电缆、光纤、电话线、蜂窝链路、射频(rf)链路和其他通信信道来实现。
本文描述的方法和系统可以至少部分地以用于实践这些过程的计算机实现的过程和设备的形式来体现。所公开的方法还可以至少部分地以编码有计算机程序代码的有形非临时性机器可读存储介质的形式来体现。该介质可以包括例如ram、rom、cd-rom、dvd-rom、bd-rom、硬盘驱动器、闪存或任何其他非临时性机器可读存储介质,其中,当计算机程序代码被加载到计算机中并且被计算机执行时,计算机成为用于实践该方法的设备。这些方法也可以至少部分地以计算机形式来体现,计算机程序代码被加载到该计算机中和/或在其中被执行,使得该计算机成为用于实践该方法的专用计算机。当在通用处理器上实现时,计算机程序代码段配置处理器以创建特定逻辑电路。替代地,所述方法可以至少部分地体现在数字信号处理器中,该数字信号处理器由用于执行所述方法的专用集成电路形成。
图10a-10c示出了示例,该示例展示了与使用传统suv图像相比,使用由cbmpet系统101获得的参数化图像来检测肿瘤的优点。图10a是ki图像的矢状图像,图10b是suv图像的矢状图像。胸部中的肿瘤(1002和1004)在参数化ki图像中更显眼,这也在图10c的关于肿瘤的线绘图中示出,图10c中虚线曲线1000指示使用suv获取的图像,并且实线曲线1002指示ki。在实线曲线1002中的ki图像中信号与背景的比率要高得多。
尽管已经根据示例性实施例描述了本主题,但本主题不限于此。相反,所附权利要求应该被广义地解释,以包括本领域技术人员可以做出的其他变体和实施例。
- 还没有人留言评论。精彩留言会获得点赞!