一种改良型低毒增生平组合物及其制备方法和用途与流程
本发明涉及一种预防和/或治疗肿瘤疾病的中药复方组合物,具体地说涉及减少肝毒性的改良型中药复方增生平组合物及其制备方法和用途。
背景技术:
肿瘤,尤其是恶性肿瘤是目前人类致死率最高的疾病之一。目前对恶性肿瘤的治疗主要以手术、放疗、化疗为主,但许多化学抗癌药物在作用于靶细胞时往往累及正常细胞,造成严重的副反应。中药复方增生平(cn1062656a,cn101966272a)由六味中药:山豆根、夏枯草、拳参、北败酱、白鲜皮、黄药子组成。具有清热解毒、化瘀散结之功效。适用于食管和贲门上皮增生,具有呃逆,进食吞咽不利,口干,口苦,咽痛,便干,舌暗,脉弦滑等热瘀内结表现者。临床上一般用于上消化道的癌前病变如:与口腔癌相关的口腔黏膜白斑、与食管癌和贲门癌相关的食管和贲门上皮增生的治疗(cn1062656a)、对中晚期的食管癌、贲门癌、胃癌有良好的缓解作用。尽管长期慢性毒性研究认为增生平无明显的肝肾毒性(付永艳etal.,1998),但长期的临床实践中发现部分病人(刘晓东and闻炜,1999;张俊忠,2007)可引起严重的肝损伤、出现黄疸等比较严重的副作用。其临床表现一般为在临床常规服用药物一段时间后,如出现肝损伤指标,则立即停药,并予以保肝治疗,但肝损伤的情况仍持续恶化,乃至出现严重黄疸。尽管这种严重的肝损伤的情况发病率较低,但随着人们对中草药用药安全性认识的不断提高,严重影响并限制了增生平这种药物在临床上的应用。
经文献调研,已明确证实增生平的组方中药中,黄药子有较强的肝毒性,其作用机制为黄药子中含有的黄独素类成分如黄独素b等,通过代谢活化作用(linetal.,2014),与体内蛋白相结合(图1),诱发免疫反应(choanduetrecht,2017),因而对肝脏产生直接毒性(lietal.,2016)。发明人在研究中发现白鲜皮是组方中另一致肝毒性中药。而目前关于白鲜皮的肝毒性报道较少,仅通过流行病学调查(leeetal.,2015)和整合证据链分析(黄奕雪etal.,2017),认为白鲜皮可能具有肝毒性,但目前对其毒性成分知之甚少。本发明在前期研究中发现白鲜皮中的主要成分如黄柏酮、梣酮,具有与黄独素类成分相似的活性呋喃结构片段(图2),因此推测白鲜皮也可能具有相似的肝毒性。本发明在基于对黄药子和白鲜皮中的肝毒性成分及其理化性质的考虑之上,通过改良增生平的传统制备工艺,去除可能的肝毒性成分,保留有效成分,以获得一种改良型低毒增生平组合物及其制剂。目前基于减毒的改良型增生平组合物及其制备方法未见文献报道。
技术实现要素:
本发明的技术问题是提供一种改良型的低毒中药复方增生平的制备工艺、及其制备得到的改良型低毒增生平组合物、以及其在治疗和/或预防癌症方面的用途。具体的说,通过本制备工艺获得的改良型低毒增生平组合物及制剂对癌症,特别是鳞状细胞癌,包括口腔癌、食管癌、贲门癌、胃癌等有显著的预防和/或治疗作用,并具有较低的肝毒性。该工艺不同于传统的增生平水提取的制备工艺,其特点在于针对毒性药材,通过增加萃取或树脂精制步骤,针对性的去除了增生平组方中毒性药材中含有的可能导致严重肝损伤的毒性成分,同时保留了其有效成分。本发明充分保证了中药增生平在使用中的安全性和有效性,有十分重要的应用前景。
为解决本发明的技术问题,本发明提供了如下技术方案:
本发明技术方案的第一方面是提供了一种改良型低毒增生平组合物的制备方法,其特征在于,由以下步骤组成:
1)黄药子和白鲜皮若干g,每100g药材用600ml~2000ml的水提取1~3次,过滤,浓缩,得到提取液。
其中所述的黄药子和白鲜皮,可以分别提取浓缩,也可以混合提取浓缩;优选的,混合后进行提取。
其中所述每100g药材用600ml~2000ml的水提取1~3次,可以使用800ml、600ml、600ml水提取3次,也可以使用1000ml、1000ml的水提取2次;提取前可以浸泡,也可以不经浸泡直接提取;提取方式可以采用加热、浸泡、超声提取等本领域公知的多种方法;优选的,使用加热提取方法;提取时间为1~2小时。
其中所述的浓缩,可使用减压浓缩,也可以使用常压浓缩,优选的,使用减压浓缩的方法;浓缩后的样品体积根据工艺的不同,技术指标会略有不同,一般按照本领域内公知的要求,通常每100g药材浓缩至100ml。
2)向步骤1)中的黄药子、白鲜皮的提取液中加入等体积的萃取溶剂萃取1~3次,取萃取后的水相,得到黄药子、白鲜皮的精制液。
其中所述的萃取溶剂包括正丁醇、乙酸乙酯、氯仿、二氯甲烷、石油醚、环己烷、正己烷;优选的,萃取溶剂为正丁醇、乙酸乙酯。
其中所述黄药子和白鲜皮的提取液可以单独萃取,也可以混合后萃取;优选的,混合后进行萃取。
或者,将黄药子和白鲜皮的提取液上样至大孔吸附树脂或微孔吸附树脂后,用0~70%乙醇洗脱2~4个柱体积,收集洗脱液,得到黄药子、白鲜皮的精制液。
其中所述的黄药子、白鲜皮的提取液,可以单独进行树脂精制,也可以混合后进行树脂精制;优选的,混合后进行树脂精制。
其中所述的大孔吸附树脂为本领域内公知的非极性、弱极性、中极性、极性和强极性大孔吸附树脂;优选的,使用非极性、弱极性和中极性大孔吸附树脂。
其中所述的大孔吸附树脂按照结构来讲,为本领域内公知的苯乙烯型、苯乙烯二乙烯基苯型、交联聚苯乙烯型、苯乙烯腈型、甲基苯乙烯型、甲基丙烯酸酯型、甲基丙烯酸型、丙烯酸型、丙烯酰胺型、乙烯吡咯烷酮型、亚砜型、苯酚-甲醛型或氧化氮型;优选的,使用苯乙烯型、丙烯酸酯型或甲基丙烯酸酯型大孔吸附树脂。
其中所述的大孔吸附树脂具体的型号包括但并不限于d101,da201,d301,d3520,d4006,d4020,h103,h107,h30,h60,ab-8,x-5,nka,diaionhp-20,sepabeadssp-700,hp2mgl,hpd100,hpd722,hpd-600,hpd-826,ads-17,amberlitexad-4、xad-1600等。
其中所述的微孔吸附树脂为本领域内公知的非极性、中极性、极性微孔吸附树脂;优选的,使用非极性和中极性微孔吸附树脂;
其中所述的微孔吸附树脂的结构类型为本领域内公知的苯乙烯型、丙烯酸酯型或甲基丙烯酸酯型、丙烯酸型或氧化氮型;优选的,使用苯乙烯型、丙烯酸酯型或甲基丙烯酸酯型;具体的型号包括但并不限于mcigelchp20、mcigelcmg20。
其中所述的树脂洗脱溶剂,优选的,使用30%~50%乙醇进行洗脱;
3)山豆根,拳参,北败酱,夏枯草若干g,每100g药材用600ml~2000ml的水进行提取,得到四种药材提取液。
其中所述的四种药材,可以分别提取,也可以混合提取;可以全部提取,也可以部分提取,所余药材粉碎后作为赋形剂使用;
其中所述的每100g药材可用600ml~2000ml的溶剂进行提取1~3次,可以使用800ml、600ml、600ml水提取三次,也可以使用1000ml、1000ml的水提取2次。提取前可以浸泡,也可以不经浸泡直接提取;提取方式可以采用加热、浸泡、超声提取等本领域公知的多种方法;优选的,使用加热提取方法;提取时间为1~2小时;
4)将步骤2)中所述精制液与步骤3)中所述提取液,混合、浓缩、干燥、粉碎,得到改良型低毒增生平组合物。
其中步骤2)所述的精制液与步骤3)中所述的提取液,可分别单独浓缩后混合,也可混合后浓缩。
其中所述的浓缩,可使用减压浓缩,也可以使用常压浓缩;优选的,使用减压浓缩的方法。
其中所述的干燥,可使用减压干燥,也可使用常压干燥,可以使用冷冻干燥,也可使用喷雾干燥。
上述制备工艺使用的六种药材,其处方比例来源于cn1062656a(无效),cn101966272a(无效)。其中由于黄药子和白鲜皮的肝毒性,在初始处方基础上,可酌情减少黄药子或白鲜皮的用量或直接去除其中的一味或两位药材,因此在本发明中药材比例具体如下:
山豆根18-24份,拳参17-21份,北败酱17-23份,夏枯草18-25份,黄药子0-6份,白鲜皮0-12份。
根据实验例的有效性和毒性实验结果,优选的,药材比例为:山豆根18-24份,拳参17-21份,北败酱17-23份,夏枯草18-25份,黄药子3-6份,白鲜皮8-12份。
本技术方案的第二方面是提供由第一方面的制备方法制备得到的改良型低毒增生平组合物。根据以上制备工艺制备的改良型低毒增生平组合物中,黄药子中的毒性成分以黄独素b为代表,白鲜皮中的毒性成分以黄柏酮和梣酮为代表,其含量限量为:黄独素b含量低于30ppm,黄柏酮含量低于100ppm,梣酮含量低于50ppm;
优选的,所述改良型低毒增生平组合物中黄独素b含量低于20ppm,黄柏酮含量低于20ppm,梣酮含量低于20ppm;
进一步优选的,所述改良型低毒增生平组合物中黄独素b含量低于10ppm,黄柏酮含量低于10ppm,梣酮含量低于10ppm。
本技术方案的第三方面是提供了一种药物组合物,所述的药物组合物含有由第一方面的制备方法制备得到的改良型低毒增生平组合物以及药学上可接受的载体或赋形剂。
上述药物组合物可以单位剂量形式给药,给药途径可为肠道或非肠道,如口服、静脉注射、肌肉注射、皮下注射、鼻腔、口腔黏膜、眼、肺和呼吸道、皮肤、阴道、直肠等。
给药剂型可以是液体剂型、固体剂型或半固体剂型。液体剂型可以是溶液剂(包括真溶液和胶体溶液)、乳剂(包括o/w型、w/o型和复乳)、混悬剂、注射剂(包括水针剂、粉针剂和输液)、滴眼剂、滴鼻剂、洗剂和搽剂等;固体剂型可以是片剂(包括普通片、肠溶片、含片、分散片、咀嚼片、泡腾片、口腔崩解片)、胶囊剂(包括硬胶囊、软胶囊、肠溶胶囊)、颗粒剂、散剂、微丸、滴丸、栓剂、膜剂、贴片、气(粉)雾剂、喷雾剂等;半固体剂型可以是软膏剂、凝胶剂、糊剂等。
本发明的药物组合物可以制成普通制剂、也制成是缓释制剂、控释制剂、靶向制剂及各种微粒给药系统。
为了将本发明的改良型低毒增生平组合物制成片剂,可以广泛使用本领域公知的各种赋形剂,包括稀释剂、黏合剂、润湿剂、崩解剂、润滑剂、助流剂,也可以使用部分未提取的药材粉碎后,作为赋形剂。稀释剂可以是淀粉、糊精、蔗糖、葡萄糖、乳糖、甘露醇、山梨醇、木糖醇、微晶纤维素、硫酸钙、磷酸氢钙、碳酸钙等;湿润剂可以是水、乙醇、异丙醇等;粘合剂可以是淀粉浆、糊精、糖浆、蜂蜜、葡萄糖溶液、微晶纤维素、阿拉伯胶浆、明胶浆、羧甲基纤维素钠、甲基纤维素、羟丙基甲基纤维素、乙基纤维素、丙烯酸树脂、卡波姆、聚乙烯吡咯烷酮、聚乙二醇等;崩解剂可以是干淀粉、微晶纤维素、低取代羟丙基纤维素、交联聚乙烯吡咯烷酮、交联羧甲基纤维素钠、羧甲基淀粉钠、碳酸氢钠与枸橼酸、聚氧乙烯山梨糖醇脂肪酸酯、十二烷基磺酸钠等;润滑剂和助流剂可以是滑石粉、二氧化硅、硬脂酸盐、酒石酸、液体石蜡、聚乙二醇等。
还可以将片剂进一步制成包衣片,例如糖包衣片、薄膜包衣片、肠溶包衣片,或双层片和多层片。
为了将给药单元制成胶囊剂,可以将有效成分本发明化合物及其药学上可接受的盐与稀释剂、助流剂混合,将混合物直接置于硬胶囊或软胶囊中。也可将有效成分本发明化合物及其药学上可接受的盐先与稀释剂、黏合剂、崩解剂制成颗粒或微丸,再置于硬胶囊或软胶囊中。用于制备本发明化合物及其药学上可接受的盐片剂的各稀释剂、黏合剂、润湿剂、崩解剂、助流剂品种也可用于制备本发明化合物及其药学上可接受的盐的胶囊剂。
本发明的药物组合物可单独服用,或与其他治疗药物或对症药物合并使用。当本发明的药物组合物与其它治疗药物存在协同作用时,应根据实际情况调整它的剂量。
此外,如需要,也可以向药物制剂中添加着色剂、防腐剂、香料、矫味剂或其它添加剂。
为达到用药目的,增强治疗效果,本发明的改良型低毒增生平组合物或药物组合物可用任何公知的给药方法给药。
本技术方案的第四方面是提供了由第一方面的制备方法制备得到的改良型低毒增生平组合物在制备治疗和/或预防癌症或增生性疾病药物中的应用。
所述的癌症或增生性疾病包括鳞状细胞癌及黏膜潜在恶性病变。
所述的鳞状细胞癌包括口腔癌、食管癌、贲门癌、胃癌、宫颈癌、结肠癌、肺癌;所述的黏膜潜在恶性病变包括口腔白斑和红斑、黏膜下纤维化、慢性盘状红斑狼疮、口腔扁平苔藓、食管上皮增生、浅表性胃炎、慢性萎缩性胃炎、胃黏膜肠化生、胃黏膜不典型增生、乳腺不典型增生。
本技术方案的第五方面是提供由第一方面的制备方法制备得到的改良型低毒增生平组合物在制备清热解毒、化瘀散结药物中的应用,适用于食管和贲门上皮增生、呃逆,进食吞咽不利,口干、口苦、咽痛、便干舌暗、脉弦滑者热瘀内结表现者的治疗。
有益技术效果:
本发明在分析发现黄药子和白鲜皮中的肝毒性成分基础上,改进了原制备工艺中全部或部分白鲜皮药材粉末入药,其余药材全部水提取的工艺,改良后的工艺特征为使用萃取或树脂精制工艺针对性的去除黄药子和白鲜皮中的肝毒性成分,保留其他有效成分,并通过有效性实验和毒性实验证明去除毒性成分的改良型增生平组合物,能够在保障有效性的前提下,大大降低了增生平的肝肾毒性,进一步增强了其临床用药的安全性,因而具有十分重要的应用价值。
附图说明
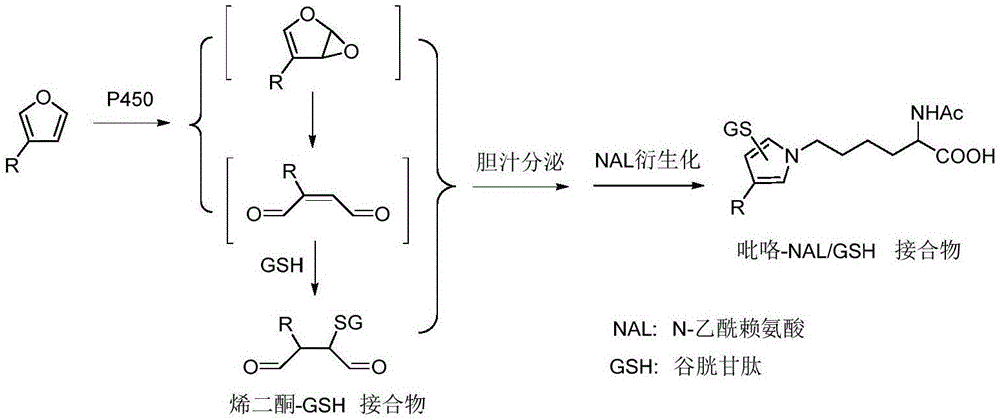
图1呋喃类成分与蛋白质中的氨基酸缩合的可能反应机制(lietal.,2015)
图2黄药子和白鲜皮中的主要呋喃类成分
图3增生平市售样品与对比例中肝毒性成分的uplc图谱
图4有效性实验中的各组动物的体重曲线
图5长期毒性实验中各组动物的体重曲线
图6颊囊组织肉眼观察标准(abcd分别表示正常黏膜、炎症状态、瘢痕挛缩及肿瘤形成)
图7各组的颊囊图片(abcde分别表示zsp-1,2,4组、dmba组及正常对照组颊囊黏膜)
图8he病理学切片(abcdef分别表示正常黏膜上皮、单纯增生、轻度异常增生、中度异常增生、重度异常增生和鳞状细胞癌,he染色,x200)
图9brdu的表达情况(abcdef分别表示正常黏膜上皮、单纯增生、轻度异常增生、中度异常增生、重度异常增生和鳞状细胞癌中brdu表达情况,图中胞核棕染为阳性表达,x200)
图10cd31的表达情况(abc分别表示正常黏膜上皮、异常增生上皮和鳞状细胞癌中cd31表达情况,图中棕黄色着色为阳性表达,x200)
图1112周肝脏he染色结果(abcd分别示zsp-1,2,4组和正常对照组12周肝脏he染色,x200,三角所指为肝细胞空泡变性,箭头所指为炎细胞浸润灶)
图1216周肝脏he染色结果(a',b',c',d'分别示zsp-1,2,4组和正常对照组16周肝脏he染色,x200)
图1312周肾脏he染色结果(abcd分别示zsp-1,2,4组和正常对照组12周肾脏he染色,x100)
具体实施方式
下面的实施例及药理活性实验用于进一步说明本发明,但这并不意味着对本发明的任何限制。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
下述实施例中,部分物质的全称或相应的中文名称如下:
dmba:7,12-dimethylbenzanthracen;二甲基苯并蒽
brdu:bromodeoxyuridine,溴化去氧尿苷
he染色:hematoxylin-eosinstaining,苏木精-伊红染色法
dab染色:二氨基联苯胺染色
cox-2:cyclooxygenase,环氧合酶-2
alt:alaninetransaminase,谷丙转氨酶
ast:aspartatetransaminase,天门冬氨酸转氨酶
γ-gt:γ-glutamyltranspeptidase,γ-谷氨酰转肽酶
alp:alkalinephosphatase,碱性磷酸酶
ldh:lacticdehydrogenase,乳酸脱氢酶
bun:bloodureanitrogen,尿素氮
crea:creatinine,肌酐
ua:uricacid,尿酸
gsh:glutathione,谷胱甘肽
mda:malondialdehyde,丙二醛
sod:superoxidedismutase,超氧化物歧化酶
cat:过氧化氢酶
对比例.原处方
根据增生平组方,按照传统水提取工艺,制备增生平的对比例。山豆根420g,拳参420g,北败酱420g,夏枯草420g,黄药子100g,白鲜皮210g,加入水19.9l,加热提取,共两次,每次各2小时,过滤,合并提取液,60℃减压浓缩至约1.99l,冷冻干燥后粉碎,称重,计算得率为25%。编号为zsp-1。
实施例1.去除毒性成分的制备工艺1
黄药子100g,白鲜皮210g,加入水3.1l,加热提取,共两次,每次各2小时,过滤,合并提取液,60℃减压浓缩至约310ml。加入乙酸乙酯约310ml,萃取,共三次,弃去有机相,取水相为a。山豆根420g,拳参420g,北败酱420g,夏枯草420g,加入水16.8l,加热提取,共两次,每次各2小时,过滤,合并提取液,60℃减压浓缩至约1.68l,为b。a与b混匀后,冷冻干燥,粉碎,称重,计算得率为22%。编号为zsp-2。
实施例2.去除毒性成分的制备工艺2
黄药子100g、白鲜皮210g,加入水3.1l,加热提取,共两次,每次各2小时,过滤,合并提取液,60℃减压浓缩至约310ml。浓缩液上样至大孔吸附树脂diaionhp-20(3.1l)后,用50%乙醇洗脱4倍柱体积,合并洗脱液,60℃减压浓缩至约310ml,编号为a。山豆根420g,拳参420g,北败酱420g,夏枯草420g,加入水16.8l,加热提取,共两次,每次各2小时,过滤,合并提取液,60℃减压浓缩至约1.68l,编号为b。a与b混匀后,冷冻干燥后粉碎,计算得率为21%。编号为zsp-3。
实施例3.去除毒性药材的制备工艺3
山豆根420g,拳参420g,北败酱420g,夏枯草420g,加入水16.8l,加热提取,共两次,每次各2h,过滤,合并提取液,浓缩后,冷冻干燥后粉碎,得率23%。编号为zsp-4。
实施例4.去除毒性成分的制备工艺4
黄药子100g、白鲜皮210g,加入水3.1l,加热提取,共两次,每次各2小时,过滤,合并提取液,60℃减压浓缩至约310ml。浓缩液上样至大孔吸附树脂d-101(3.1l)后,用50%乙醇洗脱4倍柱体积,合并洗脱液,60℃减压浓缩至约310ml,编号为a。山豆根420g,拳参420g,北败酱420g,夏枯草420g,加入水16.8l,加热提取,共两次,每次各2小时,过滤,合并提取液,60℃减压浓缩至约1.68l,编号为b。a与b混匀后,冷冻干燥后粉碎,计算得率为21%。编号为zsp-5。
实施例5.去除毒性成分的制备工艺5
黄药子100g、白鲜皮210g,加入水3.1l,加热提取,共两次,每次各2小时,过滤,合并提取液,60℃减压浓缩至约310ml。浓缩液上样至大孔吸附树脂ab-8(3.1l)后,用50%乙醇洗脱4倍柱体积,合并洗脱液,60℃减压浓缩至约310ml,编号为a。山豆根420g,拳参420g,北败酱420g,夏枯草420g,加入水16.8l,加热提取,共两次,每次各2小时,过滤,合并提取液,60℃减压浓缩至约1.68l,编号为b。a与b混匀后,冷冻干燥后粉碎,计算得率为22%。编号为zsp-6。
实施例6.去除毒性成分的片剂制备工艺6
黄药子100g,白鲜皮210g,加入水3.1l,加热提取,共两次,每次各2小时,过滤,合并提取液,60℃减压浓缩至约310ml。加入乙酸乙酯约310ml,萃取,共三次,弃去有机相,取水相为a。山豆根420g,拳参420g,北败酱320g,夏枯草420g,加入水15.8l,加热提取,共两次,每次各2小时,过滤,合并提取液,60℃减压浓缩至约1.58l,为b。剩余100g北败酱粉碎成细粉。a与b混匀后,减压浓缩、干燥、粉碎后,加入100g北败酱细粉,用适当浓度乙醇制粒、压片、干燥即得。
成分分析实验和药理实验:
实验例1.针对市售增生平、对比例增生平组合物、以及实施例1-5的改良型低毒增生平组合物进行uplc肝毒性成分分析
实验方法:
仪器:配有ultimate3000液相系统和qexactivefocus质谱仪
色谱条件:流动相:0.1%甲酸水溶液(a)-乙腈(b);流速:0.4ml/min;梯度:30%b(0min)→30%b(3min)→50%b(4min)→70%b(10min);色谱柱:beh-c18(100×2.1mm,1.7μ,waters)
质谱条件:分辨率:70,000;扫描范围:70-1000m/z;喷雾电压:3.30kv;毛细管温度:320℃;鞘气(n2):35psi;辅助气(n2):10arb;吹扫气(n2):1arb;探针温度:310℃;s-lensrflevel:50v。选择离子:345.133,455.207,233.117。
样品处理方法:精密称取样品粉末1000mg,置10ml容量瓶中,精密加入甲醇10ml,超声提取60min,放置至常温后用甲醇补足重量,过滤,即得。使用外标一点法计算含量。
实验结果:
表1肝毒性成分含量(ppm)
由于黄独素b、黄柏酮和黄芩苷在改良型低毒增生平组合物中含量较低,因此采用uplc-ms选择离子检测,测定其含量(图3)。由计算结果可知(表1)可知:本发明制备的对比例样品和市售增生平样品中黄独素b、黄柏酮和梣酮含量均大大高于实施例1~5制备的改良型低毒增生平组合物(zsp-2~6)。说明通过萃取及树脂精制均可大大减少三种毒性成分的含量,其降低倍数在1/25~1/50之间。市售样品与自制对比例之间含量的差别可能由选用药材质量不同导致。
实验例2体内有效性
实验方法
6周龄雄性金黄地鼠50只,体重100-120g,spf级,购自北京斯贝福公司。实验期间饲养于spf级动物饲养室,12h明/暗,标准饮食饮水。动物平均随机分为5组:正常对照组,dmba组、zsp-1组、zsp-2组、zsp-4组。
实验组动物前6周左颊囊涂抹0.5%dmba溶液,3次/周。按照相同的处方量计算给药剂量,dmba组及zsp-1,2,4组从第7周起分别给予蒸馏水、zsp-1水溶液(1.776g/kg)、zsp-2水溶液(1.575g/kg)、zsp-4水溶液(1.562g/kg),5次/周,持续至14周末。正常对照组常规饲养。14周末处死全部动物。实验期间观察动物行为表现,每周记录体重。
完整取下金黄地鼠左颊囊黏膜组织,肉眼观察肿瘤发生情况,记数肿瘤数目和大小,部分组织10%福尔马林溶液固定,进行he染色,显微镜下观察。按who口腔潜在恶性病变及口腔上皮异常增生2017年标准(reibeletal,2017)纪录分值,上皮结构与细胞学特征各占8项,每项记1分,总分值0-8分。
动物处死前2小时腹腔注射brdu50mg/kg。对石蜡切片进行brdu及cd31免疫组织化学染色。显微镜下观察,brdu阳性表达为细胞核染色,cd31标记血管内皮细胞,凡是染成棕色的单个内皮细胞或内皮细胞簇,均作为1个血管计数,同时凡管腔大于8个红细胞,带较厚肌层的血管均不计数。随机取200倍镜下10个视野,记录阳性表达数量。
实验结果
a:动物一般情况
实验组地鼠在dmba给药期间极易激惹,焦躁不安,实验后期活动量均有减少,部分地鼠出现呼吸困难,口唇紫绀,伴有或不伴有明显消瘦。正常对照组动物一般情况良好。第1周至第9周各实验组金黄地鼠的平均体重逐渐增长;第9周后dmba组地鼠体重开始下降;第11周后,除正常对照组外,其余各实验组金黄地鼠平均体重同样呈现下降趋势,但降幅较小;14周末各给药组地鼠平均体重均高于dmba组,在一定程度上提示各增生平样品均可以通过抑制肿瘤形成和发展来改善地鼠的生长情况。(图4)
第2周至第4周给药组地鼠颊囊表现为明显炎症反应,黏膜充血,见脓性分泌物;其后炎症逐渐消退,黏膜发白增厚,颊囊袋底有瘢痕挛缩;第9周有颊囊开始出现肉眼可见的颗粒状突起,体积逐渐增大;至14周末,多数动物口内可见瘤体,大小形态各异。正常对照组动物颊囊颜色粉红,光滑连续,未见异常。
b:颊囊组织肉眼观察情况
正常对照组地鼠颊囊黏膜为淡粉色、光滑、菲薄、连续,黏膜下血管清晰可见。实验组地鼠颊囊黏膜增厚粗糙,颜色暗红,多有肉眼可见增生物,小者呈颗粒状或毛刺状,大者呈球状或菜花状,增生物表面颜色苍白或鲜红,伴或不伴有糜烂及脓性分泌物。其中dmba组瘤体个数、大小及炎症程度明显重于其余各给药组(图6,图7)。对肉眼所见肿瘤个数及体积进行统计发现(表2),zsp-2组的肿瘤个数明显少于dmba组,差异有统计学意义。除zsp-4组外,其余各给药组的肿瘤体积均较dmba组小,差异显著。说明zsp-1、zsp-2给药组均具有抗肿瘤作用。
表2肿瘤发生情况
与dmba组相比,p<0.05,anova分析;*与dmba组相比,p<0.01,anova分析c:组织病理学观察
he染色(图8)可见正常地鼠颊囊黏膜为4-6层细胞组成的角化复层鳞状上皮,基底层细胞为单层立方形,上皮和肌层之间为疏松结缔组织,可见少量血管及小涎腺。实验组经dmba处理后,颊囊黏膜上皮都出现了不同程度增生,部分出现鳞状细胞癌。统计(表3)发现各给药组病理评分均低于dmba组,其中zsp-1,2组与dmba组结构特征相比有非常显著差异,zsp-2组与dmba细胞学特征相比有非常显著差异。说明zsp-1组、zsp-2组、zsp-4组均具有抗肿瘤作用。以去除有毒成分的zsp-2组为优。
表3he染色病理评分(分)
*与dmba组比较,p<0.01,秩和检验
d:免疫组化染色结果
取zsp-1,2,4组和dmba组石蜡切片行免疫组化染色。brdu阳性反应定位于细胞核,正常黏膜上皮仅在基底层有个别细胞表达;异常增生上皮除基底细胞外,棘层细胞也可见阳性表达,其表达量伴随异常增生严重程度加重而增多;癌巢内阳性表达普遍超过了细胞总数的1/3。统计(表4)各组异常增生状态黏膜上皮中brdu表达情况,发现各给药组阳性细胞数均显著少于dmba组,zsp-4组阳性细胞数略多于zsp-1,2组。说明各给药组均能够降低异常增生上皮中的细胞增殖指数,但zsp-4作用稍低于其余给药组。(图9)
正常黏膜微血管数量较少,从异常增生黏膜到鳞癌发展过程中,微血管密度逐渐增高,癌巢内可见微血管的大量增生。统计(表4)发现,各给药组异常增生状态黏膜中cd31表达均显著低于dmba组,zsp-4组阳性表达稍高于zsp-2,3组。说明各给药组均能够降低异常增生上皮中的微血管密度,但zsp-4作用稍低于其余给药组。(图10)
表4黏膜异常增生部位免疫组化染色阳性结果统计
*与dmba组比较,p<0.01,秩和检验;#与dmba组比较,p<0.05,秩和检验;##与zsp-4组比较,p<0.05,anova分析
综上,通过不同制备工艺获得的zsp各组均具有抗癌作用,其中zsp-2与对比例组zsp-1具有相同的治疗和预防癌症的作用,zsp-4的抗癌活性总体较对照组zsp-1稍弱。
实验例3细胞毒活性
实验方法
hcc94细胞株在含10%新生牛血清的rpmi1640培养液中,于37℃、5%co2的co2培养箱内培养至对数生长期。收集对数生长期的hcc94细胞,以1×104个细胞/孔接种于96孔板,常规贴壁培养24h后,实验组分别加入2μl待测化合物(少量dmso助溶,dmso终浓度0.2%),阴性对照组和空白组分别加入等体积dmso和培养液。培养72h后,每孔加入20μlmtt,继续培育4h。然后弃去培养液,每孔滴加150μldmso,37℃振荡10min,使结晶充分溶解,酶标仪在波长490nm处测定各孔吸光度值。计算ic50值。
实验结果
由(表5)可知:zsp-2、zsp-3、zsp-5、zsp-6组对人子宫高分化鳞癌hcc94较其他各组有较好的细胞毒活性。
表5细胞毒活性(hcc94,人子宫高分化鳞癌)
n.a.:未测出
实验例4体内毒性
实验方法
6周龄雄性金黄地鼠40只,体重100-120g,spf级,购自北京斯贝福公司。实验期间饲养于spf级动物饲养室,12h明/暗,标准饮食饮水。动物平均随机分为4组:正常对照组,zsp-1组、zsp-2组、zsp-4组。按照相同的处方量计算给药剂量,五组分别给予蒸馏水、zsp-1水溶液(1.776g/kg)、zsp-2水溶液(1.575g/kg)、zsp-4水溶液(1.562g/kg)灌胃给药,持续12周。处死部分动物,剩余动物停药至16周末处死。实验期间观察动物行为表现,每周记录体重,每两周采血做血生化检测(alt,ast,γ-gt,alp,ldh,bun,crea,ua)。
动物处死后立即摘取完整肝脏和肾脏精密称重,计算肝肾脏器系数。部分组织-80℃冻存,部分10%福尔马林溶液固定,进行he染色,显微镜下进行组织病理学观察。
取部分新鲜肝肾组织,用0.9%氯化钠溶液制备10%组织匀浆,按试剂盒操作步骤检测gsh、mda、sod、cat含量。
实验结果:
a:一般情况与生化检测
由图5的体重结果可知:各组动物一般情况良好。1-8周各组体重逐渐上升,第9周起正常对照组体重趋于平稳,其余各给药组仍持续上升。
表612周末肝功能指标检测(u/l)
*与各给药组比较,p<0.01,anova分析
表7停药至16周末肝功能指标检测(u/l)
#与正常对照组比较,p<0.05;*与其余各组比较,p<0.01,anova分析
每两周检测alt,ast,γ-gt,alp,ldh。由上表的肝功能指标检测结果可知,在第12周末(表6),各给药组alp值均高于正常对照组(p<0.01)。其余各时间点,各指标组间均未出现差异。说明在给药期间,zsp各组仍有一定的肝毒性。
但停药后,在第16周的结果(表7)中,zsp-1组的ast明显升高。该现象与临床中出现严重肝损伤的病人表现一致,即在发现肝损伤立即停药并给予保肝治疗后,也不能延缓肝损伤的持续加重。这说明对比例zsp-1能导致蓄积性的不可逆肝损伤。而zsp-2和zsp-4致的肝损伤停药后可较快恢复。说明去除毒性成分得到的zsp-2和去除毒性药材得到的zsp-4的肝毒性小于原制备方法组,不会导致蓄积性的严重肝损伤。
表812周末肾功能指标检测(u/l)
*与其余各组比较,p<0.01,anova分析
表9停药至16周末肾功能指标检测(u/l)
p>0.05,anova分析
每两周检测bun,crea,ua,由表8和表9的肾功能指标检测结果可知,在第12周末,zsp-1组ua值高于其余各组(p<0.01),其余各组与正常对照组的各指标无显著性差异,说明采用改良制备方法制备的样品肾毒性低于原方法。第16周末,zsp-1的ua指标恢复正常。
b:脏器指数及组织病理学观察
表1012周末及16周末脏器指数(%)
*与正常对照组比较,p<0.05,anova分析
12周末处死动物中,由表10可知:各给药组肝脏指数均大于正常对照组(p<0.05),给药组间无明显差异。停药4周后,组间差异消除,说明各给药组恢复正常。肾脏指数12周末及16周末均未出现差异。
12周肝脏病理显示(图11),各给药组均出现不同程度肝细胞空泡变形,zsp-1,2,4组分别有2/6、1/6、3/6只动物出现中性粒细胞和淋巴细胞浸润,zsp-2组出现肝脏损伤的动物最少,且仅存在空泡变性,无炎细胞浸润灶,说明zsp-2组的肝损伤毒性明显低于其余各组。停药至16周末后(图12)各组未见明显异常。
12周肾脏病理(图13)未见明显异常。
c:肝肾组织氧化损伤指标
12周末测定肝脏及肾脏中gsh、mda、sod、cat含量,结果见表11。发现zsp-1组肝脏中mda含量高于正常对照组,zsp-2组和zsp-4组mda含量较zsp-1组明显降低(p<0.05)。说明原处方用水提取后,能引起肝脏氧化损伤,而通过改良制备方法去除毒性成分后(zsp-2),或者去除两味毒性药材(zsp-4)后,可减少这种氧化损伤。
肾脏组织中(表12),zsp-1组mda值高于正常对照组和zsp-2组(p<0.05)。与此同时,zsp-1组、zsp-4组肾脏组织中gsh值低于正常对照组和zsp-2组(p<0.05)。zsp-2组与正常对照组间各指标均未出现差异。说明zsp-2组优于其他各组。
表1112周末肝脏氧化损伤指标
*与zsp-1组比较,p<0.01,#与zsp-1组比较,p<0.05,anova分析
表1212周末肾脏氧化损伤指标
##与zsp-1,4组比较,p<0.05;#与zsp-1组比较,p<0.05,anova分析
综上,通过不同的组方及制备工艺获得的zsp各组中,以去除毒性部位的工艺制备的样品(zsp-2)肝肾毒性最小,去除两味毒性药材后制备的样品(zsp-4)次之。
参考文献
cho,t.,uetrecht,j.,2017.howreactivemetabolitesinduceanimmuneresponsethatsometimesleadstoanidiosyncraticdrugreaction.chemicalresearchintoxicology30,295-314.
lee,w.-j.,kim,h.-w.,lee,h.-y.,son,c.-g.,2015.systematicreviewonherb-inducedliverinjuryinkorea.foodchem.toxicol.84,47-54.
li,c.,lin,d.,gao,h.,hua,h.,peng,y.,zheng,j.,2015.n-acetyllysine/glutathione-derivedpyrrolesaspotentialexvivobiomarkersofbioactivatedfuran-containingcompounds.chemicalresearchintoxicology28,384-393.
li,w.,lin,d.,gao,h.,xu,y.,meng,d.,smith,c.v.,peng,y.,zheng,j.,2016.metabolicactivationoffuranmoietymakesdiosbulbinbhepatotoxic.arch.toxicol.90,863-872.
lin,d.,li,c.,peng,y.,gao,h.,zheng,j.,2014.cytochromep450-mediatedmetabolicactivationofdiosbulbinb.drugmetab.dispos.42,1727-1736,1710pp.
reibelj,galen,hillej,etal.oralpotentiallymalignantdisordersandoralepithelialdysplasia.in:el-naggarak,chanjkc,grandisjr,takatat,slootwegpj,eds.whoclassificationoftumoursoftheheadandneck.4thed.lyon,france:iarcpress;2017.
付永艳,周欣,候茂君,高鸿雁,1998.纯中药防癌制剂──增生平片.中草药,138.
黄奕雪,郭玉明,周永峰,章从恩,景静,刘士敬,张娜娜,宋经元,肖小河,王伽伯,2017.基于整合证据链的白鲜皮粉末致肝损伤病例实验研究.中国中药杂志,600-606.
刘晓东,闻炜,1999.与黄药子有关的严重肝损害1例.中西医结合肝病杂志,20.
张俊忠,2007.增生平片致肝损害.药物不良反应杂志,215。
- 还没有人留言评论。精彩留言会获得点赞!