一种叶酸靶向修饰共载盐酸阿霉素和藤黄酸纳米结构脂质载体制剂及其制备方法与流程
本发明涉及制药技术领域,尤其涉及一种叶酸靶向修饰共载盐酸阿霉素和藤黄酸纳米结构脂质载体制剂及其制备方法。
背景技术
据美国癌症协会(acs)最近公布的2017美国癌症年度报告中指出,对女性而言,乳腺癌、肺癌与结直肠癌将成为2017年最为常见的三种癌症,而乳腺癌将占美国女性新发癌症病例的30%。现阶段临床上治疗乳腺癌以化学疗法为主,以靶向治疗、内分泌治疗及免疫治疗等手段配合来降低乳腺癌切除术后肿瘤的转移及复发,提高患者的生存率。然而,常用化疗药物如抗生素阿霉素、柔红霉素,抗代谢药物甲氨蝶呤、5-氟尿嘧啶,抗肿瘤动植物成分紫杉醇、羟基喜树碱等,虽然具有显著的抗肿瘤活性,但由于对肿瘤细胞缺乏特异选择性,导致肿瘤靶向性不明显,在杀伤肿瘤细胞的同时,对机体正常组织器官造成不可逆损害,使人体免疫力降低,因此难以取得理想的治疗效果。另一方面,在临床治疗过程中,由于长期使用化疗药物而产生的肿瘤多药耐药性(multidrugresistance,mdr),也是化疗失败的主要原因之一。
因此,实现药物靶向输送,降低药物毒副作用和克服抗肿瘤药物多药耐药性是乳腺癌患者化疗疗效及预后的关键。
由于肿瘤病灶组织细胞的高度异质性,仅通过基于epr的被动靶向不足以控制药物的体内分布及靶向治疗,因此,通过主动靶向使载体聚集到在靶区并释放药物是研究者们的共同目标。
技术实现要素:
本发明的目的在于通过主动靶向使载体聚集到在靶区并释放药物,具体地将盐酸阿霉素和藤黄酸共载于纳米结构脂质载体中,连接叶酸靶向载体,制备成叶酸靶向修饰的纳米结构脂质载体。
为实现上述目的,本发明采用的技术方案是:
第一方面,本发明提供了一种叶酸靶向修饰共载盐酸阿霉素和藤黄酸纳米结构脂质载体制剂,包括以下组分:
优选地,所述盐酸阿霉素的重量份为0.05-0.5份。
优选地,所述藤黄酸的重量份为:0.05-0.5份。
优选地,所述磷脂-聚乙二醇-叶酸的重量份为0.01-0.48份。
优选地,所述固体脂质为硬脂酸、山嵛酸、山嵛酸甘油酯、单硬脂酸甘油酯、甘油棕榈酸硬脂酸酯、豆蔻酸甘油酯、单棕榈酸甘油酯和月桂酸甘油酯中的一种或多种。
优选地,所述液体脂质为辛酸癸酸聚乙二醇甘油酯、辛酸癸酸甘油三酯、棕榈酸异丙酯、肉豆蔻酸异丙酯、大豆油和油酸中的一种或多种。
优选地,所述脂溶性乳化剂为大豆卵磷脂和/或合成磷脂。
优选地,所述水溶性乳化剂为泊洛沙姆、聚氧乙烯脂肪醇醚、聚氧乙烯硬脂酸酯、胆酸钠和脱氧胆酸钠中的一种或多种。
第二方面,本发明提供了一种叶酸靶向修饰共载盐酸阿霉素和藤黄酸纳米结构脂质载体制剂的制备方法,所述制备方法用于制备如第一方面所述的制剂,包括以下步骤:
将盐酸阿霉素溶解到去离子水中,形成第一水溶液;
将水溶性乳化剂溶解到去离子水中,形成第二水溶液;
将所述第一溶液和所述第二溶液混合,构成水相;
将藤黄酸溶解到第一有机溶剂中,然后加入脂溶性乳化剂,形成第一有机溶液;
将磷脂-聚乙二醇-叶酸溶于第二有机溶剂中,然后加入到所述第一有机溶液中,形成第二有机溶液;
将固体脂质和液体脂质溶解到第三有机溶剂中,形成第三有机溶液;
将所述第二有机溶液和所述第三有机溶液,构成油相;
在搅拌条件下,将所述油相滴加到所述水相中,然后过滤,得到所需盐酸阿霉素和藤黄酸纳米结构脂质载体制剂。
优选地,所述第一有机溶剂、所述第二有机溶剂和所述第三有机溶剂分别为:无水乙醇、二甲基亚砜或氯仿中的一种。
与现有技术相比,本发明的有益效果体现在:
本发明制得的纳米制剂粒径较小、分布均匀、稳定性好、包封率较高,改善了藤黄酸的水不溶性,延长药物的滞留时间,具有较好的主动靶向性,两药协同发挥疗效,增强抗肿瘤活性,减少化疗药物用量,提高其生物利用度,同时逆转盐酸阿霉素产生的多药耐药性。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明提供的制剂的制备方法流程示意图;
图2为纳米结构脂质载体粒径测定结果(n=3);
图3为纳米结构脂质载体电位测定结果(n=3);
图4为不同浓度纳米结构脂质载体对人乳腺癌细胞mda-mb-231抗肿瘤活性的影响(mean±sd,n=6)(*p<0.05versuscontrol;**p<0.01versuscontrol);
图5为不同浓度纳米结构脂质载体对人乳腺癌阿霉素耐药细胞mda-mb-231/adr抗肿瘤活性的影响(mean±sd,n=6)(*p<0.05versuscontrol;**p<0.01versuscontrol);
图6为纳米结构脂质载体对人乳腺癌细胞mba-md-231和人乳腺癌阿霉素耐药细胞mba-md-231/adr细胞凋亡率(mean±sd,n=3)(**p<0.01versuscontrol;#p<0.05;##p<0.01versussl-dox/ga;&p<0.05versusnlc-dox/ga);
图7为dir标记的纳米结构脂质载体在荷瘤裸鼠体内的生物分布;
图8为24h荷瘤裸鼠离体的主要脏器及肿瘤组织的荧光分布;
图9为给药后balb/c-nu裸鼠体重-时间变化图(mean±sd,n=6);
图10为纳米结构脂质载体给药后肿瘤生长曲线(mean±sd,n=6);
图11为纳米结构脂质结构载体给药后裸鼠瘤重(mean±sd,n=6)(*p<0.05vs.ns;**p<0.01vs.ns;#p<0.05vs.sl-dox/ga;&p<0.05vs.nlc-dox/ga);
图12为纳米结构脂质载体对主要脏器及肿瘤组织的病理学分析(×10)。
具体实施方式
下面结合实施例,对本发明进行进一步的详细说明,但并不意于限制本发明的保护范围。
下面首先介绍本本发明可能利用到的一些物质或技术用语的中文名称及其对应的英文缩写对照表:
表1英文缩写词表
实施例1
本发明提供了一种叶酸靶向修饰共载盐酸阿霉素和藤黄酸纳米结构脂质载体制剂,包括以下组分:
优选地,所述盐酸阿霉素的重量份为0.05-0.5份。
优选地,所述藤黄酸的重量份为:0.05-0.5份。
优选地,所述磷脂-聚乙二醇-叶酸的重量份为0.01-0.48份。
优选地,所述固体脂质为硬脂酸、山嵛酸、山嵛酸甘油酯、单硬脂酸甘油酯、甘油棕榈酸硬脂酸酯、豆蔻酸甘油酯、单棕榈酸甘油酯和月桂酸甘油酯中的一种或多种。
优选地,所述液体脂质为辛酸癸酸聚乙二醇甘油酯、辛酸癸酸甘油三酯、棕榈酸异丙酯、肉豆蔻酸异丙酯、大豆油和油酸中的一种或多种。
优选地,所述脂溶性乳化剂为大豆卵磷脂和/或合成磷脂。
优选地,所述水溶性乳化剂为泊洛沙姆、聚氧乙烯脂肪醇醚、聚氧乙烯硬脂酸酯、胆酸钠和脱氧胆酸钠中的一种或多种。
针对该制剂提供了其制备方法,如图1所示,所述制备方法包括:
s100,将盐酸阿霉素溶解到去离子水中,形成第一水溶液。
为加快溶解,可在水浴加热中进行该过程。
s110,将水溶性乳化剂溶解到去离子水中,形成第二水溶液。
s120,将所述第一溶液和所述第二溶液混合,构成水相。
s130,将藤黄酸溶解到第一有机溶剂中,然后加入脂溶性乳化剂,形成第一有机溶液。
s140,将磷脂-聚乙二醇-叶酸溶于第二有机溶剂中,然后加入到所述第一有机溶液中,形成第二有机溶液。
需要说明的是,此处也可以选择叶酸,然后对叶酸进行处理,将叶酸接枝到磷脂-聚乙二醇上,获得磷脂-聚乙二醇-叶酸后,再使用。
s150,将固体脂质和液体脂质溶解到第三有机溶剂中,形成第三有机溶液。
s160,将所述第二有机溶液和所述第三有机溶液,构成油相。
s170,在搅拌条件下,将所述油相滴加到所述水相中,然后过滤,得到所需盐酸阿霉素和藤黄酸纳米结构脂质载体制剂。
在一个示例中,在水浴中滴加,待体系澄清时,降低搅拌速度,继续搅拌至总体积的1/3,然后冰浴,最后过滤,得到所需制剂。
需要说明的是,所述第一有机溶剂、所述第二有机溶剂和所述第三有机溶剂分别为:无水乙醇、二甲基亚砜或氯仿中的一种。第一有机溶剂、第二有机溶剂和第三有机溶剂三种有机溶剂不能是同一种。
本发明制得的纳米制剂粒径较小、分布均匀、稳定性好、包封率较高,改善了藤黄酸的水不溶性,延长药物的滞留时间,具有较好的主动靶向性,两药协同发挥疗效,增强抗肿瘤活性,减少化疗药物用量,提高其生物利用度,同时逆转盐酸阿霉素产生的多药耐药性。
下面实施例2-11依据实施例1提供的制备方法,制备制剂。
实施例2
精密称取一定量的盐酸阿霉素,加2ml去离子水溶解,并称取2重量份的泊洛沙姆加入到9ml的去离子水中,水浴74℃溶解。在磁力搅拌下,将0.01重量份溶解完全的盐酸阿霉素水溶液加入到泊洛沙姆中,混合均匀,共同构成水相。称取0.01重量份的藤黄酸溶于2ml的无水乙醇中,溶解完全后,加入0.1重量份的大豆卵磷脂,使二者混合均匀;称取0.01重量份的dspe-peg-fa溶于dmso中,同时作为有机相加入制剂;另外称取0.1重量份的硬脂酸作为固体脂质、0.1重量份的棕榈酸异丙酯作为液体脂质加1ml氯仿使之溶解,并将乙醇溶液与氯仿溶液合并,混匀,构成油相。保持水相在74℃的水浴中磁力搅拌,随之将混合好的油相滴入到水相中。待体系澄清时,降低转速,继续搅拌至总体积的1/3,冰水浴2h。最后经0.22μm微孔滤膜过滤,得到叶酸靶向修饰的盐酸阿霉素/藤黄酸纳米结构脂质载体。
实施例3-11
实施例3-11按照表2的组分进行制备制剂。
表2制剂各组分及其重量份
为了进一步了解药物,发明人还对本发明制备的制剂进行了抗肿瘤活性及肿瘤靶向性等研究,测试方法与评价如下:
1.纳米结构脂质载体粒径、多分散系数(pdi)和zeta电位测定
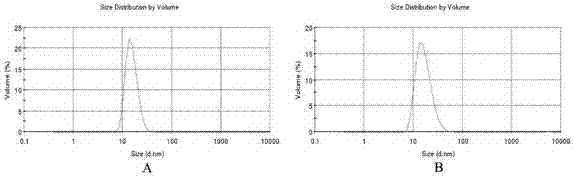
取制得的盐酸阿霉素/藤黄酸纳米结构脂质载体和叶酸靶向修饰的盐酸阿霉素/藤黄酸纳米脂质载体溶液适量,经去离子水稀释到适宜浓度后,置于激光粒径测定仪内,在25℃下测定粒径大小及分布情况以及zeta电位值。结果见表3、图2和图3,其中,图2和图3中的a为nlc-dox/ga;b为fa-nlc-dox/ga为。由结果可知,盐酸阿霉素/藤黄酸纳米结构脂质载体的粒径为(22.65±1.08)nm,pdi为(0.312±0.05),电位为(-3.05±0.17)mv;叶酸靶向修饰的盐酸阿霉素/藤黄酸纳米结构脂质载体的粒径为(22.87±4.99)nm,pdi为(0.257±0.09),电位为(-2.55±0.55)mv;可见制备的纳米载体粒径小,分散均匀,呈正态分布,并具有较好的稳定性。
表3粒径大小及分布情况以及zeta电位值(mean±sd,n=3)
2.纳米结构脂质载体对细胞抗肿瘤活性的影响
取1×104/孔浓度接种于96孔板中,细胞悬液每孔100μl,在37℃,5%co2条件下培养24h后,将一系列浓度的sl-dox、sl-dox/ga、nlc-dox、nlc-dox/ga和fa-nlc-dox/ga分别加入到mda-mb-231和mda-mb-231/adr细胞的细胞培养孔,使其终浓度分别2.5、1、0.5、0.25、0.1、0.05、0.01μg·ml-1和10、5、2.5、1、0.5、0.25、0.1μg·ml-1,设置空白孔(只含培养基)和对照孔(含培养基和细胞,不含药物),给药后于细胞培养箱中孵育24h,cck-8法检测肿瘤细胞存活率,计算各组ic50值。图4中显示的是sl-dox、sl-dox/ga、nlc-dox、nlc-dox/ga、fa-nlc-dox/ga处理24h后,对mda-mb-231细胞抗肿瘤活性的影响。从图中可以看出,各实验组随着药物浓度的增大,细胞活力不断降低,与浓度呈现负相关趋势。载药纳米载体抑制肿瘤作用大小为nlc-dox<nlc-dox/ga<fa-nlc-dox/ga,说明dox和ga共载于纳米结构脂质载体后,对细胞的增殖有较显著的抑制作用,提示可能起到了两药协同作用,制备成脂质载体后增强了细胞毒性。其中,fa-dox-ga-nlc表现出最强的抑制效果,说明制备成叶酸靶向修饰的纳米结构脂质载体后,抗mda-mb-231肿瘤细胞的活性明显增强。从图5中可以看出,对于mda-mb-231/adr细胞而言,sl-dox、sl-dox/ga和nlc-dox随着药物浓度的增大,细胞的存活率变化不大,说明含有dox的溶液或者纳米结构脂质载体在mda-mb-231/adr中产生了耐药性。nlc-dox/ga和fa-nlc-dox/ga对耐药细胞的作用趋势与mda-mb-231相一致,均表现出显著的细胞毒性作用,且随着浓度的增大,细胞活力不断降低,说明共载dox和ga的纳米结构脂质载体对耐药细胞同样具有浓度依赖性,并且可以逆转阿霉素的多药耐药性。
3.纳米结构脂质载体逆转细胞的耐药作用
取1×104/孔浓度接种于96孔板中,细胞悬液每孔100μl,在37℃,5%co2条件下培养24h后,将一系列浓度的sl-dox、sl-dox/ga、nlc-dox、nlc-dox/ga和fa-nlc-dox/ga分别加入到mda-mb-231和mda-mb-231/adr细胞的细胞培养孔,使其终浓度分别2.5、1、0.5、0.25、0.1、0.05、0.01μg·ml-1和10、5、2.5、1、0.5、0.25、0.1μg·ml-1,设置空白孔(只含培养基)和对照孔(含培养基和细胞,不含药物),给药后于细胞培养箱中孵育24h,采用cck-8法检测肿瘤细胞存活率。根据公式计算逆转倍数(ri,逆转指数)。
逆转倍数(ri)=ic50(dox)/ic50(dox+ga)
根据公式分别计算sl-dox、sl-dox/ga、nlc-dox、nlc-dox/ga和fa-nlc-dox/ga对mda-mb-231细胞的ic50和逆转倍数ri,考察纳米结构脂质载体逆转mda-mb-231细胞的耐药作用。
表4各组溶液对mda-mb-231的抑制作用(mean±sd,n=6)
表5各组纳米结构脂质载体对mda-mb-231的抑制作用(mean±sd,n=6)
由表4、表5可知,对于mda-mb-231细胞来说,sl-dox和sl-dox/ga的ic50分别为3.117和8.835μg·ml-1,nlc-dox、nlc-dox/ga和fa-nlc-dox/ga的ic50分别为0.253、0.2251和0.0935μg·ml-1,纳米结构脂质载体的ic50值和游离溶液相比明显降低,说明药物包载于nlc中,对细胞的杀伤作用明显强于游离药物,其中,nlc-dox/ga的ic50值小于nlc-dox,而fa-nlc-dox/ga的ic50值最低,说明共载盐酸阿霉素和藤黄酸的纳米结构脂质载体对细胞的增殖具有抑制作用,叶酸靶向修饰后显著增强了对细胞的杀伤能力。
根据逆转倍数ri的公式计算各组的逆转倍数:
sl-dox/ga对mda-mb-231细胞的逆转倍数ri=3.117/8.835=0.35;nlc-dox/ga对mda-mb-231细胞的逆转倍数ri=0.253/0.2251=1.12;fa-nlc-dox/ga对mda-mb-231细胞的逆转倍数ri=0.253/0.0935=2.70。由结果可知,将dox和ga包载于纳米载体后可以显著逆转盐酸阿霉素的多药耐药性,叶酸靶向修饰比未修饰逆转效果增强,说明叶酸靶向修饰后提高了纳米结构脂质载体的逆转多药耐药性作用。
表6、图7显示了sl-dox、sl-dox/ga、nlc-dox、nlc-dox/ga和fa-nlc-dox/ga对mda-mb-231/adr细胞的ic50。
表6各组溶液对mda-mb-231/adr的抑制作用(mean±sd,n=6)
表7各组纳米结构脂质载体对mda-mb-231/adr的抑制作用(mean±sd,n=6)
对于mda-mb-231/adr细胞,sl-dox和sl-dox/ga的ic50分别为56.02和36.20μg·ml-1,nlc-dox、nlc-dox/ga和fa-nlc-dox/ga的ic50分别为24.91、1.399和0.4685μg·ml-1。与sl-dox相比,sl-dox/ga和nlc-dox的ic50均有所降低,说明盐酸阿霉素和藤黄酸联用增加了mda-mb-231/adr细胞的抑制率,盐酸阿霉素制备成纳米结构脂质载体后可以降低耐药细胞的繁殖能力。然而,nlc-dox/ga和fa-nlc-dox/ga的ic50值较其他实验组明显降低,说明加入藤黄酸后的纳米结构脂质载体对耐药细胞的毒性明显高于盐酸阿霉素溶液和盐酸阿霉素纳米制剂组,叶酸靶向修饰后同样显著增强了纳米结构脂质载体对细胞的杀伤能力,此结果与mda-mb-231细胞一致。
根据逆转倍数ri的公式计算各组的逆转倍数:
sl-dox/ga对mda-mb-231/adr细胞的逆转倍数ri=56.02/36.20=1.55;nlc-dox/ga对mda-mb-231/adr细胞的逆转倍数ri=24.91/1.399=17.81;fa-nlc-dox/ga对mda-mb-231/adr细胞的逆转倍数ri=24.91/0.4685=53.17,nlc-dox/ga和fa-nlc-dox/ga对耐药肿瘤细胞的逆转倍数分别是敏感肿瘤细胞的15.90倍和19.69倍,提示包载盐酸阿霉素和藤黄酸的纳米结构脂质载体可以逆转盐酸阿霉素在耐药细胞中的多药耐药性,叶酸靶向修饰后的纳米结构脂质载体显著增加逆转作用。
4.纳米结构脂质载体对细胞调亡的影响
选择对数生长期的细胞,用0.25%胰酶制备成单细胞悬液,调整细胞密度为1×106/ml,接种到96孔培养皿中,每孔接种100μl,分别采用药物总浓度为0.1μg·ml-1和0.5μg·ml-1的sl-dox/ga、nlc-dox/ga和fa-nlc-dox/ga与mda-mb-231和mda-mb-231/adr细胞共同孵育24h,每孔终体积为100μl,加入培养基作为对照组,设3个复孔。采用流式仪(bdfacsverse,usa)上机检测细胞凋亡。
本实验以早期调亡细胞(lr)和中晚期凋亡及死亡细胞(ur)调亡率的总和作为细胞调亡率的数值。由细胞凋亡率的结果可知(图6),对于mda-mb-231细胞,sldox/ga组、nlcdox/ga组和fa-nlcdox/ga组的凋亡率分别为(34.83±2.15)%、(79.80±4.16)%、(83.27±3.73)%,和对照组(0.87±0.90)%相比,具有极显著差异(p<0.01)。在mda-mb-231/adr细胞中,对照组的凋亡率为(3.63±2.45)%,sl-dox/ga组的凋亡率为(10.10±2.91)%,两者无统计学差异,此结果说明了耐药细胞对于sl-dox/ga具有一定的耐药性。对于nlc-dox/ga组和fa-nlc-dox/ga组,凋亡率分别为(41.67±5.03)%和(71.40±6.09)%,与对照组相比,均具有极显著差异(p<0.01),提示两药共载制备的纳米结构脂质载体可以显著增加肿瘤敏感细胞和耐药细胞的凋亡,且叶酸靶向修饰后对细胞的凋亡效果更佳明显。
5.纳米结构脂质载体体内靶向性研究
将6只荷瘤裸鼠随机分为三组,分别为dir标记的溶液组(sl-dir)、dir标记的纳米结构脂质载体组(nlc-dir)和叶酸靶向修饰的dir标记的纳米结构脂质载体组(fa-nlc-dir),以200μl/只的剂量尾静脉注射给药。分别于给药后1h、2h、4h、8h、24h五个时间点麻醉裸鼠后,将荷瘤裸鼠置于活体成像系统内观察,采集数据和图片。检测条件为:激发波长748nm,发射波长780nm,曝光时间为3s。注射药物24h后,将荷瘤裸鼠拉颈处死,进行解剖,分别取心、肝、脾、肺、肾、肿瘤等组织,置于小动物活体成像系统中进行成像,通过软件分析各组织的荧光强度,确定载体在各组织器官内的分布情况。
结果见图7和图8。其中,图8中的a为sl-dir;b为nlc-dir;c为fa-nlc-dir。纳米结构脂质载体可以延长药物作用时间,增加药物在肿瘤的积累,经叶酸靶向修饰后的纳米结构脂质载体增强了药物在肿瘤部位的浓度,说明了fa-nlc-dir的肿瘤靶向性持续时间较长,可以起到提高治疗效果的作用。
6.纳米结构脂质载体内药效学研究
通过构建乳腺癌细胞裸鼠移植瘤模型,尾静脉注射药物,考察共载盐酸阿霉素和藤黄酸的纳米结构脂质载体在荷瘤裸鼠抗肿瘤增长的作用,通过抑制肿瘤作用来评价其体内抗肿瘤效果,采用he染色病理学观察考察纳米结构脂质载体应用的安全性。结果见图9、图10、图11和图12。其中,图12中的a为ns;b为sl-dox;c为sl-dox/ga;d为nlc-dox/ga;e为fa-nlc-dox/ga。由结果可知,纳米结构脂质载体可以减轻dox对荷瘤裸鼠的毒副作用,肿瘤体积和瘤重均小于对照组,说明纳米结构脂质载体可以抑制肿瘤的生长,具有显著的体内抗肿瘤作用。叶酸靶向修饰纳米结构脂质载体后提高了药物的主动靶向性,增加了肿瘤的治疗效果。病理学观察结果显示纳米制剂对机体组织和器官产生的毒性较低,体现了纳米脂质载体的安全性。
本发明中的纳米结构脂质载体(nanostructuredlipidcarriers,nlc)作为脂质纳米粒具有特殊的结构与组成,既可以作为脂溶性药物的载体,也可以包载水溶性药物。它是在固体脂质的基础上,加入一定比例的液体脂质或混合脂质共同作为药物载体材料。加入的液体脂质可扰乱固体脂质规则的晶格结构,从而改善药物的容量空间,提高载药能力,降低储存过程中药物的泄漏率。
利用本发明方法制得的纳米制剂改善了藤黄酸的水不溶性,延长药物的滞留时间,具有较好的主动靶向性,两药协同发挥疗效,增强抗肿瘤活性,减少化疗药物用量,提高其生物利用度,同时逆转盐酸阿霉素产生的多药耐药性。
以上所述的具体实施方式,对本发明的目的、技术方案和有益效果进行了进一步详细说明,所应理解的是,以上所述仅为本发明的具体实施方式而已,并不用于限定本发明的保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!