一种用于靶向控释药物的相变介孔硅仿生制剂及其制备方法和应用与流程
本发明涉及药物靶向控释制剂领域,具体涉及一种用于靶向控释药物的相变介孔硅仿生制剂及其制备方法和应用。
背景技术
临床上常用的药物治疗方式有口服、静注、静滴、肌注等,但是由于大部分药物都不具备靶向性,所以药物会在非目标部位累积并产生程度不同的毒副作用。目前,临床与科学界对此的解决方案大致有以下几种:(1)制备靶向生物制剂:如单克隆抗体等;(2)制备靶向载药纳米颗粒:如顺铂脂质体等;(3)制备细胞靶向载体:如中性粒细胞等。目前所采用的解决方案均是利用被动和主动靶向功能来实现药物递送的,其各有自身的优缺点,如生物制剂价格高昂、纳米颗粒制备技术复杂、细胞载体无法去除等。
其中,上述第三种解决方案,即制备细胞靶向载体,制备方法首先会合成纳米颗粒进行载药,然后选取一种能够在发病部位大量聚集且有吞噬功能的细胞作为载体,以这种细胞吞噬载药纳米颗粒,构成细胞药物靶向系统。这种系统具有高效的主动靶向效率,而且由于细胞的存在,机体内免疫系统无法识别外来抗原(纳米颗粒),从而实现了免疫逃逸的作用。但是这种方案大部分存在着几个问题:一个是无法对药物进行主动控释,另一个是无法消灭人为注射的细胞载体。
目前比较成功且理想的解决方案是应用于肿瘤光热治疗领域的细胞靶向系统。该系统所载纳米颗粒具有光热效应,其受到激光照射一段时间后,由于温度的上升会破坏细胞载体与肿瘤细胞,发挥抑瘤效果。但是这种解决方案比较致命的不足之处在于应用范围窄。首先,具有光热效应的物质不多,其次,能用光热治疗的疾病类型很少,基本为良恶性肿瘤。所以,急需一种靶向能力强,能够定点释放药物,应用范围广,组合方式灵活的药物制剂。
技术实现要素:
针对现有技术中面临的问题,本方案发明人提出一种改良的细胞药物靶向系统,实现药物定点控释且消灭外来细胞载体的同时,拥有更加广泛的疾病应用范围和灵活的药物选择。
本发明以巨噬细胞作为载体,这是一种炎症趋化性细胞,拥有强大的吞噬能力,从纳米到微米级别的颗粒都能够吞噬,而且受炎症因子的趋化,能够在炎症部位大量聚集,而很多疾病如肿瘤、炎症、自身免疫病等的发病部位均有炎性改变,大量分泌如整合素、选择素、免疫球蛋白超家族成员等炎症因子,能够吸引大量包括巨噬细胞在内的炎症细胞聚集黏附。
另外,本发明以介孔硅作为载药纳米颗粒,其具有优秀的生物相容性、很高的稳定性与强大的载药能力,且容易进行表面改性的优势。未经修饰的介孔硅颗粒对水溶性药物拥有良好的负载能力,而经过修饰改性的介孔硅颗粒能实现脂溶性药物的负载,且研究表明,其能同时负载多种药物及物质。
本发明除了在介孔硅颗粒内载药外,还载入了全氟戊烷(perfluoropentane,pfp)。pfp是科学界制备氟碳相变液滴的常用全氟化物,其受到一定强度的超声辐照时能够发生相变,从液态变为气态,具有相对较低的相变能量阈值。所以,本发明设计的这种细胞药物靶向系统由巨噬细胞吞噬同时载药和pfp的介孔硅颗粒组成,巨噬细胞能够将药物高效靶向到发病部位,然后对该部位进行超声辐照,就能使pfp发生相变,同时破坏巨噬细胞并释放出药物发挥疗效,这个系统为相变介孔硅仿生系统。
本系统除了能够达到靶向递送药物和免疫逃避作用外,能够较好地解决了药物控释与消灭外来细胞载体的问题,且能够灵活替换所载药物,并扩大此类技术的疾病应用范围,是临床未来用于降低药物全身毒副作用的一种良好候选解决方案。
综上所述,本发明一个方面提供了一种载药相变介孔硅仿生制剂,所述制剂包含巨噬细胞,该巨噬细胞吞噬了载有药物活性成分和全氟化物的中空介孔硅。
本发明的技术方案中,所述的全氟化物选自全氟戊烷。
本发明的技术方案中,所述的药物活性成分选自抗炎药物,抗肿瘤药物,心血管疾病药物,消化系统疾病药物等。
本发明的技术方案中,所述的制剂为冻干制剂。
本发明的技术方案中,所述载有药物活性成分和全氟化物的中空介孔硅通过以下方式制备:
1)十六烷基三甲基溴化铵,去离子水和无水乙醇,配成十六烷基三甲基溴化铵溶液,在搅拌的情况下逐渐加入二氧化硅溶液,然后加入氨水,再加入1,4-双(三乙氧基硅基)苯反应至完全;离心收集产物,将沉淀分散于碱性溶液中,进行刻蚀;离心收集产物,并用去离子水清洗后冷冻干燥储存,得到中空介孔硅;
2)中空介孔硅与药物活性成分的水溶液进行混合,得到载药中空介孔硅;
3)将载药中空介孔硅冷冻干燥后抽真空,注入全氟化物,得到载有药物活性成分和全氟化物的中空介孔硅。
本发明的技术方案中的巨噬细胞吞噬了载有药物活性成分和全氟化物的中空介孔硅,其制备方法为:将巨噬细胞与载有药物活性成分和全氟化物的中空介孔硅共培养后,即可获得上述巨噬细胞。
本发明获得的中空介孔硅(hmsns)为中空有序介孔有机氧化硅(hpmos)。
本发明另一个方面提供了本申请的载药相变介孔硅仿生制剂在制备治疗抗肿瘤、抗炎、心血管疾病、消化系统疾病的药物中的用途。
有益效果
(1)载药后的中空介孔硅(hpmos)为冻干粉,可以小剂量分装后长期低温储存,待需要建立相变仿生系统时再加入pfp,即配即用,避免了pfp制品保存条件苛刻的缺点。
(2)本系统同时具有炎症趋化性及hifu超声响应性,可以实现炎症部位的药物靶向递送,并应用hifu超声定点释药。
(3)本系统应用范围广,如肿瘤、自身免疫病、炎症性疾病等,发病部位具有炎性改变且能够吸引巨噬细胞聚集的疾病都能够应用。
(4)本系统的药物可进行替换,分别对应治疗不同的疾病,组合方式灵活。
附图说明
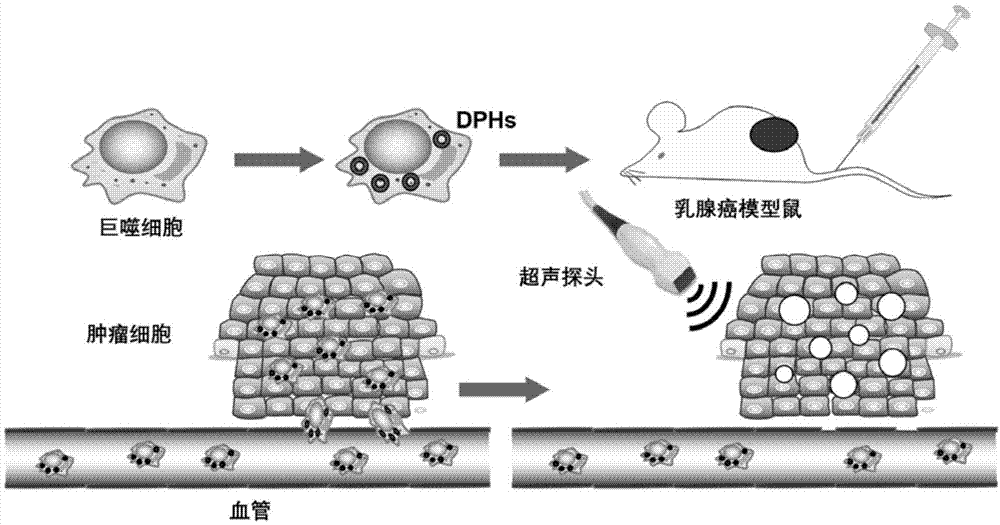
图1cell-dphs的构建与应用
巨噬细胞吞噬dphs成为cell-dphs,将cell-dphs经尾静脉注入乳腺癌模型鼠体内,cell-dphs靶向聚集于乳腺癌部位,经过hifu辐照后,dphs内的pfp发生气化破坏巨噬细胞,并释放出药物发挥治疗乳腺癌作用。
dphs:dox-pfp-hpmos。
图2hpmos、dhs及dphs的表征及体外性能测试
a.hpmos的投射电镜图:hpmos为直径约400nm的介孔中空球,均一性好;b.hpmos直径峰值分布图;c.hpmos、dhs、dphs的zeta电位分布图;d.dphs的体外药物释放曲线图。
dhs:dox-hpmos;dphs:dox-pfp-hpmos。
图3超声激发dphs相变的超声图像
将dphs置于琼脂糖模具中,利用vevo2100爆破键进行超声激励,同时使用vevo2100进行实时b模式成像。经超声激励后的dphs发生相变,产生小气泡逐渐上浮。
图44t1乳腺癌模型鼠离体器官的活体荧光成像图
吞噬有dphs的巨噬细胞(上)和没有吞噬dphs的巨噬细胞(下)均在肿瘤部位有丰富聚集,cell-dphs具有肿瘤靶向性,且dphs对巨噬细胞的靶向效率无明显影响。
图54t1乳腺癌模型鼠肿瘤切片的激光共聚焦图
大箭头:dapi标记肿瘤组织细胞核;小箭头:药物dox;dox在肿瘤部位富集。
图6cell-dphs的4t1乳腺癌模型鼠治疗实验图
a.乳腺癌生长曲线图:us+cell-dphs组肿瘤生长体积较其他组小,差异具有统计学意义(p<0.05);b.乳腺癌模型鼠体重曲线图:各组小鼠体重差异无显著性;c.乳腺癌模型鼠生存曲线图:cell-dphs和us+cell-dphs组与control、us、us+cell-phs组差异具有统计学意义(p<0.05),但cell-dphs组与us+cell-dphs组差异无统计学意义,说明cell-dphs能够降低乳腺癌模型鼠死亡率,但超声和非超声处理对死亡率的影响无差异;d.治疗终点时间各组小鼠整体图;e.治疗终点时间各组小鼠离体肿瘤大体图(对应图d);f.治疗终点时间各组小鼠离体肺部大体图(对应图d):黑色圆圈表示肺转移结节,us+cell-dphs组较其他组别的肺转移结节数少,具有抑制乳腺癌肺转移作用。
具体实施方式
实施例1载药相变介孔硅仿生制剂的制备方法
1、载药相变介孔硅仿生制剂的合成
(1)称取1.2027g十六烷基三甲基溴化铵(cetrimoniumbromide,ctab),加入20ml去离子水和10ml无水乙醇,配成0.11mol/l浓度的ctab溶液,在搅拌的情况下逐渐加入二氧化硅溶液,然后加入3ml氨水。反应5分钟后,加入3ml1,4-双(三乙氧基硅基)苯(1,4-bis(triethoxysilyl)benzene,bteb),再搅拌6h。15000rpm/min离心15分钟收集产物,将沉淀分散于0.6mol/l的na2co3溶液中,并于80℃水浴中磁性搅拌30min进行刻蚀。15000rpm/min离心15分钟收集产物,并用去离子水清洗3次后冷冻干燥储存,得到中空介孔硅(hollowperiodicmesoporousorganosilicananoparticles,hpmos)。
(2)将hpmos加入1mg/ml的阿霉素(doxorubicin,dox)水溶液中,4℃下磁性搅拌24h,12000rpm/min离心10分钟,弃上清,并用去离子水清洗2遍,得到载阿霉素的中空介孔硅dox-hpmos(dhs)。
(3)将dhs冷冻干燥后抽真空,注入适量全氟戊烷pfp,得到载阿霉素和全氟戊烷的中空介孔硅dox-pfp-hpmos(dphs)。
(4)把巨噬细胞与10μg/ml的dphs共培养1h,得到载药相变介孔硅仿生制剂(cell-dphs)。
2、载药相变介孔硅(dphs)的基本表征及体外性能检测
(1)使用透射电镜和马尔文粒径分析仪对所合成的hpmos、dhs和dphs进行表征,得到所制得hpmos的形貌特征电镜图(图2a)与三种颗粒的粒径(图2b)及电位(图2c)。结果显示hpmos为(461.7±1.96)nm的中空球型结构。
(2)为了分析dphs的释药性能,发明人对dphs进行了体外药物实验,结果显示在没有超声刺激的情况下,dox呈缓释过程,24h的药物释放率<20%(图2d)。
(3)为了证明pfp成功载入hpmos中,并且超声能激发其相变,利用vevo2100对其进行超声成像,结果显示超声能使pfp发生相变,并具备超声显像功能(图3)。
3、载药相变介孔硅制剂(cell-dphs)的基本性能检测
(1)发明人首先利用raw264.7小鼠巨噬细胞系制备了载药相变介孔硅制剂(cell-dphs),然后利用hifu超声处理cell-dphs。将所得产物进行离心,收集上清与沉淀分别与4t1小鼠乳腺癌细胞系进行共孵育3h后,进行免疫荧光标记,并用倒置荧光显微镜进行观察。结果显示,dox成功从raw264.7细胞中释放出来,并且进入4t1细胞核(图x)。
(2)发明人用dir标记raw264.7的细胞膜,将cell-dphs和raw264.7经尾静脉注入4t1乳腺癌模型鼠内,利用小动物活体成像仪对其进行成像,并于24h后取出小鼠器官进行离体成像。结果显示,cell-dphs在小鼠肿瘤部位富集,具有靶向作用,且dphs不影响其靶向效率(图4)。
(3)发明人将上述肿瘤进行冰冻切片,并进行免疫荧光标记,利用激光共聚焦显微镜对其进行观察。结果显示,dox富集于肿瘤部位(图5)。
实施例2载药相变介孔硅制剂(cell-dphs)用于乳腺癌小鼠的治疗
1、4t1乳腺癌小鼠模型的构建
(1)发明人选取balb/c裸鼠作为模型鼠,按每只鼠100万个4t1细胞的比例,将4t1细胞皮下注射入鼠右侧腋下脂肪垫内,并于3天后每日测量肿瘤体积。
(2)当肿瘤体积达150mm3时,对乳腺癌模型鼠进行分组并开始cell-dphs治疗。发明人按肿瘤体积大小和形态随机分为5组,每组6只。具体分组情况如下:对照组(control组)、超声组(us组)、超声相变组(us+cell-phs组)、载药相变组(cell-dphs组)和超声载药相变组(us+cell-dphs组)。
2、4t1乳腺癌模型鼠的治疗实验
第0、3、6天对cell-dphs组和us+cell-dphs组分别尾静脉注射100万个cell-dphs每只鼠,对us+cell-phs组尾静脉注射100万个cell-phs每只鼠,并于给药24h后对us组、us+cell-phs组和us+cell-dphs组进行hifu辐照。每2天记录一次肿瘤体积和鼠体重。结果显示,cell-dphs能够减缓乳腺癌的体积增长速度(图6a,7),对乳腺癌的生存率有一定程度的提高(图6b),对鼠的体重无明显影响(图6c)。
- 还没有人留言评论。精彩留言会获得点赞!