一种具有靶向功能仿病毒结构高分子囊泡及其制备与应用的制作方法
本发明属于高分子材料领域,涉及一种具有靶向功能仿病毒结构高分子囊泡及其制备方法,具体涉及一种由透明质酸接枝的两亲性嵌段共聚物与其他两亲性嵌段共聚物混合自组装成具有仿病毒表面突触结构的高分子囊泡及其制备方法与应用。
技术背景
恶性肿瘤是一种是危害人类生命健康的严重疾病,其防治仍依然是当今生命科学研究领域的一个难点。常规的化学疗法是一种全身性的疗法,在相关治疗手段中是首选,适用于大部分实体肿瘤或血液肿瘤。然而,已知的化疗药物仍普遍存在毒性强、对肿瘤靶向识别性差的问题,在杀死肿瘤细胞的同时也对人体正常组织细胞造成很大的伤害。长期治疗更会致使肿瘤细胞产生耐药性,对人体的毒副作用很大等缺点。因此,如何选择性地杀死肿瘤细胞而不造成机体正常组织细胞损伤成为治疗的关键问题。选择性或针对肿瘤细胞进行靶向治疗是解决此关键问题的首选途径。在自然界中,病毒是一种具有靶向性的基因载体,其主要由核酸分子和蛋白构成的外衣壳组成。病毒衣壳能屏蔽环境中的潜在破坏因素,如核酸酶、酸碱度等,具有保护基因遗传物质的功能,同时直接参与病毒的感染过程,实现对宿主细胞表面的特异性吸附。受病毒结构和功能的启示,科学家们一直在不断尝试各种人工仿病毒结构和功能的自组装聚集体用于药物控释和靶向治疗的药物载体,其中以高分子囊泡最为典型。高分子囊泡是一类由双亲性嵌段共聚物有序组合而成的中空球体,其球体的外壳膜层由双亲性分子构成,而内部亲水空腔可以用于包裹药物。高分子囊泡膜结构可分为三层:两个内外侧的亲水层和一个处于内外亲水层中间的疏水层,疏水层由于内外表面的亲水层保持稳定。通常,高分子囊泡是由单一种类的两亲性嵌段共聚物自组装而成,其囊泡表面呈“光滑”状态。而本发明通过两种及以上嵌段共聚物制备的仿病毒核衣壳及表面刺突结构的高分子囊泡是一种非常具有潜力的药物载体。高分子囊泡可通过“特洛伊木马”策略包载基因、药物,并避免其中体内循环中被免疫系统辨识、吞噬。此外,通过嵌段共聚物设计与合成,如对进行功能基团接枝修饰,可使高分子囊泡表面带有特定功能性配体从而具有对特定细胞的靶向性。
目前,同时具有针对肿瘤细胞靶向功能以及仿病毒结构高分子囊泡还未见有公开报道。
技术实现要素:
基于获得结构与功能上仿病毒结构,同时赋予高分子囊泡靶向肿瘤细胞功能的需求,本发明的目的在于提供一种含有透明质酸接枝嵌段共聚物构建的具有肿瘤细胞靶向功能及仿病毒结构的高分子囊泡的制备方法。
本发明的另一目的在于提供由上述方法得到的具有靶向功能仿病毒结构高分子囊泡。
本发明的目的通过以下技术方案实现:
一种具有靶向功能仿病毒结构高分子囊泡的制备方法,具体包括以下步骤:
s1:将含有氨基的透明质酸(ha)与含有羧基的疏水性聚合物进行酰胺反应,得到透明质酸(ha)接枝的两亲性嵌段共聚物;所述含有羧基的疏水性聚合物在反应之前需进行羧基活化处理;
s2:将透明质酸ha接枝的两亲性嵌段共聚物与其他两亲性嵌段共聚物通过溶剂交换法或水合法制备成具有靶向功能仿病毒结构高分子囊泡。
步骤s1中所述含有氨基的透明质酸是通过二元胺与透明质酸反应得到。所述二元胺的结构为h2n-r-nh2,r为有机基团;所述二元胺优选为脂肪二元胺,更优选为丁二胺。
步骤s1中所述含有氨基的透明质酸的具体制备步骤为:
将透明质酸溶于缓冲溶液中,加入二元胺,恒温搅拌,加入还原剂反应,反应完成后透析,冻干,得到端氨基化透明质酸即含有氨基的透明质酸。
所述恒温搅拌的温度为40~60℃,优选为50℃;所述恒温搅拌的时间为20~36h,优选为24h;
所述二元胺优选为1,4-丁二胺;所述还原剂为硼氰化钠;
所述反应的时间为2~4天,优选为3天,所述还原剂分2~4次加入;
所述缓冲溶液优选为醋酸盐缓冲液。
所述透明质酸ha和二元胺摩尔比为1:(1~5),还原剂与透明质酸质量比为(1~3):5。
步骤s1中所述含有羧基的疏水性聚合物在反应之前需进行羧基活化处理,活化处理具体为:在有机溶剂中,采用活化剂将含有羧基的疏水性聚合物进行羧基活化,得到羧基活化的产物;所述活化剂为1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)与n-羟基琥珀酰亚胺(nhs)。
所述羧基活化的时间为10~36h,优选为24h。
所述含有羧基的疏水性聚合物、edc与nhs的摩尔比为(1~2.5):5:5;
所述含有羧基的疏水性聚合物进行羧基活化后需进行沉淀洗涤,干燥处理。
所述羧基活化完成后,反应母液需进行沉淀,所述沉淀剂为甲醇/乙醚(75/25v/v)混合溶剂。
步骤s1中所述含有氨基的透明质酸与含有羧基的疏水性聚合物的摩尔比为1:1。
步骤s1中所述酰胺反应需加入n,n-二异丙基胺或n,n-二异丙基乙胺,所述含有羧基的疏水性聚合物与n,n-二异丙基胺或n,n-二异丙基乙胺的摩尔比为1:(1.5~2)。
步骤s1中所述酰胺反应以有机溶剂为反应介质,所述有机溶剂优选为二甲基亚砜(dmso)。
步骤s1中所述酰胺反应的温度为40~60℃,优选为50℃;酰胺反应的时间为36~72h,优选为48h。
步骤s1中所述酰胺反应完成后,反应液需透析,冻干处理,得到最终产物。
步骤s1中所述含有羧基的疏水性聚合物为端基为羧基的聚己内酯(pcl)、端基为羧基的聚乳酸(pla)、端基为羧基的聚乙烯吡咯烷酮(pvp)中的一种;
步骤s2中所述其他两亲性嵌段共聚物为聚乙二醇-b-聚己内酯(peg-b-pcl)、聚乙二醇-b-聚乳酸(peg-b-pla)、聚乙二醇-b-聚乳酸-羟基乙酸共聚物(peg-b-plga)中的一种以上。
步骤s2中所述透明质酸ha接枝的两亲性嵌段共聚物与其他两亲性嵌段共聚物的质量比为1:(5~20)。
步骤s2中所述溶剂交换法为:将透明质酸ha接枝的两亲性嵌段共聚物与其他两亲性嵌段共聚物溶于有机溶剂中,加入水或磷酸盐缓冲液(pbs),持续搅拌使有机溶剂完全挥发,得到高分子囊泡溶液;
步骤s2中所述水合法为:将透明质酸ha接枝的两亲性嵌段共聚物与其他两亲性嵌段共聚物溶于有机溶剂中,完全溶解后,成膜;将膜与水或pbs缓冲液进行搅拌,得到高分子囊泡溶液;搅拌的时间为2~5天;所述成膜为真空干燥成膜;
所述溶剂法中有机溶剂为四氢呋喃(thf)、n,n-二甲基甲酰胺(dmf)、n,n-二甲基乙酰胺(dmac)、二氯甲烷(dcm)、氯仿(chcl3)中的一种以上。
所述水合法中有机溶剂为四氢呋喃(thf)、n,n-二甲基甲酰胺(dmf)、n,n-二甲基乙酰胺(dmac)、二氯甲烷(dcm)、氯仿(chcl3)中的一种以上。
步骤s2中所述溶剂法或水合法制备具有靶向功能仿病毒结构高分子囊泡时,所得高分子囊泡溶液需进行纯化分离。
所述纯化分离的方法为透析法或液相色谱柱法中的一种以上。
所述液相色谱柱法进行分离时,将高分子囊泡溶液从色谱柱上方加入,之后加入pbs缓冲液使高分子囊泡溶液按照尺寸大小在不同的淋出体积/保留时间从色谱柱下方分离出,按照所需尺寸收集。
步骤s2中所述具有靶向功能仿病毒结构高分子囊泡的尺寸为50nm~400nm。
步骤s2中所述具有靶向功能仿病毒结构高分子囊泡以溶液形式存在,其浓度为5mg/ml~30mg/ml,优选为10mg/ml~20mg/ml。
所述具有靶向功能仿病毒结构高分子囊泡通过上述方法得到。
所述具有靶向功能仿病毒结构高分子囊泡用于药物载体和/或制备治疗肿瘤药物。
本发明的透明质酸(ha)是一种d-葡萄糖醛酸和n-乙酰-d-葡萄胺两种单糖重复排列的直线性多糖。ha基团能与肿瘤细胞中受体cd44配对,这种受体与ha相互作用,可调节肿瘤发展和转移过程中的细胞行为。基于ha能与肿瘤细胞表面cd44特异性受体结合的特性,给予药物载体输送药物的靶向性,引导药物载体被肿瘤细胞内吞,从而提高药物利用率,增强药物疗效。
与现有技术相比,本发明具有如下优点以及有益效果:
本发明采用具有透明质酸基团的嵌段共聚物与其他嵌段共聚物共混,通过水合法或溶剂法自组装制备高分子囊泡;通过透明质酸基团的嵌段共聚物与其他嵌段共聚物的选用以及两嵌段共聚共混比例的调控使得高分子囊泡具有仿病毒结构,而嵌段共聚物中由于透明质酸基团的存在,使得高分子囊泡具有肿瘤细胞靶向性。总之,本发明的方法重复性好,所获得高分子囊泡具有仿病毒结构,同时其靶向性好,具有较好的应用前景。本发明的方法易于获得不同形貌和功能性的高分子囊泡,并应用于药物释放等多种领域。
附图说明
图1为实施例1制备的ha接枝的两亲性嵌段共聚物的1h-nmr核磁氢谱图
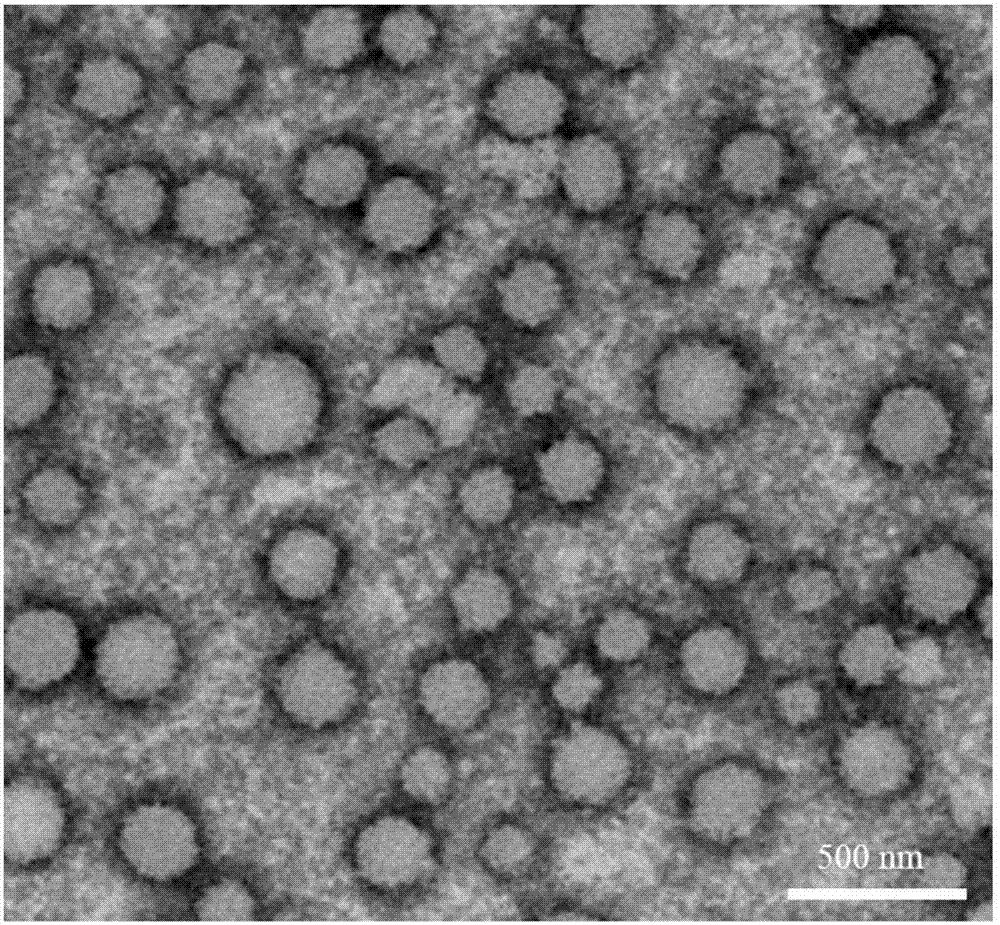
图2为实施例1制备的高分子囊泡的透射电子显微镜图(tem),放大倍数为2万倍。
具体实施方式
下面结合实施例和附图对本发明作进一步解释说明,但本发明的实施方式不限于此。
实施例1
(1)将1.0g透明质酸(mw=5000,0.2mmol)溶于30ml的醋酸盐缓冲液(ph=5.6,醋酸/醋酸钠)中,完全溶解后,加入1.0ml的1,4-丁二胺(0.4mmol),50℃恒温条件下,磁力搅拌24小时;之后在保持温度搅拌条件不变的情况下,每天加入0.2g的硼氰化钠,共三次,采用透析袋在去离子水中透析1天,将袋中物-20℃条件下冷冻干燥得到端氨基化透明质酸;
(2)称取1.0g的pcl-cooh(端羧基的pcl,mw=10,000,0.1mmol),溶于10ml的甲醇中,加入0.2mmol的edc与0.2mmol的nhs,室温下搅拌24h,使用10ml甲醇/乙醚(75/25v/v)沉淀产物,70℃真空干燥3h,得到nhs/羧基活泼中间酯即羧基活化的产物;
(3)称取总质量为0.5g的端氨基化透明质酸和nhs/羧基活泼中间酯(摩尔比为1:1)溶于20mldmso中,加入20μl的n,n-二异丙基胺(0.05mmol),在50℃的条件下搅拌反应48小时,采用透析袋在去离子水中透析1天,将袋中物在-20℃条件下冷冻干燥,得到ha接枝的两亲性嵌段共聚物,其1h-nmr氢谱见图1;
(4)称取合成的ha接枝的两亲性嵌段共聚物和peg45-b-pla140混合物,总质量为25mg,质量比为1:10,完全溶解在2.5ml二氯甲烷中,加入5ml去离子水,充分搅拌使有机溶剂挥发完全,后移入透析袋中,透析3天,得到平均直径200nm的10mg/ml高分子囊泡溶液。所述高分子囊泡的透射电镜图如图2所示,其中可见囊泡的直径约200nm。
实施例2
(1)将2.0g透明质酸(mw=5,000,0.4mmol)溶于30ml醋酸盐缓冲液(ph=5.6,醋酸/醋酸钠)中,完全溶解后,加入1.0ml的1,4-丁二胺(0.4mmol),50℃恒温条件下,磁力搅拌24小时;之后在保持温度搅拌条件不变的情况下,每天加入0.2g的硼氰化钠,共三次,采用透析袋在去离子水中透析1天,将袋中物-20℃条件下冷冻干燥,得到端氨基化透明质酸;
(2)称取1.0g的pcl-cooh(端羧基的pcl,mw=10,000,0.1mmol),溶于10ml的甲醇中,加入0.2mmol的edc与0.2mmol的nhs,室温下搅拌24h,使用10ml甲醇/乙醚(75/25v/v)沉淀产物,70℃真空干燥3h,得到nhs/羧基活泼中间酯;
(3)称取总质量为0.5g的端氨基化透明质酸和nhs/羧基活泼中间酯(摩尔比为1:1)溶于20mldmso中,加入20μl的n,n-二异丙基胺(0.05mmol),在温度50℃的条件下搅拌反应48小时,透析1天处理后,-20℃条件下冷冻干燥得到ha接枝的两亲性嵌段共聚物;
(4)称取合成的ha接枝的两亲性嵌段共聚物和peg45-b-pcl140总质量为25mg,质量比为1:15,完全溶解在2.5ml的thf中,向高分子溶液中加入5ml去离子水,充分搅拌后移入透析袋中,透析1天,得到10mg/ml平均直径150nm的高分子囊泡溶液。
实施例3
(1)将1.0g透明质酸(mw=5000,0.2mmol)溶于30ml醋酸盐缓冲液(ph=5.6,醋酸/醋酸钠)中,完全溶解后,加入1.0ml的1,4-丁二胺(0.4mmol),50℃恒温条件下,磁力搅拌24小时;之后在保持温度搅拌条件不变的情况下,每天加入0.2g的硼氰化钠,共三次,采用透析袋在去离子水中透析1天,将袋中物在-20℃条件下冷冻干燥,得到端氨基化透明质酸;
(2)称取2.0g的pvp-cooh(端羧基的pvp,mw=10,000,0.2mmol),溶于10ml的甲醇中,加入0.4mmol的edc与0.4mmol的nhs,室温下搅拌24h,使用10ml甲醇/乙醚(75/25v/v)沉淀产物,70℃真空干燥3h,得到nhs/羧基活泼中间酯;
(3)称取总质量为0.5g的端氨基化透明质酸和nhs/羧基活泼中间酯(摩尔比为1:1)溶于20mldmso中,加入20μl的n,n-二异丙基胺(0.05mmol),在温度50℃的条件下搅拌反应48小时,透析1天处理后,-20℃条件下冷冻干燥得到ha接枝的两亲性嵌段共聚物;
(4)称取合成的ha接枝的两亲性嵌段共聚物和peg45-b-pla140总质量为25mg,质量比为1:15,完全溶解在2.5ml的thf中完全溶解,后经真空中除尽有机溶剂成膜,之后添加去离子水,进行磁力搅拌5天,通过液相色谱柱法纯化分离,得到5mg/ml平均直径250nm的高分子囊泡溶液。
实施例4
(1)将2.0g透明质酸(mw=5000,0.4mmol)溶于30ml醋酸盐缓冲液(ph=5.6,醋酸/醋酸钠)中,完全溶解后,加入1.0ml的1,4-丁二胺(0.4mmol),50℃恒温条件下,磁力搅拌24小时;之后在保持温度搅拌条件不变的情况下,每天加入0.1g的硼氰化钠,共三次,采用透析袋在去离子水中透析1天,将袋中物-20℃条件下冷冻干燥,得到端氨基化透明质酸;
(2)称取2.0g的pla-cooh(端羧基的pla,mw=10,000,0.2mmol),溶于10ml的甲醇中,加入0.4mmol的edc与0.4mmol的nhs,室温下搅拌24h,使用10ml甲醇/乙醚(75/25v/v)沉淀产物,70℃真空干燥3h,得到nhs/羧基活泼中间酯;
(3)称取总质量为0.5g的端氨基化透明质酸和nhs/羧基活泼中间酯(摩尔比为1:1)溶于20mldmso中,加入20μl的n,n-二异丙基胺(0.05mmol),在温度50℃的条件下搅拌反应48小时,透析1天处理后,-20℃条件下冷冻干燥得到ha接枝的两亲性嵌段共聚物;
(4)称取合成的ha接枝的两亲性嵌段共聚物和peg45-b-pla140总质量为25mg,质量比为1:15,完全溶解在2.5ml的thf中完全溶解,后经真空中除尽有机溶剂成膜,之后添加去离子水,进行磁力搅拌2天,通过液相色谱柱法纯化分离,得到5mg/ml平均直径200nm的高分子囊泡溶液。
实施例5
(1)将1.0g透明质酸(mw=5000,0.2mmol)溶于30ml醋酸盐缓冲液(ph=5.6,醋酸/醋酸钠)中,完全溶解后,加入1.0ml的1,4-丁二胺(0.4mmol),50℃恒温条件下,磁力搅拌24小时;之后在保持温度搅拌条件不变的情况下,每天加入0.1g的硼氰化钠,共三次,采用透析袋在去离子水中透析1天,将袋中物-20℃条件下冷冻干燥,得到端氨基化透明质酸;
(2)称取2.0g的pcl-cooh(端羧基的pcl,mw=10,000,0.2mmol),溶于10ml的甲醇中,加入0.2mmol的edc与0.2mmol的nhs,室温下搅拌24h,使用10ml甲醇/乙醚(75/25v/v)沉淀产物,70℃真空干燥3h,得到得到nhs/羧基活泼中间酯;
(3)称取总质量0.5g称取总质量为0.5g的端氨基化透明质酸和nhs/羧基活泼中间酯(摩尔比为1:2)溶于20mldmso中,加入20μl的n,n二异丙基胺(0.05mmol),在温度50℃的条件下搅拌反应48小时,透析1天处理后,-20℃条件下经冷冻干燥得到ha接枝的两亲性嵌段共聚物;
(4)称取ha接枝的两亲性嵌段共聚物和peg45-b-plga100总质量为30mg,质量比为1:20,完全溶解在3ml的氯仿(chcl3)中,真空干燥箱中干燥除去有机溶剂,加入去离子水,磁力搅拌5天,透析3天,得到平均直径300nm的30mg/ml高分子囊泡溶液。
实施例6
(1)将2.0g透明质酸(mw=5,000,0.4mmol)溶于30ml配制而成的醋酸盐缓冲液(ph=5.6,醋酸/醋酸钠)中,完全溶解后,加入1.0ml的1,4-丁二胺(0.4mmol),50℃恒温条件下,磁力搅拌24小时;之后在保持温度搅拌条件不变的情况下,每天加入0.1g的硼氰化钠,共三次,采用透析袋在去离子水中透析1天,将袋中物-20℃条件下冷冻干燥,得到端氨基化透明质酸;
(2)称取1.5g的pvp-cooh(端羧基的pvp,mw=10,000,0.15mmol),溶于10ml的甲醇中,加入0.8mmol的edc与0.8mmol的nhs,室温下搅拌24h,使用10ml甲醇/乙醚(75/25v/v)沉淀产物,70℃真空干燥3h,得到nhs/羧基活泼中间酯;
(3)称取总质量为0.5g的端氨基化透明质酸和nhs/羧基活泼中间酯(摩尔比为1:1)溶于20mldmso中,加入20μl的n,n-二异丙基胺(0.04mmol),在温度50℃的条件下搅拌反应48小时,透析1天处理后,-20℃条件下冷冻干燥得到ha接枝的两亲性嵌段共聚物;
(4)称取合成的ha接枝的两亲性嵌段共聚物和peg45-b-pcl120质量为30mg,质量比为1:5,完全溶解在5ml的n,n-二甲基甲酰胺(dmf)中完全溶解,后经真空中除尽有机溶剂成膜,之后添加去磷酸盐缓冲液(pbs),进行磁力搅拌3天,通过液相色谱柱法纯化分离,得到5mg/ml平均直径50nm的高分子囊泡溶液。
- 还没有人留言评论。精彩留言会获得点赞!