MS-275在制备促进胰岛素分泌药物中的用途的制作方法
本发明涉及基因的功能与应用技术领域,具体涉及一种ms-275在制备促进胰岛素分泌药物中的用途。
背景技术
胰岛是调节机体血糖稳态的重要器官,众所周知血糖上升时,胰岛β细胞分泌胰岛素促使血糖下降,并且这种葡萄糖刺激引起的胰岛素分泌在体内呈双相特征,第一时相快速地达到一个峰值称为胰岛素分泌的触发阶段,紧接着进入缓慢而持续的第二阶段,称为胰岛素分泌的扩大阶段,线粒体在这种双相分泌的过程中发挥了重要的作用。当胰岛β细胞受损或凋亡致使胰岛素分泌不足或者产生胰岛素抵抗致使胰岛素含量相对不足时,就会发生糖尿病。
ms-275是i类组蛋白去乙酰化酶抑制剂,主要对hdac1和hdac3有抑制作用,而组蛋白去乙酰化酶是调控基因表达和修饰染色质结构的一类具有重要作用的蛋白酶,近年来已成为研究热点。ms-275对多种肿瘤治疗有效,包括乳腺癌、肺癌以及结直肠癌等,其商品名为恩替诺特,已于2013年9月被fda通过指定为突破性治疗药物。有研究表明应用ms-275还可以改善急慢性胰腺炎的预后。但是,ms-275作为一种新型抗癌药物,在糖尿病领域的研究还较少,其对胰岛在体功能影响以及具体分子机制还需要进一步探讨。
技术实现要素:
本发明的目的在于提供一种ms-275在制备促进胰岛素分泌药物中的用途。
本发明的目的是通过以下技术方案来实现的:
第一方面,本发明涉及一种ms-275在制备促进胰岛素分泌药物中的用途。
优选的,ms-275通过抑制葡萄糖氧化产生的活性氧物质来保护胰岛β细胞。
第二方面,本发明涉及一种ms-275在用作线粒体氧化磷酸化基因抑制剂中的用途。
优选的,所述氧化磷酸化基因包括atp5mg、uqcrc2、ndufb7、ndufs7。
优选的,该抑制剂可用于调节高糖刺激的胰岛素分泌。
优选的,该抑制剂通过抑制线粒体氧化磷酸化来调节高糖刺激的胰岛素分泌。
第三方面,本发明涉及一种ms-275在用作抑制线粒体的融合和分裂基因fis1和mfn2的制剂中的用途。
优选的,该抑制剂可用于调节高糖刺激的胰岛素分泌。
优选的,该抑制剂通过抑制线粒体融合/分裂来调节高糖刺激的胰岛素分泌。
与现有技术相比,本发明发现ms-275促进胰岛素分泌的同时,可以抑制氧化磷酸化相关基因,说明ms-275是通过抑制葡萄糖氧化产生的活性氧等物质起保护胰岛β细胞作用。进一步的,本发明还发现ms-275不仅能抑制线粒体氧化磷酸化,还能同时抑制线粒体的融合和分裂相关基因fis1和mfn2。
附图说明
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
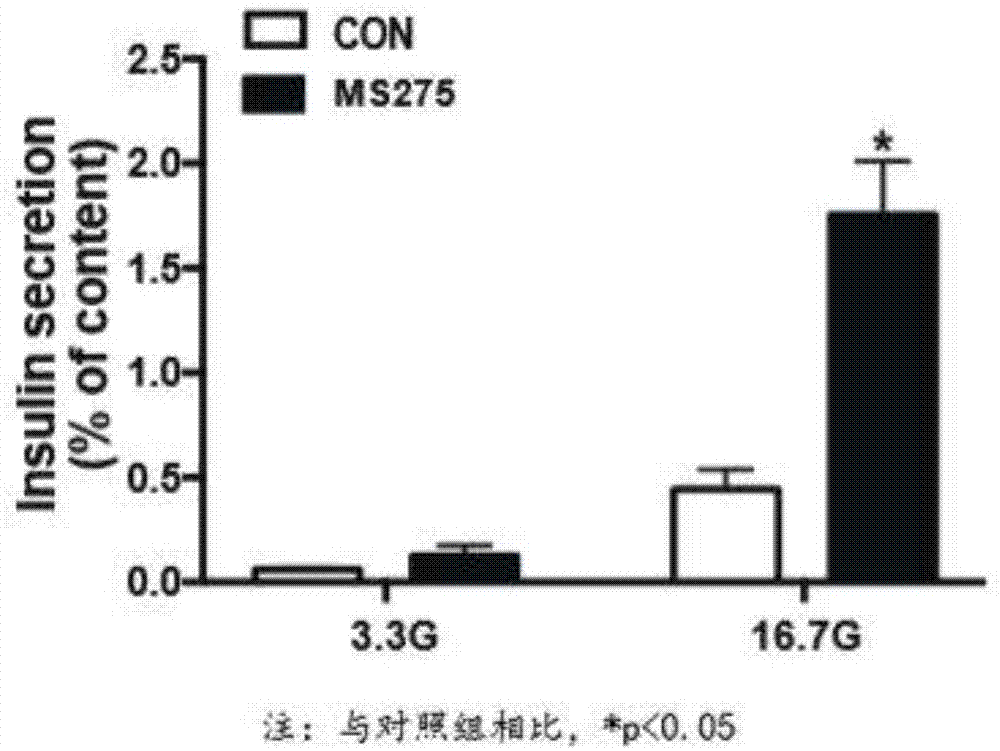
图1为ms-275预处理24h增强大鼠胰岛葡萄糖刺激的胰岛素分泌功能示意图,其中,与对照组相比,*p<0.05;
图2为ms-275预处理24h增强小鼠胰岛葡萄糖的刺激胰岛素分泌功能示意图,其中,与对照组相比,***p<0.001;
图3为用rna变性琼脂糖凝胶电泳检测rna样本的质量以及完整性示意图;其中,1-3泳道代表con组;4-6泳道代表ms-275组;
图4为上调表达的差异基因富集程度最高的10个生物学过程示意图;
图5为下调表达的差异基因富集程度最高的10个生物学过程示意图;
图6为上调表达的差异基因富集程度最高的10个细胞组分示意图;
图7为下调表达的差异基因富集程度最高的10个的细胞组分示意图;
图8为上调表达的差异基因富集程度最高的10个分子功能示意图;
图9为下调表达的差异基因富集程度最高的10个分子功能示意图;
图10为上调表达的差异基因富集程度最高的10个信号通路示意图;
图11为下调表达的差异基因富集程度最高的10个信号通路示意图;
图12为ms-275对ins-1细胞多种线粒体相关基因表达的影响示意图;其中,con:3.3mmol/l葡萄糖组;ms:3mol/l;ms-275;作用24h,与对照相比,p<0.05,**p<0.01,***p<0.001。
具体实施方式
下面结合实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干调整和改进。这些都属于本发明的保护范围。
实施例1、ms-275对胰岛素分泌影响的验证
1.1大鼠胰岛细胞的分离:
1)梯度分离液的配置:
a液:40ml原液+2ml不含bsa的hank’s液
b液:6.4mla液+1.1ml不含bsa的hank’s液
c液:2.4mlb液+2.6ml不含bsa的hank’s液
灌注用酶:23ml不含bsa的hank’s液+1mlxi胶原酶原液+1ml25%bsa(注:b、c液为1只大鼠的剂量;每只大鼠灌注10ml左右胶原酶);
2)配完上述试剂后,每500mlhank’s加入2ml25%bsa,上下颠倒混匀,放冰上备用;
3)用10%的水合氯醛按1ml/20g的剂量对大鼠(6~8周龄的普通雄性sd大鼠200-300g)进行腹腔注射以麻醉大鼠;对麻醉大鼠进行胰腺分离;
4)将完整分离下来的胰腺装入事先准备好的50ml离心管内,迅速浸入37℃水浴锅中恒温消化16min+30s;到时间后,取出离心管用力将整个胰腺甩开,加入含0.1%的bsa的冰hank’s液约50ml终止消化;迅速放入预冷至4℃的离心机中1000rpm离心1min,上下加速度为9,倒掉上清以及未消化的脂肪组织,再次加入约50ml含bsa的冰hank’s液吹打沉淀后再次离心,重复一次(共离心3次);第三次离心结束后,倒掉上清,加入约25ml的冰hank’s,轻吹混匀后过筛(筛孔直径为850μm),过筛结束后,用20~25ml的冰hank’s涮洗管壁将滤出液补至50ml,4℃离心,1000rpm3min,上下加速度为9,倒掉上清后,用枪吸尽管壁残余液体;向离心管中加入300μl25%bsa轻摇混匀后加入配好的a液10ml,彻底吹打混匀,再依次缓慢加入5mla液、b液、c液(液体密度分别为1.094、1.061、1.041),可见明显的分层,4℃离心,400rpm×3min,上下加速度为0,接着调至1700rpm×14min,上下加速度仍为0;离心完成后用玻璃管吸取位于b、c液交界层面的胰岛团置于约含30mlhank’s的离心管中,用冰hank’s补齐至50ml,4℃离心,1000rpm×3min,上下加速度为9,去上清;向离心管中加约10ml冰hank’s于沉淀中,吹散后倒入直径10cm的大培养皿中,用5mlhank’s涮洗管壁一次,显微镜下或肉眼挑出胰岛,重复3遍至没有杂质;
5)不做其他处理时,可将胰岛收集至1.5ml离心管中,标明日期及数量,吸去hank’s,加入1ml冰pbs,2000rpm离心2min,,重复上述步骤,尽量吸尽残余液体(注意不要吸到ep管底部的胰岛),放入液氮罐20min后,储存于-80℃;要后续处理时,在超净无菌工作台中在小皿中用无菌胰岛洗液洗6次后,将胰岛转移至10cm大皿中于37℃,5%co2细胞培养箱中预培养3~4h后,按实验需要分成不同的处理组置于培养箱内培养,待用。
1.2ms-275促进胰岛素分泌水平提高
1.2.1大鼠胰岛胰岛素分泌实验
1)分离出胰岛后,挑选状态良好大小适宜的胰岛置于含5%胎牛血清,5.6mmol/l葡萄糖的dmem培液中孵育过夜;
2)长期分泌实验:在体视显微镜下以每孔10个胰岛(24孔板)或者每孔150个胰岛(6孔板)将胰岛挑入相应的培养板中,用含0.5%的bsa和不同糖浓度的dmem培液预处理24h;
3)急性分泌实验:将修复或处理后的胰岛挑入含0.1%,2.8mmol/l葡萄糖的krb溶液中(24孔板),洗涤两遍,置于1ml上述krb缓冲液中,细胞培箱预处理30min后根据实验设计更换预热过的含不同糖浓度的krb缓冲液,细胞培箱孵育1h,立即收上清,1000rmp,4℃离心3min,吸取上清冻存于-80℃待测;
4)处理后的胰岛用酸化乙醇(含0.18nhcl的70%乙醇)法提取蛋白,用于胰岛素测定的校正;
5)用elisa试剂盒检测胰岛素浓度:室温平衡aplco超敏大鼠胰岛素超敏试剂盒及待检测样本30min;依次向96孔胰岛素测定板中加入10μm标准品,质控及待测样本后,再加入100μm以conjugatebuffer稀释后的enzymeconjugate溶液,套好锡箔纸用胶布与振荡器固定,800rmp室温震荡2h(18~25℃);用双蒸水稀释washbuffer,洗板6次(每次用力甩去液体并在吸水纸上将残余液体吸干);每孔加入200μmtmbsubstrate(注意避光,避免产生气泡),800rmp室温震荡15min;每孔加入50μlstopsolution终止反应(可以将测定板震荡5s以确保充分混匀);30min内用酶标仪读取450nm处的吸光度值,根据标准曲线计算出胰岛素浓度。
1.2.2葡萄糖和ms-275预处理的大鼠胰岛细胞的胰岛素分泌
分别用3.3mmol/l葡萄糖和3μmol/lms-275预处理分离的大鼠胰岛细胞24h后,用3.3mmol/l葡萄糖和16.7mmol/l葡萄糖处理1h,观察其胰岛素分泌水平的改变。虽然在高糖处理下对照组和实验组的胰岛素分泌均增加,但是高糖刺激后ms-275预处理组胰岛素分泌的增加明显优于对照组(图1)。用同样的实验条件处理小鼠胰岛,结果与大鼠胰岛一致,与低糖对照组相比,ms-275预处理24h同样能显著刺激小鼠胰岛葡萄糖刺激的胰岛素的分泌(图2)。
实施例2、ms-275调节胰岛功能的具体机制验证
2.1大鼠胰岛rna测序实验
1)用如前所述的方法分离大鼠胰岛,用3.3mmol/l葡萄糖以及3μmol/l的ms-275孵育24h后,每份胰岛加入1mltrizol提取样本rna(qiagen试剂盒);
2)使用nanodrop测定样本rna浓度,用分光光度计测定其在230nm,260nm和280nm评估其纯度;本实验所用rna样本a260/a280的比值均大于1.8,接近2.0,并且a260/a230的比值大于1.8,证明本次实验所用rna样本质量可靠,较少受蛋白质和有机物污染,可以用于进一步实验。
3)用变性琼脂糖凝胶电泳检测rna的纯度和完整性,选择高质量完整没有rnase和dna污染的样本进行检测;如图3所示,电泳图像可以清晰地看见18srrna、28srrna、5srrna三条带,且28srrna条带的亮度是18srrna的两倍,条带清晰无拖影,说明样本rna完整未降解。
4)每个样品选取2μg总的rna进行扩增,标记荧光crna,构建测序文库;
5)在标准条件下,标记过的探针与基因组芯片进行杂交;
6)用agilentmicroarrayscanner扫描芯片荧光强度,进行图像采集,同时将实验结果转换为数字型数据保存于电脑中。
7)最后用genespringgx(agilenttechnologies)等相关软件进行数据分析。
2.2差异表达基因的分析结果
对比两组样本的基因芯片结果,发现与3.3mmol/l葡萄糖对照组相比,ms-275处理24h导致2797个基因上调,1828个基因下调(差异表达基因显著性的界限设为倍数改变值大于等于2.0,t检验p<0.05)。为了进一步从整体细胞生物学水平了解两组样本差异表达基因的功能属性,我们对其进行了go分析(geneontology)和信号通路分析(kyotoencyclopediaofgeneandgenome,kegg),其中go分析又包括三个部分,分别为生物学过程(biologicalprocess,bp)、细胞组分(cellularcomponent,cc)和分子功能(molecularfunction,mf)。通过对基因芯片差异基因定位,功能和参与的信号通路的分析以进一步探究ms-275调节胰岛功能的具体机制。
1)g0分析结果
ms-275处理组差异表达上调基因富集的生物过程主要包括轴突导向、神经分化以及细胞的增生与凋亡(图4),而差异表达下调基因富集的生物过程主要包括纤毛组装、泛素化降解、氧化还原反应以及四氢叶酸和甘露糖的代谢过程(图5)。与对照组相比,ms-275处理后差异基因上调富集的细胞组分主要包括细胞表面膜组分以及神经胞体和突触,下调富集的细胞组分主要包括线粒体和细胞核浆(图6、图7)。最后从分子功能方面查看上调基因富集分子结合和转录活性(图8),下调基因富集泛素蛋白连接酶结合以及rna结合(图9)。
2)kegg信号通路分析结果
与低糖对照组相比,ms-275处理组中上调表达的基因在10条信号通路中富集较高,主要包括多种癌症以及mapk信号通路(图10);而下调表达的基因则主要富集于体内多种代谢途径以及线粒体自噬(图11)。
2.3rna测序分析线粒体相关基因的验证
胰岛素的分泌与线粒体氧化功能密切相关,因此,从rna测序的表达谱中挑选了几个线粒体氧化磷酸化相关(atp5mg,uqcrc2,ndufb7,ndufs7)、线粒体分裂融合相关(fis1,mfn2)以及线粒体自噬相关(pink1)的基因在ins-1细胞上进行了pcr验证,发现这些基因的表达均明显下调,与测序结果一致,证明测序结果可信(图12)。
综上所述,ms-275预处理24h可以明显增加高糖刺激的胰岛素分泌,而基因芯片的结果提示ms-275处理后下调的基因主要富集于线粒体、细胞质和细胞核,参与纤毛组装、氧化磷酸化以及自噬等生物学过程,主要分子功能包括rna以及泛素蛋白连接酶的结合kegg代谢通路分析显示,与对照相比,ms-275处理组差异表达下调基因主要富集于代谢通路和线粒体自噬。为进一步了解线粒体功能状态与胰岛素分泌的关系,我们从基因芯片中选取了氧化磷酸化(atp5mg、uqcrc2、ndufb7、ndufs7)、分裂融合动态平衡(fis1和mfn2)和线粒体自噬(pink1)相关基因进行了验证,结果与芯片一致,ms-275处理24h以后,这些基因都有不同程度的下降,其中ndufs7下调了70%左右。可见,ms-275促进胰岛素分泌的同时,可以抑制氧化磷酸化相关基因,说明ms-275可能是通过抑制葡萄糖氧化产生的活性氧等物质起保护胰岛β细胞作用。进一步的,ms-275不仅能抑制线粒体氧化磷酸化,还能同时抑制线粒体的融合和分裂相关基因fis1和mfn2。
- 还没有人留言评论。精彩留言会获得点赞!