月桂酰精氨酸乙酯作为兽用抗菌剂的用途的制作方法
本发明涉及化合物月桂酰精氨酸乙酯在制备兽用抗菌剂、饲料添加剂或饲料营养能量物质中的应用。
背景技术
鸭疫里默氏杆菌病是由鸭疫里默氏杆菌(riemerellaanatipestifer,ra)引起的一种接触性传染病,又称为鸭传染性浆膜炎、鸭败血症、鸭疫综合症、鸭疫巴氏杆菌病等。多见于1‐8周龄的雏鸭,其中2‐4周龄的雏鸭最易感。呈急性或慢性败血症,临诊上主要表现为眼和鼻的分泌物增多、喘气、咳嗽、下痢、共济失调和头颈震颤,少数慢性病例出现头颈歪斜等症状。在病变上以纤维素性心包炎、肝周炎、气囊炎、脑膜炎及部分病例出现关节炎为特征,常引起小鸭的大批发病和死亡。该病的发病率可达90%以上,死亡率与发病鸭日龄、菌株毒力、不良应激因素相关,最高可达75%。除可引起1~8周龄鸭死亡外,还可引起输卵管炎,造成成年鸭产蛋率下降,生长迟缓,给养殖户造成了极大的经济损失。自1982年首次报道以来,此病已成为危害肉鸭养殖业的一种最常见细菌病。在自然条件下,本病一年四季都有发生。主要通过污染的饲料、饮水、尘土、飞沫等经呼吸道、消化道或皮肤的伤口(尤其是足蹼部皮肤)进入家禽体内而引发疾病。不同品种的鸭如北京鸭、樱桃谷鸭、狄高鸭、水鸭、番鸭、半番鸭、麻鸭等都可以感染发病。2012年7月至8月对江苏省内48个养鸭场进行随机抽查,其中45个养鸭场有疑似鸭疫里默氏杆菌病病例的出现,甚至有12个养鸭场在抽查期间竟然两次爆发该病。另外,若某一养鸭场发生该病,其周围的鸭场也会相继爆发该病,由此可见该病对养鸭业造成危害的严重性。
金黄色葡萄球菌病是指由金黄色葡萄球菌引起多种动物不同疾病或病型的通称。致病性金黄色葡萄球菌可引起各种家禽家畜发病,幼龄畜禽对本病最易感,多经消化道感染,鸡亦可通过呼吸道感染,常见症状有腹泻、肠炎、肝脏坏死等。常引起两类疾病,一类是化脓性疾病,主要引起动物的乳房炎、关节炎、创伤感染和败血症等;另一类是毒素性疾病,被致病菌污染的饲料会引起动物的中毒性肠炎及人的毒素休克综合征等。金黄色葡萄球菌的致病力强弱主要取决于其产生的毒力致病因子,主要包括血浆凝固酶、肠毒素、耐热核酸酶、溶血毒素和杀白细胞素等。
大肠杆菌病是指由致病性大肠杆菌引起多种动物不同疾病或病型的通称。病原性大肠杆菌和人畜肠道内正常寄居的非致病性大肠杆菌在形态、染色反应、培养特性和生化反应等方面没有区别,但抗原构造不同。致病性大肠杆菌可引起各种家禽家畜发病,如猪牛羊马鸡兔等,幼龄畜禽最易感本病,多经消化道感染,鸡亦可通过呼吸道感染。其中猪大肠杆菌病,根据仔猪的生长期和病原菌血清型的不同,在仔猪的临诊表现也不同,可分为黄痢型、白痢型和水肿型。仔猪发生黄痢时,常波及一窝仔猪的90%以上,病死率高,有的可达100%;白痢的发病率为30%~80%;水肿病发病率为10%~35%。雏鸡的大肠杆菌病通常表现为急性败血型、卵黄性腹膜炎、眼炎、气囊炎肿头综合征等。发病率可达30%~60%,病死率可达100%。
温和气单胞菌是革兰氏阴性、兼性厌氧性细菌,常存在于各种水环境、土壤环境中,并且是一种人畜共患致病菌。温和气单胞菌能产生溶菌素、胞外酶等多种致病因子,可导致水产动物患败血症,从而引发水产动物的死亡,严重影响水产养殖的经济基础。另外,致病菌还可能通过水产品感染到人,患者会出现腹泻等症状甚至发展为食物中毒或败血症。
除改善饲养条件外,施加抗生素是预防和治疗畜禽水产细菌性疾病的主要措施。然而,近年来,如金霉素、土霉素、四环素、氯霉素等常用抗生素因其抗病、促生长的功效在畜禽养殖业中被大肆使用。据统计,我国每年抗生素原料生产量约为21万吨,其中有9.7万吨的抗生素用于畜禽养殖业,占总生产量的46.1%。不恰当的抗生素使用、药物质量无保障、不全面的监管以及不严谨的用药规定导致了抗生素滥用加剧,从而产生了许多过犹不及的严重问题,如细菌耐药性的产生、动物机体免疫机能下降、肉类产品药物残留等,直接危害人类的健康。有研究称,约75%的抗生素是无法被人体或动物体吸收代谢,部分会残留在体内,有20%‐50%的活鸡或者冻鸡组织中能够检测到抗生素残留;残留的抗生素亦可随着排泄物进入环境中,有的会直接进入河道并影响下游居民的饮水安全,我国许多沿河城市的居民自来水中都检测到过土霉素、四环素、强力霉素、阿莫西林、金霉素等畜禽业抗生素的残留。近年来有研究对上海1000名儿童尿液进行抗生素检测,58%的尿液样品中检测到了多种仅在养殖业使用的兽用抗生素(如泰乐菌素、氯四环素和恩氟沙星等)。更重要的是,这些残余的抗生素会对环境中的微生物进行自然选择或者诱发其基因突变,具备耐药性的细菌存活下来并继续繁殖出更多的耐药菌。另外,细菌还能通过接合、转化、转导、转座等方式将自己的耐药基因传递给其他不同种、属的微生物使之获得耐药性。这就使得耐药细菌在环境中富集,被污染的土壤、水源一旦被人或牲畜接触则极易引发疾病并加速耐药菌的扩散。除了违规添加抗生素或抗菌剂之外,兽药和饲料添加剂主要包括防腐剂、防尘剂、抗氧化剂、抗原虫药等。这些物质因长期使用或使用不当,就会给畜禽和人身健康带来危害。
因此,在水产、畜牧、家禽类的养殖中,尤其是禽类(如鸡鸭)养殖中,迫切需要一种能够快速杀菌,并在体内易降解、无残留的抗菌剂,既能有效防止养殖业中疾病发生和蔓延,还能避免类似抗生素残留对人体及环境的影响。
月桂酰精氨酸乙酯(ethyllauroylarginate,lae)是一种由脂肪酸和二元氨基酸缩合而成的有机物,为白色吸湿性固体,在ph3~7范围内化学性质稳定,熔点50~58℃,该温度下247g的lae可分散于1kg的水中,它在水和油中的分配系数大于10,即主要存在于水相中。研究发现,月桂酰精氨酸乙酯lae具有抗菌能力强、生物毒性低、体内代谢效果好、与环境相容性高的特点。而其中最具代表性的特点是月桂酰精氨酸乙酯代谢无残留,相关研究显示月桂酰精氨酸乙酯在人体与动物体内可快速进行自然代谢,生成月桂酸和精氨酸,进一步被代谢为鸟氨酸、尿素、二氧化碳和水。月桂酰精氨酸乙酯代谢过程中所产生的所有初级代谢产物及终产物都是无毒无害的,与人和动物日常摄取的食物在体内的代谢产物相同。
例如,中国专利申请cn201710056593、发明名称为“一种果蔬防腐保鲜剂及其制备方法和应用”公开了以月桂酰精氨酸乙酯盐酸盐和尼泊金甲酯钠为主要活性成分的组合物来作为果蔬防腐保鲜剂,能够有效抑制导致果蔬腐烂的细菌生长。然而,该发明中高浓度的尼泊金甲酯钠(2000μg/ml)的单独抑菌效果强于低浓度的lae(1000μg/ml),这是因为其具有酚羟基结构,抗菌性能远远强于苯甲酸、山梨酸,因此在保证防腐性能的前提下,该方法明确指出使用尼泊金甲酯钠代替lae,有助于降低防腐剂的用量成本。
中国专利申请cn201510748675、发明名称为“采用月桂酰精氨酸乙酯抑制酒精发酵污染微生物的方法”公开了采用月桂酰精氨酸乙酯抑制酒精发酵污染微生物的方法,该方法包括将lae及其盐类化合物,以低于50μg/ml的浓度加入酿酒酵母的发酵液中,能有效抑制乳酸菌的生长,并控制其他污染微生物的生长。然而,该抑菌剂在一定程度上轻微影响酵母菌的生长,并导致酒精产量降低0.6%。
中国专利申请cn201610466729、发明名称为“一种温和的婴童洗发沐浴泡泡”公开了一种温和的婴童洗发沐浴泡泡,其针对婴童毛发及肤质的特点,选用椰油酰谷氨酸二钠、椰油酰胺丙基甜菜碱及磺酸羟丙酯月桂基葡糖苷交联聚合物钠复配作为表面活性剂体系,选用山茶籽油、α葡聚糖寡糖/菊粉复配物作为调理成分,野菊花提取物和月桂酰精氨酸乙酯hcl复配作为防腐体系,该发明中各原料互相协作,清洁效果好,温和无刺激。
中国专利申请cn201280073013、发明名称为“协同作用的抗微生物剂”公开通过将有效量的n‐α‐长链烷酰基二元氨基酸烷基酯盐与甘油单脂肪酸酯组合提供协同作用的抗微生物组合物,产生更有效的抗微生物剂和食品防腐剂。同时,中国专利申请cn200810131638、发明名称为“杀微生物剂组合物”公开甲基异噻唑啉酮和lae的组合物用于制备抗微生物剂和食品防腐剂的用途。然而,该方法涉及包括lae在内的多种抑菌成分,并未研究lae的单独抑菌作用。同时,该发明仅仅教导了所述组合物用于日用产品、清洁剂、伤口护理组合物、各类食品、各类医用清洁产品等用途,并未教导如何将单一的lae成分用于禽畜水产的抗菌性饲料的用途。
中国专利申请cn201280027864、发明名称为“具有改进的耐水性的化妆防晒制剂或皮肤科防晒制剂”公开一种lae用于制备化妆防晒制剂或皮肤科防晒制剂的用途,该制剂除了uv滤光剂之外还包括乳化剂聚甘油‐10硬脂酸酯。
作为最接近的现有技术,中国专利申请cn200580051259,发明名称为“包括阳离子表面活性剂的防腐体系”首次公开lae及其盐酸盐用于防腐体系中的用途,在食品、化妆品中添加包含0.2g/kglae的该体系从而起到防腐作用。该发明研究了lae的抑菌机理,并提出如何将lae用于食品、化妆品等防腐作用的应用,因此美国食品安全局于2005年批准月桂酰精氨酸乙酯用于食品防腐剂;2012年欧盟食品安全局、澳大利亚和新西兰也都批准了月桂酰精氨酸乙酯用于食品防腐剂。同时,鉴于该发明首次提出在化妆品方面的应用,后续研究中发现月桂酰精氨酸乙酯可用于口腔护理方面的产品(例如us20100330136a1、ep2361606a2、ep231603a2),如漱口水、牙膏等,可有效抑制口腔内牙斑的形成,它与漱口水中的其它化学成分兼容且化学性质稳定;月桂酰精氨酸乙酯可用于有局部治疗功效的化妆品中,这些化妆品有以下的特性:抗菌效果,低毒,没有致敏作用,对皮肤没有刺激。目前,研究人员正在研制清洁的洗手液和用于皮肤表面的抑菌剂。
另一方面,研究发现lae在体内快速降解,lae中的月桂酰胺键或酯键断裂,脱去月桂酸部分或乙醇部分,形成精氨酸乙醇酯或月桂酰胺精氨酸,二者再分别脱去乙醇部分或月桂酸部分,形成相同的中间产物l‐精氨酸。该代谢过程产生的月桂酸也是棕榈油、山胡椒油、椰子油等食用油的脂肪酸主要组成成分。精氨酸是组成蛋白质的20种氨基酸之一,存在于坚果、奶酪和鱼等食物中,根据中华人民共和国农业部公告第2045号文件——饲料添加剂品种目录(2013),l‐精氨酸属于氨基酸、氨基酸盐及其类似物大类,是一种提供能量的饲料添加剂。另外,l‐精氨酸也可进一步水解成鸟氨酸和尿素,其中鸟氨酸可通过尿素循环和柠檬酸(三羟酸)循环合成有机物,最终分解为尿素和二氧化碳排出体外。即,lae在动物体内的代谢过程中产生的代谢中间产物或终产物不仅安全无毒,还将产生大量的能量物质。因此,将lae应用于饲料添加可同时发挥其抗菌和提供代谢能量作用,从而有利于动物的健康、营养生长。
技术实现要素:
综上所述,现有的发明并未教导如何使用单一的月桂酰精氨酸乙酯(lae)及其衍生物或其水合物成分作为禽畜水产的抗菌性药物或饲料添加剂的用途,也未公开月桂酰精氨酸乙酯(lae)及其衍生物或其水合物在作为抗菌性药物或饲料添加剂的适宜浓度。因此,本发明首次将月桂酰精氨酸乙酯及其衍生物或其水合物(优选lae)用于禽畜水产的抗菌性药物的研究中,并通过实验确定其适宜的使用浓度,以达到有效抗菌防病效果的同时,对环境产生的负面影响小,毒副作用低,缓解现今抗生素在养殖业滥用所导致的严重细菌耐药后果。另一方面,在以上研究的基础上,将所述lae成分作为饲料添加剂,用于禽畜水产的生产。最后,在保证lae的抑菌效果的情况下,分别分析lae在不同的抑菌性饲料中作为能量物质对于禽畜水产动物营养生长的影响,从而确定同时实现抗菌防病和提供能量营养的合适配比。
本发明第一个目的是提供如式(i)所示的化合物月桂酰精氨酸乙酯(lae)及其衍生物或其水合物或药学上可接受的盐,在制备治疗或防治因致病微生物引起的禽畜、水产动物的疾病的药物中的用途。
本发明还提供了一种药物组合物,其包括式(i)所示的月桂酰精氨酸乙酯化合物(lae化合物)或其水合物或药学上可接受的盐。
其中,
x是卤素或者hso4;优选地,为br,cl或者hso4;
r1是含有8‐14个碳原子的直链饱和脂肪酸基团、或含有8‐14个碳原子的含氧酸基团;优选地,为含有12个碳原子的直链含氧酸基团;
r2是含有1‐18个碳原子的直链脂肪酸基团、或含有1‐18个碳原子的支链脂肪酸基团、或含有1‐18个碳原子的芳香基团,或含1‐4个碳原子的直链烷基;优选地,为含有2个碳原子的直链饱和脂肪酸;
r3是下列结构的一种:
n的范围是0‐4。
其中,所述式(i)所示的化合物是包含来源于脂肪酸和酯化二元氨基酸的缩合物的抗菌剂,能够预防及治疗由鸭疫里默氏杆菌引起的雏鸭鸭疫里默氏杆菌病,能够治疗由大肠杆菌及金黄色葡萄球菌引起的小鼠腹膜炎疾病,能够防治由温和气单胞菌引发的鱼败血症。优选地,该式(i)所示的抗菌剂为月桂酰精氨酸乙酯lae。该抗菌剂可以有效抑制或杀灭细菌,能够大幅度降低家禽、家畜及水产动物感染细菌的风险,并提升已感染致病菌动物的存活率。月桂酰精氨酸乙酯在人体及动物体内可安全降解,毒副作用小,避免了由于残留的抗菌剂排放到环境中所引起的环境耐药菌的产生,在达到有效抗菌效果的同时对环境负面影响小。
其中,所制备的药物中,以每千克体重给予0.625‐50mg(即,0.625‐50mg/kgbw)式(i)所示的化合物的剂量进行施用(优选为0.625-45mg/kgbw、进一步优选为0.625-40mg/kgbw)。在一个具体实施方案中,该药物以每千克体重给予2-25mg、2.5-25mg、4-25mg、8-25mg、8-16mg、10-25mg或16-25mg、16-20mg、30-50mg式(i)所示的化合物的剂量进行施用,所述致病微生物是致病性革兰氏阳性菌、革兰氏阴性菌。
在一个优选实施方案中,所述x是cl,所述式(i)所示的化合物是月桂酰精氨酸乙酯盐酸盐(laehcl),其结构式如下式(ii)所示:
在一个实施方案中,所述药物是用于治疗或预防雏鸭感染致病性革兰氏阴性菌的口服药物,并且该药物以每千克体重给予8‐40mg式(i)或(ii)所示的化合物的剂量进行施用。在一个优选实施方案中,该药物以每千克体重给予8‐16mg式(i)或(ii)所示的化合物的剂量进行施用,所述致病性革兰氏阴性菌是鸭疫里默氏杆菌、大肠杆菌、巴氏杆菌、沙门氏菌、嗜血杆菌、布鲁氏菌。在最优选实施方案中,该药物以每千克体重给予16mg式(i)或(ii)所示的化合物的剂量进行施用,所述致病性革兰氏阴性菌是鸭疫里默氏杆菌。
在另一实施方案中,所述药物是用于治疗或预防禽畜、水产动物的革兰氏阴性菌疾病的腹腔给药的药物,并且该药物以每千克体重给予2.5‐25mg式(i)或(ii)所示的化合物的剂量进行施用。在一个优选实施方案中,所述致病性革兰氏阴性菌是里默氏杆菌、大肠杆菌、巴氏杆菌、沙门氏菌、嗜血杆菌、布鲁氏菌。
在其他实施方案中,所述药物是用于治疗或预防禽畜、水产动物的革兰氏阳性菌疾病的口服给药的药物,并且该药物以每千克体重给予2.5‐25mg式(i)或(ii)所示的化合物的剂量进行施用。在优选实施方案中,所述革兰氏阳性菌是金黄色葡萄球菌、链球菌、丹毒杆菌、分枝杆菌、炭疽杆菌,并且该药物以每千克体重给予10‐25mg式(i)所示的化合物的剂量进行施用。
在其他实施方案中,所述药物是用于治疗或预防禽畜、水产动物的革兰氏阴性菌疾病的口服给药的药物,并且该药物以每千克体重给予0.625‐10mg式(i)或(ii)所示的化合物的剂量进行施用。在优选实施方案中,所述革兰氏阴性菌是大肠杆菌、巴氏杆菌、里默氏杆菌、沙门氏菌、嗜血杆菌、布鲁氏菌,并且该药物以每千克体重给予0.625‐10mg式(i)所示的化合物的剂量进行施用。
在其他实施方案中,所述药物是用于治疗仔猪腹泻的药物,并且该药物以每千克体重给予10‐50mg式(i)或(ii)所示的化合物的剂量进行施用仔猪。在优选实施方案中,所述药物以每千克体重给予30‐50mg式(i)所示的化合物的剂量进行施用仔猪,并取得优于同剂量抗生素的治疗仔猪腹泻的效果。在最优选的实施方案中,所述药物以每千克体重给予50mg式(i)或(ii)所示的化合物的剂量进行施用仔猪,并取得优于同剂量抗生素的治疗仔猪腹泻的效果。
在另一实施方案中,所述包含式(i)或(ii)所示的化合物的药物的剂型包括颗粒剂、溶液剂、悬浮剂、粉剂、胶囊剂、油剂、膏剂。
在上述任一实施方案中,所述禽畜、水产动物包括:鸡鸭鹅火鸡鹌鹑家鸽,猪牛羊马骆驼猫狗,以及鱼虾蟹等,所述致病菌包括但不局限于黄白痢、气喘病、丹毒病、水肿病、梭菌性肠炎、增生性肠炎、结核病、巴氏杆菌病、炭疽杆菌病、沙门杆菌病。
在一个优选的实施方案中,所述式(i)或(ii)所示的化合物能在30min内杀灭致病微生物,并且不引发耐药菌的出现。在另一优选的实施方案中,所述式(i)或(ii)所示的化合物能连续30天刺激致病微生物而不引发耐药菌的出现。在更优选的实施方案中,所述式(i)或(ii)所示的化合物对正常哺乳动物细胞毒性低。在最小杀菌浓度下不引发红细胞溶血。
在另一具体实施方案中,所述式(i)或(ii)所示的化合物对健康雏鸭生存率无影响,对健康雏鸭体重增长无影响,对健康雏鸭脏器无毒性,且能降低由于细菌感染而上升的动物体内炎症因子il‐1β和/或il‐1β蛋白水平。
本发明第二目的是提供如式(i)或(ii)所示的月桂酰精氨酸乙酯衍生物或其水合物或药学上可接受的盐在制备改变微生物的细胞膜极性的药物中的用途。
本发明还提供了如式(i)或(ii)所示的月桂酰精氨酸乙酯衍生物或其水合物或药学上可接受的盐,用于改变微生物的细胞膜极性的方法,步骤包括:
(1)将致病性微生物溶液稀释至od600=0.05,然后加入细胞膜极性染料;
(2)加入式(i)所示的化合物溶液直至终浓度为16μg/ml,充分反应;
(3)以622nm波长的光为激发光,测量670nm处的荧光值;
(4)通过流式细胞仪检测每个样品的荧光值,通过计算比值来分析细菌细胞膜发生去极化的程度。
在一个优选实施方案中,所述x是cl,所述式(i)所示的化合物是月桂酰精氨酸乙酯盐酸盐(laehcl),其结构式如下式(ii)所示:
在一个实施方案中,所述微生物是禽畜、水产动物中的致病性革兰氏阳性菌、革兰氏阴性菌。
在一个具体实施方案中,所述革兰氏阳性菌选自葡萄球菌、链球菌、丹毒杆菌、分枝杆菌、炭疽杆菌。在一个优选实施方案中,所述革兰氏阳性菌是金黄色葡萄球菌。
在另一具体实施方案中,所述革兰氏阴性菌选自大肠杆菌、巴氏杆菌、里默氏杆菌、沙门氏菌、嗜血杆菌、布鲁氏菌。在一个优选实施方案中,所述革兰氏阴性菌选自大肠杆菌、鸭疫里默氏杆菌。
在上述任一实施方案中,所述细胞膜极性染料是disc3(5)、disc2(3)荧光染料。
本发明的有益效果在于:
1、本发明的式(i)或(ii)所示的化合物能够在30min内完全清除革兰氏阳性菌、革兰氏阴性菌(如大肠杆菌、金黄色葡萄球菌以及鸭疫里默氏杆菌)。
2、本发明的式(i)或(ii)所示的化合物连续给药30天不诱发致病微生物的耐药突变。
3、本发明的式(i)或(ii)所示的化合物在最小杀菌浓度下不引发红细胞溶血现象。
4、本发明的式(i)或(ii)所示的化合物能够提升已感染鸭疫里默氏杆菌的雏鸭存活率,降低雏鸭感染鸭疫里默氏杆菌的风险,并对健康雏鸭生存率无影响。
5、本发明的式(i)或(ii)所示的化合物不仅不影响雏鸭的体重增长,相反能够作为能量物质促进雏鸭的生长。
6、本发明的式(i)或(ii)所示的化合物能够恢复动物体内由于细菌感染而引起的炎症因子il‐1β、tnf‐α的蛋白水平的升高。
7、实验证明,本发明的式(i)或(ii)所示的化合物对动物连续口服给药3个月,给药组相对于对照组体重增加有显著性升高,并且给药组相对于对照组重要脏器没有显著毒性。
8、实验证明,给药3个月后停药24h,给药组动物的心、肝、脾、肺、肾、小肠、胃、肌肉组织药物残留量符合欧盟对未规定兽药残留量的要求。
9、实验证明,所述式(i)或(ii)所示的化合物能够促进家禽的生长,其中促进鸭的生长,日增重提高11.5%。
10、实验证明,所述式(i)或(ii)所示的化合物既能防治水产动物的细菌性疾病,还能够促进家禽水产动物的营养生长,其中:抗感染实验结果显示,食用未含式(i)或(ii)所示的化合物饲料的试验鱼全部死亡,食用含有式(i)或(ii)所示的化合物的罗非鱼存活率可达88.33%;对于罗非鱼,能够提高相对增重率3.03%、6.23%、3.88%和特定生长率12.32%,降低饲料系数3.15%。
11、实验证明,与同剂量的庆大霉素相比,所述式(i)或(ii)所示的化合物能更有效地治疗仔猪腹泻,并避免抗生素的使用,减少牲畜中的抗生素的残留。
12、月桂酰精氨酸乙酯在人体及动物体内可安全降解,毒副作用小,能够避免由于残留的抗菌剂排放到环境中所引起的环境耐药菌的产生,在达到有效抗菌效果的同时对环境负面影响小。
附图说明
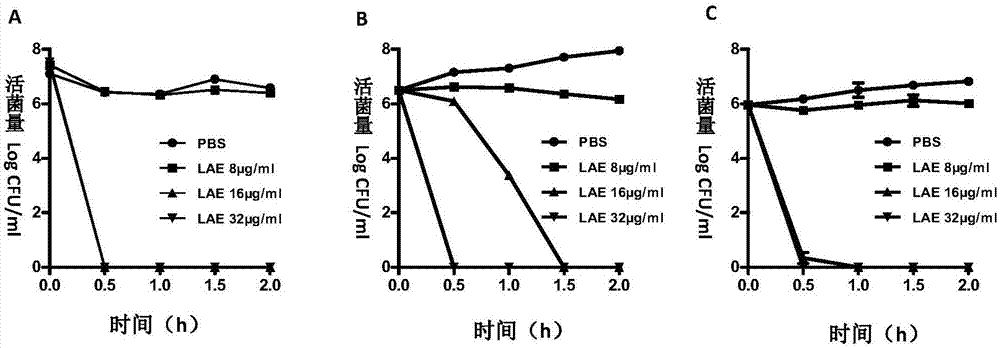
图1(a)所示式(i)月桂酰精氨酸乙酯化合物对鸭疫里默氏杆菌临床分离致病菌株ra‐11的时间杀菌曲线;(b)所示式(i)月桂酰精氨酸乙酯化合物对金黄色葡萄球菌atcc29213的时间杀菌曲线;(c)所示式(i)月桂酰精氨酸乙酯化合物对大肠杆菌atcc25922的时间杀菌曲线。
图2(a)所示式(i)月桂酰精氨酸乙酯化合物与氯霉素诱发鸭疫里默氏杆菌耐药的结果;(b)所示式(i)月桂酰精氨酸乙酯化合物与氯霉素诱发金黄色葡萄球菌耐药的结果;(c)所示式(i)月桂酰精氨酸乙酯化合物与氯霉素诱发大肠杆菌耐药的结果。
图3所示式(i)月桂酰精氨酸乙酯化合物对哺乳动物细胞毒性。其中,(a)所示月桂酰精氨酸乙酯化合物对小鼠成纤维细胞、小鼠肌成纤维细胞、人成纤维细胞的细胞毒性;(b)所示月桂酰精氨酸乙酯化合物对哺乳动物红细胞的溶血实验。
图4所示式(i)月桂酰精氨酸乙酯化合物在动物体内的毒性结果。其中,(a)为口服月桂酰精氨酸乙酯化合物5日雏鸭的生存状况;(b)为月桂酰精氨酸乙酯化合物对雏鸭增重率的影响;(c)为小鼠口服月桂酰精氨酸乙酯化合物三个月药物在体内残留量;(d)为小鼠口服月桂酰精氨酸乙酯化合物三个月体重的变化情况;(e)为小鼠口服月桂酰精氨酸乙酯化合物三个月主要脏器指数;(f)为雏鸭口服月桂酰精氨酸乙酯化合物5日脏器h&e染色结果;(g)为小鼠口服月桂酰精氨酸乙酯化合物三个月脏器h&e染色结果。
图5所示式(i)月桂酰精氨酸乙酯化合物对细菌细胞膜的影响。其中,(a)为正常大肠杆菌的扫描电镜图;(b)为月桂酰精氨酸乙酯化合物处理15min后大肠杆菌的扫描电镜图;(c)为月桂酰精氨酸乙酯化合物对鸭疫李默氏杆菌细胞膜极性的影响的荧光分光光度计结果;(d)为月桂酰精氨酸乙酯化合物对金黄色葡萄球菌细胞膜极性的影响的荧光分光光度计结果;(e)为月桂酰精氨酸乙酯化合物对大肠杆菌细胞膜极性的影响的荧光分光光度计结果;(f)为月桂酰精氨酸乙酯化合物对哺乳动物红细胞膜极性的影响;(g)为月桂酰精氨酸乙酯化合物对鸭疫李默氏杆菌细胞膜极性的影响的流式结果,(j)为其统计图;(h)为月桂酰精氨酸乙酯化合物对金黄色葡萄球菌细胞膜极性的影响的流式结果,(k)为其统计图;(i)为月桂酰精氨酸乙酯化合物对大肠杆菌细胞膜极性的影响的流式结果;(l)为其统计图。
图6所示式(i)月桂酰精氨酸乙酯化合物通过结合磷脂酰丝氨酸发挥杀菌作用。其中,(a)为月桂酰精氨酸乙酯化合物与水溶液的滴定itc结果;(b)为月桂酰精氨酸乙酯化合物与磷脂酰丝氨酸水溶液的滴定itc结果;(c)为月桂酰精氨酸乙酯化合物与磷脂酰胆碱水溶液的滴定itc结果;(d)为月桂酰精氨酸乙酯化合物与磷脂酰乙醇胺水溶液的滴定itc结果;(e)为不同浓度的磷脂酰丝氨酸保护大肠杆菌抵御月桂酰精氨酸乙酯化合物的结果,(g)为其统计图;(f)为不同浓度的磷脂酰丝氨酸保护金黄色葡萄球菌抵御月桂酰精氨酸乙酯化合物的结果,(h)为其统计图;(i)为相同浓度的磷脂酰胆碱、磷脂酰乙醇胺以及磷脂酰丝氨酸分别保护大肠杆菌抵御月桂酰精氨酸乙酯化合物的结果,(k)为其统计图;(j)为相同浓度的磷脂酰胆碱、磷脂酰乙醇胺以及磷脂酰丝氨酸分别保护大肠杆菌抵御月桂酰精氨酸乙酯化合物的结果,(l)为其统计图。
具体实施方式
结合以下具体实施例和附图,对本发明作进一步的详细说明,本发明的保护内容不局限于以下实施例。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求书为保护范围。实施本发明的过程、条件、试剂、实验方法等,除以下专门提及的内容之外,均为本领域的普遍知识和公知常识,本发明没有特别限制内容。
实施例一:微量肉汤稀释法测lae对细菌最小抑菌浓度(mic)
原理与目的:根据clsi规定的微量肉汤稀释法,药物与细菌在96孔板内共孵育24h后,细菌生长被抑制的最小药物浓度为该药的最小抑菌浓度。
方法:将lae、细菌(鸭疫里默氏杆菌临床分离致病菌株ra‐11、金黄色葡萄球菌atcc29213、和大肠杆菌atcc25922)分别用胰酪胨大豆肉汤培养基(tsb)稀释并加入到96孔板里,另设无细菌的空白对照培养基ck1和添加lae(1000μg/ml)的培养基ck2以及不含药物lae但含的细菌正常生长的对照培养基ck3。将96孔板放入37℃温箱中孵育24h后测定各孔625nm处的吸光光度值。与空白对照培养基ck1的od625值一致的孔视为细菌无明显生长。细菌无明显生长的药物最低浓度为lae对细菌的最小抑菌浓度mic(minimalinhibitoryconcentration)。将各孔中的液体用逐级稀释法点加在胰蛋白胨大豆琼脂培养基(tsa)上,待液体蒸干后倒置放置于37℃培养箱里培养18‐24h后观察菌落形成情况。无菌落形成的药物最低浓度为lae对细菌的最小杀菌浓度mbc(minimalbactericidalconcentration)。
结果如下表1所示,lae对ra‐11的最小杀菌浓度及最小抑菌浓度均为≥16μg/ml,对atcc25922的最小杀菌浓度和最小抑菌浓度均为≥16μg/ml,对atcc29213的最小杀菌浓度和最小抑菌浓度均为≥16μg/ml。
表1lae对三种细菌的体外抗菌效果
注:++为菌液浑浊,有悬浮物;+为菌液较为浑浊;+‐为菌液较为清亮;‐为菌液清亮
实施例二:lae对细菌有效杀菌时间的测定
原理和目的:药物与细菌共孵育,每隔一定时间取出一部分样品进行细菌平板计数,从而获得细菌在药物作用下的生长曲线即为该药物的时间杀菌曲线。
方法:将对数期的细菌与不同浓度的lae溶液混合,分别在加药后0、0.5、1、1.5、2h取样并10倍逐级稀释点在tsa平板上,37℃条件下培养18‐24h。通过菌落数计算出各时间点各加药组的细菌浓度,得出如图1所示的细菌生存曲线图。
结果分析:在16μg/ml浓度下,lae能在30min内将鸭疫里默氏杆菌、大肠杆菌完全杀灭,金黄色葡萄球菌的数量减少6个数量级;在30min内,在32μg/ml浓度下,能够将鸭疫里默氏杆菌、金黄色葡萄球菌和大肠杆菌完全杀灭。因此,lae是一种能够快速杀菌的抗菌化合物,作用时间短的优点在于:能够在细菌发生耐药突变之前将其清除,降低细菌被诱导产生耐药的风险。
实施例三:lae诱发细菌耐药实验
原理与目的:细菌在亚抑菌浓度下能够被诱发产生对该药物的耐药菌,通过长期将亚抑菌浓度药物培养的细菌转接到新鲜的含药培养基中来检测该药物诱发细菌产生耐药突变的能力。
方法:对数期的细菌与lae溶液混合于玻璃试管,棉塞封口,放置于37℃、220rpm的恒温摇床培养24h。之后每隔24h检查药物的mic,并将能培养出浑浊菌液的最高药物浓度(即低于mic的最高药物浓度)的菌液以1:100的比例再次加入到含有不同药物浓度的新鲜培养基里,37℃、220rpm培养24h,持续30天。氯霉素为阳性对照组,操作与lae组相同。得出如图2所示的统计图。
结果分析:
如图2(a)所示,对于鸭疫里默氏杆菌,经过30天的连续给药刺激,氯霉素的mic先是呈持续上升趋势,最高升至最初mic的6倍,之后有所波动,但基本高于初始mic。而lae的mic则基本稳定,仅有一天出现了1.5倍于初始mic的情况,其他时间都低于或等于初始mic;
如图2(b)所示,对于金黄色葡萄球菌,经过30天的连续给药刺激,氯霉素的mic从第18天开始出现快速上升之势,最高达到初始mic的10倍,最后稳定在初始mic的8倍。。而lae的mic仅有略微的提升,最终达到初始mic的2倍;
如图2(c)对于大肠杆菌,经过30天的连续给药刺激,氯霉素的mic从第16天开始出现快速上升之势,最后达到初始mic的12倍。而lae的mic仅有略微的提升,最终达到初始mic的2倍。此结果显示,氯霉素诱发鸭疫里默氏杆菌、大肠杆菌、金黄色葡萄球菌耐药的能力较高,lae基本不诱发鸭疫里默氏杆菌的耐药,对大肠杆菌、金黄色葡萄球菌有轻微诱发耐药作用。lae的这一特性说明其能成为一种优于现有抗生素的抗菌剂。
实施例四:lae对哺乳动物细胞体外毒性的研究
1.lae对哺乳动物细胞毒性试验:
原理和目的:mts为四氮唑蓝盐化合物,能够被活细胞内的脱氢酶还原成有色的甲瓒产物,通过酶标仪测定样品的吸光值转换为样品中细胞的存活率。
方法:细胞毒性实验:将处于对数生长期的细胞以5000/孔的量接种于96孔板中,待细胞贴壁后,将培养基换成新鲜的含不同lae浓度的培养基,置于细胞培养箱37℃处理72h,每孔加入20μlmts,37℃孵育1h,用酶标仪测定每孔在490nm的吸光值,未给药对照组的od490在0.8‐1之间时,数据可靠性最高。计算每孔的细胞存活率并制成如图3(a)所示的图。2.lae对兔红细胞溶血性试验:
原理和目的:红细胞溶血后会释放出内容物,包括血红蛋白等有色物质,离心后,细胞碎片沉降,有色物质保留在上清中,通过检测上清的吸光值可以转换为细胞溶血程度。
方法:耳动脉取血法收集新鲜兔全血,加入肝素抗凝,离心、清洗后取积压的红细胞配制2%红细胞悬液,以每孔100μl的量加入到96孔板中。实验组加入等体积的不同浓度lae溶液,空白对照组加入等体积pbs,阳性对照组加入等体积1%tritonx‐100,37℃恒温箱中放置1h。离心取上清,用酶标仪测定450nm处的吸光值,并按照以下公式计算溶血率:
得到如图3(b)所示的统计图。
结果分析
如图3(a)所示,所有检测的细胞在药物处理72h后存活率均很高,即使在给药浓度远高于mic条件下,细胞仍有80%以上的存活率。根据药典规定,溶血率大于5%的样品具有溶血性。
如图3(b)所示,lae的半致溶血浓度为细菌mic的2倍。该实验说明,体外条件下,lae对哺乳动物细胞的毒性极低,对细菌有着很好的选择性。
实施例五:lae对禽畜的细菌性疾病防治效果
1.lae对感染鸭疫里默氏杆菌雏鸭的口服治疗效果
原理与目的:雏鸭感染细菌后,口服lae观察动物的存活情况,研究lae对已患细菌性疾病家禽的治疗效果。
方法:雏鸭25只随机分成5组,每组5只。将鸭疫里默氏杆菌以4×106cfu的量皮下注射接种在四组雏鸭腿部设为感染组,另一组不做任何处理设为空白组。12h后4个感染组分别以灌胃的形式给不同剂量的lae水溶液或者空白水溶液对照组,在给药后1h、7h、12h、24h、48h、72h、96h分别进行观察并记录死亡情况,96h动物存活情况见表2。
表2:口服lae对已感染鸭疫李默氏杆菌的雏鸭的治疗效果
注:试验组为感染致病菌并给不同浓度lae的动物;
空白组为未接触致病菌的动物;
对照组为感染致病菌只给空白水溶液但未给药lae水溶液的动物。
结果分析:雏鸭在感染鸭疫里默氏杆菌后,若不加以药物治疗则在48h内全部死亡;若在感染后12h进行lae水溶液灌胃治疗,则感染后96h的生存率达到60%,考虑到4‐8天的治疗周期以及lae治疗溶剂的成本,口服剂量至少为8‐16mg/kgbw的lae能有效降低感染鸭疫李默氏杆菌雏鸭的发病率,符合生产的需要。因此,lae大大提高了感染雏鸭的生存率。
2.lae对雏鸭感染鸭疫里默氏杆菌的防治效果
原理与目的:感染细菌前,雏鸭口服lae,感染后继续每日口服lae,观察动物存活情况,研究lae作为抗菌剂保护家禽不受细菌侵染的效果。
方法:雏鸭50只随机分成5组,每组10只。其中2个组以灌胃的形式给空白水溶液做未给药组,另外3组以灌胃的形式给lae水溶液做试验组。第一次给药后8h将鸭疫里默氏杆菌以4×106cfu的量皮下注射接种在三组实验组以及一组未给药对照组的雏鸭腿部为感染组,另1组未给药组不做任何处理做未感染组(即不感染细菌也不给药作为空白)。分别在感染后12h、24h、48h对未感染组和感染未给药组以灌胃的形式给空白水溶液,实验1、2、3组分别给不同浓度的lae水溶液。在给药后1h、7h、12h、24h、48h、72h、96h分别进行观察并记录死亡情况,96h的存活情况结果见表3。
表3:口服lae对雏鸭抵抗鸭疫李默氏杆菌感染的防治效果。
注:试验组为先给不同浓度lae后感染致病菌的动物;
空白组为未接触致病菌且未给药lae的动物;
对照组为感染致病菌但未给药lae的动物。
结果分析:在雏鸭感染细菌前口服lae相比于感染后给药,这种摄取方式能够将雏鸭的生存率再次提高。口服剂量为8‐40mg/kgbw的lae已经能有效防治雏鸭感染鸭疫李默氏杆菌。持续给药能更大程度地发挥防治疾病效果。溶剂对照组的10只雏鸭在96h内全部死亡,给药组在实验结束时仍有9只存活,生存率达到90%。考虑到4‐8天的治疗周期以及lae治疗溶剂的成本,因此40mg/kgbw的剂量范围已经是生产需要的上限。
3.lae腹腔给药对感染大肠杆菌小鼠的治疗效果研究
原理与目的:小鼠腹腔注射大肠杆菌模拟家畜感染革兰氏阴性菌疾病,感染后腹腔给药观察小鼠存活率、检测lae对小鼠体内致病菌的清除率,并检测药物对感染小鼠体内炎症因子水平的影响。该实验可以检测lae对于家畜感染革兰氏阴性菌疾病后的治疗效果。
方法:50只balb/c小鼠随机分为5组,每组10只。将对数期的大肠杆菌以108cfu的量注射到4组小鼠的腹腔,另一组不做任何处理设为未感染组。1h后1个感染组腹腔注射0.5ml的生理盐水,另外三个感染组分别注射不同浓度的lae溶液。统计24h后的小鼠存活情况,得到表4的结果。
另外60只balb/c小鼠随机分为6组,每组10只。将对数期的大肠杆菌以108cfu的量注射到5组小鼠的腹腔,另一组不做任何处理设为未感染组。1h后1个感染组腹腔注射0.5ml生理盐水,另外4个感染组分别注射不同浓度lae溶液。在给药后的24h颈椎脱臼法处死小鼠,用无菌pbs冲洗小鼠腹腔,并收集腹腔液。用逐级稀释法将腹腔液点在tsa平板上,37℃倒置培养18‐24h,统计并计算各组小鼠腹腔液中的致病菌浓度。分别用il‐1β、tnf‐α的elisa试剂盒检测腹腔液中的il‐1β、tnf‐α蛋白水平。结果见表5。
表4:腹腔给药lae对已感染大肠杆菌的哺乳动物的治疗效果
注:
试验组为感染致病菌并口服不同浓度lae的动物;
空白组为未接触致病菌的动物;
对照组为感染致病菌但未给药lae组。
表5:腹腔给药lae对已感染大肠杆菌的哺乳动物体内致病菌的清除效果
注:
试验组为感染致病菌并给不同浓度lae的动物;
空白组为未接触致病菌的动物;
对照组为感染致病菌但未给药lae的动物。
结果分析:小鼠感染大肠杆菌后,注射生理盐水组的10只动物在11h内全部死亡,注射lae溶液的小鼠24h后存活率为70%,说明lae对动物起到了治疗作用,且清除了小鼠体内的致病大肠杆菌,降低了由于细菌感染而升高的炎症因子水平。
腹腔注射2.5‐25毫克每千克体重的lae能够提升感染大肠杆菌小鼠的存活率,腹腔注射1‐25毫克每千克体重的lae能够清除感染小鼠体内的致病菌。
4.lae口服给药对感染革兰氏阴性菌、阳性菌小鼠的治疗效果。
原理与目的:能够口服摄取并发挥疗效,是对抗菌剂的较高要求,因此我们用小鼠代表家畜,分别用革兰氏阴性菌大肠杆菌、革兰氏阳性菌金黄色葡萄球菌来感染小鼠,之后通过口服lae来评估药物对动物的治疗效果。
方法:60只balb/c小鼠随机分为6组,每组10只。将对数期的金黄色葡萄球菌以108cfu的量注射到小鼠的腹腔。1h后分别灌胃0.5ml生理盐水、不同药物浓度的lae水溶液或者是头孢唑林水溶液,在给药后的24h颈椎脱臼法处死小鼠,用无菌pbs冲洗小鼠腹腔,并收集腹腔液。用逐级稀释法将腹腔液点在tsa平板上,37℃倒置培养18‐24h。统计并计算各组小鼠腹腔液中致病菌的浓度,结果见表6。
表6:口服lae对哺乳动物体内革兰氏阳性致病菌的清除效果
注:
试验组为感染致病菌并口服给药不同浓度lae的动物;
头孢唑林组为感染致病菌并口服头孢唑林水溶液的动物;
空白组为未接触致病菌的动物;
对照组为感染致病菌但未给药的动物。
30只balb/c小鼠随机分为6组,每组5只。将对数期的大肠杆菌以108cfu的量注射到小鼠的腹腔。1h后5组分别口服灌胃0.5ml生理盐水、不同浓度lae水溶液和氨苄青霉素水溶液,在给药后的24h颈椎脱臼法处死小鼠,用无菌pbs冲洗小鼠腹腔,并收集腹腔液。用逐级稀释法将腹腔液点在tsa平板上,37℃倒置培养18‐24h。统计并计算各组小鼠腹腔液中的致病菌浓度,结果见表7。
表7:口服lae对哺乳动物体内革兰氏阴性致病菌的清除效果
注:
试验组为感染致病菌并口服给药不同浓度lae的动物;
氨苄青霉素霉素组为感染致病菌并口服氨苄青霉素水溶液的动物;
空白组为未接触致病菌的动物;
对照组为感染致病菌但未给药的动物。
结果分析:小鼠在感染细菌后口服lae,lae能够减少感染小鼠体内的大肠杆菌、金黄色葡萄球菌量,口服2.5‐25毫克每千克体重的lae能够清除患病小鼠体内的致病革兰氏阳性菌金黄色葡萄球菌;口服0.625‐10毫克每千克体重的lae能够清除患病小鼠体内的致病革兰氏阴性菌大肠杆菌。清除效果与抗生素的疗效相当,说明lae可以以口服给药的方式治疗哺乳动物的革兰氏阴性菌、革兰氏阳性菌疾病。
综上结果,lae可以口服治疗、预防家禽感染细菌性疾病;lae可以口服治疗家畜感染革兰氏阴性菌、革兰氏阳性菌疾病;lae可以腹腔给药治疗家畜感染细菌性疾病。
实施例六:lae对禽畜的毒性研究
1.lae口服给药对樱桃鸭雏鸭的毒性研究
原理与目的:每日一次的口服四倍于有效治疗浓度的lae一周,观察动物精神状态、存活率和体重增长情况,检测脏器毒性。
方法:雏鸭20只随机分成2组,每组10只。其中a组以灌胃的形式给空白水溶液,b组以灌胃的形式施加四倍于有效治疗浓度的lae水溶液,每隔24小时给一次药,连续给药五天,持续观察7天并记录实验动物临床表现情况得到如图4(a)所示的生存率统计图,并于实验结束时取空白组与最高药物剂量组实验动物的心、肝、脾、肾组织进行病理学分析。得到如图4(f)所示的脏器毒性结果。并统计如图4(b)所示的7天内各组实验动物平均日增重。
2.lae口服给药对动物急性、亚急性毒性及体内积累量研究
原理与目的:研究lae口服对动物的长期毒性以及药物在体内的积累量,从而评价lae的安全性。对药物在动物体内积累量的研究分析lae是否能作为无残留的添加剂。
方法:雏鸭急性毒性试验:雏鸭20只随机分为两组,每日进行灌胃,实验组为lae水溶液,空白对照组为同体积的水。口服7天,进行体重测量,对心、肝、脾、肺、肾进行h&e染色;小鼠亚急性毒性试验:20只小鼠随机分为两组,每组10只。每日对小鼠进行灌胃给药,实验组为lae水溶液,空白对照组为同体积的水。每周对小鼠体重进行称量,90天后于最后一次给药后24h处死小鼠,对心、肝、脾、肺、肾进行称重、h&e染色并用hplc检测lae在各组织器官中的残留量。
结果分析:
(1)雏鸭急性毒性试验:无实验动物死亡,所有给药组在形态、精神状态、毛色等方面未表现出与对照组的异常。
(2)脏器外观无任何异常,心、肝、脾、肾组织切片的h&e染色未表现出与对照组的异常。空白对照组平均日增重21.38g,最高药物剂量组平均日增重22.57g,药物不对鸭子的增重造成负面影响。在四倍于有效防治鸭疫里默氏杆菌病药物剂量下,lae对樱桃鸭雏鸭无口服毒性;
(3)小鼠亚急性毒性试验:如图4(d)所示经过90天的口服喂药,实验组小鼠体重增长在第1周以及第4到10周相对于空白组呈现出显著性提升。图e显示lae对脏器系数没有明显影响,图g各器官的h&e染色结果显示lae对实验动物脏器没有明显毒性。而lae在各组织器官中的残留量(图c)也均低于10μg/kg(欧盟对未规定兽药的检出量要求)。
以上结果说明,哺乳动物口服lae3个月对动物的毒性极低,能一定程度上促进动物体重增长,并且有极低的药物残留。以上结果说明,lae对动物的急性、亚急性毒性均极低,长期服用在体内的积累量极低,符合抗菌剂的安全、环保要求。
实施例七:lae化合物作为饲料添加剂用于哺乳动物的疾病预防
将所述lae化合物的有效成分按照饲料总重量计,以0.01%~1.0%直接将本品添加到小鼠饲料中;或将本品与载体混合制成预混剂;或与其它饲料添加剂或饲料原料混合制成预混料、浓缩料形式饲喂小鼠。
选用6周龄小鼠50只,按体重相近的原则随机分成5个处理组。对照组饲喂玉米小麦豆粕型日粮,试验组饲喂玉米小麦豆粕型并添加饲料总重量0.01%、0.1%、1%的lae化合物,饲养7天后,测定小鼠对大肠杆菌的抗病能力。结果见表8。
表8:饲料添加lae对哺乳动物的疾病防治
注:
试验组是接触致病菌并添加不同剂量lae化合物的饲料;
空白组未接触致病菌;
对照组是接触致病菌但未添加lae化合物的饲料
从上表可见,所有试验组的小鼠存活率比较对照组都有显著上升,其中最佳组为试验3组,成活率为80%,未添加lae的对照组实验动物全部死亡,说明lae化合物作为饲料添加剂对哺乳动物疾病具有防治作用。考虑到治疗周期以及lae治疗剂的成本,lae作为药物或饲料添加剂的有效浓度为0.01‐1%已经能有效防治发病,符合生产的需要。
实施例八、lae化合物作为营养能量添加剂用于哺乳动物的营养生长
按照实施例七确定的lae化合物的浓度适用范围,在各组日粮配方相同的基础上,试验1、2、3组分别将lae化合物以0.3%、0.6%、0.9%质量比添加于全价配合饲料中,对照组不添加任何药物。40只6周龄balb/c小鼠随机分为4组,正式试验开始时称取各组第1天的体重,15日后再次称取小鼠体重。结果如表9所示:
表9:饲料添加lae对哺乳动物生长的影响
注:
试验组是添加不同剂量lae化合物的饲料;
对照组是未添加lae化合物的饲料
结果分析:从上表可见,试验初始重各组间差异不显著。从15天平均个体净增重看,2组明显高于1、3组。
由此表明,试验期间与对照组比,在小鼠饲料中添加0.6%lae化合物,显著提高小鼠的平均增重9.64%。因此,饲料添加lae化合物能够促进哺乳动物的生长。
实施例九:lae化合物作为饲料添加剂用于雏鸭的疾病防治
将所述lae化合物的有效成分按照饲料总重量计,为0.01%~1.0%,直接将本品添加到雏鸭饲料中;或将本品与载体混合制成预混剂;或与其它饲料添加剂或饲料原料混合制成预混料、浓缩料形式饲喂雏鸭。
选用14日龄樱桃雏鸭50只,按体重相近的原则随机分成5个处理组。每个处理设1个重复(栏),每栏10只(雌雄各半)。对照组饲喂玉米豆粕型日粮,试验组饲喂玉米豆粕型并添加饲料总重量0.01%、0.1%、1%的lae化合物,饲养7天后,测定雏鸭对鸭疫里默氏杆菌病抗病能力。结果见表10。
表10:饲料添加lae对雏鸭的疾病防治效果:
注:
试验组是添加不同剂量lae化合物的饲料;
空白组未接触致病菌;
对照组是未添加lae化合物的饲料
结果分析:从上表可见,所有试验组的雏鸭存活率比较对照组都有显著上升,其中最佳组为试验3组,成活率为90%,未添加lae的对照组实验动物全部死亡,说明lae化合物作为饲料添加剂对雏鸭疾病具有防治作用,考虑到治疗周期以及lae治疗剂的成本,因此lae作为药物或饲料添加剂的有效浓度为0.01‐1%、优选0.1‐1%时能有效防治发病,符合生产的需要。
实施例十、lae化合物作为营养能量添加剂用于雏鸭的疾病预防和营养生长
按照实施例九确定的lae化合物的浓度适用范围,在各组日粮配方相同的基础上,试验1、2、3组分别将lae化合物以0.3%、0.6%、0.9%质量比添加于全价配合饲料中,对照组不添加任何药物。试验开始时称取各组动物第1天体重,15日后再次称取体重并测定各组对鸭疫里默氏杆菌病抗病能力。结果如表11所示:
表11:饲料添加lae对雏鸭的疾病防治及营养生长效果
注:
试验组是添加不同量lae化合物的饲料;
对照组是未添加lae化合物的饲料
结果分析:由此表明,试验期间与对照组比,在雏鸭饲料中添加0.3%‐0.9%的lae均能提升雏鸭的平均增重,其中0.6%lae化合物增重作用最明显,相较于对照组显著提高雏鸭的平均增重11.5%。因此,lae化合物既能减少雏鸭由鸭疫里默氏杆菌病引起的死亡,又能提高雏鸭生长性能,促进其营养生长。
实施例十一:lae化合物作为营养能量添加剂用于水产动物的疾病预防和营养生长
选用体重为42.1±0.24g的240尾罗非鱼分为4个处理组,分别添加不同梯度水平的lae化合物,每组3个重复,每重复20尾鱼。通过8周的生长试验,来评价lae化合物对罗非鱼生长性能的影响。饲养同时,为探究lae对水产动物抗细菌性疾病的能力,将喂养含有lae饲料8周的罗非鱼进行温和气单胞菌感染,以感染后罗非鱼的存活率来体现其抗病力。结果见表12。
表12饲料添加lae对罗非鱼营养生长的影响
注:
试验组是添加不同剂量lae的饲料;
对照组是未添加lae化合物的饲料
表12数据表明,在罗非鱼的饲料中添加lae化合物可以提高相对增重率3.03%、6.23%、3.88%和特定生长率5.69%、12.32%、7.1%(p<0.05),降低饲料系数2.36%、3.15%、1.57%(p<0.05),促进了罗非鱼的生长。
同时,抗感染实验结果显示,食用未含lae饲料的试验鱼全部死亡,食用含有lae的罗非鱼存活率分别为61.67%、78.33%、88.33%。说明添加0.01%‐1%lae的确能够提升鱼的抗感染能力。
实施例十二:lae通过去极化细菌细胞膜引发细菌死亡
1.sem观察lae对细菌形态的影响
原理和目的:经过固定、脱水、喷金后的样品在扫描电镜下可以观察到表面形貌,该技术常用来分析化学材料、生物材料的微观表面形貌。
方法:用1×mic的lae处理对数期的大肠杆菌15min。8000rpm离心5min,弃上清,加入2.5%的戊二醛固定2h,pbs吹洗三遍,每次10min,1%的锇酸固定1h,pbs吹洗三遍,每次10min。依次用50%、70%、90%的乙醇各脱水10min,无水乙醇脱水5min。临界点干燥法干燥2h。将干燥后的粉末粘在载物台上,喷金40min。上机用扫描电镜观察并拍照。
2.荧光染料染色研究lae对原核、真核细胞膜极性的影响差异。
原理和目的:disc3(5)、disc2(3)荧光染料是细胞膜极性染料,细胞膜由于存在内外电势差,经过disc2(3)染色后发射红色荧光,一旦电势差消失即发生去极化反应,disc2(3)则会发射绿色荧光,通过计算红、绿荧光值的比值可以得到细胞发生去极化反应的强弱。
方法:对数期的ra‐11用pbs稀释到od600=0.05,加入disc3(5)荧光染料,37℃避光放置1h后加入kcl溶液。分别加入不同浓度的lae溶液使其终浓度分别为0.5×mic、mic,分别取多粘菌素b、万古霉素、pbs为阳性对照、阴性对照和空白对照。以622nm波长的光为激发光,分别在加药后0、2、10、20、30、40、50、60min测量670nm处的荧光值,做出如图5(c)所示的统计图。
对数期的金黄色葡萄球菌用pbs稀释到od600=0.05,加入disc3(5)荧光染料,37℃避光放置1h后加入kcl溶液。分别加入不同浓度的lae溶液使其终浓度分别为0.5×mic、mic,分别取多粘菌素b、万古霉素、pbs为阳性对照、阴性对照和空白对照。以622nm波长的光为激发光,分别在加药后0、2、10、20、30、40、50、60min测量670nm处的荧光值,做出如图5(d)所示的统计图。
对数期的大肠杆菌用pbs稀释到od600=0.05,加入disc3(5)荧光染料,37℃避光放置1h后加入kcl溶液。分别加入不同浓度的lae溶液使其终浓度分别为0.5×mic、mic,分别取多粘菌素b、万古霉素、pbs为阳性对照、阴性对照和空白对照。以622nm波长的光为激发光,分别在加药后0、2、10、20、30、40、50、60min测量670nm处的荧光值,做出如图5(e)所示的统计图。
新鲜的兔红细胞计数并稀释到5×107个/ml,加入disc3(5)荧光染料,37℃避光放置1h后加入kcl溶液。分别加入不同浓度的lae溶液使其终浓度分别为大肠杆菌的0.5×mic、mic,以622nm波长的光为激发光,分别在加药后0、2、10、20、30、40、50、60min测量670nm处的荧光值,做出如图5(f)所示的统计图。
对数期的鸭疫李默氏杆菌稀释到5×107cfu/ml,加入不同浓度的lae溶液使其终浓度分别为0.5×mic、mic、2×mic。另外取加cccp组为阳性对照,加pbs组为阴性对照。加入dioc2(3)处理1小时,流式细胞仪检测每个样品的红、绿荧光值,得到如图5(g),通过计算比值来分析细菌细胞膜发生去极化的程度,做出如图5(j)的统计图。
对数期的金黄色葡萄球菌稀释到5×107cfu/ml,加入不同浓度的lae溶液使其终浓度分别为0.5×mic、mic、2×mic。另外取加cccp组为阳性对照,加pbs组为阴性对照。加入dioc2(3)处理1小时,流式细胞仪检测每个样品的红、绿荧光值,得到如图5(h),通过计算比值来分析细菌细胞膜发生去极化的程度,做出如图5(k)的统计图。
对数期的大肠杆菌稀释到5×107cfu/ml,加入不同浓度的lae溶液使其终浓度分别为0.5×mic、mic、2×mic。另外取加cccp组为阳性对照,加pbs组为阴性对照。加入dioc2(3)处理1小时,流式细胞仪检测每个样品的红、绿荧光值,得到如图5(i),通过计算比值来分析细菌细胞膜发生去极化的程度,做出如图5(l)的统计图。结果分析:扫描电镜结果显示,用1×miclae处理大肠杆菌15min,菌体表面出现凹陷甚至空洞,说明lae可以破坏细菌的完整性从而引发细菌死亡。对于鸭疫里默氏杆菌和大肠杆菌,所有lae施加组以及阳性对照多粘菌素b组均能在短时间内使荧光值大幅度提升,说明lae能够使细胞膜发生去极化反应,阴性对照万古霉素组以及空白对照组荧光值没有明显变化;对于金黄色葡萄球菌,所有lae施加组以及阳性对照多粘菌素b组均能在短时间内使荧光值大幅度提升,说明lae能够使细胞膜发生去极化反应,阴性对照万古霉素组以及空白对照组荧光值没有明显变化;对于哺乳动物红细胞,只有lae的浓度达到大肠杆菌mic的2倍时才发生轻微的去极化现象。该实验结果说明,lae可能通过对细菌细胞膜产生去极化作用使膜破裂从而发挥杀菌作用,并且该作用对原核细胞的作用要强于真核细胞,这与其杀菌作用强、真核细胞毒性较低的现象所一致。流式结果与分光光度计检测结果相一致。
实施例十三:lae通过结合细菌细胞膜上的磷酯酰丝氨酸引发细菌死亡
1.等温滴定量热法检测lae与磷脂的结合作用
原理和目的:当两个分子发生结合时,会有热量的吸收或释放,通过检测两个分子相互滴定时的热量变化可确定该两分子是否有结合反应的发生。
方法:将lae水溶液在itc200仪器上分别滴定磷脂酰胆碱(pc)水溶液、磷脂酰乙醇胺(pe)水溶液、磷酯酰丝氨酸(ps)水溶液,记录各自的热量变化曲线并计算lae与各磷脂分子的结合常数。得到如图6a/b/c/d的曲线。
结果:只有磷酯酰丝氨酸和lae在滴定过程中的热量变化图符合两分子结合的热量变化,两者的结合常数约为2.95e5±2.48e5m‐1。而磷脂酰胆碱和磷脂酰乙醇胺没有检测到结合反应。说明lae能够和细菌膜表面较多的酸性磷脂如磷脂酰丝氨酸结合,不和中性磷脂发生结合。2.磷脂保护试验
原理和目的:根据以上试验我们初步可以判断lae与磷酯酰丝氨酸分子有结合反应,如果这种结合是lae发挥杀菌功能的必要因素,那么当我们在lae和细菌共孵育的体系中添加一定量的ps,则会降低lae的杀菌功效,并且添加pe或者pc都不能起到相同的作用效果。
方法:+我们在革兰氏阴性菌大肠杆菌、革兰氏阳性菌金黄色葡萄球菌中分别提前添加了低浓度或高浓度的磷酯酰丝氨酸ps。之后加入相同浓度的lae水溶液,于37℃培养24h。对每个样品进行平板活菌计数,于37℃培养箱倒置培养18‐20小时后拍照得到如图6e大肠杆菌、图6f金黄色葡萄球菌分别在ps保护下抵抗lae的情况,图6g/h为其各自的统计图。除此之外,我们还用相同浓度的磷脂酰胆碱pc、磷脂酰乙醇胺pe、磷酯酰丝氨酸ps重复以上试验,得到图6i大肠杆菌、图6j金黄色葡萄球菌分别在磷脂保护下抵抗lae的情况,图6k/l为其各自的统计图。
结果:与预期一致,只有磷脂酰丝氨酸ps能够保护细菌不受lae的杀伤作用。可以得出lae是通过与ps的结合来发挥杀菌作用的。
实施例十四、lae与抗生素对腹泻仔猪的治疗效果的比较
申请人委托河南省某大型养猪场,对其农场的118头出现腹泻的仔猪进行给药sy(即本发明的lae)实验。
另设置庆大霉素给药组作为平行对照。
每天早(7:00)、中(12:00)、晚(18:00)3次,对病猪进行灌药。
评价标准:腹泻治好后无需用药的动物,计为剩余存活的动物,即试验停止;
仔猪用药后无效死亡的动物,计为死亡的动物,即试验停止。
结果如表13所示。
表13
如上表所示,使用庆大霉素治疗的仔猪,平均治愈率为77.5%。然而,该剂量已经远远超过常规抗生素的使用剂量,预示着为了获得该治愈率,仔猪体内的抗生素残留将显著超标。
使用lae治疗的仔猪,最小剂量10mg/kg的治愈率为72.2%,最大剂量50mg/kg的治愈率为78.57%,均远远超过相同剂量的抗生素的治愈率(10mg/kg的庆大霉素的治愈率未显示),这表明lae在治疗仔猪腹泻上,相比于庆大霉素,其相同给药剂量的治愈率更高,且因其良好的生物代谢特性,将预示仔猪体内不存在任何有害药物的残留,为替代兽用抗生素提供了良好的方向。
- 还没有人留言评论。精彩留言会获得点赞!