一种利用膜循环生物反应器分阶段制备L‑鸟氨酸和丁二酸的方法与流程
本发明属于生物化工领域,具体涉及一种利用膜循环生物反应器分阶段制备l-鸟氨酸和丁二酸的方法。
背景技术:
l-鸟氨酸属于碱性氨基酸,是活细胞中重要的代谢物,主要参与生物体内的尿素循环,用于生物体内瓜氨酸、精氨酸、脯氨酸、多胺的生物合成,具有保肝解毒和抗疲劳的功效。近年l-鸟氨酸在医药、保健领域的应用日益广泛,具有良好的市场前景。
微生物直接发酵法是生产l-鸟氨酸的重要来源,菌种主要为谷氨酸棒杆菌的精氨酸缺陷型菌株。专利zl201010286236.8公布了一种有氧发酵制备l-鸟氨酸的方法,以葡萄糖为碳源,l-鸟氨酸产量可达35~45g/l。专利zl201510024099.3公布了一种利用纤维床反应器有氧发酵制备l-鸟氨酸的方法,可连续发酵多批,提高了发酵过程效率。发酵结束后衰老的谷氨酸棒杆菌均被作为固体废渣处理,常被用于生产菌体蛋白饲料等附加值较低的产品,但是近年来的研究表明,谷氨酸棒杆菌在厌氧条件下可将大量葡萄糖转化为丁二酸,这一发现使谷氨酸棒杆菌的应用领域进一步扩大,因此通过有氧-厌氧发酵联产l-鸟氨酸和丁二酸已被证明可行。目前一般采用离心或过滤的方式收集有氧发酵后的菌体,重新补充培养基后厌氧发酵制备丁二酸,但是这些处理方式对无菌洁净环境的要求较高,在工业生产中极易感染杂菌和噬菌体,威胁生产。由此可见开发一种工艺简单的l-鸟氨酸和丁二酸联产的方法对将该技术应用于工业生产至关重要。
技术实现要素:
本发明要解决的技术问题是提供一种利用膜循环生物反应器分阶段制备l-鸟氨酸和丁二酸的方法,以解决现有技术存在的效率低下,溶液感染等问题。
为解决上述技术问题,本发明采用的技术方案如下:
所述的膜循环生物反应器包括发酵罐、中空纤维膜组件和培养基储罐;其中,发酵罐和中空纤维膜组件的进料口连通,中空纤维膜组件的透过液出口通过透过液出口支路与培养基储罐相连,中空纤维膜组件浓缩液出口通过管道与发酵罐连通;各相连管道上均设有阀门;
所述的方法它包括如下步骤:
(1)将培养后的谷氨酸棒杆菌种子液接入发酵罐中的有氧发酵培养基,进行有氧发酵制备l-鸟氨酸;
(2)在步骤(1)中的有氧发酵完成后,将所得有氧发酵液经中空纤维膜组件的进料口泵入中空纤维膜组件中进行循环分离,透过液经中空纤维膜组件的透过液出口流出并收集,用于l-鸟氨酸的提取;浓缩液经中空纤维膜组件的浓缩液出口回流至发酵罐中;持续循环分离,直至发酵罐内的有氧发酵液体积低于中空纤维膜组件膜分离的体积要求;
(3)将厌氧发酵培养基通过透过液出口支路泵入中空纤维膜组件中,经浓缩液出口进入发酵罐中,再通过透过液出口支路泵入去离子水将中空纤维膜组件内残留的厌氧发酵培养基和菌体压入发酵罐中;厌氧发酵培养基和水都泵入完成后,在发酵罐中进行厌氧发酵制备丁二酸;厌氧发酵完成后,将所得厌氧发酵液经中空纤维膜组件的进料口泵入中空纤维膜组件中,透过液从中空纤维膜组件的透过液出口流出并收集,用于丁二酸的提取;浓缩液由中空纤维膜组件的浓缩液出口回流至发酵罐中;持续循环分离,直至发酵罐内的厌氧发酵液体积低于中空纤维膜组件膜分离的体积要求;
(4)完成步骤(3)中操作后,分别对发酵罐和膜组件进行蒸汽和化学消毒处理,为下一批次的分阶段发酵做准备。
在有氧发酵和厌氧发酵完成前,所有连接管道上的阀门都处于关闭状态。
步骤(1)中,所述的培养后的谷氨酸棒杆菌种子液由谷氨酸棒杆菌接种于种子培养基上培养得到;
其中,
培养基配方为:葡萄糖20g/l,k2hpo4·3h2o1.5g/l,kh2po40.5g/l,mgso4·7h2o0.4g/l,feso4·7h2o20mg/l,mnso4·h2o20mg/l,尿素2.5g/l,生物素100μg/l,精氨酸200mg/l,维生素b1200μg/l,ph7.0;110℃下灭菌10min;
培养条件为:摇瓶装液量10%,接种量2%,30℃下200rpm震荡培养10h。
其中,所述的谷氨酸棒杆菌已在中国微生物菌种保藏管理委员会普通微生物中心保藏,保藏编号为cgmccno.3991。该菌株已经在专利“一种高产琥珀酸的谷氨酸棒杆菌”(申请号:201010578530.6)中公开。
步骤(1)中,接入培养后的种子液前,先对发酵罐和有氧发酵培养基进行蒸汽灭菌;蒸汽灭菌的条件为110℃,20min。
步骤(1)中,所述的有氧发酵培养基的配方为:葡萄糖60~90g/l,k2hpo4·3h2o1.0g/l,kh2po41.0g/l,mgso4·7h2o0.25g/l,feso4·7h2o20mg/l,mnso4·h2o20mg/l,(nh4)2so440g/l,zncl21mg/l,cuso40.2mg/l,生物素100μg/l,精氨酸200mg/l,维生素b1200μg/l,ph7.0。
步骤(1)中,所述的有氧发酵的条件为:接种量为3~5%,发酵温度为29~32℃,搅拌速度为300~500rpm;发酵过程中用氨水控制ph为6.7~7.0,并通入无菌空气,通气量为0.5~1.5vvm;发酵至残留葡萄糖低于1g/l时,终止发酵。
步骤(2)中,在有氧发酵完毕前2小时,对中空纤维膜组件进行化学消毒,具体操作如下:
用无菌水配制的4g/lnaoh经透过液出口支路泵入中空纤维膜,循环清洗20min,清洗废水经进料口支路和浓缩液出口支路排出,膜组件随后用无菌水经透过液出口支路泵入将其洗至出水为ph9以下;接着再将无菌水配制的5g/l柠檬酸经透过液出口支路泵入中空纤维膜,循环清洗20min,随后用无菌水将其洗至出水为ph6以上,即完成中空纤维膜的化学消毒。
步骤(2)中,所述的中空纤维膜组件中,中空纤维膜为微滤膜,膜孔径为0.1~0.22μm。
步骤(3)中,所述的厌氧发酵基的配方为:葡萄糖40~80g/l,k2hpo4·3h2o0.5g/l,kh2po40.5g/l,mgso4·7h2o0.5g/l,feso4·7h2o6mg/l,mnso4·h2o6mg/l,生物素200μg/l,维生素b1200μg/l,ph7.0。
步骤(3)中,所述的厌氧发酵的条件为:发酵温度为29~32℃,搅拌速度为150~200rpm;发酵过程中用20%的na2co3控制ph为6.5~6.8,并通入无菌co2气体发酵,通气量为0.1~0.2vvm;发酵至残留葡萄糖低于1g/l时,终止发酵。
步骤(3)中,厌氧发酵培养基泵入发酵罐时,会经过中空纤维膜过滤除菌,因此只需要泵入未消毒的厌氧发酵培养基即可。
步骤(3)中,当厌氧发酵培养基泵入发酵罐后,继续泵入少量去离子水将膜组件内少量残留的培养基压入发酵罐中。
步骤(2)和(3)中,中空纤维膜组件分离发酵液时,每小时的循环体积流速为2~3.0vvh。
步骤(4)中,对发酵罐进行蒸汽灭菌处理和对中空纤维膜组件进行化学消毒的操作与步骤(1)和(2)中相同。
有益效果:
与现有l-鸟氨酸发酵后通过离心回收菌体细胞用于厌氧发酵生产丁二酸相比,本发明可避免菌体细胞暴露在外界空气中,不但大幅降低了染菌几率,还同时完成了对发酵液的除菌预处理,便于后期提取产品;通过膜组件对厌氧发酵培养基进行过滤除菌可替代传统的蒸汽杀菌,减少了能耗。可见,本发明可降低同一菌株分阶段制备l-鸟氨酸与丁二酸的操作难度,缩短了操作周期,适合规模化生产控制。
附图说明
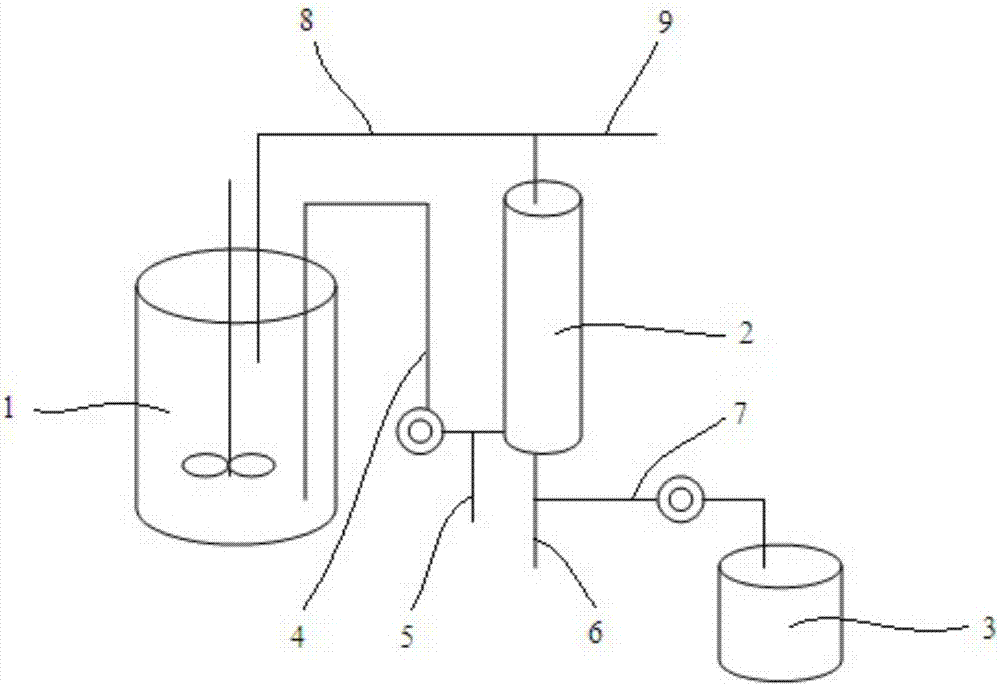
图1为本发明所用膜循环生物反应器的结构示意图;
图2为膜循环生物反应器化学消毒清洗中空纤维膜组件的示意图;
图3为膜循环生物反应器分离发酵液的示意图;
图4为膜循环生物反应器补充厌氧发酵培养基的示意图。
具体实施方式
根据下述实施例,可以更好地理解本发明。然而,本领域的技术人员容易理解,实施例所描述的内容仅用于说明本发明,而不应当也不会限制权利要求书中所详细描述的本发明。
以下实施例采用的是5l发酵罐,蠕动泵泵入速度1vvh=5l/h,通气速度1vvm=5l/min。
实施例1
本发明及其它实施例中所述的膜循环生物反应器如图1所示,它包括反应罐1、中空纤维膜组件2和培养基储罐3;反应罐1和中空纤维膜组件2的进料口4以及浓缩液出口8相连;中空纤维膜组件2下方设有透过液出口6,并通过透过液出口支路7和培养基储罐3相连;其中,浓缩液出口8处和进料口4处分别设有浓缩液出口支路9和进料口支路5,用于排出废水。所有进出口处和支路上均设有阀门。
如图2所示,此时膜循环生物反应器中正对中空纤维膜组件2进行化学清洗消毒。此时,除进料口支路5和浓缩液出口支路9上的阀门外,所有阀门均关闭。
如图3所示,此时膜循环生物反应器正在分离发酵液。此时,发酵罐中的发酵液从进料口进入中空纤维膜组件中,分离得到的透过液通过透过液出口流出,分离得到的浓缩液通过浓缩液出口回流至发酵罐中。此时,进料口支路、浓缩液出口支路和透过液出口支路上的阀门关闭。
如图4所示,此时膜循环生物反应器中正在为发酵罐中补充厌氧发酵培养基。此时,厌氧发酵培养基从发酵培养基储罐中由透过液出口支路经透过液出口泵入中空纤维膜组件中,再经浓缩液出口进入发酵罐中。
实施例2
将5l发酵罐与孔径为0.1μm的中空纤维膜组件串联形成膜循环生物反应器。将培养好的种子液接入已经经过蒸汽灭菌处理的发酵罐(装液量为3l)中进行有氧发酵,有氧发酵培养基中葡萄糖浓度为60g/l,接种量为3%,发酵温度29℃,发酵过程中控制ph为6.7,无菌空气的通气量为0.5vvm,搅拌速度300rpm,发酵至40h,残留葡萄糖低于1g/l时,终止发酵。发酵液中产l-鸟氨酸18.8g/l。打开发酵罐与膜组件相连的阀门,使发酵罐与膜组件相连,发酵液通过蠕动泵进入膜组件进行循环分离,循环流速体积流速为2vvh,分离出2.9l发酵液用于l-鸟氨酸的提取,细胞截留率为99%。
将通入的无菌空气切换为无菌co2气体,体积为3l的葡萄糖浓度为40g/l的厌氧发酵培养基由膜组件的滤出液出口泵入膜组件,同时打开由膜组件返回发酵罐的阀门,泵入时的体积流速为3vvh,经过中空纤维膜过滤的厌氧培养基将被拦截在膜组件内的细胞反冲入发酵罐中,当培养基输送完毕后,继续泵入200ml去离子水将膜组件内少量残留的培养基和细胞压入发酵罐中,随后关闭膜组件与发酵罐相连的所有阀门,并对膜组件进行化学消毒清洗。厌氧发酵温度29℃,发酵过程中控制ph为6.5,无菌co2气体的通气量为0.1vvm,搅拌速度150rpm,发酵28h至残留葡萄糖低于1g/l时,丁二酸产量为28.4g/l,再次打开相连的阀门,使发酵罐与膜组件相连,发酵液通过蠕动泵进入膜组件进行循环分离,泵入时的体积流速为3vvh,分离出3.1l发酵液用于丁二酸的提取,细胞截留率为99%。
实施例3
将5l发酵罐与孔径为0.22μm的中空纤维膜组件串联形成膜循环生物反应器。将培养好的种子液接入已经经过蒸汽灭菌处理的发酵罐(装液量为3l)中进行有氧发酵,有氧发酵培养基中葡萄糖浓度为80g/l,接种量为5%,发酵温度30℃,发酵过程中控制ph为6.8,无菌空气的通气量为1.0vvm,搅拌速度500rpm,发酵至48h,残留葡萄糖低于1g/l时,终止发酵。发酵液中产l-鸟氨酸26.8g/l。打开发酵罐与膜组件相连的阀门,使发酵罐与膜组件相连,发酵液通过蠕动泵进入膜组件进行循环分离,循环流速体积流速为2.5vvh,分离出2.85l发酵液用于l-鸟氨酸的提取,细胞截留率为98%。
将通入的无菌空气切换为无菌co2气体,体积为2.5l的葡萄糖浓度为60g/l的厌氧发酵培养基由膜组件的滤出液出口泵入膜组件,同时打开由膜组件返回发酵罐的阀门,泵入时的体积流速为2vvh,经过中空纤维膜过滤的厌氧培养基将被拦截在膜组件内的细胞反冲入发酵罐中,当培养基输送完毕后,继续泵入300ml去离子水将膜组件内少量残留的培养基和细胞压入发酵罐中,随后关闭膜组件与发酵罐相连的所有阀门,并对膜组件进行化学消毒清洗。厌氧发酵温度30℃,发酵过程中控制ph为6.8,无菌co2气体的通气量为0.2vvm,搅拌速度200rpm,发酵36h至残留葡萄糖低于1g/l时,丁二酸产量为42.1g/l,再次打开相连的阀门,使发酵罐与膜组件相连,发酵液通过蠕动泵进入膜组件进行循环分离,泵入时的体积流速为3vvh,分离出2.7l发酵液用于丁二酸的提取,细胞截留率为98%。
实施例4
将5l发酵罐与孔径为0.15μm的中空纤维膜组件串联形成膜循环生物反应器。将培养好的种子液接入已经经过蒸汽灭菌处理的发酵罐(装液量为3l)中进行有氧发酵,有氧发酵培养基中葡萄糖浓度为90g/l,接种量为4%,发酵温度32℃,发酵过程中控制ph为7.0,无菌空气的通气量为1.5vvm,搅拌速度300rpm,发酵至58h,残留葡萄糖低于1g/l时,终止发酵。发酵液中产l-鸟氨酸34.5g/l。打开发酵罐与膜组件相连的阀门,使发酵罐与膜组件相连,发酵液通过蠕动泵进入膜组件进行循环分离,循环流速体积流速为3vvh,分离出2.9l发酵液用于l-鸟氨酸的提取,细胞截留率为99%。将通入的无菌空气切换为无菌co2气体,体积为2.0l的葡萄糖浓度为80g/l的厌氧发酵培养基由膜组件的滤出液出口泵入膜组件,同时打开由膜组件返回发酵罐的阀门,泵入时的体积流速为3vvh,经过中空纤维膜过滤的厌氧培养基将被拦截在膜组件内的细胞反冲入发酵罐中,当培养基输送完毕后,继续泵入200ml去离子水将膜组件内少量残留的培养基和细胞压入发酵罐中,随后关闭膜组件与发酵罐相连的所有阀门,并对膜组件进行化学消毒清洗。厌氧发酵温度32℃,发酵过程中控制ph为7.0,无菌co2气体的通气量为0.1vvm,搅拌速度150rpm,发酵48h至残留葡萄糖低于1g/l时,丁二酸产量为53.3g/l,再次打开相连的阀门,使发酵罐与膜组件相连,发酵液通过蠕动泵进入膜组件进行循环分离,泵入时的体积流速为2vvh,分离出2.2l发酵液用于丁二酸的提取,细胞截留率为99%。
- 还没有人留言评论。精彩留言会获得点赞!