肉苁蓉多糖在制备治疗骨关节炎药物方面的应用的制作方法
本发明属于骨疾病治疗技术领域,尤其涉及肉苁蓉多糖在制备治疗骨关节炎药物方面的应用。
背景技术
骨关节炎是一种退行性骨关节疾病,是中老年人常见、多发的关节病,以关节软骨生化代谢异常,进行性变性和消失,关节边缘和软骨下骨质产生反应性变化,使得软骨组织产生变化,关节囊纤维增生,并最终导致关节疼痛和功能丧失。骨关节炎是一种复杂的慢性疾病,如何治疗依然是发明人面临的最大的问题。非甾体类抗炎药(nsaids)在临床上被用来减少炎症,但其对治疗和预防骨关节炎骨损伤的功效较弱。但是并不能阻止骨关节炎最主要病理进展,且长期服用者的胃肠道、肝和肾脏的毒副作用也不容忽视。因此,急需开发新型的补充和替代药物,以预防炎症和关节损伤,减少不良反应的产生。此外,活性氧(ros)与破骨细胞的形成有关,并可能有助于骨关节炎的发展。一些研究发现,nrf2抗氧化不足会增加ros水平,并促进核因子-κb配体(rankl)诱导破骨细胞分化的受体活化剂。细胞代谢过程中活性氧(ros)的积累促进破骨细胞的增殖和分化,在骨关节炎中起着重要的作用。因此,减少破骨细胞分化过程中的ros生成可考虑作为治疗骨关节炎的备选策略。
破骨细胞来源于单核细胞/巨噬细胞造血谱系,是唯一进行骨吸收的多核细胞。因此,研究破骨细胞的形成对于发展有效的骨代谢疾病治疗具有重要意义。破骨细胞是降解骨基质的主要效应细胞,其功能异常导致骨关节炎的发生。成骨细胞和活化的t细胞产生的巨噬细胞集落刺激因子(m-csf)和rankl是调节破骨细胞生成的重要细胞因子。rankl诱导活化的t细胞(nfatc1)核因子表达,这是破骨细胞形成过程中活跃的关键转录因子。活化的nfatc1促进破骨细胞标记基因的表达,如抗酒石酸酸性磷酸酶(tracp)和调节破骨细胞生成和破骨细胞功能的cathepsink(ctsk)。
肉苁蓉多糖(cdp)是从肉苁蓉肉质茎中分离而来,具有免疫调节、抗肿瘤、抗衰老等药理作用。cdp对脂多糖(lps)诱导的小鼠小胶质细胞(bv-2细胞)产生一氧化氮(no)有抑制作用。此外,肉苁蓉富含苯乙醇提取物(ecd)还能通过减少肌肉损伤、延缓乳酸积累和提高能量储存来增强小鼠的游泳能力。
技术实现要素:
本发明要解决的技术问题是提供一种肉苁蓉多糖在制备治疗骨关节炎药物方面的应用。
为解决上述技术问题,本发明采用以下技术方案:
肉苁蓉多糖在制备治疗骨关节炎药物方面的应用。
上述骨关节炎因破骨细胞活动过度造成过度骨吸收所致。
上述破骨细胞活动由ros诱导引起。
目前,肉苁蓉多糖(cdp)对破骨细胞功能和活性的影响尚不清楚。发明人通过抗酒石酸酸性磷酸酶(tracp)染色、免疫荧光、rt-pcr和westernblot等方法研究了cdp对破骨成骨和羟基磷灰石吸收的抑制作用。研究发现,cdp能够抑制rankl诱导的破骨细胞分化和骨吸收,其机制是cdp可增强抗氧化物酶的表达,减少ros的产生,进而抑制rankl激活的nfat和mapk信号级联。此外,cdp还能抑制破骨细胞因子ctsk、mmp9和acp5的表达,对rank的表达无明显影响。因此,肉苁蓉多糖可能是治疗骨关节炎尤其是ros诱导破骨细胞活动过度所致骨关节炎的候选药物。
附图说明
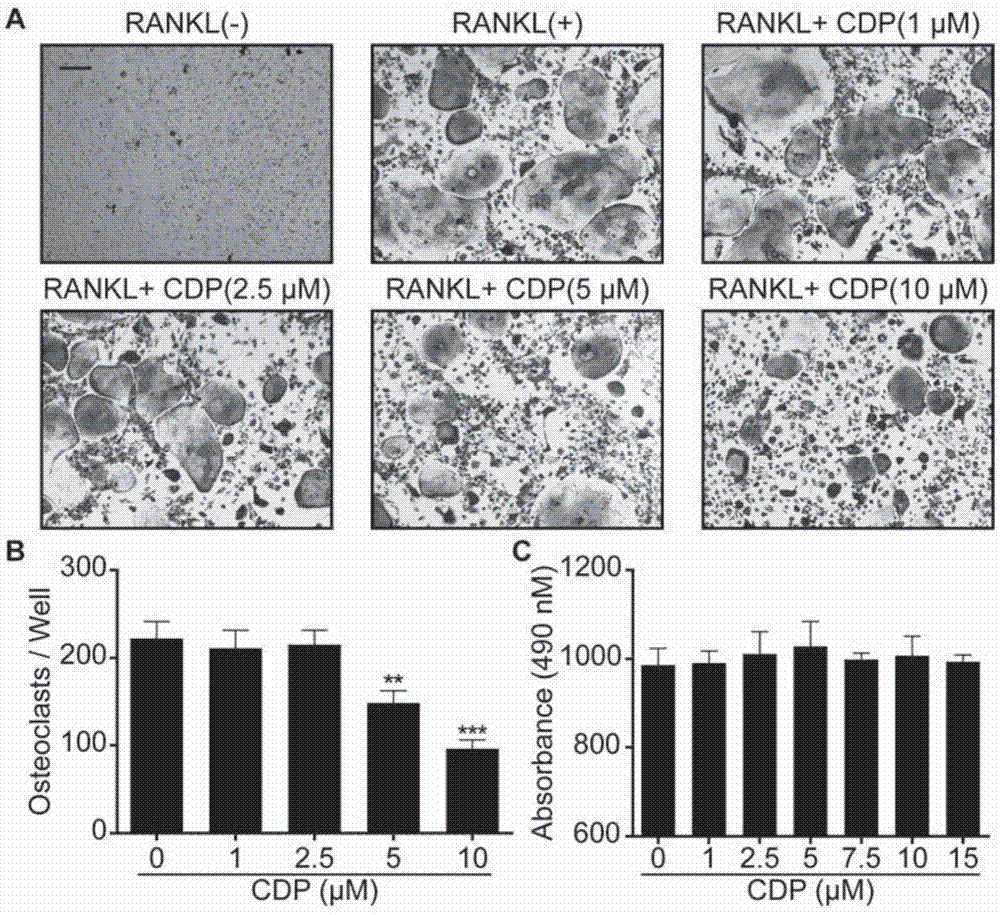
图1是cdp抑制rankl诱导的破骨细胞生成的研究结果图,图中:(a)在不同浓度的cdp处理后,bmmstracp染色的代表性图像(标尺200μm);(b)破骨细胞数的定量(trap阳性≥3个核);(c)通过mts细胞活力测定评估的cdp对bmms的细胞毒性;图中数据用均数±标准差表示,治疗组和对照组之间的显著性差异标示为**(p<0.01)或***(p<0.001)。
图2是cdp抑制rankl诱导的破骨细胞融合的研究结果图,图中:(a)破骨细胞共同聚焦图像(f-actin和dapi(细胞核)染色,标尺200μm);(b)每个视野内的破骨细胞数量;(c)单个视野内破骨细胞平均核数;图中数据用均数±标准差表示,治疗组与对照组比较,差异有显著性(p<0.05)或**(p<0.01)。
图3是cdp抑制rankl诱导的破骨细胞羟基磷灰石吸收活性的研究结果图,图中:(a)tracp染色的破骨细胞(第一行)和破骨细胞去除后的检测表面的典型图像(第二行,4x;第三行,10x,标尺200μm);(b)每孔中破骨细胞的数量;(c)每孔骨吸收面积的量化;图中数据用均数±标准差表示,治疗组与对照组的显著性差异为*(p<0.05)或**(p<0.01)。
图4是cdp抑制破骨细胞标志基因表达的研究结果图,图中:用m-csf(50ng/ml)和gst-rrankl(100ng/ml)处理bmms,添加不同浓度cdp并设无药物对照,各基因表达水平以内参hmbs进行标准化;a、b、c、d分别为检测破骨细胞分化过程中nfatc1(a)、mmp9(b)、ctsk(c)和acp5(tracp)(d)mrna的相对水平;图中数据用均数±标准差表示,治疗组与对照组的显著性差异为**(p<0.001)或***(p<0.001)。
图5是cdp抑制nfatc1活性和下游蛋白表达的研究结果图,图中:(a)转染nfatc1荧光素酶结构的rankl刺激raw264.7细胞的荧光素酶活性,转染细胞用相应浓度的cdp预处理后,用gst-rrankl(100ng/ml)刺激24h;(b)rankl(100ng/ml)和m-csf(50ng/ml)诱导的c-fos、nfatc1、v-atpase-d2、ctsk、rank和actb(β-actin)的westernblot结果;测定c-fos、nfatc1、v-atpase-d2、rank和ctsk与actb的比值,图中数据用均数±标准差表示,治疗组与对照组的显著性差异为***(p<0.001)。
图6是cdp清除rankl诱导破骨细胞分化过程中产生的ros的研究结果图,图中:(a)不同浓度的cdp治疗破骨细胞分化过程中ros阳性bmms的代表图像(标尺200μm);(b)每个视野中ros阳性细胞数量;(c)对每个细胞的平均荧光强度进行量化;(d)在cdp存在下,rankl(100ng/ml)和m-csf(50ng/ml)(50ng/ml)诱导bmms中nos2、trx1、gsr和actb(β-actin)的westernblot结果,测定nos2、trx1和gsr与actb的比值;(e)在cdp或过氧化物存在下,rankl(100ng/ml)和m-csf(50ng/ml)诱导bmms中nfatc1、c-fos和actb(β-actin)的westernblot结果,测定了nfatc1和c-fos与actb的比值;(f)hmbs中nfatc1和fos的相对mrna表达水平;图中数据用均数±标准差表示,治疗组与对照组比较,差异有显著性*(p<0.05),**(p<0.01)or***(p<0.001)。
图7是cdp在rankl诱导破骨细胞生成过程中抑制mapk通路的研究结果图,图中:用rankl(100ng/ml)和m-csf(50ng/ml)诱导bmms在cdp存在下60分钟,用traf6、actb、pjnk1/2、jnk、p-erk1/2、erk、p-p38和p38的特异性抗体对蛋白印迹进行检测,测定traf6和磷酸化蛋白相对于actb和未磷酸化蛋白的相对表达水平;图中的数据用均数±标准差表示,治疗组与对照组比较有显著性差异*(p<0.05),**(p<0.01)or***(p<0.001)。
图8是cdp影响破骨细胞分化的机制示意图,图中:cdp减少rankl诱导的ros产生,并抑制nfatc1和mapk的活化,从而抑制破骨细胞分化。
具体实施方式
材料与方法
一、材料
肉苁蓉多糖(即cdp,纯度>98%))购自索莱宝(北京,中国),用磷酸盐缓冲生理盐水(pbs)溶解制成1mm储存液。c-fos、ctsk、gsr、trx1、nos2、traf6、rank、nfatc1、erk、jnk、p38、磷酸化(p)-erk、p38、p-jnk和β-肌动蛋白的特异性抗体购自santacruz(sanjose,ca)。v-atpased2的抗体参考文献(fengh,chengt,steerjh,joyceda,pavlosnj,leongc,kularj,liuj,fengx,zhengmh,xuj.2009.myocyteenhancerfactor2andmicrophthalmia-associatedtranscriptionfactorcooperatewithnfatc1totransactivatethev-atpased2promoterduringrankl-inducedosteoclastogenesis.thejournalofbiologicalchemistry284(21):14667-14676.)制备。3(4-5-二甲基噻唑-2-基)-5-(3-羧基甲氧基苯基)-2(4-磺基苯基)-2h四唑(mts)和荧光素酶检测试剂盒购自promega(澳大利亚悉尼)获得的。重组巨噬细胞集落刺激因子(m-csf)购自r&d(minneapolis,mn)。
raw264.7细胞(小鼠巨噬细胞)来源于美国典型培养物保藏中心(atcc,manassas,va),在α-mem(thermofisherscientific,澳大利亚)中添加10%胎牛血清(fbs)、2mml-谷氨酰胺、100u/ml青霉素和100μg/ml链霉素(完全培养基)培养。从6周龄c57bl/6j小鼠中分离出骨髓源性单核细胞(bmms),按西澳大利亚大学动物伦理委员会批准的程序(ra/3/100/1244)对其进行安乐死。取长骨游离软组织,将骨髓从股骨和胫骨中冲洗,然后添加m-csf(50ng/ml)的完全培养基中培养。
二、方法
1.破骨细胞分化实验
bmms在浓度为6×103细胞/孔的96孔培养板中,添加不同浓度的cdp并设无药物对照组,用含m-csf(50ng/ml)和gst-rrankl(100ng/ml)的完全培养基处理。细胞培养液每2天更换一次。5天后,用4%多聚甲醛固定10min,用pbs洗涤3次,然后用白细胞酸性磷酸酶染色试剂盒(sigma-aldrich,澳大利亚悉尼)按照制造商的程序染色。tracp阳性多核细胞(>3核)为破骨细胞。
2.细胞毒性试验
将bmms接种于96孔板中,每孔6×103个细胞/孔,培养过夜待细胞贴壁。第二天,用不同浓度的cdp孵育细胞。再加mts溶液(20μl/孔),与细胞共培养2h,用微板阅读器测定490nm处的吸光度(multiscanspectrum;thermolabsystems,chantilly,va)。
3.免疫荧光染色
bmms在mcsf(50ng/ml)存在下,密度为6×103细胞/孔。然后用m-csf和gst-rrankl(100ng/ml)刺激细胞,直至形成成熟的破骨细胞。破骨细胞用不同浓度的cdp作用48h后,用4%多聚甲醛固定,0.1%tritonx-100/pbs渗透,3%bsa阻断。制备细胞用罗丹明-共轭酞菁在黑暗中孵育45min,进行f-肌动蛋白染色。然后用pbs清洗细胞,用dapi染色细胞核,封片后并在共聚焦显微镜下观察。
4.羟基磷灰石吸收试验
为了测定在6孔胶原包被板(bdbiocoat;thermofisher)上培养的破骨细胞活性bmms(1×105细胞/孔),用gst-rrankl(100ng/ml)和m-csf(50ng/ml)刺激培养,直至产生成熟破骨细胞。然后使用细胞解离溶液(sigma-aldrich)将细胞轻轻从板上分离,并将相等数量的成熟破骨细胞接种到羟基磷灰石包被的96孔板中的各个孔(corning骨测定;corning,ny)。成熟破骨细胞在含有gst-rrankl和m-csf的培养基中,添加不同浓度cdp孵育,并设无cdp对照。48小时后,对一半孔进行tracp染色,评估每孔活性多核细胞的数量;剩余的孔漂洗10分钟以除去细胞并测量再吸收区域。光学显微镜下拍摄细胞吸收区域,并使用imagej软件(nationalinstitutesofhealth,bethesda,md)量化由破骨细胞吸收的羟基磷灰石面积百分比。
5.荧光素酶报告基因测定
为了研究nfatc1转录激活,用nfatc1应答的荧光素酶报告构建体稳定转染raw264.7细胞。将转染的细胞以1.5×105细胞/孔的密度在48孔板中培养,并用不同浓度的cdp预处理1小时。预处理后,用gst-rrankl(100ng/ml)刺激细胞24小时,并根据试剂盒说明书(promega)使用荧光素酶报告基因测定系统测定荧光素酶活性。
6.定量rt-pcr分析
用trizol试剂从细胞中提取总rna,并以1μgrna模板和寡核苷酸引物为模板,用moloney鼠白血病病毒逆转录酶合成总rna。用以下程序进行特异性序列的聚合酶链反应扩增:94℃,5min,随后94℃40s,60℃40s,72℃40s共30次循环,最后72℃延伸5min。特异引物的详细信息如表1所示。用hmbs基因表达作为内参标准化各基因相对mrna水平。
表1特异引物信息
7.蛋白免疫印迹
bmms在含m-csf的完全培养基中6孔板内培养,用gst-rrankl(100ng/ml)刺激。用放射免疫沉淀(ripa)裂解缓冲液溶解细胞,sds-聚丙烯酰胺凝胶电泳分析蛋白质,转移到聚偏氟乙烯(pvdf)膜。在5%脱脂牛奶中封闭1h,在4℃下用相应特异性一抗进行检测,在4℃下轻轻摇动过夜。用辣根过氧化物酶(hrp)结合的二抗体对膜进行洗涤和孵育。然后用增强化学发光试剂(美国药典生物技术公司,piscataway,nj)检测抗体的反应性,并用图像量化的las4000(gehealthcare)进行显色。
8.细胞内活性氧检测
用2‘,7’-二氯荧光素二乙酸酯(dcfda)细胞ros检测试剂盒(abcam,墨尔本,澳大利亚)检测细胞内活性氧水平。bmms(5×103细胞/孔)在96孔板中培养,分别用rankl(100ng/ml)、m-csf(50ng/ml)和cdp处理72h,用dcfda检测细胞内ros水平,在ros存在下氧化成荧光dcf。细胞在hanks缓冲液中洗涤,避光中孵育30min,用10mdcfh-da孵育30min,共聚焦显微镜采图。
9.统计分析
除另有说明外,所有数据均来自至少三次实验的测量统计。数据以均值±标准差表示。采用单因素方差分析(anova)和student-newman-keulsposthoc确定结果间差异的显著性,p<0.05认为差异具有显著性。
三、结果
1.cdp抑制rankl诱导的破骨发生及破骨细胞融合
为了确定cdp能否抑制rankl诱导的破骨细胞形成,发明人首先用小鼠骨髓源性单核细胞(bmms)进行破骨实验。用rankl和m-csf处理bmms5天,并添加不同浓度的cdp浓度。当cdp浓度达到5μm或更高时,cdp可减少tracp阳性多核细胞的数量(图1a,1b)。为了评估cdp的毒性,并确认这些结果不是由细胞死亡或数量减少造成的,发明人进行了mts试验。用rankl和m-csf处理bmms,用不同剂量的cdp作用48h。cdp在15μm或以下浓度下对bmm增殖无影响(图1c)。
为探讨cdp对破骨细胞融合的影响,采用rankl和m-csf联合不同剂量cdp诱导破骨细胞。破骨细胞用罗丹明-phalloidin和dapi染色,以评估每个破骨细胞的细胞核数目(图2a)。cdp治疗后,破骨细胞数量和每个破骨细胞的平均核数均减少(5-10μm)(图2b,2c)。因此,cdp对rankl诱导的破骨形成和破骨细胞融合具有剂量依赖性的抑制作用。
2.cdp抑制rankl诱导的破骨细胞羟基磷灰石吸收活性。
用羟基磷灰石吸附法检测cdp对破骨细胞功能的影响(图3a)。培养24h后,与对照组相比,5和10μmcdp处理后,破骨细胞数无明显变化,羟基磷灰石吸收面积明显减少(图3b,3c)。这些结果表明,cdp对破骨细胞的形成和破骨细胞的吸收活性均有较强的抑制作用,但无细胞毒性作用。
3.cdp抑制破骨细胞关键基因表达
为进一步研究cdp对破骨发生和破骨细胞骨吸收的抑制作用,应用rankl和m-csf,以不同浓度的cdp处理bmms,观察其对破骨发生和破骨细胞骨吸收的抑制作用。采用rt-pcr技术检测破骨细胞关键基因的表达。nfatc1是破骨过程中重要的转录因子,cdp以剂量依赖性的方式抑制其表达(图4a)。此外,cdp(5和10μm)下调了骨吸收相关基因的表达,包括mmp9、ctsk和acp5(图4b-d)。
4.cdp抑制nfatc1活性及下游蛋白表达
为探讨cdp对rankl诱导的nfatc1活性的影响,采用荧光素酶报告法进行了研究。结果,cdp(5μm及更高浓度)显著抑制rankl诱导的nfatc1活性(图5a)。此外,westernblotting显示,cdp明显抑制rankl和m-csf处理的bmms中nfatc1和c-fos的表达(图5b)。此外,与对照组相比,cdp作用下破骨细胞功能相关蛋白v-atp酶-d2和ctsk的表达下调。然而,cdp对rank的表达没有显著影响(图5b)。
5.cdp促进rankl诱导破骨过程中抗氧化酶的表达
为探讨cdp依赖性破骨抑制作用的机制,采用rankl(100ng/ml)和m-csf(50ng/ml)联合pbs或cdp作用72h,观察cdp对rankl刺激细胞内ros生成的影响。rankl处理可使细胞内ros水平升高,cdp(5和10μm)可使细胞内ros水平降低(图6a)。cdp处理后,ros阳性细胞数和ros染色强度均呈剂量依赖性降低(图6b,6c)。此外,westernblot结果显示,cdp能促进bmms中硫氧还蛋白(trx1)和谷胱甘肽还原酶(gsr)的表达,抑制诱导型一氧化氮合酶(nos2)的表达(图6d)。
为进一步探讨cdp是否通过降低ros的产生而抑制破骨细胞分化。然后,发明人用过氧化物(10μm)处理bmms,以模拟细胞内的高ros状态。rankl和m-csf诱导bmms作用3d,westernblot和rt-pcr结果表明,与对照组相比,过氧化物能促进nfatc1和c-fos的表达。与图5中的结果一致,cdp抑制了nfatc1和c-fos的表达,而过氧化物则削弱了cdp的抑制作用(图6e,6f)。这些数据表明cdp通过清除ros的产生抑制了nfatc1和c-fos的表达。
6.cdp抑制rankl诱导破骨过程中的mapk通路
发明人研究了cdp处理对rankl介导的traf6表达和mapk通路激活的影响。在无血清培养基中孵育2h后,用rankl刺激bmms,与不加cdp刺激60min。cdp(10μm)刺激10min和20min对traf6的表达和jnk2和erk1/2的磷酸化均无影响(图7)。此外,与对照组相比,cdp处理60分钟后,p38磷酸化明显受到抑制(图7)。这些数据表明,cdp抑制rankl诱导的mapk信号通路,与其对破骨细胞形成和活性的抑制作用一致。
四、讨论
肉苁蓉,被称为“沙漠人参”,最近因其在衰老和氧化应激中调节免疫和保护作用的能力而受到广泛关注。肉苁蓉的主要活性成分苯丙烷取代的二糖苷被证明能抑制巨噬细胞中的一氧化氮(n0)活性。此外,肉苁蓉提取物还能降低缺血后再灌注心肌的氧化应激,并在抑制凋亡通路以保护心脏方面发挥重要作用。cdp作为肉苁蓉的重要成分,具有多种药理作用。本研究发现cdp通过抑制ros的产生以及nfat和mapk的激活,抑制rankl激活的破骨细胞分化和激活。
tracp作为一种酸性磷酸酶存在于多种细胞中,大量存在于破骨细胞和肺泡巨噬细胞。tracp是破骨细胞特有的酶,其表达与破骨细胞功能密切相关,可作为破骨细胞活性和骨吸收的指标。在发明人的研究中,cdp抑制tracp阳性细胞的数量,表明rankl诱导的破骨作用被cdp所阻断。破骨细胞对骨基质的降解依赖于组织蛋白酶k(ctsk)和基质金属蛋白酶(mmps)(gruber,2015)。在此,cdp显著下调了破骨细胞功能基因如mmp9、ctsk和acp5的表达。
破骨细胞的分化和功能受多种信号途径的调控。rankl在与rank结合后,通过激活traf6适配蛋白激活破骨细胞形成的重要转录因子nfatc1的表达,影响破骨细胞特异性基因的表达,包括tracp和ctsk。在本研究中,发明人发现cdp对破骨细胞rank和traf6的表达没有影响。cdp抑制rankl诱导的bmms破骨过程中nfatc1的激活。此外,线粒体在传递电子的过程中产生的活性氧促进了破骨细胞的增殖和分化,调节了骨基质的降解。最近研究发现,rankl能诱导bach1核导入并减弱nrf2介导的抗氧化酶的产生,从而增强小鼠细胞内ros的表达和破骨作用。此外,同型半胱氨酸增加细胞内活性氧的生成会促进破骨细胞的形成和活性。发明人的研究发现,cdp通过抑制nos2的表达,促进trx1和谷胱甘肽还原酶等抗氧化酶的表达,减少破骨细胞ros的积累。此外,发明人还用过氧化物处理bmms,以增加细胞内ros的积累。结果表明,ros的增加能促进nfatc1的表达,说明ros位于nfatc1的上游。发明人还发现,过氧化物可削弱cdp对nfatc1表达的抑制作用。提示cdp抑制ros的积累,抑制nfatc1的表达,进而抑制破骨细胞的形成和功能。
erk、jnk和p38属于mapk家族,参与破骨细胞分化的调控)。rankl通过增加erk、jnk和p38的磷酸化而激活mapk通路。发明人发现cdp抑制了mapk通路中rankl介导的关键蛋白磷酸化,从而促进了cdp对破骨细胞标记基因表达的抑制作用。这是首次发现cdp对ros产生、nfat和mapk激活的抑制作用,代表了cdp体外作用的新机制。
总之,发明人发现cdp能抑制破骨和羟基磷灰石的吸收,以及ctsk、mmp9和acp5等破骨细胞标志基因的表达。cdp能抑制rankl介导的ros产生,抑制nfat和丝裂原活化蛋白激酶(mapk)的激活(图8)。发明人的结果表明,cdp可作为治疗ros诱导的破骨细胞相关疾病的候选药物。
序列表
<110>广西医科大学
<120>肉苁蓉多糖在制备治疗骨关节炎药物方面的应用
<160>12
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>1
aagggcttttctgaggcacc20
<210>2
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>2
agttgcccatctttcatcactg22
<210>3
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>3
ggagagtccgagaatcgagat21
<210>4
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>4
ttgcagctaggaagtacgtct21
<210>5
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>5
agtttggtgtcgcggagcac20
<210>6
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>6
tacatgagcgcttccggcac20
<210>7
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>7
gggagaaaaacctgaagc18
<210>8
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>8
attctggggactcagagc18
<210>9
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>9
tgtggccatctttatgct18
<210>10
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>10
gtcatttctttggggctt18
<210>11
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>11
gcgagcaactgagaagac18
<210>12
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>12
ttgaaacccgagaacatc18
- 还没有人留言评论。精彩留言会获得点赞!