江蓠科植物的水萃物或其发酵物的应用与治疗及/或减缓神经疾病的药物组合物或保健食品的制作方法
本发明系关于江蓠科植物的水萃物或其发酵物的应用与治疗及/或减缓神经疾病的药物组合物及/或保健食品。
背景技术:
全球65岁以上人口于2050年将超过20亿,约占总人口的20%,而人口老化已成为必然趋势。扶老比的增加将加重扶养负担,造成医疗支出逐年增加。
由老化所引起的相关疾病中以神经退化性疾病最受重视,老化加速神经相关能力的退化,例如:认知、合理性、速度、记忆力、语言能力等,进而引起老化相关疾病。根据世界卫生组织who统计,目前已有超过20%的60岁以上人口罹患精神性或神经性疾病,造成此族群人口达6.6%失能,其中最常见的老年神经或精神疾病为阿兹海默症与忧郁症,而焦虑则影响此族群人口约3.8%。此三种疾病皆属神经退化性疾病。
因此,阻滞或延缓老化现象以及预防与减缓神经退化性相关疾病是重要与迫切的议题。
技术实现要素:
本发明提供一种江蓠科植物的水萃物或其发酵物用于制备治疗及/或减缓神经疾病的药物及/或保健食品的用途,其中江蓠科植物的水萃物的发酵物为乳酸菌发酵物。
本发明也提供一种治疗及/或减缓神经疾病的药物组合物及/或保健食品,包括:江蓠科植物的水萃物或其发酵物,其中该江蓠科植物的水萃物的发酵物为乳酸菌发酵物;以及药学上可接受的载体或盐类。
本发明更提供一种江蓠科植物的水萃物作为培养微生物的培养基的用途。
附图简述
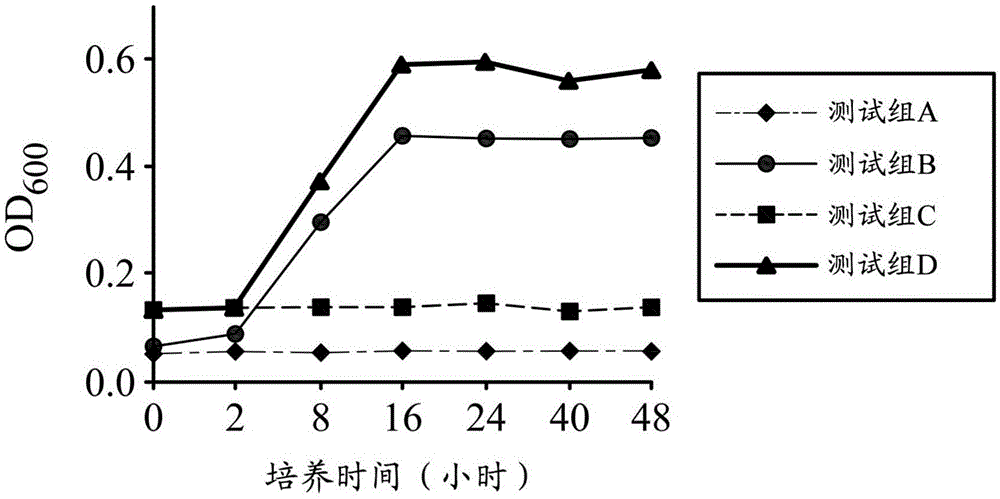
图1a-1c显示,添加葡萄糖的含芋根江蓠水萃取物的水溶液(5%(w/v)芋根江蓠水萃取物+1%(w/v)葡萄糖)的测试结果。第1a图显示,接种或不接种经活化的胚芽乳酸杆菌的mrs培养液或含芋根江蓠水萃取物的水溶液的混浊度变化。第1b图显示,接种或不接种经活化的胚芽乳酸杆菌的mrs培养液或含芋根江蓠水萃取物的水溶液的ph值变化。第1c图显示,胚芽乳酸杆菌在mrs培养液与在含芋根江蓠水萃取物的水溶液的生长曲线。测试组a:为未接菌的mrs培养液;测试组b:接种经活化的胚芽乳酸杆菌的mrs培养液;测试组c:未接菌的含芋根江蓠水萃取物的水溶液;测试组d:接种经活化的胚芽乳酸杆菌的含芋根江蓠水萃取物的水溶液。
图2显示,胚芽乳酸杆菌在mrs培养液与在含芋根江蓠水萃取物的水溶液(10%(w/v)芋根江蓠水萃取物)的生长曲线。测试组a:接种经活化的胚芽乳酸杆菌的mrs培养液;测试组b:接种经活化的胚芽乳酸杆菌的含芋根江蓠水萃取物的水溶液。
图3a显示,本发明一实施例的旷野实验所使用的测试箱100的整体外观示意图。
图3b显示,本发明一实施例的旷野实验所使用的测试箱100的内部的底部的示意图。
图4a-4e显示,本发明一实施例的旷野实验的结果。第4a图显示,于旷野试验中小鼠移动至中央区域的次数。第4b图显示,于旷野试验中小鼠处于中央区域的时间比例。第4c图显示,于旷野试验中小鼠的总移动距离。第4d图显示,于旷野试验中小鼠的站立次数。第4e图显示,于旷野试验中小鼠的移动轨迹。测试组a:空白组;测试组b:小鼠仅经皮质酮诱导;测试组c:小鼠经皮质酮诱导并给予含乳酸菌(2*1010cfu/天)的饲料;测试组d:小鼠经皮质酮诱导并给予含芋根江蓠水萃物(2wt%)的饲料;测试组e:小鼠经皮质酮诱导并给予含芋根江蓠水萃物的乳酸菌发酵物(2wt%)的饲料。统计显著差异性以spss统计软件(spssinstitute,inc.,chicago,il,usa)进行duncan检定的单变量变异数分析,p值小于0.05视为具有显著性差异。拥有相同字母元素的组别间没有显著性的差异;没有共同元素字母的组别间有显著性的差异。
图5显示,本发明一实施例的明暗箱试验所使用的测试箱200的示意图。
图6a与6b显示,本发明一实施例的明暗箱试验的结果。第6a图显示,于明暗箱试验中小鼠停留于明室的时间。第6b图显示,于明暗箱试验中小鼠进出明室与暗室的次数。测试组a:空白组;测试组b:小鼠仅经皮质酮诱导;测试组c:小鼠经皮质酮诱导并给予含乳酸菌(2*1010cfu/天)的饲料;测试组d:小鼠经皮质酮诱导并给予含芋根江蓠水萃物(2wt%)的饲料;测试组e:小鼠经皮质酮诱导并给予含芋根江蓠水萃物的乳酸菌发酵物(2wt%)的饲料。统计显著差异性以spss统计软件(spssinstitute,inc.,chicago,il,usa)进行duncan检定的单变量变异数分析,p值小于0.05视为具有显著性差异。拥有相同字母元素的组别间没有显著性的差异;没有共同元素字母的组别间有显著性的差异。
图7a与图7b显示,本发明一实施例的蔗糖偏好性试验的结果。第7a图显示,于蔗糖水偏好性试验中小鼠的蔗糖水偏好度。第7b图显示,于蔗糖水偏好性试验中小鼠的总液体摄取量。测试组a:空白组;测试组b:小鼠仅经皮质酮诱导;测试组c:小鼠经皮质酮诱导并给予含乳酸菌(2*1010cfu/天)的饲料;测试组d:小鼠经皮质酮诱导并给予含芋根江蓠水萃物(2wt%)的饲料;测试组e:小鼠经皮质酮诱导并给予含芋根江蓠水萃物的乳酸菌发酵物(2wt%)的饲料。统计显著差异性以spss统计软件(spssinstitute,inc.,chicago,il,usa)进行duncan检定的单变量变异数分析,p值小于0.05视为具有显著性差异。拥有相同字母元素的组别间没有显著性的差异;没有共同元素字母的组别间有显著性的差异。
图8a与图8b显示,本发明一实施例的小鼠血清中压力激素的测定结果,第8a图显示,小鼠的血清中皮质酮的浓度。第8b图显示,小鼠的血清中肾上腺素的浓度。测试组a:空白组;测试组b:小鼠仅经皮质酮诱导;测试组c:小鼠经皮质酮诱导并给予含乳酸菌(2*1010cfu/天)的饲料;测试组d:小鼠经皮质酮诱导并给予含芋根江蓠水萃物(2wt%)的饲料;测试组e:小鼠经皮质酮诱导并给予含芋根江蓠水萃物的乳酸菌发酵物(2wt%)的饲料。统计显著差异性以spss统计软件(spssinstitute,inc.,chicago,il,usa)进行duncan检定的单变量变异数分析,p值小于0.05视为具有显著性差异。拥有相同字母元素的组别间没有显著性的差异;没有共同元素字母的组别间有显著性的差异。
符号说明
100~旷野试验所使用的测试箱;
101~中央区域;
103~中心点;
105~周边区域;
200~明暗箱试验所使用的测试箱;
201~隔板;
203~明室;
205~暗室;
207~光源;
209~门。
实施方式
本发明提供一种江蓠科(gracilariaceae)植物的水萃物或其发酵物用于制备治疗及/或减缓神经疾病的药物及/或保健食品的用途。
上述神经疾病可为任何与神经相关的疾病,并无特别限制,如忧郁症(depression)、躁郁症(bipolardisorder)、焦虑症(anxiety)、自闭症(autism)、失智症(dementia)等,但不限于此。
于本发明江蓠科植物的水萃物或其发酵物用于制备治疗及/或减缓神经疾病的药物及/或保健食品的用途中,上述江蓠科植物的水萃物的发酵物,可为乳酸菌发酵物,但不限于此。
上述江蓠科植物的例子可包括芋根江蓠(gracilariablodgettii)、菊花江蓠(gracilariacoforvoides)、粗江蓠(gracilariagigas)、绳江蓠(gracilariachorda)、菊花心江篱(gracilarialichenoides)、扁江蓠(gracilariacompressa)等,但不限于此。在一实施例中,上述江蓠科植物可为芋根江蓠(gracilariablodgettii)。
又,上述乳酸菌可包括乳酸杆菌属(lactobacillus)的菌,但不限于此。而上述乳酸杆菌属的菌的例子,可包括,但不限于,胚芽乳酸杆菌(lactobacillusplantarum)、嗜酸乳酸杆菌(lactobacillusacidophilus)、保加利亚乳酸杆菌(lactobacillusbulgaricusk)、加氏乳酸杆菌(lactobacillusgasseri)等。在一实施例中,上述乳酸菌可为乳酸杆菌属的菌,且可为胚芽乳酸杆菌。
于本发明江蓠科植物的水萃物或其发酵物用于制备治疗及/或减缓神经疾病的药物及/或保健食品的用途中,在一实施例中,上述江蓠科植物可为芋根江蓠,而上述乳酸菌则可为胚芽乳酸杆菌。
而,上述江蓠科植物的水萃物的获得方式并无特殊限制,只要以水作为萃取溶剂即可,例如可藉由本技术领域已知的任何植物的水萃物的萃取方法所获得,或操作者视情况进行适合的参数调整所获得。
在一实施例中,上述江蓠科植物的水萃物可由下列所示例的步骤所获得,但不限于此,例如,将江蓠科植物以水进行加热回流程序以获得萃取液形式的水萃物,或将江蓠科植物以水进行加热回流程序以获得水萃液并将该水萃液进行干燥以获得萃取粉末形式的水萃物。
于上述实施例中,江蓠科植物与水的重量比可为约1:5-100,例如,1:5-10、1:10-15、1:10-20、1:15-20等,但不限于此。在一特定实施例中,江蓠科植物与水的重量比可为约1:10-15。
又,于上述实施例中,加热回流程序的温度可为约80-100℃,但不限于此,例如,80℃、85℃、90℃、95℃、100℃等。
此外,上述江蓠科植物的水萃物的发酵物的获得方式并无特殊限制,只要将江蓠科植物的水萃物进行发酵即可。
在一实施例中,上述江蓠科植物的水萃物的发酵物可由包括下列步骤的方法所形成:
首先,将经活化乳酸菌加入水溶液。上述水溶液可含有萃取液形式的任一上述的江蓠科植物的水萃物,或上述水溶液可由萃取粉末形式的任一上述的江蓠科植物的水萃物添加于水中所形成。
在上述水溶液中,上述萃取粉末的含量可为约1-20%(w/v),如1%(w/v)、2%(w/v)、5%(w/v)、8%(w/v)、10%(w/v)等,但不限于此。
在一实施例中,上述水溶液系由上述萃取液所组成。
在另一实施例中,上述水溶液仅由上述萃取粉末添加于水中所形成,而于此实施例中,上述萃取粉末的含量可为约1-20%(w/v),如1%(w/v)、2%(w/v)、5%(w/v)、8%(w/v)、10%(w/v)等,但不限于此。在一特定实施例中,在上述水溶液中,上述萃取粉末的含量可为约10%(w/v)。
此外,在一实施例中,于上述将经活化乳酸菌加入一水溶液的步骤中,上述水溶液除了上述任一的江蓠科植物的水萃物,还可更包括糖类。
在上述糖类存在于上述水溶液中的情况,上述糖类并无特别限制,只要为乳酸菌可利用的糖类皆可,例如,葡萄糖、蔗糖、乳糖等,但不限于此。在一实施例中,上述糖类为葡萄糖。又,在糖类存在于上述水溶液中的情况,上述糖类于水溶液中的含量可为约1-5%(w/v),但不限于此,例如,约1%(w/v)、2%(w/v)、5%(w/v)等。在一实施例中,在糖类存在于上述水溶液中的情况,上述糖类于水溶液中的含量可为约1%(w/v)。在一特定实施例中,在糖类存在于上述水溶液中的情况,上述萃取粉末的含量可为约5%(w/v),且上述糖类为葡萄糖,而上述葡萄糖于水溶液中的含量可为约1%(w/v)。
接着,于上述将经活化的乳酸菌加入水溶液的步骤之后,对上述水溶液进行发酵程序以形成上述江蓠科植物的水萃物的发酵物。
而于上述对水溶液进行发酵程序以形成江蓠科植物的水萃物的发酵物的步骤中,上述发酵程序的温度并无特殊限制,只要适合乳酸菌生长即可。上述发酵程序的温度可为约34-40℃,例如,34℃、35℃、36℃、36.5℃、37℃、37.5℃、40℃等,但不限于此。在一实施例中,上述发酵程序的温度可为约37℃。
又于上述对水溶液进行发酵程序以形成江蓠科植物的水萃物的发酵物的步骤中,上述发酵程序的时间也并无特殊限制,可视需要而定。上述发酵程序的时间可为约16-72小时,例如,约16小时、约24小时、约48小时、约72小时等,但不限于此。在一实施例中,上述发酵程序的时间可为约48小时。
在一特定实施例中,于上述对水溶液进行发酵程序以形成江蓠科植物的水萃物的发酵物的步骤中,上述发酵程序的温度可为约37℃,且上述发酵程序的时间可为约48小时。
另外,在一实施例中,上述形成江蓠科植物的水萃物的发酵物的方法,在对上述水溶液进行发酵程序以形成上述江蓠科植物的水萃物的发酵物的步骤之后,可更包括将江蓠科植物的水萃物的发酵物进行干燥的步骤。
又,在本发明江蓠科植物的水萃物或其发酵物用于制备治疗及/或减缓神经疾病的药物及/或保健食品的用途中,在一实施例中,上述江蓠科植物为芋根江蓠,而上述江蓠科植物的水萃物的发酵物系由包括下列步骤的方法所形成:
首先,将经活化的胚芽乳酸杆菌加入水溶液,而上述水溶液可含有萃取液形式的芋根江蓠水萃物,或上述水溶液可由萃取粉末形式的芋根江蓠水萃物添加于水中所形成。
而在一特定实施例中,在上述将经活化的胚芽乳酸杆菌加入水溶液的步骤中,上述水溶液系由任一上述的萃取液所组成,或者,上述水溶液仅由上述萃取粉末添加于水中所形成。而于此特定实施例中,上述萃取粉末于水溶液的含量可为约10%(w/v)。
在另一特定实施例中,上述水溶液除了上述芋根江蓠水萃物,还可更包括葡萄糖。而于此特定实施例中,上述萃取粉末于水溶液的含量可为约5%(w/v),而上述葡萄糖于水溶液的含量可为约1%(w/v)。
而在将经活化的胚芽乳酸杆菌加入水溶液之后,对上述水溶液进行发酵程序以形成上述江蓠科植物的水萃物的发酵物。上述发酵程序的温度可为约37℃,又,上述发酵程序的时间可为约48小时。
另外,在一特定实施例中,在将经活化的胚芽乳酸杆菌加入水溶液并对上述水溶液进行发酵程序以形成上述江蓠科植物的水萃物的发酵物之后,可进一步将江蓠科植物的水萃物的发酵物进行干燥。
上述任一的江蓠科植物的水萃物或其发酵物,皆具有降低血清中压力激素的能力,压力激素的例子可包括皮质酮、肾上腺素等,但不限于此。
又,上述任一的江蓠科植物的水萃物或其发酵物,皆具有减缓情绪反应的功效。
此外,本发明也提供一种治疗及/或减缓神经疾病的药物组合物及/或保健食品。于此所述的神经疾病可为任何与神经相关的疾病,并无特别限制,如忧郁症、躁郁症、焦虑症、自闭症、失智症等,但不限于此。
而上述本发明的治疗及/或减缓神经疾病的药物组合物及/或保健食品,可包括,但不限于,江蓠科植物的水萃物或其发酵物与药学上可接受的载体或盐类。
本发明的治疗及/或减缓神经疾病的药物组合物及/或保健食品所包含的江蓠科植物的水萃物或其发酵物,可为前方江蓠科植物的水萃物或其发酵物用于制备治疗及/或减缓神经疾病的药物及/或保健食品的用途的相关段落中所提及的任一种江蓠科植物的水萃物或其发酵物,故不再于此重复赘述。
前述药学上可接受的载体可包括,但不限于溶剂、分散媒(dispersionmedium)、套膜(coating)、抗菌与抗真菌试剂与等渗透压与吸收延迟(absorptiondelaying)试剂等与药学给予相容者。对于不同的给药方式,可利用一般方法将药学组合物配置成剂型(dosageform)。
又,上述药学上可接受的盐类可包括,但不限于盐类包括无机阳离子,例如,碱金属盐类,如钠、钾或胺盐,碱土金族盐类,如镁、钙盐,含二价或四价阳离子的盐类,如锌、铝或锆盐。此外,也可是为有机盐类,如二环己胺盐类、甲基-d-葡糖胺,氨基酸盐类,如精氨酸、赖氨酸、组氨酸、谷氨酰胺。
本发明药物组合物给药可以非口服、口服、经由吸入喷雾(inhalationspray)或藉由植入贮存器(implantedreservoir)的方式。非口服可包括涂擦患部、皮下(subcutaneous)、皮内(intracutaneous)静脉内(intravenous)、肌肉内(intramuscular)、关节内(intraarticular)动脉(intraarterial)、滑囊(腔)内(intrasynovial)、胸骨内(intrasternal)蜘蛛膜下腔(intrathecal)、疾病部位内(intralesional)注射以及灌注技术。
口服成分的形式可包括,但不限定于,药锭、胶囊、乳剂(emulsions)、水性悬浮液(aqueoussuspensions)、分散液(dispersions)与溶液。
再者,本发明还提供一种江蓠科植物的水萃物作为培养微生物的培养基的用途。
于此所述的微生物并无特别限制,只要能够利用江蓠科植物的水萃物生长即可,例如,细菌。在一实施例中,上述细菌可为乳酸杆菌属的菌,例如胚芽乳酸杆菌、嗜酸乳酸杆菌、保加利亚乳酸杆菌、加氏乳酸杆菌等,但不限于此。在一特定实施例中,于此所述的微生物为胚芽乳酸杆菌。
又,本发明江蓠科植物的水萃物作为培养微生物的培养基的用途中所述的江蓠科植物的水萃物,也可为前方江蓠科植物的水萃物或其发酵物用于制备治疗及/或减缓神经疾病的药物及/或保健食品的用途的相关段落中所提及的任一种江蓠科植物的水萃物,因此,不再于此重复赘述。
而在本发明江蓠科植物的水萃物作为培养微生物的培养基的用途中,所述培养基可含有萃取液形式的任一上述的江蓠科植物的水萃物,或所述培养基可由萃取粉末形式的任一上述的江蓠科植物的水萃物添加于水中所形成。上述萃取粉末于培养基中的含量可为约1-20%(w/v),如1%(w/v)、2%(w/v)、5%(w/v)、8%(w/v)、10%(w/v)等,但不限于此。
在一实施例中,上述培养基系由上述萃取液所组成。
在另一实施例中,上述培养基仅由上述萃取粉末添加于水中所形成,而于此实施例中,上述萃取粉末的含量可为约1-20%(w/v),如1%(w/v)、2%(w/v)、5%(w/v)、8%(w/v)、10%(w/v)等,但不限于此。在一特定实施例中,在上述水溶液中,上述萃取粉末的含量可为约10%(w/v)。
此外,在一实施例中,在本发明江蓠科植物的水萃物作为培养微生物的培养基的用途中,上述培养基除了上述任一的江蓠科植物的水萃物,还可更包括糖类。
在上述糖类存在于培养基中的情况,上述糖类并无特别限制,只要为微生物可利用的糖类皆可,例如,葡萄糖、蔗糖、乳糖等,但不限于此。在一实施例中,上述糖类为葡萄糖。又,在糖类存在于培养基中的情况,上述糖类于培养基中的含量可为约1-5%(w/v),但不限于此,例如,约1%(w/v)、2%(w/v)、5%(w/v)等。在一实施例中,在糖类存在于上述培养基中的情况,上述糖类于培养基中的含量可为约1%(w/v)。在一特定实施例中,在糖类存在于上述培养基中的情况,上述糖类为葡萄糖,而上述葡萄糖于培养基中的含量可为约1%(w/v)。
在本发明江蓠科植物的水萃物作为培养微生物的培养基的用途中,在一实施例中,所述培养基系用于培养胚芽乳酸杆菌。
而于所述培养基系用于培养胚芽乳酸杆菌中,上述培养基可由任一上述的萃取液所组成,或者,上述培养基仅由萃取粉末形式的任一上述的江蓠科植物的水萃物添加于水中所形成。而上述萃取粉末于培养基的含量可为约10%(w/v)。
或者,于所述培养基系用于培养胚芽乳酸杆菌中,上述培养基除了任一上述的江蓠科植物的水萃物,还可更包括葡萄糖。而上述萃取粉末于培养基的含量可为约5%(w/v),且上述葡萄糖于培养基的含量可为约1%(w/v)。
在本发明的江蓠科植物的水萃物作为培养微生物的培养基的用途中,适合以所述培养基来培养微生物的温度并无特别限制,可依据所培养的为生物而定。在一实施例中,适合以所述培养基来培养微生物的温度可为约34-40℃,例如,34℃、35℃、36℃、36.5℃、37℃、37.5℃、40℃等,但不限于此。在一特定实施例中,上述适合以所述培养基来培养微生物的温度可为约37℃。
又,在本发明的江蓠科植物的水萃物作为培养微生物的培养基的用途中,适合以所述培养基来培养微生物的时间也并无特别限制,其同样可依据所培养的微生物而定。在一实施例中,适合以所述培养基来培养微生物的时间可为约可为约16-72小时,例如,约16小时、约24小时、约48小时、约72小时等,但不限于此。在一特定实施例中,上述适合以所述培养基来培养微生物的时间可为约48小时。
实施例
实施例1
芋根江蓠水萃取物的制备
将芋根江蓠加入10-15倍重量的去离子水中,并以于80-100℃加热回流1-2小时来进行萃取,获得一萃取液。将萃取液以滤纸进行抽气过滤后,以减压浓缩机进行浓缩,并以真空干燥机进行冷冻干燥以去除水分,以获得萃取粉末。
实施例2
芋根江蓠水萃取物作为培养基的使用(芋根江蓠水萃取物的发酵)
实施例2-1
添加葡萄糖的含芋根江蓠水萃取物的水溶液的测试
a.方法
1.将胚芽乳酸杆菌(lactobacillusplantarum)(产品名lactobacillusplantarum(lp28),购自生合生物科技股份有限公司)的菌体悬浮液(菌液浓度:1x105cfu/ml)以1%(v/v)(菌体悬浮液与培养液的体积比为1:99)的接菌量接种于经灭菌的mrs液态培养液(sigma,catno.69966),置于37℃培养箱中培养12-18小时以使其活化。
2.将经活化的胚芽乳酸杆菌的菌体悬浮液(菌液浓度:1x105cfu/ml)以1%(v/v)的接菌量接种或不接种于经灭菌的mrs培养液或含芋根江蓠水萃取物的水溶液(含上方所获得的萃取粉末形式的芋根江蓠水萃取物5%(w/v)与1%(w/v)葡萄糖)中,以产生4组测试组,其分别为测试组a、测试组b、测试组c与测试组d。测试组a为未接菌的mrs培养液(mrs培养液的空白对照组)、测试组b为接种经活化的胚芽乳酸杆菌的mrs培养液(mrs培养液的实验组)、测试组c为未接菌的含芋根江蓠水萃取物的水溶液(含芋根江蓠水萃取物的水溶液的空白对照组),而测试组d为接种经活化的胚芽乳酸杆菌的含芋根江蓠水萃取物的水溶液(含芋根江蓠水萃取物的水溶液的实验组)。
3.将4组试验组置于37℃培养箱中培养48小时。于培养期间定时取样。测定各时间点的样本于波长600nm的吸光值(od600)以及ph值。又,将各时间点的样本经适当稀释后,分别并涂抹于mrs固态培养基。接着,将涂抹菌液的固态培养基于37℃培养箱中培养48小时后,以计算出各时间点的样本的菌数。
b.结果
各测试组吸光值变化以及ph值变化分别显示于第1a图与第1b图。而各测试组的菌量变化则显示于第1c图。
由第1a图可知,接种经活化的胚芽乳酸杆菌的含芋根江蓠水萃取物的水溶液(测试组d)的混浊度随培养时间延长而提高,并与接种经活化的胚芽乳酸杆菌的mrs培养液(测试组b)有相似的混浊度变化趋势,而此显示胚芽乳酸杆菌在含芋根江蓠水萃取物的水溶液与在mrs培养液中具有相似的生长趋势。又,由第1a图可知,测试组a及测试组c的溶液混浊度并未增加,而此代表mrs培养液与芋根江蓠水萃取物水溶液并未受到杂菌污染。
而由第1b图可知,接种经活化的胚芽乳酸杆菌的含芋根江蓠水萃取物的水溶液(测试组d)的ph值随着培养时间延长而下降,并与接种经活化的胚芽乳酸杆菌的mrs培养液(测试组b)有相似的ph变化趋势,而此代表乳酸菌的主要产物乳酸的增加。又,由第1b图可知,测试组a组及测试组c的溶液几乎无变化,而此代表mrs培养液与芋根江蓠水萃取物水溶液并未受到杂菌污染。
由第1c图可知,以含芋根江蓠水萃取物的水溶液培养的胚芽乳酸杆菌(测试组d)的菌量与生长速度皆与以mrs培养液培养的胚芽乳酸杆菌(测试组b)相似,而此显示芋根江蓠水萃取物可提供胚芽乳酸杆菌足够营养源以使其生长并可替代标准培养基而作为培养基使用。
实施例2-1
未添加葡萄糖的含芋根江蓠水萃取物的水溶液的测试
a.方法
1.将胚芽乳酸杆菌(lactobacillusplantarum)(产品名lactobacillusplantarum(lp28),购自生合生物科技股份有限公司)的菌体悬浮液(菌液浓度:1x105cfu/ml)以1%(v/v)(菌体悬浮液与培养液的体积比为1:99)的接菌量接种于经灭菌的mrs液态培养液(sigma,catno.69966),置于37℃培养箱中培养12-18小时以使其活化。
2.将经活化的胚芽乳酸杆菌的菌体悬浮液(菌液浓度:1x105cfu/ml)以1%(v/v)的接菌量接种于经灭菌的mrs培养液或含芋根江蓠水萃取物的水溶液(含上方所获得的萃取粉末形式的芋根江蓠水萃取物10%(w/v))中,以产生2组测试组,其分别为测试组a与测试组b。测试组a为接种经活化的胚芽乳酸杆菌的mrs培养液,而测试组b为接种经活化的胚芽乳酸杆菌的含芋根江蓠水萃取物的水溶液。
3.将2组测试组置于37℃培养箱中培养48小时。于培养期间定时取样。将各时间点的样本经适当稀释后,分别并涂抹于mrs固态培养基。接着,将涂抹菌液的固态培养基于37℃培养箱中培养48小时后,以计算出各时间点的样本的菌数。
b.结果
各测试组的菌量变化则显示于第2图。
由第2图可知,胚芽乳酸杆菌在含芋根江蓠水萃取物的水溶液(测试组b)与mrs培养液(测试组a)中皆可良好地生长,而此显示芋根江蓠水萃取物可提供胚芽乳酸杆菌足够营养源以使其生长并可替代标准培养基而作为培养基使用。
根据实施例2-1与实施例2-2的结果可清楚得知,不论是否具有葡萄糖的添加,芋根江蓠水萃取物皆可作为培养基使用,而使胚芽乳酸杆菌良好地生长。
实施例3:
芋根江蓠水萃物与其发酵物在旷野试验中对于小鼠的行为改善的评估
a.方法
将7-8周大的balb/c公鼠分成5组,分别为测试组a、测试组b、测试组c、测试组d与测试组e。测试组a为空白组。
将测试组b、测试组c、测试组d与测试组e的小鼠连续28天经皮下注射皮质酮(corticosterone,cort)(40mg/kg/天)以诱发小鼠的类忧郁/类焦虑症状,而空白组的小鼠则连续28天经皮下注射大豆油。
于第15天起开始给予小鼠一般饲料(测试组a与测试组b)、含乳酸菌(2*1010cfu/天)的饲料(测试组c)、含芋根江蓠水萃物(2wt%)的饲料(测试组d)或含芋根江蓠水萃物的乳酸菌发酵物(2wt%)的饲料(测试组e)。于测试组b中,小鼠仅经皮质酮诱导。
在给予饲料样品期间,仍对小鼠维持皮质酮的皮下注射诱导。
于开始喂食饲料样本14天之后,对小鼠进行旷野试验(openfieldtest)以评估小鼠的行为。
旷野试验为目前最常用的动物行为学分析方法。根据动物行为学,啮齿类动物对新环境具有趋触性(thigmotaxis)。中央区域为空旷的,其意味着威胁情境,而周边区域则相对安全,因此啮齿类动物天生有靠近周边活动的倾向。
旷野试验系于如第3a图所示的一测试箱100中进行。第3b图显示测试箱100内部的底部。测试箱的长度为40公分、宽度为30公分、高度为15公分。参见第3b图,测试箱内部被划分为中央区域101与周边区域105。中央区域101系为位于测试箱100的底部中央部分的一矩形区域,且其具有一中心点103。周边区域105位于中央区域101的外围并围绕中央区域101,且具有5公分的宽度。于试验期间进行摄影,并以动物行为追踪分析系统(noldusethovisionxt,第十版)进行记录与分析。
将小鼠放入测试箱100中的中央区域的中心点(起始点),并开始观察。记录5分钟内小鼠跨越各区域的次数、中央区域停留时间的比例、总移动距离以及站立(rearing)次数。一般啮齿类动物倾向于在周边活动,而若在中央区域的次数和时间增加,则表示忧郁/焦虑程度减轻。藉由实验动物于中央区域与周边区域的活动情形来评估实验动物的情绪反应。
b.结果
旷野试验的结果如第4a-4e图所示。第4a图显示小鼠探访中央区域的次数,第4b图显示小鼠处于中央区域的时间比例、第4c图显示小鼠的总移动距离,第4d图显示小鼠的站立次数,而第4e图显示小鼠的移动轨迹。
由第4a-4e图所示的试验结果可知,相较于空白组(测试组a)的小鼠,仅经皮质酮诱导的小鼠(测试组b)显著减少探访中央区域的次数(第4a图)与停留在中央区域的时间比例(第4b图)(p<0.05)。又,相较于空白组(测试组a)的小鼠,仅经皮质酮诱导的小鼠(测试组b)亦显著减少总移动距离(第4c图)与站立的次数(第4d图)(p<0.05)。
上述结果显示,具类忧郁/类焦虑症状的小鼠为寻求保护,会快速移动到四周找寻庇护之处,因此其在中央区域的停留时间及总移动距离会明显减少,而其站立次数减少则表示探索行为下降。
又,由第4a-4e图所示的实验结果可知,相较于仅经皮质酮诱导的小鼠(测试组b),口服给予乳酸菌(测试组c)、芋根江蓠水萃物(测试组d)或芋根江蓠水萃物的乳酸菌发酵物(测试组e)的小鼠则显著恢复探访中央区域的次数(第4a图)与停留在中央区域的时间比例(第4b图)(p<0.05)。再者,相较于仅经皮质酮诱导的小鼠(测试组b),口服给予乳酸菌(测试组c)、芋根江蓠水萃物(测试组d)或芋根江蓠水萃物的乳酸菌发酵物(测试组e)的小鼠也显示显著较高的行走意愿(第4c图)(p<0.05),且也显著增加站立次数(第4d图)(p<0.05)。
上述结果显示,乳酸菌、芋根江蓠水萃物或芋根江蓠水萃物的乳酸菌发酵物的口服给予,能够促进小鼠的对外界好奇与探索。芋根江蓠水萃物的乳酸菌发酵物恢复小鼠停留在中央区域的时间比例的效果,有优于乳酸菌或芋根江蓠水萃物的趋势(第4b图),而芋根江蓠的乳酸菌发酵物提高小鼠站立次数的效果则显著优于乳酸菌及芋根江蓠(第4d图)(p<0.05)。
实施例4
芋根江蓠水萃物与其发酵物在明暗箱试验中对于小鼠(light-darkbox,ldb)的行为改善的评估
a.方法
以实施例3中的各组小鼠进行此实验。
于开始喂食饲料样品14天之后,对小鼠进行明暗箱试验以评估小鼠的行为。
啮齿类动物对明亮灯光具有厌恶及回避的本能行为的生物学特性,因此以明暗箱试验能够评估小鼠行为的变化。
明暗箱试验系于如第5图所示的一测试箱200中进行。测试箱200内部以一隔板201分隔为明室203与暗室205。明室203中设置有一光源207以使明室203维持明亮,而暗室205中则维持黑暗。隔板201底部设置有门209,以使小鼠能够于明室与暗室之间自由移动。于实验中进行摄影,并以动物行为追分析系统(noldusethovisionxt,第十版)进行记录与分析。
将小鼠以头朝方向为背对门209的方式放入测试箱200中的明室203,并开始观察。记录5分钟内小鼠在明室的停留时间与进出明室与暗室的次数。一般啮齿类动物倾向于在暗室活动,而若啮齿类动物在明室的停留次数和时间增加及/或明暗两室的转换次数增加,则表示其忧郁/焦虑程度减轻。藉由实验动物在明室与暗室的活动情形来评估实验动物的情绪反应。
b.结果
明暗箱试验的结果如第6a与6b图所示。第6a图显示小鼠在明室的停留时间,而第6b图显示小鼠进出明室与暗室的次数。
由第6a与6b图所示的试验结果可知,仅经皮质酮诱导的小鼠(测试组b)在明室停留的时间(第6a图)与进出明室与暗室的次数(第6b图)明显低于空白组(测试组a)的小鼠(p<0.05)。
上述结果显示,具类忧郁/类焦虑症状的小鼠停留在明室的意愿减低。
由第6a与6b图所示的实验结果可知,相较于仅经皮质酮诱导的小鼠(测试组b),口服给予乳酸菌(测试组c)、芋根江蓠水萃物(测试组d)或芋根江蓠水萃物的乳酸菌发酵物(测试组e)的小鼠则显著增加在明室停留的时间与进出明室与暗室的次数(p<0.05)。
上述结果显示,乳酸菌、芋根江蓠水萃物或芋根江蓠水萃物的乳酸菌发酵物的口服给予,能够提升小鼠待移动至明室及/或待在明室的意愿。此外,芋根江蓠水萃物的乳酸菌发酵物提升小鼠在明室停留的时间与进出明室与暗室的次数的效果显著优于乳酸菌及芋根江蓠水萃物(p<0.05)。
实施例5
芋根江蓠水萃取物在蔗糖水偏好性试验中对于小鼠的行为改善的评估
a.方法
以实施例3中的各组小鼠进行此实验。
于开始喂食饲料样品14天之后,对小鼠进行蔗糖水偏好性试验以评估小鼠的行为。
啮齿类动物一般具有享乐行为,而相较于不含糖分的水,会更倾向于饮用含糖的水。而若啮齿类动物糖水偏好度提升,则表示其忧郁/焦虑程度减轻。
试验期间同时给予小鼠蔗糖含量1%(w/v)的蔗糖水及一般不含糖的水,小鼠可自由摄食两种液体,而试验时间为24小时。于试验结束后,计算小鼠对于蔗糖水与一般不含糖的水的分别的摄取量,并进行加总以获得小鼠的总液体摄取量,进而评估在24小时内小鼠对蔗糖水的选择性。蔗糖水偏好性(%)以下方所示的公式计算:
蔗糖水偏好性(%)=(蔗糖水摄取量/[蔗糖水摄取量+一般不含糖水摄取量])x100
b.结果
蔗糖水偏好性试验的结果如第7a与7b图所示。第7a图显示小鼠的蔗糖水偏好度,而第7b图显示小鼠的总液体摄取量。
由第7a图所示的试验结果可知,相较于空白组(测试组a)的小鼠,蔗糖水并无法吸引仅经皮质酮诱导的小鼠(测试组b)饮用。
上述结果显示,具类忧郁/类焦虑症状的小鼠较无享乐行为。
由第7a图所示的试验结果可知,相较于仅经皮质酮诱导的小鼠(测试组b),口服给予乳酸菌(测试组c)或芋根江蓠水萃物的乳酸菌发酵物(测试组e)的小鼠则显著提升对于蔗糖水的偏好度(p<0.05),但给予芋根江蓠水萃物(测试组d)无法提升小鼠的蔗糖水偏好度。此外,第7b图显示,各组间的总液体摄取量并无显著性差异,而此代表乳酸菌与芋根江蓠水萃物的乳酸菌发酵物的改善效应并不是由于饮水量不同所造成。
上述结果显示,芋根江蓠经乳酸菌发酵后可促进小鼠的享乐行为,并具有良好的改善情绪反应效果。
实施例6
芋根江蓠水萃取物与其发酵物对于小鼠的血清中压力激素含量的影响
a.方法
以实施例3中的各组小鼠进行此实验。
于开始喂食饲料样品14天之后,对小鼠进行采血以测定小鼠的血清皮质酮及肾上腺素(adrenaline)的浓度。
皮质酮及肾上腺素(adrenaline)皆为压力反应相关激素,其于生物体血液中浓度过高会造成动物产生忧郁/焦虑等情况。
b.结果
血清中激素测定结果如第8a与8b图所示。第8a图显示小鼠的血清中皮质酮的浓度,而第8b图显示小鼠的血清中肾上腺素的浓度。
第8a与8b图显示,相较于空白组的小鼠(测试组a),小鼠经皮质酮诱导后(测试组b),血清中压力激素、皮质酮与肾上腺素的浓度显著增加(p<0.05)。
又,第8a与8b图也显示,口服给予乳酸菌(测试组c)、芋根江蓠水萃物(测试组d)或芋根江蓠水萃物的乳酸菌发酵物(测试组e)能显著抑制小鼠因皮质酮诱导而提升的血清中压力激素含量(p<0.05)。此外,芋根江蓠水萃物的乳酸菌发酵物抑制小鼠血清中压力激素的能力显著优于乳酸菌及芋根江蓠(p<0.05)。
虽然本发明已以较佳实施例揭露如上,然其并非用以限定本发明,任何熟习此技艺者,在不脱离本发明的精神和范围内,当可作些许的更动与润饰,因此本发明的保护范围当视后附的权利要求所界定者为准。
- 还没有人留言评论。精彩留言会获得点赞!