为优化诊断性能利用边界条件模型化血流的方法和系统与流程
优先权
本申请要求2013年7月30日提交的临时申请no.61/860,138和2014年7月30日提交的美国专利申请no.14/447,195的优先权的权益,所述申请以引用的方式整体并入本文中。
实施方案包括用于模型化血流的患者特定估计的方法和系统,且更特定而言,用于产生对诊断性能而言最优的边界条件的方法和系统。
背景技术
冠状动脉疾病可在提供血液给心脏的血管中产生冠状动脉病变,诸如狭窄(血管的异常窄化)。结果,到心脏的血流可能受限制。患冠状动脉疾病的患者可体验胸痛,胸痛在强体力活动期间被称为慢性稳定型心绞痛或在患者静止时被称为不稳定型心绞痛。疾病的更严重表现可引起心肌梗死或心脏病发作。
存在提供关于冠状动脉病变的更准确数据,例如大小、形状、位置、功能意义(例如,病变是否影响血流)等的需要。遭受胸痛和/或展现冠状动脉疾病的症状的患者可经历一或多次试验,所述试验可提供关于冠状动脉病变的某一间接证据。举例来说,非侵入性试验可包括心电图、血液试验的生物标志物评估、平板试验、超声心动图、单正电子发射计算机断层扫描(spect)以及正电子发射断层扫描(pet)。然而,这些非侵入性试验通常不提供对冠状动脉病变的直接评估或不评估血液流率。所述非侵入性试验可通过寻找以下各者来提供冠状动脉病变的间接证据:心脏的电活动(例如,使用心电图(ecg))、心肌的运动(例如,使用负荷超声心动图)、心肌的灌注(例如,使用pet或spect)或代谢变化(例如,使用生物标志物)。
举例来说,解剖数据可使用冠状动脉计算机断层血管造影(ccta)以非侵入性方式获得。ccta可用于具有胸痛的患者的成像,并且包括在静脉输注造影剂之后使用计算机断层(ct)技术对心脏和冠状动脉成像。然而,ccta也不能提供关于冠状动脉病变的功能意义(例如,病变是否影响血流)的直接信息。另外,由于ccta纯粹为诊断试验,因此,其不能用以预测冠状动脉血流、压力或心肌灌注在其它生理状态(例如,锻炼)下的变化,也不能用以预测干预的后果。
因此,患者也可能需要诸如诊断心导管插入术的侵入性试验,以使冠状动脉病变可见。诊断心导管插入术可包括进行常规冠状动脉血管造影(cca)以通过为医生提供动脉的大小和形状的图像来收集关于冠状动脉病变的解剖数据。然而,cca不提供用于评估冠状动脉病变的功能意义的数据。举例来说,在未确定冠状动脉病变是否有功能意义的情况下,医生不能够诊断所述病变是否有害。因此,cca已导致被称为“目视狭窄反射(oculostenoticreflex)”的情况,某些介入心脏科医生针对用cca发现的每个病变插入支架,不管所述病变是否有功能意义。结果,cca可能导致对患者的不必要手术,此可能为患者带来增加的风险且可引起患者的不必要的医疗成本。
在诊断心导管插入术期间,冠状动脉病变的功能意义可通过测量所观察病变的血流储备分数(ffr)以侵入性方式评估。ffr被定义为例如通过静脉给药腺苷诱发的增加的冠状动脉血流的条件下的病变下游的平均血压除以病变上游的平均血压(例如,主动脉压)的比。血压可通过将压力线插入到患者中来测量。因此,在诊断心导管插入术的初始费用和风险已经发生之后,可作出基于确定的ffr治疗病变的决定。
现有技术评估冠状动脉解剖、心肌灌注以及冠状动脉血流,以非侵入性方式改善用于怀疑具有冠状动脉疾病的患者的诊断和治疗计划。这些技术依赖于建立根据成像数据建构的解剖模型的边界处的血流的生理模型。血流、血压以及诸如ffr的其它量度可在解剖模型的界限内计算。当这些结果由医师临床使用以帮助诊断和规划患者的治疗方案时,诊断性能非常重要。边界条件对准确度有极大影响且先前未经充分设计和调节以增强性能或优化诸如敏感性和特异性的各种量度的平衡。因此,需要使得边界条件能够达成最优诊断性能的系统和方法。
应理解,前述一般描述和以下的详细描述均仅为示例性和解释性的,而非限制本公开。
技术实现要素:
根据一实施方案,一种用于确定患者的心血管信息的系统包括至少一个计算机系统,所述至少一个计算机系统被配置来:接收关于所述患者的心脏的几何形状的患者特定数据;以及基于所述患者特定数据建立表示所述患者的心脏的至少一部分的三维模型。所述至少一个计算机系统经进一步配置以:建立有关于所述患者的心脏的血流特性的基于物理学的模型;以及基于所述三维模型和所述基于物理学的模型,确定所述患者的心脏内的血流储备分数。
根据另一实施方案,一种使用至少一个计算机系统确定患者特定心血管信息的方法包括:将关于所述患者的心脏的几何形状的患者特定数据输入到所述至少一个计算机系统中;以及使用所述至少一个计算机系统,基于所述患者特定数据建立表示所述患者的心脏的至少一部分的三维模型。所述方法进一步包括:使用所述至少一个计算机系统,建立有关于所述患者的心脏的血流特性的基于物理学的模型;以及使用所述至少一个计算机系统,基于所述三维模型和所述基于物理学的模型,确定所述患者的心脏内的血流储备分数。
根据另一实施方案,提供一种在至少一个计算机系统上使用的非暂时性计算机可读媒体,其含有用于进行用于确定患者特定心血管信息的方法的计算机可执行编程指令。所述方法包括:接收关于所述患者的心脏的几何形状的患者特定数据;以及基于所述患者特定数据建立表示所述患者的心脏的至少一部分的三维模型。所述方法进一步包括:建立有关于所述患者的心脏中的血流特性的基于物理学的模型;以及基于所述三维模型和所述基于物理学的模型,确定所述患者的心脏内的血流储备分数。
根据另一实施方案,一种用于规划患者的治疗方案的系统包括至少一个计算机系统,所述至少一个计算机系统被配置来:接收关于所述患者的解剖结构的几何形状的患者特定数据;以及基于所述患者特定数据建立表示所述患者的所述解剖结构的至少一部分的三维模型。所述至少一个计算机系统经进一步配置以:基于所述三维模型和有关于所述患者的所述解剖结构的基于物理学的模型,确定关于所述患者的所述解剖结构内的血流特性的第一信息;修改所述三维模型;以及基于所述经修改三维模型,确定关于所述患者的所述解剖结构内的所述血流特性的第二信息。
根据另一实施方案,提供一种在计算机系统上使用的非暂时性计算机可读媒体,其含有用于进行用于规划患者的治疗方案的方法的计算机可执行编程指令。所述方法包括:接收关于所述患者的解剖结构的几何形状的患者特定数据;以及基于所述患者特定数据建立表示所述患者的所述解剖结构的至少一部分的三维模型。所述方法进一步包括:基于所述三维模型和有关于所述患者的所述解剖结构的基于物理学的模型,确定关于所述患者的所述解剖结构内的血流特性的第一信息;以及基于所述患者的所述解剖结构的几何形状的所需变化,确定关于所述患者的所述解剖结构内的所述血流特性的第二信息。
根据另一实施方案,一种用于使用计算机系统规划患者的治疗方案的方法包括:将关于所述患者的解剖结构的几何形状的患者特定数据输入到至少一个计算机系统中;以及使用所述至少一个计算机系统,基于所述患者特定数据建立表示所述患者的所述解剖结构的至少一部分的三维模型。所述方法进一步包括使用所述至少一个计算机系统,基于所述三维模型和有关于所述患者的所述解剖结构的基于物理学的模型,确定关于所述患者的所述解剖结构内的血流特性的第一信息。所述方法还包括:使用所述至少一个计算机系统,修改所述三维模型;以及使用所述至少一个计算机系统,基于所述经修改三维模型确定关于所述患者的所述解剖结构内的所述血流特性的第二信息。
根据另一实施方案,一种用于规划患者的治疗方案的系统包括至少一个计算机系统,所述至少一个计算机系统被配置来:接收关于所述患者的解剖结构的几何形状的患者特定数据;以及基于所述患者特定数据建立表示所述患者的所述解剖结构的至少一部分的三维模型。所述至少一个计算机系统还被配置来:基于所述三维模型和关于所述患者的生理条件的信息,确定关于所述患者的所述解剖结构内的血流特性的第一信息;修改所述患者的所述生理条件;以及基于所述患者的所述经修改生理条件,确定关于所述患者的所述解剖结构内的所述血流特性的第二信息。
根据另一实施方案,提供一种在计算机系统上使用的非暂时性计算机可读媒体,其含有用于进行用于规划患者的治疗方案的方法的计算机可执行编程指令。所述方法包括:接收关于所述患者的解剖结构的几何形状的患者特定数据;以及基于所述患者特定数据建立表示所述患者的所述解剖结构的至少一部分的三维模型。所述方法进一步包括:基于所述三维模型和关于所述患者的生理条件的信息,确定关于所述患者的所述解剖结构内的血流特性的第一信息;以及基于所述患者的所述生理条件的所需变化,确定关于所述患者的所述解剖结构内的所述血流特性的第二信息。
根据另一实施方案,一种用于使用至少一个计算机系统规划患者的治疗方案的方法包括:将关于所述患者的解剖结构的几何形状的患者特定数据输入到至少一个计算机系统中;以及使用所述至少一个计算机系统,基于所述患者特定数据建立表示所述患者的所述解剖结构的至少一部分的三维模型。所述方法还包括使用所述至少一个计算机系统,基于所述三维模型和关于所述患者的生理条件的信息,确定关于所述患者的所述解剖结构内的血流特性的第一信息。所述方法进一步包括:使用所述至少一个计算机系统,修改所述患者的所述生理条件;以及使用所述至少一个计算机系统,基于所述患者的所述经修改生理条件,确定关于所述患者的所述解剖结构内的所述血流特性的第二信息。
根据另一实施方案,一种用于确定患者特定心血管信息的系统包括至少一个计算机系统,所述至少一个计算机系统被配置来:接收关于所述患者的解剖结构的几何形状的患者特定数据;以及基于所述患者特定数据建立表示所述患者的所述解剖结构的至少一部分的三维模型。所述至少一个计算机系统还被配置来:确定与通过所述患者的所述解剖结构的所述部分的总流量关联的总阻力;以及基于所述三维模型、有关于所述患者的所述解剖结构的基于物理学的模型以及所述已确定总阻力,确定关于所述患者的所述解剖结构内的血流特性的信息。
根据另一实施方案,一种用于使用至少一个计算机系统确定患者特定心血管信息的方法包括:将关于所述患者的解剖结构的几何形状的患者特定数据输入到所述至少一个计算机系统中;以及使用至少一个计算机,基于所述患者特定数据建立表示所述患者的所述解剖结构的至少一部分的三维模型。所述方法还包括:使用至少一个计算机,确定与通过所述患者的所述解剖结构的所述部分的总流量关联的总阻力;以及使用至少一个计算机,基于所述三维模型、有关于所述患者的所述解剖结构的基于物理学的模型以及所述已确定总阻力,确定关于所述患者的所述解剖结构内的血流特性的信息。
根据另一实施方案,提供一种在计算机系统上使用的非暂时性计算机可读媒体,其含有用于进行用于确定患者特定心血管信息的计算机可执行编程指令。所述方法包括:接收关于所述患者的解剖结构的几何形状的患者特定数据;以及基于所述患者特定数据建立表示所述患者的所述解剖结构的至少一部分的三维模型。所述方法还包括:确定与通过所述患者的所述解剖结构的所述部分的总流量关联的总阻力;以及基于所述三维模型、有关于所述患者的所述解剖结构的基于物理学的模型以及所述已确定总阻力,确定关于所述患者的所述解剖结构内的血流特性的信息。
根据另一实施方案,一种用于使用网站提供患者特定心血管信息的系统包括至少一个计算机系统,所述至少一个计算机系统被配置来:允许远程用户访问网站;接收关于所述患者的解剖结构的几何形状的至少一部分的患者特定数据;基于所述患者特定数据建立表示所述患者的所述解剖结构的至少一部分的三维模型;以及基于所述三维模型和所述患者的生理条件,确定关于所述患者的所述解剖结构内的血流特性的信息。所述至少一个计算机系统还被配置来使用所述网站将关于所述患者的所述解剖结构的至少所述部分的第一三维模拟的显示信息传达到所述远程用户。所述三维模拟包括关于所述血流特性的已确定信息。
根据另一实施方案,一种用于使用网站提供患者特定心血管信息的方法包括:使用至少一个计算机系统,允许远程用户访问网站;以及使用所述所述至少一个计算机系统,接收关于所述患者的解剖结构的几何形状的患者特定数据。所述方法还包括:使用所述至少一个计算机系统,基于所述患者特定数据建立表示所述患者的所述解剖结构的至少一部分的三维模型;以及使用所述至少一个计算机系统,基于所述三维模型和所述患者的生理条件,确定关于所述患者的所述解剖结构内的血流特性的信息。所述方法进一步包括使用所述至少一个计算机系统,使用所述网站将关于所述患者的所述解剖结构的至少所述部分的第一三维模拟的显示信息传达到所述远程用户。所述三维模拟包括关于所述血流特性的已确定信息。
根据另一实施方案,提供一种在计算机系统上使用的非暂时性计算机可读媒体,其含有用于进行用于使用网站提供患者特定心血管信息的方法的计算机可执行编程指令。所述方法包括:允许远程用户访问网站;接收关于所述患者的解剖结构的几何形状的患者特定数据;以及基于所述患者特定数据建立表示所述患者的所述解剖结构的至少一部分的三维模型。所述方法还包括:基于所述三维模型和有关于所述患者的所述解剖结构的基于物理学的模型,确定关于所述患者的所述解剖结构内的血流特性的信息;以及使用所述网站将关于所述患者的所述解剖结构的至少所述部分的第一三维模拟的显示信息传达到所述远程用户。所述三维模拟包括关于所述血流特性的已确定信息。
根据另一实施方案,一种用于确定患者特定时变心血管信息的系统包括至少一个计算机系统,所述至少一个计算机系统被配置来:在不同时间接收关于所述患者的解剖结构的至少一部分的几何形状的时变患者特定数据;以及基于所述患者特定数据建立表示所述患者的所述解剖结构的至少一部分的三维模型。所述至少一个计算机系统还被配置来基于所述三维模型和有关于所述患者的所述解剖结构的基于物理学的模型,确定关于所述患者的所述解剖结构内的血流特性随时间的变化的信息。
根据另一实施方案,一种用于使用至少一个计算机系统确定患者特定时变心血管信息的方法包括使用至少一个计算机系统,在不同时间接收关于所述患者的解剖结构的几何形状的时变患者特定数据。所述方法还包括使用所述至少一个计算机系统,基于所述患者特定数据建立表示所述患者的所述解剖结构的至少一部分的三维模型。所述方法进一步包括使用所述至少一个计算机系统,基于所述三维模型和关于有关于所述患者的所述解剖结构的基于物理学的模型的所述信息,确定关于所述患者的所述解剖结构内的血流特性随时间的变化的信息。
根据另一实施方案,提供一种在计算机系统上使用的非暂时性计算机可读媒体,其含有用于进行用于确定患者特定时变心血管信息的方法的计算机可执行编程指令。所述方法包括:在不同时间接收关于所述患者的解剖结构的几何形状的时变患者特定数据;基于所述患者特定数据建立表示所述患者的所述解剖结构的至少一部分的三维模型;以及基于所述三维模型和关于有关于所述患者的所述解剖结构的基于物理学的模型的所述信息,确定关于所述患者的所述解剖结构内的血流特性随时间的变化的信息。
根据另一实施方案,一种用于确定患者的心血管信息的系统包括至少一个计算机系统,所述至少一个计算机系统被配置来接收关于所述患者的解剖结构的至少一部分的几何形状和至少一种材料性质的患者特定数据。所述解剖结构包括血管的至少一部分。所述至少一个计算机系统经进一步配置以:基于所述患者特定数据建立表示所述患者的所述解剖结构的三维模型;以及基于所述三维模型和所述患者的生理条件,确定关于所述患者的所述解剖结构内的血流特性的信息。所述至少一个计算机系统还被配置来识别所述血管内的斑块的位置。
根据另一实施方案,一种用于使用至少一个计算机系统确定患者的心血管信息的方法包括使用至少一个计算机系统,接收关于所述患者的解剖结构的至少一部分的几何形状和至少一种材料性质的患者特定数据。所述解剖结构包括血管的至少一部分。所述方法还包括:使用所述至少一个计算机系统,基于所述患者特定数据建立表示所述患者的所述解剖结构的三维模型;以及使用所述至少一个计算机系统,基于所述三维模型和所述患者的生理条件,确定关于所述患者的所述解剖结构内的血流特性的信息。所述方法进一步包括使用所述至少一个计算机系统,识别所述血管内的斑块。
根据另一实施方案,提供一种在计算机系统上使用的非暂时性计算机可读媒体,其含有用于进行用于确定患者的心血管信息的方法的计算机可执行编程指令。所述方法包括接收关于所述患者的解剖结构的至少一部分的几何形状和至少一种材料性质的患者特定数据。所述解剖结构包括血管的至少一部分。所述方法还包括:基于所述患者特定数据建立表示所述患者的所述解剖结构的三维模型;以及基于所述三维模型和所述患者的生理条件,确定关于所述患者的所述解剖结构内的血流特性的信息;以及识别所述血管内的斑块的位置。
根据另一实施方案,一种用于确定患者的心血管信息的系统包括至少一个计算机系统,所述至少一个计算机系统被配置来接收关于所述患者的解剖结构的至少一部分的几何形状的患者特定数据。所述解剖结构包括多个动脉的至少一部分和连接到所述多个动脉的至少一部分的组织。所述至少一个计算机系统经进一步配置以:基于所述患者特定数据建立表示所述患者的所述解剖结构的三维模型;将所述三维模型的表示所述组织的至少一部分划分为多个段;以及基于所述三维模型和所述患者的生理条件,确定关于与所述段中的至少一个关联的血流特性的信息。
根据另一实施方案,一种用于使用至少一个计算机系统确定患者的心血管信息的方法包括使用至少一个计算机系统,接收关于所述患者的解剖结构的至少一部分的几何形状的患者特定数据。所述解剖结构包括多个动脉的至少一部分和连接到所述多个动脉的至少一部分的组织。所述方法还包括:使用所述至少一个计算机系统,基于所述患者特定数据建立表示所述患者的所述解剖结构的三维模型;以及使用所述至少一个计算机系统,扩展所述三维模型以形成扩大模型。所述方法进一步包括:使用所述至少一个计算机系统,将所述扩大模型的表示所述组织的至少一部分划分为多个段;以及使用所述至少一个计算机系统,基于所述扩大模型和所述患者的生理条件,确定关于与所述段中的至少一个关联的血流特性的信息。
根据另一实施方案,提供一种在计算机系统上使用的非暂时性计算机可读媒体,其含有用于进行用于确定患者的心血管信息的方法的计算机可执行编程指令。所述方法包括接收关于所述患者的解剖结构的至少一部分的几何形状的患者特定数据。所述解剖结构包括多个动脉的至少一部分和连接到所述多个动脉的至少一部分的组织。所述方法还包括:基于所述患者特定数据建立表示所述患者的所述解剖结构的三维模型;将所述三维模型的表示所述组织的至少一部分划分为多个段;以及基于所述三维模型和有关于所述解剖结构的基于物理学的模型,确定关于与所述段中的至少一个关联的血流特性的信息。
根据另一实施方案,一种用于确定患者的心血管信息的系统包括至少一个计算机系统,所述至少一个计算机系统被配置来接收关于所述患者的脑部的几何形状的患者特定数据。所述至少一个计算机系统经进一步配置以:基于所述患者特定数据建立表示所述患者的脑部的至少一部分的三维模型;以及基于所述三维模型和有关于所述患者的脑部的基于物理学的模型,确定关于所述患者的脑内的血流特性的信息。
根据另一实施方案,一种用于至少一个计算机系统确定患者特定心血管信息的方法包括将关于所述患者的多个脑动脉的至少一部分的几何形状的患者特定数据输入到所述至少一个计算机系统中。所述方法还包括;使用所述至少一个计算机系统,基于所述患者特定数据建立表示所述患者的所述脑动脉的至少所述部分的三维模型;以及使用所述至少一个计算机系统,基于所述三维模型和有关于所述患者的所述脑动脉的基于物理学的模型,确定关于所述患者的所述脑动脉内的血流特性的信息。
根据另一实施方案,提供一种在至少一个计算机系统上使用的非暂时性计算机可读媒体,其含有用于进行用于确定患者特定心血管信息的方法的计算机可执行编程指令。所述方法包括:接收关于所述患者的脑部的几何形状的患者特定数据;基于所述患者特定数据建立表示所述患者的脑部的至少一部分的三维模型;以及基于所述三维模型和有关于所述患者的脑部的基于物理学的模型,确定关于所述患者的脑内的血流特性的信息。
额外实施方案和优点将部分地在随后的描述中阐述,并且将部分地从所述描述显而易见,或者可通过实践本公开来习得。实施方案和优点将借助于下文特定指出的元件和组合来实现和达到。
附图说明
并入本说明书中且构成本说明书的部分的附图说明若干实施方案,并且与描述一起用来解释本公开的原理。
图1为根据一示例性实施方案的用于提供有关于特定患者中的冠脉血流的各种信息的系统的示意图;
图2为根据一示例性实施方案的用于提供有关于特定患者中的血流的各种信息的方法的流程图;
图3为示出图2的方法的子步骤的流程图;
图4示出根据一示例性实施方案的非侵入性地从患者获得的成像数据;
图5示出使用图4的成像数据产生的示例性三维模型;
图6示出图4的成像数据的切片的部分,所述部分包括用于形成第一初始模型的种子;
图7示出通过扩展(expanding)图6的种子形成的第一初始模型的一部分;
图8示出根据一示例性实施方案的经裁剪实体模型;
图9示出当患者静止时的示例性计算ffr(cffr)模型;
图10示出当患者处于最大充血时的示例性cffr模型;
图11示出当患者处于最大运动时的示例性cffr模型;
图12示出根据一示例性实施方案的为了形成集总参数模型而提供的经裁剪实体模型的一部分;
图13示出用于为了形成集总参数模型而提供的图12的经裁剪实体模型的中心线的一部分;
图14示出基于为了形成集总参数模型而提供的图12的经裁剪实体模型所形成的多个段;
图15示出为了形成集总参数模型而提供的经电阻器替换的图14的段;
图16示出根据一示例性实施方案的示例性集总参数模型,表示实体模型的流入和流出边界处的上游和下游结构;
图17示出基于图8的实体模型制备的三维网格;
图18和19示出图17的三维网格的部分;
图20示出患者的解剖的模型,其包含血流信息,其中模型上的某些点通过个别参考标签来识别;
图21为主动脉中和图20中所识别的点中的一些点处的模拟血压随时间变化的图;
图22为图20中所识别的点中的每一个点处的模拟血流量随时间变化的图;
图23为根据一示例性实施方案的最终报告;
图24a为根据一示例性实施方案的用于提供有关于特定患者中的冠脉血流的各种信息的方法的流程图;
图24b和24c为根据一示例性实施方案的用于提供有关于特定患者中的冠脉血流的各种信息的方法的额外流程图;
图24d和24e为根据一示例性实施方案的不同血管区域中的狭窄的直径减小百分比和测量ffr的群体数据的示例性图表;
图25示出根据一示例性实施方案的基于通过加宽左前降支(lad)动脉的部分和lcx动脉的部分建立的实体模型确定的经修改cffr模型;
图26示出根据一示例性实施方案的在加宽lad动脉的一部分和左旋支(lcx)动脉的一部分之后的经修改模拟血流量模型的实例;
图27为根据一示例性实施方案的用于使用降阶模型模拟各种治疗选项的方法的流程图;
图28为根据另一示例性实施方案的用于使用降阶模型模拟各种治疗选项的方法的流程图;
图29为根据一示例性实施方案的用于提供有关于特定患者中的心肌灌注的各种信息的方法的流程图;
图30为根据另一示例性实施方案的用于提供有关于特定患者中的心肌灌注的各种信息的方法的流程图;
图31示出根据另一示例性实施方案的提供有关于心肌灌注的各种信息的患者特定模型;
图32为根据又一示例性实施方案的用于提供有关于特定患者中的心肌灌注的各种信息的方法的流程图;
图33为沿着血管壁积聚的斑块的截面图;
图34示出根据一示例性实施方案的提供有关于斑块易损性的各种信息的患者特定模型;
图35为根据一示例性实施方案的用于提供有关于评估特定患者中的斑块易损性、心肌体积风险以及心肌灌注风险的各种信息的方法的流程图;
图36为示出根据一示例性实施方案的从图35的方法所获得的信息的示意图;
图37为脑动脉的图;
图38为根据一示例性实施方案的用于提供有关于特定患者中的颅内和颅外血流的各种信息的方法的流程图;
图39为根据一示例性实施方案的用于提供有关于特定患者中的脑灌注的各种信息的方法的流程图;
图40为根据另一示例性实施方案的用于提供有关于特定患者中的脑灌注的各种信息的方法的流程图;
图41为根据又一示例性实施方案的用于提供有关于特定患者中的脑灌注的各种信息的方法的流程图;以及
图42为根据一示例性实施方案的用于提供有关于评估特定患者中的斑块易损性、脑体积风险以及脑灌注风险的各种信息的方法的流程图。
具体实施方式
现在将详细参考示例性实施方案,所述实施方案的实例在附图中说明。只要有可能,将遍及图式使用相同参考数字来指代相同或相似部分。这个描述是根据以下大纲组织:
i.概述
ii.获得并预处理患者特定解剖数据
iii.基于获得的解剖数据建立三维模型以为分析做准备
iv.准备模型以用于分析和确定边界条件
a.准备模型以用于分析
b.确定边界条件
i.确定降阶模型
ii.示例性集总参数模型
c.针对准确度优化边界条件
1.基于群体结果进行调节
2.调整区域性边界条件
d.建立三维网格
v.进行计算分析和输出结果
a.进行计算分析
b.显示血压、血流量以及cffr的结果
c.验证结果
d.用于提供冠脉血流信息的系统和方法的另一实施方案
e.用于提供患者在身体活动期间的冠脉血流信息的系统和方法的示例性实施方案
vi.提供患者特定治疗计划
a.使用降阶模型比较不同治疗选项
vii.其它结果
a.评估心肌灌注
b.评估斑块易损性
viii.其它应用
a.模型化颅内和颅外血流
i.评估脑灌注
ii.评估斑块易损性。
i.概述
在一示例性实施方案中,方法和系统使用以非侵入性方式从患者接收的信息来确定有关于特定患者中的血流的各种信息。所确定信息可与患者的冠状血管中的血流有关。或者,如下文将更详细描述,所确定信息可与患者的血管的其它区(诸如颈动脉、外围、腹部、肾以及脑血管)中的血流有关。冠状血管包括从大动脉到小动脉、毛细血管、小静脉、静脉等的血管的复杂网络。冠状血管使血液循环到心脏以及在心脏内循环并且包括供应血液到多个主冠状动脉4(图5)(例如,左前降支(lad)动脉、左旋支(lcx)动脉、右冠状(rca)动脉等)的主动脉2(图5),所述主动脉可进一步划分成在主动脉2和主冠状动脉4下游的动脉或其它类型的血管的分支。因此,示例性方法和系统可确定有关于主动脉、主冠状动脉和/或在主冠状动脉下游的其它冠状动脉或血管内的血流的各种信息。尽管主动脉和冠状动脉(以及从冠状动脉伸出的分支)在下文加以讨论,但是公开的方法和系统也可适用于其它类型的血管。
在一示例性实施方案中,通过公开的方法和系统确定的信息可包括(但不限于)各种血流特性或参数,诸如主动脉、主冠状动脉和/或在主冠状动脉下游的其它冠状动脉或血管中的各种位置处的血流速度、压力(或两者之比)、流率以及ffr。这个信息可用以确定病变是否有功能意义和/或是否治疗病变。这个信息可使用以非侵入性方式从患者获得的信息确定。结果,可作出是否治疗病变的决定而不会有与侵入性治疗关联的的代价和风险。
图1示出根据一示例性实施方案的用于提供有关于特定患者中的冠脉血流的各种信息的系统的方面。患者的解剖的三维模型10可使用以非侵入性方式从患者获得的数据建立,如下文将更详细描述。其它患者特定信息也可以非侵入性方式获得。在一示例性实施方案中,患者的解剖的由三维模型10表示的部分可包括主动脉的至少一部分和连接到主动脉的主冠状动脉的近端部分(以及从其伸出或发出的分支)。
有关于冠脉血流的各种生理规律或关系20可(例如)从实验数据推断,如下文将更详细描述。使用三维解剖模型10和推断的生理规律20,可确定有关于冠脉血流的多个方程式30,如下文将更详细描述。举例来说,方程式30可使用任何数值方法(例如,有限差分、有限体积、频谱、格子玻尔兹曼、基于粒子、水平集、有限元方法等)确定以及求解。方程式30可能有解以确定由模型10表示的解剖中的各种点处的关于患者的解剖中的冠脉血流的信息(例如,压力、速度、ffr等)。
方程式30可使用计算机40解出。基于解出的方程式,计算机40可输出一个或多个图像或模拟,所述图像或模拟指示有关于由模型10表示的患者的解剖中的血流的信息。举例来说,图像可包括模拟血压模型50、模拟血流量或速度模型52、计算ffr(cffr)模型54等,如下文将更详细描述。模拟血压模型50、模拟血流模型52以及cffr模型54提供关于由模型10表示的患者的解剖中的沿着三个维度的各种位置处的各个血压、速度以及cffr的信息。在增加的冠脉血流的条件(例如,传统上由腺苷的静脉给药诱发)下,cffr可计算为模型10中的特定位置处的血压除以主动脉中的血压(例如,在模型10的流入边界处)的比。
在一示例性实施方案中,计算机40可包括存储指令的一个或多个非暂时性计算机可读存储装置,所述指令在由处理器、计算机系统等执行时可进行本文中所描述的用于提供有关于患者中的血流的各种信息的动作中的任一者。计算机40可包括台式或便携式计算机、工作站、服务器、个人数字助理或任何其它计算机系统。计算机40可包括处理器、只读存储器(rom)、随机存取存储器(ram)、用于连接外围装置(例如,输入装置、输出装置、存储装置等)的输入/输出(i/o)适配器、用于连接诸如键盘、鼠标、触摸屏、语音输入的输入装置和/或其它装置的用户界面适配器、用于将计算机40连接到网络的通信适配器、用于将计算机40连接到显示器的显示器适配器等。举例来说,显示器可用以显示三维模型10和/或通过解出方程式30产生的任何图像,诸如模拟血压模型50、模拟血流模型52和/或cffr模型54。
图2示出根据另一示例性实施方案的用于提供有关于特定患者中的血流的各种信息的方法的方面。所述方法可包括获得患者特定解剖数据,诸如关于患者的解剖(例如,主动脉的至少一部分,和主冠状动脉(以及从主冠状动脉伸出的分支)的连接到主动脉的近端部分)的信息,以及预处理所述数据(步骤100)。患者特定解剖数据可例如通过ccta以非侵入性方式获得,如下文将描述。
可基于获得的解剖数据来建立患者的解剖的三维模型(步骤200)。举例来说,三维模型可为上文结合图1所描述的患者的解剖的三维模型10。
可准备三维模型以用于分析且可确定边界条件(步骤300)。举例来说,上文结合图1所描述的患者的解剖的三维模型10可经裁剪并且离散化成体积网格,例如,有限元或有限体积网格。体积网格可用以产生上文结合图1所描述的方程式30。
还可指派边界条件并且将边界条件并入到上文结合图1所描述的方程式30中。边界条件提供关于三维模型10的在其边界(例如,流入边界322(图8)、流出边界324(图8)、血管壁边界326(图8)等)处的信息。流入边界322可包括血流经引导到三维模型的解剖中所经过的边界,诸如在主动脉的靠近主动脉根的末端(例如,图16中示出的末端a)。通过将心脏模型和/或集总参数模型耦合到边界等,每一流入边界322可经指派(例如)关于速度、流率、压力或其它特性的指定值或域(field)。流出边界324可包括血流从三维模型的解剖向外引导所经过的边界,诸如主动脉的靠近主动脉弓的末端(例如,图16中示出的末端b),和主冠状动脉以及从其伸出的分支的下游末端(例如,图16中示出的末端a到m)。每一流出边界可例如通过耦合集总参数或分散式(例如,一维波传播)模型来指派,如下文将详细描述。流入和/或流出边界条件的指定值可通过以非侵入性方式测量患者的生理特性(诸如,但不限于,心输出量(来自心脏的血流的体积)、血压、心肌质量等)来确定。血管壁边界可包括三维模型10的主动脉、主冠状动脉和/或其它冠状动脉或血管的物理边界。
边界条件(特别是表示远端血管的下游出口处的边界条件)可对如ffr的计算量度的诊断准确度有影响。这些边界条件的设计对于诸如敏感性、特异性、偏置(bias)、误差等的性能来说必不可少。边界条件可通过构造数据库系统和方法以用于分析患者特定数据集、计算的血流结果以及侵入性验证结果的总体来调节。诊断准确度对比侵入性参考标准可通过开发以及调节边界条件以最好地匹配侵入性结果来增强。经调节结果可接着在数据库中测试并且应用于用于未来患者特定分析的一般模型。
此外,边界条件可唯一地在模型的不同部分中应用。举例来说,lad、rca以及lcx血管区域或血管与区域的其它组合可全部具有不同的边界条件设计以增强总体诊断性能。这些边界条件可通过多种方法确定,所述方法包括(但不限于)分析方法、重复调节、优化或机器学习。
计算分析可使用预备的三维模型和所确定边界条件进行(步骤400)以确定患者的血流信息。举例来说,计算分析可利用方程式30和上文结合图1所描述的计算机40来进行,以产生上文结合图1所描述的图像,诸如模拟血压模型50、模拟血流模型52和/或cffr模型54。
所述方法还可包括使用所述结果提供患者特定治疗选项(步骤500)。举例来说,步骤200中所建立的三维模型10和/或步骤300中所指派的边界条件可经调整以模型化一个或多个治疗方案,例如,在三维模型10中所表示的冠状动脉中的一者中放置冠状动脉支架或其它治疗选项。接着,可如上文在步骤400中所描述地进行计算分析,以便产生新图像,诸如血压模型50、血流模型52和/或cffr模型54的更新版本。这些新图像可用以确定采用所述治疗选项的情况下的血流速度和压力的变化。
本文中所公开的系统和方法可并入医师可访问的软件工具中以提供用以量化冠状动脉中的血流和评估冠状动脉疾病的功能意义的非侵入性手段。另外,医师可使用软件工具预测医药、介入和/或手术治疗对冠状动脉血流的影响。软件工具可预防、诊断、管理和/或治疗心血管系统的其它部分中的疾病,所述部分包括颈部的动脉(例如,颈动脉)、头部中的动脉(例如,脑动脉)、胸部中的动脉、腹部中的动脉(例如,腹部主动脉及其分支)、臂中的动脉或腿中的动脉(例如,股动脉和腘动脉)。软件工具可为互动式的以使得医师能够针对患者开发最优个性化治疗。
举例来说,软件工具可至少部分地并入到计算机系统(例如,图1中示出的由医师或其它用户使用的计算机40)中。计算机系统可接收以非侵入性方式从患者获得的数据(例如,用以建立三维模型10的数据、用以应用边界条件或进行计算分析的数据等)。举例来说,数据可由医师输入或可从能够访问并提供这个数据的另一源(诸如放射或其它医学实验室)接收。数据可通过用于传达所述数据的网络或其它系统传输,或直接传输到计算机系统中。软件工具可使用数据产生并显示三维模型10或通过解出上文结合图1所描述的方程式30确定的其它模型/网格和/或任何模拟或其它结果,诸如模拟血压模型50、模拟血流模型52和/或cffr模型54。因此,软件工具可进行步骤100到500。在步骤500中,医师可将其它输入提供到计算机系统以选择可能治疗选项,并且计算机系统可基于所选择的可能治疗选项而向医师显示新模拟。另外,图2中所示出的步骤100到500中的每一者可使用独立软件包或模块进行。
或者,软件工具可作为基于网站的服务或其它服务(例如,由与医师分开的实体提供的服务)的部分而提供。服务提供者可(例如)操作基于网站的服务并且可提供门户网站或其它基于网站的应用(例如,在由服务提供者操作的服务器或其它计算机系统上执行),其可由医师或其它用户通过在计算机系统之间传达数据的网络或其它方法访问。举例来说,以非侵入性方式从患者获得的数据可提供到服务提供者,并且服务提供者可使用数据产生三维模型10或通过解出上文结合图1所描述的方程式30确定的其它模型/网格和/或任何模拟或其它结果,诸如模拟血压模型50、模拟血流模型52和/或cffr模型54。接着,基于网站的服务可传输有关于三维模型10或其它模型/网格和/或模拟的信息,使得三维模型10和/或模拟可在医师的计算机系统上向医师显示。因此,基于网站的服务可进行步骤100到500和下文所描述的用于提供患者特定信息的任何其它步骤。在步骤500中,医师可提供(例如)另外输入以选择可能的治疗选项或对计算分析进行其它调整,并且所述输入可(例如,通过门户网站)传输到由服务提供者操作的计算机系统。基于网站的服务可基于所选择的可能治疗选项产生新模拟或其它结果,并且可将有关于新模拟的信息传回给医师,使得所述新模拟可向医师显示。
应理解,本文中所描述的步骤中的一个或多个可由一个或多个人类操作者(例如,心脏科医生或其它医师、患者、提供基于网站的服务或由第三方提供的其它服务的服务提供者的雇员、其它用户等)或这些人类操作者所使用的一个或多个计算机系统(诸如台式或便携式计算机、工作站、服务器、个人数字助理等)进行。计算机系统可通过网络或其它数据通信方法连接。
图3示出用于提供有关于特定患者中的血流的各种信息的示例性方法的其它方面。图3中示出的方面可并入软件工具中,所述软件工具可至少部分地并入计算机系统中和/或作为基于网站的服务的部分。
ii.获得并预处理患者特定解剖数据
如上文结合图2中示出的步骤100所描述,示例性方法可包括获得患者特定解剖数据(诸如关于患者的心脏的信息)并预处理所述数据。在一示例性实施方案中,步骤100可包括以下步骤。
最初,可选择患者。举例来说,在医师确定关于患者的冠脉血流的信息是所要时,例如,在患者正在经历与冠状动脉疾病关联的症状(诸如胸痛、心脏病发作等)的情况下,患者可由医师选择。
可获得患者特定解剖数据,诸如关于患者的心脏的几何形状的数据,例如,患者的主动脉的至少一部分、连接到主动脉的主冠状动脉的近端部分(以及从所述部分延伸的分支)以及心肌。患者特定解剖数据可以非侵入性方式获得,例如,使用非侵入性成像方法。举例来说,ccta是用户可用来操作计算机断层(ct)扫描仪察看并建立结构(例如,心肌、主动脉、主冠状动脉以及连接到前述各者的其它血管)的图像的成像方法。ccta数据可为时变的,例如,以示出血管形状在心动周期中的变化。ccta可用以产生患者的心脏的图像。举例来说,可获得64切片ccta数据(例如,有关于患者的心脏的64切片的数据)并将所述数据组装成三维图像。图4示出由64切片ccta数据产生的三维图像120的实例。
或者,其它非侵入性成像方法(诸如磁共振成像(mri)或超声波(us))或侵入性成像方法(诸如数字减影血管造影(dsa))可用以产生患者的解剖的结构的图像。所述成像方法可涉及对患者静脉注射造影剂以使得能够识别解剖的结构。所得成像数据(例如,由ccta、mri等提供)可由第三方供应商(诸如放射实验室或心脏科医生)、由患者的医师等提供。
其它患者特定解剖数据也可以非侵入性方式从患者确定。举例来说,可测量诸如患者的血压、基线心率、身高、体重、红细胞比容、搏出量等的生理数据。血压可为患者的肱动脉中的血压(例如,使用血压计),诸如最大(心脏收缩)和最小(心脏舒张)压力。
如上所述获得的患者特定解剖数据可通过安全通信线路(例如,通过网络)传送。举例来说,数据可传送到服务器或其它计算机系统以用于进行计算分析,例如,上文在步骤400中所描述的计算分析。在一示例性实施方案中,数据可传送到由提供基于网站的服务的服务提供者操作的服务器或计算机系统。或者,数据可传送到由患者的医师或其它用户操作的计算机系统。
回头参看图3,可复查经传送数据以判定所述数据是否可接受(步骤102)。所述判定可由用户和/或由计算机系统进行。举例来说,经传送数据(例如,ccta数据和其它数据)可(例如)由用户和/或由计算机系统验证,以判定ccta数据是否完整(例如,包括主动脉和主冠状动脉的足够部分)并且对应于正确患者。
也可预处理并评估经传送数据(例如,ccta数据和其它数据)。预处理和/或评估可由用户和/或计算机系统进行并且可能包括(例如)检查ccta数据中的误配准、不一致或模糊、检查ccta数据中示出的支架、检查可能阻碍血管的管腔的可见性的伪影、检查结构(例如,主动脉、主冠状动脉以及其它血管)与患者的其它部分之间的足够对比度等。
可评估经传送数据以基于上述的验证、预处理和/或评估来判定所述数据是否可接受。在上述的验证、预处理和/或评估期间,用户和/或计算机系统可能能够校正数据的某些错误或问题。然而,如果错误或问题太多,那么可以确定数据是不可接受的,并且用户和/或计算机系统可产生解释使拒绝经传送数据成为必要的错误或问题的拒绝报告。任选地,可进行新的ccta扫描和/或可再次从患者测量上述的生理数据。如果确定经传送数据为可接受的,那么方法可前进到下文所描述的步骤202。
因此,图3中示出并且在上文描述的步骤102可被视为图2的步骤100的子步骤。
iii.基于获得的解剖数据建立三维模型
如上文结合图2中示出的步骤200所描述,示例性方法可包括基于获得的解剖数据建立三维模型。在一示例性实施方案中,步骤200可包括以下步骤。
使用ccta数据,可产生冠状血管的三维模型。图5示出使用ccta数据产生的三维模型220的表面的实例。举例来说,模型220可包括(例如)主动脉的至少一部分、连接到主动脉的所述部分的一个或多个主冠状动脉的至少近端部分、连接到主冠状动脉的一个或多个分支的至少近端部分等。主动脉、主冠状动脉和/或分支的模型化部分可以互连并且成树状,以使得没有部分与模型220的剩余部分断开。形成模型220的过程被称作分段(segmentation)。
回头参看图3,计算机系统可自动对主动脉的至少一部分(步骤202)和心肌(或其它心脏组织,或连接到待模型化的动脉的其它组织)(步骤204)分段。计算机系统也可对连接到主动脉的主冠状动脉的至少一部分分段。在一示例性实施方案中,计算机系统可允许用户选择一个或多个冠状动脉根部或起点(步骤206)以便对主冠状动脉分段。
分段可使用各种方法进行。分段可由计算机系统基于用户输入或在无用户输入下自动进行。举例来说,在一示例性实施方案中,用户可将输入提供到计算机系统以便产生第一初始模型。举例来说,计算机系统可向用户显示从ccta数据产生的三维图像120(图4)或其切片。三维图像120可包括亮度的变化强度的部分。举例来说,较亮区可指示主动脉、主冠状动脉和/或分支的管腔。较暗区可指示患者的心脏的心肌和其它组织。
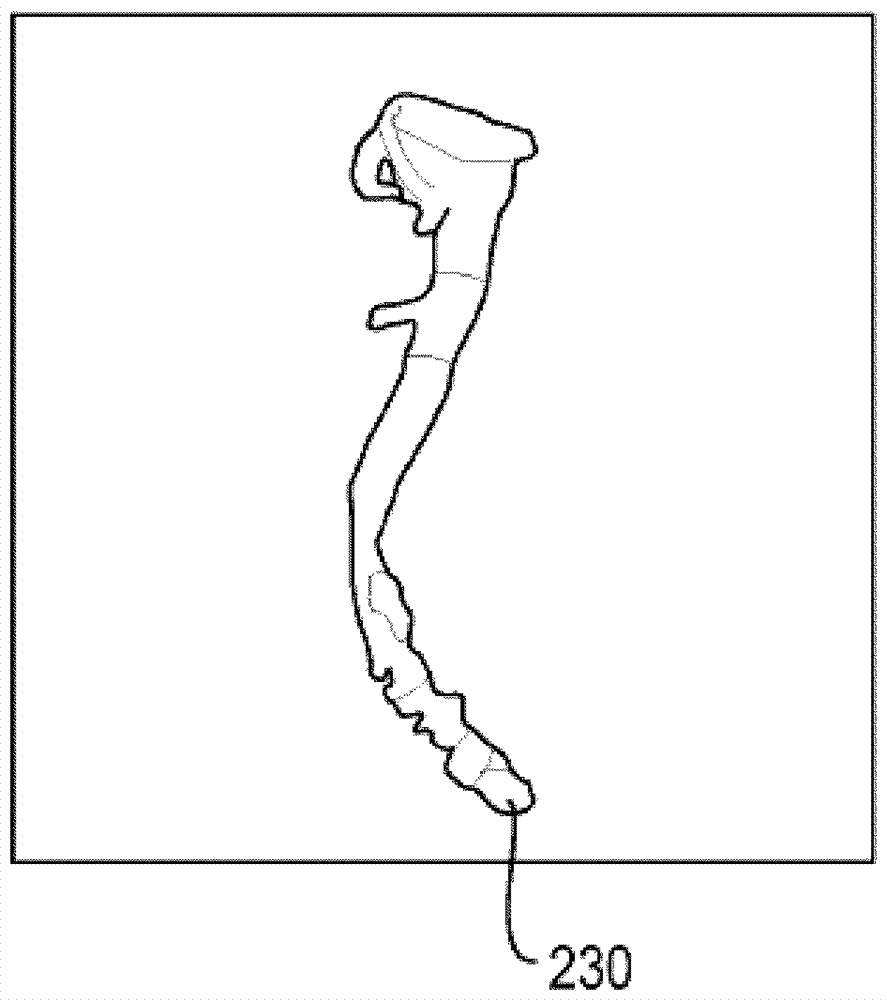
图6示出可向用户显示的三维图像120的切片222的一部分,并且切片222可包括相对明亮的区224。计算机系统可允许用户通过添加一个或多个种子226选择相对明亮的区224,并且种子226可充当用于对主冠状动脉分段的冠状动脉根部或起点。在用户命令下,计算机系统因而可将种子226用作起点以形成第一初始模型。用户可在主动脉和/或个别主冠状动脉中的一个或多个动脉中添加种子226。任选地,用户也可在连接到主冠状动脉的分支中的一个或多个分支中添加种子226。或者,计算机系统可(例如)使用提取的中心线信息自动放置种子。计算机系统可确定已经放置有种子226的图像120的强度值并且可通过沿着图像120的具有相同强度值的部分(或在中心在选定强度值处的强度值的范围或阈值内)扩展种子226而形成第一初始模型。因此,这个分段方法可被称作“基于阈值的分段”。
图7示出第一初始模型的通过扩展图6的种子226形成的一部分230。因此,用户输入种子226作为起点以供计算机系统开始形成第一初始模型。可重复这一过程,直到将感兴趣的整个部分(例如,主动脉和/或主冠状动脉的部分)分段。或者,第一初始模型可在无用户输入的情况下由计算机系统产生。
或者,分段可使用称作“基于边缘的分段”的方法进行。在一示例性实施方案中,可进行基于阈值和基于边缘的分段方法两者,如下文将描述,以形成模型220。
第二初始模型可使用基于边缘的分段方法形成。利用这个方法,可定位主动脉和/或主冠状动脉的管腔边缘。举例来说,在一示例性实施方案中,用户可将例如如上所述的种子226的输入提供给计算机系统,以便产生第二初始模型。计算机系统可沿着图像120的部分扩展种子226,直到到达边缘。可定位管腔边缘,例如,通过用户以可视方式和/或由计算机系统定位(例如,在存在高于设置阈值的强度值变化的位置处)。基于边缘的分段方法可由计算机系统和/或用户进行。
也可在步骤204中基于ccta数据对心肌或其它组织分段。举例来说,ccta数据可经分析以确定心肌的内部和外部表面的位置,例如,左心室和/或右心室。表面的位置可基于ccta数据中的心肌对比心脏的其它结构的对比度(例如,相对暗度和亮度)确定。因此,可确定心肌的几何形状。
如有需要,可复查和/或校正主动脉、心肌和/或主冠状动脉的分段(步骤208)。复查和/或校正可由计算机系统和/或用户进行。举例来说,在一示例性实施方案中,计算机系统可自动复查分段,并且用户可在存在任何错误的情况下(例如,如果模型220中的主动脉、心肌和/或主冠状动脉的任何部分缺少或不准确)手动校正分段。
举例来说,可比较上述的第一初始模型和第二初始模型以确保主动脉和/或主冠状动脉的分段准确。可比较第一初始模型与第二初始模型之间的不符合之处的任何区以校正分段以及形成模型220。举例来说,模型220可为第一初始模型与第二初始模型之间的平均值。或者,仅可进行上述分段方法中的一个,并且通过所述方法形成的初始模型可用作为模型220。
可计算心肌质量(步骤240)。所述计算可由计算机系统进行。举例来说,心肌体积可基于如上所述确定的心肌的表面的位置来计算,并且计算出的心肌体积可乘以心肌的密度以计算心肌质量。心肌的密度可以预先设置。
可确定模型220(图5)的各种血管(例如,主动脉、主冠状动脉等)的中心线(步骤242)。在一示例性实施方案中,所述确定可由计算机系统自动进行。
如有需要,可复查和/或校正在步骤242中所确定的中心线(步骤244)。所述复查和/或校正可由计算机系统和/或用户进行。举例来说,在一示例性实施方案中,计算机系统可自动复查中心线,并且用户可在存在任何错误的情况下(例如,如果任何中心线缺少或不准确)手动校正中心线。
可检测钙或斑块(导致血管的窄化)(步骤246)。在一示例性实施方案中,计算机系统可自动检测斑块。举例来说,斑块可在三维图像120中检测到并且将斑块从模型220移除。斑块可在三维图像120中识别出,这是因为斑块显现为比主动脉、主冠状动脉和/或分支的管腔更明亮的区。因此,斑块可由计算机系统检测为具有低于设置值的强度值,或由用户视觉地检测。在检测斑块之后,计算机系统可从模型220移除斑块,使得斑块不被视为血管中的管腔或开放空间的部分。或者,计算机系统可使用不同于主动脉、主冠状动脉和/或分支的颜色、形状或其它视觉指示物来指示模型220上的斑块。
计算机系统还可自动对检测到的斑块分段(步骤248)。举例来说,可基于ccta数据对斑块分段。ccta数据可经分析以基于ccta数据中的斑块相比心脏的其它结构的对比度(例如,相对暗度和亮度)来定位斑块(或其表面)。因此,也可确定斑块的几何形状。
如有需要,可复查和/或校正斑块的分段(步骤250)。所述复查和/或校正可由计算机系统和/或用户进行。举例来说,在一示例性实施方案中,计算机系统可自动复查分段,并且用户可在存在任何错误的情况下(例如,如果任何斑块缺少或不准确地示出)手动校正分段。
计算机系统可自动对连接到主冠状动脉的分支分段(步骤252)。举例来说,可使用用于对主冠状动脉分段的类似方法(例如,如图6和7中所示以及上文结合步骤206所描述)对分支分段。计算机系统也可使用如上文结合步骤248和250所描述的类似方法自动对分段分支中的斑块分段。或者,可同时对分支(和其中所含的任何斑块)和主冠状动脉分段(例如,在步骤206中)。
如有需要,可复查和/或校正分支的分段(步骤254)。复查和/或校正可由计算机系统和/或用户进行。举例来说,在一示例性实施方案中,计算机系统可自动复查分段,并且用户可在存在任何错误的情况下(例如,如果模型220中的分支的任何部分缺少或不准确)手动校正分段。
如果任何误配准、支架或其它伪影经定位(例如,在步骤102中的复查ccta数据期间),那么可校正模型220(步骤256)。校正可由用户和/或由计算机系统进行。举例来说,如果误配准或其它伪影(例如,不一致、模糊、影响管腔可见性的伪影等)经定位,那么可复查和/或校正模型220以避免血管的截面面积中的人工或虚假变化(例如,人工窄化)。如果支架经定位,那么可复查和/或校正模型220以指示支架的位置和/或(例如)基于支架的大小来校正支架定位所在的血管的截面面积。
也可独立地复查模型220的分段(步骤258)。复查可由用户和/或计算机系统进行。举例来说,用户和/或计算机系统可能够识别模型220的某些错误,诸如可校正错误和/或可能需要模型220至少部分地重做或重新分段的错误。如果这些错误被识别,那么分段可确定为不可接受的,并且可重复随所述错误而定的某些步骤,例如,步骤202到208、240到256中的一个或多个。
如果模型220的分段经独立验证为可接受的,那么,任选地,可输出并且平滑模型220(步骤260)。平滑可由用户和/或计算机系统进行。举例来说,可平滑隆脊、点或其它不连续部分。模型220可输出到独立软件模块以为计算分析等做准备。
因此,图3中示出并且在上文描述的步骤202到208和240到260可被视为图2的步骤200的子步骤。
iv.准备模型以用于分析和确定边界条件
如上文结合图2中示出的步骤300所描述,示例性方法可包括准备模型以用于分析和确定边界条件。在一示例性实施方案中,步骤300可包括以下步骤。
a.准备模型以用于分析
回头参看图3,还可确定模型220(图5)的各种血管(例如,主动脉、主冠状动脉和/或分支)的截面积(步骤304)。在一示例性实施方案中,所述确定可由计算机系统进行。
可裁剪模型220(图5)(步骤306)并且可产生实体模型。图8示出基于类似于图5中示出的模型220的模型准备的经裁剪实体模型320的实例。实体模型320为三维患者特定几何模型。在一示例性实施方案中,裁剪可在具有或不具用户的输入的情况下由计算机系统进行。流入边界322和流出边界324中的每一者可经裁剪,以使得形成各个边界的表面垂直于步骤242中所确定的中心线。流入边界322可包括血流经引导到模型320的解剖中所经过的边界,诸如在主动脉的上游末端,如图8中所示。流出边界324可包括血流从模型320的解剖向外引导所经过的的边界,诸如主动脉的下游末端和主冠状动脉和/或分支的下游末端。
b.确定边界条件
可提供边界条件以描述模型(例如,图8的三维实体模型320)的边界处正在发生什么。举例来说,边界条件可与关联于患者的模型化解剖(例如,模型化解剖的边界处)的至少一个血流特性有关,并且血流特性可包含血流速度、压力、流率、ffr等。通过适当地确定边界条件,计算分析可进行以确定模型内的各种位置处的信息。现将描述边界条件和用于确定这些边界条件的方法的实例。
在一示例性实施方案中,所确定边界条件可将在实体模型320所表示的血管的部分上游和下游的结构简化成一维或二维降阶模型。用于确定边界条件的示例性方程组和其它细节公开于(例如)美国专利申请公布no.2010/0241404和美国临时申请no.61/210,401中,所述申请的标题均为“心血管系统的患者特定血液动力学(patient-specifichemodynamicsofthecardiovascularsystem)”并且特此以引用的方式整体并入。
边界条件可视患者的生理条件改变,这是因为通过心脏的血流可视患者的生理条件而不同。举例来说,ffr通常是在充血的生理条件下进行测量,充血一般在患者在心脏中经历增加的血流(例如,由应力等引起)时发生。ffr为最大应力条件下的冠状动脉压与主动脉压的比。充血也可以药理方式例如用腺苷诱发。图9到11示出计算ffr(cffr)模型的实例,所述模型指示随患者的生理条件(静止、在最大充血或在最大运动下)而变的模型320中的冠状动脉压与主动脉压的比的变化。图9示出当患者静止时的模型320中的冠状动脉压对主动脉压的的最小变化。图10示出当患者经历最大充血时的模型320中的冠状动脉压对主动脉压的的较大变化。图11示出当患者经历最大锻炼时的模型320中的冠状动脉压对主动脉压之比的甚至更大变化。
回头参看图3,可确定用于充血条件的边界条件(步骤310)。在一示例性实施方案中,可使用冠状动脉阻力减小1到5倍、主动脉血压减小近似0到20%以及心率增加近似0到20%来模型化腺苷的效果。举例来说,可使用冠状动脉阻力减小4倍、主动脉血压减小近似10%以及心率增加近似10%来模型化腺苷的效果。虽然用于充血条件的边界条件是在示例性实施方案中确定,但是应了解,可确定用于其它生理状态(诸如静止、变化程度的充血、变化程度的运动、劳力、应力或其它条件)的边界条件。
边界条件提供关于三维实体模型320在其边界(例如,流入边界322、流出边界324、血管壁边界326等,如图8中所示)处的信息。血管壁边界326可包括模型320的主动脉、主冠状动脉和/或其它冠状动脉或血管的物理边界。
每一流入或流出边界322、324可针对速度、流率、压力或其它血流特性经指派指定值或值域。或者,每一流入或流出边界322、324可通过将心脏模型耦合到边界、集总参数或分散式(例如,一维波传播)模型、另一类型的一维或二维模型或其它类型的模型来指派。特定边界条件可基于(例如)获得的患者特定信息或其它测量参数(诸如心输出量、血压、步骤240中所计算的心肌质量等)确定的流入或流出边界322、324的几何形状而确定。
i.确定降阶模型
连接到实体模型320的上游和下游结构可表示为表示上游和下游结构的降阶模型。举例来说,图12到15示出根据一示例性实施方案的用于从流出边界324中的一者处的三维患者特定解剖数据作出集总参数模型的方法的方面。所述方法可与图2和3中所示出的方法分开进行并且在图2和3中所示出的方法之前进行。
图12示出主冠状动脉或从其伸出的分支中的一者的实体模型320的一部分330,并且图13示出图12中所示出的部分330的在步骤242中所确定的中心线的部分。
部分330可划分成多个片段332。图14示出可从部分330形成的片段332的实例。片段332的长度的选择可由用户和/或计算机系统进行。片段332可视(例如)片段332的几何形状而改变长度。各种技术可用以对部分330分段。举例来说,有病部分(例如,具有相对狭窄截面、病变和/或狭窄(血管中的异常窄化)的部分)可在一个或多个单独片段332中提供。有病部分和狭窄可(例如)通过沿着中心线的长度测量截面面积和局部地计算最小截面面积来识别。
片段332可由包括一个或多个(线性或非线性)电阻器334和/或其它电路元件(例如,电容器、电感器等)的电路图来近似。图15示出由一系列线性和非线性电阻器334替换的片段332的实例。电阻器334的个别电阻可(例如)基于对应片段332上的估计流量和/或压力确定。
电阻可(例如)视通过对应片段332的估计流率而为恒定、线性或非线性的。对于更复杂几何形状(诸如狭窄),电阻可随流率改变。各种几何形状的电阻可基于计算分析(例如,有限差分、有限体积、频谱、格子玻尔兹曼、基于粒子、水平集、等几何或有限元方法,或其它计算流体动力学(computationalfluiddynamics;cfd)分析技术)来确定,并且来自在不同流量和压力条件下进行的计算分析的多个解可用以导出患者特定、血管特定和/或病变特定阻力。结果可用以确定可模型化的任何片段的各种类型的特征和几何形状的阻力。结果,如上所述的导出患者特定、血管特定和/或病变特定阻力可允许计算机系统辨识以及评价更复杂的几何形状,诸如不对称狭窄、多个病变、二根分叉部和分支以及曲折血管处的病变等。
还可包括电容器,并且电容可(例如)基于对应片段的血管壁的弹性来确定。可包括电感器,并且电感可(例如)基于有关于流经对应片段的血量的加速或减速的惯性效应来确定。
电阻、电容、电感以及与集总参数模型中所使用的其它电气组件关联的其它变量的个别值可基于来自许多患者的数据导出,并且类似血管几何形状可具有类似值。因此,经验模型可依据大量的患者特定数据开发,从而建立对应于在未来分析中可适用于类似患者的特定几何特征的值的库。几何形状可在两个不同血管片段之间匹配以从先前模拟自动选择用于患者的片段332的值。
ii.示例性集总参数模型
或者,替代进行上文结合图12到15所描述的步骤,可预设集总参数模型。举例来说,图16示出表示实体模型320的流入和流出边界322、324处的上游和下游结构的集总参数模型340、350、360的实例。末端a位于流入边界322处,并且末端a到m以及b位于流出边界处。
集总参数心脏模型340可用以确定实体模型320的流入边界322处的末端a处的边界条件。集总参数心脏模型340可用以表示充血条件下的来自心脏的血流。集总参数心脏模型340包括各种参数(例如,pla、rav、lav、rv-art、lv-art以及e(t)),所述参数可基于关于患者的已知信息(例如,主动脉压、患者的心脏收缩和舒张血压(例如,如在步骤100中所确定)、患者的心输出量(例如基于在步骤100中所确定的患者的搏出量和心率计算的来自心脏的血流的体积)和/或用实验方法确定的常数)确定。
集总参数冠状动脉模型350可用以确定位于主冠状动脉和/或从其伸出的分支的下游末端处的实体模型320的流出边界324处的末端a到m处的边界条件。集总参数冠状动脉模型350可用以表示在充血条件下通过末端a到m从模型化血管离开的血流。集总参数冠状动脉模型350包括可基于关于患者的已知信息确定的各种参数(例如,ra、ca、ra-micro、cim以及rv),所述已知信息例如计算心肌质量(例如,如在步骤240中所确定)和末端a到m处的终端阻抗(例如,基于如在步骤304中确定的末端a到m处的血管的截面积确定)。
举例来说,计算心肌质量可用以估计通过多个流出边界324的基线(静止)平均冠脉流量。这个关系可基于实验导出的生理规律(例如,图1的生理规律20),其使平均冠脉流量q相关于心肌质量m(例如,如在步骤240中所确定),如q∝qomα,其中α为预设的标度指数且qo为预设的常数。基线(静止)条件下的流出边界324处的总冠脉流量q和患者的血压(例如,如在步骤100中所确定)可接着用以基于预设的实验导出方程式来确定流出边界324处的总阻力r。
总阻力r可基于末端a到m的各自截面积(例如,如在步骤304中所确定)而分散在末端a到m中。这个关系可基于实验导出的生理规律(例如,图1的生理规律20),其使末端a到m处的各个阻力相关,如ri∝ri,odiβ,其中ri为第i个出口处的流动阻力,且ri,o为预设的常数,di为所述出口的直径,且β为预设的幂律指数,例如,在-3与-2之间,对于冠脉血流为-2.7、对于脑血流为-2.9等。通过个别末端a到m的冠脉血流和个别末端a到m处的平均压力(例如,基于如步骤304中所确定的血管的末端a到m的个别截面积确定)可用以确定对应末端a到m处的集总参数冠状动脉模型350的阻力的总和(例如,ra+ra-micro+rv)。其它参数(例如,ra/ra-micro、ca、cim)可为用实验方法确定的常数。
弹性腔模型360可用以确定朝着主动脉弓位于主动脉的下游末端处的实体模型320的流出边界324处的末端b处的边界条件。弹性腔模型360可用以表示在充血条件下通过末端b从模型化主动脉离开的血流。弹性腔模型360包括可基于关于患者的已知信息确定的各种参数(例如,rp、rd以及c),所述已知信息例如上文结合集总参数心脏模型340所描述的患者的心输出量、上文结合集总参数冠状动脉模型350所描述的基线平均冠脉流量、主动脉压(例如,基于如步骤304中所确定的主动脉在末端b处的截面积确定)和/或用实验方法确定的常数。
边界条件(例如,集总参数模型340、350、360(或所述集总参数模型中所包括的常数中的任一者)或其它降阶模型)可基于其它因素来调整。举例来说,如果患者由于相比减小的容量而具有较低的血流对血管大小比从而使血管在生理应激下扩大,那么可(例如,增加)调整阻力值。如果患者有糖尿病、在接受药物治疗、过去已经历心脏事件等,那么也可调整阻力值。
替代的集总参数或分散式、一维网络模型可用以表示实体模型320下游的冠状血管。使用mri、ct、pet或spect的心肌灌注成像可用以为这些模型指派参数。又,替代的成像源(例如,磁共振血管造影(mra)、回顾电影门控或预期电影门控计算机断层血管造影(cta)等)可用以为这些模型指派参数。回顾电影门控可与图像处理方法结合以获得心动周期中的心室腔体积变化,从而将参数指派给集总参数心脏模型。
使用集总参数模型340、350、360或其它降阶一维或二维模型简化患者的解剖的部分允许计算分析(例如,下文所描述的图3的步骤402)更快速地进行,特别在计算分析进行多次的情况下,诸如当时评价除未治疗状态以外的可能治疗选项(例如,图2的步骤500)(例如,图2和3的步骤400),同时维持最终结果的高准确度。
在一示例性实施方案中,边界条件的确定可由计算机系统基于用户输入(诸如步骤100中所获得的患者特定生理数据)来进行。
c.针对准确度优化边界条件
如上文所讨论,可提供经确定边界条件以描述模型(例如,图8的三维实体模型320)的边界处正在发生什么。确切地说,边界条件可有关于与患者的模型化解剖关联的至少一个血流特性。举例来说,在模型化解剖的边界处,血流特性可包括血流速度、压力、流率、ffr等。通过适当确定边界条件,可进行计算分析以确定模型内的各种位置处的信息,包括血流特性。然而,三维模型内的不同区域可能未必具有均匀血流特性。举例来说,lad、lcx以及rca可各自具有不同条件并且可以不同方式受狭窄、锻炼或任何其它状态影响。举例来说,图24d说明当狭窄存在时,在不同血管区域中的患者群体中的直径减小百分比。这个数据揭露不同血管区域中的狭窄的解剖窄化的一致平均值和标准偏差。另一方面,图24e揭露当狭窄存在时,以侵入性方式收集的ffr的平均值在不同血管区域中可能未必一致的程度,尽管在这些相同区域中百分比直径狭窄一致。这个情况说明由系统授予的差别地确定不同血管区域中的边界条件的优点。
因此,下文关于图24b和24c所提供的示例性方法允许使用有关于总人口的数据优化经确定边界条件,从而允许较准确地计算不同区域中的每一区域中的血流特性。
在实施方案中,由于以非侵入性方式计算的ffr可直接与以侵入性方式测量的ffr比较,因此所有性能比较可关于测量ffr进行评估。作出决定时所使用的用于ffr的一般阈值为0.80,其中高于这个截止的值表明负性病变,且等于或低于所述阈值的值表明正性病变。敏感性和特异性特别令人感兴趣,这是因为敏感性和特异性分别将总诊断准确度分解成识别正性病变的准确度和识别负性病变的准确度。另外,接收器-操作者曲线下的面积、相关性、偏置以及平均绝对误差在提供关于计算ffr值很好地对应测量ffr的信息的其它量中。计算ffr的准确度允许将非侵入性方法用于预防性保健。
在下文所讨论的示例性实施方案中,将参考调整从心肌质量导出的冠状出口的下游出口边界条件以用于计算ffr。应注意的是,本文中所公开的原理可适用于冠脉或其它循环模组的其它边界条件、参数以及物理性质。此外,关系可从替代心肌质量或除心肌质量以外的其它源导出,其它源包括(但不限于)冠状血管容积、血管大小、spect或pet测量结果、群体或人口统计平均值等。此外,除ffr外,还可优化其它量度,包括(但不限于)血流、血压、灌注等。
1.基于人口数据确定边界条件调节特性
图24b为与示例性实施方案一致的用于针对准确度调节及调整边界条件的方法2450的流程图。方法2450的步骤2452可包括从数据库检索有关于患者的数据。所述数据库可包括有关于表示普通群体的特定量的患者的患者数据。总患者数据可分成两个群体,一个群体用于评价和调节边界条件参数(被称为调节群体);并且一个群体被称为测试群体,包括有关于什么人可用以测试边界条件的最优参数的数据,如下文将关于步骤2458进一步解释。在这个实例中,患者数据可有关于1000位患者(具有1000个ffr侵入性测量结果),其中有关于那些患者中的500人的数据可用以确定初始最优条件以及调节血流特性模型的参数,并且有关于另外500位患者的数据可用以测试血流特性模型的参数的调节。
在一些实施方案中,患者数据可包括计算结果和侵入性验证结果。确切地说,患者数据可包括如贯穿本公开的使用解剖模型非侵入性地确定患者的条件。侵入性验证结果可包括获得或获取有关于患者的数据,其以侵入性方式采集。举例来说,可以侵入性方式采集lad、lcx以及rca内的血液特性。
在一些实施方案中,存储的患者数据可为先前所收集的多个患者中的每一者的数据,包括患者特定数据,其包含用以进行计算ffr分析的数据(或计算ffr分析的结果)和每一患者内的多个位置(或区域)中的一者处的侵入性获得的ffr。因此,可针对与患者的解剖关联的多个位置中的每一者来计算ffr,患者的解剖的ffr数据是以侵入性方式获得。举例来说,患者的lad中的非侵入性采集ffr可与患者的lad中的匹配的计算ffr一起存储。
在一些实施方案中,计算出的非侵入性结果可基于模型来计算。为了产生这些计算,冠状动脉的每一出口可经指派集总参数阻抗边界条件,其随心肌质量、血管大小和/或最大充血腺苷响应而变。在血管大小不同的情况下,心肌质量和充血腺苷响应可同等地地影响所有冠脉出口边界条件且血管大小可不同地影响每一血管。在示例性实施方案中,为了简化解释,在整个描述中将边界条件描述为简单阻力,尽管边界条件可由其它集总参数来描述。因此,根据一实施方案,患者i的每一冠状出口n处的边界条件可为:
rn=f(mi,ai,dn)
其中r为阻力,m为心肌质量,a为腺苷响应,且d为冠状血管的直径。
在一示例性实施方案中,各种参数可存在于边界条件函数内。举例来说,阻力的心肌质量关系可具有常数和指数,诸如r=mom-α,腺苷响应可具有线性关系,诸如r=ao;和/或血管大小可具有常数和指数,诸如r=dod-β。
在一些实施方案中,这些参数的调整可影响计算ffr分析的准确度。这些参数中的多者可基于对先前获取的数据、用户设置或基于文献的值的分析来设置。另外,计算ffr分析的准确度可受建构的解剖模型的特性、用以计算ffr的方程式、所利用的流体流方程式以及用于计算ffr的许多其它方面影响。
方法2450的步骤2454可包括通过比较计算的患者结果与调节群体的侵入性测量的结果来确定边界条件调节特性。边界条件可经调节以减小患者中的每一者的计算血流特性与血流特性的侵入获得性测量结果之间的差异。因此,参数递增地粘附到边界条件,直到某些量度得到满足,如下文将更详细解释。所述参数可指向人类解剖内的不同区域的血流特性。举例来说,计算的血流特性(具有更改参数)可反复地与多个解剖位置处的血流特性的对应侵入获得性测量结果进行比较。因此,边界条件调节特性考虑所述多个解剖位置中的每一者(血流特性是在所述解剖位置处确定)的独特边界条件调节特性。
在一些实施方案中,一个或多个准确度量度可使用调节群体的计算和测量数据产生。所述量度可包括敏感性、特异性、平均偏置和/或平均绝对误差。这些量度可如下所述地计算:
敏感性=tp/(tp+fn)
特异性=tn/(tn+fp)
平均偏置=∑(ffrc-ffrm)/n
平均绝对误差=∑|ffrc-ffrm|/n。
在另一示例性实施方案中,所述量度可用作初始条件,调节从此开始。各种步骤(包括但不限于手动调整、优化或重复)可用以将边界条件从初始条件调节到所要条件。举例来说,初始总偏置可为0.01且所要偏置可为-0.02。反复地调整心肌质量参数mo和/或腺苷充血参数ao的循环可允许偏置会聚在-0.02。对于每一反复,参数可使用内插或外插技术而通过设置增量或通过由先前反复通知的增量来调整。对于参数的每一反复,整个调节群体可通过仅改变参数来重新分析。可重新计算量度且可评估与目标偏置的误差。
在另一实施方案中,可能需要多因素优化,诸如在将特异性最大化和将平均绝对误差减至最小同时实现至少80%的敏感性。反复优化可进行以调整至少一个参数,直到获得所要结果,或直到获得具有与所要结果的最小总误差的解。
在另一实施方案中,统计技术(诸如蒙特卡罗(montecarlo)或自举方法)可用以预测较大患者群体的经调节边界条件的性能以指导优化。此情况在存在有限数据用以调节和用来测试或增加最优量度的置信度的情况下可能有用。
因此,此优化或调节反复地发生,直到实现量度中的每一者的目标。参数的更改可被称为边界条件调节特性。
图24b的步骤2456可包括通过比较测试群体的计算患者结果与侵入性测量结果来确定边界条件调节特性的准确度。确切地说,使用基于调节群体提供最优参数的边界条件调节特性,可对测试群体进行非侵入性ffr分析。确切地说,表示测试群体中的患者中的每一者的边界条件的模型可基于边界条件调节特性而调节/更改。经调节/经更改的模型可用以计算ffr的值。此后,如果比较揭露测试群体中的侵入性测量的ffr与计算ffr之间的小于阈值量的差异,那么可认为边界条件调节特性是准确的。
在一些实施方案中,当边界条件调节特性不准确时,方法2450可包括通过包括来自患者的额外数据而重复步骤2456。额外数据可包括有关于试验池中的患者的数据或患者数据的其它来源。举例来说,可将通知提供给请求更多数据或手动选择测试群体的量以包括在调节群体内的保健专业人员。
图24b的步骤2458可包括将边界条件调节特性存储在数据库中。在实施方案中,存储的边界调节条件可接着被应用于确定准确的边界条件以用于任何新的预期患者特定分析。
2.针对特定患者调整区域性边界条件
优化边界条件的模型接着可用以针对特定患者调整边界条件,从而允许对三维模型的不同区域中的血流特性的准确确定。图24c说明用于优化患者的模型的边界条件的示例性方法2460。
方法2460的步骤2462可包括检索有关于患者的数据。这个数据可包括解剖信息、侵入性采集的数据,或任何其它数据被用以建立患者的三维模型,如上文所更详细描述。
方法2460的步骤2464可包括基于检索到的数据建立三维模型。确切地说,三维模型可基于检索到的数据产生,如本公开中始终所描述。三维模型的建立可包括根据以下函数确定边界条件,边界条件可为心肌质量、腺苷响应和/或血管大小的函数:
rn=f(mi,ai,dn)
在一些实施方案中,三维模型可在如下假设下操作:微循环的所有区域和遍布冠状血管的整个血管形态和分布同样地超出所建立的三维解剖模型的范围。
在一些实施方案中,所属领域的技术人员应理解,如果针对患者先前已产生三维模型,那么可在步骤2462中检索所述三维模型,由此省略步骤2464。此后,可将步骤2466和2468应用于新建立或所检索的三维模型。
方法2460的步骤2466可包括基于边界条件调节特性数据而更新三维模型的边界条件。因此,这个步骤可包括检索可存储在数据库中的边界条件调节特性。边界条件调节特性允许对三维模型的调整考虑:对于微循环的所有区域,遍布冠状动血管的血管形态和分布同样不超出所建立的三维解剖模型的范围。举例来说,这个情况可由心舒期与心缩期之间的脉动流率的差异、不同分支式样以及微循环阻力指数(indexofmicrocirculatoryresistance;“imr”)的差异引起。
方法2460的步骤2468可包括基于三维模型的经更新边界条件而计算一个或多个位置中的血流特性。确切地说,使用三维模式的经更新边界条件,可计算血流特性(例如,计算ffr),计算方法类似于本公开中所描述的方法。
d.建立三维网格
回头参看图3,可基于在步骤306中所产生的实体模型320产生三维网格(步骤312)。图17到19示出基于步骤306中所产生的实体模型320准备的三维网格380的实例。网格380包括多个节点382(网格点(meshpoint)或格点(gridpoint)),所述节点沿着实体模型320的表面且遍布实体模型320的内部。网格380可用四面体元(具有形成节点382的点)建立,如图18和19中所示。或者,可使用具有其它形状的元素,例如,六面体或其它多面体、曲线元等。在一示例性实施方案中,节点382的数目可以百万计,例如,五百万到五千万个。节点382的数目随着网格380变得更精细而增加。具有更多数目个节点382,可提供模型320内的更多点处的信息,但是计算分析可耗费更长时间执行,这是因为更多数目个节点382使待求解的方程式(例如,图1中示出的方程式30)的数目增加。在一示例性实施方案中,网格380的产生可在具有或不具用户的输入(例如,规定节点382的数目、元素的形状等)的情况下由计算机系统进行。
回头参看图3,可验证网格380和所确定边界条件(步骤314)。所述验证可由用户和/或计算机系统进行。举例来说,用户和/或计算机系统可能够识别网格380和/或边界条件的需要网格380和/或边界条件重做的某些错误,例如,在网格380扭曲或不具有足够空间分辨率的情况下,在边界条件不足以进行计算分析的情况下,在步骤310中所确定的阻力似乎错误的情况下,等等。如果这样,那么可确定网格380和/或边界条件是不可接受的,并且可重复步骤304到314中的一个或多个。如果确定网格380和/或边界条件是可接受的,那么方法可前进到下文所描述的步骤402。
另外,用户可检查所获得的患者特定信息或其它测量参数(诸如心输出量、血压、身高、体重、步骤240中所计算的心肌质量)已正确输入和/或已正确计算。
因此,图3中示出并且在上文描述的步骤304到314可被视为图2的步骤300的子步骤。
v.进行计算分析和输出结果
如上文结合图2中示出的步骤400所描述,示例性方法可包括进行计算分析和输出结果。在一示例性实施方案中,步骤400可包括以下步骤。
a.进行计算分析
参看图3,可由计算机系统进行计算分析(步骤402)。在一示例性实施方案中,步骤402可持续若干分钟到若干小时,取决于(例如)网格380(图17到19)中的节点382的数目等。
分析涉及产生描述模型320(网格380是从所述模型产生)中的血流的一系列方程式。如上所述,在示例性实施方案中,所要信息是关于在充血条件下通过模型320的血流的模拟。
分析还涉及使用数值方法使用计算机系统解出血流的三维方程式。举例来说,数值方法可为已知方法,诸如有限差分、有限体积、频谱、格子玻尔兹曼、基于粒子、水平集、等几何或有限元方法,或其它计算流体动力学(cfd)数值技术。
使用这些数值方法,可将血液模型化为牛顿(newtonian)、非牛顿或多相流体。步骤100中所测量的患者的红细胞比容或其它因素可用以确定血液黏度以并入分析中。可假设血管壁是硬质或柔性的。在后一情况下,壁动力学的方程式(例如,弹性动力学方程式)可与血流的方程式一起解出。步骤100中所获得的时变三维成像数据可用作输入以模型化血管形状在心动周期中的变化。更详细地公开示例性方程组和用于进行计算分析的步骤,例如,在特此以引用的方式整体并入的美国专利no.6,236,878(其标题为“用于计划医疗干预和模拟生理条件的预测性模型化的方法(methodforpredictivemodelingforplanningmedicalinterventionsandsimulatingphysiologicalconditions)”)和美国专利申请公布no.2010/0241404以及美国临时申请no61/210,401(所述两者标题为“心血管系统的患者特定血液动力学(patient-specifichemodynamicsofthecardiovascularsystem)”)中。
使用准备的模型和边界条件的计算分析可确定表示三维实体模型320的网格380的节点382中的每一者处的血流和血压。举例来说,计算分析的结果可包括节点382中的每一者处的各种参数的值,诸如(但不限于)各种血流特性或参数,诸如血流速度、血压、流率,或诸如cffr的计算参数,如下文所描述。所述参数也可内插在三维实体模型320中。结果,计算分析的结果可为用户提供通常可以侵入性方式确定的信息。
回头参看图3,可验证计算分析的结果(步骤404)。所述验证可由用户和/或计算机系统进行。举例来说,用户和/或计算机系统可能够识别结果的需要网格380和/或边界条件重做或修正的某些错误,例如,在由于不足数目的节点382,存在不足信息的情况下,在分析由于过多数目的节点382而耗费过长时间的情况下,等等。
如果在步骤404中确定计算分析的结果不可接受,那么用户和/或计算机系统可判定(例如)是否和如何修正或改进步骤306中所产生的实体模型320和/或步骤312中所产生的网格380,是否和如何修正步骤310中所确定的边界条件,或是否对用于计算分析的输入中的任一者进行其它修正。接着,可基于经确定修正或改进,重复上述的一个或多个步骤,例如,步骤306到314、402以及404。
b.显示血压、血流量以及cffr的结果
回头参看图3,如果在步骤404中确定计算分析的结果是可接受的,那么计算机系统可输出计算分析的某些结果。举例来说,计算机系统可显示基于计算分析的结果而产生的图像,诸如上文结合图1所描述的图像,诸如模拟血压模型50、模拟血流模型52和/或cffr模型54。如上文所述,这些图像指示例如模拟充血条件下的模拟血压、血流以及cffr,这是因为步骤310中所确定的边界条件是关于充血条件确定。
模拟血压模型50(图1)示出模拟充血条件下的由图17到19的网格380表示的患者的解剖中的局部血压(例如,以毫米汞柱或mmhg计)。计算分析可确定网格380的每一节点382处的局部血压,并且模拟血压模型50可将对应颜色、阴影或其它视觉指示物指派给各个血压,以使得模拟血压模型50可从视觉上指示模型50中的血压的变化,而不必规定每一节点382的个别值。举例来说,图1中所示出的模拟血压模型50示出:对于这一特定患者,在模拟充血条件下,压力在主动脉中科大体上均匀并且较高(如较暗的阴影所指示);以及压力随着血液向下游流到主冠状动脉中和流到分支中而逐渐且连续地降低(如阴影中的朝着分支的下游末端的逐渐且连接变亮所示出)。模拟血压模型50可伴以指示血压的特定数值的尺度,如图1中所示。
在一示例性实施方案中,模拟血压模型50可按颜色提供,并且颜色谱可用以指示模型50中的压力的变化。以最高压力到最低压力的次序,颜色谱可包括红色、橙色、黄色、绿色、蓝色、靛蓝色以及紫色。举例来说,上限(红色)可指示大约110mmhg或更高(或80mmhg、90mmhg、100mmhg等),且下限(紫色)可指示大约50mmhg或更低(或20mmhg、30mmhg、40mmhg等),其中绿色指示大约80mmhg(或上限与下限之间大约一半的其它值)。因此,一些患者的模拟血压模型50可将大部分或全部主动脉示为红色或接近色谱的更高端的其它颜色,并且朝着冠状动脉和从其伸出的分支的远端末端,颜色可在谱中逐渐改变(例如,接近谱的较低端(低至紫色))。特定患者的冠状动脉的远端末端可视关于各个远端末端所确定的局部血压而具有不同颜色,例如,红色到紫色中的任一处。
模拟血流模型52(图1)示出在模拟充血条件下的由图17到19的网格380表示的患者的解剖中的局部血液速度(例如,以厘米每秒或cm/s计)。计算分析可确定网格380的每一节点382处的局部血液速度,并且模拟血流模型52可将对应的颜色、阴影或其它视觉指示物指派给各个速度,以使得模拟血流模型52可从视觉上指示模型52中的速度变化,而非必须针对每一节点382规定个别值。举例来说,图1中示出的模拟血流模型52示出:对于这位特定患者,在模拟充血条件下,速度在主冠状动脉和分支的某些区域中通常较高(如图1中的区域53中的较暗阴影所指示)。模拟血流模型52可伴以指示血液速度的特定数值的尺度,如图1中所示。
在一示例性实施方案中,模拟血流模型52可按颜色提供,并且颜色谱可用以指示模型52中的速度的变化。以最高速度到最低速度的次序,颜色谱可包括红色、橙色、黄色、绿色、蓝色、靛蓝色以及紫色。举例来说,上限(红色)可指示大约100(或150)cm/s或更高,且下限(紫色)可指示大约0cm/s,其中绿色指示大约50cm/s(或上限与下限之间大约一半的其它值)。因此,一些患者的模拟血流模型52可将大部分或全部主动脉示为接近谱的较低端的颜色(例如,绿色到紫色)的混合,并且在所确定血液速度增加的某些位置处,颜色可在谱中逐渐改变(例如,接近谱的较高端(高至红色))。
cffr模型54(图1)示出在模拟充血条件下的由图17到19的网格380表示的患者的解剖中的局部cffr。如上文所述,cffr可计算为特定节点382处的通过计算分析确定的局部血压(例如,在模拟血压模型50中示出)除以主动脉中的血压(例如,在流入边界322(图8)处)的比。计算分析可确定网格380的每一节点382处的cffr,并且cffr模型54可将对应颜色、阴影或其它视觉指示物指派给各个cffr值,以使得cffr模型54可从视觉上指示模型54中的cffr的变化,而不必规定每一节点382的个别值。举例来说,图1中示出的cffr模型54示出:对于这位特定患者,在模拟充血条件下,cffr可大体上均匀且在主动脉中为大约1.0,以及随着血液向下游流到主冠状动脉中和分支中,cffr逐渐且连续地减小。cffr模型54还可指示cffr模型54中的某些点处的cffr值,如图1中所示。cffr模型54可伴以指示cffr的特定数值的尺度,如图1中所示。
在一示例性实施方案中,cffr模型54可按颜色提供,并且颜色谱可用以指示模型54中的压力的变化。以最低cffr(指示功能意义的病变)到最高cffr的次序,颜色谱可包括红色、橙色、黄色、绿色、蓝色、靛蓝色以及紫色。举例来说,上限(紫色)可指示1.0的cffr,且下限(红色)可指示大约0.7(或0.75或0.8)或更低,其中绿色指示大约0.85(或上限与下限之间大约一半的其它值)。举例来说,下限可基于用于判断cffr测量结果是否指示功能意义病变或可能需要干预的其它特征的下限(例如,0.7、0.75或0.8)而确定。因此,一些患者的cffr模型54可将大部分或全部主动脉示为紫色或接近谱的较高端的其它颜色,并且朝着冠状动脉和从其伸出的分支的远端末端,颜色在谱中可逐渐改变(例如,接近谱的较高端(高至红色到紫色中的任一处)。视关于各个远端末端所确定的cffr的局部值而定,特定患者的冠状动脉的远端末端可具有不同颜色,例如,红色到紫色中的任一处。
在确定cffr已降到用于确定功能意义病变或可能需要干预的其它特征的存在的下限以下之后,可评估动脉或分支以定位功能意义病变。计算机系统或用户可基于动脉或分支的几何形状(例如,使用cffr模型54)而定位功能意义病变。举例来说,功能意义病变可通过寻找位于cffr模型54的具有局部最小cffr值的位置附近(例如,上游)的窄化或狭窄来定位。计算机系统可指示或向用户显示cffr模型54(或其它模型)的包括功能意义病变的部分。
其它图像也可基于计算分析的结果而产生。举例来说,计算机系统可提供关于特定主冠状动脉的额外信息,例如,如图20到22中所示。在例如特定冠状动脉包括最低cffr的情况下,冠状动脉可通过计算机系统选择。或者,用户可选择特定冠状动脉。
图20示出患者的解剖的模型,其包括计算分析的结果,其中模型上的某些点通过个别参考标签(例如,lm、lad1、lad2、lad3等)来识别。在图21中示出的示例性实施方案中,点提供于模拟充血条件下的lad动脉(其为具有这位特定患者的最低cffr的主冠状动脉)中。
图21和22示出这些点中的一些或全部(例如,lm、lad1、lad2、lad3等)处和/或模型上(例如,在主动脉中等)的某些其它位置处的某些变量随时间变化的图。图21为主动脉中和图20中所指示的点lad1、lad2以及lad3处的压力(例如,以毫米汞柱或mmhg计)随时间变化的图。图中的顶部曲线指示主动脉中的压力,从顶部起的第二曲线指示点lad1处的压力,从顶部起的第三曲线指示点lad2处的压力,且底部曲线指示点lad3处的压力。图22为图20中所指示的点lm、lad1、lad2以及lad3处的流量(例如,以立方厘米每秒或cc/s计)随时间变化的图。另外,可提供其它图,诸如这些点中的一些或全部处和/或其它点处的剪应力随时间变化的图。图上的顶部曲线指示点lm处的流量,从顶部起的第二曲线指示指示点lad1处的流量,从顶部起的第三曲线指示点lad2处的流量,且底部曲线指示点lad3处的流量。也可提供示出这些变量(例如,血压、流量、速度或cffr)沿着特定主冠状动脉和/或从其伸出的分支的长度的变化的图。
任选地,上述的各种图和其它结果可在报告中定案(步骤406)。举例来说,上述的图像和其它信息可插入到具有设置模板的文件中。模板可以预设且对多个患者可通用,并且可用于向医师和/或患者报告计算分析的结果。文件或报告可在计算分析完成之后由计算机系统自动完成。
举例来说,最终报告可包含图23中示出的信息。图23包括图1的cffr模型54且还包括概括信息,诸如主冠状动脉和从其伸出的分支中的每一者中的最低cffr值。举例来说,图23指示:lad动脉中的最低cffr值为0.66,lcx动脉中的最低cffr值为0.72,rca动脉中的最低cffr值为0.80。其它概括信息可包括患者的姓名、患者的年龄、患者的血压(bp)(例如,在步骤100中获得)、患者的心率(hr)(例如,在步骤100中获得)等。最终报告还可包含如上所述产生的医师或其它用户可存取以确定更多信息的图像和其它信息的变体(version)。由计算机系统产生的图像可经格式化以允许医师或其它用户将光标定位于任何点上以测定那个点处的上述变量(例如,血压、速度、流量、cffr等)中的任一者的值。
最终报告可传输给医师和/或患者。最终报告可使用任何已知通信方法(例如,无线或有线网络、通过邮件等)来传输。或者,可以通知医师和/或患者:最终报告可供下载或拾取。接着,医师和/或患者可登录基于网站的服务以通过安全通信线路下载最终报告。
c.验证结果
回头参看图3,可独立地验证计算分析的结果(步骤408)。举例来说,用户和/或计算机系统可能够识别计算分析的结果(例如,步骤406中所产生的图像和其它信息)需要上述步骤中的任一者重做的某些错误。如果这些错误经识别,那么计算分析的结果可确定为不可接受的,并且可重复某些步骤,例如,步骤100、200、300、400、子步骤102、202到208、240到260、304到314以及402到408等。
因此,图3中示出且上文所描述的步骤402到408可被视为图2的步骤400的子步骤。
用于验证计算分析的结果的另一方法可包括使用另一方法测量来自患者的结果中所包含的变量(例如,血压、速度、流量、cffr等)中的任一者。在一示例性实施方案中,可测量所述变量(例如,侵入性地),然后比较所述变量与通过计算分析确定的结果。举例来说,在由实体模型320和网格380表示的患者的解剖内的一个或多个点处,可(例如)使用如上所述的插入到患者中的压力线来确定ffr。可比较一位置处的测量ffr与同一位置处的cffr,并且可在多个位置进行比较。任选地,可基于所述比较来调整计算分析和/或边界条件。
d.用于提供冠脉血流信息的系统和方法的另一实施方案
用于提供有关于特定患者中的冠脉血流的各种信息的方法600的另一实施方案在图24a中示出。方法600可在上述的计算机系统(例如,用以实现上文所描述且在图3中示出的步骤中的一个或多个的计算机系统)中实现。方法600可使用一个或多个输入610进行,并且可包括:基于输入610产生一个或多个模型620;基于输入610和/或模型620指派一个或多个条件630;以及基于模型620和条件630导出一个或多个解640。
输入610可包括患者的主动脉、冠状动脉(和从冠状动脉伸出的分支)以及心脏的医学成像数据611,诸如ccta数据(例如,在图2的步骤100中所获得)。输入610还可包括患者的肱血压的测量结果612和/或其它测量结果(例如,在图2的步骤100中所获得)。测量结果612可以非侵入性方式获得。输入610可用以产生模型620和/或确定下文所描述的条件630。
如上所述,一个或多个模型620可基于输入610而产生。举例来说,方法600可包括基于成像数据611产生患者的解剖(例如,主动脉、冠状动脉和从冠状动脉伸出的分支)的一个或多个患者特定三维几何模型(步骤621)。举例来说,几何模型可为图3的步骤306中所产生的图8的实体模型320,和/或图3的步骤312中所产生的图17到19的网格380。
回头参看图24a,方法600还可包括产生一个或多个基于物理学的血流模型(步骤622)。所述血流模型可包括有关于通过步骤621中所产生的患者特定几何模型的血流、心脏和主动脉循环、远端冠脉循环等的模型。所述血流模型可有关于关联于患者的模型化解剖的至少一个血流特性,例如,血流速度、压力、流率、ffr等。所述血流模型可经指派为三维几何模型的流入边界322和流出边界324处的边界条件。所述血流模型可包括上文结合图3的步骤310所描述的降阶模型或其它边界条件,例如,集总参数心脏模型340、集总参数冠状动脉模型350、弹性腔模型360等。
如上文所述,一个或多个条件630可基于输入610和/或模型620来确定。条件630包括针对在步骤622(和图3的步骤310)中所确定的边界条件计算的参数。举例来说,方法600可包括通过基于成像数据611(例如,如在图3的步骤240中所确定)计算患者特定心室或心肌质量而确定条件(步骤631)。
方法600可包括通过基于关系q=qomα(其中α为预设的标度指数,m为心室或心肌质量,且qo为预设的常数(例如,如上文结合在图3的步骤310中确定集总参数模型所描述)),使用步骤631中所计算的心室或心肌质量计算静止冠脉流量而确定条件(步骤632)。或者,所述关系可具有形式q∝qomα,如上文结合在图3的步骤310中确定集总参数模型所描述。
方法600还可包括通过使用步骤632中所计算的所得冠脉流量和患者的测量血压612计算总静止冠脉阻力(例如,如上文结合在图3的步骤310中确定集总参数模型所描述)而确定条件(步骤633)。
方法600还可包括通过使用步骤633中所计算的总静止冠脉阻力和模型620计算个别冠状动脉(以及从冠状动脉伸出的分支)的个别阻力而确定条件(步骤634)。举例来说,如上文结合图3的步骤310所描述,基于个别冠状动脉和分支的远端末端的大小(例如,从步骤621中所产生的几何模型确定)以及基于关系r=rodβ(其中r为特定远端末端处的流动阻力,且ro为预设的常数,d为大小(例如,所述远端末端的直径),且β为预设的幂律指数,如上文结合在图3的步骤310中确定集总参数模型所描述),步骤633中所计算的总静止冠脉阻力可分散到个别冠状动脉和分支。
回头参看图24a,方法600可包括基于患者的一个或多个身体条件调整边界条件(步骤635)。举例来说,步骤631到634中所确定的参数可基于解640是否打算模拟静止、变化的充血水平、变化的运动或劳力水平、不同用药等来修改。基于输入610、模型620以及条件630,可进行计算分析,例如,如上文结合图3的步骤402所描述,以确定包括关于步骤635中所选择的身体条件下的患者的冠脉血流的信息的解640(步骤641)。现在将描述从解640可提供的信息的实例。
组合式患者特定解剖(几何)和生理(基于物理学的)模型可用以确定更改心率、搏出量、血压或冠脉微循环功能的不同用药或生活方式变化(例如,停止吸烟、饮食变化或增加的身体活动)对冠状动脉血流影响。这个信息可用以优化医学治疗或避免可能有危险的用药结果。组合式模型也可用以确定对替代形式和/或变化水平的身体活动或暴露于可能外在力量的风险(例如,当踢足球时、在太空飞行期间、当进行水肺潜水时、在飞机飞行期间等)的冠状动脉血流的影响。这个信息可用以识别对于特定患者可能安全且有效的身体活动的类型和水平。组合式模型也可用以预测对冠状动脉血流的经皮冠状动脉介入的可能益处以便选择最优介入策略,和/或用以预测对冠状动脉血流的冠状动脉旁路移植术的可能益处以便选择最优手术策略。
组合式模型也可用以说明动脉疾病的负担增加对冠状动脉血流的可能有害影响,以及用以使用机械论或现象疾病进展模型或经验数据来预测何时进行性疾病可导致血流对心脏肌的危害。这个信息可能够确定“保用期(warrantyperiod)”(在保用期中,使用非侵入性成像经观察最初无血液动力学意义上的疾病的患者不期望需要医药、介入性或手术治疗),或者,在不利因素继续的情况下进展可能发生的速率。
组合式模型也可用以说明由冠状动脉疾病的负担减小产生的对冠状动脉血流的可能有益影响,以及用以使用机械论或现象疾病进展模型或经验数据来预测何时疾病的消退可导致通过冠状动脉到心脏肌的增加的血流。这个信息可用以指导医疗管理项目,包括(但不限于)饮食变化、增加的身体活动、抑制素或其它药物的处方等。
vi.提供患者特定治疗计划
如上文结合图2中示出的步骤500所描述,示例性方法可包括提供患者特定治疗计划。在一示例性实施方案中,步骤500可包括以下步骤。虽然图3未示出以下步骤,但是应理解,这些步骤可结合图3中所示的步骤进行,例如,在步骤406或408之后。
如上所述,图1和23中示出的cffr模型54指示未治疗状态下和模拟充血条件下的由图17到19的网格380表示的患者的解剖中的cffr值。使用这个信息,医师可开出患者的治疗方案,诸如增加锻炼、改变饮食、药物处方、对模型化解剖的任何部分或心脏的其它部分进行手术(例如,冠状动脉旁路移植术、插入一个或多个冠状动脉支架等)等。
为了确定开出什么治疗方案,计算机系统可用以预测依据计算分析确定的信息可如何基于这些治疗方案改变。举例来说,某些治疗方案(诸如插入支架或其它手术)可导致模型化解剖的几何形状的变化。因此,在一示例性实施方案中,步骤306中所产生的实体模型320可经修正以指示有支架插入的一个或多个管腔的变宽。
举例来说,图1和23中示出的cffr模型54指示:lad动脉中的最低cffr值为0.66,lcx动脉中的最低cffr值为0.72,并且rca动脉中的最低cffr值为0.80。如果cffr值(例如)小于0.75,那么可建议治疗。因此,计算机系统可建议用户修改实体模型320以指示lad动脉和lcx动脉的变宽,以模拟在这些冠状动脉中插入支架。可建议用户选择对应于模拟支架的位置和大小的变宽的位置和量(例如,长度和直径)。或者,变宽的位置和量可由计算机系统基于各种因素(诸如,具有小于0.75的cffr值的节点的位置、血管明显变窄的位置、惯用支架的大小等)自动确定。
图25示出基于通过加宽位置512处的lad动脉的一部分和位置514处的lcx动脉的一部分建立的实体模型确定的经修改cffr模型510的实例。在一示例性实施方案中,上述步骤(例如,步骤310到314和402到408)中的任一者可使用经修改实体模型重复。在步骤406中,最终报告可包括有关于未治疗患者(例如,无支架)的信息(诸如图23中所示出的信息)和有关于用于患者的模拟治疗方案的信息(诸如图25和26中所示出的信息)。
图25包括经修改cffr模型510并且还包括概括信息,诸如与建议治疗方案关联的经修改实体模型的主冠状动脉和从其伸出的分支中的最低cffr值。举例来说,图25指示:lad动脉(及其下游分支)中的最低cffr值为0.78,lcx动脉(及其下游分支)中的最低cffr值为0.78,并且rca动脉(及其下游分支)中的最低cffr值为0.79。因此,未治疗患者(无支架)的cffr模型54与用于建议治疗方案(插入支架)的cffr模型510之间的比较指示:建议治疗方案可使lad动脉中的最小cffr从0.66增加到0.78且可使lcx动脉中的最小cffr从0.72增加到0.76,同时应存在rca动脉中的最小cffr的从0.80到0.79的最小减少。
图26示出在如上所述地加宽位置512处的lad动脉和位置514处的lcx动脉的部分之后确定的经修改模拟血流模型520的实例。图26还包括概括信息,诸如与建议治疗方案关联的经修改实体模型的主冠状动脉和从其伸出的分支中的各种位置处的血流值。举例来说,图26指示未治疗患者(无支架)和已治疗患者(具有插入支架)的lad动脉中的四个位置lad1、lad2、lad3以及lad4和lcx动脉中的两个位置lcx1和lcx2的血流值。图26还指示未治疗状态与已治疗状态之间的血流值变化百分比。因此,未治疗患者的模拟血流模型52与建议治疗方案的模拟血流模型520的比较指示:视位置而定,建议治疗方案可使所有位置lad1到lad4、lcx1以及lcx2处的通过lad动脉和lcx动脉的流量增加9%到19%。
还可比较未治疗状态与已治疗状态之间的其它信息,诸如冠状动脉血压。基于这个信息,医师可与患者讨论是否继续所建议的治疗选项。
其它治疗选项还可涉及以不同方式修改实体模型320。举例来说,冠状动脉旁路移植术可涉及在实体模型320中建立新管腔或通道,且移除病变还可涉及加宽管腔或通道。其它治疗选项可不涉及修改实体模型320。举例来说,增加锻炼或劳力、改变饮食或其它生活方式变化、药物处方等可涉及改变步骤310中所确定的边界条件,例如,由于血管收缩、扩张、降低的心率等。举例来说,患者的心率、心输出量、搏出量、血压、冠脉微循环功能、集总参数模型的配置等可取决于所开出的药物、所采用的锻炼(或其它劳力)的类型和频率、所采用的生活方式变化的类型(例如,停止吸烟、饮食变化等),由此以不同方式影响步骤310中所确定的边界条件。
在一示例性实施方案中,经修改边界条件可使用来自许多患者的数据以实验方式确定,并且类似治疗选项可能需要以类似方式修改边界条件。经验模型可依据大量患者特定数据来开发,从而建立对应于在未来分析中可应用于类似患者的特定治疗选项的边界条件或用于计算边界条件的函数的库。
在修改边界条件之后,上述步骤(例如,步骤312、314以及402到408)可使用经修改边界条件重复,并且在步骤406中,最终报告可包括有关于未治疗患者的信息(诸如图23中所示出的信息)和有关于用于患者的模拟治疗方案的信息(诸如图25和26中所示出的信息)。
或者,可为医师、患者或其它用户提供用户界面,其允许与三维模型(例如,图8的实体模型320)的互动。模型320可划分成多个用户可选择片段,所述片段可由用户编辑以反映一个或多个治疗选项。举例来说,用户可选择具有狭窄(或闭塞,例如,急性闭塞)的片段并且调整所述片段以移除狭窄,用户可将片段添加到模型320以充当旁路,等。用户也可经提示以规定其它治疗选项和/或可更改上文所确定的边界条件的生理参数,例如,心输出量、心率、搏出量、血压、锻炼或劳力水平、充血水平、用药等的变化。在一替代实施方案中,计算机系统可确定或提议治疗选项。
用户界面可允许与三维模型320的互动以允许用户模拟狭窄(或闭塞,例如,急性闭塞)。举例来说,用户可选择用于包括狭窄的片段,并且计算机系统可用以预测从计算分析确定的信息如何基于狭窄的添加而变化。因此,本文中所描述的方法可用以预测闭塞动脉的效果。
用户界面也可允许与三维模型320的互动以模拟受损动脉或动脉的移除,移除可(例如)在某些手术程序中发生,诸如当移除癌性肿瘤时。模型也可经修改以模拟阻止血流通过某些动脉的效果,以便预测侧支通路为患者供应足够血流的可能。
a.使用降阶模型比较不同治疗选项
在一示例性实施方案中,计算机系统可允许用户通过用降阶模型替换三维实体模型320或网格380来更快地模拟各种治疗选项。图27示出有关于根据一示例性实施方案的用于使用降阶模型模拟各种治疗选项的方法700的示意图。方法700可在上述的计算机系统中实现。
可从上述的计算分析输出表示血流或其它参数的一个或多个患者特定模拟血流模型(步骤701)。举例来说,模拟血流模型可包括图1的模拟血压模型50、图1的模拟血流模型52、图1的cffr模型54等,所述模型使用上文所描述及在图2和3中示出的方法提供。如上所述,模拟血流模型可包括患者的解剖的三维几何模型。
可从模拟血流模型提取功能信息以便规定降阶模型的条件(步骤702)。举例来说,功能信息可包括上述的使用计算分析确定的血压、流量和速度信息。
可提供降阶(例如,零维或一维)模型以替换用以产生步骤701中所产生的患者特定模拟血流模型的三维实体模型320,并且降阶模型可用以确定关于患者中的冠脉血流的信息(步骤703)。举例来说,降阶模型可为如上文结合图3的步骤310所描述产生的集总参数模型。因此,集总参数模型为患者的解剖的简化模型,其可用以确定关于患者中的冠脉血流的信息,而不必对与图17到19的网格380关联的方程式的更复杂系统求解。
可接着将在步骤703中从解出降阶模型确定的信息映射或外插到患者的解剖的三维实体模型(例如,实体模型320)(步骤704),并且用户可视需要对降阶模型做出改变以模拟可由用户选择的用于患者的各种治疗选项和/或生理参数的变化(步骤705)。可选择生理参数可包括心输出量、锻炼或劳力水平、充血水平、用药的类型等。可选择治疗方案可包括移除狭窄、添加旁路等。
接着,可基于由用户选择的治疗选项和/或生理参数来修改降阶模型,并且经修改降阶模型可用以确定关于与所选治疗选项和/或生理参数关联的患者中的冠脉血流的信息(步骤703)。可接着将在步骤703中的从解出降阶模型确定的信息映射或外插到患者的解剖的三维实体模型320,以预测所选治疗选项和/或生理参数对患者的解剖中的冠脉血流的影响(步骤704)。
可针对各种不同治疗选项和/或生理参数重复步骤703到705,以将各种治疗选项的预测效果相互比较以及与关于未治疗患者中的冠脉血流的信息进行比较。结果,各种治疗选项和/或生理参数的预测结果可相对于彼此以及相对于关于未治疗患者的信息进行评价,而不必使用三维网格380再执行更复杂的分析。作为替代,可使用降阶模型,其可允许用户更简单且快速地分析以及比较不同治疗选项和/或生理参数。
图28示出根据一示例性实施方案的用于使用降阶模型模拟各种治疗选项的示例性方法的其它方面。方法700可在上述的计算机系统中实现。
如上文结合图3中示出的步骤306所描述,可基于患者的成像数据产生患者特定几何模型(步骤711)。举例来说,成像数据可包括在图2的步骤100中所获得的ccta数据,并且几何模型可为在图3的步骤306中所产生的图8的实体模型320,和/或在图3的步骤312中所产生的图17到19的网格380。
使用患者特定三维几何模型,可进行计算分析(例如,如上文结合图3的步骤402所描述),以确定关于患者的冠状动脉血流的信息(步骤712)。计算分析可输出表示血流或其它参数的一个或多个三维患者特定模拟血流模型,例如,图1的模拟血压模型50、图1的模拟血流模型52、图1的cffr模型54等。
可基于模型的解剖特征将模拟血流模型分段(例如,如上文结合图14所描述)(步骤713)。举例来说,可在单独片段中提供从主冠状动脉伸出的分支(步骤714),可在单独片段中提供具有狭窄或有病区的部分(步骤716),并且可在单独片段中提供分支与具有狭窄或有病区的部分之间的部分(步骤715)。可对模拟血流模型分段时可提供变化程度的分辨率,以使得每一血管可包括多个短的离散片段或较长片段,例如,包括整个血管。又,可提供各种技术以用于对模拟血流模型分段,包括产生中心线并基于产生的中心线分割,或检测分支点并基于检测到的分支点分割。可识别有病部分和狭窄,例如,通过沿着中心线的长度测量截面积以及局部地计算最小截面积。步骤711到716可被视为图27的步骤701的子步骤。
所述片段可由集总参数模型的组件(诸如如上文结合图15所描述的电阻、电容器、电感器等)替换。电阻、电容、电感以及与集总参数模型中所使用的其它电阻件关联的其它变量的个别值可从步骤712中所提供的模拟血流模型导出。举例来说,对于分支和分支与具有狭窄或有病区域的部分之间的部分,从模拟血流模型导出的信息可用以将线性电阻指派给对应片段(步骤717)。对于具有复杂几何形状(诸如狭窄或有病区)的部分,电阻可随流率改变。因此,多次计算分析可用以获得各种流量和压力条件的模拟血流模型,以导出这些复杂几何形状的患者特定、血管特定以及病变特定电阻函数,如上文结合图15所描述。因此,对于具有狭窄或有病区域的部分,从这些多次计算导出的信息或从先前数据导出的模型可用以将非线性、流量依赖的电阻指派给对应片段(步骤718)。步骤717和718可被视为图27的步骤702的子步骤。
使用在步骤717和718中所确定的电阻,可产生降阶(例如,零维或一维)模型(步骤719)。举例来说,降阶模型可为如上文结合图3的步骤310中所描述地产生的集总参数模型。因此,集总参数模型为患者的解剖的简化模型,其可用以确定关于患者中的冠脉血流的信息,而不必对与图17到19的网格380关联的方程式的更复杂系统求解。
可提供用户界面,其允许用户与步骤719中所建立的降阶模型互动(步骤720)。举例来说,用户可选择并编辑降阶模型的不同片段以模拟不同治疗选项和/或可编辑各种生理参数。举例来说,介入术(诸如插入支架以修复有病区域)可通过减小支架将插入到的片段的电阻来模型化。形成旁路可通过平行于有病片段添加具有低电阻的片段来模型化。
经修改降阶模型可经解出以确定关于步骤720中所选择的治疗方案或生理参数变化下的患者中的冠脉血流的信息(步骤721)。可接着比较步骤721中所确定的每一片段中的流量和压力的解值与步骤712中所确定的三维解,并且可通过调整片段的电阻函数(例如,如步骤717和718中所确定)以及对降阶模型求解(例如,步骤721),直到解匹配而将任何差异减至最小。结果,可建立降阶模型且接着用简化的方程组对降阶模型求解,降阶模型允许相对快速的计算(例如,与完整三维模型相比)且可用以解出可紧密近似完整三维计算解的结果的流量和压力。降阶模型允许相对快速的迭代以模型化各种不同治疗选项。
可接着将在步骤721中从对降阶模型求解确定的信息映射或外插到患者的解剖的三维实体模型(例如,实体模型320)(步骤722)。步骤719到722可类似于图27的步骤703到705并且可视需要由用户重复以模拟治疗选项和/或生理参数的不同组合。
或者,不是计算沿着来自三维模型的片段的电阻(例如,如上文关于步骤717和718所描述),可将沿着中心线间隔的流量和压力指定到集总参数或一维模型中。有效电阻或损失系数可在边界条件和指定流量及压力的约束下解出。
而且,跨个别片段的流率和压力梯度可用以使用从降阶模型导出的解(例如,如上文关于步骤721所描述)来计算心外膜冠脉阻力。心外膜冠脉阻力可计算为心外膜冠状动脉(包括于从医学成像数据重建的患者特定模型中的冠状动脉和从其伸出的分支的部分)的等效电阻。此情况在解释在冠状动脉中具有弥漫性动脉粥样硬化的患者为什么可能展现缺血(供血的限制)的症状具有临床意义。而且,每单位心肌组织体积(或质量)的流量和/或在模拟药物诱发充血或变化的运动强度的条件下工作的每单位心脏的流量可使用来自降阶模型的数据计算。
结果,三维血流模型化的准确度可与一维和集总参数模型化技术中固有的计算简单性和相对速度组合。三维计算方法可用以从数值导出患者特定一维或集总参数模型,所述模型嵌套数值导出的经验模型以用于正常片段、狭窄、接头以及其它解剖特征上的压力损失。可提供用于具有心血管疾病的患者的改善诊断,并且可更快地进行医药、介入性以及手术治疗方案的计划。
而且,三维计算流体动力学技术的准确度可与血流的集总参数和一维模型的计算简单性和性能能力组合。三维几何及生理模型可自动分解成降阶一维或集总参数模型。三维模型可用以计算通过正常片段、狭窄和/或分支的血流的线性或非线性血液动力学效果,以及用以设置经验模型的参数。一维或集总参数模型可更有效且更快速地解出患者特定模型中的血流和血压,并且显示集总参数或一维解的结果。
降阶患者特定解剖和生理模型可用以确定更改心率、搏出量、血压或冠脉微循环功能的不同用药或生活方式变化(例如,停止吸烟、饮食变化或增加的身体活动)对冠状动脉血流的影响。这个信息可用以优化医学治疗或避免可能有危险的用药结果。降阶模型还可用以确定对替代形式和/或变化水平的身体活动或暴露于可能外在力量的风险(例如,当踢足球时、在太空飞行期间、当进行水肺潜水时、在飞机飞行期间等)的冠状动脉血流的影响。这个信息可用以识别对于特定患者可安全且有效的身体活动的类型和水平。降阶模型还可用以预测对冠状动脉血流的经皮冠状动脉介入的可能益处以便选择最优介入策略,和/或用以预测对冠状动脉血流的冠状动脉旁路移植术的可能益处以便选择最优手术策略。
降阶模型还可用以说明动脉疾病的负担增加对冠状动脉血流的可能有害影响,以及用以使用机械论或现象疾病进展模型或经验数据来预测何时进行性疾病可导致血流对心脏肌的危害。这个信息可能够确定“保用期”(在保用期中,使用非侵入性成像经观察最初无血液动力学意义上的疾病的患者不期望需要医药、介入性或手术治疗),或者,在不利因素继续的情况下进展可能发生的速率。
降阶模型还可用以说明由冠状动脉疾病的负担减小产生的对冠状动脉血流的可能有益影响,以及用以使用机械论或现象疾病进展模型或经验数据来预测何时疾病的消退可导致通过冠状动脉到心脏肌的增加的血流。这个信息可用以指导医疗管理项目,包括(但不限于)饮食变化、增加的身体活动、抑制素或其它药物的处方等。
降阶模型也可并入到血管造影系统中以允许当医师在心导管插入术实验室中检查患者时的治疗选项的实时计算。模型可与血管造影显示配准到同一定向,从而允许冠状动脉的实时血管造影视图与模拟血流解的并排或重叠结果。医师可在程序期间进行观察时计划并更改治疗方案计划,从而允许在作出医疗决定之前相对快速地反馈。医师可以侵入性方式取得压力、ffr或血流测量结果,并且所述测量结果可用以在进行预测性模拟之前进一步改进模型。
降阶模型也可并入到医学成像系统或工作站中。如果从先前患者特定模拟结果的库导出,那么降阶模型可结合几何分段算法使用以在完成成像扫描之后相对快速地解出血流信息。
降阶模型也可用以模型化新医学疗法或治疗选项的成本/益处对大量患者的效用。多个患者特定集总参数模型(例如,数百个、数千个或更多)的数据库可提供模型以在相对少量的时间中求解。可提供相对快速的迭代和优化以用于药品、疗法或临床试验模拟或设计。使模型适合于表示治疗方案、患者对药品的反应或外科手术可允许获得效用的估计,而不必进行可能高成本且可能有风险的大规模临床试验。
vii.其它结果
a.评估心肌灌注
可计算其它结果。举例来说,计算分析可提供量化心肌灌注(通过心肌的血流)的结果。量化心肌灌注可帮助识别心肌血流减小(诸如由于缺血(供血的限制)、瘢痕或其它心脏问题)的区域。
图29示出有关于根据一示例性实施方案的用于提供有关于特定患者中的心肌灌注的各种信息的方法800的示意图。方法800可在上述的计算机系统(例如,用以实现上文所描述且在图3中示出的步骤中的一个或多个的计算机系统)中实现。
方法800可使用一个或多个输入802进行。输入802可包括患者的主动脉、冠状动脉(和从冠状动脉伸出的分支)以及心脏的医学成像数据803,诸如ccta数据(例如,在图2的步骤100中获得)。输入802还可包括从患者测量的额外生理数据804,诸如患者的肱血压、心率和/或其它测量结果(例如,在图2的步骤100中获得)。额外生理数据804可以非侵入性方式获得。输入802可用以进行下文所描述的步骤。
可基于成像数据803建立患者的心肌组织的三维几何模型(步骤810),并且可将所述几何模型划分成多个片段或体积(步骤812)。举例来说,图31示出三维几何模型846,包括划分成片段842的患者的心肌组织的三维几何模型838。个别片段842的大小和位置可基于冠状动脉(及从其伸出的分支)的流出边界324(图8)的位置、在各个片段842中或连接到片段的血管(例如,邻近的血管)的大小等确定。几何心肌模型838到片段842的划分可使用各种已知方法进行,所述已知方法诸如快速跨步方法、广义快速跨步方法、水平集方法、扩散方程、控制有孔介质中的流量的方程式等。
所述三维几何模型还可包括患者的主动脉和冠状动脉(和从冠状动脉伸出的分支)的一部分,所述部分可基于成像数据803模型化(步骤814)。举例来说,图31的三维几何模型846包括患者的主动脉和冠状动脉(以及从冠状动脉伸出的分支)的三维几何模型837和步骤810中所建立的患者的心肌组织的三维几何模型838。
回头参看图29,可进行计算分析(例如,如上文结合图3的步骤402所描述),以确定包括关于由用户确定的身体条件下的患者的冠脉血流的信息的解(步骤816)。举例来说,身体条件可包括静止、所选择的充血水平、所选择的锻炼或劳力水平或其它条件。解可提供步骤814中所模型化的患者的解剖中的各种位置处且在规定身体条件下的信息,诸如血流和血压。计算分析可使用从集总参数或一维模型导出的流出边界324(图8)处的边界条件进行。一维模型可产生以填充片段842,如下文结合图30所描述。
基于步骤816中所确定的血流信息,可计算血流到步骤812中所建立的心肌的各个片段842中的灌注(步骤818)。举例来说,灌注可通过依据出口灌注到的分段心肌的体积划分来自边界条件324(图8)的每一出口的血流来计算。
可在步骤810或812中所产生的心肌的几何模型(例如,图31中所示出的患者的心肌组织的三维几何模型838)上显示步骤818中所确定的心肌的各个片段的灌注(步骤820)。举例来说,图31示出:几何模型838的心肌的片段842可用不同阴影或颜色来说明以指示血流到各别片段842中的灌注。
图30示出有关于根据一示例性实施方案的用于提供有关于特定患者中的心肌灌注的各种信息的方法820的另一示意图。方法820可在上述的计算机系统(例如,用以实现上文所描述且在图3中示出的步骤中的一个或多个的计算机系统)中实现。
方法820可使用一个或多个输入832进行,所述输入可包括患者的主动脉、冠状动脉(以及从冠状动脉伸出的分支)以及心脏的医学成像数据833,诸如ccta数据(例如,在图2的步骤100中获得)。输入832可用以进行下文所描述的步骤。
可基于成像数据833建立患者的心肌组织的三维几何模型(步骤835)。所述模型还可包括患者的主动脉和冠状动脉(以及从冠状动脉伸出的分支)的一部分,所述部分也可使用成像数据803建立。举例来说,如上所述,图31示出三维几何模型836,其包括患者的主动脉和冠状动脉(以及从冠状动脉伸出的分支)的几何模型837和患者的心肌组织的几何模型838。步骤835可包括上文所描述的图29的步骤810和814。
回头参看图30,可将几何心肌模型838划分成多个体积或片段842(步骤840)。步骤840可包括上文所描述的图29的步骤812。如上所述,图31示出三维几何模型846,其包括患者的心肌组织的几何模型838,其划分成多个片段842。
回头参看图30,几何模型846可经修改以将下一代分支857包括于冠状动脉树中(步骤855)。分支857(在图31中用虚线示出)的位置和大小可基于冠状动脉(以及从冠状动脉伸出的分支)的中心线来确定。中心线可(例如)基于成像数据833确定(步骤845)。算法也可用以基于形态计量模型(用以预测在流出边界324(图8)处的已知出口下游的血管位置和大小的模型)和/或有关于血管大小的生理分支规律来确定分支857的位置和大小(步骤850)。形态计量模型可扩充到包括于几何模型837中的冠状动脉(以及从冠状动脉伸出的分支)的下游末端,并且提供在心外膜表面(心脏组织的外层)上或包含在心肌壁的几何模型838内。
可基于步骤855中所建立的分支857对心肌进一步分段(步骤860)。举例来说,图31示出:片段842可划分成多个子体积或子片段862。
可在子片段862中建立额外分支857,且子片段862可进一步分段成较小片段867(步骤865)。可重复建立分支和对体积进行子分段的步骤,直到获得体积大小和/或分支大小的所要分辨率。模型846(其已经扩充而包括步骤855和865中的新分支857)可接着用以计算到子片段(诸如步骤865中所产生的子片段867)中的冠脉血流和心肌灌注。
因此,经扩充模型可用以进行上述的计算分析。计算分析的结果可提供有关于从患者特定冠状动脉模型(例如,图31的模型837)到所产生的形态计量模型(包括步骤855和865中所产生的分支857)中的血流的信息,形态计量模型可延伸到步骤865中所产生的灌注子片段867中。计算分析可使用并入来自耦合心脏机械论模型的数据的静态心肌灌注体积或动态模型进行。
图32示出有关于根据一示例性实施方案的用于提供有关于特定患者中的心肌灌注的各种信息的方法870的另一示意图。方法870可在上述的计算机系统(例如,用以实现上文所描述且在图3中示出的步骤中的一个或多个的计算机系统)中实现。
方法870可使用一个或多个输入872进行。输入872可包括患者的主动脉、冠状动脉(以及从冠状动脉伸出的分支)以及心脏的医学成像数据873,诸如ccta数据(例如,在图2的步骤100中获得)。输入872还可包括从患者测量的额外生理数据874,诸如患者的肱血压、心率和/或其它测量结果(例如,在图2的步骤100中获得)。额外生理数据874可以非侵入性方式获得。输入872可进一步包括(例如,使用ct、pet、spect等)从患者测量的心脏灌注数据875。输入872可用以进行下文所描述的步骤。
可基于成像数据873建立患者的主动脉和冠状动脉(以及从冠状动脉伸出的分支)的三维几何模型(步骤880)。举例来说,图31示出患者的主动脉和冠状动脉(以及从冠状动脉伸出的分支)的三维几何模型837。步骤880可类似于上文所描述的图29的步骤814。
可进行计算分析,例如,如上文结合图3的步骤402所描述,以确定包括关于由用户确定的身体条件下的患者的冠脉血流的信息的解(步骤882)。举例来说,身体条件可包括静止、所选择的充血水平、所选择的锻炼或劳力水平或其它条件。解可提供步骤880中所模型化的患者的解剖中的各种位置处且在规定身体条件下的信息,诸如血流和血压。步骤882可类似于上文所描述的图29的步骤816。
而且,可基于成像数据873建立患者的心肌组织的三维几何模型(步骤884)。举例来说,如上所述,图31示出三维几何模型836,其包括患者的心肌组织的三维几何模型838(例如,如步骤884中所建立)和患者的主动脉和冠状动脉(以及从冠状动脉伸出的分支)的三维几何模型837(例如,如步骤880中所建立)。步骤884可类似于上文所描述的图29的步骤810。
可将几何模型划分成多个片段或子体积(步骤886)。举例来说,图31示出几何模型846,其包括划分成片段842的患者的心肌组织的模型838。步骤886可类似于上文所描述的图29的步骤812。
基于步骤882中所确定的血流信息,可计算血流到步骤886中所建立的心肌的各个片段842中的灌注(步骤888)。步骤888可类似于上文所描述的图29的步骤818。
可在步骤884或886中所产生的心肌的几何模型(例如,图31中示出的患者的心肌组织的三维几何模型838)上显示心肌的各个片段的计算灌注(步骤890)。举例来说,图31示出,几何模型838的心肌的片段842可用不同阴影或颜色说明以指示血流到各个片段842中的灌注。步骤890可类似于上文所描述的图29的步骤820。
可比较映射到步骤890中的心肌的三维几何模型上的模拟灌注数据与测量的心脏灌注数据875(步骤892)。所述比较可对(例如)心肌的基于体元的表示或心肌的不同离散表示(例如,有限元网格)进行。所述比较可使用心肌的三维表示上的不同颜色和/或阴影来指示模拟灌注数据与测量灌注数据之间的差异。
可调整步骤880中所建立的三维几何模型的出口处的边界条件以减小模拟灌注数据与测量灌注数据之间的误差(步骤894)。举例来说,为了减小误差,可调整边界条件,使得供给区域(例如,片段842、862或867)(其中模拟灌注低于测量灌注)的血管的指定流动阻力可减小。可调整边界条件的其它参数。或者,可修改模型的分叉结构。举例来说,步骤880中所建立的几何模型可如上文关于图30和31所描述地扩充以建立形态计量模型。使用参数估计或数据同化方法(诸如标题为“用于调节患者特定心血管模拟的方法(methodfortuningpatient-specificcardiovascularsimulations)”的美国专利申请公布no.2010/0017171中所描述的方法)或其它方法,可凭经验或系统性地调整边界条件的参数和/或形态计量模型。
可重复图32的步骤882、888、890、892、894和/或其它步骤,例如,直到模拟灌注数据与测量灌注数据之间的误差低于预定阈值。结果,可使用关于解剖信息、冠脉血流信息以及心肌灌注信息的模型进行计算分析。这个模型可用于诊断目的以及用于预测医药、介入性或手术疗法的益处。
结果,静止和/或应力条件下的冠状动脉血流和心肌灌注可在依据三维医学成像数据构建的患者特定几何模型中模拟。测量的心肌灌注数据可与模拟心肌灌注结果组合使用以调整边界条件,直到模拟心肌灌注结果在给定容限内匹配测量的心肌灌注数据(例如,如上文关于图32所描述)。可提供更准确的患者特定冠状动脉血流计算,并且心脏科医生可能够在测量数据不可得的情境下(诸如当模拟最大运动或劳力、模拟治疗方案或其它条件下的患者时)预测冠状动脉血流和心肌灌注。
左心室和/或右心室心肌的患者特定三维模型可划分成灌注片段或子体积。而且,从医学成像数据确定的冠状动脉的患者特定三维几何模型可与在心外膜表面上或含于由灌注子体积表示的左心室和/或右心室心肌壁中的剩余冠状动脉树的一部分的形态计量模型组合,以形成扩充模型。可计算扩充模型中的给定(例如,有病)位置下游的总心肌体积的百分比。还可计算扩充模型中的给定(例如,有病)位置处的总心肌血流的百分比。扩充模型可用以计算冠脉血流和心肌灌注。也可修改冠脉血流模型,直到模拟灌注在指定容限内匹配测量的灌注数据。
b.评估斑块易损性
计算分析还可提供量化作用于可积聚在患者的主动脉和冠状动脉(以及从冠状动脉伸出的分支)中的斑块(例如,冠状动脉动脉粥样硬化斑块)上的患者特定生物机械力的结果。生物机械力可由脉动压力、血流以及心脏运动导致。
图33示出沿血管壁902(诸如主冠状动脉中的一者或从主冠状动脉伸出的分支中的一者的壁)积聚的斑块900的实例。斑块的上游末端与下游末端之间的压力和/或表面积的差异可产生至少沿血流的方向作用于斑块900的力904,例如,由流经血管的血液导致。另一力906可至少沿朝着并且垂直于血管902的方向作用于斑块900的表面。力906可由流经血管的血液的血压导致。又一力908可至少沿血流的方向作用于斑块900的表面,且可由静止、锻炼等期间的血液动力学力引起。
结果还可评估斑块破裂的风险(例如,当堆积在血管壁上的斑块变得不稳定且脱离或破开时)和可能受此破裂影响的心肌体积。结果可在诸如静止、锻炼等的各种模拟生理条件下进行评估。斑块破裂风险可定义为模拟斑块应力与使用从ccta或mri(例如,在图2的步骤100中确定)导出的材料组成数据估计的斑块强度的比。
举例来说,图34示出计算分析可输出的结果的实例。所述结果可包括图31的三维几何模型846,其可包括患者的主动脉和冠状动脉(以及从冠状动脉伸出的分支)的三维几何模型837和划分成片段842的患者的心肌组织的三维几何模型838。所述结果还可指示冠状动脉(具有从其伸出的分支)中的一者中的位置910(在所述位置中,斑块可确定为易损的),并且位置910可基于对斑块破裂风险的评估(如下文将更详细描述)和/或基于来自用户的输入来识别。而且,如图34中所示,(多个片段842的)心肌片段912可经识别为具有低灌注的高可能性,由位置910处识别的斑块的破裂引起。
图35和36为示出根据一示例性实施方案的用于提供有关于评估特定患者中的斑块易损性、心肌体积风险以及心肌灌注风险的各种信息的方法920的方面的示意图。方法920可在上述的计算机系统(例如,用以实现上文所描述且在图3中示出的步骤中的一个或多个的计算机系统)中实现。方法920可使用一个或多个输入922进行,并且可包括:基于输入922产生一个或多个模型930;基于模型930中的一个或多个进行一个或多个生物机械分析940;以及基于模型930和生物机械分析940提供各种结果。
输入922可包括患者的主动脉、冠状动脉(以及从冠状动脉伸出的分支)以及心脏的医学成像数据923,诸如ccta数据(例如,在图2的步骤100中获得)。输入922还可包括从患者测量的额外生理数据924,诸如患者的肱血压、心率和/或其它测量结果(例如,在图2的步骤100中获得)。额外生理数据924可以非侵入性方式获得。输入922可用以产生模型930和/或进行下文所描述的生物机械分析940。
如上文所述,一个或多个模型930可基于输入922而产生。举例来说,方法920可包括产生血液动力学模型932,其包括遍布患者的解剖的三维几何模型中的各种位置处的计算血流和血压信息。可使用医学成像数据923来建立患者的解剖的模型,例如,图3的步骤306中所产生的图8的实体模型320,和/或图3的步骤312中所产生的图17到19的网格380,并且,在一示例性实施方案中,血液动力学模型932可为模拟血压模型50(图1)、模拟血流模型52(图1)、cffr模型54(图1),或在进行计算分析之后所产生的其它模拟,例如,如上文结合图3的步骤402所描述。固体力学模型(包括流体结构相互作用模型)可用利用已知数值方法的计算分析来求解。斑块和血管的性质可模型化为线性或非线性的、各向同性或各向异性的。解可提供斑块和斑块与血管之间的界面的应力和应变。在图36中所示出的示例性实施方案中,血液动力学模型932为cffr模型54。
方法920可包括通过计算由各种生理状态(诸如静止、变化水平的锻炼或劳力等)下的血液动力学力引起的作用于斑块腔面的压力906(图33)和剪应力908(图33),使用血液动力学模型932进行生物力学分析940(步骤942)。压力906和剪应力908可基于来自血液动力学模型932的信息(例如,血压和血流量)而计算。
任选地,方法920还可包括从四维成像数据(例如,在心动周期的多个阶段(诸如心脏收缩和心脏舒张阶段)所获得的成像数据)产生用于量化血管变形的几何分析模型934。成像数据可使用各种已知成像方法获得。几何分析模型934可包括关于在心动周期的不同阶段的血管位置、变形、定向以及大小(例如,由心脏运动引起)的信息。举例来说,患者的主动脉、冠状动脉(以及从冠状动脉伸出的分支)以及斑块的各种类型的变形(诸如纵向延长(伸长)或缩短、扭曲(扭转)、径向膨胀或压缩以及弯曲)可由几何分析模型934来模拟。
方法920可包括通过计算由心脏诱发脉动压力引起的患者的主动脉、冠状动脉(以及从冠状动脉伸出的分支)以及斑块的各种变形特性(诸如纵向延长(伸长)或缩短、扭曲(扭转)、径向膨胀或压缩以及弯曲等),使用几何分析模型934进行生物力学分析940(步骤944)。这些变形特性可基于来自几何分析模型934的信息(例如,心动周期的多个阶段中的血管位置、定向以及大小的变化)而计算。
可通过确定模型化几何形状(例如,患者的主动脉、冠状动脉(以及从冠状动脉伸出的分支)、斑块等的几何形状)的中心线或表面网格来简化变形特性的计算。为了确定不同阶段之间的模型化几何形状的变化,分支口、钙化病变以及软斑块可用作为标志。在没有标志的区域中,沿模型化几何形状的长度的截面积分布可用以识别两个图像帧之间的对应位置(以“配准”两个图像帧)。基于原始图像数据的变形配准算法可用以提取三维变形场。可接着将计算的三维变形场投影到与模型化几何形状(例如,血管长度)对齐的曲线轴以计算变形场的切向分量和法向分量。模型化几何形状(例如,血管长度)的所得差异、分支分离的角度以及心缩期与心舒期之间的曲度可用以确定血管所经历的应变。
方法920还可包括从医学成像数据923产生用于确定斑块组成和性质的斑块模型936。举例来说,斑块模型936可包括关于斑块的密度和其它材料性质的信息。
方法920还可包括产生用于计算关于斑块、血管壁和/或斑块与血管壁之间的界面的信息的血管壁模型938。举例来说,血管壁模型938可包括关于应力和应变的信息,其可基于包括于斑块模型936中的斑块组成和性质、步骤942中所计算的压力906和剪应力908和/或步骤944中所计算的变形特性而计算。
方法920可包括通过计算斑块上的由血液动力学力和心脏运动诱发应变引起的应力(例如,急性或累积应力),使用血管壁模型938进行生物力学分析940(步骤946)。举例来说,可计算作用于斑块的流动诱发力904(图33)。斑块上的由血液动力学力和心脏运动诱发应变引起的应力或力可基于来自血管壁模型938的信息(例如,斑块上的应力或应变)而计算。
方法920可包括基于上文所描述的模型930中的一个或多个以及生物机械分析940中的一个或多个来确定其它信息。
可计算斑块破裂易损性指数(步骤950)。斑块破裂易损性指数可(例如)基于总血液动力学应力、应力频率、应力方向和/或斑块强度或其它性质而计算。举例来说,包围感兴趣斑块的区域可与斑块的三维模型930(诸如斑块模型936)隔离。斑块的强度可从斑块模型936中所提供的材料性质确定。感兴趣的斑块上的由脉动压力、流动以及心脏运动引起的血液动力和组织应力可在模拟基线和运动(或劳力)条件下通过使用先前在步骤946中计算的血液动力学应力和运动诱发应变而计算。斑块的易损性可基于斑块应力与斑块强度之比来评估。
还可计算心肌体积风险指数(mvri)(步骤952)。mvri可以定义为受动脉树中的给定位置处的斑块破裂和血管闭塞(闭合或阻塞)影响的总心肌体积的百分比。mvri可基于由给定斑块下游的血管供应的心肌的部分而计算,其可考虑相对于下游血管的大小的斑块的大小和斑块基于三维血液动力学解可能流到不同血管中的可能性。
心肌可经模型化并在血液动力模拟中划分成由每一血管供应的片段842(例如,如结合图30的步骤835和840所描述)。几何模型可经修改以将下一代分支857包括于冠状动脉树中(例如,如结合图30的步骤855所描述),且心肌可进一步分段(例如,如结合图30的步骤860所描述)。可在子片段862中建立额外分支857,且子片段862可进一步分段成较小片段867(例如,如结合图30的步骤865所描述)。如先前所述,生理关系可用以关联血管的大小与所供应的比例量的心肌。
可确定破裂斑块所循的可能路径。血液动力学解可用以确定斑块碎片或栓子可流到不同下游血管中的百分比机会。
可比较破裂斑块的大小与下游血管的大小以确定斑块最终可在何处形成流动的障碍。这个信息可与易损性指数组合以提供可能潜在地受破裂斑块影响的心肌的体积的可能性图。mvri可指派给每一可能受影响片段。图34示出片段912的实例,在所述片段中,远端血管中的位置910处的易损斑块具有影响小面积的心肌的高可能性。
还可计算心肌灌注风险指数(mpri)(步骤954)。mpri可定义为受动脉树中的给定位置处的斑块破裂或血管闭塞影响的总心肌血流的百分比。举例来说,与lad动脉的近端部分中的斑块破裂相比,lad动脉的远端部分中的斑块破裂可产生较低mvri和较低mpri。然而,如果心肌体积的受供血血管中的易损斑块影响的一部分不可行(例如,由于在心肌梗死后可形成的瘢痕组织),那么这些指数可以不同。因此,mpri指示到心肌片段的可能灌注损失,而非如mvri所指示的受影响的体积。可计算到图31的每一片段842、862或867的灌注率,且可基于易损性指数、血液动力学解以及斑块和血管的大小来计算灌注损失。
结果,可计算由脉动血压、脉动血流、脉动血液剪应力和/或脉动心脏运动引起的斑块应力,并且可基于医学成像数据估计斑块强度,并且可量化有关于斑块易损性、心肌体积风险以及心肌灌注风险的指数。
viii.其它应用
上文所描述的实施方案与评估关于患者中的冠脉血流的信息关联。或者,实施方案也可适用于身体中的其它区(诸如,但不限于,颈动脉、外围、腹部、肾、股、腘以及脑动脉)中的血流。
a.模型化颅内和颅外血流
现在将描述有关于脑动脉的实施方案。许多疾病可以影响或受颅外或颅内动脉中的血流和压力影响。颅外动脉(例如,颈动脉和椎动脉)中的动脉粥样硬化性疾病可限制到脑部的血液流动。动脉粥样硬化性疾病的严重表现可引起短暂性脑缺血发作或缺血性中风。颅内或颅外动脉中的动脉瘤性疾病可造成引起缺血性中风的栓塞或引起出血性中风的动脉瘤破裂的风险。诸如头部创伤、高血压、头颈癌、动静脉畸形、直立耐受不能等的其它条件也可影响脑血流。此外,脑血流的减少可诱发诸如昏厥的症状或影响慢性神经障碍,诸如阿尔兹海默病或帕金森病后继的痴呆。
具有已知或可疑颅外或颅内动脉疾病的患者通常可接受以下非侵入性诊断测试中的一个或多个:us、mri、ct、pet。然而,这些测试对于大部分患者而言不能够有效地提供颅外和颅内动脉的解剖和生理数据。
图37为脑动脉(包括颅内(颅腔内)和颅外(颅腔外)动脉)的图。用于确定关于患者特定颅内和颅外血流的信息的方法可大体上类似于如上所述的用于确定关于患者特定冠脉血流的信息的方法。
图38为示出用于提供有关于特定患者中的颅内和颅外血流的各种信息的方法1000的方面的示意图。方法1000可在计算机系统(例如,类似于用以实现上文所描述且在图3中示出的步骤中的一个或多个的计算机系统)中实现。方法1000可使用一个或多个输入1010进行,并且可包括:基于输入1010产生一个或多个模型1020;基于输入1010和/或模型1020指派一个或多个条件1030;以及基于模型1020和条件1030导出一个或多个解1040。
输入1010可包括患者的颅内和颅外动脉(例如,患者的主动脉、颈动脉(在图37中示出)、椎动脉(在图37中示出))和脑的医学成像数据1011,诸如ccta数据(例如,结合图2的步骤100如上所述地以类似方式获得)。输入1010还可包括患者的肱血压、颈动脉血压(例如,使用眼压测量法)的测量结果1012,和/或其它测量结果(例如,结合图2的步骤100如上所述地以类似方式获得)。测量结果1012可以非侵入性方式获得。输入1010可用以产生模型1020和/或确定下文所描述的条件1030。
如上文所述,一个或多个模型1020可基于输入1010而产生。举例来说,方法1000可包括基于成像数据1011产生患者的颅内和颅外动脉的一个或多个患者特定三维几何模型(步骤1021)。三维几何模型1021可使用如上所述的用于产生图8的实体模型320和图17到19的网格380的类似方法产生。举例来说,如图3的步骤306和312的类似步骤可用以产生表示患者的颅内和颅外动脉的三维实体模型和网格。
回头参看图38,方法1000还可包括产生一个或多个基于物理学的血流模型(步骤1022)。举例来说,血流模型可为表示遍及步骤1021中所产生的患者特定几何模型的流量、心脏和主动脉循环、远端颅内和颅外循环等的模型。血流模型可包括三维几何模型1021的流入边界和/或流出边界处的如上文结合图3的步骤310所描述的降阶模型,例如,集总参数模型或分散式(一维波传播)模型等。或者,流入边界和/或流出边界可经指派速度、流率、压力或其它特性等的各别指定值或域。作为另一替代方案,流入边界可耦合到心脏模型,例如,包括主动脉弓。用于流入和/或流出边界的参数可经调整以匹配测量或选择的生理条件,包括(但不限于)心输出量和血压。
如上文所述,一个或多个条件1030可基于输入1010和/或模型1020而确定。条件1030包括为步骤1022(和图3的步骤310)中所确定的边界条件所计算的的参数。举例来说,方法1000可包括通过基于成像数据1011(例如,以如上文结合图3的步骤240所描述的类似方式获得)计算患者特定脑或头体积,确定条件(步骤1031)。
方法1000可包括通过使用步骤1031中所计算的脑或头体积,基于关系q=qomα(其中α为预设的标度指数,m为从脑或头体积确定的脑质量,且qo为预设的常数)(例如,类似于上文结合图3的步骤310中确定集总参数模型所描述的生理关系)计算静止脑血流q来计算条件(步骤1032)。或者,所述关系可具有形式q∝qomα,如上文结合在图3的步骤310中确定集总参数模型所描述。
方法1000还可包括通过使用步骤1032中所计算的所得冠脉血流和患者的测量血压1012,计算总静止脑阻力(例如,类似于上文结合图3的步骤310中确定集总参数模型所描述的方法)来确定条件(步骤1033)。举例来说,步骤1032中所确定的基线(静止)条件下的三维几何模型1021的流出边界处的总脑血流q和测量血压1012可用以基于预设的实验导出方程式而确定流出边界处的总阻力r。与集总参数模型中所使用的各种电组件关联的电阻、电容、电感以及其它变量可并入到边界条件中(例如,如上文结合在图3的步骤310中确定集总参数模型所描述)。
方法1000还可包括使用步骤1033中所计算的总静止脑阻力和模型1020计算个别颅内和颅外动脉的个别阻力而确定条件(步骤1034)。举例来说,类似于上文结合图3的步骤310所描述的方法,步骤1033中所计算的总静止脑阻力r可基于个别颅内和颅外动脉的远端末端的大小(例如,从步骤1021中所产生的几何模型确定)以及基于关系r=rodβ(其中r为特定远端末端处的流动阻力,且ro为预设的常数,d为大小(例如,所述远端末端的直径),且β为预设的幂律指数,如上文结合在图3的步骤310中确定集总参数模型所描述),分散到个别颅内和颅外动脉。
回头参看图38,方法1000可包括基于患者的一个或多个身体条件调整边界条件(步骤1035)。举例来说,在步骤1031到1034中所确定的参数可基于解1040是否意欲模拟静止、变化水平的应力、变化水平的压力感受器响应或其它自主反馈控制、变化水平的充血、变化水平的锻炼、劳力、高血压或低血压、不同用药、姿势变化和/或其它条件来修改。所述参数(例如,有关于流出边界处的边界条件的参数)也可基于颅内和颅外动脉的血管舒张能力(血管变宽的能力)(例如,由微血管功能障碍或内皮健康引起)来调整。
基于输入1010、模型1020以及条件1030,可进行计算分析,例如,如上文结合图3的步骤402所描述,以确定包括关于在步骤1035中所选择的身体条件下的患者的冠脉血流的信息的解1040(步骤1041)。可从解1040提供的信息的实例可类似于上文关于图1和21到24所提供的实例,例如,模拟血压模型、模拟血流模型等。结果也可用以确定(例如)流率、总脑血流、血管壁剪应力、作用于血管壁或动脉粥样硬化斑块或动脉瘤的拉力或剪力、粒子/血液停留时间、血管壁移动、血液剪切速率等。这些结果也可用以分析离开血管系统中的特定区域的栓子由于血液循环而最可能移动到何处。
计算机系统可允许用户模拟几何形状中的各种变化。举例来说,模型1020(例如,步骤1021中所产生的患者特定几何模型)可经修改以预测使动脉闭塞(例如,急性闭塞)的效果。在一些手术程序中,诸如当移除癌性肿瘤时,一个或多个颅外动脉可能损坏或经移除。因此,步骤1021中所产生的患者特定几何模型也可经修改以模拟阻止血流到达颅外动脉中的一个或多个的效果,以便预测侧支通路为患者供应足够血流的可能。
计算机系统可允许用户模拟例如急性闭塞的各种治疗选项(诸如介入或手术修复)的结果。通过用如上文结合图27和28所描述的降阶模型替换如上所述的表示颅内和颅外动脉的三维实体模型或网格,模拟可更快速地进行。结果,降阶模型(诸如一维或集总参数模型)可以更有效且更快地解出患者特定模型中的血流和徐亚,并且显示解的结果。
特定患者对血管扩张刺激的反应可基于患者在静止时的血液动力学信息或基于不同疾病状态的基于群体的数据来预测。举例来说,在基线(静止)中,执行模型(例如,如上文在步骤1041中所描述),其中血流分布是基于幂律和脑质量指派(例如,如上文结合步骤1032所描述)。阻力值(例如,如步骤1033和1034中所确定)可经调整以允许充分灌注。或者,来自具有诸如糖尿病、药物治疗以及过去心脏事件的因素的患者群体的数据被用以指派不同阻力。静止条件下的阻力的调整(单独地或与血液动力学信息(例如,壁剪应力或流量与血管大小的关系)组合)可用以确定远端脑血管的剩余扩张能力。需要阻力减小以满足静止流量要求的患者或具有高的流量对血管大小比的患者可具有减弱的在生理应激下使血管进一步扩张的能力。
跨脑动脉的个别片段的流率和压力梯度(例如,如在步骤1041中所确定)可用以计算脑动脉阻力。脑动脉阻力可计算为包括于从医学成像数据产生的患者特定几何模型(例如,在步骤1021中产生)中的颅外和颅内动脉的部分的等效电阻。脑动脉阻力在解释在颅外和/或颅内动脉中具有弥漫性动脉粥样硬化的患者为什么可以展现昏厥(暂时失去意识或姿势,例如,晕倒)或缺血(供血限制)的症状时可具有临床意义。
而且,可(例如)基于步骤1041中所确定的流量信息和步骤1031中所计算的脑组织体积或质量来计算基线或经更改生理条件下的每单位脑组织体积(或质量)的流量。此计算在理解血流减少对慢性神经障碍的影响时可能有用。此计算也可在选择或改进医学疗法(例如,抗高血压药的剂量)时有用。额外结果可包括量化创伤、震荡、外部生理应激、过多g力、失重、太空飞行、深海减压(例如,弯曲)等的影响。
组合式患者特定解剖(几何)和生理(基于物理学的)模型可用以确定更改心率、搏出量、血压或脑微循环功能的不同用药或生活方式变化(例如,停止吸烟、饮食变化或增加的身体活动)对脑动脉血流的影响。组合式模型还可用以确定对替代形式和/或变化水平的身体活动或暴露于可能外在力量的风险(例如,当踢足球时、在太空飞行期间、当进行水肺潜水时、在飞机飞行期间等)的脑动脉血流的影响。这个信息可用以识别对于特定患者可能安全且有效的身体活动的类型和水平。组合式模型也可用以预测对脑动脉血流的经皮介入的可能益处以便选择最优介入策略,和/或用以预测对脑动脉血流的颈动脉内膜切除术或颈外动脉到颈内动脉旁路移植术的可能益处以便选择最优手术策略。
组合式模型也可用以说明动脉疾病的负担增加对脑动脉血流的可能有害影响,以及用以使用机械论或现象疾病进展模型或经验数据来预测何时进行性疾病可导致血流对脑部的危害。这个信息可能够确定“保用期”(在保用期中,使用非侵入性成像经观察最初无血液动力学意义上的疾病的患者不期望需要医药、介入性或手术治疗),或者,在不利因素继续的情况下进展可能发生的速率。
组合式模型也可用以说明由疾病负担减少引起的对脑动脉血流的可能有益影响,以及用以使用机械论或现象疾病进展模型或经验数据来预测何时疾病的消退可导致到脑部的增加血流。这个信息可用以指导医疗管理项目,包括(但不限于)饮食变化、增加的身体活动、抑制素或其它药物的处方等。
组合式模型也可用以预测动脉闭塞的影响。在一些手术程序中,诸如移除癌性肿瘤。一些颅外动脉可能损坏或被移除。模拟阻止血流到达颅外动脉中的一者的效果可允许预测侧支通路为特定患者供应足够血流的可能。
i.评估脑灌注
可计算其它结果。举例来说,计算分析可提供量化脑灌注(通过大脑的血流)的结果。量化脑灌注可帮助识别具有减小脑血流的区域。
图39示出有关于根据一示例性实施方案的用于提供有关于特定患者中的脑灌注的各种信息的方法1050的示意图。方法1050可在上述的计算机系统(例如,类似于用以实现上文所描述且在图3中示出的步骤中的一个或多个的计算机系统)中实现。
方法1050可使用一个或多个输入1052进行。输入1052可包括患者的颅内和颅外动脉(例如,患者的主动脉、颈动脉(在图37中示出)、椎动脉(在图37中示出))和脑的医学成像数据1053,诸如ccta数据(例如,结合图2的步骤100如上所述地以类似方式获得)。输入1052还可包括从患者测量的额外生理数据1054,诸如患者的肱血压、心率和/或其它测量结果(例如,结合图2的步骤100如上所述地以类似方式获得)。额外生理数据1054可以非侵入性方式获得。输入1052可用以进行下文所描述的步骤。
可基于成像数据1053建立患者的脑组织的三维几何模型(步骤1060)并且可将所述几何模型划分成多个片段或体积(步骤1062)(例如,以上文结合图29到32所描述的类似方法)。个别片段的大小和位置可基于颅内和颅外动脉的流出边界的位置、各个片段中或连接到各个片段的血管(例如,邻近血管)的大小等而确定。几何模型到片段的划分可使用各种已知方法进行,所述已知方法诸如快速跨步方法、广义快速跨步方法、水平集方法、扩散方程、控制有孔介质中的流量的方程式等。
三维几何模型还可包括患者的颅内和颅外动脉的一部分,其可基于成像数据1053模型化(步骤1064)。举例来说,在步骤1062和1064中,可建立三维几何模型,其包括脑组织和颅内及颅外动脉。
可进行计算分析,例如,如上文结合图3的步骤402所描述,以确定包括关于由用户确定的身体条件下的患者的脑血流的信息的解(步骤1066)。举例来说,身体条件可包括静止、变化水平的应力、变化水平的压力感受器响应或其它自主反馈控制、变化水平的充血、变化水平的锻炼或劳力、不同用药、姿势变化和/或其它条件。解可提供步骤1064中所模型化的患者的解剖中的各种位置处且在规定身体条件下的信息,诸如血流和血压。计算分析可使用从集总参数或一维模型导出的流出边界处的边界条件进行。一维模型可产生以填充如下文结合图40所描述的脑组织的片段。
基于步骤1066中所确定的血流信息,可计算血流到步骤1062中所建立的脑的各个片段中的灌注(步骤1068)。举例来说,可通过将来自流出边界的每一出口的血流除以出口灌注到的分段脑部的体积来计算灌注。
可在步骤1060或1062中所产生的脑的几何模型上显示步骤1068中所确定的脑的各个片段的灌注(步骤1070)。举例来说,步骤1060中所建立的几何模型中所示的脑的片段可用不同阴影或颜色来说明以指示血流到各个片段中的灌注。
图40示出有关于根据一示例性实施方案的用于提供有关于特定患者中的脑灌注的各种信息的方法1100的另一示意图。方法1100可在上述的计算机系统(例如,类似于用以实现上文所描述并且在图3中示出的步骤中的一个或多个的计算机系统)中实现。
方法1100可使用一个或多个输入1102进行,所述输入可包括患者的主动脉、颈动脉(在图37中示出)、椎动脉(在图37中示出)以及脑的医学成像数据1103,诸如ccta数据(例如,结合图2的步骤100如上所述地以类似方式获得)。输入1102可用以进行下文所描述的步骤。
可基于成像数据1103建立患者的脑组织的三维几何模型(步骤1110)。所述模型还可包括患者的主动脉、颈动脉(在图37中示出)以及椎动脉(在图37中示出)的一部分,所述部分也可基于成像数据1103建立。举例来说,如上所述,可建立包括脑组织以及颅内和颅外动脉的三维几何模型。步骤1110可包括上文所描述的图39的步骤1060和1064。
可将步骤1110中所建立的几何脑组织模型划分成多个体积或片段(步骤1112)。步骤1112可包括上文所描述的图39的步骤1062。几何脑组织模型也可经进一步修改以将下一代分支包括于脑树中(步骤1118)(例如,以上文关于图29到32所描述的类似方法)。分支的位置和大小可基于颅内和颅外动脉的基线确定。可(例如)基于成像数据1103确定基线(步骤1114)。算法也可用以基于形态计量模型(用以预测在流出边界处的已知出口下游的血管位置和大小的模型)和/或有关于血管大小的生理分支规律来确定分支的位置和大小(步骤1116)。形态计量模型可扩充到包括于几何模型中的颅内和颅外动脉的下游末端,并且提供在脑组织的外层上或包含在脑组织的几何模型内。
可基于步骤1118中所建立的分支进一步对脑分段(步骤1120)(例如,以上文关于图29到32所描述的类似方式)。可在子片段中建立额外分支,且子片段可进一步分段成较小片段(步骤1122)(例如,以上文关于图29到32所描述的类似方式)。可重复建立分支和对体积进行子分段的步骤,直到获得体积大小和/或分支大小的所要分辨率。几何模型(其已经扩充而包括步骤1118和1122中的新分支)可接着用以计算到子片段(诸如步骤1122中所产生的子片段)中的脑血流和脑灌注。
因此,经扩充模型可用以进行上述的计算分析。计算分析的结果可提供有关于从患者特定脑动脉模型到所产生的形态计量模型(包括步骤1118和1122中所产生的分支)中的血流的信息,形态计量模型可延伸到步骤1122中所产生的灌注子片段的每一者中。
图41示出有关于根据一示例性实施方案的用于提供有关于特定患者中的脑灌注的各种信息的方法1150的另一示意图。方法1150可在上述的计算机系统(例如,用以实现上文所描述并且在图3中示出的步骤中的一个或多个步骤的计算机系统)中实现。
方法1150可使用一个或多个输入1152进行。输入1152可包含患者的主动脉、颈动脉(在图37中示出)、椎动脉(在图37中示出)以及脑部的医学成像数据1153,诸如ccta数据(例如,结合图2的步骤100如上所述地以类似方式获得)。输入1152还可包含从患者测量的额外生理数据1154,诸如患者的肱血压、心率和/或其它测量结果(例如,在图2的步骤100中获得)。额外生理数据1154可以非侵入性方式获得。输入1152更可包含(例如,使用ct、pet、spect、mri等)从患者测量的脑灌注数据1155。输入1152可用以进行下文所描述的步骤。
可基于成像数据1153建立患者的颅内和颅外动脉的三维几何模型(步骤1160)。步骤1160可类似于上文所描述的图39的步骤1064。
可进行计算分析,例如,上文结合图3的步骤402所描述,以确定包括关于在由用户确定的身体条件下的患者的脑血流的信息的解(步骤1162)。举例来说,身体条件可包括静止、变化水平的应力、变化水平的压力感受器响应或其它自主反馈控制、变化水平的充血、变化水平的锻炼或劳力、不同用药、姿势变化和/或其它条件。解可提供步骤1160中所模型化的患者的解剖中的各种位置处且在规定身体条件下的信息,诸如血流和血压。步骤1162可类似于上文所描述的图39的步骤1066。
又,可基于成像数据1153建立患者的脑组织的三维几何模型(步骤1164)。举例来说,在步骤1160和1164中,可建立三维几何模型,其包含脑组织和颅内及颅外动脉。步骤1164可类似于上文所描述的图39的步骤1060。
可将几何模型划分成多个片段或子体积(步骤1166)。步骤1166可类似于上文所描述的图39的步骤1062。
基于在步骤1162中确定的血流信息,可计算血流到步骤1166中所建立的脑组织的各个片段中的灌注(步骤1168)。步骤1168可类似于上文所描述的图39的步骤1068。
可在步骤1164或1166中所产生的脑组织的几何模型上显示脑组织的各个片段的计算灌注(步骤1170)。步骤1170可类似于上文所描述的图39的步骤1070。
可比较映射到步骤1170中的脑组织的三维几何模型上的模拟灌注数据与测量的脑灌注数据1155(步骤1172)。所述比较可使用脑组织的三维表示上的各种颜色和/或阴影来指示模拟灌注数据与计算灌注数据中的差异。
可调整步骤1160中所建立的三维几何模型的出口处的边界条件以减少模拟灌注数据与测量灌注数据之间的误差(步骤1174)。举例来说,为了减少误差,可调整边界条件,使得供给区域(例如,在步骤1166中建立的片段)(其中模拟灌注低于测量灌注)的血管的指定流动阻力可减小。可调整边界条件的其它参数。或者,可修改模型的分支结构。举例来说,步骤1160中所建立的几何模型可结合图40如上所述地扩大以建立形态计量模型。使用参数估计或数据同化方法(诸如标题为“用于调节患者特定心血管模拟的方法(methodfortuningpatient-specificcardiovascularsimulations)”的美国专利申请公布no.2010/0017171中所描述的方法)或其它方法,可凭经验或系统性地调整边界条件的参数和/或形态计量模型。
可重复图41的步骤1162、1168、1170、1172、1174和/或其它步骤,例如,直到模拟灌注数据与测量灌注数据之间的误差低于预定阈值。结果,可使用关于解剖信息、脑血流信息以及脑灌注信息的模型进行计算分析。这个模型可用于诊断目的以及用于预测医药、介入性或手术疗法的益处。
结果,可计算基线条件或已更改生理状态下的颅外和颅内动脉血流和脑灌注。脑灌注数据可结合模拟脑灌注结果使用以调整颅内动脉血流计算的边界条件,直到模拟脑灌注结果在给定容限内匹配测量脑灌注数据。因此,可提供更准确的患者特定颅外和颅内动脉血流计算,并且医师可能够在测量数据不可得时(例如,诸如锻炼、劳力、姿势变化或模拟治疗方案的某些身体条件)预测脑动脉血流和脑灌注。脑部的患者特定三维模型可划分成灌注片段或子体积,并且可判定患者是否正在接收到脑的各种区域的足够最小灌注。
颅内动脉的患者特定三维几何模型可从医学成像数据产生并且可与由灌注片段或子体积(例如,如上文关于图40所描述)表示的剩余颅内动脉树的一部分的形态计量模型组合以形成扩充模型。可计算在扩充模型中的给定(例如,有病)位置下游的总脑体积(或质量)的百分比。而且,可计算扩充模型中的给定(例如,有病)位置处的总脑血流的百分比。另外,功能性成像研究(例如,功能性磁共振成像(functionalmagneticresonanceimaging;fmri))、灌注ct或mri中所说明的亏缺可接着追踪到供给血管、解剖变异、受损自动调整机制、低血压或其它条件中的疾病,此可具有缺血性中风、昏厥、直立耐受不能、创伤或慢性神经障碍的患者可能有用。
ii.评估斑块易损性
计算分析还可提供量化作用于可积聚在患者的颅内和颅外动脉中的斑块(例如,颈动脉动脉粥样硬化斑块)上的患者特定生物机械力的结果。生物机械力可由脉动压力、流动以及颈部运动导致。
图42为示出根据一示例性实施方案的用于提供有关于评估特定患者中的斑块易损性、脑体积风险以及脑灌注风险的各种信息的方法1200的方面的示意图。方法1200可在上述计算机系统(例如,类似于用以实现上文所述并且在图3中示出的步骤中的一个或多个步骤的计算机系统)中实现。方法1200可以使用一个或多个输入1202进行,并且可以包括基于输入1202产生一个或多个模型1210、基于模型1210中的一个或多个模型进行一次或多次生物力学分析1220以及基于模型1210和生物力学分析1220提供各种结果。
输入1202可包括患者的颅内和颅外动脉(例如,患者的主动脉、颈动脉(在图37中示出)、椎动脉(在图37中示出)和脑的医学成像数据1203,诸如ccta数据(例如,结合图2的步骤100如上所述地以类似方式获得)。输入1202也可包括从患者测量的额外生理数据1204,诸如患者的肱血压、心率和/或其它测量结果(例如,结合图2的步骤100如上所述地以类似方式获得)。额外生理数据1204可以非侵入性方式获得。输入1202可用以产生模型1210和/或进行下文所描述的生物力学分析1220。
如上文所述,一个或多个模型1210可基于输入1202产生。举例来说,方法1200可包括产生血液动力学模型1212,所述血液动力学模型包含遍布患者的解剖的三维几何模型的各种位置处的计算血流和血压信息。患者的解剖模型可使用医学成像数据1203来建立,并且,在一示例性实施方案中,血液动力学模型1212可为在进行计算机模拟(例如,如上文结合图3的步骤402所描述的)之后所产生的模拟血压模型、模拟血流模型或其它模拟。固体力学模型(包括流体结构相互作用模型)可用利用已知数值方法的计算分析来求解。斑块和血管的性质可模型化为线性或非线性的、各向同性或各向异性的。解可提供斑块和斑块与血管之间的界面的应力和应变。用于产生血液动力学模型1212的步骤可类似于上文所描述的图35的用于产生血液动力学模型932的步骤。
方法1200可包括通过计算由各种生理状态(诸如静止、变化水平的锻炼或劳力等)下的血液动力学力引起的作用于斑块腔面的压力和剪应力,使用血液动力学模型1212进行生物力学分析1220(步骤1222)。压力和剪应力可基于来自血液动力学模型1212的信息(例如,血压和血流量)计算。步骤1222可类似于上文所描述的图35的步骤942。
任选地,方法1200还可包括从四维成像数据(例如,例如,在心动周期的多个阶段(诸如心脏收缩和心脏舒张阶段)所获得的成像数据)产生用于量化血管变形的几何分析模型,方式类似于上文关于图35的几何分析模型934所描述的方式。方法1200还可包括通过计算由心脏诱发脉动压力引起的患者的颅内和颅外动脉以及斑块的各种变形特性(诸如纵向延长(伸长)或缩短、扭曲(扭转)、径向膨胀或压缩以及弯曲等),使用几何分析模型进行生物力学分析1220,方式类似于如上文关于图35的步骤944所描述的方式。
方法1200还可包括从医学成像数据1203产生用于确定斑块组成和性质的斑块模型1214。举例来说,斑块模型1214可包括关于斑块的密度和其它材料性质的信息。
方法1200还可包括产生用于计算关于斑块、血管壁和/或斑块与血管壁之间的界面的信息的血管壁模型1216。举例来说,血管壁模型1216可包括关于应力和应变的信息,应力和应变可基于包括于斑块模型1214中的斑块组成和性质以及在步骤1220中计算出的压力和剪应力而计算。任选地,应力和应变也可使用如上所述的计算出的变形特性来计算。用于产生斑块模型1214和/或血管壁模型1216的步骤可类似于上文所描述的图35的用于产生斑块模型936和/或血管壁模型938的步骤。
方法1200可包括通过计算斑块上的由血液动力学力和颈部移动诱发应变引起的应力(例如,急性或累积应力),使用血管壁模型1216进行生物力学分析1220(步骤1224)。举例来说,可计算作用于斑块的血流诱发力904(图33)。可基于来自血管壁模型1216的信息(例如,斑块上的应力和应变)来计算斑块上的由血液动力学力和颈部移动诱发应变引起的应力或力。步骤1224可类似于上文所描述的图35的步骤946。
方法1200可包括基于上文所描述的模型1210中的一个或多个模型和生理力学分析1220中的一次或多次生物力学分析确定另外信息。
可计算斑块破裂易损性指数(步骤1230)。斑块破裂易损性指数可(例如)基于血液动力学应力、应力频率、应力方向和/或斑块强度或其它性质来计算。举例来说,围绕感兴趣斑块的区域可与斑块的三维模型1210(诸如斑块模型1214)隔离。斑块的强度可以根据斑块模型1214中所提供的材料性质来确定。感兴趣的斑块上的由脉动压力、流动以及颈部运动引起的血液动力和组织应力可在模拟基线和运动(或劳力)条件下通过使用先前在步骤1224中计算的血液动力学应力和运动诱发应变而计算。斑块的易损性可基于斑块应力与斑块强度的比来评估。步骤1230可类似于上文所描述的图35的步骤950。举例来说,斑块破裂易损性指数可针对位于颅外动脉中的斑块进行计算以用于中风评估(strokeassessment)。
还可计算脑体积风险指数(cvri)(步骤1232)。cvri可定义为受动脉树中的给定位置处的斑块破裂或血管的栓塞和闭塞(闭合或阻塞)影响的总脑体积的百分比。cvri可基于由给定斑块下游的血管供应的脑的部分而计算,其可考虑相对于下游血管的大小的斑块的大小和斑块基于三维血液动力学解可能流到不同血管中的可能性。可在有病状态下或在干预之前或之后对cvri进行评估。步骤1232可类似于上文所描述的图35的步骤952。
脑组织可经模型化并在血液动力模拟中划分成由每一血管供应的片段(例如,如结合图40的步骤1110和1112所描述)。几何模型可经修改以将下一代分支包括于脑树中(例如,如结合图40的步骤1118所描述),并且脑组织可进一步分段(例如,如结合图40的步骤1120所描述)。可在所述子片段中建立额外分支,并且所述子片段可进一步分段成较小片段(例如,如结合图40的步骤1122所描述)。如先前所述,生理关系可用以关联血管的大小与所供应的比例量的脑组织。
可确定破裂斑块所循的可能路径。血液动力学解可用以确定斑块碎片或栓子可流到不同下游血管中的百分比机会。
可比较破裂斑块的大小与下游血管的大小以确定斑块最终可在何处形成流动的障碍。这个信息可与易损性指数组合以提供可能潜在地受破裂斑块影响的脑组织的体积的可能性图。cvri可指派给每一可能受影响片段。
还可计算脑灌注风险指数(cpri)(步骤1234)。cpri可定义为受动脉树中的给定位置处的斑块破裂和血管闭塞影响的总脑血流的百分比。cpri指示到脑组织片段的可能灌注损失,而非如cvri所指示的受影响的体积。举例来说,颈动脉斑块的破裂或栓塞的影响可视患者的大脑动脉环的几何形状(在图37中示出)而改变并且由于解剖上的这些差异而可产生不同的cvri和cpri值。可计算到脑组织的每一片段的灌注率,且可基于易损性指数、血液动力学解以及斑块和血管的大小来计算灌注损失。可在有病状态下或在干预之前或之后对cpri进行评估。步骤1234可类似于上文所描述的图35的步骤954。
结果,可评估由脉动压力、脉动血流和/或任选颈部运动产生的作用于颈动脉动脉粥样硬化斑块的生物机械力。可量化由脉动压力、脉动血流和/或任选颈部运动产生的斑块经历的总应力。解可考虑作用于斑块或作用于斑块与血管壁之间的界面的患者特定血液动力学应力的多个来源。而且,可基于医学成像数据来估计斑块强度,且可量化有关于斑块易损性、脑体积风险以及脑灌注风险的指数。
通过如下所述地确定颅外和颅内动脉的解剖和生理数据,可预测处于各种身体条件下的特定患者的动脉或器官层面的血流变化。此外,可提供其它信息,诸如短暂性脑缺血发作、缺血性中风或动脉瘤破裂的风险,作用于动脉粥样硬化斑块或动脉瘤的力,医疗介入或手术疗法对颅内或颅外血流、血压、壁应力或脑灌注的预测影响。可量化颅内或颅外动脉中的血流、血压以及壁应力,以及总体和区域性脑灌注,并且可确定疾病的功能意义。
除量化从成像数据构建的三维几何模型(例如,如上文在步骤1212中所描述)中的血流外,还可修改模型以模拟疾病的进展或消退或药物、经皮或手术干预的效果。在一示例性实施方案中,可通过随时间迭代解(例如,通过解出剪应力或粒子停留时间和基于血液动力学因素和/或患者特定生化测量结果而使几何模型适合于使动脉粥样硬化斑块发展前进)来模型化动脉粥样硬化的进展。此外,血流、心率、血压以及其它生理变量的变化对颅外和/或颅内动脉血流或脑灌注的影响可通过边界条件的变化来模型化并且用以计算这些变量随时间的累积影响。
任何实施方案中所阐述的任何方面可与本文中所阐述的任何其它实施方案一起使用。本文中所阐述的每一个装置和设备可在任何合适的医疗程序中使用,可在任何合适的身体管腔和体腔中前进,并且可用于成像任何合适的身体部分。
本领域技术人员将显而易见,各种修改和改变可在公开的系统和过程中作出,而不脱离本公开的范围。对本领域技术人员而言,其它实施方案将从考虑本文中所公开的说明书和公开的实践显而易见。希望说明书和实例被视为仅示例性的,而本公开的真正范围和精神是由以下权利要求书指示。
- 还没有人留言评论。精彩留言会获得点赞!