基于深度置信网络模型的糖尿病指标预测方法及其系统与流程
本发明属于智能监护设备
技术领域:
,尤其涉及基于深度置信网络模型的糖尿病指标预测方法及其系统。
背景技术:
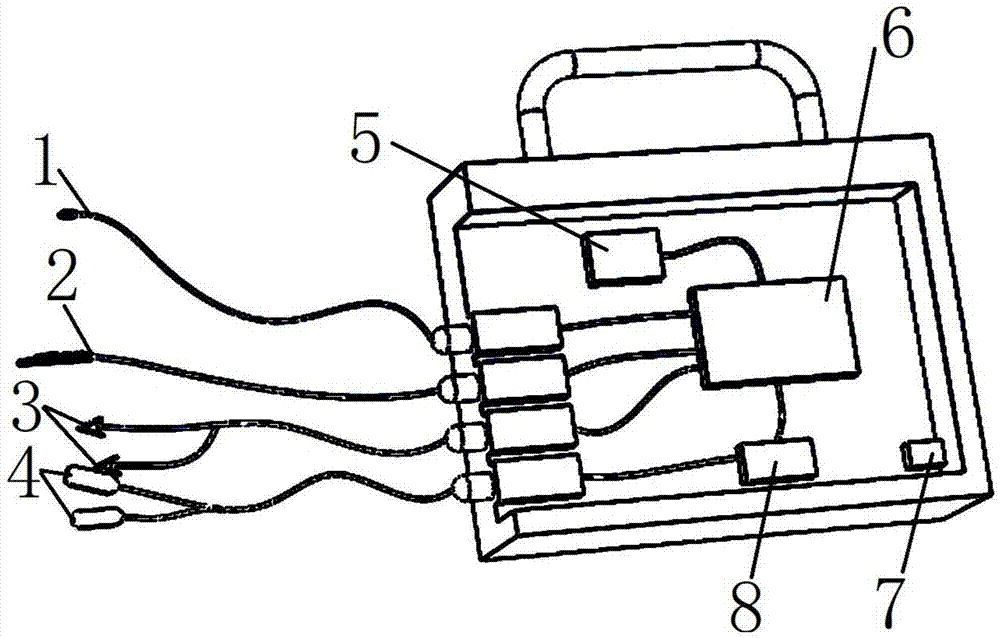
:糖尿病是仅次于癌症的高危慢性疾病,我国不行罹患糖尿病的人群已高达五千万,而且糖尿病的患病人群近年来呈现逐渐增长的态势,糖尿病及其并发症不仅对患者的生活质量造成影响,还给患者的家庭带来沉重的经济和心理负担,成为严重的公共卫生问题。血糖指标是诊断糖尿病的重要标准,通过检测空腹血糖和餐后2h血糖值可对受试者是否患糖尿病进行诊断。有明显“三多一少”症状者,只要一次异常血糖值即可诊断。无症状者诊断糖尿病需要两次异常血糖值。糖化血红蛋白(ghb)是红细胞中的血红蛋白与血清中的糖类相结合的产物。它是通过缓慢、持续及不可逆的糖化反应形成,其含量的多少取决于血糖浓度以及血糖与血红蛋白接触时间,而与抽血时间、患者是否空腹、是否使用胰岛素等因素无关。因此,ghb可有效地反映糖尿病患者过去1~2个月内血糖控制的情况。ghb由hba1a、hba1b、hba1c组成,其中hba1c约占70%,且结构稳定,因此被用作糖尿病控制的监测指标。总胆固醇是指血液中所有脂蛋白所含胆固醇之总和,总胆固醇偏高说明人体的肝和肺开始发生实质性的病变。人群总胆固醇水平主要取决于遗传因素和生活方式.总胆固醇包括游离胆固醇和胆固醇酯,肝脏是合成和贮存的主要器官。胆固醇是合成肾上腺皮质激素、性激素、胆汁酸及维生素d等生理活性物质的重要原料,也是构成细胞膜的主要成分,其血清浓度可作为脂代谢的指标。现有血糖检测设备以侵入式为主,需要将采血针刺入患者的皮肤或血管取血液样本,会给患者带来采血的不适和感染风险;此外,心率变异率(heartratevariability,hrv)是反映心脏自主神经调节功能状况的敏感、无创性客观指标,近10年来用hrv预测血糖、糖化血红蛋白指标有突破性进展,发现hrv与血糖存在着相关关系,糖尿病患者的hrv相比于正常人要高。但是hrv与血糖的相关性很差,r只有0.2~0.4左右,因此用hrv直接预测血糖的精度很差。而且很多研究表明,hrv还受到很多因素影响,例如年龄、性别、体质指数、环境因素、运动、温度、情绪等等,所以尽管在hrv与糖尿病相关的领域有突破,但是还无法到达应用层面。另外现在测量hrv还是使用12导量测量方法,虽然测量准确,但是对操作人员的专业素质要求高,而且需要专门的测量场所,无法进行大规模应用。因此,研发一款预测准确性高、使用方便、便携、基于hrv的非侵入式糖尿病血液指标检测设备是本领域技术人员亟需解决的技术问题。技术实现要素:有鉴于此,本发明公开了一基于深度置信网络模型的糖尿病指标预测方法及其系统,有效解决目前传统的侵入式糖尿病血液指标检测技术存在的给患者带来采血的不适以及目前糖尿病指标预测方法的准确性低的技术缺陷。本发明公开了一种基于深度置信网络模型的糖尿病指标预测方法,包括:采集预设机体的心电波在第一预设时间段内若干个第一时间点的心率信号数据、体温数据、皮肤电信号数据、皮肤水分数值数据、身体姿势信息数据的数据;对每一第一时间点的心电波的数据和该第一时间点的所述心率信号数据、体温数据、皮肤电信号数据、皮肤水分数值数据、身体姿势信息数据的数据进行相关性分析,将相关性系数大于预设值的所述心率信号数据、所述体温数据、所述皮肤电信号数据、所述皮肤水分数值数据、所述身体姿势信息数据的数据作为该第一时间点的糖尿病指标的关键因素;将每一第一时间点的所述心率信号数据、所述体温数据、所述皮肤电信号数据、所述皮肤水分数值数据、所述身体姿势信息数据的数据、该糖尿病指标的关键因素及该心电波的数据的采集数据形成该第一时间点的数据集,将各个第一时间点的数据集形成数据库;建立深度置信网络模型,将所述数据库中多个第一时间点的数据集输入所述深度置信网络模型,并对所述深度置信网络模型进行训练;利用训练完成的深度置信网络模型预测所述预设机体在第一预设时间段内第一时间点的血液粘度、血糖和糖化血红蛋白值的预测数据。具体的,采集预设机体的心电波在第一预设时间段内若干个第一时间点的心率信号数据、体温数据、皮肤电信号数据、皮肤水分数值数据、身体姿势信息数据的数据具体包括:对采集到的数据进行预处理,将心电波进行除噪,然后对心电波形进行分段,对每段心电波形及与该段心电波形同时检测到的机体运动状态、皮肤体温、皮肤电及皮肤湿度指标共同提取用于输入深度置信网络的初级特征;对心电波形分段后,对每段心电波形提取d维的特征,按维度对机体运动状态、皮肤体温、皮肤电及皮肤湿度特征进行均值为0,方差为1的标准化,得到最后用于输入深度置信网络的d维初级特征;给每个样本加标签,标签为检测到受试者的血液粘度、血糖和糖化血红蛋白值具体的,建立深度置信网络模型具体包括:将上述得到的初级特征输入深度置信网络,逐层无监督预训练深度置信网络,得到优化的深度置信网络模型,用于提取采集到受试者机体数据的抽象特征,具体步骤为:用于提取受试者机体采集数据抽象特征的深度置信网络由受限玻尔兹曼机堆叠而成,其中第一层为输入层。另一层为用于提取受试者机体采集数据抽象特征的深度置信网络的隐含层数。每个受限玻尔兹曼机都由一层可见层和一层隐含层构成,其中所述的可见层为每个受限玻尔兹曼机的输入层,第一个受限玻尔兹曼机的输入层为无标签的受试者机体采集数据的初级特征,受限玻尔兹曼机可见层节点数根据经验信息和测试结果人工调整对应层的单元数确定:受限玻尔兹曼机的隐含层为受限玻尔兹曼机的输出层,每个受限玻尔兹曼机的输出作为下个受限玻尔兹曼机的输入,每个受限玻尔兹曼机的隐含层节点数为下一个受限玻尔兹曼机的可见层节点数。对隐含层选取激活函数,通过对比散度算法和吉布斯采样对受限玻尔兹曼机的每一层进行多次迭代训练来更新模型参数,进而得到参数较优的深度置信网络模型,各参数更新的计算方式如下:δwij=ε(<vihj>data-<vihj>recom)δbi=ε(<vi>data-<vi>recom)δaj=ε(<hj>data-<hj>recom);其中δwij表示连接第i层和第j层的权值矩阵的更新量,δbi表示第i个可见层偏置的更新量,δaj表示第j个隐含层偏置的更新量,ε表示学习率,<·>data表示实际数据分布情况,<·>recon表示重构后模型分布情况。在上述预训练后的深度置信网络模型后加一层softmax回归,对整个网络进行反向微调,将深度置信网络最后一个隐含层输出的受试者机体采集数据的抽象特征输入至softmax回归层,输出的结果为每个受试者机体采集数据对应的血液粘度、血糖和糖化血红蛋白值标签,并将输出的预测血液粘度、血糖和糖化血红蛋白与实际的血液粘度、血糖和糖化血红蛋白值进行比较,得到所述指标的预测准确率。具体步骤为:在预训练后的深度置信网络的最后一个隐含层后增加一个softmax层作为输出层,计算每个受试者机体采集数据样本划分到某区段血液指标的概率,将受试者机体采集数据样本划分到对应概率最大的标签中,则该受试者预测的血液指标即为标签对应的实测血液指标。对于输入样本x,其划分到对应血液指标的概率公式为:则该输入对应的预测标签为概率最大值对应的标签,其公式为:ypred=argmaxmp(y=m|x,w,b)其中w表示softmax层的权值矩阵,b表示softmax层的偏置,y表示每个概率对应的标识标签,ypred表示最大概率对应的预测标签。对血液指标标签的数据,利用反向传播和梯度下降方法微调整个网络的参数,通过逐层最小化损失函数最小化重构误差,求得整个网络的最优参数,进而得到提取受试者机体采集数据抽象特征的最佳深度置信网络模型,并基于该模型测试每个受试者的预测血液粘度、血糖和糖化血红蛋白值,并与实测的血液粘度、血糖和糖化血红蛋白值进行比较,得到血液粘度、血糖和糖化血红蛋白的预测准确率。作为优选,所述深度置信网络模型包括一个输入层、一个输出层及设置在所述输入层和所述输出层之间的多个隐含层,各个隐含层和所述输入层中的任意两相邻层形成一个受限玻尔兹曼机,所述输出层与相邻的隐含层形成一个bp神经网络模块;每一层设置有预设数量的节点,且相邻层之间设置有连接权重矩阵。作为优选,所述对所述深度置信网络模型进行训练,包括:在所述深度置信网络模型的每一受限玻尔兹曼机中建立一训练目标函数,所述训练目标函数的变量为该受限玻尔兹曼机中每一节点的状态值、偏置值和该受限玻尔兹曼机中两层之间的连接权重矩阵,所述训练目标函数的训练目标是该受限玻尔兹曼机能量值最小;利用最大似然估计算法计算该受限玻尔兹曼机中的可选连接权重矩阵和每一节点的可选偏置值;利用对比散列度算法进行寻优计算,在所述可选连接权重矩阵和每一节点的可选偏置值中筛选出最优连接权重矩阵和每一节点的最优偏置值。作为优选,在所述利用训练完成的深度置信网络模型预测所述预设机体在第一预设时间段内第一时间点的血液粘度、血糖和糖化血红蛋白值的预测数据之前,还包括:利用反向传播算法计算所述深度置信网络模型中每一节点的偏置值的误差和每一连接权重矩阵的误差;利用得到的误差对所述深度置信网络模型每一节点的偏置值及每一连接权重矩阵进行修正。作为优选,采用下式确定所述输入层的节点数量:n1=m1×m2;其中,n1为输入层的节点数量,m1为第一时间点的个数,m2为每一第一时间点的第一时间点的糖尿病指标的关键因素的个数之和。作为优选,采用下式确定每一隐含层的节点数量:n2=n1+n3+a1;其中,n2为每一隐含层的节点数量,n1为所述输入层的节点数量,n3为所述输出层的节点数量,a1为大于等于0且小于等于10的整数。作为优选,所述输出层为softmax函数,所述softmax函数公式为:其中输出层数据公式为:ypred=argmaxmp(y=m|x,w,b)(2);其中w为softmax层的权值矩阵,b为softmax层的偏置,y为每个概率对应的标识标签,ypred表示最大概率对应的输出层数据。作为优选,采用下式确定所述输出层的节点数量:n3=m1×m4其中,n3为输出层的节点数量,m1为所述第一预设时间段内第一时间点的个数,m4为每一第一时间点的数据集中糖尿病指标的关键因素的二进制编码位数。作为优选,所述隐含层选取激活函数,通过对比散度算法和吉布斯采样对受限玻尔兹曼机的每一层进行多次迭代训练来更新所述深度置信网络模型的参数,进而得到参数较优的深度置信网络模型。本发明还公开了一种基于深度置信网络模型的糖尿病指标预测系统,包括:数据采集模块,用于采集预设机体的心电波在第一预设时间段内若干个第一时间点的心率信号数据、体温数据、皮肤电信号数据、皮肤水分数值数据、身体姿势信息数据的数据;相关性分析模块,用于对每一第一时间点的心电波的数据和该第一时间点的所述心率信号数据、体温数据、皮肤电信号数据、皮肤水分数值数据、身体姿势信息数据的数据进行相关性分析,将相关性系数大于预设值的所述心率信号数据、所述体温数据、所述皮肤电信号数据、所述皮肤水分数值数据、所述身体姿势信息数据的数据作为该第一时间点的糖尿病指标的关键因素;数据库形成模块,用于将每一第一时间点的所述心率信号数据、所述体温数据、所述皮肤电信号数据、所述皮肤水分数值数据、所述身体姿势信息数据的数据、该糖尿病指标的关键因素及该心电波的数据的采集数据形成该第一时间点的数据集,将各个第一时间点的数据集形成数据库;模型建立模块,用于建立深度置信网络模型,将所述数据库中多个第一时间点的数据集输入所述深度置信网络模型,并对所述深度置信网络模型进行训练;指标预测模块,用于利用训练完成的深度置信网络模型预测所述预设机体在第一预设时间段内第一时间点的血液粘度、血糖和糖化血红蛋白值的预测数据。从以上技术方案可以看出,本发明具有以下优点:本发明中,通过人体心脏的电位变化、心率信号数据、人体的体温数据、皮肤电信号数据、人体的皮肤水分数值数据、人体的身体姿势信息数据后,在进过微处理器中内置的预置程序计算得到血液粘度、血糖和糖化血红蛋白的预测值,最后将血液粘度、血糖和糖化血红蛋白的预测值显示在显示器上,从而实现全天候、实时地非侵入式地测量血液中的各种指标。本发明基于深度置信网络模型得到糖尿病血液指标标签的数据,利用反向传播和梯度下降方法微调整个网络的参数,通过逐层最小化损失函数最小化重构误差,求得整个网络的最优参数,进而得到提取受试者机体采集数据抽象特征的最佳深度置信网络模型,并基于该模型测试每个受试者的预测空腹血糖、糖化血红蛋白和总胆固醇值,并与实测的空腹血糖、糖化血红蛋白和总胆固醇值进行比较,得到空腹血糖、糖化血红蛋白和总胆固醇值的预测准确率。本发明能对使用者的血液指标进行实时评估监测,具有便携易用的特点,既可以进行床边诊断,也可作为家用监护设备使用,还具有易于推广的作用。且非侵入式的检测方法,既能让患者有更舒适的就医体验,也能让病人在家里就能对血液状况进行自我检测,更好地对疾病进行管理。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。图1示本发明提供的一种便携式血液检测装置的结构内剖图;图2示本发明提供的一种便携式血液检测装置;图3示本发明提供的一种便携式血液检测装置的电路图;图4示本发明提供的检测血糖值与实测血糖值的相关性;图5示本发明提供的便携式血液检测装置的检测血糖值与实测血糖值相关性分析,****表示本发明提供的便携式血液检测装置的检测血糖值与实测血糖值相关性显著,p<0.05;图6示本发明提供的便携式血液检测装置的检测血液粘度与实测血液粘度的关系,其中,血液粘度一天测3次,早上刚起床、中午饭后1h和晚饭前1h;图7示本发明提供的便携式血液检测装置的检测血液粘度值与实测血液粘度值相关性分析,****表示便携式血液检测装置的检测血液粘度值与实测血液粘度值相关性显著,p<0.05;图8示本发明提供的便携式血液检测装置的检测糖化血红蛋白与实测血糖化血红蛋白的关系;图9示本发明提供的便携式血液检测装置的检测糖化血红蛋白值与实测糖化血红蛋白值相关性分析,****表示便携式血液检测装置的检测糖化血红蛋白值与实测糖化血红蛋白值相关性显著,p<0.05;其中,附图标记,体温检测器1、皮肤水分检测器2、皮肤电阻检测器3、心电图检测仪4、重力加速度传感器5、微处理器6、电源7、心率检测器8、显示器9、按钮a。具体实施方式本发明公开了基于深度置信网络模型的糖尿病指标预测方法及其系统,有效解决目前传统的血液粘度方法无法对血液粘度进行全天候的实时监测,而且会给被检测者带来痛苦的技术缺陷。下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。本发明实施例提供了基于深度置信网络模型的糖尿病指标预测方法的具体实施方式,利用目前的手环(或者能检测所述心率信号数据、所述体温数据、所述皮肤电信号数据、所述皮肤水分数值数据、所述身体姿势信息数据和心电波数据的生理指标检测器)能检测hrv(sdnn、sdann、rmssd、pnn50)、心率、体温、皮肤湿度、皮肤电信号及机体运动状态的数据,并通过计算模块将上述数据输入及测得的数据计算得到血糖、糖化血红蛋白和总胆固醇指标的预测值。在华侨医院,从内分泌门诊随机选择100名确诊的糖尿病受试者,并从病人家属中招募了150名志愿者,共250人。其中男性52人,女性98人,受试者的年龄在30~70岁。使用生理指标检测器检测得到150名志愿者的心率、hrv、体温、皮肤湿度、皮肤电生理活动、运动状态、静息心率、心率波动和心率恢复速度等数据信息。使用现有的血糖和糖化血红蛋白检测方法对受试者的血糖和糖化血红蛋白的数值进行测量,使用的设备为博唐平血糖糖化检测仪,具体实施方法依据设备操作说明书,使用现有的血糖检测方法对受试者的总胆固醇进行测量,使用的设备为民康血脂检测仪,具体使用方法依据设备操作说明书,使用现有的测血液粘度的方法(毛细管粘度测量法)对受试者的血液粘度数值进行测量,使用的设备为科西德6000血流变仪,具体实施方法为采用绿头管对受试者进行空腹采血5ml,2h内使用赛科西德6000血流变仪进行检测。使用分别三天取血,测定空腹血糖浓度、总胆固醇含量、糖化血红蛋白,分别取平均值,结果如表1所述。表1预测模型搭建搭建深度置信学习模型,使用以上测得的数值,训练模型,并输出预测值。输入输出设定:此次选取上述实施例中250名志愿者作为数据,样品随机打乱后,其中200人的数据作为训练数据,50名志愿者的数据作为检验数据。根据现在的研究表明,研究样本数量达到100以上,糖尿病血液相关指标即具有普适性,能够反映普遍样品的特征。因为本模型中反映预测值(空腹血糖浓度、总胆固醇含量、糖化血红蛋白)趋势的特征值有空腹血糖浓度、总胆固醇含量、糖化血红蛋白的特征值,且具有三种不同状态(睡眠,空腹静息,运动状态),每种状态测量时间为1h,每隔1min计算测量值平均,即能收集60个数据点。选用前10分钟的信息数据预测第11分钟的趋势,所以本文预测模型的输入层共为(5×10)个输入,且按每分钟的时间顺序依次输入。输出层神经元种类有3种类型(空腹血糖浓度、总胆固醇含量、糖化血红蛋白);隐含层设定:分别设定三个深度置信网络模型来训练隐含层层数,第一个网络模型的隐含层层数被设置为3层,且隐含层的神经元个数依次被设定为150,100,60;第二个深度置信网络模型的隐含层层数被设置为4层,每层隐含层的神经元个数依次被设定为150,100,60,40;第三个深度置信网络模型的隐含层层数被设置为5层,每层的神经元个数依次被设定为150,100,60,40,20;深度置信网络模型参数设定:深度置信网络模型参数包含每层各个神经元之间的权重系数ω,可视层神经元的偏置向量ai、隐含层神经元的偏置向量bj。参数确定的过程先是将参数初始化、然后经过训练不断调整更新。本发明实施例的初始权重矩阵ω被设定为正态分布n(0,0.01)的随机数,设可视层神经元的偏置向量被取为ai、隐含层神经元的偏置向量被选取为bj,其中初始隐含层神经元的偏置向量b0=0,本发明实施例的深度置信网络模型的θ初始值为定值,取值为0.1,训练截止标志位学习效率θ<0.001。根据训练样本数据直接对连接权值ω、可视层和隐层偏置的进行训练更新调整,本实施例预先将训练样本数据分成依照按照每10个样本为1组的小样本数据集进行划分。参考文献《糖尿病心率变异性图谱学特点及其临床相关性的研究》,使用测量hrv方法,预测血糖的,将hrv预测值与实际值(抽血确定)做比较。预测误差=abs(预测值-实际值)/实际值。设定预测误差<=0.15为预测准确,以下是以往方法对50个检验数据输出的的预测准确率情况如下:空腹血糖以往方法模型预测准确率40.56%基于深度置信网络模型的糖尿病指标预测方法的精确度分析:将本发明预测的血糖、糖化血红蛋白及总胆固醇(本发明的预测值)与使用传统方法测得的血糖、糖化血红蛋白及总胆固醇的数值(抽血实际值)进行对比,对比结果如下:预测误差=abs(预测值-实际值)/实际值。设定预测误差<=0.15为预测准确,以下是训练后模型对50个检验输出的的预测准确率情况。模型隐含层数设定实例预测准确率对比表如下:其中,正常的血糖值正常人的空腹血糖值为3.89~6.1mmol/l;如大于6.1mmol/l而小于7.0mmol/l为空腹血糖受损;如两次空腹血糖大于等于7.0mmol/l考虑糖尿病;建议复查空腹血糖,糖耐量试验。如果随机血糖大于等于11.1mmol/l可确诊糖尿病。因此,从以上分析可以看出,本发明的预测方法比现有的预测方法准确性更高。本发明实施例还提供了一种便携式血液检测装置的具体实施方式,实施例2包括:心电图检测仪4、心率检测器8、体温检测器1、皮肤电阻检测器3、皮肤水分检测器2、重力加速度传感器5、微处理器6、显示器9和电源7;心电图检测仪4、心率检测器8、体温检测器1、皮肤电阻检测器3、皮肤水分检测器2、重力加速度传感器5、微处理器6和显示器9均与电源7连接;心电图检测仪4、心率检测器8、体温检测器1、皮肤电阻检测器3、皮肤水分检测器2和重力加速度传感器5均与微处理器6电性连接;微处理器6与显示器9电性连接。开始检测后,本发明的装置通过心电图检测仪4收集人体心电信号(p波数据、qrs波数据、t波数据、pr间期数据、qt间期数据、pr段数据和st段数据),并将收集的心电信号传输到微处理器6,微处理器6对心电信号进行分析量化;本发明的装置通过心率检测器8收集人体心率信号;通过体温检测器1收集人体的局部体温值;通过皮肤电阻检测器3收集人体皮肤电信号(皮肤电阻、皮肤电压、皮肤电位sp、皮肤电位水平spl、皮肤电位反应spr、皮肤电导水平scl、皮肤电导反应scr),通过皮肤水分检测器2收集人体皮肤水分数值,通过重力加速度传感器5检测人体的加速度从而获得人体的运动状态和身体姿势,并将上述检测结果传输微处理器6。微处理器6将心率、体温、皮肤电信号、皮肤水分、机体运动状态和身体姿势信息进行综合分析,并结合心电图检测仪4传输过来的心电信号分析结果,通过预置的计算公式计算得到血液粘度、血糖和糖化血红蛋白的检测值。通过本发明的便携设备测量上述指标,能全天候、实时地测量包括心电图在内的多个指标,并能根据独创性的数学模型将所测得的指标转换为血液相关指标。本发明实施例提供了一种便携式血液检测装置的具体实施方式,实施例2包括:心电图检测仪4、心率检测器8、体温检测器1、皮肤电阻检测器3、皮肤水分检测器2、重力加速度传感器5、微处理器6、显示器9和电源7;心电图检测仪4、心率检测器8、体温检测器1、皮肤电阻检测器3、皮肤水分检测器2、重力加速度传感器5、微处理器6和显示器9均与电源7连接;心电图检测仪4、心率检测器8、体温检测器1、皮肤电阻检测器3、皮肤水分检测器2和重力加速度传感器5均与微处理器6电性连接;微处理器6与显示器9电性连接。具体的,心电图检测仪4具体为导联线心电图检测仪,导联线心电图检测仪将检测得到的p波数据、qrs波数据、t波数据、pr间期数据、qt间期数据、pr段数据和st段数据发送到微处理器。具体的,心率检测器8具体为红外线心率检测器,通过红外线对心率进行检测。具体的,体温检测器1具体为液晶温度计。具体的,皮肤电阻检测器3具体获得人体的皮肤的电阻、皮肤的电压、皮肤的电位sp、皮肤的电位水平spl、皮肤的电位反应spr、皮肤的电导水平scl、皮肤的电导反应scr。具体的,皮肤水分检测器2具体获得人体皮肤含水量。具体的,重力加速度传感器5获得人体的加速度数据。具体的,微处理器6具体为中央微处理器cpu。具体的,显示器9具体为:阴极射线管显示器、等离子显示器或液晶显示器。具体的,电源7具体为外置电池。更具体的,电源7可以从家用插座供电,也可以使用电池供电。本发明实施例2通过传感器检测到的心电、心率、体温、皮肤电、皮肤水分、机体运动状态和身体姿势信号数据。测试完成后,可以通过按钮a查看检测的血液粘度、血糖和糖化血红蛋白值。研究表明,血液粘度与多个能通过体外无创方式检测到的指标有关,相关指标描述如下:心电图(ecg)是指心脏在每个心动周期中,由起搏点、心房、心室相继兴奋,伴随着生物电的变化,通过心电传感器从体表引出多种形式的电位变化的图形。前期研究发现,血液粘度与心脏心肌收缩能力是有关系的,血液粘度越高,机体供血需要的心肌收缩力就越大,就会导致心电变化。因此,血液粘度的变化可以通过心电表现出来,即可以通过检测心电来对血液粘度进行检测。除心电以外,前期研究发现,心率、体温、皮肤水分、皮肤电和机体运动状态也与血液粘度存在着关系。当机体处于不同的动静状态时,如静止、运动和睡眠,血流的速度是不一样的。因此,在血液粘度不变的情况下,心肌需要输出的舒张和收缩力会因机体所处状态的不同而有变化,心电电位和波形都会因此出现改变。因此,需要通过重力传感器测定机体的运动状态,来对测得的心电数据进行校正,才能得到更准确的血液粘度数值;机体处于不同的体温状态也会对血液粘度的状态产生影响,同样物质浓度的液体,在不同的温度下物质的粘度会有所变化。体温升高会增加血液的流动性,使粘度降低;反之,体温降低血液粘度会相对增加。因此,准确测量血液粘度需考虑进体温的因素;不同的血液粘度会对微循环产生影响,会反映在皮肤电指标上的变化,因此检测皮肤电指标能辅助对血液粘度进行判断。本发明提供了一种便携式血液检测装置的检测实施例,于华侨医院的内分泌门诊选取200名受试者,使用本装置进行检测,受试者采用本装置测量指标数据,得到受试者的血液粘度值、血糖值及糖化血红蛋白值,其中,图5、图7和图9的横坐标的分组是指通过随机森林树模型将患者的检测数据分为了5个组。检测结果如图4至图9所示,图4和图5的结果说明,本发明提供的实测血糖值与检测血糖值的相关性显著;图6和图7的结果说明,本发明提供的便携式血液检测装置的检测血液粘度值与实测血液粘度值相关性显著;图8和图9的结果说明,本发明提供的便携式血液检测装置的检测糖化血红蛋白值与实测糖化血红蛋白值相关性显著。本实施例中将本发明与传统的采血测血糖值、血液粘度和糖化血红蛋白的方法进行了比较,对比结果显示本发明测得的血糖值、血液粘度和糖化血红蛋白与传统方法相近,证明本发明测得的血糖值、血液粘度和糖化血红蛋白的准确度高。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1