用于治疗癌症的涉及针对密蛋白18.2之抗体的联合治疗的制作方法
本发明涉及用于治疗癌症的针对密蛋白18.2之抗体的联合治疗。
背景技术:
胃和食管(胃食管;ge)的癌症属于具有尚未被满足之最高医疗需求的恶性肿瘤。在世界范围内,胃癌是癌症死亡的第二主要原因。近几十年来,食管癌的发病率(incidence)有所上升,同时其组织学类型及原发肿瘤部位发生变化。在美国和西欧,现在食管的腺癌比鳞状细胞癌更普遍,其中大多数肿瘤位于食管远端。胃食管癌的五年总存活率为20%至25%,不论与大量副作用相关的已建立之标准治疗的积极性(aggressiveness)。
大部分患者出现局部晚期或转移疾病,并不得不经受一线化学治疗。治疗方案基于通常与第三化合物(例如,紫杉烷(taxane)或蒽环类药物(anthracyclines))组合的铂和氟嘧啶衍生物骨架(backbone)。然而,可预期之最好的中值无进展存活为5至7个月,而最好的中值总存活为9至11个月。
来自多种更新一代用于这些癌症的组合化学治疗方案的主要益处的缺乏刺激了对靶向药剂使用的研究。最近,曲妥珠单抗(trastuzumab)已经被批准用于her2/neu阳性胃食管癌。然而,由于仅~20%的患者表达该靶标并且适于进行该治疗,因此医疗需求仍然较高。
紧密连接分子密蛋白18剪接变体2(密蛋白18.2(cldn18.2))是紧密连接蛋白质之密蛋白家族中的一员。cldn18.2为27.8kda的跨膜蛋白质,其包含四个具有两个小的胞外环的跨膜结构域。
在正常组织中(除胃外),通过rt-pcr检测不到cldn18.2的表达。cldn18.2特异性抗体的免疫组织化学显示胃为唯一的阳性组织。
cldn18.2为只在短暂分化的胃上皮细胞上表达的高度选择性胃谱系抗原。cldn18.2保持在恶性转化的过程中,因此频繁在人胃癌细胞的表面上展示。此外,在食管、胰腺和肺腺癌中,以显著水平异位活化该泛肿瘤抗原(pan-tumoralantigen)。cldn18.2蛋白还位于胃癌腺癌的淋巴结转移瘤以及特别是卵巢中的远处转移瘤(distantmetastase)(所谓的克鲁肯伯格氏肿瘤(krukenbergtumor))中。
ganymedpharmaceuticalsag已开发出针对cldn18.2的igg1嵌合抗体imab362。imab362以高亲和力和特异性识别cldn18.2的第一胞外结构域(ecd1)。imab362不与任何其他密蛋白家族成员结合,包括紧密相关的密蛋白18剪接变体1(cldn18.1)。imab362表现出精确的肿瘤细胞特异性,并且组合了四种独立的高度有效的作用机制。靶标结合后,imab362通过adcc、cdc、诱导通过肿瘤细胞表面上的靶标交联诱导的凋亡以及直接抑制增殖来介导细胞杀伤。因此,imab362有效裂解cldn18.2阳性细胞,包括体外和体内的人胃癌细胞系。具有cldn18.2阳性癌细胞系的小鼠具有生存益处,并且当用imab362处理时,多至40%的小鼠表现出其肿瘤的退化。
已经在小鼠和食蟹猴(cynomolgusmonkey)中对imab362的毒性和pk/tk特性进行了彻底研究,包括确定剂量范围的研究、在食蟹猴中进行28天重复剂量毒性研究以及在小鼠中进行3个月重复剂量毒性研究。在小鼠(最长处理持续时间3个月,每周施用,最高剂量水平400mg/kg)和食蟹猴(每周多至5次施加多至100mg/kg)两者中,经静脉注射的重复剂量的imab362被良好耐受。未诱发全身或局部毒性的迹象。具体而言,在任何毒性研究中均未观察到胃毒性。imab362不诱导免疫激活和细胞因子释放。未记录到对雄性或雌性生殖器官的不良作用。imab362不与缺乏靶标的组织结合。小鼠中的生物分布研究表明缺乏胃毒性的原因最可能是在健康胃上皮中的管腔部位(luminalsite)的紧密连接区室化,这样似乎严重削弱了imab362表位的易接近性。一旦恶性转化,则该区室化消失,致使可通过imab362使表位有可药性(drugable)。
imab362用于早期临床测试中。i期临床研究已在人中进行。3名患者的5个剂量组(33mg/m2、100mg/m2、300mg/m2、600mg/m2、1000mg/m2)各自接受单次静脉内施用imab362,并观察28天。imab362被良好地耐受,在患者中未观察到相关的安全性后果。在一名患者中,在治疗后四周内,所测量的全部肿瘤标志物均显著下降。在正在进行的iia期临床研究中,重复给予imab362。
此处,我们示出这样的数据,其证明化学治疗剂可通过抗cldn18.2抗体(例如,imab362)来稳定或增加cldn18.2在癌细胞表面上的表达,从而导致cldn18.2增强的可药性。观察到抗cldn18.2抗体(例如,imab362)与特定的化学治疗方案,特别是用于治疗胃癌或治疗人实体癌的化学治疗方案的协同效应。用化学治疗预处理的人癌细胞对抗体诱导的靶特异性杀伤作用更敏感。在小鼠肿瘤模型中,用抗cldn18.2抗体加化学治疗控制肿瘤优于用抗cldn18.2抗体作为单一药剂控制肿瘤。
此外,本文所示的数据表明双膦酸/盐/酯(bisphosphonate)(例如,唑来膦酸(za)),特别是当与重组白细胞介素-2(il-2)联合施用时,还增强抗cldn18.2抗体(例如,imab362)的活性。潜在的机制是高细胞毒性免疫细胞群(γ9δ2t细胞)的活化和扩增。
技术实现要素:
本发明普遍地提供了一种联合治疗,其用于有效治疗和/或预防与表达cldn18.2之细胞相关的疾病,所述疾病包括癌症疾病,例如胃癌、食管癌、胰腺癌、肺癌(例如,非小细胞肺癌(nsclc))、卵巢癌、结肠癌、肝癌、头颈癌和胆囊癌及其转移,特别是胃癌转移(例如,克鲁肯伯格氏肿瘤、腹膜转移和淋巴结转移)。特别优选的癌症疾病为胃、食管、胰管、胆管、肺和卵巢的腺癌。
在一个方面,本发明提供了治疗或预防癌症疾病的方法,所述方法包括向患者施用能够结合cldn18.2的抗体与稳定或增加cldn18.2表达的药剂的组合。cldn18.2优选在癌细胞的细胞表面表达。稳定或增加cldn18.2表达的药剂可在施用能够结合cldn18.2的抗体之前、同时或之后施用,或其组合。
稳定或增加cldn18.2表达的药剂可为细胞毒剂和/或细胞抑制剂。在一个实施方案中,稳定或增加cldn18.2表达的药剂包含这样的药剂,其诱导细胞周期停滞或细胞累积在细胞周期中的一个或更多个时相中,优选在细胞周期除g1期之外的一个或更多个时相中。稳定或增加cldn18.2表达的药剂可包括选自以下的药剂:蒽环类药物、铂化合物、核苷类似物、紫杉烷类和喜树碱类似物或其前药及其组合。稳定或增加cldn18.2表达的药剂可包括选自表柔比星(epirubicin)、奥沙利铂(oxaliplatin)、顺铂(cisplatin)、5-氟尿嘧啶或其前药(例如,卡培他滨)、多西他赛(docetaxel)、伊立替康(irinotecan)及其组合的药剂。稳定或增加cldn18.2表达的药剂可包括奥沙利铂与5-氟尿嘧啶或其前药的组合、顺铂与5-氟尿嘧啶或其前药的组合、至少一种蒽环类药物与奥沙利铂的组合、至少一种蒽环类药物与顺铂的组合、至少一种蒽环类药物与5-氟尿嘧啶或其前药的组合、至少一种紫杉烷与奥沙利铂的组合、至少一种紫杉烷与顺铂的组合、至少一种紫杉烷与5-氟尿嘧啶或其前药的组合或者至少一种喜树碱类似物与5-氟尿嘧啶或其前药的组合。稳定或增加cldn18.2表达的药剂可为诱导免疫原性细胞死亡的药剂。诱导免疫原性细胞死亡的药剂可包括选自蒽环类药物、奥沙利铂及其组合的药剂。稳定或增加cldn18.2表达的药剂可包括表柔比星与奥沙利铂的组合。在一个实施方案中,本发明的方法包括施用至少一种蒽环类药物、至少一种铂化合物以及至少一种5-氟尿嘧啶和其前药。蒽环类药物可选自表柔比星、阿霉素、柔红霉素、伊达比星和戊柔比星。优选地,蒽环类药物为表柔比星。铂化合物可选自奥沙利铂和顺铂。核苷类似物可选自5-氟尿嘧啶和其前药。紫杉烷可选自多西他赛和紫杉醇。喜树碱类似物可选自伊立替康和拓扑替康。在一个实施方案中,本发明的方法包括施用(i)表柔比星、奥沙利铂和5-氟尿嘧啶,(ii)表柔比星、奥沙利铂和卡培他滨,(iii)表柔比星、顺铂和5-氟尿嘧啶,(iv)表柔比星、顺铂和卡培他滨,或(v)亚叶酸、奥沙利铂和5-氟尿嘧啶。
在一个实施方案中,本发明的方法还包括施用刺激γδt细胞的药剂。在一个实施方案中,γδt细胞为vγ9vδ2t细胞。在一个实施方案中,刺激γδt细胞的药剂为双膦酸/盐/酯,例如,含氮双膦酸/盐/酯(氨基双膦酸/盐/酯)。在一个实施方案中,刺激γδt细胞的药剂选自唑来膦酸、氯膦酸、伊班膦酸、帕米膦酸、利塞磷酸、米诺膦酸、奥帕膦酸、阿仑膦酸、英卡膦酸及其盐。在一个实施方案中,刺激γδt细胞的药剂与白细胞介素-2组合施用。
本发明的方法还可包括施用至少一种另外的化学治疗剂,所述治疗剂可为细胞毒剂。
能够结合cldn18.2的抗体可与活细胞表面上存在的cldn18.2的天然表位结合。在一个实施方案中,能够结合cldn18.2的抗体与cldn18.2的第一胞外环结合。在一个实施方案中,能够结合cldn18.2的抗体通过以下的一种或更多种来介导细胞杀伤:补体依赖性细胞毒性(cdc)介导的裂解、抗体依赖性细胞的细胞毒性(adcc)介导的裂解、诱导凋亡和抑制增殖。在一个实施方案中,能够结合cldn18.2的抗体为单克隆抗体、嵌合抗体或人源化抗体,或抗体的片段。在一个实施方案中,能够结合cldn18.2的抗体为选自以下的抗体:(i)由以如下登记号保藏的克隆产生的和/或能够从其获得的抗体:dsmacc2737、dsmacc2738、dsmacc2739、dsmacc2740、dsmacc2741、dsmacc2742、dsmacc2743、dsmacc2745、dsmacc2746、dsmacc2747、dsmacc2748、dsmacc2808、dsmacc2809或dsmacc2810,(ii)(i)中抗体的嵌合形式或人源化形式的抗体,(iii)具有(i)中抗体的特异性的抗体,以及(iv)包含(i)中抗体的抗原结合部分或抗原结合位点特别是可变区并且优选地为具有(i)中抗体的特异性的抗体。在一个实施方案中,抗体与治疗剂(例如毒素、放射性同位素、药物或细胞毒剂)相偶联。
在一个实施方案中,本发明的方法包括以多至1000mg/m2的剂量施用能够结合cldn18.2的抗体。在一个实施方案中,本发明的方法包括以300至600mg/m2的剂量重复施用能够结合cldn18.2的抗体。
在一个实施方案中,癌症呈cldn18.2阳性。在一个实施方案中,癌症疾病选自胃癌、食管癌、胰腺癌、肺癌、卵巢癌、结肠癌、肝癌、头颈癌、胆囊癌及其转移。癌症疾病可为克鲁肯伯格氏肿瘤、腹膜转移和/或淋巴结转移。在一个实施方案中,癌症为腺癌,特别是晚期腺癌。在一个实施方案中,癌症选自胃癌、食管(特别是下段食管)的癌症、食管-胃连接部(eso-gastricjunction)癌和胃食管癌。患者可为her2/neu阴性患者或具有her2/neu阳性状态但不适于进行曲妥珠单抗治疗的患者。
根据本发明,cldn18.2优选地具有根据seqidno:1的氨基酸序列。
在另一个方面,本发明提供了医药制备物,其包含能够结合cldn18.2的抗体和稳定或增加cldn18.2表达的药剂。本发明的医药制备物还可包含刺激γδt细胞的药剂。能够结合cldn18.2的抗体和稳定或增加cldn18.2表达的药剂以及任选地刺激γδt细胞的药剂可以以混合物或彼此分离的形式存在于医药制备物中。医药制备物可为药盒,所述药盒包含含有所述能够结合cldn18.2之抗体的第一容器和含有所述稳定或增加cldn18.2表达之药剂的容器,以及任选地含有所述刺激γδt细胞之药剂的容器。所述医药制备物还可包含将制备物用于治疗癌症(特别是用于本发明方法的制备物)的印刷说明书。医药制备物不同的实施方案,特别是稳定或增加cldn18.2表达的药剂和刺激γδt细胞之药剂的不同的实施方案如上文中对本发明的方法所描述的。
本发明还提供了本文所述的药剂,例如,用于本文所述方法中的能够结合cldn18.2的抗体,例如,用于与稳定或增加cldn18.2表达的药剂,以及任选地刺激γδt细胞的药剂组合施用。
本发明的另一些特征和优点将通过下文的详细描述和权利要求而明显。
附图说明
图1.化学治疗对胃癌细胞的作用。将katoiii细胞培养96个小时导致细胞周期停滞在g0/g1期且cldn18.2下调。导致细胞周期停滞在细胞周期的不同时相的细胞抑制化合物(s期(5-fu)或g2期(表柔比星))稳定cldn18.2表达。
图2.化学治疗对胃癌细胞的作用。a/b:化学治疗对胃癌细胞中cldn18.2的转录和蛋白质水平的作用,c:流式细胞术分析结合在经化学治疗剂处理的胃癌细胞上的胞外imab362。
图3.化学治疗对胃癌细胞的作用。导致细胞周期停滞在细胞周期的不同时相的细胞抑制化合物(s/g2期(伊立替康)或g2期(多西他赛))。
图4.经化学治疗剂预处理之后,imab362诱导的adcc介导的胃癌细胞杀伤。
图5.化学治疗对胃癌细胞的作用。a:与用培养基培养的靶细胞相比,经伊立替康、多西他赛或顺铂处理的细胞显示出较低水平的活细胞。b:与用培养基培养的细胞相比,经伊立替康、多西他赛或顺铂处理的细胞中cldn18.2的表达增加。c/d:用伊立替康、多西他赛或顺铂处理细胞增强了imab362诱导adcc的效力。
图6.化学治疗对imab362诱导的cdc的作用。
图7.化学治疗对效应细胞的作用。
图8.补充有za/il-2的培养物中pbmc的扩增。
图9.补充有za/il-2的pbmc培养物中vγ9vδ2t细胞的富集。
图10.补充有za和增加剂量的il-2的培养基中vγ9vδ2t细胞的富集。
图11.当与za脉冲的单核细胞和人癌细胞共孵育时vγ9vδ2t细胞的扩增和细胞毒性活性。
图12.在pbmc培养物中不同细胞类型的za-依赖性发育(development)。
图13.经za/il-2处理后,表面标志物在vγ9vδ2t细胞上的展示。
图14.具有imab362的vγ9vδ2t细胞对cldn18.2阳性nugc-4胃癌细胞的adcc活性。
图15.使用vγ9vδ2t细胞作为效应细胞的imab362的adcc。
图16.za对cldn18.2在靶细胞上表面定位的作用。
图17.化学治疗和za/il-2处理对效应细胞的作用。
图18.小鼠中缀合抗体的生物分布研究。
图19.hek293-cldn18.2肿瘤异种移植物的早期治疗。
图20.晚期hek293-cldn18.2肿瘤异种移植物的治疗。
图21.imab362对胃癌异种移植物的皮下肿瘤生长的作用。
图22.使用imab362的免疫治疗对nci-n87~cldn18.2胃癌异种移植物的作用。
图23.使用imab362和eof方案的联合治疗对nci-n87~cldn18.2异种移植物的作用。
图24.使用imab362和eof方案的联合治疗对nugc-4~cldn18.2异种移植物的作用。
图25.za/il-2诱导的vγ9vδ2t细胞对通过imab362控制nsg小鼠中肉眼可见肿瘤(macroscopictumor)的作用。
图26.使用imab362和eof方案的联合治疗对cls-103~cldn18.2同种异体移植肿瘤的作用。
具体实施方式
尽管下文将对本发明作详细描述,但应当理解的是本发明并不局限于本文中所描述的具体方法学、方案和试剂,因此这些可以变化。还应当理解的是本文中所使用的术语仅仅是为了描述一些具体的实施方案,并非意图限制本发明的范围,本发明的范围将仅由所附权利要求限定。除非另有限定,否则本文中使用的所有技术和科学术语的含义与本领域中普通技术人员通常理解的含义相同。
在下文中,将对本发明的要素进行描述。这些要素随具体的实施方案列出,然而,应当理解的是这些要素可以任意方式和任意数量组合以产生另外的实施方案。各种描述的实施例和优选实施方案不应解释为将本发明限制于仅明确描述的实施方案。本说明书应当被理解为支持且涵盖将明确描述的实施方案与任意数量的公开和/或优选要素组合的实施方案。此外,除非在上下文中另有指出,否则在本申请中所有描述的要素的任意排列和组合应被认为是由本申请的说明书所公开的。
优选地,如“amultilingualglossaryofbiotechnologicalterms:(iupacrecommendations)″,h.gw.leuenberger,b.nagel,和h.
除非另有指出,否则本发明的实践将采用化学、生物化学、细胞生物学、免疫学和重组dna技术中的常规方法,这些方法在本领域的文献中进行了解释(参见,例如,molecularcloning:alaboratorymanual,第2版,j.sambrook等编辑,coldspringharborlaboratorypress,coldspringharbor1989)。
除非上下文另有要求,否则在整个本说明书和所附权利要求中,词语“包括/包含”及其变化形式将被理解为意指包括/包含所述成员、整数(integer)或步骤或者成员、整数或步骤的组,但不排除任何其它的成员、整数或步骤或者成员、整数或步骤的组,尽管在一些实施方案中可能不包括这样其它的成员、整数或步骤或者成员、整数或步骤的组,即,主题在于包括所述成员、整数或步骤或者成员、整数或步骤的组。除非在本文中另有指出或明显地与上下文矛盾,否则在描述本发明的上下文中(特别是在权利要求的上下文中)使用的没有数量词修饰的名词应被解释为涵盖单数和复数两者。本文中引用的数值范围仅仅旨在用作分别指落入该范围的每个单独值的简写方法。除非在本文中另有指出,否则每个单独的值都被并入说明书,就像其在本文中被单独引用一样。除非在本文中另有指出或明显地与上下文矛盾,否则本文中描述的所有方法均可以以任何合适的顺序进行。除非另有要求,否则本文中提供的任何和所有实例,或示例性语言(例如,“例如”)的使用仅旨在更好地说明本发明,并非对本发明的范围设定限制。说明书中的语言不应被解释为表示对实施本发明必不可少的任何未要求保护的要素。
贯穿本说明书的正文,引用了几篇文献。本文中引用的每一篇文献(包括所有专利、专利申请、科学出版物、制造商说明书、说明等),无论上文中还是下文中,均通过引用以其整体并入本文。本文中没有任何内容应被解释为承认本发明由于先前的发明而无权早于该公开内容。
术语“cldn18”指密蛋白18,并且包括任意变体,包括密蛋白18剪接变体1(密蛋白18.1(cldn18.1))和密蛋白18剪接变体2(密蛋白18.2(cldn18.2))。
术语“cldn18.2”优选指人cldn18.2,并且特别指包含优选由根据序列表的seqidno:1的氨基酸序列或所述氨基酸序列的变体组成的蛋白质。
术语“cldn18.1”优选指人cldn18.1,并且特别指包含优选由根据序列表的seqidno:2的氨基酸序列或所述氨基酸序列的变体组成的蛋白质。
根据本发明,术语“变体”特别指突变体、剪接变体、构象、同种型、等位基因变体、种变体(speciesvariant)和种同源物(specieshomolog),特别是天然存在的那些。等位基因变体指基因的正常序列中发生了改变,其显著性通常不明显。对于给定的基因,全基因测序通常鉴定出多种等位基因变体。种同源物是与给定的核酸或氨基酸序列具有不同物种来源的核酸或氨基酸序列。术语“变体”应涵盖任何经翻译后修饰的变体和构象变体。
根据本发明,术语“cldn18.2阳性癌症”意指涉及表达cldn18.2之癌细胞的癌症,优选在所述癌细胞的表面上表达cldn18.2。
“细胞表面”根据其在本领域中的通常含义使用,并因此包括易于被蛋白质和其他分子结合的细胞外部。
如果cldn18.2位于细胞的表面并且易于被添加到所述细胞的cldn18.2特异性抗体结合,则cldn18.2在所述细胞表面上表达。
根据本发明,如果与胃细胞或胃组织中的表达相比,表达水平较低,则cldn18.2在所述细胞中基本不表达。优选地,表达水平为胃细胞或胃组织中的表达的低于10%,优选地低于5%、3%、2%、1%、0.5%、0.1%或0.05%,或甚至更低。优选地,如果表达水平超过非癌组织(除胃外)中表达水平不超过2倍,优选1.5倍,并且优选地不超过所述非癌组织中的表达水平,则cldn18.2在所述细胞中基本不表达。优选地,如果表达水平低于检测界限和/或如果表达水平太低以致于不能被添加至细胞的cldn18.2特异性抗体结合,则cldn18.2在所述细胞中基本上不表达。
根据本发明,如果表达水平超过非癌组织(除胃外)中表达水平优选2倍以上,优选10倍、100倍、1000倍或10000倍以上,则cldn18.2在细胞中表达。优选地,如果表达水平高于检测界限和/或如果表达水平足够高使得能够被添加至细胞的cldn18.2特异性抗体结合,则cldn18.2在所述细胞中表达。优选地,在细胞中表达的cldn18.2在所述细胞表面上表达或暴露。
根据本发明,术语“疾病”指任何病理状态,包括癌症,特别是本文中所描述的那些形式的癌症。任何本文中提及的癌症或癌症的特别形式还包括其癌症转移。在一个优选实施方案中,根据本申请,待治疗的疾病涉及表达cldn18.2的细胞。
根据本发明,“与表达cldn18.2之细胞相关的疾病”或类似表达意指cldn18.2在病态组织或器官的细胞中表达。在一个实施方案中,与健康组织或器官中的状况相比,病态的组织或器官中的cldn18.2表达增加。增加指增加至少10%,特别是至少20%、至少50%、至少100%、至少200%、至少500%、至少1000%、至少10000%,或甚至更多。在一个实施方案中,表达仅见于病态的组织,而健康组织中的表达被抑制。根据本发明,与表达cldn18.2之细胞相关的疾病包括癌症疾病。此外,根据本发明,癌症疾病优选地为其中癌细胞表达cldn18.2的那些。
如本文所用,“癌症疾病”或“癌症”包括具有如下特征的疾病:异常调节性细胞生长、增殖、分化、粘附和/或迁移。“癌细胞”意指其通过迅速、不受控制的细胞增殖生长并且能在起始新生长的刺激停止后继续生长的异常细胞。优选地,“癌症疾病”以表达cldn18.2的细胞为特征并且癌细胞表达cldn18.2。表达cldn18.2的细胞优选地为癌细胞,优选地为本文所述癌症的癌细胞。
“腺癌”为源自腺组织的癌症。该组织也是称为上皮组织的一大类组织的一部分。上皮组织包括皮肤、腺体以及内衬于身体的腔和器官的多种其他组织。在胚胎学上,上皮来自外胚层、内胚层和中胚层。被归类为腺癌的细胞并不一定必须是腺体的一部分,只要它们具有分泌特性即可。该形式的癌症可发生在一些包括人在内的高等哺乳动物中。高度分化的腺癌趋向于与其所来源的腺组织类似,而低分化的腺癌则可能不是这样。通过染色来自活检的细胞,病理学家将确定肿瘤是腺癌还是一些其他类型的癌症。由于腺体在体内普遍存在的性质,腺癌可在身体的许多组织中发生。尽管每种腺体可以不分泌相同的物质,但只要细胞具有外分泌功能,它就可被认为是腺性的,并且它的恶性形式因而被命名为腺癌。只要有充足的时间,恶性腺癌就侵袭其它组织并且常常转移。卵巢腺癌是最常见的卵巢癌类型。其包括浆液和粘液腺癌、透明细胞腺癌和子宫内膜样腺癌。
“转移”是指癌细胞从其初始部位扩散至身体的其它部位。转移的形成是非常复杂的过程,并依赖于恶性细胞从原发肿瘤脱离,侵袭胞外基质,穿透内皮基底膜进入体腔和血管,并随后在被血液运输后,浸润靶器官。最后,新肿瘤在靶部位的生长依赖于血管发生。由于肿瘤细胞或组分可残留并发展出转移潜力,因此即使在去除原发肿瘤后仍经常发生肿瘤转移。在一个实施方案中,根据本发明的术语“转移”指“远处转移”,其指远离原发肿瘤和局部淋巴结系统的转移。在一个实施方案中,根据本发明的术语“转移”指淋巴结转移。使用本发明的治疗可治疗的转移中的一个特定形式为源自胃癌(作为原发部位)的转移。在一些优选实施方案中,这样的胃癌转移为克鲁肯伯格氏肿瘤、腹膜转移和/或淋巴结转移。
克鲁肯伯格氏肿瘤为一种不常见的卵巢转移性肿瘤,占全部卵巢肿瘤的1%至2%。克鲁肯伯格氏肿瘤的预后仍然很差,并且未建立起用于克鲁肯伯格氏肿瘤的治疗。克鲁肯伯格氏肿瘤为卵巢转移性指环状细胞(signetringcell)腺癌。在大多数克鲁肯伯格氏肿瘤病例(70%)中,胃为原发部位。结肠、阑尾和乳房(主要为侵入性小叶癌)的癌是第二最常见的原发部位。已报道极少数的克鲁肯伯格氏肿瘤病例源自胆囊、胆管、胰腺、小肠、法特壶腹(ampullaofvater)、子宫颈和膀胱/脐尿管的癌。在诊断原发性癌和随后发现卵巢参与之间的间隔通常为6个月或更短,但已报道过更长的时期。在很多病例中,原发肿瘤非常小并且可避开检测。在仅20%至30%的病例中可得到胃或其它器官先前的癌病史。
克鲁肯伯格氏肿瘤为胃-卵巢轴中最普遍的癌症选择性扩散的一个实例。该肿瘤扩散轴在历史上引起了许多病理学家的注意,特别是当发现胃瘤可在不涉及其它组织的情况下选择性地转移至卵巢。长期以来,胃癌转移至卵巢的途径一直是个谜,但现在明显的是逆行淋巴扩散是最可能的转移途径。
对患有转移癌的患者来说,患有克鲁肯伯格氏肿瘤的女性不通常趋于为年轻人,因为她们一般处于她们生命的第五个十年,平均年龄为45岁。该年轻年龄分布可能部分与年轻女性中胃指环状细胞癌频率升高有关。出现的常见症状通常涉及卵巢参与,其中最常见的症状为腹部疼痛和膨胀(主要是由于通常两侧的和常常大的卵巢质量)。其余患者具有非特异性胃肠症状或无症状。此外,据报道,克鲁肯伯格氏肿瘤与由卵巢基质产生激素导致的男性化有关。腹水存在于50%的病例中并且通常显示恶性细胞。
在超过80%的已报道病例中,克鲁肯伯格氏肿瘤是两侧的。卵巢通常不对称地扩大,并具有有圆凸的轮廓。切面为黄色或白色;它们通常为实心的,但偶为囊状的。重要的是,具有克鲁肯伯格氏肿瘤的卵巢的囊状表面通常为光滑的并且无粘附或腹膜沉积物。注意到,其它至卵巢的转移肿瘤倾向与表面移植有关。这可能解释了为什么克鲁肯伯格氏肿瘤的总体形态可欺骗性地看起来好像原发卵巢肿瘤。然而,克鲁肯伯格氏肿瘤的两侧对称与其转移性质一致。
患有克鲁肯伯格氏肿瘤的患者具有显著高的总死亡率。大多数的患者在2年内死亡(中值存活为14个月)。几项研究表明当原发肿瘤在发现转移至卵巢之后被鉴定时,预后差,且如果原发肿瘤保持隐藏,预后变得更差。
文献中尚未明确建立针对克鲁肯伯格氏肿瘤的最佳治疗策略。还未充分解决是否应进行手术切除。化学治疗或放射治疗对患有克鲁肯伯格氏肿瘤的患者的预后无显著作用。
“治疗”意指向对象施用化合物或组合物或者化合物或组合物的组合以预防或消除疾病,包括减小对象中的肿瘤大小或肿瘤数目、停滞或减缓对象中的疾病、抑制或减缓对象中新疾病的发展、降低目前患有或以前曾患有疾病的对象中症状和/或复发的频率或严重程度,和/或延长,即增加对象的寿命。
特别地,术语“疾病的治疗”包括疾病或其症状的治愈、缩短持续时间、减轻、预防、减缓或抑制发展或恶化,或者预防或延迟发生。
根据本发明,术语“患者”意指治疗对象,特别是患病的对象,包括人类、非人灵长类或其它动物,特别是哺乳动物,例如,牛、马、猪、绵羊、山羊、狗、猫或啮齿目动物(例如,小鼠和大鼠)。在一个特别优选实施方案中,患者为人类。
术语“稳定或增加cldn18.2表达的药剂”指药剂或药剂组合,其中,与不向细胞提供药剂或药剂组合的情况相比,向细胞提供所述药剂或药剂组合导致cldn18.2的rna和/或蛋白质水平提高,优选地导致细胞表面的cldn18.2蛋白质水平提高。优选地,细胞为癌细胞,特别是表达cldn18.2的癌细胞,例如,本文所述癌症类型的细胞。术语“稳定或增加cldn18.2表达的药剂”特别指药剂或药剂组合,其中,与不向细胞提供药剂或药剂组合的情况相比,向细胞提供所述药剂或药剂组合导致所述细胞表面上具有更高密度的cldn18.2。“稳定cldn18.2的表达”包括,特别是,药剂或药剂组合防止cldn18.2表达降低或减小cldn18.2表达降低的情况,例如,在不提供药剂或药剂组合的情况下,cldn18.2的表达将降低,并且提供药剂或药剂组合防止cldn18.2表达的所述降低或减小cldn18.2表达的所述降低。“增加cldn18.2的表达”包括,特别是,药剂或药剂组合增加cldn18.2表达的情况,例如,在不提供药剂或药剂组合的情况下,cldn18.2的表达将降低、基本保持不变或增加,而与不提供药剂或药剂组合的情况相比,提供药剂或药剂组合增加cldn18.2的表达,使得与在不提供药剂或药剂组合下,cldn18.2的表达将降低、基本保持不变或增加的情况相比,得到的表达更高。
根据本发明,术语“稳定或增加cldn18.2表达的药剂”包括化学治疗剂或化学治疗剂(例如,细胞抑制剂)的组合。化学治疗剂可以以下列方式中的一种来影响细胞:(1)损伤细胞dna使其再不能复制,(2)抑制新dna链的合成,使得不能进行细胞复制,(3)阻止细胞的有丝分裂过程,使得细胞不能分裂成两个细胞。
根据本发明,术语“稳定或增加cldn18.2表达的药剂”优选指药剂或药剂的组合(例如,细胞抑制化合物或细胞抑制化合物的组合),向细胞(特别是癌细胞)提供所述药剂或药剂组合导致细胞停滞或累积在细胞周期的一个或更多个时相中,优选细胞周期中除gl期和g0期之外,优选在除g1期之外的一个或更多个时相中,优选在细胞周期g2期或s期中的一个或更多个中(例如,细胞周期中的g1/g2期、s/g2期、g2期或s期)。术语“细胞停滞或累积在细胞周期的一个或更多个时相中”意指处于所述细胞周期的一个或更多个时相中的细胞的百分数增加。每个细胞经历包含四个时相的周期以自我复制。称为g1的第一时相为细胞准备复制其染色体时。第二时相称为s,在此时相发生dna合成且dna进行复制。下一时相为g2期,此时rna和蛋白质复制。最后时相为m期,其为实际细胞分裂的时相。在此最后时相中,已复制的dna和rna分开(split)并且向细胞分开的端部移动,细胞实际上分裂为两个相同的功能性细胞。化学治疗剂,即dna损伤剂,通常导致细胞在g1期和/或g2期累积。通过干扰dna合成来阻断细胞生长的化学治疗剂(例如,抗代谢物)通常导致细胞在s期的累积。这些药物的实例为6-巯基嘌呤和5-氟尿嘧啶。
根据本发明,术语“稳定或增加cldn18.2表达的药剂”包括蒽环类药物,例如表柔比星、铂化合物(例如,奥沙利铂和顺铂)、核苷类似物(例如,5-氟尿嘧啶或其前药)、紫杉烷类(例如,多西他赛)和喜树碱类似物(例如,伊立替康和拓扑替康)以及药物的组合,例如,包含一种或更多种蒽环类药物(例如,表柔比星)、奥沙利铂和5-氟尿嘧啶的组合,例如,包含奥沙利铂和5-氟尿嘧啶的药物组合或本文所述的其它药物组合。
在一个优选实施方案中,“稳定或增加cldn18.2表达的药剂”为“诱导免疫原性细胞死亡的药剂”。
在特定情况下,癌细胞可进入与时空限定的信号组合之发出相关联的致死应激途径(lethalstresspathway),所述途径可通过免疫系统解码以激活肿瘤特异性免疫应答(zitvogell.等.(2010)ceu140:798-804)。在这种情况下,癌细胞被触发以发出信号,该信号可被先天免疫效应细胞(例如,树突细胞)感知从而触发与cd8+t细胞和ifn-γ信号传导相关的同源免疫应答,使得肿瘤细胞死亡可引发有效的(productive)抗癌免疫应答。这些信号包括凋亡前内质网(er)伴侣钙网蛋白(crt)暴露在细胞表面、凋亡前atp的分泌和凋亡后核蛋白hmgb1的释放。总之,这些过程构成了免疫原性细胞死亡(icd)的分子决定因素。蒽环类药物、奥沙利铂和γ辐射能够诱导所有限定icd的信号,而例如顺铂,不能诱导crt从er向死亡细胞表面转位(需要er应激的过程)需要通过毒胡萝卜素(一种er应激诱导物)互补。
根据本发明,术语“诱导免疫原性细胞死亡的药剂”指这样的药剂或药剂组合,当向细胞(特别是癌细胞)提供所述药剂或药剂组合时,其能够诱导细胞进入最后导致肿瘤特异性免疫应答的致死应激途径。特别地,当向细胞提供诱导免疫原性细胞死亡的药剂时,其诱导细胞发出时空限定的信号组合,包括,特别是,凋亡前内质网(er)伴侣钙网蛋白(crt)暴露在细胞表面、凋亡前atp的分泌和凋亡后核蛋白hmgb1的释放。
根据本发明,术语“诱导免疫原性细胞死亡的药剂”包括蒽环类药物和奥沙利铂。
蒽环类药物是一类通常用于癌症化学治疗中的药物,其也为抗生素。在结构上,所有的蒽环类药物共有四环7,8,9,10-四氢并四苯-5,12-醌结构并且通常需要在特异位点进行糖基化。
蒽环类药物优选进行下列作用机制中的一种或更多种:1.通过插入dna/rna链的碱基对之间来抑制dna和rna的合成,从而防止迅速生长的癌细胞的复制;2.抑制拓扑异构酶ii,防止超螺旋dna松弛并由此阻断dna转录和复制;3.产生铁介导的损伤dna和细胞膜的游离氧自由基。
根据本发明,术语“蒽环类药物”优选指优选通过抑制dna与拓扑异构酶ii再结合来诱导凋亡的药剂,优选抗癌药剂。
优选地,根据本发明,术语“蒽环类药物”一般指具有以下环结构的一类化合物,
包括类似物和衍生物、药用盐、水合物、酯、缀合物及其前药。
蒽环类药物和蒽环类药物类似物的实例包括,但并不局限于,柔红霉素(道诺霉素)、阿霉素(亚德里亚霉素)、表柔比星、伊达比星、紫红霉素、吡拉柔比星(pyrarubicin)、戊柔比星、n-三氟-乙酰基阿霉素-14-戊酸酯、阿克拉霉素、吗啉代阿霉素(吗啉代-dox)、氰基吗啉代-阿霉素(氰基吗啉代-dox)、2-吡咯啉-阿霉素(2-pdox)、5-亚氨基道诺霉素、米托蒽醌和阿克拉霉素a(阿克拉比星)。米托蒽醌是anthracendione类化合物中的一员,其为缺乏蒽环类药物中的糖部分但保留允许插入dna中的二维多环芳香环结构的蒽环类药物类似物。
根据本发明,特别优选的蒽环类药物为下式的化合物:
其中,r1选自h和oh,r2选自h和ome,r3选自h和oh,并且r4选自h和oh。
在一个实施方案中,r1为h,r2为ome,r3为h,并且r4为oh。在另一个实施方案中,r1为oh,r2为ome,r3为h,并且r4为oh。在另一个实施方案中,r1为oh,r2为ome,r3为oh,并且r4为h。在另一个实施方案中,r1为h,r2为h,r3为h,并且r4为oh。
在本发明的上下文中,特别构想的蒽环类药物为表柔比星。表柔比星为具有下式的蒽环类药物:
并且以商品名ellence(美国)、表阿霉素或表柔比星ebewe(其它地方)市售。特别地,术语“表柔比星”指化合物(8r,10s)-10-[(2s,4s,5r,6s)-4-氨基-5-羟基-6-甲基-
根据本发明,术语“铂化合物”指其结构中包含铂的化合物,例如铂络合物,并且包括例如顺铂、卡铂和奥沙利铂的化合物。
术语“顺铂”指下式的化合物顺-二氨二氯铂(ii)(cddp):
术语“卡铂”指下式的化合物顺-二氨(1,1-环丁烷二羧酸)铂(ii):
术语“奥沙利铂”指这样的化合物,其为与下式的二氨基环己烷载体配体络合的铂化合物:
具体地,术语“奥沙利铂”指化合物[(1r,2r)-环己烷-1,2-二胺](乙二酸络(ethanedioato)-o,o′)铂(ii)。注射用奥沙利铂还以商品名eloxatine市售。
术语“核苷类似物”指核苷的结构类似物,其类别包括嘌呤类似物和嘧啶类似物二者。特别地,术语“核苷类似物”指包括氟尿嘧啶及其前药的氟嘧啶衍生物。
术语“氟尿嘧啶”或“5-氟尿嘧啶”(5-fu或f5u)(以商标名adrucil、carac、efudix、efudex和fluoroplex出售)为下式的嘧啶类似物的化合物:
具体地,该术语指化合物5-氟-1h-嘧啶-2,4-二酮。
术语“卡培他滨”(xeloda,roche)指化学治疗剂,其为在组织中转化为5-fu的前药。可经口施用的卡培他滨具有下式:
具体地,该术语指化合物[1-(3,4-二羟基-5-甲基四氢呋喃-2-基)-5-氟-2氧代-1h-嘧啶-4-基]氨基甲酸戊酯。
紫杉烷类为一类二萜化合物,其最早来源于天然来源,例如红豆衫(taxus)属植物,但一些已经人工合成。紫杉烷类药物的主要作用机制为破坏微管功能,从而抑制细胞分裂过程。紫杉烷类包括多西他赛(taxotere)和紫杉醇(tax0l)。
根据本发明,术语“多西他赛”指具有下式的化合物:
根据本发明,术语“紫杉醇”指具有下式的化合物:
根据本发明,术语“喜树碱类似物”指化合物喜树碱(cpt;(s)-4-乙基-4-羟基-1h-吡喃并[3′,4′:6,7]中氮茚并[1,2-b]喹啉-3,14-(4h,12h)-二酮)的衍生物。优选地,术语“喜树碱类似物”指包含下面结构的化合物:
根据本发明,优选的喜树碱类似物为dna酶拓扑异构酶i(拓扑i)的抑制剂。根据本发明,优选的喜树碱类似物为伊立替康和拓扑替康。
伊立替康为通过抑制拓扑异构酶i来防止dna展开的药物。从化学角度,其为具有下式的天然生物碱喜树碱的半合成类似物:
具体地,术语“伊立替康”指化合物(s)-4,11-二乙基-3,4,12,14-四氢-4-羟基-3,14-二氧代1h-吡喃并[3′,4′:6,7]-中氮茚并[1,2-b]喹啉-9-基-[1,4′联哌啶]-1′-羧酸酯。
拓扑替康为下式的拓扑异构酶抑制剂:
具体地,术语“拓扑替康”指化合物(s)-10-[(二甲基氨基)甲基]-4-乙基-4,9-二羟基-1h-吡喃并[3′,4′:6,7]中氮茚并[1,2-b]喹啉-3,14(4h,12h)-二酮单盐酸盐。
根据本发明,稳定或增加cldn18.2表达的药剂可为化学治疗剂,特别是在癌症治疗中确定的化学治疗剂,并且可为药物组合的一部分,例如,用于治疗癌症的确定的药物组合。该药物组合可为化学治疗中使用的药物组合,并且可为用于化学治疗方案中的药物组合,所述化学治疗方案选自eox化学治疗、ecf化学治疗、ecx化学治疗、eof化学治疗、flo化学治疗、folfox化学治疗、folfiri化学治疗、dcf化学治疗和flot化学治疗。
eox化学治疗中使用的药物组合包含表柔比星、奥沙利铂和卡培他滨。ecf化学治疗中使用的药物组合包含表柔比星、顺铂和5-氟尿嘧啶。ecx化学治疗中使用的药物组合包含表柔比星、顺铂和卡培他滨。eof化学治疗中使用的药物组合包含表柔比星、奥沙利铂和5-氟尿嘧啶。
表柔比星通常以50mg/m2的剂量给予,顺铂为60mg/m2,奥沙利铂为130mg/m2,以200mg/m2/天延长静脉输注5-氟尿嘧啶并且每日两次口服卡培他滨625mg/m2,持续总共八个3周周期。
flo化学治疗中使用的药物组合包含5-氟尿嘧啶、亚叶酸和奥沙利铂(通常以2,600mg/m224小时输注5-氟尿嘧啶,亚叶酸为200mg/m2且奥沙利铂为85mg/m2,每两周)。
folfox为由亚叶酸(甲酰四氢叶酸(leucovorin))、5-氟尿嘧啶和奥沙利铂构成的化学治疗方案。以每两周给予的建议剂量方案如下:第1天:以85mg/m2静脉内输注奥沙利铂和以200mg/m2静脉内输注甲酰四氢叶酸,然后以400mg/m2静脉内推注(bolus)5-fu,然后以600mg/m222小时持续静脉内输注5-fu;第2天:以200mg/m2静脉内输注甲酰四氢叶酸120分钟,然后以400mg/m2静脉内推注给予5-fu2至4分钟,然后以600mg/m222小时持续静脉内输注5-fu。
folfiri化学治疗中使用的药物组合包含5-氟尿嘧啶、甲酰四氢叶酸和伊立替康。
dcf化学治疗中使用的药物组合包含多西他赛、顺铂和5-氟尿嘧啶。
flot化学治疗中使用的药物组合包含多西他赛、奥沙利铂、5-氟尿嘧啶和亚叶酸。
术语“亚叶酸”或“甲酰四氢叶酸”指用于与化学治疗剂5-氟尿嘧啶协同组合的化合物。亚叶酸具有下式:
具体地,该术语指化合物(2s)-2-{[4-[(2-氨基-5-甲酰基-4-氧代-5,6,7,8-四氢-1h-蝶啶-6-基)甲基氨基]苯甲酰基]氨基}戊二酸。
γδt细胞(伽马德耳塔t细胞)代表一小亚类在其表面上具有不同t细胞受体(tcr)的t细胞。大多数t细胞具有由两个称为α-和β-tcr链的糖蛋白链构成的tcr。相比之下,在γδt细胞中,tcr是由一个γ链和一个δ链构成的。与αβt细胞相比,这组t细胞通常不常见。人γδt细胞在应激-监督应答(stress-surveillancereponse)(例如,感染性疾病和自身免疫)中起重要作用。还提出肿瘤中转化诱导的变化导致由γδt细胞介导的应激-监督应答并增强抗肿瘤免疫。重要的是,在抗原接合之后,在病变部位活化的γδt细胞提供介导其它效应细胞募集的细胞因子(例如,infγ、tnfα)和/或趋化因子,并且表现出立即的效应功能例如细胞毒性(通过死亡受体和溶细胞颗粒途径)和adcc。
在外周血中,大多数γδt细胞表达vγ9vδ2t细胞受体(tcrγδ)。vγ9vδ2t细胞是人类和灵长类动物特有的,并且由于vγ9vδ2t细胞在很多急性感染中显著扩增并且可在几日内超过诸如以下病中的所有其他淋巴细胞,例如,结核病、沙门菌病、埃里希菌病、布氏菌病、土拉菌病、利斯特菌病、弓形体病和疟疾,因此被认为在通过侵入病原体感知“危险”中起着早期和必要作用。
γδt细胞对小的非肽磷酸化抗原(磷酸抗原)产生应答,例如,细菌中合成的焦磷酸盐和哺乳动物细胞中通过甲羟戊酸途径产生的异戊烯基焦磷酸(ipp)。尽管正常细胞中的ipp产生不足以活化γδt细胞,肿瘤细胞中甲羟戊酸途径的调节异常导致ipp的累积和γδt细胞活化。ipp还可通过氨基双膦酸/盐/酯在治疗上增加,这抑制甲羟戊酸途径酶法呢焦磷酸合酶(fpps)。其中,唑来膦酸(zoledronicacid)(za,唑来膦酸盐/酯,zometatm,novartis)是这种氨基双膦酸/盐/酯的代表,其已向患者临床施用来治疗骨质疏松症和转移性骨疾病。当体外治疗pbmc时,za特别由单核细胞摄取。ipp在单核细胞中累积并且它们分化成刺激γδt细胞发育的抗原呈递细胞。在这种情况下,优选添加白细胞介素-2(il-2)作为活化的γδt细胞的生长和存活因子。最后,已经描述了一些体外活化vγ9vδ2t细胞的烷基化胺,不过仅以毫摩尔的浓度。
根据本发明,术语“刺激γδt细胞的药剂”指在体外和/或体内,特别是通过诱导γδt细胞的活化和扩增来刺激γδt细胞,特别是vγ9vδ2t细胞发育的化合物。优选地,该术语指在体外和/或体内,优选通过抑制甲羟戊酸途径酶法呢焦磷酸合酶(fpps)来增加哺乳动物细胞中产生的异戊烯基焦磷酸(ipp)的化合物。
刺激γδt细胞的一组特定的化合物为双膦酸/盐/酯,特别是含氮双膦酸/盐/酯(n-双膦酸/盐/酯;氨基双膦酸/盐/酯)。
例如,适用于本发明中的双膦酸/盐/酯可包括下列化合物中的一种或更多种,所述化合物包括类似物和衍生物、药用盐、水合物、酯、缀合物及其前药:
[1-羟基-2-(1h-咪唑-1-基)乙烷-1,1--二基]双(膦酸),唑来膦酸,例如,唑来膦酸盐/酯;
(二氯-膦酰基-甲基)膦酸,例如,氯膦酸盐/酯;
{1-羟基-3-[甲基(戊基)氨基]丙烷-1,1-二基}双(膦酸),伊班膦酸,例如,伊班膦酸盐/酯;
(3-氨基-1-羟基丙烷-1,1-二基)双(膦酸),帕米膦酸,例如,帕米膦酸盐/酯;
(1-羟基-1-膦酰基-2-吡啶-3-基-乙基)膦酸,利塞膦酸,例如,利塞膦酸盐/酯;
(1-羟基-2-咪唑并[l,2-a]吡啶-3-基-1-膦酰基乙基)膦酸,米诺膦酸;
[3-(二甲基氨基)-1-羟基丙烷-1,1-二基]双(膦酸),奥帕膦酸(olpadronicacid);
[4-氨基-1-羟基-1-(羟基-氧代-磷酰基)-丁基]膦酸,阿仑膦酸,例如,阿仑膦酸盐/酯;
[(环庚基氨基)亚甲基]双(膦酸),英卡膦酸;
(1-羟基乙烷-1,1-二基)双(膦酸),羟乙膦酸,例如,羟乙膦酸盐/酯;以及
{[(4-氯苯基)硫代]亚甲基}双(膦酸),替鲁膦酸。
根据本发明,唑来膦酸(inn)或唑来膦酸盐/酯(由novartis以商品名zometa、zomera、aclasta和reclast市售)为特别优选的双膦酸/盐/酯。zometa用于预防患有癌症(例如,多发性骨髓瘤和前列腺癌)的患者骨折以及治疗骨质疏松症。其还可用于治疗恶性高钙血症并且可有益于治疗来自骨转移的疼痛。
在一个特别优选的实施方案中,根据本发明刺激γδt细胞的药剂与il-2组合施用。已表明,该组合可特别有效地介导γ9δ2t细胞的扩增和活化。
白细胞介素-2(il-2)为一种白细胞介素,即免疫系统中的一类细胞因子信号转导分子。其是一种吸引淋巴细胞的蛋白质,并且为对微生物感染以及区分外源(非自身)和自身的身体自然应答的一部分。il-2通过与淋巴细胞表达的il-2受体结合来介导其效应。
根据本发明使用的il-2可为任何支持或能够刺激γδt细胞的il-2,并且可来自任何物种,优选人。il-2可为分离的、重组产生的或合成的il-2,还可为天然存在或修饰的il-2。
在本发明的一个实施方案中,根据eox方案,与能够结合cldn18.2的抗体(特别是imab362)组合施用标准化学治疗,持续最多8个周期。剂量和方案可如下:
在eox阶段期间,在每个周期的第一天,经15分钟输注静脉内施用50mg/m2表柔比星。
在eox阶段期间,在每个周期的第一天,经2小时输注静脉内施用130mg/m2奥沙利铂。
在eox阶段期间,从每个周期的第一天晚上开始,早晚每日两次口服摄入625mg/m2卡培他滨,持续21天。
在第一个周期的第一天,经2小时输注静脉内施用1000mg/m2抗体。此后,在每个其它周期的第一天,在奥沙利铂输注完成之后,经2小时输注静脉内施用600mg/m2抗体。
在化学治疗结束后,每3周或4周,患者将继续经2小时输注施用600mg/m2抗体。
在本发明的一个实施方案中,根据eox方案,与za/il-2和能够结合cldn18.2的抗体(特别是imab362)组合施用标准化学治疗,持续最多8个周期(24周)。
术语“抗原”指包含针对其引起和/或将引起免疫应答之表位的物质(agent),例如,蛋白质或肽。在一个优选的实施方案中,抗原为肿瘤相关抗原(例如,cldn18.2),即可来源于细胞质、细胞表面和细胞核的癌细胞组成,特别是优选细胞内大量产生的那些抗原或作为癌细胞上的表面抗原。
在本发明的上下文中,术语“肿瘤相关抗原”优选指在正常条件下在有限数目的组织和/或器官中或在特定发育阶段中特异性表达的蛋白质和在一个或更多个肿瘤或癌症组织中表达或异常表达的蛋白质。在本发明的上下文中,肿瘤相关抗原优选与癌细胞的细胞表面缔合,并且优选不在或仅很少在正常组织中表达。
术语“表位”指分子中的抗原决定簇,即,指分子中被免疫系统识别(例如,被抗体识别)的部分。例如,表位是被免疫系统识别的抗原上不连续的三维位点。表位通常由分子的化学活性表面基团(例如,氨基酸或糖侧链)组成,并且通常具有特定的三维结构特征以及特定的电荷特征。构象表位与非构象表位的区别在于,在存在变性溶剂的情况下,前者丧失结合,而后者则不然。蛋白质(例如,cldn18.2)的表位优选包含所述蛋白质的连续或不连续部分,并且长度优选为5至100,优选5至50,更优选8至30,最优选10至25个氨基酸,例如,表位的长度可优选为8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个氨基酸。
术语“抗体”指包含通过二硫键相互连接的至少两条重(h)链和两条轻(l)链的糖蛋白,并且包括任何包含其抗原结合部分的分子。术语“抗体”包括单克隆抗体和抗体片段或衍生物,包括但不局限于,人抗体、人源化抗体、嵌合抗体、单链抗体(例如,scfv′s)和抗原结合的抗体片段(例如,fab和fab′片段),术语“抗体”还包括本文所述的所有重组形式的抗体,例如,在原核生物中表达的抗体、非糖基化抗体以及任何与抗原结合的抗体片段和衍生物。每条重链由重链可变区(本文缩写为vh)和重链恒定区构成。每条轻链由轻链可变区(本文缩写为vl)和轻链恒定区构成。vh和vl区可进一步细分为称为互补决定区(cdr)的高变区,其散布在称为框架区(fr)的更保守区域中。每个vh和vl由三个cdr和四个fr构成,从氨基端到羧基端按以下列顺序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。重链和轻链的可变区含有与抗原相互作用的结合结构域。抗体的恒定区可介导免疫球蛋白与宿主组织或因子的结合,所述宿主组织或因子包括免疫系统的多种细胞(例如,效应细胞)和经典补体系统的第一组分(c1q)。
本文所述的抗体可为人抗体。本文使用的术语“人抗体”旨在包括具有来源于人生殖系免疫球蛋白序列的可变区和恒定区的抗体。本文所述的人抗体可包括不是由人生殖系免疫球蛋白序列编码的氨基酸残基(例如,通过体外随机诱变或定点诱变或者通过体内体细胞突变引入的突变)。
术语“人源化抗体”指具有基本来源于非人物种免疫球蛋白的抗原结合位点的分子,其中所述分子其余的免疫球蛋白结构基于人免疫球蛋白的结构和/或序列。所述抗原结合位点可包含融合至恒定结构域的完整可变结构域或仅包含移植(graft)至可变结构域中适当的构架区的互补决定区(cdr)。抗原结合位点可为野生型的,或者通过一个或更多个氨基酸替换进行修饰,例如,进行修饰以与人免疫球蛋白更为类似。一些形式的人源化抗体保留了全部cdr序列(例如,含有来自小鼠抗体的全部六个cdr的人源化小鼠抗体)。其它形式具有一个或更多个相对于原始抗体而言发生了改变的cdr。
术语“嵌合抗体”指这样的抗体,其中每个重链和轻链的氨基酸序列中的一部分与来自特定物种或属于特定类别的抗体中的相应序列同源,而该链的其余区段则与另一物种或属于另一类别的抗体的相应序列同源。通常,轻链和重链的可变区均模拟来自一个哺乳动物物种之抗体的可变区,而恒定部分则与来自另一物种的抗体的序列同源。这种嵌合形式的一个明显的优势是可使用容易获得的b细胞或来自非人宿主生物体的杂交瘤从目前已知的来源中方便地产生可变区,而与其组合的恒定区来自例如人细胞制备物。所述可变区具有易于制备的优点,并且其特异性不受来源影响,而由于恒定区为人类的,因此该抗体在注射时引发人对象免疫应答的可能性将比恒定区来自非人来源时更低。然而,定义并不局限于此具体实例。
术语抗体的“抗原结合部分”(或简称为“结合部分”)或抗体的“抗原结合片段”(或简称为“结合片段”)或者类似的术语指抗体中保留特异性结合抗原之能力的一个或更多个片段。已表明,抗体的抗原结合功能可通过全长抗体的片段来实现。术语抗体的“抗原结合部分”中涵盖的结合片段的实例包括(i)fab片段,由vl、hl、cl和ch结构域组成的一价片段;(ii)f(ab′)2片段,包含通过铰链区处的二硫键连接的两个fab片段的二价片段;(iii)由vh和ch结构域组成的fd片段;(iv)由抗体单臂上的vl和vh结构域组成的fv片段;(v)由vh结构域组成的dab片段(ward等,(1989)nature341:544-546);(vi)分离的互补决定区(cdr)以及(vii)两个或更多个分离的cdr的组合,其可任选地通过合成接头连接。此外,尽管fv片段的两个结构域vl和vh由单独的基因编码,但是可使用重组方法通过合成接头将它们连接,使之成为单个蛋白质链,其中vl和vh区配对以形成一价分子(称为单链fv(scfv);参见例如,bird等(1988)science242:423-426;和huston等(1988)proc.natl.acad.sci.usa85:5879-5883)。这种单链抗体还旨在涵盖于术语抗体的“抗原结合片段”内。另一个实例是结合结构域免疫球蛋白融合蛋白,其包含(i)与免疫球蛋白铰链区多肽融合的结合结构域多肽,(ii)与该铰链区融合的免疫球蛋白重链ch2恒定区,和(iii)与ch2恒定区融合的免疫球蛋白重链ch3恒定区。所述结合结构域多肽可为重链可变区或轻链可变区。结合结构域免疫球蛋白融合蛋白在us2003/0118592和us2003/0133939中进一步公开。使用本领域技术人员已知的常规技术获得这些抗体片段,并以与完整抗体相同的方式根据用途对片段进行筛选。
术语“双特异性分子”旨在包括具有两种不同的结合特异性的任何物质,例如,蛋白质、肽或者蛋白质或肽复合物。例如,分子可与(a)细胞表面抗原和(b)效应细胞表面上的fc受体结合或相互作用。术语“多特异性分子”或“异种特异性分子”旨在包括具有多于两种不同结合特异性的任何物质,例如,蛋白质、肽或者蛋白质或肽复合物。例如,所述分子可与(a)细胞表面抗原、(b)效应细胞表面上的fc受体和(c)至少一种其它组分结合或相互作用。因此,本发明包括,但不局限于,针对cldn18.2和其它靶标(例如,效应细胞上的fc受体)的双特异性、三特异性、四特异性以及其它多特异性分子。术语“双特异性抗体”还包括双抗体。双抗体为二价的双特异性抗体,其中vh和vl结构域在单个多肽链上表达,但由于使用的接头太短以致于不能使同一链上的两个结构域配对,从而促使结构域与另一链的互补结构域配对并产生两个抗原结合位点(参见例如,holliger,p.,等(1993)proc.natl.acad.sci.usa90:6444-6448;poljak,r.j.,等(1994)structure2:1121-1123)。
抗体可与治疗部分或治疗剂缀合,例如,细胞毒素、药物(例如,免疫抑制剂)或放射性同位素。细胞毒素或细胞毒剂包括对细胞有害和特别是杀伤细胞的任何试剂。实例包括紫杉醇、细胞松弛素b、短杆菌肽d、溴乙啡啶、依米丁、丝裂霉素、依托泊苷、替尼泊苷(tenoposide)、长春新碱、长春花碱、秋水仙碱(cochicin)、阿霉素、柔红霉素、二羟基炭疽菌素(anthracin)二酮、米托蒽醌、光辉霉素、放线菌素d、1-去氢睾酮、糖皮质激素、普鲁卡因、丁卡因、利多卡因、普萘洛尔和嘌呤霉素及其类似物或同系物。适于形成抗体缀合物的治疗剂包括,但不局限于,抗代谢物(例如,氨甲喋呤、6-巯基嘌呤、6-硫代鸟嘌呤、阿糖胞苷、氟达拉滨、5-氟尿嘧啶达卡巴嗪(decarbazine))、烷基化剂(例如,氮芥(mechlorethamine)、硫喷妥苯丁酸氮芥(thioepachlorambucil)、美法仑(melphalan)、卡莫司汀(bsnu)和罗莫司丁(ccnu)、环磷酰胺、白消安、二溴甘露醇、链脲霉素、丝裂霉素c和顺二氯二胺铂(ii)(ddp)顺铂)、蒽环类药物(例如,柔红霉素(原来的道诺霉素(daunomycin))和阿霉素)、抗生素(例如,更生霉素(原来的放线菌素)、博莱霉素、光辉霉素和氨茴霉素(amc))和抗有丝分裂剂(例如,长春新碱和长春花碱)。在一个优选实施方案中,治疗剂为细胞毒剂或放射性毒剂。在另一实施方案中,治疗剂为免疫抑制剂。在又一实施方案中,治疗剂为gm-csf。在一个优选实施方案中,治疗剂为阿霉素、顺铂、博莱霉素、硫酸盐、卡莫司汀、苯丁酸氮芥、环磷酰胺或蓖麻蛋白a。
抗体还可与放射性同位素缀合,例如,碘-131、钇-90或铟-111,以产生细胞毒性放射性药物。
本发明的抗体缀合物可用于修饰给定的生物应答,并且药物部分不应被解释为局限于经典的化学治疗剂。例如,药物部分可为具有所期望生物活性的蛋白质或多肽。这样的蛋白质可包括,例如,酶促活性毒素或其活性片段,例如,相思豆毒素、蓖麻蛋白a、假单胞菌外毒素或白喉毒素;蛋白质,例如,肿瘤坏死因子或干扰素-γ;或者生物应答调节物,如,例如,淋巴因子、白细胞介素-1(“il-1”)、白细胞介素-2(“il-2”)、白细胞介素-6(“il-6”)、粒细胞巨噬细胞集落刺激因子(“gm-csf”)、粒细胞集落刺激因子(“g-csf”)或其它生长因子。
用于缀合该治疗部分至抗体的技术是公知的,参见,例如,arnon等,″monoclonalantibodiesforimmunotargetingofdrugsincancertherapy″,monoclonalantibodiesandcancertherapy中,reisfeld等(编辑),第243-56页(alanr.liss,inc.1985);hellstrom等,″antibodiesfordrugdelivery″,controlleddrugdelivery(第2版)中,robinson等(编辑),第623-53页(marceldekker,inc.1987);thorpe,″antibodycarriersofcytotoxicagentsincancertherapy:areview″,monoclonalantibodies′84:biologicalandclinicalapplications中,pincheraet等(编辑),第475-506页(1985);″analysis,results,andfutureprospectiveofthetherapeuticuseofradiolabeledantibodyincancertherapy″,monoclonalantibodiesforcancerdetectionandtherapy中,baldwin等(编辑),第303-16页(academicpress1985),和thorpe等,″thepreparationandcytotoxicpropertiesofantibody-toxinconjugates″,immunol.rev.,62:119-58(1982)。
如本文所用,如果通过免疫动物或通过筛选免疫球蛋白基因文库来从系统获得抗体,则抗体“来自”特定的生殖系序列,并且其中选择的抗体的氨基酸序列与所述生殖系免疫球蛋白基因编码的氨基酸序列具有至少90%、更优选至少95%、甚至更优选至少96%、97%、98%或99%的同一性。一般而言,与所述生殖系免疫球蛋白基因编码的氨基酸序列相比,来自特定生殖系序列的抗体显示出不超过10个氨基酸差异,更优选,不超过5个氨基酸差异,或者甚至更优选不超过4、3、2或1个氨基酸差异。
本文所用的术语“异源抗体”指连接在一起的两个或更多个抗体、其衍生物或抗原结合区,其中至少两个具有不同的特异性。这些不同的特异性包括对效应细胞上的fc受体的结合特异性和对靶细胞(例如,肿瘤细胞)上抗原或表位的结合特异性。
本文所述的抗体可为单克隆抗体。本文所用的术语“单克隆抗体”指单分子组成的抗体分子制备物。单克隆抗体显示出单一结合特异性和亲和力。在一个实施方案中,单克隆抗体通过包括与无限增殖化(immortalized)细胞融合的获自非人动物(例如,小鼠)之b细胞的杂交瘤产生。
本文所述抗体可为重组抗体。本文所用的术语“重组抗体”包括所有通过重组手段制备、表达、产生或分离的抗体,例如,(a)从免疫球蛋白基因为转基因或转染色体的动物(例如,小鼠)或由其制备的杂交瘤分离的抗体,(b)从经转化以表达所述抗体的宿主细胞(例如,转染瘤)分离的抗体,(c)从重组组合抗体文库分离的抗体,和(d)通过涉及将免疫球蛋白基因序列剪接成其他dna序列的任何其它手段制备、表达、产生或分离的抗体。
本文所述抗体可来自不同的物种,包括,但不限于小鼠、大鼠、兔、豚鼠和人。
本文所述抗体包括多克隆抗体和单克隆抗体,并且包括iga,例如,igal或iga2、igg1、igg2、igg3、igg4、ige、igm和igd抗体。在多种实施方案中,抗体为igg1抗体,更特别地为igg1,κ或igg1,λ同种型(即iggl,κ、λ)、igg2a抗体(例如,igg2a,κ、λ)、igg2b抗体(例如,igg2b,κ、λ)和igg3抗体(例如,igg3,κ、λ)或igg4抗体(例如,igg4,κ、λ)。
本文所用的术语“转染瘤”包括表达抗体的重组真核宿主细胞,例如,cho细胞、ns/0细胞、hek293细胞、hek293t细胞、植物细胞或真菌,包括酵母细胞。
本文所用的“异源抗体”是以产生这种抗体的转基因生物体定义的。该术语指这样的抗体,所述抗体的氨基酸序列或编码核酸序列对应于不由该转基因生物体组成的生物体中可见的氨基酸序列或编码核酸序列,并且一般来自除所述转基因生物体以外的物种。
本文所用的“异源杂合抗体(heterohybridantibody)”指具有不同生物来源的轻链和重链的抗体。例如,具有与鼠类轻链结合的人重链的抗体即为异源杂合抗体。
本发明包括本文所述的所有抗体和抗体衍生物,为了本发明的目的其均被涵盖在术语“抗体”中。术语“抗体衍生物”指任何修饰形式的抗体,例如,抗体和另一物质或抗体的缀合物,或抗体片段。
本文所述抗体优选是分离的。本文所用的“分离的抗体”意指基本不含其他具有不同抗原特异性之抗体的抗体(例如,与cldn18.2特异性结合的分离抗体基本无特异性结合除cldn18.2以外之抗原的抗体)。然而,与人cldn18.2的表位、同工型或变体特异性结合的分离抗体可对其它相关的抗原,例如,来自其它物种(例如,cldn18.2种同源物)具有交叉反应性。此外,分离的抗体可基本无其它细胞材料和/或化学物质。在本发明的一个实施方案中,“分离的”单克隆抗体的组合指具有不同特异性并且组合在明确确定的组合物或混合物中的抗体。
根据本发明,术语“结合”优选指特异性结合。
根据本发明,在标准测定中如果抗体对所述预定靶标具有显著的亲和力并且与所述预定靶标结合,则所述抗体能够与预定靶标结合。“亲和力”或“结合亲和力”一般通过平衡解离常数(kd)来测定。优选地,术语“显著亲和力”指以10-5m或更低、10-6m或更低、10-7m或更低、10-8m或更低、10-9m或更低、10-10m或更低、10-11m或更低或者10-12m或更低的解离常数(kd)与预定靶标结合。
在标准测定中,如果抗体对靶标不具有显著的亲和力并且不与所述靶标显著地结合,特别是不与之可检测地结合,则所述抗体(基本上)不能与所述靶标结合。优选地,如果以高至2μg/ml,优选10μg/ml,更优选20μg/ml,特别是50或100μg/ml或更高的浓度存在,则所述抗体不能与所述靶标可检测地结合。优选地,如果抗体与靶标以与预定靶标(所述抗体能够与其结合)结合之kd相比高至少10倍、100倍、103倍、104倍、105倍或106倍的kd结合,则所述抗体对所述靶标不具有显著的亲和力。例如,如果抗体与所述抗体能够结合的靶标结合的kd为10-7m,则抗体与对其无显著亲和力的靶标结合的kd为至少10-6m、10-5m、10-4m、10-3m、10-2m或10-1m。
如果在标准测定中抗体能够与所述预定靶标结合而不能够与其它靶标结合,即对其它靶标无显著亲和力,并且不能与其它靶标显著结合,则所述抗体对所述预定靶标具有特异性。根据本发明,如果抗体能够与cldn18.2结合但是(基本上)不能够与其它靶标结合,则所述抗体对cldn18.2具有特异性。优选地,如果与这些其它靶标的亲和力和结合不能显著超过与cldn18.2不相关蛋白质的亲和力或结合,则所述抗体对cldn18.2具有特异性,所述与cldn18.2不相关蛋白质例如,牛血清白蛋白(bsa)、酪蛋白、人血清白蛋白(hsa)或非密蛋白跨膜蛋白质(例如,mhc分子或转铁蛋白受体)或任何其它特定的多肽。优选地,如果抗体与所述靶标以与抗体对其不具有特异性的靶标结合之kd相比低至少10倍、100倍、103倍、104倍、105倍或106倍的kd结合,则所述抗体对预定靶标具有特异性。例如,如果抗体与所述抗体对其具有特异性的靶标结合的kd为10-7m,则抗体与对其不具有特异性的靶标结合的kd为至少10-6m、10-5m、10-4m、10-3m、10-2m或10-1m。
可使用任何合适的方法通过实验确定抗体与靶标的结合;参见,例如,berzofsky等,″antibody-antigeninteractions″infundamentalimmunology,paul,w.e.,编辑,ravenpressnewyork,ny(1984),kuby,janisimmunology,w.h.freemanandcompanynewyork,ny(1992)以及本文所述方法。可使用常规技术容易地测定亲和力,例如,通过平衡透析;通过使用biacore2000仪器,使用制造商所描述的通用方法;通过使用放射性标记的靶抗原进行放射免疫测定;或通过技术人员已知的其他方法。可例如通过scatchard等,annn.y.acad.scl,51:660(1949)的方法对亲和力数据进行分析。如果在不同条件(例如,盐浓度、ph)下测量,则测定的特定抗体-抗原相互作用的亲和力可不同。因此,亲和力和其它抗原结合参数(例如,kd、ic50)的测定优选使用抗体和抗原标准化溶液以及标准化缓冲液来进行。
本文所用的“同种型”指由重链恒定区基因编码的抗体类别(例如,igm或igg1)。
本文所用的“同种型转换(isotypeswitching)”指抗体的类别或同种型从一种ig类别转换至其它ig类别之一的现象。
应用于某对象时,本文所用的术语“天然存在的”指该对象可见于自然界这一事实。例如,存在于可从自然界来源分离的生物体(包括病毒)中,并且未经人在实验室中有意修饰的多肽或多核苷酸序列即是天然存在的。
本文所用的术语“重排的”指重链或轻链免疫球蛋白基因座的构型,其中v区段在编码基本上完整的vh结构域或vl结构域的构象中分别位于紧邻d-j区段或j区段的位置。重排的免疫球蛋白(抗体)基因座可通过与生殖系dna的比较来鉴定;重排的基因座将具有至少一个重组的七聚体/九聚体同源性元件。
涉及v区段时,本文所用的术语“未重排的”或“生殖系构型”指其中v区段未经重组从而与d或j区段紧邻的构型。
根据本发明,能够结合cldn18.2的抗体为能够与cldn18.2中存在的表位,优选位于cldn18.2的胞外结构域,特别是第一胞外结构域,优选cldn18.2的第29至78位的氨基酸内的表位结合的抗体。在一些具体实施方案中,能够结合cldn18.2的抗体为能够与以下表位结合的抗体:(i)cldn18.2上的但不存在于cldn18.1上的表位,优选seqidno:3、4和5,(ii)位于cldn18.2-环1上的表位,优选seqidno:8,(iii)位于cldn18.2-环2上的表位,优选seqidno:10,(iv)位于cldn18.2-环d3上的表位,优选seqidno:11,(v)涵盖cldn18.2-环1和cldn18.2-环d3的表位,或(vi)位于cldn18.2-环d3上的非糖基化表位,优选seqidno:9。
根据本发明,能够结合cldn18.2的抗体优选为能够与cldn18.2结合但不与cldn18.1结合的抗体。优选地,能够结合cldn18.2的抗体对cldn18.2具有特异性。优选地,能够结合cldn18.2的抗体优选为在细胞表面上表达的能够结合cldn18.2的抗体。在一些特别优选的实施方案中,能够结合cldn18.2的抗体与活细胞表面上存在的cldn18.2的天然表位结合。优选地,能够结合cldn18.2的抗体与一种或更多种选自seqidno:1、3-11、44、46和48-50的肽结合。优选地,能够结合cldn18.2的抗体对前述蛋白质、肽或免疫原性片段或其衍生物具有特异性。能够结合cldn18.2的抗体可通过包括用蛋白质或肽或表达所述蛋白质或肽的核酸或宿主细胞免疫动物之步骤的方法获得,所述蛋白质或肽包含选自seqidno:1、3-11、44、46和48-50的氨基酸序列。优选地,抗体与癌细胞结合,特别是上述癌症类型的细胞,优选地,所述抗体基本不与非癌细胞结合。
优选地,能够结合cldn18.2的抗体与表达cldn18.2之细胞的结合诱导或介导杀伤表达cldn18.2的细胞。表达cldn18.2的细胞优选为癌细胞,特别地,选自致瘤性胃癌、食管癌、胰腺癌、肺癌、卵巢癌、结肠癌、肝癌、头颈癌和胆囊癌细胞。优选地,抗体通过诱导补体依赖性细胞毒性(cdc)介导的裂解、抗体依赖性细胞的细胞毒性(adcc)介导的裂解、凋亡和抑制表达cldn18.2之细胞增殖中的一种或更多种来诱导或介导细胞杀伤。优选地,在存在效应细胞的情况下,发生adcc介导的细胞裂解,在特定实施方案中,所述效应细胞选自单核细胞、单核的细胞、nk细胞和pmn。可使用溴脱氧尿苷(5-溴-2-脱氧鸟苷,brdu)通过确定细胞在测定中的增殖来体外测量对细胞增殖的抑制。brdu为合成的核苷,其为胸腺嘧啶核苷的类似物,并且在dna复制期间,可被掺入复制中之细胞(在细胞周期的s期)的新合成的dna中,从而取代胸腺嘧啶核苷。使用例如对brdu具有特异性的抗体检测到掺入的化学物,表明细胞正活跃地复制其dna。
在一些优选实施方案中,本文所述抗体可以以下述特性中的一种或更多种为特征:
a)对cldn18.2具有特异性;
b)对cldn18.2的结合亲和力为约100nm或更低,优选,约5至10nm或更低,更优选,约1至3nm或更低;
c)诱导或介导cldn18.2阳性细胞上cdc的能力;
d)诱导或介导cldn18.2阳性细胞上adcc的能力;
e)抑制cldn18.2阳性细胞生长的能力;
f)诱导cldn18.2阳性细胞凋亡的能力。
在一个特别优选的实施方案中,能够结合cldn18.2的抗体由保藏在德国微生物菌种保藏中心(dsmz)的杂交瘤产生(mascheroderweg1b,31824braunschweig,德国;新地址:inhoffenstr.7b,31824braunschweig,德国),其命名和登记号如下:
a.182-d1106-055,登记号dsmacc2737,保藏于2005年10月19日
b.182-d1106-056,登记号dsmacc2738,保藏于2005年10月19日
c.182-d1106-057,登记号dsmacc2739,保藏于2005年10月19日
d.182-d1106-058,登记号dsmacc2740,保藏于2005年10月19日
e.182-d1106-059,登记号dsmacc2741,保藏于2005年10月19日
f.182-d1106-062,登记号dsmacc2742,保藏于2005年10月19日
g.182-d1106-067,登记号dsmacc2743,保藏于2005年10月19日
h.182-d758-035,登记号dsmacc2745,保藏于2005年11月17日
i.182-d758-036,登记号dsmacc2746,保藏于2005年11月17日
i.182-d758-040,登记号dsmacc2747,保藏于2005年11月17日
k.182-d1106-061,登记号dsmacc2748,保藏于2005年11月17日
l.182-d1106-279,登记号dsmacc2808,保藏于2006年10月26日
m.182-d1106-294,登记号dsmacc2809,保藏于2006年10月26日
n.182-d1106-362,登记号dsmacc2810,保藏于2006年10月26日。
根据本发明,优选的抗体为由上述杂交瘤产生及可从上述杂交瘤获得的那些;即,在182-d1106-055的情况下为37g11,在182-d1106-056的情况下为37h8,在182-d1106-057的情况下为38g5,在182-d1106-058的情况下为38h3,在182-d1106-059的情况下为39f11,在182-d1106-062的情况下为43a11,在182-d1106-067的情况下为61c2,在182-d758-035的情况下为26b5,在182-d758-036的情况下为26d12,在182-d758-040的情况下为28d10,在182-d1106-061的情况下为42e12,在182-d1106-279的情况下为125e1,在182-d1106-294的情况下为163e12,在182-d1106-362的情况下为175d10,以及其嵌合和人源化形式。
优选的嵌合抗体及其序列在下表中示出。
在一些优选实施方案中,根据本发明的抗体(特别是嵌合形式的抗体)包括包含如下重链恒定区(ch)的抗体,所述重链恒定区包含来自人重链恒定区的氨基酸序列,例如seqidno:13所示的氨基酸序列或其片段。在另一些优选实施方案中,根据本发明的抗体(特别是嵌合形式的抗体)包括包含如下轻链恒定区(cl)的抗体,所述轻链恒定区包含来自人轻链恒定区的氨基酸序列,例如seqidno:12所示的氨基酸序列或其片段。在一个特别优选的实施方案中,根据本发明的抗体(特别是嵌合形式的抗体)包括包含含有来自人ch的氨基酸序列之ch的抗体,例如seqidno:13所示的氨基酸序列或其片段,并且其包括包含含有来自人cl的氨基酸序列之cl的抗体,例如seqidno:12所示的氨基酸序列或其片段。
在一个实施方案中,能够结合cldn18.2的抗体为包含以下的嵌合小鼠/人igg1单克隆抗体:κ鼠可变轻链、人κ轻链恒定区同种异型km(3)、鼠重链可变区、人igg1恒定区同种异型glm(3)。
在某些优选实施方案中,嵌合形式的抗体包括包含含有选自seqidno:14、15、16、17、18、19和其片段的氨基酸序列之重链的抗体,和/或包含含有选自seqidno:20、21、22、23、24、25、26、27、28和其片段的氨基酸序列之轻链的抗体。
在某些优选实施方案中,嵌合形式的抗体包括包含选自以下可能情况
(i)至(ix)的重链和轻链的组合的抗体:
(i)重链包含seqidno:14所示的氨基酸序列或其片段,且轻链包含seqidno:21所示的氨基酸序列或其片段,
(ii)重链包含seqidno:15所示的氨基酸序列或其片段,且轻链包含seqidno:20所示的氨基酸序列或其片段,
(iii)重链包含seqidno:16所示的氨基酸序列或其片段,且轻链包含seqidno:22所示的氨基酸序列或其片段,
(iv)重链包含seqidno:18所示的氨基酸序列或其片段,且轻链包含seqidno:25所示的氨基酸序列或其片段,
(v)重链包含seqidno:17所示的氨基酸序列或其片段,且轻链包含seqidno:24所示的氨基酸序列或其片段,
(vi)重链包含seqidno:19所示的氨基酸序列或其片段,轻链包含seqidno:23所示的氨基酸序列或其片段,
(vii)重链包含seqidno:19所示的氨基酸序列或其片段,且轻链包含seqidno:26所示的氨基酸序列或其片段,
(viii)重链包含seqidno:19所示的氨基酸序列或其片段,且轻链包含seqidno:27所示的氨基酸序列或其片段,以及
(ix)重链包含seqidno:19所示的氨基酸序列或其片段,且轻链包含seqidno:28所示的氨基酸序列或其片段。
上文使用的“片段”或“氨基酸序列的片段”指抗体序列的一部分,即,表示在n端和/或c端缩短的抗体序列的序列,其在替换抗体中的所述抗体序列时保留所述抗体与cldn18.2的结合并优选保留所述抗体如本文所述的功能,例如cdc介导的裂解或adcc介导的裂解。优选地,氨基酸序列的片段包含来自所述氨基酸序列的至少80%,优选至少90%、95%、96%、97%、98%或99%的氨基酸残基。选自seqidno:14、15、16、17、18、19、20、21、22、23、24、25、26、27和28的氨基酸序列的片段优选地指其中除去了n端17、18、19、20、21、22或23个氨基酸的所述序列。
在一个优选实施方案中,能够结合cldn18.2的抗体包含含有选自seqidno:29、30、31、32、33、34的氨基酸序列及其片段的重链可变区(vh)。
在一个优选实施方案中,能够结合cldn18.2的抗体包含含有选自seqidno:35、36、37、38、39、40、41、42、43的氨基酸序列及其片段的轻链可变区(vl)。
在某些优选实施方案中,能够结合cldn18.2的抗体包含选自以下可能情况(i)至(ix)的重链可变区(vh)和轻链可变区(vl)的组合:
(i)vh包含seqidno:29所示的氨基酸序列或其片段,且vl包含seqidno:36所示的氨基酸序列或其片段,
(ii)vh包含seqidno:30所示的氨基酸序列或其片段,且vl包含seqidno:35所示的氨基酸序列或其片段,
(iii)vh包含seqidno:31所示的氨基酸序列或其片段,且vl包含seqidno:37所示的氨基酸序列或其片段,
(iv)vh包含seqidno:33所示的氨基酸序列或其片段,且vl包含seqidno:40所示的氨基酸序列或其片段,
(v)vh包含seqidno:32所示的氨基酸序列或其片段,且vl包含seqidno:39所示的氨基酸序列或其片段,
(vi)vh包含seqidno:34所示的氨基酸序列或其片段,且vl包含seqidno:38所示的氨基酸序列或其片段,
(vii)vh包含seqidno:34所示的氨基酸序列或其片段,且vl包含seqidno:41所示的氨基酸序列或其片段,
(viii)vh包含seqidno:34所示的氨基酸序列或其片段,且vl包含seqidno:42所示的氨基酸序列或其片段,
(ix)vh包含seqidno:34所示的氨基酸序列或其片段,且vl包含seqidno:43所示的氨基酸序列或其片段。
在一个优选实施方案中,能够结合cldn18.2的抗体包含含有选自以下实施方案(i)至(vi)的互补决定区cdr1、cdr2和cdr3组的vh:
(i)cdr1:seqidno:14的45至52位,cdr2:seqidno:14的70至77位,cdr3:seqidno:14的116至125位,
(ii)cdr1:seqidno:15的45至52位,cdr2:seqidno:15的70至77位,cdr3:seqidno:15的116至126位,
(iii)cdr1:seqidno:16的45至52位,cdr2:seqidno:16的70至77位,cdr3:seqidno:16的116至124位,
(iv)cdr1:seqidno:17的45至52位,cdr2:seqidno:17的70至77位,cdr3:seqidno:17的116至126位,
(v)cdr1:seqidno:18的44至51位,cdr2:seqidno:18的69至76位,cdr3:seqidno:18的115至125位,以及
(vi)cdr1:seqidno:19的45至53位,cdr2:seqidno:19的71至78位,cdr3:seqidno:19的117至128位。
在一个优选实施方案中,能够结合cldn18.2的抗体包含含有选自以下实施方案(i)至(ix)的互补决定区cdr1、cdr2和cdr3组的vl:(i)cdr1:seqidno:20的47至58位,cdr2:seqidno:20的76至78位,cdr3:seqidno:20的115至123位,
(ii)cdr1:seqidno:21的49至53位,cdr2:seqidno:21的71至73位,cdr3:seqidno:21的110至118位,
(iii)cdr1:seqidno:22的47至52位,cdr2:seqidno:22的70至72位,cdr3:seqidno:22的109至117位,
(iv)cdr1:seqidno:23的47至58位,cdr2:seqidno:23的76至78位,cdr3:seqidno:23的115至123位,
(v)cdr1:seqidno:24的47至58位,cdr2:seqidno:24的76至78位,cdr3:seqidno:24的115至123位,
(vi)cdr1:seqidno:25的47至58位,cdr2:seqidno:25的76至78位,cdr3:seqidno:25的115至122位,
(vii)cdr1:seqidno:26的47至58位,cdr2:seqidno:26的76至78位,cdr3:seqidno:26的115至123位,
(viii)cdr1:seqidno:27的47至58位,cdr2:seqidno:27的76至78位,cdr3:seqidno:27的115至123位,以及
(ix)cdr1:seqidno:28的47至52位,cdr2:seqidno:28的70至72位,cdr3:seqidno:28的109至117位。
在一个优选实施方案中,能够结合cldn18.2的抗体包含vh和vl的组合,其中vh和vl分别包含选自以下实施方案(i)至(ix)的互补决定区cdr1、cdr2和cdr3组:
(i)vh:cdr1:seqidno:14的45至52位,cdr2:seqidno:14的70至77位,cdr3:seqidno:14的116至125位,vl:cdr1:seqidno:21的49至53位,cdr2:seqidno:21的71至73位,cdr3:seqidno:21的110至118位,
(ii)vh:cdr1:seqidno:15的45至52位,cdr2:seqidno:15的70至77位,cdr3:seqidno:15的116至126位,vl:cdr1:seqidno:20的47至58位,cdr2:seqidno:20的76至78位,cdr3:seqidno:20的115至123位,
(iii)vh:cdr1:seqidno:16的45至52位,cdr2:seqidno:16的70至77位,cdr3:seqidno:16的116至124位,vl:cdr1:seqidno:22的47至52位,cdr2:seqidno:22的70至72位,cdr3:seqidno:22的109至117位,
(iv)vh:cdr1:seqidno:18的44至51位,cdr2:seqidno:18的69至76位,cdr3:seqidno:18的115至125位,vl:cdr1:seqidno:25的47至58位,cdr2:seqidno:25的76至78位,cdr3:seqidno:25的115至122位,
(v)vh:cdr1:seqidno:17的45至52位,cdr2:seqidno:17的70至77位,cdr3:seqidno:17的116至126位,vl:cdr1:seqidno:24的47至58位,cdr2:seqidno:24的76至78位,cdr3:seqidno:24的115至123位,
(vi)vh:cdr1:seqidno:19的45至53位,cdr2:seqidno:19的71至78位,cdr3:seqidno:19的117至128位,vl:cdr1:seqidno:23的47至58位,cdr2:seqidno:23的76至78位,cdr3:seqidno:23的115至123位,
(vii)vh:cdr1:seqidno:19的45至53位,cdr2:seqidno:19的71至78位,cdr3:seqidno:19的117至128位,vl:cdr1:seqidno:26的47至58位,cdr2:seqidno:26的76至78位,cdr3:seqidno:26的115至123位,
(viii)vh:cdr1:seqidno:19的45至53位,cdr2:seqidno:19的71至78位,cdr3:seqidno:19的117至128位,vl:cdr1:seqidno:27的47至58位,cdr2:seqidno:27的76至78位,cdr3:seqidno:27的115至123位,以及
(ix)vh:cdr1:seqidno:19的45至53位,cdr2:seqidno:19的71至78位,cdr3:seqidno:19的117至128位,vl:cdr1:seqidno:28的47至52位,cdr2:seqidno:28的70至72位,cdr3:seqidno:28的109至117位。
在另一些优选实施方案中,能够结合cldn18.2的抗体优选包含针对cldn18.2的单克隆抗体(优选本文所述针对cldn18.2的单克隆抗体)的重链可变区(vh)和/或轻链可变区(vl)的一个或更多个互补决定区(cdr),优选至少包含cdr3可变区,且优选包含本文所述重链可变区(vh)和/或轻链可变区(vl)的一个或更多个互补决定区(cdr),优选至少包含cdr3可变区。在一个实施方案中,所述一个或更多个互补决定区(cdr)选自本文所述互补决定区cdr1、cdr2和cdr3组。在一个特别优选实施方案中,能够结合cldn18.2的抗体优选包含针对cldn18.2的单克隆抗体(优选本文所述针对cldn18.2的单克隆抗体)的重链可变区(vh)和/或轻链可变区(vl)的互补决定区cdr1、cdr2和cdr3,并优选包含本文所述重链可变区(vh)和/或轻链可变区(vl)的互补决定区cdr1、cdr2和cdr3。
在一个实施方案中,如本文所述包含一个或更多个cdr、一组cdr或cdr组的组合的抗体包含所述cdr及其插入构架区(interveningframeworkregion)。优选地,该部分还将包含至少约50%的第一和第四构架区之一或两者,所述50%为第一构架区的c端50%和第四构架区的n端50%。通过重组dna技术进行的抗体的构建可导致在可变区的n端或c端引入接头编码的残基,所述接头的引入是为了便于克隆或其他操作步骤,包括引入接头连接本发明的可变区与其他蛋白质序列,所述其他蛋白质序列包括免疫球蛋白重链、其他可变结构域(例如,在产生双抗体中)或蛋白质标签。
在一个实施方案中,如本文所述包含一个或更多个cdr、一组cdr或cdr组之组合的抗体包含在人抗体构架中的所述cdr。
本文中提到的在其重链中包含特定链或特定区域或特定序列的抗体优选指这样的情况,其中所述抗体的所有重链均包含所述特定链、区域或序列。这相应地也适用于抗体的轻链。
本文所用的术语“核酸”旨在包括dna和rna。核酸可为单链的或双链的,但优选为双链dna。
根据本发明,依照其最通常的含义来使用术语“表达”,包括产生rna或者产生rna和蛋白质/肽。其还包括核酸的部分表达。此外,表达可瞬时进行或稳定地进行。
本文就特定氨基酸序列(例如,序列表中所示出的那些)给出的教导解释为还指所述特定序列的变体,所述变体产生与所述特定序列在功能上等同的序列,例如显示出与所述特定氨基酸序列相同的或类似的特性的氨基酸序列。一个重要的特性是保留抗体与其靶标的结合或维持抗体的效应功能。优选地,特定序列变体的序列在替换抗体中的所述特定序列时保留所述抗体与cldn18.2的结合,并优选保留所述抗体如本文所述的功能,例如,cdc介导的裂解或adcc介导的裂解。
本领域的技术人员应当理解,特别是可以修饰cdr、高变区和可变区的序列而不丧失结合cldn18.2的能力。例如,cdr区与本文所述抗体的区域相同或高度同源。“高度同源”意指可以在cdr中进行1至5,优选1至4,例如,1至3或1或2个替换。此外,可对高变区和可变区进行修饰,使得它们与本文具体公开的抗体区域示出显著的同源性。
出于本发明的目的,氨基酸序列的“变体”包括氨基酸插入变体、氨基酸添加变体、氨基酸缺失变体和/或氨基酸替换变体。在蛋白质的n端和/或c端包含缺失的氨基酸缺失变体还被称为n端和/或c端截短变体(truncationvariant)。
氨基酸插入变体包括在特定氨基酸序列中插入单个或两个或更多个氨基酸。在具有插入的氨基酸序列变体的情况下,向氨基酸序列的特定位点中插入一个或更多个氨基酸残基,但是随机插入并对所产生的产物进行合适的筛选也是可能的。
氨基酸添加变体包括一个或更多个氨基酸(例如,1、2、3、5、10、20、30、50或更多个氨基酸)的氨基端和/或羧基端融合。
氨基酸缺失变体的特征为从序列中除去一个或更多个氨基酸,例如,除去1、2、3、5、10、20、30、50或更多个氨基酸。所述缺失可在蛋白质的任何位置。
氨基酸替换变体的特征为除去序列中的至少一个残基,并且在其位置插入其他残基。优选在氨基酸序列中同源蛋白质或肽之间非保守的位置处进行修饰和/或用具有类似特性的其它氨基酸取代氨基酸。优选地,蛋白质变体中的氨基酸改变为保守氨基酸改变,即,替换带有类似电荷的或不带电荷的氨基酸。保守氨基酸改变涉及替换与其侧链中相关的氨基酸家族之一。天然存在的氨基酸一般分为四个家族:酸性氨基酸(天冬氨酸、谷氨酸)、碱性氨基酸(赖氨酸、精氨酸、组氨酸)、非极性氨基酸(丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸)和不带电的极性氨基酸(甘氨酸、天冬酰胺、谷氨酰胺、半胱氨酸、丝氨酸、苏氨酸、酪氨酸)。苯丙氨酸、色氨酸和酪氨酸有时同时被归类为芳香族氨基酸。
优选地,给定的氨基酸序列和所述给定的氨基酸序列之变体氨基酸序列之间的相似度优选同一性为至少约60%、65%、70%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。优选地针对氨基酸区域给出相似度或同一性,所述区域为参考氨基酸序列全长的至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%或约100%。例如,如果参考氨基酸序列由200个氨基酸组成,优选地针对至少约20、至少约40、至少约60、至少约80、至少约100、至少约120、至少约140、至少约160、至少约180或约200个氨基酸给出相似度或同一性,优选连续的氨基酸。在一些优选实施方案中,针对参考氨基酸序列的全长给出相似度或同一性。可用本领域已知的工具进行用于确定序列相似性(优选序列同一性)的比对,优选使用最佳序列比对,例如,使用align,采用标准设定,优选emboss:needle,matrix:blosum62,缺口打开(gapopen)10.0,缺口延伸(gapextend)0.5来进行。
“序列相似性”指相同的或显示保守氨基酸替换的氨基酸的百分比。两条氨基酸序列之间的“序列同一性”指所述序列之间相同的氨基酸的百分比。
术语“百分比同一性”意指在最佳比对之后获得的所比较的两条序列之间相同的氨基酸残基所占的百分比,该百分比完全是统计学意义上的,并且两条序列之间的差异随机分布在其全长上。两条氨基酸序列之间的序列比较通过在对其进行最佳比对后比较其序列来常规地进行,所述比较通过区段或通过“比较窗”来进行以鉴定和比较局部区域的序列相似性。除手工产生以外,用于比较的序列的最佳比对还可通过以下手段产生:smith和waterman,1981,adsapp.math.2,482的局部同源性算法,neddleman和wunsch,1970,j.mol.biol.48,443的局部同源性算法,pearson和lipman,1988,proc.natlacad.sci.usa85,2444的相似性搜索法,或者使用这些算法的计算机程序(在wisconsingenetics软件包中的gap,bestfit,fasta,blastp,blastn和tfasta,geneticscomputergroup,575sciencedrive,madison,wis.)。
通过以下方法计算百分比同一性:测定进行比较的两条序列之间相同的位置数,用该数除以进行比较的的位置数,并用所得结果乘以100,从而获得这两条序列之间的百分比同一性。
术语“转基因动物”指具有包含一个或更多个转基因(优选重链和/或轻链转基因)或转染色体(整合或不整合至动物的天然基因组dna中)的基因组的动物,并且其优选能够表达所述转基因。例如,转基因小鼠可具有人轻链转基因和人重链转基因或人重链转染色体,使得当用cldn18.2抗原和/或表达cldn18.2的细胞免疫时,所述小鼠产生人抗cldn18.2抗体。可将人重链转基因整合到小鼠的染色体dna中(如转基因小鼠(例如,humab小鼠(例如,hco7或hcol2小鼠))的情况那样),或者可以染色体外维持人重链转基因(如wo02/43478中所述的转染色体(例如,km)小鼠的情况那样)。所述转基因和转染色体小鼠可通过进行v-d-j重组和同种型转换而能够产生针对cldn18.2的多种同种型的人单克隆抗体(例如,igg、iga和/或ige)。
本文所用的“减少”、“降低”或“抑制”指水平(例如,表达水平或细胞增殖水平)的总体降低或引起总体降低的能力,优选5%或更高,10%或更高,20%或更高,更优选50%或更高,最优选75%或更高的降低。
术语,例如“增加”或“增强”优选指增加或增强约至少10%,优选至少20%,优选至少30%,更优选至少40%,更优选至少50%,甚至更优选至少80%,最优选至少100%、至少200%、至少500%、至少1000%、至少10000%或甚至更多。
mab的作用机制
尽管下文提供了关于本发明抗体治疗效力背后的机制方面的一些考虑,但不应认为这以任何方式限制了本发明。
本文所述的抗体优选地与免疫系统的组成相互作用,优选通过adcc或cdc。本文所述抗体还可用于靶向有效负载(例如,放射性同位素、药物或毒素)从而直接杀伤肿瘤细胞或者可与传统化学治疗剂协同使用,通过互补性作用机制攻击肿瘤,所述作用机制可包括由于化学治疗剂对t淋巴细胞的细胞毒性副作用而受损的抗肿瘤免疫应答。然而,本文所述抗体还可简单地通过在细胞表面结合cldn18.2而发挥作用,从而例如阻断细胞增殖。
抗体依赖性细胞介导的细胞毒性
本文所述的adcc描述了效应细胞特别是淋巴细胞的细胞杀伤能力,其优选需要被抗体标记的靶细胞。
adcc优选在抗体与肿瘤细胞上的抗原结合以及抗体fc结构域与免疫效应细胞表面上的fc受体(fer)接合时发生。已鉴定出几个fc受体家族,且特定的细胞群特征性地表达确定的fc受体。可将adcc视为直接诱导不同程度的直接肿瘤破坏的机制,所述破坏导致抗原呈递并诱导肿瘤指向性t细胞应答。优选地,adcc的体内诱导将引起肿瘤指向性t细胞应答和宿主来源的抗体应答。
补体依赖性细胞毒性
cdc是可通过抗体指引的另一细胞杀伤方法。igm是用于补体活化的最有效的同种型。igg1和igg3在通过经典的补体活化途径指引cdc方面也都很有效。优选地,在该级联中,抗原-抗体复合物的形成导致紧邻参与抗体分子(例如,igg分子)ch2结构域的多个c1q结合位点暴露出来(c1q是补体c1的三种亚组分之一)。优选地,这些暴露的c1q结合位点将先前低亲和力的c1q-igg相互作用转变为一种高亲和力相互作用,这触发了涉及一系列其它补体蛋白质的级联事件并且引起效应细胞趋化剂/活化剂c3a和c5a的蛋白水解释放。优选地,该补体级联最终形成膜攻击复合物,其在细胞膜中产生孔,有利于水和溶质自由穿行于细胞内外。
本文所述的抗体可通过多种技术产生,包括常规的单克隆抗体法,例如,kohler和milstein,nature256:495(1975)的标准体细胞杂交技术。尽管原则上优选体细胞杂交方案,但是也可采用其它技术来产生单克隆抗体,例如,b淋巴细胞的病毒或致癌转化或使用抗体基因文库的噬菌体展示技术。
用于制备分泌单克隆抗体的杂交瘤的优选动物系统为鼠系统。在小鼠中产生杂交瘤是已经非常成熟的方案。分离用于融合的免疫脾细胞的免疫方案和技术在本领域中是公知的。融合伴侣(fusionpartner)(例如,鼠骨髓瘤细胞)和融合方法也是已知的。
用于制备分泌单克隆抗体的杂交瘤的其它优选动物系统为大鼠系统和兔系统(例如,spieker-polet等,proc.natl.acad.sci.u.s.a.92:9348(1995)中所描述的,还参见,rossi等,am.j.clin.pathol.124:295(2005))。
在又一优选实施方案中,可使用携带部分人免疫系统而不是小鼠系统的转基因或转染色体小鼠产生人单克隆抗体。这些转基因和转染色小鼠包括分别称为humab小鼠和km小鼠的小鼠,并且在本文中统称为“转基因小鼠”。可按照wo2004035607中对cd20详细描述的那样在所述转基因小鼠中进行人抗体的产生。
用于产生单克隆抗体的又一策略为直接从产生具有确定特异性的抗体的淋巴细胞中分离编码抗体的基因,例如,参见babcock等,1996;anovelstrategyforgeneratingmonoclonalantibodiesfromsingle,isolatedlymphocytesproducingantibodiesofdefinedspecificities。重组抗体工程的细节还可参见welschof和kraus,recombinantantibodesforcancertherapyisbn-0-89603-918-8和bennyk.c.loantibodyengineeringisbn1-58829-092-1。
可以如所述的,利用来自抗原序列(即,抗体待指向的序列)的载体缀合肽、重组表达的抗原或其片段的富集制备物和/或表达抗原的细胞免疫小鼠以产生抗体。或者,可利用编码抗原或其片段的dna免疫小鼠。如果使用抗原的纯化制备物或富集制备物的免疫不产生抗体,还可用表达抗原的细胞(例如,细胞系)免疫小鼠来促进免疫应答。
可以用通过尾静脉或眶后取血获得的血浆和血清样品在免疫方案的全程中监测免疫应答。可使用具有足够效价的免疫球蛋白的小鼠进行融合。可以在处死并摘出脾前3天,利用抗原表达细胞经腹膜内或经静脉内对小鼠进行加强免疫以提高分泌特异性抗体的杂交瘤的比率。
为了产生产生单克隆抗体的杂交瘤,可从经免疫的小鼠中分离出脾细胞和淋巴结细胞,并将其与合适的无限增殖细胞系(例如,小鼠骨髓瘤细胞系)融合。然后,可针对抗原特异性抗体的产生筛选获得的杂交瘤。然后可以通过elisa对单个孔进行筛选以获得分泌抗体的杂交瘤。使用抗原表达细胞通过免疫荧光和facs分析,可对抗抗原的特异性抗体进行鉴定。可将分泌该抗体的杂交瘤重新铺板,再次筛选,并且如果单克隆抗体仍为阳性的,则可通过有限稀释进行亚克隆。接着,可在组织培养基中体外培养稳定的亚克隆以产生抗体用于表征。
还可使用例如本领域中公知的重组dna技术和基因转染方法的组合在宿主细胞转染瘤中产生抗体(morrison,s.(1985)science229:1202)。
例如,在一个实施方案中,可将目的基因(例如,抗体基因)连接至表达载体(例如,真核表达质粒)中,例如,采用wo87/04462、wo89/01036和ep338841中公开的gs基因表达系统或本领域公知的其它表达系统来进行。可将具有所克隆抗体基因的纯化质粒引入真核宿主细胞中,例如,cho细胞、ns/0细胞、hek293t细胞或hek293细胞或者其它真核细胞(例如,来自植物的细胞、真菌或酵母细胞)中。用于引入这些基因的方法可为本领域中所述的方法,例如,电穿孔、lipofectine、lipofectamine或其他。在将这些抗体基因引入宿主细胞后,可对表达抗体的细胞进行鉴定和选择。这些细胞代表此后可扩增其表达水平并扩大规模以生产抗体的转染瘤。可从这些培养上清液和/或细胞中分离并纯化出重组抗体。
或者,克隆的抗体基因可在其它表达系统中表达,包括原核细胞,例如,微生物,如大肠杆菌(e.coli)。此外,抗体可在非人转基因动物中产生,例如,在羊和兔的乳汁中或在鸡蛋中产生,或者转基因植物中产生,参见例如,verma,r.,等(1998)j.immunol.meth.216:165-181;pollock,等(1999)j.immunol.meth.231:147-157;和fischer,r,等(1999)biol.chem.380:825-839。
嵌合
当用毒素或放射性同位素进行标记时,鼠单克隆抗体可在人体内用作治疗抗体。未标记的鼠抗体在重复应用时在人体内具有高免疫原性,导致治疗效果降低。主要的免疫原性是由重链恒定区介导的。如果对各抗体进行嵌合或人源化,则鼠抗体在人体内的免疫原性可降低或完全避免。嵌合抗体为不同部分来自不同动物物种的抗体,例如,具有来自鼠抗体可变区和人免疫球蛋白恒定区的抗体。将鼠抗体重链和轻链的可变区与人重链和轻链的恒定区连接在一起从而获得抗体的嵌合(例如,如kraus等,inmethodsinmolecularbiologyseries,recombinantantibodiesforcancertherapyisbn-0-89603-918-8所述)。在一个优选实施方案中,嵌合抗体可通过连接人κ轻链恒定区至鼠轻链可变区产生。在另一优选实施方案中,嵌合抗体可通过连接人λ轻链恒定区至鼠轻链可变区产生。用于产生嵌合抗体的优选重链恒定区为igg1、igg3和igg4。用于产生嵌合抗体的其它优选重链恒定区为igg2、iga、igd和igm。
人源化
抗体主要通过位于六个重链和轻链互补决定区(cdr)的氨基酸残基与靶抗原相互作用。由于这个原因,在各抗体之间,cdr内的氨基酸序列比cdr外的序列更多样化。由于cdr序列负责大多数抗体-抗原相互作用,因此有可能通过通过构建表达载体来表达模拟特定天然存在的抗体之特性的重组抗体,所述表达载体包含来自所述特定天然存在抗体的cdr序列,其移植到来自具有不同特性的不同抗体的框架序列上(参见,例如,riechmann,l.等(1998)nature332:323-327;jones,p.等(1986)nature321:522-525;和queen,c.等(1989)proc.natl.acad.sci.u.s.a.86:10029-10033)。这样的框架序列可获自包含生殖系抗体基因序列的公共dna数据库。这些生殖系序列不同于成熟的抗体基因序列,因为它们不包含完整装配的可变基因,其是在b细胞成熟期间通过v(d)j连接而形成的。生殖系基因序列还将在均匀穿过可变区的个别处不同于高亲和力次级全套抗体(secondaryrepertoireantibody)的序列。
可使用标准结合测定来确定抗体结合抗原的能力(例如,elisa、western印迹、免疫荧光和流式细胞术分析)。
为了纯化抗体,可将选择的杂交瘤培养在两升旋转瓶中以纯化单克隆抗体。或者,可以在基于透析的生物反应器中产生抗体。在用蛋白质g琼脂糖或蛋白质a琼脂糖进行亲和色谱之前,可将上清液过滤并浓缩(如有需要)。可通过凝胶电泳和高效液相色谱检查经洗脱的igg,以确保纯度。可将缓冲液更换成pbs,并可以用1.43消光系数通过od280来测定浓度。可将单克隆抗体分成等分试样并贮存于-80℃。
可使用定点诱变或多点定向诱变来确定选择的单克隆抗体是否与独特的表位结合。
可利用多种市售试剂盒(例如,zymed,rochediagnostics)进行同种型elisa来确定抗体的同种型。可用抗小鼠ig包被微量滴定板的孔。封闭后,使所述板与单克隆抗体或纯化的同种型对照于环境温度下反应两小时。然后,可使孔与小鼠igg1、igg2a、igg2b或igg3、iga或小鼠igm特异性过氧化物酶缀合探针反应。在洗涤之后,将所述板用abts底物(1mg/ml)显影,并于od405至650下进行分析。或者,可按照制造商所述使用isostrip小鼠单克隆抗体同种型试剂盒(roche,cat.no.1493027)。
可使用流式细胞术来证明经免疫的小鼠的血清中存在抗体或存在单克隆抗体与活细胞表达抗原的结合。可将天然或转染后表达抗原的细胞系和缺乏抗原表达的阴性对照(在标准生长条件下培养)与杂交瘤上清液中或含有1%fbs的pbs中不同浓度的单克隆抗体混合,并可于4℃下孵育30分钟。在洗涤之后,可使apc-或alexa647-标记的抗igg抗体在与第一抗体染色相同的条件下与抗原结合的单克隆抗体结合。通过流式细胞术,用facs装置利用光散射和侧向散射特性对单个活细胞设置门控来分析样品。可采用共转染方法以在单次测定中区分抗原特异性单克隆抗体和非特异性结合物。可如上所述对用编码抗原和荧光标志物的质粒瞬时转染的细胞进行染色。经转染的细胞可在与抗体染色细胞不同的荧光通道中检测到。由于大多数经转染的细胞同时表达两种转基因,因此抗原特异性单克隆抗体优选与表达荧光标志物的细胞结合,而非特异性抗体以相当的比率与未转染的细胞结合。可利用使用荧光显微术的替代测定补充或替代流式细胞术测定。可完全如上所述染色细胞并通过荧光显微术来检查细胞。
可使用免疫荧光显微术分析来证明经免疫的小鼠的血清中存在抗体或存在单克隆抗体与表达抗原的活细胞结合。例如,将自发或在转染后表达抗原的细胞系和缺乏抗原表达的阴性对照于标准生长条件下培养于腔室载玻片(chamberslide)中补充有10%胎牛血清(fcs)、2mml-谷氨酰胺、100iu/ml青霉素和100μg/ml链霉素的dmem/f12培养基中。然后用甲醇或多聚甲醛固定细胞或不做处理。然后,可将细胞与针对抗原的单克隆抗体于25℃下反应30分钟。在洗涤之后,使细胞与alexa555标记的抗小鼠igg第二抗体(molecularprobes)于相同条件下反应。然后,通过荧光显微术检查细胞。
可制备来自表达抗原的细胞的细胞提取物和适当的阴性对照,并进行十二烷基硫酸钠(sds)聚丙烯酰胺凝胶电泳。电泳之后,将分开的抗原转移至硝酸纤维素膜,封闭,并用待测单克隆抗体测试。可使用抗小鼠igg过氧化物酶检测igg结合并用ecl底物显影。
还可以按照技术人员公知的方式,通过免疫组织化学来检测抗体与抗原的反应性,例如,使用来自常规手术过程期间的患者或来自携带接种有自发表达或在转染后表达抗原之细胞系的异种移植肿瘤的小鼠的非癌组织或癌组织样品的多聚甲醛或丙酮固定的冷冻切片或用多聚甲醛固定的石蜡包埋组织切片。对于免疫染色,可孵育与抗原反应的抗体,然后根据供应商的说明加入辣根过氧化物酶缀合的山羊抗小鼠或山羊抗兔抗体(dako)。
可对抗体介导吞噬和杀伤表达cldn18.2之细胞的能力进行测试。单克隆抗体活性的体外检测可在体内模型检测前提供初步筛选。
抗体依赖性细胞介导的细胞毒性(adcc):
简言之,来自健康供体的多形核细胞(pmn)、nk细胞、单核细胞、单核的细胞或其它效应细胞可通过ficollhypaque密度离心然后裂解污染性红血细胞来纯化。可将经洗涤的效应细胞悬浮于补充了10%热灭活的胎牛血清,或者5%热灭活的人血清的rpmi中,并以不同的效应细胞:靶细胞的比例与51cr标记的表达cldn18.2的靶细胞混合。或者,可用荧光增强配体(batda)标记靶细胞。可用荧光计测定从死亡细胞中释放的增强配体与铕形成的高荧光螯合物。另一替代技术可利用具有荧光素酶的靶细胞的转染。然后,可仅通过活细胞将添加的荧光黄氧化。然后,以不同浓度添加经纯化的抗cldn18.2igg。可使用不相关的人igg作为阴性对照。根据使用的效应细胞类型,于37℃下,可进行测定4至20小时。可通过测定培养上清液中51cr的释放或eutda螯合物的存在来测定样品的细胞溶解。或者,由荧光黄氧化产生的发光可为活细胞的量度。
还可用多种组合来测试抗cldn18.2单克隆抗体以确定使用多个单克隆抗体是否增强细胞溶解。
补体依赖性细胞毒性(cdc):
可使用多种已知的技术来测试单克隆抗cldn18.2抗体介导cdc的能力。例如,可以以技术人员已知的方式从血液中获得补体血清。可使用不同的方法来确定mabs的cdc活性。例如,可测定51cr的释放或可使用碘化丙啶(pi)排除测定来评价提高的膜渗透性。简言之,可洗涤靶细胞,并将5x105/ml与不同浓度的mab于室温或37℃下孵育10至30分钟。然后,添加血清或血浆至终浓度为20%(v/v),并使细胞于37℃下孵育20至30分钟。可向facs管中的pi溶液添加来自每个样品的全部细胞。然后,可立即使用facsarray通过流式细胞术分析来分析该混合物。
在一种替代测定中,可根据贴壁细胞确定cdc的诱导。在所述测定的一个实施方案中,在进行测定前24小时,以3×104/孔的密度将细胞接种于组织培养平底微量滴定板中。第二天,去除生长培养基并将细胞与抗体一式三份地孵育。将对照细胞分别与生长培养基或包含0.2%皂苷的生长培养基孵育用于确定背景裂解和最大裂解。室温孵育20分钟后,去除上清液,并向细胞添加20%(v/v)dmem中的人血浆或血清(预热至37℃)并于37℃下再孵育20分钟。向碘化丙啶溶液(10μg/ml)添加来自每个样品的全部细胞。然后,用含有2.5μg/溴乙啡啶的pbs替换上清液,并在使用tecansafire在600nm下测量520nm处激发后的荧光发射。如下计算百分比特异性裂解:%特异性裂解=(样品荧光-背景荧光)/(最大裂解荧光-背景荧光)x100。
通过单克隆抗体来诱导凋亡和抑制细胞增殖:
可将单克隆抗cldn18.2抗体与例如cldn18.2阳性肿瘤细胞(例如,snu-16、dan-g、kato-iii)或转染了cldn18.2的肿瘤细胞于37℃下孵育约20小时以测试引发凋亡的能力。可以收获细胞,用膜联蛋白-v结合缓冲液(bdbiosciences)洗涤,并与和fitc或apc缀合的膜联蛋白-v(bdbiosciences)在黑暗中孵育15分钟。可向facs管中的pi溶液(10μg/ml于pbs中)添加来自每个样品的全部细胞,并立即通过流式细胞术进行评价(如上)。或者,可利用市售的试剂盒来检测单克隆抗体对细胞增殖的一般抑制。delfia细胞增殖试剂盒(perkin-elmer,cat.no.ad0200)为基于测量在微板中的增殖细胞dna合成期间5-溴-2-脱氧尿苷(brdu)的掺入的非同位素免疫测定。使用铕标记的单克隆抗体来检测掺入的brdu。使用固定溶液固定细胞并使dna变性以能够检测抗体。洗去未结合的抗体,并添加delfia诱导剂以从标记抗体中解离铕离子至溶液中,其中它们与delfia诱导剂的组分形成高荧光螯合物。在检测中,利用时间分辨荧光术测定的荧光与每个孔的细胞中dna的合成成比例。
临床前研究
还可在体内模型(例如,在携带有用表达cldn18.2细胞系接种的异种移植肿瘤的免疫缺陷性小鼠中,例如,dan-g、snu-16或kato-iii,或在转染后,例如,hek293)中对结合cldn18.2的单克隆抗体进行检测以确定它们控制表达cldn18.2之肿瘤细胞生长的效力。
可以在将表达cldn18.2的肿瘤细胞异种移植至免疫受损的小鼠或其它动物中后,利用本文所述抗体进行体内研究。可向无肿瘤小鼠施用抗体,然后注射肿瘤细胞以测量所述抗体防止肿瘤或肿瘤相关症状形成的效果。可向具有肿瘤的小鼠施用抗体以确定各抗体降低肿瘤生长、转移或肿瘤相关症状的治疗效力。抗体施加可与其它物质,如细胞抑制(cystostatic)药物、生长因子抑制剂、细胞周期阻断剂、血管发生抑制剂或其它抗体的施加组合以测定组合的协同效力和潜在毒性。可用抗体或对照试剂接种动物,并针对与cldn18.2抗体治疗可能相关的症状进行彻底研究以分析抗体介导的毒副作用。体内施加cldn18.2抗体可能的副作用特别包括在表达cldn18.2的组织(包括胃)的毒性。在人和其它物种(例如,小鼠)中识别cldn18.2的抗体对预测由在人中施加单克隆cldn18.2抗体介导的潜在副作用特别有用。
可按照“glenne.morris的epitopemappingprotocols(methodsinmolecularbiology)isbn-089603-375-9”和olwynm.r.westwood,frankc.hay的“epitopemapping:apracticalapproach″practicalapproachseries,248中详细描述的那样,对抗体识别的表位作图。
可以以任意合适的药物组合物的形式施用本文所述的化合物和药剂。
药物组合物一般以均匀的剂型提供,并且可以以本身已知的方式制备。药物组合物可例如是溶液或混悬剂形式的。
药物组合物可包含盐、缓冲物质、防腐剂、载体、稀释剂和/或赋形剂,所有这些均优选为可药用的。术语“可药用的”指不与药物组合物的活性成分的作用相互作用的材料无毒性。
不可药用的盐可用于制备可药用的盐,并且也包括在本发明中。这类可药用盐以非限制性方式包括由以下酸制备的那些:盐酸、氢溴酸、硫酸、硝酸、磷酸、马来酸、乙酸、水杨酸、柠檬酸、甲酸、丙二酸、琥珀酸等。可药用盐还可制备成碱金属盐或碱土金属盐,例如,钠盐、钾盐或钙盐。
适用于药物组合物中的缓冲物质包括盐中的乙酸、盐中的柠檬酸、盐中的硼酸和盐中的磷酸。
适用于药物组合物中的防腐剂包括苯扎氯铵、氯丁醇、对羟基苯甲酸酯和硫柳汞。
可注射制剂可包含可药用赋形剂,例如,ringer乳酸盐。
术语“载体”指天然或合成性质的有机或无机组分,其中将活性组分组合以促进、增强或实现应用。根据本发明,术语“载体”还包括适于向患者施用的一种或更多种相容的固体或液体填料、稀释剂或包封物质。
可用于肠胃外施用的载体物质为,例如,无菌水、ringer、ringer乳酸盐、无菌氯化钠溶液、聚亚烷基二醇、氢化萘以及,特别是,生物相容的丙交酯聚合物、丙交酯/乙交酯共聚物或聚氯乙烯/多氧-丙烯共聚物。
术语“赋形剂”在本文中使用时意指可存在于药物组合物中但不是活性成分的所有物质,例如,载体、结合剂、润滑剂、增稠剂、表面活性剂、防腐剂、乳化剂、缓冲剂、调味剂或着色剂。
本文所述的药剂和组合物可通过任意常规途径施用,例如,通过肠胃外施用,包括通过注射或输注。施用优选肠胃外施用,例如,静脉内施用、动脉内施用、皮下施用、皮内施用或肌内施用。
适于肠胃外施用的组合物一般包括活性化合物的无菌水或非水制备物,其优选与接受者的血液等渗。相容的载体和溶剂的实例为ringer溶液和等渗氯化钠溶液。此外,通常使用无菌固定油类作为溶液或悬浮介质。
本文所述的药剂和组合物以有效量施用。“有效量”指单独或与其它剂量一起获得预期反应或预期效果的量。在治疗特定疾病或特定病症的情况下,预期的反应优选关于抑制疾病进程。这包括减缓疾病的发展和,特别是,中止或逆转疾病的发展。治疗疾病或病症中的预期反应还可为延迟或预防所述疾病或所述病症的发病。
本文所述药剂或组合物的有效量将取决于待治疗的病症、疾病的严重程度、患者的个体参数(包括年龄、生理状况、尺寸和体重)、治疗的持续时间、伴随治疗的类型(如果存在的话),具体施用途径以及类似因素。因此,本文所述药剂的施用剂量可取决于多个这种参数。在患者对初始剂量反应不够的情况下,可使用更高剂量(或通过不同的更局部化的施用途径获得有效的更高剂量)。
本文所述的药剂和组合物可施用于患者(例如,在体内)以治疗或预防多种病症,例如,本文所述的那些。优选的患者包括患有可通过施用本文所述的药剂和组合物校正(correct)或改善之病症的人患者。这包括涉及以改变cldn18.2的表达模式为特征之细胞的病症。
例如,在一个实施方案中,本文所述抗体可用于治疗患有癌症疾病的患者,例如,本文所述的以存在表达cldn18.2的癌细胞为特征的癌症疾病。
根据本发明,所述药物组合物和治疗方法还可用于免疫或疫苗接种从而预防本文所述的疾病。
通过以下实施例对本发明进一步说明,所述实施例不解释为限制了本发明的范围。
实施例
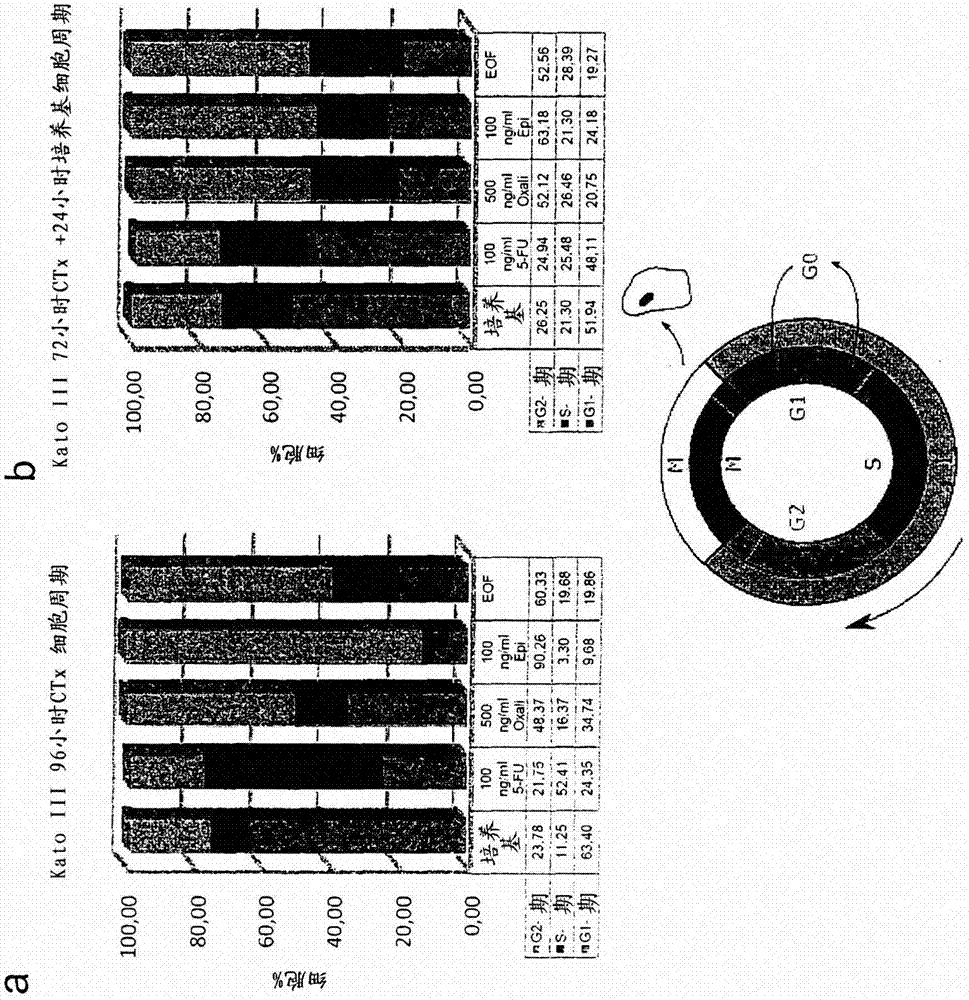
实施例1:通过用化学治疗剂进行体外处理来稳定人胃癌细胞系的cldn18.2表达
在含有或不含细胞抑制化合物的情况下,在37℃和5%co2下,在含有20%fcs(perbio)和2mmglutamax(invitrogen)的rpmi1640培养基(invitrogen)中培养katoiii细胞(人胃癌细胞系)。在10或100ng/ml的浓度下测试表柔比星(pfizer),在10或100ng/ml的浓度下测试5-fu(来自neocorpag的neofluor),并在50或500ng/ml的浓度下测试奥沙利铂(hospira)。还使用全部3种化合物的组合(eof:表柔比星10ng/ml、奥沙利铂500ng/ml、5-fu10ng/ml)。在37℃和5%co2下,在6孔组织培养板中将8×105个katoiii细胞培养96小时而不更换培养基,或者培养72小时后在标准培养基中培养24小时,从而从细胞周期停滞释放细胞。用edta/胰蛋白酶收集细胞、洗涤并分析。
为了进行cldn18.2的细胞外检测,用单克隆抗cldn18.2抗体imab362(ganymed)或同种型匹配的对照抗体(ganymed)对细胞进行染色。使用来自dianova的山羊抗huigg-apc作为第二试剂。
基于细胞dna含量的测量值来确定细胞周期时相。这样使得人们能够区分处于细胞周期g1期、s期或g2期的细胞。在s期,dna复制发生,而在g2期,细胞生长并且为有丝分裂作准备。按照制造商的方案,使用来自bdbiosciences的cycletestplusdna试剂盒进行细胞周期分析。使用bdfacscantoii(bdbiosciences)和flowjo(treestar)软件进行流式细胞术获取和分析。
图1a和1b中的栏示出了处于细胞周期g1期、s期或g2期之细胞各自的百分比。经培养基培养的katoiii细胞显示出主要在g1期的细胞周期停滞。用5-fu处理的细胞主要被阻断在s期。经表柔比星或eof处理的katoiii细胞显示出主要在g2期的细胞周期停滞。经奥沙利铂处理的katoiii细胞显示出细胞主要在g1期和g2期富集。由图1c中可见,s期或g2期中的细胞周期停滞导致cldn18.2稳定或上调。细胞只要从细胞周期的任意阶段释放(图1b),katoiii细胞之细胞表面上的cldn18.2表达就上调(图1d)。
利用5-fu+ox(10ng/ml5-fu和500ng/ml奥沙利铂)、eof(10ng/ml表柔比星、500ng/ml奥沙利铂和10ng/ml5-fu)或flo(10ng/ml5-fu、50ng/ml亚叶酸和500ng/ml奥沙利铂)处理nugc-4和katoiii细胞,持续96小时。分离经化学治疗预治疗的nugc-4和katoiii细胞的rna并将其转变为cdna。用定量实时pcr分析cldn18.2的转录水平。结果以与管家基因hprt转录水平相比较的相对表达示于图2a中。图2b示出了未经处理的和经处理的nugc-4细胞的cldn18.2western印迹和肌动蛋白内参对照。发光信号的强度以关于肌动蛋白的百分比示出。
用eof、flo以及5-fu+ox组合化学治疗对nugc-4和katoiii细胞进行预处理导致cldn18.2的rna和蛋白质水平增加,如同通过定量实时pcr(图2a)和western印迹(图2b)所示出的那样。
通过流式细胞术分析结合在经eof(10ng/ml表柔比星、500ng/ml奥沙利铂和10ng/ml5-fu)或flo(10ng/ml5-fu、50ng/ml亚叶酸和500ng/ml奥沙利铂)处理96小时之nugc-4和katoiii胃癌细胞上的imab362。如图2c中所示出的那样,胃癌细胞系表面上imab362可靶向的cldn18.2蛋白的量有所增加。该作用在经eof或flo预处理的细胞中最突出。
用伊立替康或多西他赛将katoiii细胞预处理4天,并对其cldn18.2表达和细胞周期停滞进行分析。用伊立替康处理细胞导致剂量依赖性抑制细胞生长和细胞周期在s/g2期停滞(图3)。用多西他赛处理细胞导致剂量依赖性抑制细胞生长和细胞周期在g2期停滞(图3)。
实施例2:用化学治疗剂预处理人胃癌细胞导致更高效力的imab362介导的adcc
使用nugc-4胃癌细胞作为靶细胞来研究imab362介导的adcc,用10ng/ml5-fu和500ng/ml奥沙利铂(5-fu+ox)、10ng/ml表柔比星、500ng/ml奥沙利铂和10ng/ml5-fu(eof)或10ng/ml5-fu、50ng/ml亚叶酸和500ng/ml奥沙利铂(flo)预处理所述细胞96小时(效应细胞:靶标比40:1)或不做处理。从7个健康供体获得未经处理的和经eof、flo或5-fu+ox预处理之nugc-4细胞的ec50值。
如图4a所示,与未经处理的靶细胞相比,经预处理的细胞的剂量/应答曲线向上并向左移动。这导致更高的最大裂解并且ec50值降低至未经处理的细胞的三分之一(图4b)。
通过ficollhypaque密度离心纯化来自健康人供体的外周血单核细胞(pbmc),包括nk细胞、单核细胞、单核的细胞或其它效应细胞。将经洗涤的效应细胞接种于x-vivo培养基中。在该环境下,使用内源表达cldn18.2并且来源于胃的katoiii细胞作为靶细胞。靶细胞稳定地表达荧光素酶和仅被活细胞氧化的荧光黄。添加不同浓度的纯化抗cldn18.2抗体imab362,并使用不相关的嵌合hulgg1抗体作为同种型对照抗体。通过测量由荧光黄氧化产生的荧光来测定样品的细胞溶解,其为imab362诱导细胞毒性后剩余之活细胞的量的值。将经伊立替康(1000ng/ml)、多西他赛(5ng/ml)或顺铂(2000ng/ml)预处理3天的katoiii与未经处理的培养基培养的靶细胞进行比较,并对imab36诱导的adcc进行量化。
与培养基培养的靶细胞相比,经伊立替康、多西他赛或顺铂预处理3天的katoiii显示出更低水平的活细胞(图5a),并且与培养基培养的细胞相比,经伊立替康、多西他赛或顺铂预处理的细胞中密蛋白18.2表达增加(图5b)。
此外,用伊立替康、多西他赛或顺铂预处理katoiii细胞增强了imab362诱导adcc的效力(图5c和5d)。
实施例3:化学治疗导致更高功效的imab362诱导的cdc
通过用10ng/ml5-fu和500ng/ml奥沙利铂(5-fu+ox)将katoiii胃癌细胞预处理48小时来分析化学治疗剂对imab362诱导的cdc的作用。使用经化学治疗剂预处理的katoiii细胞产生的imab362诱导之cdc的代表性剂量应答曲线示于图6中。将肿瘤细胞预处理48小时增强了imab362诱导cdc的效力,从而导致与未经处理的细胞相比,经预处理的肿瘤细胞更高的最大细胞裂解。
实施例4:免疫效应细胞进行imab362介导的adcc的能力不因用化学治疗剂处理而被损害
eof或flo方案中使用的化学治疗剂高度有效地抑制靶细胞增殖。为了研究化学治疗对效应细胞的不良作用,用10ng/ml表柔比星、500ng/ml奥沙利铂和10ng/ml5-fu(eof)或10ng/ml5-fu、50ng/ml亚叶酸和500ng/ml奥沙利铂(flo)处理来自健康供体的pbmc72小时,然后应用于adcc测定中。图7a示出了4个健康供体的ec50值,而图7b示出了用eof或flo预处理的效应细胞之imab362诱导的adcc的代表性剂量/应答曲线。nugc-4胃癌细胞之imab362诱导的adcc不会因eof或flo化学治疗而受到损害。
实施例5:za/il-2处理的组合导致外周血单核细胞(pbmc)培养物最佳地扩增
在体外,对za/il-2对pbmc培养物增殖的作用进行评价。从健康人供体采集pbmc,并用单次剂量的za处理培养物。每3至4天添加il-2。具体地,将来自3个不同健康人供体(#1、#2和#3)的pbmc在含有1μmza加高(300u/ml)或低(25u/ml)剂量的il-2的rpmi培养基中(1×106个细胞/ml)培养14天;参照图8a。另外,将相同供体的pmbc在含有300u/mlil-2的加/不加za的rpmi培养基中再培养14天;参照图8b。通过在第6、8、11和14天对活细胞进行计数来确定细胞数目的增加。
与补充低剂量的il-2的培养物相比,在补充高剂量的il-2的培养基中,细胞扩增了约2至5倍多(图8a)。与含za培养基中的细胞生长相比,不含za培养基中的细胞扩增低大约2倍(图8b)。这些数据表明必须组合施加za和il-2二者从而确保细胞的适当扩增。
实施例6:za/il-2处理导致pbmc培养物中vγ9vδ2t细胞大量扩增
在补充有300u/mlil-2并且含有或不含1μmza的rpmi培养基中将pbmc培养14天。在第0天和第14天,通过多色facs测定vγ9+vδ2+t细胞在cd3+淋巴细胞群中的百分比(图9a)和cd16+细胞在cd3+vγ9+vδ2+t细胞群中的百分比(图9b)。将每个供体的结果记录在散点图中。图9c示出了表示cd3+vγ9+vδ2+和cd3+cd16+vγ9+vδ2+t细胞的数目在淋巴细胞群中随时间增加(富集)的散点图。将接种第0天的细胞量和第14天收集的细胞量考虑在内。
需要在pbmc培养物中添加il-2用于淋巴细胞的存活和生长。所述淋巴细胞在补充300u/mlil-2的培养物中有效扩增。使用vγ9和vδ2特异性抗体进行的facs分析表明添加za/il-2特异性地诱导vγ9vδ2t细胞的累积(图9a)。14天后,cd3+淋巴细胞群可占vγ9vδ2t细胞的高达80%。一部分vγ9vδ2t细胞表达cd16,而根据供体,这些细胞在cd3+淋巴细胞群中的富集为10至700倍(图9b和9c)。与不含za情况下生长的培养物相比,cd16+vγ9+vδ2+t细胞在培养物中的富集高10至600倍(图9c)。我们认为体外za/il-2处理pbmc导致adcc介导fcγiii受体cd16在显著比例的γδt细胞中上调。
实施例7:il-2以剂量依赖性方式影响vγ9vδ2t细胞扩增
培养物中za的添加为诱导vγ9vδ2t细胞产生的最重要因素。众所周知,t细胞的生长和存活需要il-2。
将在补充有1μmza和浓度增加的il-2的rpmi培养基中将pbmc培养14天。在第0天和第4天添加il-2。在第0天和第14天,通过多色facs染色来确定cd16+vγ9+vδ2+t细胞在cd3+淋巴细胞群中的富集。用600u/mlil-2培养后,将收集的cd16+vγ9+vδ2+t细胞的量设定为100%以比较不同供体;参照图10(左图)。此外,对在浓度增加的il-2中生长14天之分离的培养物的adcc活性进行测试;参照图10(右图)。
通过剂量应答分析,我们确定il-2还刺激vγ9vδ2t细胞亚群的生长和存活。通过在培养基中添加低浓度的il-2,发现il-2剂量和cd16+vγ9vδ2t细胞在cd3+淋巴细胞群中的百分比相关(图10,左图)。与在低浓度il-2下生长的细胞相比,在较高浓度il-2(150-600u/ml)中生长之细胞的adcc活性得到改善(图10,右图)。
实施例8:za在都刺激vγ9vδ2t细胞扩增的单核细胞和癌细胞中诱导ipp产生
将新鲜的pbmc(实验#1)或经za/il-2刺激14天的vγ9vδ2t细胞培养物(实验#2至5)(无单核细胞,效应细胞∶单核细胞比为1∶0)与0.2倍(4∶1)或5倍(比1∶4)量的单核细胞±1μmza孵育。14天后,通过多色facs确定共培养物中vγ9vδ2t细胞的富集,而将培养物的扩增考虑在计算内。对于每个实验,将与单核细胞以1∶4的比培养的vγ9vδ2t细胞的富集因子设定为100%。培养物中单核细胞的增加导致vγ9vδ2t细胞富集多于10倍。该作用明显为za依赖性的;参照图11a。
此外,用5μmza预处理人胃癌细胞(nugc-4-荧光素酶)和鼠胃癌细胞(cls103-钙荧光素染色)2天,或不做处理。对人vγ9vδ2t细胞(第14天)进行macs纯化并与癌细胞共培养24小时。通过测量剩余的荧光素酶活性或钙荧光素荧光来确定vγ9vδ2t细胞对未经za处理的或经za处理的靶细胞的细胞毒性;参照图11b。靶细胞(nugc-4和cls103)用5μmza预处理2天,或不做处理,之后与丝裂霉素c(50mi)孵育4小时以使增殖停止。添加经macs纯化的人14日龄vγ9vδ2t静息细胞和3h-胸腺嘧啶核苷至靶细胞并于37℃下孵育共培养物48小时。通过使用microbeta闪烁计数器测量dna中3h-胸腺嘧啶核苷的掺入来确定增殖。将未经za处理的靶细胞和无vγ9vδ2t细胞的增殖设定为100%;参照图11c。
如图11b和11c所示,就细胞毒性(5至10倍)和增殖(1.4至1.8倍)方面而言,经za脉冲处理的人癌细胞活化了vγ9vδ2t细胞,而鼠癌细胞系cls103未能引发对vγ9vδ2t细胞的这些效果。
实施例9:za/il-2处理影响pbmc培养物的组成
pbmc培养物中特定细胞类型的生长和分化取决于细胞因子的存在。这些组分被添加至培养基中(例如,血清中存在的生长因子,il-2)或由免疫系统自身分泌。进化(evolve)为何种类型的细胞还取决于pbmc的初始组成和先天遗传(geneticendowment)。在存在300u/mlil-2以及有或没有1μmza的情况下,培养10个不同供体的pbmc14天来分析效应细胞(nk细胞和vγ9vδ2t细胞)中的总体增加。使用cd3、cd16、cd56、vγ9和vδ2抗体,通过多色facs染色来鉴定淋巴细胞群中效应细胞的量。cd3-cd56+cd16+细胞表示nk细胞,而cd3+vγ9+vδ2+表示vγ9vδ2t细胞。
多色facs分析表明用il-2处理后,主要是nk细胞发育,而在经za/il-2处理的培养物中,vγ9vδ2t细胞明显地扩增(图12)。
实施例10:za/il-2处理产生vγ9vδ2+效应记忆t细胞
可借助于两种表面标志物,常见的淋巴细胞抗原cd45ra的高分子量同工型和趋化因子受体ccr7来描述t淋巴细胞的亚群。ccr7+幼稚和中枢记忆(cm)t细胞的特征在于其能够在淋巴结中重复循环并且遇到抗原。相比之下,效应记忆(em)和效应t淋巴细胞ra+(temra)使ccr7下调,并似乎专门移动至外周非淋巴样组织,例如,移动至被感染的部位或肿瘤部位。基于cd27和cd28的差别表达,em细胞还可被进一步细分。cd28和cd27表面表达逐渐丧失与细胞之细胞溶解能力的上调伴随存在。此外,cd57的水平与粒酶和穿孔蛋白的表达有关,并因此代表显示细胞毒性/细胞成熟的第三标志物。
用300u/mlil-2以及有或灭有1μmza下培养pbmc14天。在第0天(pmbc)和第14天,通过多色facs分析来确定不同表面标志物的表达。幼稚细胞为cd45ra+ccr7+,中枢记忆细胞(cm)为cd45ra-ccr7+,temra为cd45ra+ccr7-,并且效应记忆细胞(em)对两种标志物均为阴性;参照图13a。而且,通过对cd27和cd57标志物染色来确定vγ9vδ2t细胞的细胞溶解活性;参照图13b和13c。此外,通过用cd16(抗体结合)和cd56(粘附)对cd3+细胞进行染色来分析对adcc活性重要的nk细胞样特征的发生;参照图13d。
vγ9vδ2t细胞的多色facs分析表明za/il-2处理明显刺激em型(cd27-和cd57+)的vγ9vδ2t细胞发育(图13b至13c)。除了增强的细胞溶解活性之外,还观察到cd3+群中cd16和cd56水平的增加,这可从adcc中涉及的nk细胞(cd3-cd16+cd56+)得知(图13d)。
总而言之,这些数据表明za处理pbmc导致cd16+vγ9+vδ2+效应记忆t细胞的发育,其能够迁移至外周非淋巴样组织并且显示出具有高细胞溶解活性的标志物。与imab362肿瘤靶向抗体组合,这些细胞被极好地利用来迁移从而靶向和杀伤肿瘤细胞。
实施例11:经za/il-2扩增的vγ9vδ2t细胞是imab362介导的cldn18.2依赖性adcc的有效效应物
与nk细胞类似,经za/il-2扩增的vγ9vδ2t细胞对cd16呈阳性(参见图9和13),cd16是通过其细胞结合抗体触发adcc的fcγriii受体。已进行了一系列实验来评价vγ9vδ2t细胞与imab362联合是否能够诱导有效的adcc。
将来自2个不同供体(#1和#2)的pmbc培养于含有300u/mlil-2以及有或没有1μmza的培养基中。14天后,收集细胞,并与浓度逐渐增加(0.26ng/ml至200μg/ml)的imab362一起被添加至表达cldn18.2的nugc-4细胞。在荧光素酶测定中确定特异性杀伤;参照图14a。图14b和14c给出了用生长于300u/mlil-2以及有或没有1μmza中的27个供体进行的adcc测定的概图。nugc-4用作靶细胞。对于每个供体,由剂量-应答曲线计算ec50值(b)并且将在200μg/mlimab362剂量下的最大特异性杀伤率(c)记录在散点图中。
使用经za/il-2培养14天的pbmc观察到针对cldn18.2阳性nugc-4细胞具有强imab362依赖性的adcc活性(图14a)。使用经za/il-2处理的pbmc培养物,adcc取决于vγ9vδ2t细胞的存在(图12和15)。如果在不含za的情况下培养细胞,则对于大多数供体,adcc活性降低。在这些培养物中,残留的adcc活性为nk细胞依赖性的(图11和14)。通过测试多于20个供体,adcc测定表明与仅用il-2培养的pbmc相比,za/il-2处理的pbmc的ec50和最大特异性杀伤率均有所改善。
此外,用1μmza和300u/mlil-2培养两个不同供体(#1+#2)的pbmc。将这些效应细胞培养物与cldn18.2阳性(nugc-4、katoiii)和阴性(sk-br-3)人靶细胞系(e∶t比40∶1)一起用于adcc测定中。添加逐渐增加量(0.26ng/ml至200μg/ml)的imab362抗体。在荧光素酶测定中测量adcc;参照图15a。用在不同时间点从经za/il-2处理的培养物中收集的nugc-4靶细胞和效应细胞进行如(a)所述的相同实验;参照图15b。使用nugc-4作为靶细胞进行与(a)中所述相同的实验;参照图15c。直接使用经za/il-2扩增的细胞或使用tcrγδmacs分选(miltenyibiotech)从培养物纯化的vγ9vδ2t细胞。在淋巴细胞中获得纯度超过97.0%的vγ9vδ2t细胞。
观察到了针对cldn18.2阳性人肿瘤细胞系,而不是cldn18.2阴性人肿瘤细胞系的强adcc活性(图15a)。此外,用同种型对照抗体未获得adcc活性(未示出)。在za/il-2处理过程中,对于一部分供体,adcc裂解活性随时间增加(图15b)。imab362的剂量/效应曲线向上并向左移动表现出随时间改善的ec50值和最大裂解速率。与未经处理的pbmc相比,通过za/il-2处理富集的vγ9vδ2效应t细胞能够达到cldn18.2阳性靶细胞的更高最大杀伤率,而且对于同样的杀伤率,它们需要更低浓度的imab362。
为了确定vγ9vδ2t细胞是裂解活性的储存库(reservoir),在第14天,通过磁性细胞分选从经za/il-2培养的pbmc群分离出纯度>97%的这些细胞。由于更高的纯度,与imab362联合的adcc活性得到保留并且部分地有所提高。这些数据证实vγ9vδ2t细胞主要负责adcc活性,所述活性用14日龄pbmc培养物可观察到(图15c)。
实施例12:用za/il-2处理靶细胞系不影响cldn18.2的表面表达
imab362触发的作用模式严格依赖于细胞外可检测到cldn18.2的存在和量。因此,使用内源表达cldn18.2的nugc-4和katoiii细胞系,通过流式细胞术来分析za/il-2处理对cldn18.2表面密度的影响。具体地,对经za/il-2或za/il-2+eof或za/il-2+5-fu/ox预处理72小时的未经透化之nugc-4胃癌细胞上结合的imab362进行流式细胞术分析。
在体外进行的za/il-2处理揭示cldn18.2表面定位的量未变化;参照图16。
实施例13:通过za/il-2处理pbmc增加imab362介导的adcc不被eof预处理损害
化学治疗剂损害细胞增殖。相比之下,za/il-2处理触发vγ9vδ2t细胞扩增。为了分析这些对立的相互作用对效应细胞的影响,将6个健康供体的pbmc与za/il-2或za/il-2+eof培养8天,然后应用于adcc测定中(e∶t比15∶1)。确定导致未经处理nugc-4靶细胞50%的adcc介导之裂解的imab362浓度(ec50)。
由于用za/il-2处理pmbc,nugc-4细胞的imab362诱导的adcc增强,所述增强不由pbmc与eof的组合处理而显著改变(图17)。
实施例14:在裸鼠中,体内imab362靶向cldn18.2阳性肿瘤以及imab362对人肿瘤细胞异种移植物的抗肿瘤作用
为了研究imab362的体内肿瘤细胞靶向,将80μg
此外,imab362用于处理具有cldn18.2阳性异种移植肿瘤的裸鼠。进行早期处理模型研究(早在肿瘤细胞接种后的3天施用imab362)。此外,在肿瘤细胞接种后多至9天,当肿瘤体积达到约60至120mm3时,开始晚期肿瘤处理实验。
经皮下向裸鼠接种1×107个hek293~cldn18.2转染子。在接种肿瘤后3天开始处理每组10只小鼠。交替进行静脉内和腹膜内施用途径,用200μgimab362、英夫利昔单抗作为同种型对照和pbs处理小鼠,每周两次,持续6周。虽然用pbs或同种型对照处理的组中的所有小鼠均在70至80天内死亡,但是用imab362处理的动物具有生存益处(图19)。不仅死亡时间延长,而且在210天的整个观察期间,十分之四的小鼠存活下来。
当平均肿瘤体积达到88mm3(62至126mm3)时,开始每组9至10只小鼠的处理。在处理之前,将小鼠分成测试组以保证所有组中具有相当的肿瘤大小。交替进行静脉内和腹膜内施用途径,用200μgimab362、同种型对照或pbs处理小鼠,每周两次,持续6周。用pbs或同种型对照处理的组中的所有小鼠均在50至100天内死亡。用imab362处理的动物具有生存益处,具有将近加倍的中值存活(47天对25天)。在整个观察期间,这些小鼠中有三只存活下来(图20)。重要地是,体内抗肿瘤功效取决于肿瘤细胞上靶标的存在。在用cldn18.2阴性hek293肿瘤细胞移入的小鼠中未见imab362处理的抗肿瘤作用。
使用nugc-4胃肿瘤模型来研究imab362对具有cldn18.2内源表达之癌细胞的功效。nugc-4细胞在裸鼠中积极地生长。
经皮下注射1×107个nugc-4胃癌细胞至无胸腺裸鼠的左胁腹中(imab362组n=9,对照组n=8)。在经静脉内注射接种肿瘤后6天开始每周两次交替静脉内和腹膜内施加imab362(200μg每次注射)和对照。每周两次监视肿瘤大小。图21a中示出的数据为平均值和sem。与用对照处理过的小鼠相比,经imab362处理的小鼠的肿瘤生长被显著抑制(*p<0.05)。图21b示出了接种肿瘤后第21天的肿瘤体积。经imab362处理过的小鼠的肿瘤体积显著小于对照小鼠的肿瘤(*p<0.05)。
当接种1×107个肿瘤细胞于小鼠时,未经处理小鼠的中值存活不超过25天。当肿瘤体积达到约109mm3的平均大小(63mm3至135mm3)时,开始用imab362、西妥昔单抗、曲妥珠单抗或同种型以及缓冲对照处理。根据大小,将小鼠划分处理组(图21)。imab362显示出显著降低肿瘤生长速率。与盐水或抗体对照相比,所述积极生长的肿瘤模型中未观察到肿瘤生长的显著降低。肿瘤生长的延迟与经imab362处理过的小鼠非显著增加的中值存活有关(31天对25天)。
用两个人胃癌异种移植模型,使用具有imab362靶向cldn18.2(nci-n87~cldn18.2和nugc-4~cldn18.2)慢病毒转导的nci-n87或nugc-4细胞检测imab362的抗肿瘤活性。
通过向每处理组的8只裸鼠肋腹(雌性,6周龄)注射1×107个nci-n87~cldn18.2细胞皮下接种nci-n87~cldn18.2异种移植肿瘤。在接种肿瘤后5天,通过静脉内注射800μgimab362或用200μl0.9%nacl作为盐水对照组开始处理。在整个观察时间内,每周继续静脉内施用。每半周监测肿瘤大小和动物健康状况。图22a示出了imab362处理对肿瘤生长的作用。每周两次测量皮下肿瘤的大小(平均值+sem,***p<0.001)。图22b示出了kaplan-meier存活曲线。当肿瘤体积达到1400mm3时,处死小鼠。
因此,持续的imab362处理高度显著(p<0.001)抑制nci-n87~cldn18.2胃癌异种移植物的肿瘤生长(图22a)。肿瘤生长中的延迟与imab362处理过的小鼠显著(p<0.05)更长的存活时间相关(图22b)。
imab362免疫治疗迅速生长的nugc-4~cldn18.2异种移植物导致在处理的第14天显著(p<0.05)更小的肿瘤大小。在第一个两周imab362处理后,nugc-4~cldn18.2的肿瘤发展非常积极。然而,抑制nugc-4~cldn18.2肿瘤生长直至处理的第14天导致经imab362处理过的小鼠具有显著(p<0.05)更久的存活。
总之,imab362对治疗胃癌异种移植物是高度有效的,在内源cldn18.2阳性肿瘤模型中,表现为显著延迟肿瘤发展和延长存活。在非常积极的肿瘤模型系统中,imab362的这些抗肿瘤作用稍不明显,但是尽管如此,也是显著的,强调了imab362的强抗肿瘤能力。
实施例15:与化学治疗组合的imab362在小鼠肿瘤模型中的抗肿瘤作用
在体外,imab362介导的adcc对经化学治疗剂组合(包括eof和5-fu+ox)预处理过的人胃癌细胞更有效。因此,在小鼠肿瘤模型中,体内研究了这些化合物与imab362组合的抗肿瘤作用。
通过向每处理组9只小鼠的胁腹皮下注射1×107个nci-n87~cldn18.2细胞来接种nci-n87~cldn18.2异种移植肿瘤。在接种肿瘤后第4、11、18和25天,根据eof方案,用1.25mg/kg表柔比星、3.25mg/kg奥沙利铂和56.25mg/kg5-氟尿嘧啶腹膜内处理具有肿瘤的小鼠,然后,在施用化学治疗后24小时,静脉内注射800μgimab362。每周继续imab362处理。每半周监测肿瘤大小和动物健康状况。图23a示出了组合治疗对肿瘤生长的作用。每周两次测量皮下肿瘤的大小(平均值+sem;*p<0.05)。图23b示出了kaplan-meier存活曲线。当肿瘤达体积达到1400mm3时,处死小鼠。
与对照小鼠相比,用imab362或eof方案处理的具有nci-n87~cldn18.2肿瘤的裸鼠表现出被高度显著抑制的肿瘤生长。与仅用eof方案处理相比,额外的imab362处理与eof化学处理组合导致显著(p<0.05)更高的肿瘤生长抑制(图23a)。盐水对照组中小鼠的中值存活为59天。每周imab362处理小鼠显著延长中值存活至76天,类似于eof组中小鼠的存活(同样具有76天的中值存活)。但是用imab362和eof组合处理将中值存活增加至81天(图23b)。
通过向每处理组的10只裸鼠(雌性,6周龄)的胁腹皮下注射1×107个nugc-4~cldn18.2细胞来接种异种移植肿瘤。在第3、10、17和24天,用化学处理剂处理小鼠。每周继续imab362处理。图24a示出了皮下nugc-4~cldn18.2异种移植物的肿瘤生长曲线(平均值+sem)。图24b示出了kaplan-meier存活曲线(log-rank(mantel-cox)检验,**p<0.01)。
皮下nugc-4~cldn18.2异种移植肿瘤非常积极地生长。然而,与盐水处理的对照组相比,imab362处理具有肿瘤的裸鼠显著抑制肿瘤生长。在用eof的组合治疗中,由eof处理产生的生长抑制掩盖了imab362对nugc-4~cldn18.2肿瘤生长的作用,表现为与仅用eof处理相比,肿瘤生长抑制未增加(图24a)。然而,与仅用eof处理的小鼠的存活相比,用imab362和eof方案处理的小鼠的中值存活高度显著地(p<0.01)延长(图24b)。
实施例16:在体内,za/il-2扩增的vγ9vδ2t细胞改善晚期肿瘤的imab362介导控制
我们采用nsg小鼠来研究在小鼠系统中γδt细胞产生的imab362和za/il-2的组合活性。nsg小鼠缺少成熟t细胞、b细胞、天然杀伤(nk)细胞和多个细胞因子信号途径,并且它们的先天免疫中存在很多缺陷,而初次免疫和二次免疫组织中的小生境(niche)允许通过人免疫细胞群集。
用1×107个经cldn18.2转染的hek293细胞皮下接种nsg小鼠。在同一天,小鼠接受8×106个通过在补充za的培养基中培养14天的vγ9vδ2t细胞富集的人pbmc。此外,对小鼠注射50μg/kgza和5000uil-2(proleukin)。每半周施用il-2,并且每周施用za以保持人t细胞的功能。当hek293~cldn18.2变得肉眼可见时,开始每半周用200μgimab362处理。除了所述处理的9只小鼠外,建立小鼠的两个对照组。一组不接受人γδt细胞,另一组用同种型对照抗体代替imab362处理。在存在人γδt细胞和za的情况下,用imab362处理的小鼠中cldn18.2阳性肿瘤的派生(outgrowth)被显著抑制,几乎消失,然而,在用同种型对照抗体处理的或缺少人t细胞效应物的小鼠中,肿瘤积极地生长并且小鼠不得不过早死亡(图25)。
实施例17:在小鼠肿瘤模型中imab362与化学治疗组合的抗肿瘤作用
利用鼠cldn18.2慢病毒转导的cls-103细胞(cls-103~cldnl8.2)来检测imab362与化学治疗组合在免疫活性远系繁殖nmri小鼠的皮下胃癌同种异体移植物中的抗肿瘤活性。
通过向每处理组的10只nmri小鼠的胁腹皮下注射1×106个cls-103~cldnl8.2细胞来接种cls-103~cldnl8.2同种异体移植肿瘤。在接种肿瘤后第3、10、17和24天,用1.25mg/kg表柔比星、3.25mg/kg奥沙利铂和56.25mg/kg5-氟尿嘧啶(eof)腹膜内处理具有肿瘤的小鼠,然后,在施用每个化学治疗后24小时,静脉内注射800μgimab362。每半周通过皮下注射3000ie来施用il-2。整个观察期间,在化学治疗结束后继续进行imab362和il-2处理。每半周监测肿瘤大小和动物健康状况。当肿瘤达体积达到1400mm3或肿瘤变成溃疡性时,处死小鼠。
由图26可见,与盐水对照组相比,仅用imab362或eof处理具有cls-103~cldnl8.2肿瘤的nmri小鼠未显现出显著的肿瘤增长抑制。相反,eof化学治疗和imab362处理的组合导致显著更高的肿瘤生长抑制作用并且延长具有肿瘤之小鼠的存活。这些观察结果表明eof化学治疗和imab362免疫治疗的组合存在附加的或甚至协同的治疗作用。il-2处理未显示出对肿瘤生长的作用。
保藏微生物或其他生物材料的证明
(细则13之二)
表pct/ro/134(1998年7月;2004年1月重印)
新国际专利申请
ganymedpharmaceuticalsag等
“用于治疗癌症的涉及针对密蛋白18.2之抗体的联合治疗”
我方卷号:342-71pct
生物材料的附加页
其他保藏物的证明
1)保藏物(dsmacc2738、dsmacc2739、dsmacc2740、dsmacc2741、dsmacc2742、dsmacc2743、dsmacc2745、dsmacc2746、dsmacc2747、dsmacc2748)的保藏单位的名称和地址:
dsmz-德国微生物菌种保藏中心
mascheroderweg1b
38124brauschweig
de
2)保藏物(dsmacc2808、dsmacc2809、dsmacc2810)的保藏单位的名称和地址:
dsmz-德国微生物菌种保藏中心
inhoffenstr.7b
38124brauschweig
de
对所有上文提到保藏物的其他说明:
-与小鼠(musmusculus)脾细胞融合的小鼠(musmusculus)骨髓瘤p3x63ag8u.1
-分泌针对人密蛋白18a2抗体的杂交瘤
3)保藏人:
所有上述保藏物均由以下保藏人进行:
加尼梅德药物公司(ganymedpharmaceuticalsag)
freiligrathstraβe12
55131mainz
de
- 还没有人留言评论。精彩留言会获得点赞!