猪流行性腹泻病毒减毒活疫苗壳聚糖微球的制备方法及其应用与流程
本发明涉及生物医药领域,具体地指一种猪流行性腹泻病毒减毒活疫苗壳聚糖微球的制备方法及其应用。
背景技术:
猪流行性腹泻(ped)是由猪流行性腹泻病毒(pedv)引起的一种急性、高度传染性肠道疾病,新生仔猪的发病率和死亡率都接近100%,给养猪业造成巨大经济损失(sunetal.,eid,2012)。其临床特征主要表现是仔猪呕吐、严重腹泻和脱水;pedv感染猪,剖检病理变化主要表现为猪的空肠和回肠部分的肠绒毛的萎缩和脱落(pensaertandyeo,2006)。ped对猪的危害很大,各种年龄的猪均可发病,但对哺乳仔猪的危害最为严重,20日龄以内仔猪死亡率达95%以上(timoneyjfetal.,1988)。
目前,ped仍在世界范围内广泛流行。在欧洲各国,ped较以前的流行程度已明显降低,但是在亚洲猪场中pedv的感染率非常高,尤其是在韩国、日本和中国等,pedv与tgev有相似的临床症状,致病机理也极为相似,但是pedv的感染率明显高于tgev和猪轮状病毒(porv)。
ped的防控,主要是以疫苗免疫预防为主。目前,ped商业化的疫苗主要是灭活苗和弱毒苗两种,灭活疫苗具有安全、稳定的优点,但由于灭活疫苗具有需要大剂量接种或者应用浓缩抗原;免疫期短,常需强化接种;不能引起局部免疫,以致细胞免疫的作用弱;产生完全免疫力需要2周;不利于紧急预防接种与降低疫苗费用等缺点,使得ped弱毒疫苗成为了研究的热。
目前,ped的商品化弱毒疫苗主要有我国的cv777株,日本的p-5v株和韩国的kped-9株、dr13株。在中国,用来预防猪流行性腹泻的活疫苗毒株主要是cv777疫苗毒株,但2006年我国报道的ped疫苗免疫猪场不能提供完全的保护(chenjfetal.,2010),近期的研究也发现我国变异毒株占主导地位(gaoyetal.,2013)。2011年由猪流行性腹泻变异毒株引起的腹泻在cv777弱毒活疫苗免疫猪场暴发,表明传统cv777弱毒疫苗免疫已经不能有效地预防变异毒株所造成的腹泻,而当今变异毒株引起的ped在世界范围类肆掠,所以通过pedv临床分离到的变异毒株开发安全、高效、廉价的变异毒株来源的pedv弱毒疫苗是世界养猪业的迫切需要。
pedv主要在肠粘膜表面启动其感染周期,因此刺激肠道黏膜产生特异性siga,成为防制本病发生和研制ped疫苗关键的问题(binlietaletal.,2017)。然而,现有的商业化灭活苗和弱毒苗在注射免疫后,只能诱导体液免疫应答,不能激活黏膜免疫系统,即使有较高的血清抗体滴度,仍不能阻止病原经黏膜入侵体内,因而免疫效果不佳。口服疫苗与注射疫苗相比,有着方便、应激少、能够激起黏膜免疫等诸多优势,而成为研究的热点(mohammadetal,2012)。ped口服疫苗策略是使妊娠晚期母猪获得免疫,新生仔猪通过哺乳的方式,从乳汁中摄取siga从而获得被动免疫来抵御病毒入侵(stephanien.langeletaletal.,2016)。由于现有ped口服疫苗经过胃内的复杂环境后,效果有所下降。
因此,急需一种新型ped疫苗的发展应当着力于加强妊娠母猪的粘膜免疫,提供持续的免疫刺激,从而使仔猪获得更有效和长久的免疫保护。
技术实现要素:
本发明目的是针对现有技术的不足,提供了一种猪流行性腹泻病毒减毒活疫苗壳聚糖微球的制备方法及其应用。
为实现上述目的,本发明提供的一种猪流行性腹泻病毒减毒活疫苗壳聚糖微球的制备方法,包括以下步骤:
1)将猪流行性腹泻病毒弱毒株pedv-yn144培养,得到病毒液;然后离心过滤去除细胞碎片和其它杂质,得到病毒滤液,其中,病毒滤液中病毒含量大于等于106tcid50/ml,且小于等于108tcid50/ml;
2)将壳聚糖加入体积浓度为1%~5%的乙酸溶液,超声溶解;即得到壳聚糖溶液;其中,壳聚糖溶液的浓度为0.5~5mg/1ml;
3)按体积比3∶3~20∶0.060~0.070∶1~20量取壳聚糖溶液、病毒滤液、碳酸氢钠溶液和三聚磷酸钠溶液;其中,碳酸氢钠溶液的浓度为60~100mg/ml,三聚磷酸钠溶液的浓度为0.3~2.0mg/ml;
4)向病毒滤液中碳酸氢钠溶液,在磁力搅拌条件下缓慢滴加壳聚糖溶液;再缓慢滴加三聚磷酸钠溶液;在室温、转速为1000~1500rpm条件下磁力搅拌8~15min;得到混合液;
5)按体积比1∶3~5将明胶与混合液混匀,冷冻干燥即得到猪流行性腹泻病毒减毒活疫苗壳聚糖微球。
进一步地,所述病毒滤液中,病毒含量为106tcid50/100ml。
再进一步地,所述步骤2)中,壳聚糖溶液的浓度为3mg/ml,所述乙酸溶液体积浓度为3%。
再进一步地,所述步骤3)中,壳聚糖溶液、病毒滤液、碳酸氢钠溶液和三聚磷酸钠溶液的体积比为:3∶15∶0.067∶1
再进一步地,所述步骤3)中,碳酸氢钠溶液的浓度为96g/ml,三聚磷酸钠溶液的浓度为0.5mg/ml。
再进一步地,所述步骤4)中,转速为1200rpm条件下磁力搅拌10min.。
再进一步地,所述猪流行性腹泻病毒减毒活疫苗壳聚糖微球的半径为500~1000nm。
本发明还提供了一种上述制备的猪流行性腹泻病毒减毒活疫苗壳聚糖微球在制备治疗预防猪流行性腹泻的疫苗中应用。
本发明的原理:
本发明所用的毒株是由本实验室在2013年8月分离到的变异pedv毒株yn1(genbankno.:kt021227),运用vero细胞传代致弱pedv的方法,获得的一种猪流行性腹泻病毒弱毒株pedv-yn144(genbankno.:kt021232)(chenfzetal.,2015),将分离到的变异猪流行性腹泻病毒在vero细胞上连续传代120代,然后通过克隆纯化继续在vero细胞上传代至144代,命名猪流行性腹泻病毒弱毒株pedv-yn144,2015年11年10日将该毒株送交位于湖北省武汉市武汉大学内的中国典型微生物保藏中心(cctcc)保藏,其保藏编号为cctccno:v201547,然后在10μg/ml胰酶的条件下在vero细胞上连续传6代得到的yn150。从30代开始在orf3基因433bp处有1个碱基的缺失,造成了orf3蛋白的提前终止,s蛋白在144-145aa处有两个氨基酸的缺失,这些特点在60代,90代,120代,144代和150代毒株都稳定存在。致弱实验表明,从60代开始,变异pedv对仔猪失去致病性;将pedvyn150在猪体内连传5代,没有任何毒力返强现象。区域性的临床试验表明此毒株对变异毒株引起的ped的免疫原性和安全性都很好,对妊娠母猪、育肥猪和仔猪等各年龄猪均安全。免疫猪后产生抗体,对猪安全无害,对人和植物无害,对环境没有污染。利用壳聚糖易于形成微球的性质制备猪流行性腹泻减毒活疫苗壳聚糖微球,能够保护抗原免受胃酸和胃蛋白酶破坏,并能靶向黏膜表面,在黏膜表面缓慢释放包裹的抗原,增强疫苗的免疫效果和作用时间。
壳聚糖是甲壳素(chitin)经脱乙酰基后得到的一种天然的带正电的多糖。不溶于水,可溶于乙酸。由于其良好的生物安全性和生物相容性、与黏液层相互吸附、成本低等优点,从而成为口服疫苗载体的研究热点(mohammadetal.,2012)。采用离子交联法制备壳聚糖微球,反应条件温和,过程不添加有机试剂,保留了抗原活性,该法原理是,向壳聚糖溶液中滴加带负电的离子交联剂三聚磷酸钠(tpp)溶液以中和壳聚糖的正电荷,使之发生凝胶化,通过搅拌,包裹溶液中的粒子(jiewuetal.,2017)。壳聚糖微球表面通常携带正电荷,可以与与黏液层相互吸附,靶向黏膜表面(liatal.,2017)。壳聚糖微球还可以在肠粘膜表面发生溶胀、侵蚀或降解,缓慢释放包裹的抗原,产生持久的免疫力。有研究者已使用壳聚糖在制备新城疫活疫苗壳聚糖纳米粒(kaietal.,2012)和禽流感灭活苗壳聚糖纳米粒(samahh.mohamedetal.,2017)、禽流感dna疫苗(zhaoetal.,2010)等的研究中取得进展。
本发明的有益效果在于:
1.本发明所用毒株来源于变异的pedv,在s基因和orf3基因处都有缺失,临床使用安全性很高,符合疫苗生物安全性要求并且易于与其他毒株区分。
2.本发明所使用的囊材壳聚糖拥有良好的生物安全性、生物相容性和生物可降解性,对猪无毒无害。
3.本发明所使用的包裹工艺过程不添加有机试剂,保留了抗原活性,制备过程简单、省时,且易于储存运输。
4.本发明的猪流行性腹泻病毒减毒活疫苗壳聚糖微球能增强疫苗的免疫效果,延长疫苗的作用时间。
附图说明
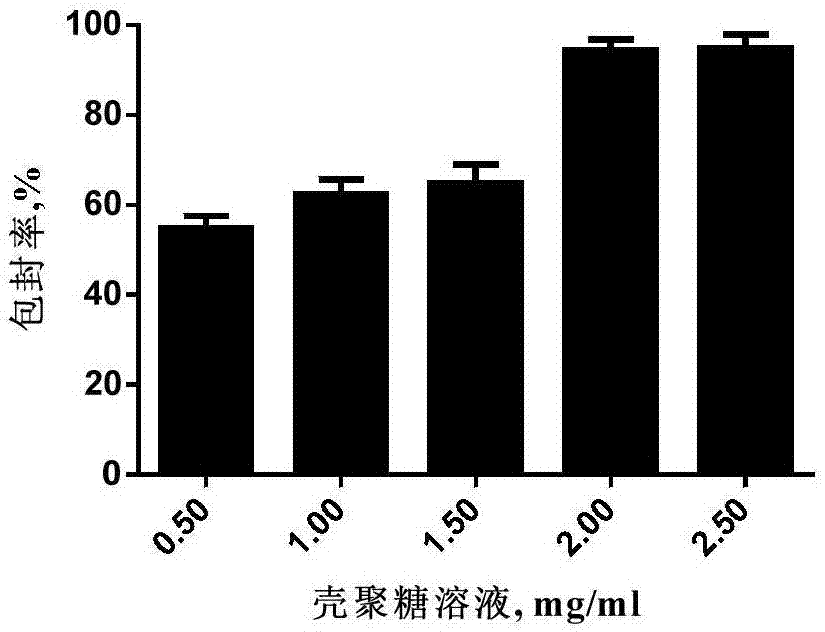
图1为壳聚糖浓度对猪流行性腹泻病毒减毒活疫苗壳聚糖微球包封率的影响图;
图2为tpp浓度对猪流行性腹泻病毒减毒活疫苗壳聚糖微球包封率的影响图;
图3为病毒液与壳聚糖投料比对猪流行性腹泻病毒减毒活疫苗壳聚糖微球包封率的影响图;
图4为猪流行性腹泻病毒减毒活疫苗壳聚糖微球在透射电镜下的形态;
图中,图4a为在标尺为2μm下的电镜图片,图4b为在标尺为0.5μm下的电镜图片;
图5为本发明制备工艺对病毒毒价的影响,
其中,a表示病毒液中加入1%乙酸和tpp溶液,在室温条件下1200rpm磁力搅拌10分钟。b表示病毒液中加入nahco3、1%乙酸和tpp溶液,在室温条件下1200rpm磁力搅拌10分钟。c表示病毒液中加入dmem和tpp溶液,在室温条件下1200rpm磁力搅拌10分钟。d表示未作处理的病毒液;
图6为猪流行性腹泻病毒减毒活疫苗壳聚糖微球经与未经壳聚糖包裹的疫苗经过人工胃液处理后的病毒拷贝数的变化图;
其中a是猪流行性腹泻病毒减毒活疫苗壳聚糖微球,b是未经壳聚糖包裹的疫苗。
图7为猪流行性腹泻病毒减毒活疫苗壳聚糖微球经与未经壳聚糖包裹的疫苗经过人工胃液处理后的tcid50的变化图;其中a是猪流行性腹泻病毒减毒活疫苗壳聚糖微球,b是未经壳聚糖包裹的疫苗。
图8:猪流行性腹泻病毒减毒活疫苗壳聚糖微球与未经壳聚糖包裹的疫苗口服免疫妊娠母猪后,初乳及乳汁中的iga水平图,
其中,a是猪流行性腹泻病毒减毒活疫苗壳聚糖微球,b是未经壳聚糖包裹的疫苗,c是pbs。
图9:猪流行性腹泻病毒减毒活疫苗壳聚糖微球与未经壳聚糖包裹的疫苗口服免疫妊娠母猪后,初乳及乳汁中的中和抗体水平图;
其中,a是猪流行性腹泻病毒减毒活疫苗壳聚糖微球,b是未经壳聚糖包裹的疫苗,c是pbs。
图10为猪流行性腹泻病毒减毒活疫苗壳聚糖微球与未经壳聚糖包裹的疫苗口服免疫妊娠母猪后,母猪分娩后第8天的血清中和抗体水平图,
其中,a是猪流行性腹泻病毒减毒活疫苗壳聚糖微球,b是未经壳聚糖包裹的疫苗,c是pbs。
具体实施方式
为了更好地解释本发明,以下结合具体实施例进一步阐明本发明的主要内容,但本发明的内容不仅仅局限于以下实施例。
猪流行性腹泻病毒减毒活疫苗壳聚糖微球的制备方法,包括以下步骤:
1)将猪流行性腹泻病毒弱毒株pedv-yn144培养,得到病毒液;然后离心过滤去除细胞碎片和其它杂质,得到病毒滤液,其中,病毒滤液中病毒含量大于等于106tcid50/ml,且小于等于108tcid50/ml;
2)将壳聚糖加入体积浓度为1%~5%的乙酸溶液,超声溶解;即得到壳聚糖溶液;其中,壳聚糖溶液的浓度为0.5~5mg/1ml;
3)按体积比3∶3~20∶0.060~0.070∶1~20量取壳聚糖溶液、病毒滤液、碳酸氢钠溶液和三聚磷酸钠溶液;其中,碳酸氢钠溶液的浓度为60~100mg/ml,三聚磷酸钠溶液的浓度为0.3~2.0mg/ml;
4)向病毒滤液中碳酸氢钠溶液,在磁力搅拌条件下缓慢滴加壳聚糖溶液;再缓慢滴加三聚磷酸钠溶液;在室温、转速为1000~1500rpm条件下磁力搅拌8~15min;得到混合液;
5)按体积比1∶3~5将明胶与混合液混匀,冷冻干燥即得到猪流行性腹泻病毒减毒活疫苗壳聚糖微球。
基于上述制备方法,选取反应条件的实验基础
1、猪流行性腹泻病毒减毒活疫苗壳聚糖微球的单因子试验
本发明猪流行性腹泻病毒减毒活疫苗壳聚糖微球的包封率受很多因素影响,尤其是壳聚糖浓度、tpp浓度、病毒滤液与壳聚糖投料比。发明人通过单因子试验对最佳制备工艺进行了探索。固定tpp浓度为1mg/ml,搅拌转速为1200rpm,搅拌时间为10min,病毒液与壳聚糖投料比3∶1不变,改变壳聚糖溶液浓度分别为0.5mg/ml、1mg/ml、1.5mg/ml、2mg/ml、2.5mg/ml进行试验,结果如图1,结果显示包封率随壳聚糖浓度升高而升高。固定壳聚糖浓度为1mg/ml,搅拌转速为1200rpm,搅拌时间为10min,病毒滤液与壳聚糖投料比3∶1不变,改变tpp溶液浓度分别为0.5mg/ml、1mg/ml、1.5mg/ml、2mg/ml、2.5mg/ml进行试验,结果如图2,结果显示包封率随tpp溶液浓度升高而升高。固定壳聚糖浓度为1mg/ml,tpp浓度为1mg/ml,搅拌转速为1200rpm,搅拌时间为10min不变,改变病毒滤液与壳聚糖投料比分别为1∶1、5∶3、7∶3、9∶3、11∶3、13∶3进行试验,结果如图3,结果显示在投料比为1∶1、7∶3、3∶1时,包封率在80%以上。
2、正交试验
在上述实验基础上,进行正交试验确定能够最优制备工艺。正交试验因素与水平及正交试验结果分别见表1和表2。从表中可以看出三个因素对包封率的影响从大向小依次是壳聚糖浓度,tpp浓度和投料比。
如表2所示试验结果的下表包封率高均接近90%,考虑单位体积中的病原含量高和单位体积所需壳聚糖量少和降低了制备成本多种因素同时尽量加大使病毒液与壳聚糖的体积比,因此最优工艺选为正交表中试验号3。
表1.因素水平表
表2.正交表
注:x1、x2、x3分别表示该因素在三个水平上的平均值,r表示平均值的范围。
3.猪流行性腹泻病毒减毒活疫苗壳聚糖微球的形态及粒径分布
采用本试验优化工艺制备的猪流行性腹泻病毒减毒活疫苗壳聚糖微球,在透射电镜下观察,粒子呈球形,具有较为圆滑的轮廓,分散性良好,半径分布在500~1000nm之间(图4)
4.猪流行性腹泻病毒减毒活疫苗壳聚糖微球制备工艺对毒价影响
上述制备方法工艺过程中添加的乙酸溶液会对整个体系的ph值造成影响,机械搅拌也可能对病毒造成破坏,探索制备工艺中这两个条件对病毒毒价的影响(图5)。
结果可以看出虽然乙酸溶液和机械搅拌会对毒价造成影响,但影响不大,通过向体系中添加碳酸氢钠溶液降低乙酸溶液对体系ph值的影响。
实施例1
猪流行性腹泻病毒减毒活疫苗壳聚糖微球1的制备方法,包括以下步骤:
1)将猪流行性腹泻病毒弱毒株pedv-yn144培养,得到病毒液;然后离心过滤去除细胞碎片和其它杂质,得到病毒滤液,其中,病毒滤液中病毒含量等于106tcid50/ml;
2)将壳聚糖加入体积浓度为3%的乙酸溶液,超声溶解;即得到壳聚糖溶液;其中,壳聚糖溶液的浓度为3mg/1ml;
3)量取3ml的壳聚糖溶液、15ml的病毒滤液、0.067ml的碳酸氢钠溶液和1ml三聚磷酸钠溶液;其中,碳酸氢钠溶液的浓度为96mg/ml,三聚磷酸钠溶液的浓度为0.5mg/ml;
4)向病毒滤液中碳酸氢钠溶液,在磁力搅拌条件下缓慢滴加壳聚糖溶液;再缓慢滴加三聚磷酸钠溶液;在室温、转速为1200rpm条件下磁力搅拌10min;得到混合液;
5)按体积比1∶4将明胶与混合液混匀,冷冻干燥即得到猪流行性腹泻病毒减毒活疫苗壳聚糖微球1,其半径为500~1000nm,包封率为88.00%。
实施例2
猪流行性腹泻病毒减毒活疫苗壳聚糖微球2的制备方法,包括以下步骤:
1)将猪流行性腹泻病毒弱毒株pedv-yn144培养,得到病毒液;然后离心过滤去除细胞碎片和其它杂质,得到病毒滤液,其中,病毒滤液中病毒含量等于106tcid50/ml;
2)将壳聚糖加入体积浓度为3%的乙酸溶液,超声溶解;即得到壳聚糖溶液;其中,壳聚糖溶液的浓度为3mg/1ml;
3)量取3ml的壳聚糖溶液、7ml的病毒滤液、0.067ml的碳酸氢钠溶液和1ml三聚磷酸钠溶液;其中,碳酸氢钠溶液的浓度为96mg/ml,三聚磷酸钠溶液的浓度为1.0mg/ml;
4)向病毒滤液中碳酸氢钠溶液,在磁力搅拌条件下缓慢滴加壳聚糖溶液;再缓慢滴加三聚磷酸钠溶液;在室温、转速为1200rpm条件下磁力搅拌10min;得到混合液;
5)按体积比1∶4将明胶与混合液混匀,冷冻干燥即得到猪流行性腹泻病毒减毒活疫苗壳聚糖微球2,其半径为500~1000nm,包封率为91.84%。
实施例3
猪流行性腹泻病毒减毒活疫苗壳聚糖微球3的制备方法,包括以下步骤:
1)将猪流行性腹泻病毒弱毒株pedv-yn144培养,得到病毒液;然后离心过滤去除细胞碎片和其它杂质,得到病毒滤液,其中,病毒滤液中病毒含量等于106tcid50/ml;
2)将壳聚糖加入体积浓度为3%的乙酸溶液,超声溶解;即得到壳聚糖溶液;其中,壳聚糖溶液的浓度为3mg/1ml;
3)量取3ml的壳聚糖溶液、11ml的病毒滤液、0.067ml的碳酸氢钠溶液和1ml三聚磷酸钠溶液;其中,碳酸氢钠溶液的浓度为96mg/ml,三聚磷酸钠溶液的浓度为1.5mg/ml;
4)向病毒滤液中碳酸氢钠溶液,在磁力搅拌条件下缓慢滴加壳聚糖溶液;再缓慢滴加三聚磷酸钠溶液;在室温、转速为1200rpm条件下磁力搅拌10min;得到混合液;
5)按体积比1∶4将明胶与混合液混匀,冷冻干燥即得到猪流行性腹泻病毒减毒活疫苗壳聚糖微球3,其半径为500~1000nm,包封率为91.84%。
实施例4
猪流行性腹泻病毒减毒活疫苗壳聚糖微球4的制备方法,包括以下步骤:
1)将猪流行性腹泻病毒弱毒株pedv-yn144培养,得到病毒液;然后离心过滤去除细胞碎片和其它杂质,得到病毒滤液,其中,病毒滤液中病毒含量等于108tcid50/ml;
2)将壳聚糖加入体积浓度为5%的乙酸溶液,超声溶解;即得到壳聚糖溶液;其中,壳聚糖溶液的浓度为5mg/ml;
3)量取3ml的壳聚糖溶液、20ml的病毒滤液、0.060ml的碳酸氢钠溶液和20ml三聚磷酸钠溶液;其中,碳酸氢钠溶液的浓度为60mg/ml,三聚磷酸钠溶液的浓度为2.0mg/ml;
4)向病毒滤液中碳酸氢钠溶液,在磁力搅拌条件下缓慢滴加壳聚糖溶液;再缓慢滴加三聚磷酸钠溶液;在室温、转速为1000rpm条件下磁力搅拌8min;得到混合液;
5)按体积比1∶3将明胶与混合液混匀,冷冻干燥即得到猪流行性腹泻病毒减毒活疫苗壳聚糖微球4,其半径为500~1000nm,包封率为86.74%。
实施例5
猪流行性腹泻病毒减毒活疫苗壳聚糖微球54的制备方法,包括以下步骤:
1)将猪流行性腹泻病毒弱毒株pedv-yn144培养,得到病毒液;然后离心过滤去除细胞碎片和其它杂质,得到病毒滤液,其中,病毒滤液中病毒含量等于106tcid50/ml;
2)将壳聚糖加入体积浓度为1%的乙酸溶液,超声溶解;即得到壳聚糖溶液;其中,壳聚糖溶液的浓度为0.5mg/ml;
3)量取3ml的壳聚糖溶液、3ml的病毒滤液、0.070ml的碳酸氢钠溶液和3ml三聚磷酸钠溶液;其中,碳酸氢钠溶液的浓度为100mg/ml,三聚磷酸钠溶液的浓度为0.3mg/ml;
4)向病毒滤液中碳酸氢钠溶液,在磁力搅拌条件下缓慢滴加壳聚糖溶液;再缓慢滴加三聚磷酸钠溶液;在室温、转速为1500rpm条件下磁力搅拌15min;得到混合液;
5)按体积比1∶5将明胶与混合液混匀,冷冻干燥即得到猪流行性腹泻病毒减毒活疫苗壳聚糖微球5,其半径为500~1000nm,包封率为87.05%。
实施例6:猪流行性腹泻病毒减毒活疫苗壳聚糖微球1在人工胃液处理下病毒拷贝数和病毒毒价的变化
用5ml人工胃液处理猪流行性腹泻病毒减毒活疫苗壳聚糖微球1和未经包裹的疫苗,分别在不同时间点回收100ul用于测定病毒拷贝数(图6)和tcid50(图7)。结果可以看出在2.5h以内,壳聚糖微球1对病毒核酸具有明显的保护作用,对病毒的毒力亦有一定的保护作用。人工胃液参照药典(第四版)上配方配置:取23.4ml浓盐酸用蒸馏水定容至100ml,取出1.64ml加蒸馏水定容至80ml,加入1g胃蛋白酶(10000u/mg)并涡旋溶解,定容至100ml,即得人工胃液,其ph约为1.4。
实施例7:猪流行性腹泻病毒减毒活疫苗壳聚糖微球1初步免疫效果观察
试验选取某猪场75头妊娠母猪,分为a、b、c三组,每组25头,产前五周肌肉注射商品化ped疫苗,a、b、c三组母猪产前二周分别口服免疫猪流行性腹泻病毒减毒活疫苗壳聚糖微球1、未经壳聚糖包裹的ped冻干疫苗和pbs,疫苗的免疫剂量为106tcid50/ml。采集初乳及分娩后2、4、6、8天的乳汁以及同期的粪便样品,采集分娩后第8天的血液样品。采集到的样品中,a、b、c每组随机选取10份样品用于后续检测,采用qrt-pcr方法检测粪便中pedv的排毒情况,采用实验室自主研发的猪流行性腹泻病毒elisa(iga)抗体检测试剂盒检测初乳及乳汁中的iga水平,采用中和试验法检测初乳、乳汁及血清中的ped中和抗体水平。qrt-pcr结果显示粪便中没有排毒,初乳及乳汁中iga检测结果(图8)显示,a组初乳和乳汁中iga抗体水平高于b组,并且初乳和2、6天的乳汁中iga抗体水平差异显著(p<0.05),第4天乳汁中iga抗体水平差异非常显著(p<0.01)。乳汁中和抗体结果(图9)显示,a组初乳中的中和抗体高于b组,但没有显著差异(p>0.05)。母猪分娩后第八天血清中核抗体水平结果(图10)显示,a组高于b组但无显著差异(p>0.05)。
其它未详细说明的部分均为现有技术。尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
- 还没有人留言评论。精彩留言会获得点赞!