一种采用激光引导实现放射性粒子植入的方法与流程
本发明属于放射性粒子植入技术领域,具体涉及一种采用激光引导实现放射性粒子植入的方法。
背景技术:
放射性粒子组织间近距离治疗肿瘤已有100多年的历史,早期的放射性粒子植入方式主要包括以下两种方式:
1、徒手穿刺,凭借医生的经验进行穿刺;
2、在人体表面设置固定模板作为引导进行平行穿刺;
但上述的粒子植入方式,在术中容易产生突发情况无法及时调整,如产生气胸、水肿等可能导致肿瘤恶化或者危机患者生命的情况,但随着计算机三维治疗计划系统的出现,使放射性粒子治疗肿瘤取得了快速发展,如今放射性粒子植入治疗已与手术、外放疗一样成为标准治疗手段之一。
放射性粒子植入治疗技术是根据超声、ct、mri等影像检查结果,首先利用放射性粒子治疗计划系统(treatmentplanningsystem,tps)准确设计放射性粒子植入的位置、数量、植入途径,制定出治疗方案;然后在ct、b超、内窥镜引导或手术直视下经皮穿刺,通过粒子植入枪将放射性粒子按计划植入实体恶性肿瘤间;最后通过放射粒子发出的持续低能量的x射线或γ射线,使肿瘤组织受到最大程度杀伤,从而达到治疗目的。由于采用tps计划系统,可使肿瘤在得到最大照射剂量的同时,减少正常组织的照射量,从而很大程度地改善患者的治疗效果及治疗后的生活质量。此外,持续低剂量的适形照射治疗,可以使肿瘤组织内分裂周期不同的肿瘤细胞得到均匀地照射治疗,符合肿瘤生长的规律,因此,近年来放射性粒子植入治疗技术在恶性肿瘤的治疗方面得到了广泛应用。
为了提高放射治疗精度,在手术前,医生需依据tps系统设计优化的穿刺布源方案,即:首先根据超声、ct、mri等影像检查结果,勾勒并重建肿瘤的三维形态;随后,依据肿瘤致死有效等剂量区的计算结果,并结合人体解剖结构,设计放射粒子植入的位置、数量及植入途径;然后医生需要根据所设计的放射性粒子植入的方案进行粒子植入,而放射性粒子植入过程是手术设计的核心。目前比较常用的粒子植入引导方式为将早期的固定模板变为适应性更高的3d打印模板,根据患者本身的肿瘤情况进行设计粒子布局,进行插植穿刺并植入粒子,可以有效地避免血管、骨头以及健康器官的阻挡,但此引导方式存在的问题有:
1、3d打印模板的制作周期长,费用成本高,模板费用成本一般在1-2万元/块,在制作周期内患者体内的肿瘤大小及位置可能已经改变,导致术中和术前存在一定的误差,并无法进行术中调整,灵活性差;
2、在3d打印模板放置到患者体表时,由于患者体形的改变,可能会导致3d打印模板放置情况与术前有一定的偏差,而导致3d打印模板上每个植入孔都产生误差,使得粒子植入位置整体偏移,导致治疗效果变差;
3、由于3d打印模板的表面设置的插针孔密度有一定的限制,导致术中能够植入的粒子数有限;
4、由于设备的成本高,技术操作难度大,提高了医院的应用门槛,而且提高了患者的经济负担和治疗风险。
下面提供申请人检索到的与本申请相关联的先有专利文献,仅供审查员参考,具体如下:
中国发明专利,申请号:cn201711059321.9,申请日:2017-11-01,内容摘要:本发明涉及一种带固定装置的3d打印个性化柱塞式穿刺治疗模板,包括模板基板、模板导孔、穿刺针引导柱、微调支架插入孔、定位孔、轻量化通孔、激光对位线、穿刺针编号和深度标记等。此模板穿刺针引导柱可随时取下,取下后模板导向孔直径较大、长度短,使局部麻醉点定位精准且较易实施,可方便使用较大直径的骨钻,钻孔定位精准。设置了三处微调支架插入孔,配合微调支架使用可微调和固定模板位置。模板基板表面设置针孔编号和穿刺针插入深度标记,防止没有深度标记,误插穿刺针。此模板个性化定制,术前根据ct、磁共振等医学影像精确设计每一根穿刺针,精准微创,极大地降低了手术难度和手术风险,降低青年医师学习周期,迅速开展业务,使更多病人受益。
上述技术并没有解决制作周期长、费用成本高以及容易产生误差的技术问题。
技术实现要素:
本发明提供一种采用激光引导实现放射性粒子植入的方法,用于解决现有技术中3d打印模板的制作周期长,费用成本高,在制作周期内患者体内的肿瘤大小及位置可能已经改变,导致术中和术前存在一定的误差,并无法进行术中调整,灵活性差的技术问题;同时,本发明还能解决设备的成本高,技术操作难度大,提高了医院的应用门槛,而且提高了患者的经济负担和治疗风险的问题。
本发明所采用的技术方案为:
一种采用激光引导实现放射性粒子植入的方法,包括以下步骤:
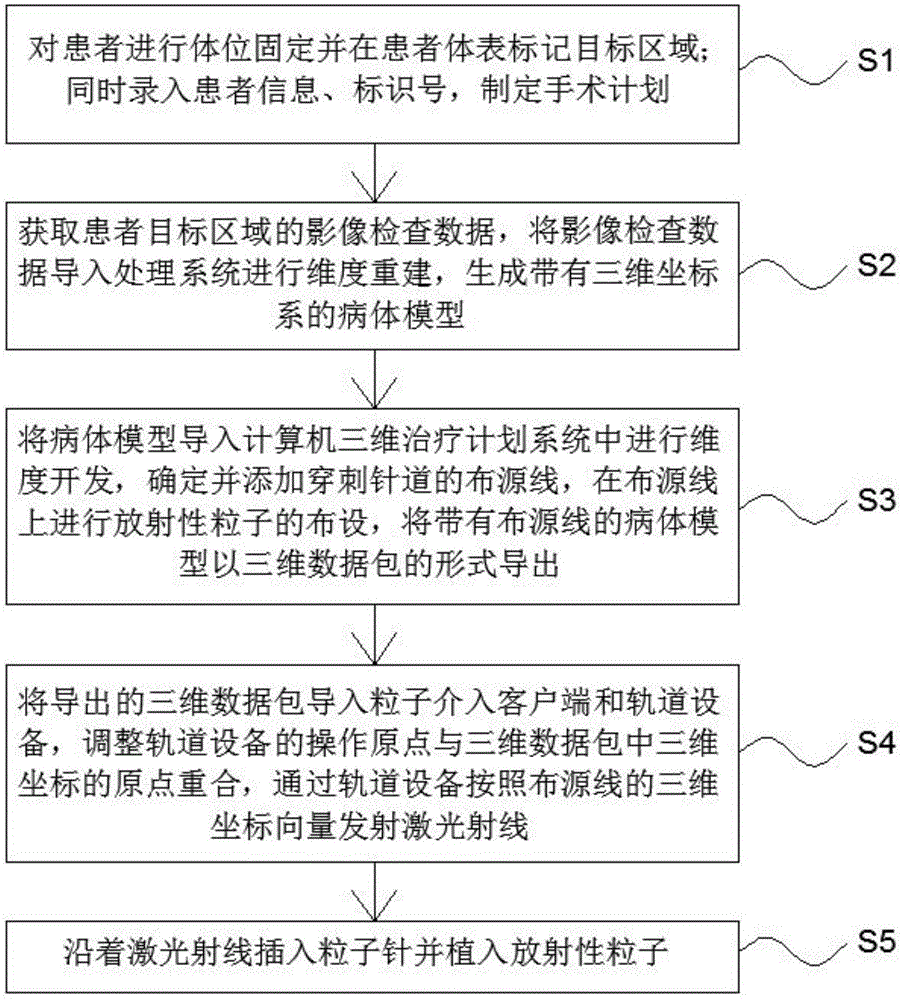
步骤s1,对患者进行体位固定并在患者体表标记目标区域;同时录入患者信息、标识号,制定手术计划;
步骤s2,获取患者目标区域的影像检查数据,将影像检查数据导入处理系统进行维度重建,生成带有三维坐标系的病体模型;
步骤s3,将病体模型导入计算机三维治疗计划系统中进行维度开发,确定并添加穿刺针道的布源线,在布源线上进行放射性粒子的布设,将带有布源线的病体模型以三维数据包的形式导出,所述布源线为在病体模型上的三维坐标向量;
步骤s4,将导出的三维数据包导入粒子介入客户端和轨道设备,调整轨道设备的操作原点与三维数据包中三维坐标的原点重合,通过轨道设备按照布源线的三维坐标向量发射激光射线;
步骤s5,沿着激光射线插入粒子针并植入放射性粒子。
作为一种优选的方案,激光射线的光斑直径可调范围为0.5-3mm,通常设置为1mm,根据临床手术的经验,常规放射性粒子的直径为0.5-1.5mm,一般为0.8mm左右,加上粒子针的厚度,一般为1mm左右,而激光射线在患者体表的光斑越接近粒子针的直径,在穿刺的过程中就更加接近预设的布源线的路径,误差更小。
值得说明的是,在进行放射性粒子植入时,除了粒子针以外还会用到植入器,作为本领域技术人员所熟知的,植入器可以为美国生产的mick枪,即笔式粒子植入器,还可以为trh-i长型植入器或trh-ii长型植入器;粒子针可以选择美国粒子植入针,用于与mick枪配合使用,也可以为日本八光针,可以与trh-i长型植入器及trh-ii长型植入器配合使用,并且其针套管上设有刻度标识,方便识别粒子针进针深度。
进一步的优选,所述步骤s1中,所述影像检查数据为通过超声、ct或mri对目标区域的影像检查结果。
值得说明的是,作为一种优选的方案,此处的超声、ct或mri的影像检查均采用造影增强扫描技术,临床试验充分证明,造影增强扫描技术相比于普通平扫可以显著地改善器官以及肿瘤的影响的分辨率以及诊断准确度,以椎体ct检查为例,平扫ct的准确率为91%,造影增强ct扫描的准确率可以达到94-98%。
进一步的优选,所述步骤s2中,所述病体模型通过患者目标区域范围内的影像检查数据叠加合成,包括患者目标区域内的体表轮廓数据、体内器官轮廓数据以及肿瘤轮廓数据。
进一步的优选,所述步骤s2中,所述维度重建的步骤为,
步骤s201:在患者目标区域上做一个体表标记点a0;
步骤s202:对病体模型建立三维坐标系,所述三维坐标系以体表标记点a0作为坐标原点,以经过体表标记点a0的竖直线为z轴,并根据坐标原点和z轴确定x轴和y轴;
步骤s203:在三维坐标系中对患者目标区域内的体表轮廓、体内器官轮廓以及肿瘤轮廓进行三维坐标编辑。
进一步的优选,所述步骤s2中,所述处理系统采用arigin3d或mimics。
下面以mimics为例进行操作步骤说明:
第一步,将上述影像检查数据导入到mimics中,通过mimics观察并调整原影像检查数据的阈值;
第二步,根据阈值的调整,获得血管造影的清晰三维图像后选中所需图像内容,确定需要进行后续建模的全部造影影像;
第三步,将选中的所有造影影像中存在的空洞或者缺失的地方全部填满,避免因为阈值设置误差导致模型存在缺陷;
第四步,建立三维模型,通常情况下,在mimics中运行calculate命令即可生成三维图形的位图,根据图片清晰情况和实际需求决定是否需要对图片进行处理;
第五步,导出ansys文件并按照ansysareafiles方式划分网格,通过mimics进行赋值,设定好单位密度(hu)和e模量后(mpa)后自动生成三维模型,即病体模型。
值得说明的是,上述是以mimics为例对建立医学数据模型进行的说明,包含但不限于采用mimics以外的软件实现。
进一步的优选,所述步骤s3中,所述三维数据包中包括每个布源线的布源信息,所述布源信息包括对应布源线的编号、穿刺起点坐标、穿刺终点坐标、粒子数量、粒子植入坐标及对应粒子的穿刺深度。
进一步的优选,所述步骤s4中,轨道设备根据三维数据包中的坐标信息调整激光发射头移动,轨道设备发射激光射线的步骤为,
步骤s401:调整轨道设备的激光发射头与三维数据包中三维坐标原点重合;
步骤s402:根据三维数据包中每个布源线的布源信息,按照布源线编号依次调整轨道设备的激光发射头的位置和方向,使激光发射头的激光发射方向与穿刺起点坐标、穿刺终点坐标所构成的三维坐标向量重合。
进一步的优选,所述步骤s5中,所述粒子针以及放射性粒子植入的步骤包括:
步骤s501,将粒子针的针头端对准激光射线在体表上的光点,调整粒子针使激光射线的光点与针尾端的中心重合,按照激光射线的路径插入粒子针;
步骤s502,在插入粒子针的同时通过激光测距对粒子针插入的深度进行测量和显示,提示插入深度;
步骤s503,根据布源信息中对应粒子的穿刺深度,在对应深度位置植入放射性粒子。
值得注意的是,为了进一步保证粒子针在穿刺过程中不发生倾斜的情况,可以选择用穿刺辅助定位装置来提高术中穿刺和粒子植入的精确定位,穿刺辅助定位装置可以固定在病床上或者患者身上(比如铅套),作为本领域技术人员所熟知的,目前的穿刺辅助定位装置有ct连床式体部穿刺定位支架,可以与ct机床无缝连接,ct扫描确定层面和倾角后,通过调节万向杆,可以使其与ct机床三轴直角坐标系完全融合,满足临床治疗上不同方向和角度的需求,做到三维立体的精确定向,极大地提高术中穿刺和粒子植入的精准度。
进一步的优选,所述步骤s502中,提示插入深度的步骤包括,
步骤s5021:在植入粒子之前,通过粒子介入客户端将三维数据的病体模型包转换成3d视图;
步骤s5022:轨道设备开始运行,在植入粒子针和植入粒子的同时,粒子介入客户端在3d视图上同步显示粒子针的植入情况以及粒子植入情况;
步骤s5023:在轨道设备归于自身轨道的操作原点时,关闭3d视图。
进一步的优选,所述步骤s5022中,还包括在3d场景中对粒子针以及放射性粒子的植入情况进行语音播报提示:当粒子针和放射性粒子到达对应植入深度后发出确认语音提示;当粒子针和放射性粒子未到达对应植入深度时发出未到达语音提示。
本发明的有益效果为:
(1)本发明采用激光技术进行引导,在结合了徒手穿刺和模板穿刺优点的基础上,术前的准备周期短,成本低,并且可以根据患者体内肿瘤的变化及时改变植入方案,灵活性强。
(2)本发明的激光引导系统不与患者体表直接接触,不会因为患者体表的变化而产生误差,并且没有了3d打印模板插针孔密度的限制,提升了手术的效率。
(3)本发明降低了医院的应用门槛,而且降低了患者的经济负担和治疗风险。
(4)本发明在植入粒子针和放射性粒子时可以通过语音提示起到预警的效果,同时为医生提供精准的辅助引导,方便了医生的操作,降低了手术风险。
附图说明
图1是本发明的激光引导放射性粒子植入的操作流程图;
图2是本发明对影像检查数据进行维度重建的操作流程图;
图3是本发明通过轨道设备发射激光射线的操作流程图;
图4是本发明粒子针以及放射性粒子植入的操作流程图;
图5是本发明通过粒子介入客户端提示插入深度的操作流程图。
具体实施方式
下面结合附图及具体实施例对本发明作进一步阐述。
实施例1:
如图1所示,一种采用激光引导实现放射性粒子植入的方法,包括以下步骤:
步骤s1,对患者进行体位固定并在患者体表标记目标区域;同时录入患者信息、标识号,制定手术计划;
步骤s2,获取患者目标区域的影像检查数据,将影像检查数据导入处理系统进行维度重建,生成带有三维坐标系的病体模型;
步骤s3,将病体模型导入计算机三维治疗计划系统中进行维度开发,确定并添加穿刺针道的布源线,在布源线上进行放射性粒子的布设,将带有布源线的病体模型以三维数据包的形式导出,所述布源线为在病体模型上的三维坐标向量;
步骤s4,将导出的三维数据包导入粒子介入客户端和轨道设备,调整轨道设备的操作原点与三维数据包中三维坐标的原点重合,通过轨道设备按照布源线的三维坐标向量发射激光射线;
步骤s5,沿着激光射线插入粒子针并植入放射性粒子。
作为一种优选的方案,激光射线的光斑直径可调范围为0.5-3mm,通常设置为1mm,根据临床手术的经验,常规放射性粒子的直径为0.5-1.5mm,一般为0.8mm左右,加上粒子针的厚度,一般为1mm左右,而激光射线在患者体表的光斑越接近粒子针的直径,在穿刺的过程中就更加接近预设的布源线的路径,误差更小;在进行放射性粒子植入时,除了粒子针以外还会用到植入器,作为本领域技术人员所熟知的,植入器可以为美国生产的mick枪,即笔式粒子植入器,还可以为trh-i长型植入器或trh-ii长型植入器;粒子针可以选择美国粒子植入针,用于与mick枪配合使用,也可以为日本八光针,可以与trh-i长型植入器及trh-ii长型植入器配合使用,并且其针套管上设有刻度标识,方便识别粒子针进针深度。
实施例2:
在上述实施例的基础上,作为一种优选方案,步骤s1中,所述影像检查数据为通过超声、ct或mri对目标区域的影像检查结果;值得说明的是,作为一种优选的方案,此处的超声、ct或mri的影像检查均采用造影增强扫描技术,临床试验充分证明,造影增强扫描技术相比于普通平扫可以显著地改善器官以及肿瘤的影响的分辨率以及诊断准确度,以椎体ct检查为例,平扫ct的准确率为91%,造影增强ct扫描的准确率可以达到94-98%。
实施例3:
如图2所示,在上述实施例的基础上,作为一种优选方案,步骤s2中,所述病体模型通过患者目标区域范围内的影像检查数据叠加合成,包括患者目标区域内的体表轮廓数据、体内器官轮廓数据以及肿瘤轮廓数据;进一步的,步骤s2中维度重建的步骤为,
步骤s201:在患者目标区域上做一个体表标记点a0;
步骤s202:对病体模型建立三维坐标系,所述三维坐标系以体表标记点a0作为坐标原点,以经过体表标记点a0的竖直线为z轴,并根据坐标原点和z轴确定x轴和y轴;
步骤s203:在三维坐标系中对患者目标区域内的体表轮廓、体内器官轮廓以及肿瘤轮廓进行三维坐标编辑。
进一步的优选,步骤s2处理系统采用arigin3d或mimics。
下面以mimics为例进行操作步骤说明:
第一步,将上述影像检查数据导入到mimics中,通过mimics观察并调整原影像检查数据的阈值;
第二步,根据阈值的调整,获得血管造影的清晰三维图像后选中所需图像内容,确定需要进行后续建模的全部造影影像;
第三步,将选中的所有造影影像中存在的空洞或者缺失的地方全部填满,避免因为阈值设置误差导致模型存在缺陷;
第四步,建立三维模型,通常情况下,在mimics中运行calculate命令即可生成三维图形的位图,根据图片清晰情况和实际需求决定是否需要对图片进行处理;
第五步,导出ansys文件并按照ansysareafiles方式划分网格,通过mimics进行赋值,设定好单位密度(hu)和e模量后(mpa)后自动生成三维模型,即病体模型。
值得说明的是,上述是以mimics为例对建立医学数据模型进行的说明,包含但不限于采用mimics以外的软件实现。
实施例4:
在上述实施例的基础上,作为一种优选方案,步骤s3中,三维数据包中包括每个布源线的布源信息,所述布源信息包括对应布源线的编号、穿刺起点坐标、穿刺终点坐标、粒子数量、粒子植入坐标及对应粒子的穿刺深度。
实施例5:
如图3所示,在上述实施例的基础上,作为一种优选方案,步骤s4中,轨道设备根据三维数据包中的坐标信息调整激光发射头移动,轨道设备发射激光射线的步骤为,
步骤s401:调整轨道设备的激光发射头与三维数据包中三维坐标原点重合;
步骤s402:根据三维数据包中每个布源线的布源信息,按照布源线编号依次调整轨道设备的激光发射头的位置和方向,使激光发射头的激光发射方向与穿刺起点坐标、穿刺终点坐标所构成的三维坐标向量重合。
实施例6:
如图4所示,在上述实施例的基础上,作为一种优选方案,步骤s5中,粒子针以及放射性粒子植入的步骤包括:
步骤s501,将粒子针的针头端对准激光射线在体表上的光点,调整粒子针使激光射线的光点与针尾端的中心重合,按照激光射线的路径插入粒子针;
步骤s502,在插入粒子针的同时通过激光测距对粒子针插入的深度进行测量和显示,提示插入深度;
步骤s503,根据布源信息中对应粒子的穿刺深度,在对应深度位置植入放射性粒子。
值得注意的是,为了进一步保证粒子针在穿刺过程中不发生倾斜的情况,可以选择用穿刺辅助定位装置来提高术中穿刺和粒子植入的精确定位,穿刺辅助定位装置可以固定在病床上或者患者身上(比如铅套),作为本领域技术人员所熟知的,目前的穿刺辅助定位装置有ct连床式体部穿刺定位支架,可以与ct机床无缝连接,ct扫描确定层面和倾角后,通过调节万向杆,可以使其与ct机床三轴直角坐标系完全融合,满足临床治疗上不同方向和角度的需求,做到三维立体的精确定向,极大地提高术中穿刺和粒子植入的精准度。
实施例7:
如图5所示,在上述实施例的基础上,作为一种优选方案,步骤s502中,提示插入深度的步骤包括,
步骤s5021:在植入粒子之前,通过粒子介入客户端将三维数据的病体模型包转换成3d视图;
步骤s5022:轨道设备开始运行,在植入粒子针和植入粒子的同时,粒子介入客户端在3d视图上同步显示粒子针的植入情况以及粒子植入情况;
步骤s5023:在轨道设备归于自身轨道的操作原点时,关闭3d视图。
其中,步骤s5022中,还包括在3d场景中对粒子针以及放射性粒子的植入情况进行语音播报提示:当粒子针和放射性粒子到达对应植入深度后发出确认语音提示;当粒子针和放射性粒子未到达对应植入深度时发出未到达语音提示。
本发明不局限于上述可选实施方式,任何人在本发明的启示下都可得出其他各种形式的产品,但不论在其形状或结构上作任何变化,凡是落入本发明权利要求界定范围内的技术方案,均落在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!