一种泽泻的炮制方法与流程
本发明涉及中药材炮制技术领域,特别涉及一种泽泻的炮制方法。
背景技术:
随着《中华人民共和国中医药法》的实施,由国家发改委和国家中医药管理局组织实施的国家中药标准化项目,重点任务是针对中药材种植、中药饮片生产、中成药生产全过程的技术规范和标准缺失问题,着力于中药生产各环节的技术规范优化,对提高中药饮片及其产品的质量和疗效具有很大的推动作用;同时,饮片标准化生产对促进中药产业“种好药、产好药、造好药”具有重要意义。
在此次建设的100多个中药饮片品种中,福建省道地药材泽泻为入选品种,该药材具有降脂、降糖、降血压、利尿、抗肿瘤、抗炎和抗脂肪肝等药效。2015年版《中国药典》和多地炮制规范对泽泻炮制品(盐泽泻)均有记载,但各个环节的量化参数未细化,地区和企业间盐泽泻的工艺差别较大,因此有必要对泽泻盐制工艺各个环节进行系统考察,制定规范化的生产规范。目前,有关泽泻炮制工艺的研究已有一些报道,但均采用实验室小试来完成工艺的摸索,不能完全反映标准化生产及生产级设备下各个环节参数的具体情况;炮制工艺评价指标选择较为单一(均为三萜类)。泽泻现代化学和药理学研究发现泽泻中除了三萜类成分外,倍半萜类也是其重要的药效物质基础,但目前文献中炮制工艺对倍半萜成分的影响却鲜有研究。
本实验按照中药标准化项目的实施细则要求,在中试级设备上采用单因素试验和正交试验对泽泻饮片炮制各个关键环节进行研究,包括泽泻切片、炮制辅料用量、炮制温度、炒制时间等生产环节。以倍半萜、三萜、醇溶性浸出物和外观性状为综合指标,优化盐泽泻的炮制工艺,旨在建立泽泻优质饮片生产加工炮制规范,为中药全产业链质量传递和优质中药饮片的标准制定提供依据。
技术实现要素:
本发明所要解决的技术问题是:提供一种能起到明显的降血脂、降血糖、抗结石、利尿、抗炎及降压功能的泽泻药材的炮制方法。
为了解决上述技术问题,本发明采用的技术方案为:一种泽泻的炮制方法,包括以下步骤:
步骤1:将泽泻生药于蒸馏水中闷润1-2h,所述闷润温度为70-80℃;
步骤2:将经过闷润的泽泻于70-80℃进行切割,制得泽泻切片,所述泽泻切片的厚度为3-5mm;
步骤3:将经过切片的泽泻于60-70℃干燥1-3h,得到泽泻饮片;
步骤4:将泽泻饮片于氯化钠溶液中闷润2.5-3.5h,所述闷润温度为70-80℃;
步骤5:将经过闷润的泽泻饮片于150-170℃下炒制7-9min后冷却,制得泽泻药材成品。
本发明的有益效果在于:本发明提供的一种泽泻炮制方法通过2次闷润,第一次闷润采用蒸馏水,使泽泻生药软化,有利于切制饮片,在第二次闷润中采用氯化钠溶液闷润,使盐渗透至泽泻饮片内,在二次闷润后进行炒制,有利于引药入经,还能有效降低毒副作用,本发明涉及的泽泻炮制方法中,2次闷润的温度与时间、炒制的温度和时间参数十分考究,过高或过低都会影响药材成品的综合评分,本发明的泽泻炮制方法制得的泽泻药材成品的综合评分高达98.45,充分满足2015年版《中国药典》对盐泽泻性状的要求,能起到明显的降血脂、降血糖、抗结石、利尿、抗炎及降压功能。
附图说明
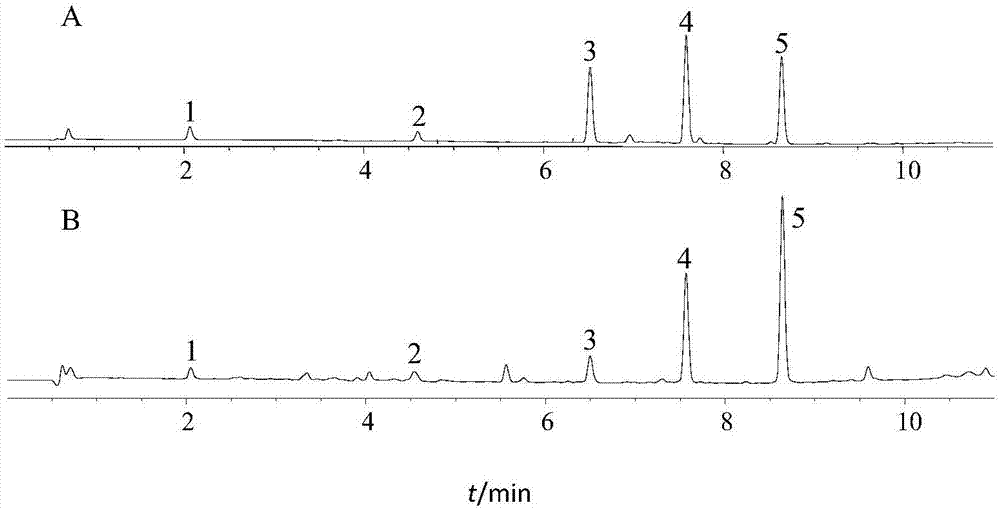
图1为本发明具体实施方式中的液相色谱试验中对照品和供试品的各成分色谱峰图;
具体实施方式
为详细说明本发明的技术内容、所实现目的及效果,以下结合实施方式并配合附图予以说明。
本发明最关键的构思在于:通过2次闷润,第一次闷润采用蒸馏水,使泽泻生药软化,有利于切制饮片,在第二次闷润中采用氯化钠溶液闷润,使盐渗透至泽泻饮片内,在二次闷润后进行炒制,有利于引药入经,还能有效降低毒副作用。
请参照图1,本发明涉及一种泽泻的炮制方法,包括以下步骤:
步骤1:将泽泻生药于蒸馏水中闷润1-2h,所述闷润温度为70-80℃;
步骤2:将经过闷润的泽泻于70-80℃进行切割,制得泽泻切片,所述泽泻切片的厚度为3-5mm;
步骤3:将经过切片的泽泻于60-70℃干燥1-3h,得到泽泻饮片;
步骤4:将泽泻饮片于氯化钠溶液中闷润2.5-3.5h,所述闷润温度为70-80℃;
步骤5:将经过闷润的泽泻饮片于150-170℃下炒制7-9min后冷却,制得泽泻药材成品。
上述泽泻炮制方法通过2次闷润,第一次闷润采用蒸馏水,使泽泻生药软化,有利于切制饮片,在第二次闷润中采用氯化钠溶液闷润,使盐渗透至泽泻饮片内,在二次闷润后进行炒制,有利于引药入经,还能有效降低毒副作用,本发明涉及的泽泻炮制方法中,2次闷润的温度与时间、炒制的温度和时间参数十分考究,过高或过低都会影响药材成品的综合评分,本发明的泽泻炮制方法制得的泽泻药材成品的综合评分高达98.45,充分满足2015年版《中国药典》对盐泽泻性状的要求,能起到明显的降血脂、降血糖、抗结石、利尿、抗炎及降压功能。
进一步的,上述泽泻的炮制方法的所述步骤4中,氯化钠溶液的浓度为11%-25%。
进一步的,上述泽泻的炮制方法的所述步骤4中,所述氯化钠溶液的质量为泽泻饮片质量的13%-16%。
进一步的,上述泽泻的炮制方法的所述步骤4中,所述氯化钠溶液的浓度为13%,所述氯化钠溶液的质量为泽泻饮片质量的15%。
进一步的,上述泽泻的炮制方法的所述步骤1中,闷润时间为1.5h,所述闷润温度为75℃,所述蒸馏水的质量为泽泻生药质量的18%。
进一步的,上述泽泻的炮制方法的所述步骤2中,
所述泽泻的切割温度为75℃。
进一步的,上述泽泻的炮制方法的所述步骤3中泽泻的干燥温度为65℃,干燥时间为2h。
进一步的,上述泽泻的炮制方法的所述泽泻饮片的炒制温度为160℃,炒制时间为7-9min。
实施例1
一种泽泻的炮制方法,包括以下步骤:
步骤1:将泽泻生药于蒸馏水中闷润1.5h,所述闷润温度为75℃;所述蒸馏水的质量为泽泻生药质量的18%;
步骤2:将经过闷润的泽泻于70-80℃进行切割,制得泽泻切片,所述泽泻切片的厚度为4mm;
步骤3:将经过切片的泽泻于65℃干燥2h,得到泽泻饮片;
步骤4:将泽泻饮片于氯化钠溶液中闷润3h,所述闷润温度为75℃;所述氯化钠溶液的浓度为13%,所述氯化钠溶液的质量为泽泻饮片质量的15%;
步骤5:将经过闷润的泽泻饮片于160℃下炒制8min后冷却,制得泽泻药材成品。
实施例2
一种泽泻的炮制方法,包括以下步骤:
步骤1:将泽泻生药于蒸馏水中闷润1h,所述闷润温度为70℃;所述蒸馏水的质量为泽泻生药质量的18%;
步骤2:将经过闷润的泽泻于70℃进行切割,制得泽泻切片,所述泽泻切片的厚度为3mm;
步骤3:将经过切片的泽泻于60℃干燥1h,得到泽泻饮片;
步骤4:将泽泻饮片于氯化钠溶液中闷润2.5h,所述闷润温度为70℃;所述氯化钠溶液的浓度为11%%,所述氯化钠溶液的质量为泽泻饮片质量的13%%;
步骤5:将经过闷润的泽泻饮片于150℃下炒制7min后冷却,制得泽泻药材成品。
实施例3
一种泽泻的炮制方法,包括以下步骤:
步骤1:将泽泻生药于蒸馏水中闷润2h,所述闷润温度为80℃;所述蒸馏水的质量为泽泻生药质量的18%;
步骤2:将经过闷润的泽泻于80℃进行切割,制得泽泻切片,所述泽泻切片的厚度为5mm;
步骤3:将经过切片的泽泻于70℃干燥3h,得到泽泻饮片;
步骤4:将泽泻饮片于氯化钠溶液中闷润3.5h,所述闷润温度为80℃;所述氯化钠溶液的浓度为25%,所述氯化钠溶液的质量为泽泻饮片质量的16%;
步骤5:将经过闷润的泽泻饮片于170℃下炒制9min后冷却,制得泽泻药材成品。
以实施例1的一种泽泻的炮制方法制得的泽泻药材成品为例,进行多指标成分的色谱分析;
色谱条件如下:
acquityuplcbehc18色谱柱(2.1mm×100mm,1.7μm),流动相乙腈(a)-水(b)梯度洗脱(0~0.2min,35%a;0.2~2.5min,35%~55%a;2.5~3.5min,55%a;3.5~6.5min,55%~73%a;6.5~9.5min,73%~87%a;9.5~11min,87%a),柱温40℃,流速0.35ml·min-1,进样量2μl,检测波长208nm。在此色谱条件下5个对照品与其他色谱峰的分离度均>1.5,理论板数均>3000,色谱峰对称性良好,见图1;其中,a为对照品;b为供试品;1为环氧泽泻烯;2为23-乙酰泽泻醇c;3为泽泻烯醇;4为泽泻醇b;5为23-乙酰泽泻醇b;
对照品溶液的制备:
精密称取环氧泽泻烯,23-乙酰泽泻醇c,泽泻烯醇,泽泻醇b和23-乙酰泽泻醇b对照品适量,分别加50%乙腈制成质量浓度为1.201,1.021,1.009,0.997,0.919g·l-1的对照品母液。
供试品溶液的制备:
精密称取泽泻粉末(过五号筛)1.0g,置50ml具塞锥形瓶中,精密加入乙腈25ml,密塞,称定质量,超声处理(功率250w,频率50khz)30min,放冷,称定质量,加乙腈补足减失的质量,摇匀,提取液于1万r·min-1离心10min,经0.22μm微孔滤膜滤过,取续滤液,即得。
线性关系考察:
精密吸取环氧泽泻烯,23-乙酰泽泻醇c,泽泻烯醇,泽泻醇b和23-乙酰泽泻醇b对照品母液适量,加50%乙腈制成混合对照品溶液,将混合对照品溶液逐级稀释为系列混合对照品溶液,按上述色谱条件测定,以峰面积(y)和分析物质量浓度(x)作线性回归,结果见表1。
表1泽泻中5个指标成分的回归方程
精密度试验:
精密吸取同一混合对照品溶液,按上述色谱条件重复测定6次,计算环氧泽泻烯,23-乙酰泽泻醇c,泽泻烯醇,泽泻醇b和23-乙酰泽泻醇b峰面积的rsd分别为1.4%,0.8%,0.5%,1.5%和1.3%,表明该仪器精密度良好。
稳定性试验:
取同一份盐泽泻供试品溶液6份,分别于0,2,6,10,12,24h按上述色谱条件测定,计算环氧泽泻烯,23-乙酰泽泻醇c,泽泻烯醇,泽泻醇b和23-乙酰泽泻醇b峰面积的rsd分别为1.5%,1.1%,1.2%,0.7%和0.8%,表明供试品溶液在24h内稳定性良好。
重复性试验:
精密称取同一份盐泽泻供试品粉末6份,制备供试品溶液,按上述色谱条件测定,计算环氧泽泻烯,23-乙酰泽泻醇c,泽泻烯醇,泽泻醇b和23-乙酰泽泻醇b的平均质量分数分别为0.003%,0.02%,0.03%,0.05%和0.11%,rsd分别为2.4%,1.5%,1.7%,1.6%和1.7%,表明该方法重复性良好。
加样回收试验:
精密称取6份已知指标成分含量的盐泽泻饮片粉末(泽泻炮制工艺单因素试验考察中闷润时间为1h)0.5g,分别精密加入一定量的混合对照品溶液,按上述方法制备供试品溶液,按上述色谱条件测定,计算环氧泽泻烯,23-乙酰泽泻醇c,泽泻烯醇,泽泻醇b和23-乙酰泽泻醇b的平均加样回收率分别为98.48%,98.57%,97.92%,100.13%和99.66%,rsd分别为2.6%,1.4%,2.3%,2.0%和2.5%,表明该方法准确可靠。
样品测定:
精密称取实施例1得到的泽泻药材成品,1.0g,按照上述方法榨汁杯供试品溶液,按上述色谱条件测定,根据外标法计算各指标成分的含量。
检测结果:
环氧泽泻烯的质量分数为0.039mg/g;23-乙酰泽泻醇c的质量分数为0.147mg/g;泽泻烯醇的质量分数为0.362mg/g;泽泻醇b的质量分数为0.464mg/g;23-乙酰泽泻醇b的质量分数为1.392mg/g。
以实施例1的一种泽泻的炮制方法制得的泽泻药材成品为例,进行醇溶性浸出物含量测定,方法如下:
精密称取泽泻和盐泽泻样品粉末2.0g,置100ml锥形瓶中,精密加入95%乙醇75ml,密塞,称定质量,静置1h后连接回流冷凝管,加热至沸腾,并保持微沸1h。放冷后取下锥形瓶,密塞,再称定质量,用95%乙醇补足减失的质量,摇匀,滤过,精密量取滤液25ml,置已干燥至恒重的蒸发皿中,水浴蒸干后于105℃干燥3h,置干燥器中冷却30min,迅速精密称定质量,计算醇溶性浸出物的含量,最终得到的醇溶性浸出物的质量分数为18.37%。
以实施例1的一种泽泻的炮制方法制得的泽泻药材成品为例,进行感官综合评分,评分标准如下:
以盐泽泻中5个成分的总量结合醇溶性浸出物含量和外观性状作为综合评价指标,其中总含量和醇溶性浸出物含量是盐泽泻的内在指标,外观性状是外在指标。参照2015年版《中国药典》对盐泽泻性状的要求,从色泽、质地、气味3方面评定外观性状总分。采用综合加权评分法优选盐泽泻的炮制工艺,5个指标成分的总量、醇溶性浸出物含量和外观性状的权重系数分别为0.50,0.35,0.15。
实施例1制得的泽泻药材成品中,色泽为淡黄色或黄褐色,质地坚实,偶见焦斑,气微,味微咸,综合评分高达98.45。
综上所述,本发明提供的一种泽泻炮制方法通过2次闷润,第一次闷润采用蒸馏水,使泽泻生药软化,有利于切制饮片,在第二次闷润中采用氯化钠溶液闷润,使盐渗透至泽泻饮片内,在二次闷润后进行炒制,有利于引药入经,还能有效降低毒副作用,本发明涉及的泽泻炮制方法中,2次闷润的温度与时间、炒制的温度和时间参数十分考究,过高或过低都会影响药材成品的综合评分,本发明的泽泻炮制方法制得的泽泻药材成品的综合评分高达98.45,充分满足2015年版《中国药典》对盐泽泻性状的要求,能起到明显的降血脂、降血糖、抗结石、利尿、抗炎及降压功能。
以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等同变换,或直接或间接运用在相关的技术领域,均同理包括在本发明的专利保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!