依他尼酸在制备治疗和预防肥胖及相关代谢性疾病药物中的应用的制作方法
本发明属于生物医药
技术领域:
,具体涉及依他尼酸在制备治疗和预防肥胖及相关代谢性疾病药物中的用途。
背景技术:
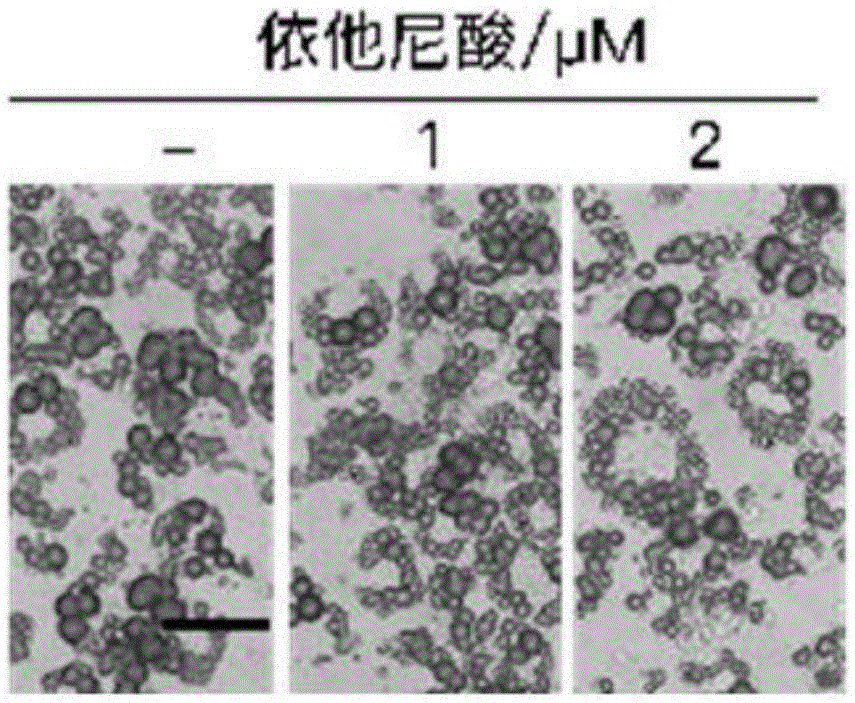
:随着全球经济的快速发展、人民生活水平的提高,加上不合理的膳食结构、不良生活方式等的出现,肥胖症的患病率日趋增加且发病愈发低龄化。资料显示,近30年全球肥胖和超重人口的数量和比例一直在增加。全球肥胖和超重总人口已由1980年的8.57亿人增至2013年的21亿,整体成人肥胖和超重人口增加了27.5%,儿童肥胖和超重人口增加了47.1%。根据2013年发表在柳叶刀上的统计数据,在我国,虽然成年人的肥胖发病率比较低,但患有中心性肥胖或周围性肥胖的总人数位于全球第二,成为仅次于美国的世界肥胖人口大国。另外,儿童及青少年肥胖问题在我国也较为突出,青少年肥胖可引起发育迟缓、心肺功能受损、高血压甚至早逝,使得儿童及青少年自信心下降,社会适应能力降低。肥胖症及其伴随的各种代谢性疾病如ⅱ型糖尿病、高血压、高脂血症、脂肪肝等已成为威胁人类身心健康的全球性焦点问题。研究显示,肥胖是由于能量代谢平衡失调,摄入过多或耗能不足致使脂肪容量增多的状态。脂肪组织是机体内部巨大的能量贮备系统,在肥胖症的发生发展过程中处于核心地位,对于维持机体的能量代谢平衡发挥着举足轻重的作用。目前已知人体存在三种脂肪组织:白色脂肪、棕色脂肪和米色脂肪。白色脂肪组织广泛分布在机体的皮下和内脏周围,主要负责将能量以甘油三脂的形式储存于大脂滴中,同时分泌不同类型的内分泌激素,如瘦素(leptin)、抗素(resistin)和脂联素(adiponectin)等来调节人体能量平衡。机体内的棕色脂肪细胞分为两种:经典的棕色脂肪细胞和分散在白色脂肪细胞间的棕色样脂肪细胞,即米色脂肪细胞。棕色脂肪细胞来源于表达myf5细胞系的棕色脂肪细胞,主要分布在颈背、肩胛、腋窝、肾脏等,细胞内含有大量的脂肪小滴和高浓度的线粒体,是哺乳动物非颤栗性产热的主要场所,线粒体中含有大量的标志分子解偶联蛋白1(uncouplingprotein1,ucp1)。ucp1定位于线粒体内膜,可以将质子从线粒体内膜渗漏到线粒体基质中,减少atp的合成,将化学能转变为热能,从而使氧化磷酸化进入空转状态,是棕色脂肪细胞激活的标志。当机体处在低温环境中,体温调节中枢下丘脑引起交感神经兴奋,通过细胞内脂肪酸的非偶联性氧化磷酸化分解产热为机体供能,维持机体体温平衡。研究发现当机体交感神经兴奋时,如运动或处于低温环境,白色脂肪会发生棕色化,转变为米色脂肪。白色脂肪组织的棕色化带来的产热效应现已成为预防和治疗肥胖症及相关代谢性疾病研究的新方向,激活体内棕色脂肪来增加机体能耗将为治疗肥胖症提供新的助力,成为肥胖症研究的重点。ucp1在棕色脂肪线粒体内膜上特异性表达,通过切断电子传递链和atp合成的偶联,阻断呼吸作用而产热。ucp1不仅参与棕色脂肪组织的产热调节和能量代谢,还是产热性脂肪组织的表型标志。除了ucp1之外,pgc1α,prdm16和cytochromec也是参与棕色化过程的重要分子。谷胱甘肽巯基转移酶(glutathionetransferase,gsts)超家族主要包括α、μ、π、θ等亚型,是体内生物转化最重要的ⅱ相代谢酶之一,是细胞抗损伤、抗癌变的主要解毒系统。依他尼酸(ethacrynicacid,ea)是一种临床使用的利尿药,也是gst同工酶的抑制剂,通过α,β-不饱和羰基化合物的碳碳双键的亲核加成方式与gsh竞争性或者非竞争性结合,抑制gsh代谢作用。但是依他尼酸在治疗肥胖及其相关的糖代谢、能量代谢失衡方面并无研究。本发明基于上述理论,探讨依他尼酸在预防及治疗肥胖症及其相关的糖代谢、能量代谢异常方面的应用。技术实现要素:本发明的目的在于提供依他尼酸在制备治疗和预防机体肥胖及相关代谢性疾病药物中的用途。本发明提供的依他尼酸在制备预防或治疗肥胖及相关代谢性疾病药物中的用途,包括:依他尼酸抑制剂在制备预防或治疗肥胖及其相关代谢性疾病药物中的用途;依他尼酸的生物学靶标gstm1在促进脂肪分解中的用途;gst的其他抑制剂在制备预防或治疗肥胖及其相关代谢性疾病药物中的用途。其中,所述依他尼酸(ethacrynicacid)为gst抑制剂;所述的促进脂肪分解指促进白色脂肪棕色化;所述的肥胖及其相关代谢性疾病包括由肥胖诱发的机体高血糖、葡萄糖耐受、胰岛素耐受、能量代谢失调等。所述gst的其他抑制剂,具体为:依他尼酸及其类似物,金诺芬,筚拨明碱,nbdehx,ter199,槲皮黄素,奎尼丁,乙嘧啶,氯贝特,棉子酚,吲哚美辛,1-(2-羟基-3-甲氧丙基)-2-硝基咪唑,吡前列素,柳氮磺吡啶。其结构式分别为如下所示:实验表明,高脂饮食饲养的小鼠在腹腔注射依他尼酸后,表现出明显的体重降低及脂肪组织含量的降低。另外,小鼠的糖代谢水平有明显的改善,氧气消耗以及能量消耗增强,小鼠在寒冷环境中保持自身体温的能力增加。此外,分别在体外前脂肪细胞分化模型及在小鼠白色脂肪组织中敲减gstm1,可增强细胞及脂肪组织的棕色化水平。这说明依他尼酸可以通过靶向gstm1来预防及改善由高脂饮食诱发的机体肥胖及代谢异常,可用于开发及制备新的抗机体肥胖及代谢异常的小分子制剂。本发明的有益效果是:依他尼酸可以通过抑制gstm1来促进脂肪分解从而改善高脂饮食诱发的体重增加、脂质累积以及糖代谢、能量代谢失衡,具有良好的临床治疗潜能,为肥胖症及其相关糖代谢、能量代谢失衡的治疗提供了一种新途径。附图说明通过结合附图来详细说明本发明的实施方案,其中:图1-3示出了依他尼酸使罗格列酮定向的c3h10t1/2出现棕色脂肪样的形态特征。其中,图1示出了依他尼酸处理的罗格列酮定向的c3h10t1/2的细胞形态特征。图2-3示出了westernblot检测了罗格列酮定向的c3h10t1/2以及不同浓度的依他尼酸处理后的bmp4定向的c3h10t1/2的棕色脂肪相关基因ucp1、pgc1a、prdm16的转录组水平和蛋白表达水平。*p<0.05,**p<0.01,***p<0.001。图4-7示出了腹腔注射依他尼酸一周诱导的高脂饲养的小鼠皮下脂肪出现棕色化。其中,图4示出了腹腔注射依他尼酸一周后,高脂饲养的小鼠在4℃环境中的体温变化。图5示出了皮下脂肪组织的he染色及ucp1染色。图6-7出示腹腔注射依他尼酸一周,对高脂饲养的小鼠进行冷暴露8小时处理后,腹股沟部脂肪组织中ucp1及其他棕色脂肪相关基因的mrna及蛋白的表达。*p<0.05,**p<0.01,***p<0.001。图8-10示出了在小鼠各脂肪组织中,gstm1家族蛋白的表达情况。图8出示了在正常小鼠的皮下脂肪组织中,gst家族蛋白各亚型的mrna表达情况。图9显示了在小鼠腹股沟白色脂肪、附睾白色脂肪和在肩胛部棕色脂肪组织中,gstm1、gstp1的mrna表达情况。图10出示了在使用不同浓度的cl316,243对成熟c3h10t1/2进行棕色化诱导时,gstm1与gstp1的蛋白表达水平。*p<0.05,**p<0.01,***p<0.001。图11-13示出了在svf原代脂肪前体细胞分化过程中敲减gstm1可使svf原代脂肪前体细胞获得棕色脂肪样形态特征。其中,图11示出了在分化过程中敲减gstm1后,svf细胞形态的变化。图12-13示出了在svf细胞分化过程中敲减gstm1后,棕色相关基因prdm16、pgc1α和ucp1的表达水平及ucp1的蛋白表达水平。*p<0.05,**p<0.01,***p<0.001。图14-16示出了使用腺病毒技术在小鼠腹股沟脂肪中敲减gstm1,并对小鼠进行冷暴露处理后,可增强小鼠腹股沟脂肪组织的棕色化表型。其中,图14出示了在小鼠腹股沟脂肪组织中敲减gstm1并对小鼠进行冷暴露处理8小时后,he染色及ucp1染色的情况。图15-16示出了在对小鼠进行冷暴露处理后,腹股沟脂肪组织中棕色相关基因mrna及ucp1的蛋白表达情况。*p<0.05,**p<0.01,***p<0.001。图17示出了依他尼酸抑制高脂饮食诱发的c57bl/6小鼠体重增加。其中,图17a示出了腹腔注射依他尼酸的c57bl/6小鼠在高脂饮食条件下的体重增加情况;图17b示出了各处理组小鼠在高脂饮食条件下的体重增长幅度。*p<0.05,**p<0.01,***p<0.001。图18示出了腹腔注射依他尼酸可减少高脂食物饲养的小鼠的脂肪组织。其中,图18a示出了腹腔注射依他尼酸的小鼠与对照组小鼠的体型比较;图18b示出了腹腔注射依他尼酸的小鼠与对照组小鼠的腹股沟部脂肪、附睾部脂肪和肩胛间区的棕色脂肪的体积;图18c示出了腹腔注射依他尼酸的小鼠与对照组小鼠的脂肪含量及肌肉含量的比较,*p<0.05,**p<0.01,***p<0.001。图19示出了高脂饮食饲养小鼠八周后,腹腔注射依他尼酸的实验组小鼠与对照组小鼠相比,血清中脂质代谢相关指标的变化。*p<0.05,**p<0.01,***p<0.001。图20示出了腹腔注射依他尼酸可以改善高脂饮食饲养的小鼠的糖代谢情况。其中,图20a示出了高脂饲养的小鼠,腹腔注射依他尼酸8周后,葡萄糖耐量的情况;图20b则示出了不同处理组小鼠胰岛素耐量的情况。*p<0.05,**p<0.01,***p<0.001。图21示出了腹腔注射依他尼酸可增强高脂饮食的小鼠的氧耗及能量产生情况。其中,图21a示出了高脂饲养的小鼠,腹腔注射依他尼酸8周后,小鼠的氧气消耗情况;图21b示出了各处理组小鼠的热量产生情况。*p<0.05,**p<0.01,***p<0.001。图22-23示出了腹腔注射依他尼酸8周后,高脂饮食饲养的小鼠皮下脂肪出现棕色化。其中,图22示出了腹腔注射依他尼酸8周后,高脂饲养的小鼠在冷暴露过程中的体温变化。图23a-23b出示腹腔注射依他尼酸8周后,对高脂饲养的小鼠进行冷暴露8小时处理后,腹股沟部脂肪组织中ucp1的mrna及蛋白水平的表达。图23c示出了各处理组小鼠皮下脂肪组织的he染色及ucp1染色情况。*p<0.05,**p<0.01,***p<0.001。图24示出了依他尼酸可显著改善由高脂饮食诱发的小鼠肥胖。在进行两个月的高脂饮食诱导的小鼠肥胖模型(dio)中,依他尼酸的处理可显著降低肥胖小鼠的体重,降低比例高达20%。图25示出了腹腔注射依他尼酸可减少dio小鼠的脂肪组织。其中,图25a示出了腹腔给予依他尼酸的dio小鼠与对照组小鼠的体型比较;图25b示出了腹腔给予依他尼酸的小鼠与对照组小鼠的腹股沟部脂肪、附睾部脂肪和肩胛间区的棕色脂肪的体积;图25c示出了腹腔给予依他尼酸的小鼠与对照组小鼠的脂肪含量及肌肉含量的比较。*p<0.05,**p<0.01,***p<0.001。图26示出了在dio小鼠模型中,依他尼酸对小鼠糖代谢的影响。图26a示出了腹腔注射依他尼酸对小鼠空腹血糖及随机血糖的影响,图26b、c分别示出了腹腔注射依他尼酸葡萄对小鼠糖耐量及胰岛素耐量的影响。*p<0.05,**p<0.01,***p<0.001。图27示出了腹腔注射依他尼酸可增强dio小鼠的氧耗及能量产生。其中,图27a示出了腹腔注射依他尼酸4周后,dio小鼠的氧气消耗情况;图27b示出了腹腔注射依他尼酸4周后,小鼠的热量产生情况。*p<0.05,**p<0.01,***p<0.001。图28示出了腹腔注射依他尼酸4周后,dio小鼠皮下脂肪出现棕色化。其中,图28a示出了腹腔注射依他尼酸4周后,对dio小鼠进行冷暴露8小时处理后,腹股沟部脂肪组织中ucp1的mrna水平的表达情况;图28b示出了皮下脂肪组织的he染色色及ucp1染色,*p<0.05,**p<0.01,***p<0.001。具体实施方式实施例1、依他尼酸诱导c3h10t1/2间充质干细胞在分化成脂肪细胞的过程中出现棕色脂肪样特征1.1材料1.1.1c3h10t1/2间充质干细胞系1.1.2dmem培养基(gibco)1.1.3胎牛血清(gibco)1.1.4小牛血清(sigma)1.1.5生物素(sigma)1.1.6青霉素和链霉素1.1.7依他尼酸(北京中科质检)1.1.8罗格列酮1.1.9pvdf膜(milliporeimmunobilon)1.1.10化学发光液(上海勤翔生物科技有限公司)1.2设备1.2.1恒温无菌孵箱thermoscientificformaseriesiiwaterjacket1.2.2显微镜olympusix7111.2.3电泳仪bioradpowerpachc1.2.4自动化学发光仪imagequantlas4000mini1.3溶液1.3.1培养基c3h10t1/2细胞生长培养基:c3h10t1/2诱导分化培养基:dmem500ml胎牛血清10%生物素8mg/ml青霉素100u/ml链霉素100u/ml1.3.2依他尼酸储存液溶解在dmso中,储存浓度为20mmol/l。1.3.3生物素80mg生物素和40mg泛酸钙溶于100ml去离子水中。加热溶解。0.22μm滤膜过滤除菌。1.3.43-异丁基-1-甲基黄嘌呤(50mmol/l)1.15g3-异丁基-1-甲基黄嘌呤溶于100ml0.2m氢氧化钾中,0.22μm滤膜过滤除菌。1.3.5地塞米松(1mmol/l)0.039g地塞米松溶于100ml水中,0.22μm滤膜过滤除菌。1.3.6胰岛素(1mg/ml)0.1g胰岛素溶于100ml水中,加几滴盐酸使之溶解,0.22μm滤膜过滤除菌。1.3.7细胞蛋白提取所用的裂解液tris-hcl(ph6.8)50mmol/lsds2%(w/v)glycerol10%(w/v)naf10mmol/lna3vo4100mmol/l1.4方法1.4.1c3h10t1/2的培养和分化在高糖dmem培养基中加入10%的小牛血清、8mg/l生物素、100iu/ml青霉素和100iu/ml链霉素,即为c3h10t1/2间充质干细胞的生长培养基,细胞的培养条件为37℃,10%co2。待c3h10t1/2间充质干细胞接种在3.5厘米的培养皿中,待其生长至接触抑制,细胞汇合两天后,按照标准的前脂肪细胞体外分化方案进行诱导。具体步骤如下:将形成接触抑制两天的c3h10t1/2细胞,用含有10%的fbs、罗格列酮、0.5mm的3-异丁基-1-甲基黄嘌呤、1μg/ml胰岛素和1μm的地塞米松的高糖dmem培养基进行分化的诱导。2天后,将培养基更换为含有10%fbs、罗格列酮和1μg/ml胰岛素的高糖dmem培养基继续培养2天,此后每两天更换含有10%fbs的高糖dmem培养基直至分化为成熟的脂肪细胞。1.4.2依他尼酸处理为了评估依他尼酸在c3h10t1/2分化过程中的作用,从分化前两天开始每次更换培养基的同时在培养基中加入依他尼酸进行处理。在细胞分化的第6-7天,进行油红染色并提取细胞的总蛋白和rna,并进行后续的westernblotting和q-pcr来检测相关基因的表达变化。1.4.3油红染色将分化好的脂肪细胞用pbs洗涤两次,4%的甲醛室温固定15分钟,再用pbs洗涤两次后,使用油红工作液室温染色4小时,去离子水洗涤两次,置于显微镜下拍照。复染过夜,晾干。1.4.4提取c3h10t1/2的细胞总rna并逆转录成cdna单层贴壁细胞经pbs洗涤后,加入适量trizolreagent,移液器吹打至液体澄清,室温静置5分钟;加入200μl三氯甲烷,剧烈晃动15秒充分混匀,室温放置3-5分钟,4℃离心12000g×15分钟;移液器吸取上层水相置于另一1.5ml离心管中,加入等体积的异丙醇,颠倒混匀后室温静置10分钟;4℃离心12000g×10分钟。弃去上清,加入1ml75%乙醇,4℃离心7500g×5分钟进行洗涤;弃去上清后室温干燥5-10分钟。用不含rna酶的水(depc水)(约20-30μl)溶解,55-60℃助溶10分钟,进行后续的逆转录反应。rna定量后取1μg总rna,使用takara逆转录试剂盒进行逆转录反应,具体反应体系如下:将上述反应体系混匀后,于37℃孵育15分钟进行逆转录反应,然后85℃孵育10s来终止反应,生成的cdna在-20℃冻存、备用。1.4.5realtimeqpcrq-pcr所用引物在上海生工合成。以cdna为扩增模板,使用上、下游引物进行pcr扩增目的片段。反应体系如下:混匀后离心,在q-pcr仪中进行pcr反应。反应条件:q-pcr反应中涉及到的引物序列如下(5’-3’):根据δδct法计算mrna的相对量,用18s作为内参,再将对照的mrna水平设定为1,各个处理组与对照组对比,得出相对量。1.4.6提取细胞总蛋白移除培养基,加入预冷的pbs洗涤细胞2次。向培养皿中加入细胞裂解液(含蛋白酶抑制剂),通常10cm培养皿加入1ml裂解液。冰上裂解10分钟,用细胞刮刮下裂解液并转移至1.5ml离心管中。100℃加热裂解液10分钟,12000rpm离心10分钟,将离心后的上清冻存存储于-80℃备用。1.4.7westernblot(1)根据蛋白样品浓度,取等量进行sds-聚丙烯酰胺凝胶电泳(sds-page);(2)电泳结束后,将nc膜和滤纸浸泡在转膜缓冲液中。按2张滤纸-凝胶-nc膜-2张滤纸顺序叠放,凝胶朝向负极,nc膜靠近正极,注意赶尽nc膜与凝胶之间的气泡。恒定电流200ma转移1h;(3)取出nc膜,放入适量封闭液(含有5%bsa或者脱脂奶粉的1×pbst)中,室温下置于摇床上轻轻摇动封闭1h;(4)用相应的第一抗体对nc膜进行免疫印迹反应,需要将第一抗体用封闭液稀释至适当浓度;在放置nc膜的孵育盒中加入第一抗体,在室温下孵育2-4h或4℃摇晃孵育过夜;(5)孵育完毕后用1×pbst洗膜3次,每次5分钟;(6)再与相应的带有hrp标记的第二抗体稀释液室温下孵育1h,1×pbst洗膜3次,每次5分钟;(7)配制所需的显色底物(1:1),放入化学发光仪进行显影成像。抗体货号和抗体稀释比例见下表:抗体货号稀释比例β-actingproteintechhrp-600081:10000ucp1abcamab109831:200二抗jacksonimmunology111-035-0031:100001.5结果1.5.1依他尼酸使罗格列酮定向的c3h10t1/2出现棕色脂肪样的形态特征c3h10t1/2是具有多向分化潜能的间充质干细胞,在罗格列酮定向的情况下分化成棕色脂肪细胞。在罗格列酮定向的c3h10t1/2分化过程中,同时加入依他尼酸(1μmol/l和2μmol/l)处理。观察细胞形态,发现依他尼酸处理的c3h10t1/2细胞出现了棕色样的特征,细胞较小,脂滴小而多。(如图1所示)。1.5.2依他尼酸使bmp4定向的c3h10t1/2细胞分化成熟后,棕色脂肪相关基因表达上调用q-pcr及westernblot检测棕色脂肪相关基因的蛋白水平,以β-tubulin作为内参。结果显示,依他尼酸使罗格列酮定向的c3h10t1/2细胞中棕色相关基因ucp1的转录水平及蛋白水平增高,并且有浓度依赖性的趋势(如图2-3所示)。实施例2、腹腔注射依他尼酸诱导高脂饲养的小鼠皮下脂肪出现棕色化2.1材料2.1.1雄性c57bl/6j小鼠(4-6week)2.1.2高脂饲料(researchdiets,usa)2.1.3小鼠体温仪(physitempbat-12)2.1.4ucp1特异性抗体(abcam,ab10983,1:50)2.1.5依他尼酸(北京中科质检生物技术有限公司)2.1.6蓖麻油(sigma)2.2方法2.2.1小鼠的饲养和给药小鼠在复旦大学实验动物中心spf级动物实验室饲养,室温21℃-23℃,每12hr光暗循环,诱导肥胖小鼠所用的高脂饲料脂肪含量60%。小鼠成长至8-week龄时,随机分成对照组和给药组,每组7只。在用高脂饲料喂养的同时,腹腔注射依他尼酸7mg/kg。每天给药一次,给药持续一周。给药结束后,小鼠禁食,置于4℃饲养箱,每隔2小时测其直肠温度。8小时后,断颈处死小鼠,取腹股沟部脂肪,进行组织学分析。组织学分析包括组织固定、石蜡包埋、切片和ucp1的免疫组化实验委托上海瑞雨生物有限公司代做。2.2.2数据分析数据差异性由studentttest方法分析,p<0.05时,认为有统计学差异。2.3结果给药一周后,当暴露在4℃环境中,腹腔注射依他尼酸的小鼠的体温略高于对照小鼠(图4)。说明给药组小鼠的体温保存能力明显增强,皮下脂肪出现明显的棕色化。取出小鼠的腹股沟脂肪进行ucp1的免疫组化检测、荧光定量pcr分析及免疫印迹检测,显示给药组的小鼠的皮下脂肪出现了明显的ucp1表达(图5-7)。这说明腹腔注射依他尼酸一周可以促进小鼠腹股沟脂肪的棕色化。实施例3、在cl316,243诱导的细胞棕色化的过程中,gstm1表达降低3.1材料3.1.1雄性c57bl/6j小鼠(6week)3.1.2c3h10t1/2间充质干细胞系3.1.3dmem培养基(gibco)3.1.4胎牛血清(gibco)3.1.5小牛血清(sigma)3.1.6生物素(sigma)3.1.7青霉素和链霉素3.1.8bmp4(r&d)3.1.9nc膜(milliporeimmunobilon)3.2设备3.2.1显微镜olympusix7113.2.2化学发光液(上海勤翔生物科技有限公司)3.2.3蛋白电泳仪3.3溶液3.3.1培养基c3h10t1/2维持培养基:dmem最多至500ml小牛血清10%生物素8mg/ml青霉素100u/ml链霉素100u/ml3.3.2细胞蛋白提取所用的裂解液:tris-hcl(ph6.8)50mmol/lsds2%(w/v)glycerol10%(w/v)naf10mmol/lna3vo4100mmol/l3.4方法3.4.1提取正常小鼠腹股沟脂肪的总rna并逆转录成cdna取正常小鼠的腹股沟脂肪,trizol溶解后,按照1.4.4提取脂肪组织的总rna并进行逆转录。3.4.2real-timeqpcr反应体系及反应条件参考1.4.5反应中涉及的引物序列如下:根据δδct法计算mrna的相对量,用18s作为内参,再将对照的mrna水平设定为1,各个处理组与对照组对比,得出相对量。3.4.3westernblot参考1.4.6-1.4.7对cl316,243处理细胞的蛋白样品进行免疫印迹检测。3.5结果在小鼠腹股沟脂肪的组织样品中对gst各亚型进行转录组水平的检测,发现gstm1与gstp1的表达量远远高于其他亚型(图8)。其中,gstm1在小鼠白色脂肪组织中的表达水平明显高于在棕色脂肪组织中的表达(图9)。在cl316,243诱导的脂肪细胞棕色化的过程中,gstm1的蛋白表达水平略有降低,gstp1的蛋白表达水平几乎不变(图10)。实施例4、在血管基质组分(stromalvascularfraction,svf)分化过程中敲减gstm1可获得棕色脂肪细胞样特征4.1材料4.1.1雄性c57bl/6j小鼠(4-6week,上海斯莱克实验动物有限公司)4.1.2青霉素和链霉素(gibco)4.1.3胎牛血清(gibco)4.1.4生物素(sigma)4.1.5dmem/f12(1:1)培养基(gibco)4.1.6nc膜(millipore)4.1.7化学发光试剂(上海勤翔)4.1.8si-gstm1寡核苷酸(吉玛生物)4.2设备4.2.1co2细胞培养箱为seriesiiwaterjacketedco2incubator4.2.2高倍显微镜olympus4.2.3超纯水系统milli-q为millipore公司4.2.4实时荧光定量pcr仪为rochelightcycler480(switzerland)4.2.5蛋白电泳仪biorad4.2.6自动化学发光仪imagequantlas40004.3溶液4.3.1svf的培养基(分化和培养)dmem/f12(1:1)最多至500ml胎牛血清10%生物素8mg/ml青霉素100u/ml链霉素100u/ml4.3.2细胞蛋白提取所用的裂解液tris-hcl(ph6.8)50mmol/lsds2%(w/v)glycerol10%(w/v)naf10mmol/lna3vo4100mmol/l4.4方法4.4.1svf的分离、培养和分化取4-6周c57bl/6小鼠的腹股沟脂肪,剪刀轻轻剪碎,使用胶原酶在37℃消化40-45分钟。离心,2500rpm,5分钟。使用f12/dmem培养基将细胞重悬,100μm的细胞滤网慢慢过滤后,室温离心2500rpm,5分钟收集svf细胞,并将细胞接种在含有20%fbs的dmem/f12培养基中。培养细胞至生长接触抑制,两天后进行分化诱导。具体过程如下:用含有10%fbs、0.5mm的3-异丁基-1-甲基黄嘌呤、5μg/ml胰岛素、1μm的地塞米松和1μm的罗格列酮的高糖f12/dmem培养基诱导,两天后更换为含有10%fbs、5μg/ml胰岛素和1μm的罗格列酮的高糖f12/dmem培养基,继续培养两天,此后每两天更换一次含有10%fbs的dmem高糖培养基,直至分化为成熟脂肪细胞。4.4.2在svf分化过程中敲减gstm1在svf细胞分化过程中,在使用诱导剂处理的前两天和后两天,更换培养液的同时进行瞬时转染gstm1的sirna,直至细胞分化成熟。4.4.3提取svf细胞总蛋白和westernblot提取svf总蛋白的方法同1.4.6,westernblot方法以及抗体货号同1.4.7。4.4.4提取细胞中的总rna并进行q-pcr提取方法及进行后续qpcr参照1.4.4-1.4.5。4.5结果4.5.1在svf原代脂肪前体细胞分化过程中敲减gstm1可诱导svf获得棕色脂肪样形态特征在svf原代前体脂肪细胞分化过程中,进行gstm1的蛋白敲减,直至svf细胞分化成熟,进行油红染色处理。我们发现,与标准分化的对照细胞相比,gstm1敲减组的脂肪细胞脂滴明显缩小,并具有多腔室小脂滴的特征(如图11)。4.5.2在svf在分化过程中敲减gstm1上调了棕色脂肪相关基因的表达用q-pcr及westernblot检测gstm1敲减后svf细胞中棕色化相关基因的表达情况。我们发现ucp1和tbx1等棕色化相关基因的转录组表达水平升高,如图12所示。ucp1的蛋白表达水平也增高,如图13所示。svf是原代脂肪前体细胞,在其分化过程中进行gstm1的敲减,可使svf在体外分化成具有棕色脂肪特征的脂肪细胞。实施例5、在小鼠腹股沟脂肪组织中使用腺病毒敲减gstm1可促进小鼠腹股沟脂肪出现棕色化表型5.1材料/试剂5.1.1雄性c57bl/6j小鼠(4-6week,南京大学模式动物研究所)5.1.2小鼠体温仪(physitempbat-12)5.1.3ucp1抗体(abcam,ab10983,1:50)5.1.4si-gstm1寡核苷酸(上海吉玛制药技术有限公司)5.2方法5.2.1腺病毒的包装及扩增gstm1敲减所用的腺病毒载体是由virapower腺病毒表达系统(invitrogen,carlsbad,ca)制备,以shlacz的腺病毒表达载体作为阴性对照。腺病毒的表达和纯化如前所述,具体步骤为:(1)在进行病毒包装前,用限制性内切酶paci酶切腺病毒载体,暴露itr序列,可有利于腺病毒在hek293a细胞内的包装;(2)hek293a细胞接种至3.5cm培养皿中,待其生长至90%融合度时,利用pei转入1μg腺病毒载体,12小时后更换培养基,转染2天后传代至10cm培养皿中继续培养。之后每隔2天进行更换培养基,并在显微镜下观察细胞的生长状态;(3)转染10天左右,显微镜下观察,当转染的细胞开始变圆、变亮、状态变差,提示此时细胞已经开始包装出重组腺病毒。待80%左右的细胞形态变圆并开始脱落时,移液器吹打细胞并收集至15ml离心管中。将细胞悬液冻存于-80℃(不少于40分钟),37℃融化(不超过15分钟),如此反复冻融3次,3000rpm离心10分钟,收集上清并分装置于-80℃冻存备用;(4)此时收集的上清为p0代病毒,一般需要进一步扩增后再用于后续实验。腺病毒的扩增方法:hek293a细胞传代至10cm培养皿,待细胞生长至90%融合度时加入100μlp0代腺病毒,2-3天后可观察到约80%细胞状态变差或死亡。按以上步骤,收集腺病毒;(5)腺病毒纯化使用试剂盒(sartorius,germany)完成。5.2.2小鼠的饲养和给药小鼠在复旦大学spf级实验动物研究中心动物饲养,维持室温21℃-23℃,每12hr进行光暗循环。小鼠成长至8周龄时,随机分成对照组和敲减组,每组6只。在用正常饲料喂养的条件下,双侧腹股沟注射纯化的腺病毒进行gstm1的敲减。每侧注射200μl,对照小鼠注射相同体积的shlacz对照病毒,两周内共注射3次。随后将小鼠禁食,置于4℃饲养箱进行冷暴露处理,每隔2小时直肠温度,8小时后断颈处死小鼠,取腹股沟部脂肪,进行组织学分析。组织学分析包括组织固定、石蜡包埋、切片、ucp1的免疫组化及he染色实验委托上海瑞雨生物技术有限公司代做。q-pcr的实验方法参考1.4.4-1.4.5,western的实验方法参考1.4.6-1.4.7。5.2.3数据分析数据差异性由studentttest方法分析,p<0.05时,认为有统计学差异。5.3结果将两组小鼠同时暴露在4℃环境中8小时后,取出小鼠的腹股沟白色脂肪进行ucp1的免疫组化检测显示敲减组的小鼠的皮下脂肪出现了明显的ucp1表达,he染色可见显著的脂滴变小(图14)。qpcr及western结果可见在腹股沟脂肪中敲减gstm1后,棕色化相关基因表达升高,ucp1的蛋白水平表达增高(图15-16)。说明在小鼠腹股沟脂肪中敲减gstm1后,皮下白色脂肪组织出现明显的棕色化。实施例6、依他尼酸可抑制高脂饮食诱导的小鼠体重增加6.1材料6.1.1雄性c57bl/6j小鼠(4-6week)(南京大学模式动物研究中心)6.1.2高脂饲料(researchdiets,usa)6.1.3天平(sartorius公司,germany)6.1.4依他尼酸(北京中科质检生物技术有限公司)6.1.5蓖麻油(sigma公司,usa)6.2方法6.2.1小鼠的饲养和给药c57bl/6小鼠在复旦大学spf级实验动物研究中心实验室饲养。饲养温度维持在22±1℃,湿度维持在45±10%,每12小时进行光暗循环。除非特殊提及,所有小鼠均可随时获取水和食物。诱导肥胖小鼠模型所用的高脂饲料脂肪含量为60%。将6-8周的成年雄性c57bl/6j小鼠随机分为2组(6-7只/组),分别为空白对照组(pbs+5%乙醇+5%蓖麻油)、依他尼酸处理组(5mg/kg)。在用高脂饮食饲养小鼠的同时,以腹腔给药的方式对小鼠进行处理,每天注射一次,给药持续八周,每隔三天记录一次小鼠的体重变化情况。6.2.2数据分析数据差异性由studentttest方法分析,p<0.05时,认为有统计学差异。6.3结果腹腔注射依他尼酸的小鼠体重明显低于对照组小鼠,两组之间的体重差异具有统计学差异,如图17a所示。给药组小鼠的体重增长明显比对照组慢,如图17b所示。由此可知,在高脂饲养条件下,腹腔注射依他尼酸显著抑制了小鼠的体重增长。实施例7、腹腔注射依他尼酸可减少高脂饮食饲养的小鼠的脂肪组织含量7.1材料7.1.1雄性c57bl/6j小鼠(4-6周,上海斯莱克实验动物有限公司)7.1.2高脂饲料(researchdiets,usa)7.1.3多聚甲醛(4%,sigma)7.1.4依他尼酸(北京中科质检生物技术有限公司)7.1.5蓖麻油(sigma)7.1.6nmr(bruker公司,germany)7.2方法7.2.1小鼠的饲养、给药及脂肪组织含量检测c57bl/6小鼠在复旦大学spf级实验动物研究中心实验室饲养。饲养温度维持在22±1℃,湿度维持在45±10%,每12小时进行光暗循环。除非特殊提及,所有小鼠均可随时获取水和食物。诱导肥胖小鼠模型所用的高脂饲料脂肪含量为60%。将6-8周的成年雄性c57bl/6j小鼠随机分为2组(6-7只/组),分别为空白对照组(pbs+5%乙醇+5%蓖麻油)、依他尼酸处理组(5mg/kg)。在使用高脂饮食饲养小鼠的同时,以腹腔给药的方式对小鼠进行处理,每天注射一次,给药持续八周。给药8周后,对各处理组小鼠进行核磁共振检测。断颈处死小鼠,解剖取出小鼠的腹股沟部脂肪(皮下脂肪),附睾部脂肪(内脏脂肪)和肩胛间区的棕色脂肪(bat)。7.2.2数据分析数据差异性由studentttest方法分析,p<0.05时,认为有统计学差异。7.3结果腹腔注射依他尼酸可显著改善高脂饮食诱导的小鼠的体型异常(图18a)。给药2个月后,将小鼠断颈处死,分别剥离小鼠的腹股沟白色脂肪、附睾部白色脂肪及肩胛部棕色脂肪,发现腹腔注射依他尼酸的小鼠脂肪组织的体积(图18b)显著小于对照组小鼠。另外,核磁共振结果可见依他尼酸处理组小鼠的机体脂肪含量明显低于对照组,肌肉组织含量显著高于对照组(图18c)。由此可见,腹腔注射依他尼酸可有效抑制高脂饮食导致的小鼠脂肪堆积。实施例8、腹腔注射依他尼酸可缓解高脂饮食饲养的小鼠血糖、血脂异常8.1材料8.1.1雄性c57bl/6j小鼠(4-6周,上海斯莱克实验动物有限公司)8.1.2高脂饲料(researchdiets,usa)8.1.3微量采血管8.1.4依他尼酸(北京中科质检生物技术有限公司)8.1.5蓖麻油(sigma)8.1.6异氟烷8.1.7血糖试纸(roche)8.1.8血糖监测仪(roche)8.2方法8.2.1小鼠的饲养、给药c57bl/6小鼠在复旦大学spf级实验动物研究中心实验室饲养。饲养温度维持在22±1℃,湿度维持在45±10%,每12小时进行光暗循环。除非特殊提及,所有小鼠均可随时获取水和食物。诱导肥胖小鼠模型所用的高脂饲料脂肪含量为60%。将6-8周的成年雄性c57bl/6j小鼠随机分为2组(6-7只/组),分别为空白对照组(pbs+5%乙醇+5%蓖麻油)、依他尼酸处理组(5mg/kg)。在使用高脂饮食饲养小鼠的同时,以腹腔给药的方式对小鼠进行处理,每天注射一次,给药持续八周。8.2.2小鼠血清学指标的检测给药处理8周后,用异氟烷麻醉小鼠,使用微量采血管进行小鼠的眼内眦静脉取血,离心后取血清,然后利用全自动生化仪对血清中各项生化指标进行检测分析。8.2.3数据分析使用studentttest方法分析数据差异,p<0.05时,认为有统计学意义。8.3结果通过实验我们发现,与对照组小鼠相比,依他尼酸处理组小鼠的随机血糖、空腹血糖的水平及血液中甘油三酯含量都有显著性的降低(图19)。实施例9、腹腔注射依他尼酸可显著改善高脂饮食诱导的肥胖小鼠的葡萄糖耐量及胰岛素耐量的降低9.1材料9.1.1雌性c57bl/6j小鼠(4-6周,上海斯莱克实验动物有限公司)9.1.2高脂饲料(researchdiets,usa)9.1.3依他尼酸(北京中科质检生物技术有限公司)9.1.4蓖麻油(sigma)9.1.5血糖试纸(roche)9.1.6血糖监测仪(roche)9.2实验方法9.2.1小鼠的饲养及给药c57bl/6小鼠在复旦大学spf级实验动物研究中心实验室饲养。饲养温度维持在22±1℃,湿度维持在45±10%,每12小时进行光暗循环。除非特殊提及,所有小鼠均可随时获取水和食物。诱导肥胖小鼠模型所用的高脂饲料脂肪含量为60%。将6-8周的成年雄性c57bl/6j小鼠随机分为2组(6-7只/组),分别为空白对照组(pbs+5%乙醇+5%蓖麻油)、依他尼酸处理组(5mg/kg)。在使用高脂饮食饲养小鼠的同时,以腹腔给药的方式对小鼠进行处理,每天注射一次,给药持续八周。9.2.2葡萄糖耐受实验(gtt)及胰岛素耐受实验(itt)葡萄糖耐受实验(gtt):对小鼠进行禁食处理16小时后,腹腔注射2mg/kg体重的葡萄糖注射液,并分别在注射后0分钟、30分钟、60分钟、90分钟、120分钟时,检测小鼠的尾静脉血糖高低以评估不同处理组小鼠的葡萄糖耐受情况。胰岛素耐受实验(itt):对小鼠进行禁食处理4小时后,腹腔注射0.75u/kg体重的胰岛素,并在注射后0分钟、30分钟、60分钟、90分钟、120分钟时,检测小鼠的尾静脉血糖高低以评估不同处理组小鼠的胰岛素耐受情况。9.2.3数据分析使用studentttest方法分析数据差异,p<0.05时,认为有统计学意义。9.3结果如图20所示,在高脂饮食诱导的肥胖小鼠模型中,腹腔注射依他尼酸可显著改善小鼠的葡萄糖耐受(图20a)及胰岛素耐受(图20b)异常情况。实施例10、腹腔注射依他尼酸可增强高脂饮食诱导的肥胖小鼠的氧消耗和能量消耗10.1材料及仪器10.1.1雄性c57bl/6j小鼠(4-6周,上海斯莱克实验动物有限公司)10.1.2高脂饲料(researchdiets,usa)10.1.3依他尼酸(北京中科质检生物技术有限公司)10.1.4蓖麻油(sigma)10.1.5小动物代谢监测系统:(columbus公司,usa)10.2方法10.2.1小鼠的饲养及给药处理c57bl/6小鼠在复旦大学spf级实验动物研究中心实验室饲养。饲养温度维持在22±1℃,湿度维持在45±10%,每12小时进行光暗循环。除非特殊提及,所有小鼠均可随时获取水和食物。诱导肥胖小鼠模型所用的高脂饲料脂肪含量为60%。将6-8周的成年雄性c57bl/6j小鼠随机分为2组(6-7只/组),分别为空白对照组(pbs+5%乙醇+5%蓖麻油)、依他尼酸处理组(5mg/kg)。在使用高脂饮食饲养小鼠的同时,以腹腔给药的方式对小鼠进行处理,每天注射一次,给药持续八周。10.2.2小鼠的能量代谢情况监测使用小动物新陈代谢监测系统(代谢笼)对不同处理组的小鼠进行能量代谢分析及昼夜活动监测,监测时间共为72小时。10.2.3数据分析使用studentttest方法分析数据差异,p<0.05时,认为有统计学意义。10.3结果如图21所示,在高脂饮食诱导的肥胖小鼠模型中,相比于空白对照小鼠,依他尼酸处理组小鼠在白循环中的氧耗量和能量消耗均显著增加。实施例11、腹腔注射依他尼酸可增强高脂饮食诱导的肥胖小鼠的冷耐受11.1材料及仪器11.1.1雄性c57bl/6j小鼠(4-6周,上海斯莱克实验动物有限公司)11.1.2高脂饲料(researchdiets,usa)11.1.3依他尼酸(北京中科质检生物技术有限公司)11.1.4蓖麻油(sigma)11.1.5小鼠直肠温度检测仪(physitemp,usa)11.2方法11.2.1小鼠的饲养及给药处理c57bl/6小鼠在复旦大学spf级实验动物研究中心实验室饲养。饲养温度维持在22±1℃,湿度维持在45±10%,每12小时进行光暗循环。除非特殊提及,所有小鼠均可随时获取水和食物。诱导肥胖小鼠模型所用的高脂饲料脂肪含量为60%。将6-8周的成年雄性c57bl/6j小鼠随机分为2组(6-7只/组),分别为空白对照组(pbs+5%乙醇+5%蓖麻油)、依他尼酸处理组(5mg/kg)。在使用高脂饮食饲养小鼠的同时,以腹腔给药的方式对小鼠进行处理,每天注射一次,给药持续八周。11.2.2小鼠在冷暴露情况下的直肠温度监测对不同处理组的小鼠进行4℃冷暴露处理,共处理8小时,每两小时监测小鼠直肠温度。11.2.3数据分析使用studentttest方法分析数据差异,p<0.05时,认为有统计学意义。11.3结果如图22所示,在高脂饮食诱导的肥胖小鼠模型中,对不同处理组小鼠进行冷暴露处理,虽然两组小鼠的体温都随时间延长而逐渐降低,但在冷暴露6小时及8小时时,依他尼酸处理组小鼠的体温显著高于对照组,说明依他尼酸处理组小鼠在受到低温刺激时,保存自身体温的能力高于对照组,冷耐受能力增加,提示机体产热性脂肪组织的功能增强,机体产热增多。实施例12、腹腔注射依他尼酸可促进高脂饮食诱导的肥胖小鼠的白色脂肪发生棕色化12.1材料及仪器12.1.1雌性c57bl/6j小鼠(4-6周,上海斯莱克实验动物有限公司)12.1.2高脂饲料(researchdiets,usa)12.1.3依他尼酸(北京中科质检生物技术有限公司)12.1.4蓖麻油(sigma)12.1.5组织研磨仪(tissuelyser-24)12.2方法12.2.1小鼠的饲养及给药处理c57bl/6小鼠在复旦大学spf级实验动物研究中心实验室饲养。饲养温度维持在22±1℃,湿度维持在45±10%,每12小时进行光暗循环。除非特殊提及,所有小鼠均可随时获取水和食物。诱导肥胖小鼠模型所用的高脂饲料脂肪含量为60%。将6-8周的成年雄性c57bl/6j小鼠随机分为2组(6-7只/组),分别为空白对照组(pbs+5%乙醇+5%蓖麻油)、依他尼酸处理组(5mg/kg)。在使用高脂饮食饲养小鼠的同时,以腹腔给药的方式对小鼠进行处理,每天注射一次,给药持续八周。12.2.2白色脂肪棕色化相关基因的检测给药8周后,对各处理组小鼠进行4℃的冷暴露处理,共处理八小时。随后断颈处死小鼠,依次取其腹股沟脂肪组织、内脏脂肪组织及肩胛部的棕色脂肪组织。每种组织均分为两部分,一部分通过组织研磨后抽提组织蛋白和rna,分别进行westernblotting及q-pcr来检测相关蛋白的表达,另一部分固定在4%的多聚甲醛中,进行后续的he染色及ucp1染色分析。12.2.3数据分析使用studentttest方法分析数据差异,p<0.05时,认为有统计学意义。12.3结果如图23a,在依他尼酸处理的小鼠白色脂肪组织中,均能检测到ucp1及其他相关棕色化相关蛋白如cd137、prdm16的基因表达水平升高,同时依他尼酸处理组小鼠白色脂肪组织中ucp1蛋白的表达水平也有显著上升(图23b)。对各处理组小鼠的腹股沟白色脂肪组织进行he染色,并使用ucp1的抗体对脂肪组织进行免疫组化染色。根据染色结果可以看出,依他尼酸处理组小鼠的白色脂肪组织中脂肪细胞体积变小,脂质累积显著减少。另外,ucp1在依他尼酸处理组小鼠的白色脂肪组织中呈一定程度的深染,说明ucp1的蛋白表达增加(图23c),腹股沟白色脂肪发生显著的棕色化。实施例13、依他尼酸可以降低高脂饮食诱导的肥胖小鼠(dio)的体重13.1材料13.1.1雌性c57bl/6j小鼠(4-6week)(南京大学模式动物研究中心)13.1.2高脂饲料(researchdiets,usa)13.1.3天平(sartorius公司,germany)13.1.4依他尼酸(北京中科质检生物技术有限公司)13.1.5蓖麻油(sigma公司,usa)13.2方法13.2.1小鼠的饲养和给药c57bl/6小鼠在复旦大学spf级实验动物研究中心实验室饲养。饲养温度维持在22±1℃,湿度维持在45±10%,每12小时进行光暗循环。除非特殊提及,所有小鼠均可随时获取水和食物。诱导肥胖小鼠模型所用的高脂饲料脂肪含量为60%。使用高脂饮食饲养6-8周的成年雄性c57bl/6j小鼠2个月,构建二型糖尿病及肥胖的小鼠模型(即dio小鼠)。将dio小鼠随机分为2组(7只/组),分别为空白对照组(pbs+5%乙醇+5%蓖麻油)、依他尼酸处理组(5mg/kg)。以腹腔给药的方式对小鼠进行处理,每天注射一次,给药持续4周,每隔三天记录一次小鼠的体重变化情况。13.2.2数据分析使用studentttest方法分析数据差异,p<0.05时,认为有统计学意义。13.3结果如图24a所示,在dio小鼠模型中,依他尼酸处理组小鼠的体重明显低于对照组。随着给药时间的延长,dio小鼠的体重降低愈加显著(图24b)。实施例14、腹腔注射依他尼酸可显著减少dio小鼠的脂肪组织含量14.1材料14.1.1雌性c57bl/6j小鼠(4-6周,上海斯莱克实验动物有限公司)14.1.2高脂饲料(researchdiets,usa)14.1.3依他尼酸(北京中科质检生物技术有限公司)14.1.4蓖麻油(sigma)14.1.5nmr(bruker公司,germany)14.2方法14.2.1小鼠的饲养、给药及脂肪组织含量检测c57bl/6小鼠在复旦大学spf级实验动物研究中心实验室饲养。饲养温度维持在22±1℃,湿度维持在45±10%,每12小时进行光暗循环。除非特殊提及,所有小鼠均可随时获取水和食物。诱导肥胖小鼠模型所用的高脂饲料脂肪含量为60%。使用高脂饮食饲养6-8周的成年雄性c57bl/6j小鼠2个月,构建二型糖尿病及肥胖的小鼠模型(即dio小鼠)。将dio小鼠随机分为2组(7只/组),分别为空白对照组(pbs+5%乙醇+5%蓖麻油)、依他尼酸处理组(5mg/kg)。以腹腔给药的方式对小鼠进行处理,每天注射一次,给药持续4周。给药4周后,对各处理组小鼠进行核磁共振检测以判断脂肪含量及肌肉含量的高低。断颈处死小鼠,解剖取出小鼠的腹股沟部脂肪(皮下脂肪),附睾部脂肪(内脏脂肪)和肩胛间区的棕色脂肪(bat)。14.2.2数据分析数据差异性由studentttest方法分析,p<0.05时,认为有统计学差异。14.3结果腹腔注射依他尼酸可显著改善dio小鼠的体型异常(图25a)。给药4周后,断颈处死小鼠,分别剥离小鼠的腹股沟白色脂肪、附睾部白色脂肪及肩胛部棕色脂肪,发现腹腔注射依他尼酸组的小鼠脂肪组织的体积(图25b)显著小于对照组小鼠。另外,核磁共振结果可见依他尼酸处理组小鼠的机体脂肪含量明显低于对照组,肌肉组织含量显著高于对照组(图25c)。由此可见,腹腔注射依他尼酸可有效抑制dio小鼠的脂肪堆积。实施例15、腹腔注射依他尼酸可改善dio小鼠的糖代谢紊乱15.1材料15.1.1雌性c57bl/6j小鼠(4-6周,上海斯莱克实验动物有限公司)15.1.2高脂饲料(researchdiets,usa)15.1.3依他尼酸(北京中科质检生物技术有限公司)15.1.4蓖麻油(sigma)15.1.5血糖试纸(roche)15.1.6血糖监测仪(roche)15.2方法15.2.1小鼠的饲养、给药c57bl/6小鼠在复旦大学spf级实验动物研究中心实验室饲养。饲养温度维持在22±1℃,湿度维持在45±10%,每12小时进行光暗循环。除非特殊提及,所有小鼠均可随时获取水和食物。诱导肥胖小鼠模型所用的高脂饲料脂肪含量为60%。使用高脂饮食饲养6-8周的成年雄性c57bl/6j小鼠2个月,构建二型糖尿病及肥胖的小鼠模型(即dio小鼠)。将dio小鼠随机分为2组(7只/组),分别为空白对照组(pbs+5%乙醇+5%蓖麻油)、依他尼酸处理组(5mg/kg)。以腹腔给药的方式对小鼠进行处理,每天注射一次,给药持续4周。15.2.2dio小鼠空腹血糖、随机血糖、gtt、itt检测依他尼酸处理dio小鼠4周后,从小鼠尾静脉采血,使用血糖仪检测小鼠的随机血糖及空腹血糖。gtt:dio小鼠禁食处理16小时后,腹腔注射2mg/kg体重的葡萄糖注射液,并分别在注射后0分钟、30分钟、60分钟、90分钟、120分钟时,检测小鼠的尾静脉血糖高低以评估不同处理组小鼠的葡萄糖耐受情况;itt:dio小鼠禁食处理4小时后,腹腔注射0.75u/kg体重的胰岛素,并在注射后0分钟、30分钟、60分钟、90分钟、120分钟时,检测小鼠的尾静脉血糖高低以评估不同处理组小鼠的胰岛素耐受情况;15.2.3数据分析使用studentttest方法分析数据差异,p<0.05时,认为有统计学意义。15.3结果如图26a所示,在dio小鼠模型中,相比于对照组小鼠,依他尼酸处理组小鼠的随机血糖及空腹血糖均有显著降低。另外,腹腔注射依他尼酸也可改善dio小鼠的葡萄糖耐受(图26b)及胰岛素耐受(图26c)异常情况。实施例16、腹腔注射依他尼酸可增强dio小鼠的氧气消耗和能量消耗16.1材料及仪器16.1.1雌性c57bl/6j小鼠(4-6周,上海斯莱克实验动物有限公司)16.1.2高脂饲料(researchdiets,usa)16.1.3依他尼酸(北京中科质检生物技术有限公司)16.1.4蓖麻油(sigma)16.1.5小动物代谢监测系统:(columbus公司,usa)16.2方法16.2.1小鼠的饲养、给药c57bl/6小鼠在复旦大学spf级实验动物研究中心实验室饲养。饲养温度维持在22±1℃,湿度维持在45±10%,每12小时进行光暗循环。除非特殊提及,所有小鼠均可随时获取水和食物。诱导肥胖小鼠模型所用的高脂饲料脂肪含量为60%。使用高脂饮食饲养6-8周的成年雄性c57bl/6j小鼠2个月,构建二型糖尿病及肥胖的小鼠模型(即dio小鼠)。将dio小鼠随机分为2组(7只/组),分别为空白对照组(pbs+5%乙醇+5%蓖麻油)、依他尼酸处理组(5mg/kg)。以腹腔给药的方式对小鼠进行处理,每天注射一次,给药持续4周。16.2.2dio小鼠的能量代谢情况监测使用小动物新陈代谢监测系统(代谢笼)对不同处理组的小鼠进行能量代谢分析及昼夜活动监测,监测时间共为72小时。16.2.3数据分析使用studentttest方法分析数据差异,p<0.05时,认为有统计学意义。16.3结果如图27所示,在dio小鼠模型中,相比于空白对照小鼠,依他尼酸处理组小鼠在白循环和夜循环中的氧耗量和能量消耗均显著增加。实施例17、腹腔注射依他尼酸可促进dio小鼠的白色脂肪发生棕色化17.1材料及仪器17.1.1雌性c57bl/6j小鼠(4-6周,上海斯莱克实验动物有限公司)17.1.2高脂饲料(researchdiets,usa)17.1.3依他尼酸(北京中科质检生物技术有限公司)17.1.4蓖麻油(sigma)17.1.5组织研磨仪(tissuelyser-24)17.2方法17.2.1小鼠的饲养及给药处理c57bl/6小鼠在复旦大学spf级实验动物研究中心实验室饲养。饲养温度维持在22±1℃,湿度维持在45±10%,每12小时进行光暗循环。除非特殊提及,所有小鼠均可随时获取水和食物。诱导肥胖小鼠模型所用的高脂饲料脂肪含量为60%。使用高脂饮食饲养6-8周的成年雄性c57bl/6j小鼠2个月,构建二型糖尿病及肥胖的小鼠模型(即dio小鼠)。将dio小鼠随机分为2组(7只/组),分别为空白对照组(pbs+5%乙醇+5%蓖麻油)、依他尼酸处理组(5mg/kg)。以腹腔给药的方式对小鼠进行处理,每天注射一次,给药持续4周。17.2.2白色脂肪棕色化相关基因的检测依他尼酸处理4周后,在4℃冰柜中对小鼠进行冷暴露8小时。随后断颈处死小鼠,依次剖离其腹股沟脂肪组织、内脏脂肪组织及肩胛部的棕色脂肪组织。每种组织均分为两部分,一部分通过组织研磨后抽提组织蛋白和rna,分别进行westernblotting及q-pcr来检测相关蛋白的表达,另一部分固定在4%的多聚甲醛中,进行后续的he染色及ucp1染色分析。17.2.3数据分析使用studentttest方法分析数据差异,p<0.05时,认为有统计学意义。17.3结果如图28a,在依他尼酸处理的dio小鼠白色脂肪组织中,能检测到ucp1基因表达水平升高。对各处理组小鼠的腹股沟白色脂肪组织进行he染色,并使用ucp1的抗体对脂肪组织进行免疫组化染色。根据染色结果可以看出,依他尼酸处理组小鼠的白色脂肪组织中脂肪细胞体积变小,脂质累积显著减少。另外,ucp1在依他尼酸处理组小鼠的白色脂肪组织中呈一定程度的深染,说明ucp1的蛋白表达增加(图28b),dio小鼠腹股沟白色脂肪发生显著的棕色化。序列表<110>复旦大学<120>依他尼酸在制备治疗和预防肥胖及相关代谢性疾病药物中的应用<130>001<160>34<170>siposequencelisting1.0<210>1<211>23<212>dna<213>人工序列(artificialsequence)<400>1ggcccttgtaaacaacaaaatac23<210>2<211>23<212>dna<213>人工序列(artificialsequence)<400>2ggcaacaagagctgacagtaaat23<210>3<211>23<212>dna<213>人工序列(artificialsequence)<400>3accatgactactgtcagtcactc23<210>4<211>22<212>dna<213>人工序列(artificialsequence)<400>4gtcacaggaggcatctttgaag22<210>5<211>21<212>dna<213>人工序列(artificialsequence)<400>5tgttcctcttaatcctgccca21<210>6<211>21<212>dna<213>人工序列(artificialsequence)<400>6ccaacctgcacaagttccctt21<210>7<211>19<212>dna<213>人工序列(artificialsequence)<400>7cctttgtgggaacctggaa19<210>8<211>18<212>dna<213>人工序列(artificialsequence)<400>8ctgtcgtctgcggtgatt18<210>9<211>22<212>dna<213>人工序列(artificialsequence)<400>9atacataaagtccttcccgctg22<210>10<211>22<212>dna<213>人工序列(artificialsequence)<400>10gtgatttgtccgttgtctttcc22<210>11<211>19<212>dna<213>人工序列(artificialsequence)<400>11ccaccagcgaggacttcac19<210>12<211>21<212>dna<213>人工序列(artificialsequence)<400>12ggaggactctcgtagctcgaa21<210>13<211>20<212>dna<213>人工序列(artificialsequence)<400>13cggctaccacatccaaggaa20<210>14<211>18<212>dna<213>人工序列(artificialsequence)<400>14gctggaattaccgcggct18<210>15<211>21<212>dna<213>人工序列(artificialsequence)<400>15atcttcagagcagttcaaggg21<210>16<211>21<212>dna<213>人工序列(artificialsequence)<400>16gctttgtccctttcctaaacg21<210>17<211>20<212>dna<213>人工序列(artificialsequence)<400>17tgtgggacgagttcaatcag20<210>18<211>19<212>dna<213>人工序列(artificialsequence)<400>18tgtcatctacgggcacaaa19<210>19<211>21<212>dna<213>人工序列(artificialsequence)<400>19ctctggtagcggacattacac21<210>20<211>20<212>dna<213>人工序列(artificialsequence)<400>20gagcaaggaatagggaaggg20<210>21<211>22<212>dna<213>人工序列(artificialsequence)<400>21gttcttgaagaccatccctgag22<210>22<211>21<212>dna<213>人工序列(artificialsequence)<400>22gggctcaaacatacggtactg21<210>23<211>21<212>dna<213>人工序列(artificialsequence)<400>23gggtggagtttgaagagaagt21<210>24<211>21<212>dna<213>人工序列(artificialsequence)<400>24tggcgatgtagttgagaatgg21<210>25<211>21<212>dna<213>人工序列(artificialsequence)<400>25ccagatgacccgtacaagaag21<210>26<211>22<212>dna<213>人工序列(artificialsequence)<400>26gttcggagagtcttcctttctc22<210>27<211>21<212>dna<213>人工序列(artificialsequence)<400>27cgcatcctggaactcttctac21<210>28<211>22<212>dna<213>人工序列(artificialsequence)<400>28ccgcaactgcagctttatattc22<210>29<211>20<212>dna<213>人工序列(artificialsequence)<400>29tgccatcttgagacaccttg20<210>30<211>21<212>dna<213>人工序列(artificialsequence)<400>30gttggtgtagatgagggtgac21<210>31<211>22<212>dna<213>人工序列(artificialsequence)<400>31gatgaggtatccatggctgatg22<210>32<211>22<212>dna<213>人工序列(artificialsequence)<400>32gttgatgtgactgatggtaggg22<210>33<211>20<212>dna<213>人工序列(artificialsequence)<400>33cggctaccacatccaaggaa20<210>34<211>18<212>dna<213>人工序列(artificialsequence)<400>34gctggaattaccgcggct18当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1