藏红花花瓣精制醇提物及其制备方法和应用与流程
本发明属于藏红花活性成分提取技术领域,尤其涉及藏红花花瓣精制醇提物及其制备方法和应用。
背景技术:
藏红花(saffron,crocussativusl.),又名番红花、西红花、洎夫蓝、撒法即,为鸢尾科番红花属多年生草本植物,据《中华人名共和国药典》记载,其药用部位为干燥的花柱,藏红花作为传统中药其功效为:活血化瘀,凉血解毒,解郁安神。用于经闭癥瘕,产后瘀阻,温毒发斑,忧郁痞闷,惊悸发狂等。除药用外,它可用作食品添加剂、食用色素和高级香料。近年对藏红花的药理研究表明,其花柱中的主要有效成分—藏红花苷对于癌症、冠心病、动脉粥样硬化、高血脂症等多种疾病具有较好的防治作用。其花柱因产量极低同时具有神奇的药效而被世人封以“植物黄金”的称号,同时,大量的非药用部位—花瓣在藏红花的制药工业中成为副产品,造成极大的资源浪费。
现有技术对藏红花花瓣的活性成分提取工艺,提取率低,提取获得的成分活性低。
技术实现要素:
有鉴于此,本发明提供一种提取率高,抗氧化、降血脂活性高的藏红花花瓣精制醇提物的制备方法和藏红花花瓣精制醇提物的应用。
为了实现上述目的,本发明提供了以下技术方案:藏红花花瓣精制醇提物的制备方法,包括以下步骤:1)将藏红花花瓣粉末与体积分数为55~65%的乙醇以1g:(15~25)ml的比例混合置于65~75℃提取1.5~2.5h后固液分离,获得第一提取液和第一料渣;2)以所述第一料渣为原料与体积分数为55~65%的乙醇按照步骤1)中所述的比例、温度和时间进行第二提取,获得第二提取液和第二料渣;3)以所述第二料渣为原料与体积分数为55~65%的乙醇按照步骤1)中所述的比例、温度和时间进行第三提取,获得第三提取液和第三料渣;4)将所述第一提取液、第二提取液和第三提取液混合获得藏红花花瓣粗提液;5)将所述藏红花花瓣粗提液经过真空冷冻干燥,得到的棕褐色粉末即为藏红花花瓣粗提物;6)将所述藏红花花瓣粗提物用乙醇水溶液溶解,过大孔树脂进行纯化藏红花花瓣精制醇提物,色谱柱的径高比为1:(8~12);上样体积为(0.8~1.1)倍柱体积,上样浓度为85~115mg/ml;洗脱剂为乙醇水溶液,所述洗脱剂的体积为3.5~4.5倍柱体积;所述大孔树脂循环吸附时间为1.5~2.5h,动态解吸附时间为1.5~2.5h。
优选的,所述大孔树脂为hpd826型大孔树脂。
优选的,所述洗脱剂乙醇水溶液的体积浓度为55~65%。
优选的,色谱柱的径高比为1:(9~11)。
优选的,上样溶液为55~65%的乙醇水溶液,上样体积为1倍柱体积,上样浓度为95~105mg/ml。
优选的,所述洗脱剂的体积为4倍柱体积,所述大孔树脂循环吸附时间为2h,动态解吸附时间为2h。
本发明还提供了上述制备方法制备获得的藏红花花瓣精制醇提物,所述藏红花花瓣精制醇提物中包括黄酮醇类物质,多酚类物质、皂苷类物质和糖类物质。
优选的,所述黄酮醇类的含量为19~20%,其中包括山奈酚13.5~14%、槲皮素4.5~4.6%、异鼠李素0.8~1.0%。
优选的,所述多酚类物质的含量为18.15%~18.29%;所述皂苷类物质的含量为16.18%~17.22%;所述糖类物质的含量为8.75%~9.65%。
本发明还提供了所述的藏红花花瓣精制醇提物在制备药品、保健品和化妆品中的应用。
本发明的有益效果:本发明中所述藏红花花瓣精制醇提物的制备方法,通过将藏红花花瓣粉末与乙醇以1g:(15~25)ml的比例混合置于65~75℃提取1.5~2.5h,提取三次后,过大孔树脂纯化,获得的藏红花花瓣精制醇提物得率高,每100g(干重)藏红花花瓣可提取获得(9.71±1.18)g精制醇提物,得率为9.71%。采用模型小鼠体内脂质过氧化及黄嘌呤氧化酶活性的影响和高血脂症的防治作用的评价系统,结果表面本发明所述的藏红花花瓣精制醇提物具有良好的抗氧化、降血脂的活性。
附图说明
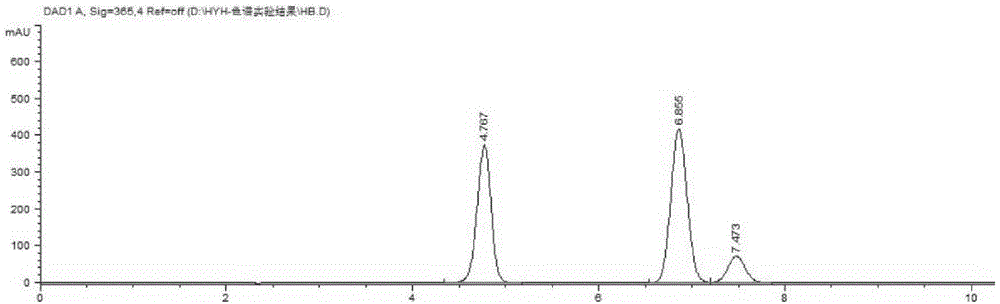
图1为槲皮素、异鼠李山奈酚混合液的高效相色谱峰图;
图2为epc的高效液相色谱图;
图3为在epc溶液中加入三种标准品的高效液相色谱图;
图4为不同浓度epc对红细胞自发性氧化溶血的抑制作用;
图5为不同浓度epc对过氧化氢诱导红细胞溶血的抑制作用;
图6为不同浓度epc对肝脏自发性脂质过氧化的抑制作用;
图7为不同浓度epc对过氧化氢诱导的肝脏脂质抑制作用;
图8为epc对黄嘌呤氧化酶的抑制作用;
图9为实施例4中饲喂高脂饲料后各组小鼠血清胆固醇水平;
图10为实施例4中各给药组(100,200和500mg/kgepc)的降脂率。
具体实施方式
本发明提供了藏红花花瓣精制醇提物的制备方法,包括以下步骤:1)将藏红花花瓣粉末与体积分数为55~65%的乙醇以1g:(15~25)ml的比例混合置于65~75℃提取1.5~2.5h后固液分离,获得第一提取液和第一料渣;2)以所述第一料渣为原料与体积分数为55~65%的乙醇按照步骤1)中所述的比例、温度和时间进行第二提取,获得第二提取液和第二料渣;3)以所述第二料渣为原料与体积分数为55~65%的乙醇按照步骤1)中所述的比例、温度和时间进行第三提取,获得第三提取液和第三料渣;4)将所述第一提取液、第二提取液和第三提取液混合获得藏红花花瓣粗提液;5)将所述藏红花花瓣粗提液经过真空冷冻干燥,得到的棕褐色粉末即为藏红花花瓣粗提物;6)将所述藏红花花瓣粗提物用乙醇水溶液溶解,过大孔树脂进行纯化,色谱柱的径高比为1:(8~12);上样体积为(0.8~1.1)倍柱体积,上样浓度为85~115mg/ml;洗脱剂为乙醇水溶液,所述洗脱剂的体积为3.5~4.5倍柱体积;所述大孔树脂循环吸附时间为1.5~2.5h,动态解吸附时间为1.5~2.5h。
在本发明中,以藏红花花瓣为原料,所述藏红花花瓣优选为去除藏红花花柱的干燥花瓣。本发明中,所述藏红花花瓣优选的烘干至恒重后进行粉碎获得藏红花花瓣粉末;所述藏红花花瓣粉末的粒度优选的小于30目。本发明中所述藏红花花瓣粉末优选的采用石油醚脱脂后,烘干备用。本发明中所述烘干的温度优选为50~60℃,更优选为56℃。本发明中,所述藏红花花瓣粉末优选的密封避光保存。
本发明将上述藏红花花瓣粉末与体积分数为55~65%的乙醇以1g:(15~25)ml的比例混合置于65~75℃提取1.5~2.5h后固液分离,获得第一提取液和第一料渣。在本发明中,所述乙醇的体积分数优选为58~62%,更优选为60%;所述藏红花花瓣粉末与乙醇的比例优选为1g:(17~23)ml,更优选为1g:20ml。本发明中所述第一提取的温度优选为68~72℃,更优选为70℃,所述第一提取的时间优选为2h。
本发明在获得第一药渣后,以所述第一料渣为原料与体积分数为55~65%的乙醇按照步骤1)中所述的比例、温度和时间进行第二提取,获得第二提取液和第二料渣;本发明中所述第二提取的料液比例、温度和时间在步骤1)中所述范围内独立选择。
本发明在获得第二药渣后,以所述第二料渣为原料与体积分数为55~65%的乙醇按照步骤1)中所述的比例、温度和时间进行第三提取,获得第三提取液和第三料渣;本发明中所述第三提取的料液比例、温度和时间在步骤1)中所述范围内独立选择。
本发明将所述第一提取液、第二提取液和第三提取液混合获得藏红花花瓣粗提液。本发明在获得将所述藏红花花瓣粗提液后经过真空冷冻干燥,得到的棕褐色粉末即为藏红花花瓣粗提物;将所述藏红花花瓣粗提物用乙醇水溶液溶解,过大孔树脂进行纯化藏红花花瓣精制醇提物。在本发明中,所述大孔树脂优选为hpd826型大孔树脂。所述色谱柱的径高比为1:(8~12),优选为1:(9~11),更优选为1:10;所述上样体积为(0.8~1.1)倍柱体积,优选为1倍柱体积,所述上样溶液为55~65%的乙醇水溶液,上样浓度为85~115mg/ml,优选为90~105mg/ml,更优选为100mg/ml;所述洗脱剂乙醇水溶液的体积浓度优选为55~65%,更优选为60%。所述洗脱剂的体积为3.5~4.5倍柱体积,优选为4倍柱体积,所述大孔树脂循环吸附时间为1.5~2.5h,优选为2h,动态解吸附时间为1.5~2.5h,优选为2h。
本发明还提供了上述制备方法制备获得的藏红花花瓣精制醇提物,所述藏红花花瓣精制醇提物中包括黄酮醇类物质,多酚类物质、皂苷类物质和糖类物质。本发明中,所述黄酮醇类的含量优选为19~20%,更优选为19.19%;本发明中所述黄酮醇类包括山奈酚13.5~14%、槲皮素4.5~4.6%、异鼠李素0.8~1.0%;优选的包括山奈酚13.71%、槲皮素4.57%、异鼠李素0.91%。
本发明中,所述藏红花花瓣精制醇提物中多酚类物质的含量优选为18.15%~18.29%;所述皂苷类物质的含量优选为16.18%~17.22%;所述糖类物质的含量优选为8.75%~9.65%。
本发明还提供了所述的藏红花花瓣精制醇提物在制备药品、保健品和化妆品中的应用。
在本发明中,所述的藏红花花瓣精制醇提物具有对红细胞自氧化溶血的抑制作用,对肝脏脂质过氧化具有抑制作用,对黄嘌呤氧化酶具有抑制作用,对高脂血症具有防治作用。本发明所述藏红花花瓣精制醇提物无生理毒性,可以应用于药品、保健品和化妆品的制备。本发明对所述藏红花花瓣精制醇提物在所述药品、保健品和化妆品中的含量没有特殊限定;所述药品、保健品和化妆品中可以只包括所述藏红花花瓣精制醇提物这一种活性成分,也可以包括所述藏红花花瓣精制醇提物和其他活性成分;本发明对所述药品、保健品和化妆品中的辅料没有特殊限定,采用常规可接受的辅料即可。
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
藏红花花瓣:去掉花柱后的干燥花瓣,于56℃烘干至恒重,粉碎成粉,过30目筛,石油醚脱脂,置干燥箱干燥后密封袋中避光备用。
将藏红花花瓣粉末5g与体积分数为60%的乙醇100ml的比例混合置于70℃提取2h后固液分离,获得第一提取液和第一料渣;以所述第一料渣为原料与体积分数为60%的乙醇混合,按照上述条件共进行3次提取;将三次提取的提取液混合获得藏红花花瓣粗提液。
将藏红花花瓣粗体液经过,真空冷冻干燥,得到棕褐色固体粉末即为藏红花花瓣粗提物。
准确称取所述藏红花花瓣粗提物100mg,溶于100ml60%乙醇溶液,用hpd826型大孔树脂进行纯化,具体条件为:色谱柱径高比为1:10;洗脱剂为60%乙醇,洗脱剂体积为4倍柱体积。树脂循环吸附时间为2小时,动态解吸附2小时。
采用上述提取、纯化条件,每100g藏红花花瓣可以得到(9.71±1.18)g精制醇提物(extractfromthepetalsofc.sativus,epc),得率为9.71%。
精密称取藏红花花瓣粉末5.00g,共5份,按上述提取工艺条件提取,进行验证实验,测得平均总黄酮含量为20.451mg·g-1,rsd为0.591%,可见该工艺稳定可行。
实施例2
藏红花花瓣精制醇提物中主要化学成分的含量测定
黄酮醇类的hplc分析
(1)色谱柱:diamonsilc18(4.6mm×150mm,5μm);流动相:甲醇0-4%磷酸(60:40);流速:1ml/min;检测波长:365nm;柱温:25℃;进样量:10μl。
(2)对照品溶液的制备:精密称取山奈酚、槲皮素、异鼠李素对照品,以甲醇为溶剂制备0.24mg/ml的对照品储备液。取储备液0.5ml于10ml量瓶中,用甲醇溶解并稀释至刻度,摇匀,作为对照品溶液。
(3)供试品溶液:取实验室制备epc细粉约1g,精密称定,置烧瓶中,精密加入40ml甲醇,称定重量,加热回流60min,放冷,再称定重量,甲醇补足减失重量,摇匀,滤过。精密量取续滤液10ml,加入36%盐酸使之终浓度为0.4%,置90℃水浴中水解60min,取出,迅速冷却,转移至25ml量瓶中,甲醇稀释至刻度,摇匀,0.45μm微孔滤膜滤过。取续滤液,即得。
采用上述色谱条件,将对照品、epc溶液,以及添加了对照品的epc溶液进行hplc分析,结果见图1、图2和图3。
总糖含量的测定
标准曲线的制备:精密称取105℃干燥至恒重的葡萄糖标准品0.05g,加水溶解后定容至50ml,混匀,制成浓度为1.00mg/ml的葡萄糖标准溶液。精密取标准溶液0、0.1、0.2、0.4、0.6、0.8、1.0ml,各管加水至5ml,混匀,配制成0、0.02、0.04、0.08、0.12、0.16、0.20mg/ml的葡萄糖溶液,各取1.0ml,加入1.0ml蒸馏水,继而加入5%的苯酚溶液1.0ml。混匀后加入5.0ml浓硫酸,充分混匀,室温放置10min后沸水浴加热20min。迅速冷却至室温,在485nm波长处测定吸光度。以葡萄糖浓度(mg/ml)为横坐标,吸光度值为纵坐标,绘制标准曲线。
样品测定:精密取待测溶液1.0ml(1mg/ml),按照标准曲线制备项下的方法测定样品的od值并计算出样品中的总糖含量。
皂苷含量的测定
标准曲线制备:精密称取替告皂苷元对照品2.8mg,用甲醇精确定容至10ml作为标准品溶液。精密量取对照品溶液0.1、0.2、0.3、0.4、0.5、0.6ml于6支干29燥的具塞试管中,水浴挥干溶剂,加入新鲜配制的5%香草醛-冰醋酸溶液0.2ml,高氯酸溶液0.8ml,60℃加热15min,取出,流水冷却2min,加入冰醋酸5ml,混匀,在529nm波长下测定系列标准溶液的吸光度,绘制标准曲线。
样品测定:精密取待测品溶液5ml(0.28mg/ml),按照标准曲线制备项下的方法,自“水浴挥干溶剂”起,按步骤测定吸光度,根据标准曲线和样品的od值计算出样品中的皂苷含量。
多酚含量的测定
取1ml样品溶液(0.1mg/ml)加入10ml容量瓶中,依次加入超纯水1ml,福林酚试剂0.5ml,充分振荡后静置4-5min,再加入1.4mol/lna2co3溶液1ml,定容至10ml,摇匀置于25℃恒温水浴中反应2h,在760nm处测定其吸光度。以一水合没食子酸(5-50μg)为标准品绘制标准曲线,以多酚含量对吸光值(a)进行直线回归,根据回归曲线可求得1ml待测样品中多酚的含量,再进一步计算出1g样品中多酚类物质的含量。
含n量的测定
含n量的测定采用lecofp-528定氮仪,按仪器说明进行。
表1epc成分分析及含量测定
n=3
由上述实验结果可知,epc中主要含有山柰酚、槲皮素、异鼠李素等黄酮醇类,经计算,三种黄酮醇含量依次为:山柰酚13.71%、槲皮素4.57%、异鼠李素0.91%,epc中总黄酮醇类含量为19.91%。除黄酮类成分外,还含有酚类、皂苷、含氮化合物及糖类成分其中多酚类含量高,而含氮化合物含量最低,此类物质可能为蛋白质和生物碱。
实施例3藏红花精制醇提物(epc)对脂质过氧化及黄嘌呤氧化酶活性的影响
对红细胞自发性氧化溶血的抑制作用
epc的制备按照实施例1中所述的方法制得,用蒸馏水溶解后,配置成相应浓度的试样。
小鼠眼眶取血,制成抗凝血,4℃,4000r/min离心5min,去除上层溶液,红细胞用预冷的生理盐水洗涤3次制成0.5%的红细胞悬液备用。取0.5%红细胞悬液1.5ml,分别加入0.1ml试样,空白对照为等体积蒸馏水,混匀,于37℃温育24h后用生理盐水稀释4倍,4000r/min离心10min,取上清液于540nm处测定od值。
对红细胞自氧化溶血的抑制率(%)=(1-a/a0)×100%
式中:a为试样的平均吸光度值,a0为空白对照的平均吸光度值。对过氧化氢诱导红细胞氧化溶血的抑制作用
取2.1制备的0.5%红细胞悬液1ml,分别加入0.1ml试样(空白对照为等体积蒸馏水代替),加入0.5ml的50mmol/lh2o2启动反应,混匀,37℃温育1h后生理盐水稀释4倍,4000r/min离心10min,取上清液于415nm处测定od值。对h2o2诱导的红细胞氧化溶血的抑制率(%)=(1-a/a0)×100%
式中:a为试样的平均吸光度值,a0为空白对照的平均吸光度值。
对肝脏自发性脂质过氧化的抑制作用
小鼠颈椎脱臼致死,迅速取出肝脏,用冰冷的生理盐水洗净,加入10倍体积冰冷的生理盐水,冰浴匀浆,得到10%的肝脏匀浆液备用。取1ml肝匀浆液于玻璃试管中,分别加入0.5ml不同浓度的供试样,空白对照加入等体积蒸馏水,混匀37℃温浴1h,加入1ml的20%三氯乙酸(tca)溶液,混匀后再加入0.7%的硫代巴比妥酸溶液1.5ml,沸水浴保持15min,4000r/min离心10min,取上清液于波长532nm处测定od值。
对肝脏自发性脂质过氧化的抑制率(%)=(1-a/a0)×100%
式中:a为试样的平均吸光度值,a0为空白对照的平均吸光度值。
对过氧化氢诱导的肝脏脂质过氧化的抑制作用
取2.3制备的肝脏匀液1ml,分别加入0.5ml不同浓度的供试样,空白对照加入等体积蒸馏水,混匀37℃温浴15min,各试管中加入0.1ml100mmol/lh2o2,混匀37℃温浴0.5h,再分别加入1ml20%的三氯乙酸终止反应,然后加入1ml0.7%的硫代巴比妥酸溶液,混匀后于沸水中显色15min,4000r/min离心10min,去除蛋白质沉淀取上清液于波长532nm处测定od值。对h2o2诱导的肝脏脂质过氧化的抑制率(%)=(1-a/a0)×100%
式中:a为试样的平均吸光度值,a0为空白对照的平均吸光度值。
对黄嘌呤氧化酶活性的影响
实验方法按照南京建成试剂盒说明书操作。
实验结果
epc对红细胞自氧化溶血的抑制作用在5mg/ml时达到40.36%,抑制作用随着浓度的增大而加强,ic50为8.82mg/ml(见图4),说明epc能有效的减少红细胞温育过程中形成的脂质过氧化物含量,对红细胞有一定的保护作用。
h2o2与红细胞产生氧化反应,破坏膜引起损伤,图5结果表明epc对h2o2诱导的红细胞氧化溶血的抑制作用呈现浓度依赖效应,且在5mg/ml时抑制率达到78.91%,ic50为0.429mg/ml,由此可见epc在细胞水平上也能够有效抑制氧化损伤。
图6表明,epc在所测定的浓度范围内,随着浓度升高对肝脏自发行性脂质过氧化的保护作用加强,并呈现出良好的浓度正相关趋势,在1mg/ml时对mda生成的抑制率达到89.81%。
h2o2刺激肝脏产生过氧化物刺激肝脏产生过氧化物mda,其产量的多少可以代表组织损害程度。由图7可知。epc对mda生成的抑制作用随着浓度的升高而迅速加强,在1mg/ml时对mda生成的抑制率达到57.53%(见图7),说明epc能够有效地保护h2o2诱导的肝脏脂质过氧化。
epc对黄嘌呤氧化酶(xo)的抑制作用如图8所示,随着藏红花精制醇提物质量浓度的升高,对xo的抑制作用增强,在5mg/ml时,epc对xo的抑制作用达到69.85%。
综上所述,藏红花精制醇提物epc对红细胞氧化溶血及肝脏脂质过化均有较好的保护作用,epc对黄嘌呤氧化酶的抑制作用呈浓度梯度效应,且抑制效果较好,具有影响尿酸代谢的潜能。
实施例4藏红花精制醇提物(epc)对高脂饮食诱导的高血脂症的防治作用
spf级icr小鼠,60只,随机分为六组,正常对照组(nc)、高脂模型对照组(hfd)、阳性药物对照组——辛伐他汀给药组(10mg/kgbwsimvastadtin;sim)、epc低、中、高3种剂量给药组,依次为:100、200和500mg/kgbw;epc100、epc200和epc500),每组10只。
实验开始时各组实验动物先以普通饲料喂养2w,并同时连续每天灌胃给予相应剂量的药物或提取物,nc及hfd组每天灌以蒸馏水(10ml/kg);预防给药2w后,除正常组外,其他5组动物均改用高脂饲料喂养并继续每天灌胃给药相应剂量的药物或提取物,持续50d,nc及hfd组每天灌以蒸馏水(10ml/kg),连续50d。
实验期间自由饮水和进食,记录体重。每10d监测一次血清tc水平,动物禁食14h后,尾静脉取血,分离血清,测定其中tc含量。预防给药64d后,所有动物禁食14h,眼眶采血后处死,取各组织器官称重,分离血清,测定脂代谢相关血液生化指标,器脏及血清样本置于-80℃冰箱保存。
血液生化指标测定
血清中tc、tg、hdl-c、ast、alt均按试剂盒说明方法测定;根据fridedwald公式计算血清低密度脂蛋白胆固醇(ldl-c)水平:
ldl-c(mmol/l)=tc-(hdl-c)-tg/2.2;
动脉粥样硬化指数ai按下述公式计算:
ai=ldl-c/hdl-c。
数据以
epc对高脂饮食小鼠体重的影响如表2所示:连续灌胃64d后,小鼠体重增长并不明显,其中高脂对照组小鼠体重与正常对照组相比无明显增加;200和500mg/kg剂量的epc组小鼠体重与高脂对照组相比极显著降低(p<0.01),且200mg/kg剂量的epc组小鼠体重增长极显著低于高脂对照组(p<0.01),但与正常对照组相比无明显差异。
表2正常组和给药组的体重差异
*p<0.05,**p<0.01与正常对照组相比;
表3epc对高脂血症小鼠脏器系数的影响
*p<0.05,**p<0.01与正常对照组相比;
表3结果显示,经高脂饲料诱导后,高脂对照组小鼠附睾处脂肪垫重量极显著增加(p<0.01);肝脏重量呈现上升趋势,但与正常对照组相比无统计学意义;脾脏和肾脏相对重量与正常对照组相比均无明显变化(p>0.05)。与高脂对照组相比,低、中、高三个剂量的epc(100,200和500mg/kg)均能极显著减轻小鼠脂肪垫重量,减轻率分别为27.00%,30.00%和27.33%(p<0.01)。与正常对照相比,200和500mg/kgepc联合高脂饮食能使小鼠肝脏重量明显增加(p<0.05,p<0.01),但与高脂对照组相比则无明显差异(p>0.05)。
epc对高脂饮食小鼠血清tc的影响
采用高脂饲料诱导高脂血症模型后,每10d监测各组小鼠的血清总胆固醇(tc)水平,共监测5次,结果见图9,其中*p<0.05,**p<0.01与正常对照组相比;
epc对高脂饮食小鼠血清tg、hdl-c、ldl-c水平及ai的影响
表4各组小鼠血清tg,hdl-c,ldl-c和ai水平
*p<0.05,**p<0.01与正常对照组相比;
由表4结果可见,各高脂饮食组小鼠的血清tg水平相比正常对照组均极显著降低(p<0.01)。与正常对照组相比,虽然高脂对照组小鼠的血清hdl-c水平极显著升高(p<0.01),但hdl-c/tc值极显著降低(p<0.01)。此外,各高脂饲喂组小鼠血清ldl-c水平和ai值则极显著高于正常小鼠(p<0.01),表明高脂引发了受试小鼠的脂代谢紊乱。灌胃epc64d后,与高脂对照组相比,200和500mg/kg剂量的epc能显著升高小鼠血清hdl-c/tc值(p<0.01),升高率分别为34.88%和24.58%;低、中、高剂量的epc均能显著降低ldl-c水平(p<0.01),降低量分别为20.95%,52.70%和38.18%;此外,200和500mg/kg剂量的epc能明显降低小鼠动脉粥样硬化指数(ai)值(p<0.01)。
epc对高脂饮食小鼠肝脏脂质的影响
表5各组肝脏tc和tg水平
*p<0.05,**p<0.01与正常对照组相比;
为进一步观察给予高脂饮食后小鼠体内脂质累积情况及epc对其的影响,对小鼠肝脏脂质水平进行了测定,结果如表5所示:高脂对照组小鼠肝脏tc水平与正常组相比升高6.20倍(p<0.01),tg升高1.60倍,表明肝脏出现脂质累积;灌胃epc64d后,与高脂对照组相比,500mg/kg剂量的epc能明显降低小鼠肝脏tc水平,降低量为30.06%(p<0.05);100mg/kg剂量的epc可显著降低肝脏tg水平(p<0.05),降低量为53.90%。
上述实验结果表明,epc具有明显的降血脂活性,提示其对于预防心血管疾病的发生发展具有一定的作用。
实施例5藏红花精制醇提物(epc)急性毒性评价
spf级icr小鼠,60只,雌雄各半,体重16~18g,购自上海西普尔-必凯实验动物有限公司,动物合格号:scxk(沪)2008-0016。
实验方法
实验设计
小鼠被随机分为五组,每组12只,雌雄各6只,适应性饲养5d后,禁食12h。第一组为正常对照组,灌胃蒸馏水;其他四组为实验组,灌胃epc溶液,分别按照4.9g/kg,7g/kg,10g/kg,14g/kg体重进行灌胃,组间剂量比为1:0.7。采用等体积不等浓度灌胃,分三次灌完,每次间隔4h,灌胃容量不超过0.2ml/10g体重。灌胃后连续观察2w,并进行相关指标观察。
生理指标观察
中枢神经系统及躯体运动的兴奋与抑制
循环及血液系统与呼吸系统
消化系统与泌尿生殖系统
眼睛、皮肤、毛发等
其它:记录摄食量、体重及死亡数;实验结束时处死小鼠,眼眶采血测定相
关生化指标;取出心脏、肝脏、脾脏、肾脏和脂肪垫等脏器,称量,各质量与体质量的比值即脏器系数,用g/100g表示。
生化指标分析
血样于4℃,10000r/min条件下,离心10min,分离血清,按照试剂盒说明书方法进行总胆固醇(tc)、甘油三酯(tg)、谷丙转氨酶(alt)、谷草转氨酶(ast)和碱性磷酸酶(alp)的测定。数据处理
采用霍恩氏法计算半数致死量(ld50);所有数据经统计学显著性检验,采用spss17.0软件分析,结果以±sd表示,组间比较采用单因素方差分析(one-way51analysisofvariance,anova),并用dunnett(方差齐)或dunnett’st3(方差不齐)进行多重比较,p<0.05为差异显著,p<0.01为差异极显著。
结果与分析
灌胃前后各组小鼠状态分析
灌胃后15min,小鼠均有轻微的颤抖,呼吸急促,但在1小时内恢复正常。灌胃次日发现,各实验组小鼠出现黑色粪便(灌胃前粪便为土黄色),可能是喂食epc的结果,在两日内此症状恢复正常。观察期间,4.9、7和14g/kg剂量组分别于灌胃后6小时各死亡1只,经解剖发现7和14g/kg剂量组死亡小鼠症状相同:胃部膨胀,胃部囤积大量未消化的食物,有气泡,肠内有结块,可能由于灌胃导致胃损伤,之后进食无法消化导致胃膨胀而死;4.9g/kg剂量组死亡小鼠脏器无明显病变,但是腹腔有大量的深褐色液体,颜色气味与epc溶液相同,可能由于灌胃戳伤所致。除此之外,各组小鼠在观察期间体态特征表现正常,生存良好。结果详见表6。
表6小鼠灌胃给药实验结果
2.2半数致死量确定
epc的ld50的测定选用霍恩氏法(即剂量递增法),根据各剂量组小鼠死亡
情况计算ld50。
lg(ld50)=xk-i(∑p-0.5)
式中,xk为最高剂量组的对数值,∑p为死亡率总和,i为相邻两组剂量对数值
之差,n为每组动物数。按照公式计算得ld50=14.91g/kg体重。
2.3灌胃epc前后体重变化
52
表7小鼠灌胃前后体重的变化
注:b,与本组第0d比较,体重显著增加;bb,与本组第0d比较,体重极显著增加;“+”,与本组给药前相比,体重增加。note:b,p<0.05;bb,p<0.01。
表7展示第0d和灌胃epc后第14d的小鼠体重变化。14d后,与灌胃前相比,4.9g/kg剂量组体重显著增加(p<0.05),其他各组体重极显著增加(p<0.01)。第14d,各剂量组与对照组相比,体重无明显变化,其中14g/kg剂量组的小鼠体重增量最小,为19.02%;而10g/kg剂量组的小鼠体重增量最大,为23.24%。
2.4epc对小鼠摄食量和体重增加量的影响
表8小鼠摄食量与体重增加量的变化
各组小鼠的摄食量和体重增加量的变化如表8所示。各给药组的摄食量和体重增加量与正常对照组相比,均无显著性差异,可能说明epc对小鼠的食欲影响较低,对小鼠的消化系统的刺激较小。
2.5epc对小鼠脏器系数的影响
表9小鼠心脏、肝脏、脾脏、肾脏和脂肪垫的脏器系数
epc对小鼠的心、肝、脾、肾及脂肪垫的脏器系数的影响如表9所示。与正常组相比,随着剂量的升高,各实验组小鼠的心脏和肝脏系数变化不大;脾脏系数略微降低;肾脏和脂肪垫系数有轻微的上升,但均无显著性差异。
2.6epc对小鼠血清tc和tg的影响
表10小鼠血清胆固醇和甘油三酯含量
实验结束后眼眶采血测定小鼠的tc和tg,实验结果如表10所示,各实验组小鼠的胆固醇和甘油三酯浓度与正常组相比,均无显著变化。
2.7epc对小鼠血清谷丙转氨酶、谷草转氨酶及碱性磷酸酶活性的影响
表11小鼠血清谷丙转氨酶、谷草转氨酶和碱性磷酸酶含量
注:b,与对照组比较,ast活性显著升高;bb,对照组比较,ast活性极显著增加。
epc对小鼠的alt和alp活性并无明显影响;但是14g/kgbwepc能够显著升高血清中ast的活性,上升率为65.11%;7g/kgbwepc能够极显著升高血清中ast的活性,上升率为69.86%,提示我们一次性灌胃高剂量的epc会对小鼠肝脏造成损伤。
3.结论
藏红花花瓣醇提物(epc)的急性毒性评价结果显示:灌胃后6h有3只小鼠死亡,经解剖分析,可能原因是灌胃戳伤所致。其余小鼠在观察期间无明显活动异常及中毒症状。按照我国食品药品毒理急性毒性分级法,epc为实际无毒。小鼠的体重增长、摄食量、各脏器重量与对照组相比并无明显差异,亦无明显病变和异常现象。测定常规血液生化指标,包括胆固醇(tc)、甘油三酯(tg)、谷丙转氨酶(alt)、谷草转氨酶(ast)、碱性转氨酶(alt)等,除了14g/kg和7g/kg能显著升高血清中ast的水平,其余指标各组之间并无显著性差异。藏红花醇提物几乎不影响小鼠的正常代谢,但一次性高剂量灌胃可能会对肝脏造成一定损伤。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!