As4S4和JQ1联合应用在制药中的用途的制作方法
本发明涉及一种as4s4和jq1联合应用在制药中的用途,属于医药领域。
背景技术:
胃癌和结肠癌一直是美国癌症致死的主要原因。胃癌(gc)是一种源自胃上皮细胞的恶性肿瘤,预后不良。胃癌同时也是全球癌症致死的第三大原因。由于转移倾向和化疗耐药性,晚期结直肠癌(crc)患者的预后仍然不能令人满意。尽管近期在癌症治疗方法上取得了很大进展,包括手术方法,放疗,化疗和胃癌和结肠癌的新型分子靶向治疗,预后仍然不能令人满意。因此,仍然需要继续研究新的治疗方法和治疗策略以改善胃癌和结肠癌患者的预后。
一类含有溴结构域的表观遗传学阅读器可通过溴结构域识别组蛋白和非组蛋白的乙酰化赖氨酸。brd4是bet(溴结构域和外末端)家族蛋白之一,在转录、细胞周期控制、炎症细胞因子产生和癌症进展发挥重要作用。能与brd4的溴结构域结合的小分子可以发挥强大的抗肿瘤活性,抑制各种癌细胞的增殖和转化潜力。jq1是一种brd4抑制剂,能靶向结合与组蛋白相互作用的bet蛋白结构域,从而竞争性地抑制bet蛋白与染色质的结合,并降低依赖于这种转录机制的rna种类的表达。jq1在各种血液恶性肿瘤的发挥强效抗肿瘤活性,这包括急性髓性白血病,多发性骨髓瘤和急性淋巴细胞白血病(all)。在这些恶性肿瘤中,jq1主要通过抑制c-myc表达来显示其抗增殖活性,c-myc是一种广泛被研究的癌基因,其组成性过表达是引起多种癌症发生的主要原因。jq1作为一个有广泛前景的癌症治疗策略,还具有一定的抗实体瘤活性,包括肺腺癌(lac),神经母细胞瘤和成神经管细胞瘤。然而,在晚期实体瘤中,bet抑制剂通常效果有限,在多数临床前肿瘤模型中对于荷瘤小鼠没有达到理想的癌症缓解。这些发现证明实体癌可能对bet抑制剂单药治疗存在内在抗性,这对这种新型药物在潜在临床应用提出了严峻挑战。
雄黄的活性成分硫化砷(as4s4)几个世纪以来已被广泛用于中药。
技术实现要素:
本发明的目的在于提供一种as4s4和jq1在制药中的联合应用。
本发明采用了如下技术方案:
本发明提供一种as4s4和jq1在制备诱导细胞色素c从线粒体释放到细胞质中的药物中的应用。
进一步,本发明的as4s4和jq1在制备诱导细胞色素c从线粒体释放到细胞质中的药物中的应用,还具有这样的特征:其中,所述细胞质为胃癌细胞或者结肠癌细胞的细胞质。
进一步,本发明的as4s4和jq1在制备诱导细胞色素c从线粒体释放到细胞质中的药物中的应用,还具有这样的特征:其中,as4s4的用量为1至5μm,jq1的用量为1至10μm。
本发明还提供一种as4s4和jq1在制备抑制胃癌细胞的迁移的药物中的应用。
进一步,本发明的as4s4和jq1在制备抑制胃癌细胞的迁移的药物中的应用,还具有这样的特征:其中,as4s4的用量为1μm,jq1的用量为1至10μm。
发明的有益效果
本发明的本项研究中,观察了as4s4如何克服实体瘤对jq1的耐药性并在胃癌和结肠癌细胞中发挥协同细胞毒性作用。本发明的实验数据表明,as4s4和jq1联合应用可通过线粒体途径在胃癌和结肠癌细胞中协同发挥抗癌活性,并对bcl-2、nfat蛋白家族和c-myc发挥协同抑制作用。
附图说明
图1a、图1b、图1c和图1d分别是1μm的jq1在4种细胞系中诱导细胞损伤的结果;
图1e、图1f和图1g是as4s4加jq1共同处理24小时后,与单一as4s4处理相比的对照结果;
图2a到图2m是as4s4和jq1协同抑制胃癌和结肠癌细胞中的nfat蛋白结果;图2a-图2d代表ags细胞,图2e-图2h代表mgc803,图2i-图2l代表hct116,图2m代表sw480细胞;
图3a至图3d是as4s4和jq1在mrna水平协同抑制胃癌和结肠癌细胞中的nfat的结果;
图4是as4s4和jq1联合应用在胃癌和结肠癌细胞中协同调节凋亡相关蛋白的结果,其中,图4a-1到图4a-7是ags细胞,图4b-1到图4b-7是mgc803细胞,图4c-1到图4c-7是hct116细胞,图4d-1到图4d-7是sw480细胞;
图5a和图5b,ags细胞用as4s4(1μm)或jq1(1或10μm)或组合处理24小时,检测细胞凋亡的结果。
图5c和图5d,ags细胞用jc-1探针染色,通过流式细胞术分析观察细胞中线粒体膜电位的结果。
图6是as4s4和jq1联合应用于胃癌和结肠癌细胞可协同诱导细胞色素c从线粒体释放到细胞质;其中,图6a-1到图6a-3是ags细胞,图6b-1到图6b-3是mgc803细胞,图6c-1到图6c-3是hct116细胞,图6d-1到图6d-3是sw480细胞;
图7是as4s4和jq1协同抑制gc细胞的迁移能力,其中,图7a是培养结果,图7b是ags细胞接受处理6小时后的结果,图7c是ags细胞接受处理12小时后的结果,图7d是ags细胞接受处理24小时后的结果;
图8是硫化砷通过线粒体途径增强jq1在胃癌和结肠癌细胞中毒性的示意图。
具体实施方式
以下结合附图来说明本发明的具体实施方式。
本实施方式中,首先提供一种as4s4和jq1在制备诱导细胞色素c从线粒体释放到细胞质中的药物中的应用。as4s4的用量为1至5μm,jq1的用量为1至10μm。
本实施方式中,还提供一种as4s4和jq1在制备抑制胃癌细胞的迁移的药物中的应用。
as4s4的用量为1μm,jq1的用量为1至10μm。
以下通过具体实验来说明as4s4和jq1联合应用的效果。
细胞培养和试剂
ags、mgc803、hct116和sw480细胞获自中国科学院委员会典型培养物细胞库(中国)。ags细胞在含有10%fbs的dmem/f12培养基(hyclone,usa)中生长;mgc803细胞在含有10%fbs的1640培养基(hyclone,usa)中生长;hct116和sw480细胞在含有10%fbs的dmem培养基(hyclone,usa)中生长。高度纯化的as4s4由上海血液学研究所(上海,中国)提供,并如文献所述制备。将as4s4(133.36μm)的储备溶液在完全培养基中稀释以获得工作溶液。3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化物(mtt)购自sigma-aldrich(stlouis,mo,usa)。nfatc1抗体购自sigma-aldrich(stlouis,mo,usa),santacruzbiotechnology(santacruz,ca,usa)。nfatc3和nfatc4的抗体购自abcam(cambridge,ma,usa)。brd4,p-gsk3β,gsk3β,bax,bcl-2,p53,c-myc的抗体来自cellsignalingtechnology(beverly,ma,usa)。细胞色素c,coxiv,caspase-3和cleaved-caspase-3的抗体来自abclonal(武汉,中国),而抗β-actin来自proteintechgroup(武汉,中国)。
实验方法:
dapi染色
将ags和hct116细胞以1.25×104个细胞/ml的密度接种在6孔板中24小时。当细胞处于对数生长期和适当的密度时,将细胞单独或以不同浓度组合接触as4s4或jq1。在相应处理24小时后,然后将细胞用4%多聚甲醛固定15分钟。然后用dpbs洗涤三次除去4%pfa,并在黑暗中用dapi染色溶液(beyotime)覆盖每个样品5分钟。用dpbs洗涤三次以除去dapi染色溶液并在荧光显微镜下观察。
通过mtt实验测定细胞活力
通过mtt测定as4s4和jq1处理后的细胞存活率。将ags和hct16细胞以每孔5×103个细/0.1ml的密度接种在96孔板中。在药物处理后,向每个孔中加入20mlmtt储备溶液。弃去上清液,加入100mldmso以在37℃黑暗中孵育另外4小时后溶解沉淀物。使用酶标仪(bio-tek,usa),使用562nm处的吸光度来确定细胞活力。将未经任何处理温育的细胞用作对照。将不含细胞的培养基用作空白对照。每个样品以四重测定。表示细胞存活率百分比=(空白对照组的实验组平均od的平均od/对照组的平均od-空白对照组的平均od)×100%。
蛋白印迹
将as4s4或jq1或以不同浓度组合处理细胞24小时。通过用pmsf(beyotime)裂解ripa缓冲液中的细胞来提取蛋白质。使用酶标仪(bio-tek,usa)和增强的bca蛋白质测定试剂盒(beyotime)测定蛋白质浓度。将样品稀释在样品稀释缓冲液中,在95℃加热5分钟,并加载到凝胶上并进行电泳。通过8%~10%sds-page分离每个泳道中的等量蛋白质,并转移至0.45μmpvdf膜(millipore,billerica,ma,usa)。在5%脱脂牛奶中封闭膜后,将膜与第一抗体在4℃温育过夜。用含有0.1%tween-20的pbs洗涤未结合的抗体,然后在室温下用标记的二抗孵育1小时,洗涤,加入immobilonwesternchemilumhrpsubstrate(millipore,usa)并使用geldocxrsystem(bio-rad,usa)获得图像。用imagej软件(nih,bethesda,md,usa)定量条带强度。
线粒体和细胞质蛋白的提取和分离
在与as4s4或jq1单独或组合处理后,通过所需方案收集ags细胞。利用
实时定量pcr(qpcr)分析
使用rneasyminikit(qiagen,valencia,ca,usa)根据制造商的使用说明提取总rna。如前所述进行第一链cdna合成和qpcr(tan等,2015)。使用如下引物扩增基因:nfatc1:5'-ggagatggaagcgaaaactg-3'(正向),5'-gcgggaaggtaggtgaaac-3'(反向);nfatc3:5'-cacaccactttgcttaccacat-3'(正向),5'-ccgttctgggtcatttatctgt-3'(反向);nfatc4:5'-cttcccttcccagagtgatg-3',5'-accttcctccagcgtgatac-3'(反向));gapdh:5'-ggcacagtcaaggctgagaatg-3'(前进)和5'-atggtggtgaagacgccagta-3'(反向)。合成引物并购自sangonbiotech(上海,中国)。所有qpcr反应均在以下循环条件下进行:94℃下3分钟,然后在94℃下40秒,在60℃下40秒,和在72℃下25秒,进行40个循环。使用管家基因gapdh对表达数据进行标准化。
annexinv/pi实验用于检测细胞凋亡
将ags细胞以每孔1×105个细胞的密度接种到6孔板中,用as4s4或jq1加以处理24小时后,根据试剂使用说明,用annexinv/pi细胞凋亡检测试剂盒(bdbiosciences,ca,usa)通过流式细胞术(fcm)检测细胞凋亡。简言之,将ags细胞在磷酸盐缓冲盐水(pbs)中洗涤一次,并在1x结合缓冲液中洗涤一次。然后将ags细胞重悬于1x结合缓冲液中,并向每个样品中加入5μl膜联蛋白v。在室温下温育10分钟后,将细胞在1×结合缓冲液中洗涤。然后在加入5μlpi染色溶液后,使用流式细胞仪(facscalibur;bdbiosciences,ca,usa)测定凋亡细胞。早期和晚期凋亡细胞都包括在细胞死亡检测中。
流式细胞术分析线粒体电位
使用线粒体膜电位测定试剂盒(jc-1;beyotime)检测ags的线粒体膜电位。根据制造商的使用说明,ags细胞接种于6孔培养板中,用as4s4或jq1单独或组合预处理24小时。用d-hank溶液洗涤两次后,收集细胞并用0.5mltryple消化1分钟,并在4℃下以1000rpm离心5分钟。向每个样品中加入5μljc-1染料(200μm)用于在37℃下孵育30分钟,然后使用流式细胞仪(facscalibur;bdbiosciences,ca,usa)测量。
划痕实验
将ags细胞以5×105个细胞/孔的密度接种在六孔板中,并分别将无血清处理饥饿12小时。然后,用移液管尖端划痕,用磷酸盐缓冲盐水洗去悬浮的细胞。将细胞与相应浓度的as4s4或jq1或其组合于有1%血清的培养基37℃、5%co2下培养24或48小时。用dmi3000b倒置显微镜(leicamicrosystems,wetzlar,germany)在0小时、6小时、12小时和24小时拍摄划痕,并按照下式计算各组的迁移率,迁移率(%)(划痕区域在0h划痕区域-6h,12h或24h)/伤口区域0h×100%。
统计分析
使用spss软件版本19.0(ibmcorporation,armonk,ny,usa)进行统计分析。所有数据均以平均标准偏差表示。使用单因素方差分析进行数据分析,然后进行最小显着性差异程序(当方差相等时)或games-howell程序(当方差不相等时)。tukey的事后检验用于多组比较,student'st检验用于单一比较。双侧p<0.05被认为具有统计学意义。
图1显示了as4s4和jq1对胃癌和结肠癌细胞发挥协同细胞毒作用。如图1a、图1b、图1c和图1d,ags,mgc803,hct116和sw480细胞用as4s4(1或5μm)或jq1(1或10μm)单独或以所示的不同浓度组合处理24小时。然后通过mtt测定确定细胞活力。统计学上,在用单独的as4s4或jq1处理的细胞与用相同浓度的as4s4加jq1处理的细胞之间的比较中观察到显着差异。数据代表具有类似结果的三个相同实验中的一个。与使用单向anova的对照组相比,*p<0.05,**p<0.01。如a中那样处理b,ags和hct116细胞,然后进行dapi染色以检测细胞核凋亡形态变化。三个独立的实验/条件。统计学上,在用单独的as4s4或jq1处理的细胞与用相同浓度的as4s4加jq1处理的细胞之间的比较中观察到显着差异。数据代表具有类似结果的三个相同实验中的一个。与使用单向anova的对照组相比,*p<0.05,**p<0.01。原始放大倍率,×100。比例尺,100μm
缩写:a,as4s4;j,jq1;h,小时。
图2.as4s4和jq1协同抑制胃癌和结肠癌细胞中的nfat蛋白。用as4s4(1或5μm)或jq1(1或10μm)单独或组合处理ad,ags,mgc803,hct116和sw480细胞24小时,用针对nfatc1,nfatc3,nfatc4和β肌动蛋白的抗体检测裂解物。图2a-图2d分别代表ags,mgc803,hct116和sw480细胞。kda,分子量。数据代表具有类似结果的三个相同实验中的一个。与使用单向anova的对照组相比,*p<0.05,**p<0.01。
图3.as4s4和jq1在mrna水平协同抑制胃癌和结肠癌细胞中的nfat。在胃癌和结肠癌细胞之后,用as4s4(1或5μm)或jq1(1或10μm)单独或组合处理nfatc1,nfatc3和nfatc4的a-d,rt-pcr24小时。收获细胞,然后在trizol中裂解以根据takara试剂盒说明书进行rna提取和逆转录。图a3-图3d分别代表ags,mgc803,hct116和sw480细胞。误差棒表示三次独立实验结果的标准偏差(sd)。
图4.as4s4和jq1联合应用在胃癌和结肠癌细胞中协同调节凋亡相关蛋白。将ags,mgc803,hct116和sw480细胞用as4s4(1或5μm)或jq1(1或10μm)单独或组合处理24小时,用针对brd4,c-myc,bax的抗体探测裂解物,bcl-2,caspase-3(cas-3),裂解的caspase-3(cl-cas-3)和β-肌动蛋白。如图4所示,在右侧图中显示了与细胞溶质(β-肌动蛋白)中的加载对照相比的相对密度的定量分析。kda,分子量。数据代表具有类似结果的三个相同实验中的一个。与使用单向anova的对照组相比,*p<0.05,**p<0.01。
图5.用as4s4和jq1联合应用在ags细胞中通过线粒体途径介导的细胞凋亡。图5a和图5b,ags细胞用as4s4(1μm)或jq1(1或10μm)或组合处理24小时。处理后,对ags细胞进行流式细胞术分析,用膜联蛋白v-pi检测细胞凋亡。图5c和图5d,ags细胞如a处理,然后用jc-1探针染色,通过流式细胞术分析观察细胞中线粒体膜电位。数据代表具有类似结果的三个相同实验中的一个。与使用单向anova的对照组相比,*p<0.05,**p<0.01。
图6.as4s4和jq1联合应用于胃癌和结肠癌细胞可协同诱导细胞色素c从线粒体释放到细胞质。as4s4(1或5μm)或jq1(1或10μm)或组合处理24小时后,用抗细胞色素c,coxiv和β-肌动蛋白的抗体探测裂解物。图a-d分别代表ags,mgc803,hct116和sw480细胞。kda,分子量。数据代表具有类似结果的三个相同实验中的一个。与使用单向anova的对照组相比,*p<0.05,**p<0.01。因此as4s4和jq1按照上述浓度混合后,或者进一步加入药物上可接受的添加剂后,能够制成诱导细胞色素c从线粒体释放到细胞质的药物。
图7.as4s4和jq1协同抑制gc细胞的迁移能力。图7a至图7d,移液器刮擦ags细胞并用as4s4(1μm)或jq1(1或10μm)或组合处理0,6,12和24小时。在相差显微镜下以50倍的放大率观察迁移。数据代表具有类似结果的三个相同实验中的一个。图7e至图7h,用as4s4(1μm)或jq1(1或10μm)或组合处理24小时的ags细胞,用针对细胞色素c,coxiv和β-肌动蛋白的抗体探测裂解物。kda,分子量。数据代表具有类似结果的三个相同实验中的一个。与使用单向anova的对照组相比,*p<0.05,**p<0.01。图7i至图7k,用as4s4(1μm)和jq1(1μm)处理24小时的ags细胞,用针对nfatc3,c-myc和β-肌动蛋白的抗体探测裂解物。kda,分子量。数据代表具有类似结果的三个相同实验中的一个。与使用单向anova的对照组相比,*p<0.05,**p<0.01。
图8.硫化砷通过线粒体途径增强jq1在胃癌和结肠癌细胞中毒性的示意图。在胃癌和结肠癌细胞中,as4s4和jq1协同调节nfat蛋白家族和c-myc,后者参与细胞存活和肿瘤侵袭性和转移。as4s4和jq1通过上调bax/bcl-2比例发挥协同细胞毒性,导致细胞色素c从功能失调的线粒体释放,caspase-3活化和随后发生的细胞凋亡。通过降低mmp-9,e-cadherin和vegf的蛋白水平,as4s4和jq1进一步抑制肿瘤侵袭性和转移性。指针箭头表示刺激;平箭头表示抑制。
结果
as4s4和jq1对胃癌和结肠癌细胞发挥协同细胞毒作用。
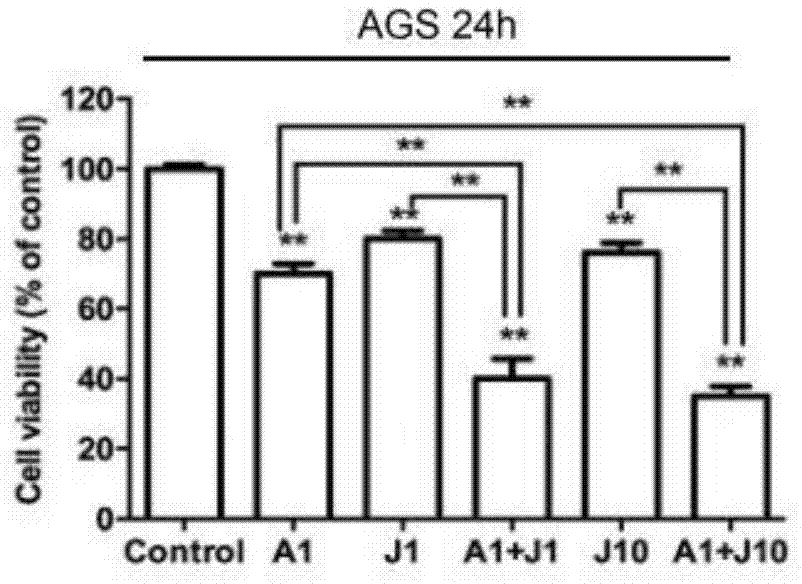
已有研究表明as4s4能够在胃癌和结肠癌细胞中发挥抗癌活性;本发明中,研究as4s4是否能协同增强jq1介导的对胃癌和结肠癌细胞的细胞毒性。首先,检测单独的as4s4或jq1对包括胃癌细胞系ags,mgc803和结肠癌细胞系hct116,sw480的4种细胞系中的细胞存活率的影响。本发明发现用1μm的as4s4处理24小时可以部分地降低胃癌细胞ags和mgc803中的细胞存活率,而在结肠细胞hct116和sw480中,用5μmas4s4处理导致部分细胞存活率降低。这可能与胃癌细胞和结肠癌细胞对as4s4具有不同药物敏感性有关。因此在后续实验中用不同浓度的as4s4处理胃癌和结肠癌细胞系。1μm的jq1能够在这4种细胞系中诱导细胞损伤,如图1a所示。当与as4s4加jq1共同处理24小时后,与单一as4s4处理相比,所有胃癌和结肠癌细胞显示出细胞存活率显着降低。然后通过dapi染色进一步评估核形态的细胞凋亡变化。发现在胃癌细胞系ags和结肠癌细胞系hct116中,与单独使用as4s4或jq1相比,as4s4和jq1的组合引起增强的细胞毒性。当组合时,核凋亡的迹象,包括核染色质浓缩,分解和碎片核更明显,如图1b所示。这些结果表明as4s4极大地增强了jq1诱导的胃癌和结肠癌细胞的细胞毒性。
as4s4和jq1在蛋白质和rna水平上协同抑制胃癌和结肠癌细胞中的nfat表达
nfat蛋白参与细胞周期调控,细胞分化和细胞存活,同时也被证实可调节肿瘤细胞的侵袭和转移。前期研究表明as4s4通过nfat途径发挥抗癌活性。本项研究中,研究了as4s4与jq1结合是否能在胃癌和结肠癌细胞中进一步抑制nfat蛋白。首先分析了上述4种胃癌和结肠癌细胞中as4s4或jq1单一处理或联合作用对nfat蛋白(nfatc1,nfatc3和nfatc4)的抑制作用。结果表明,as4s4与jq1联合可显着降低所有细胞系中nfatc1,nfatc3和nfatc4的蛋白水平。进一步通过实时pcr证实了这种增强的抑制作用,如图3所示。当用as4s4和jq1处理时,与单一as4s4或jq1处理相比,nfatc1,nfatc3和nfatc4的mrna显着降低。这些结果都表明as4s4和jq1在mrna和蛋白质水平上协同抑制胃癌和结肠癌细胞中的nfat蛋白。
as4s4和jq1的联合应用同步调节胃癌和结肠癌细胞中的凋亡相关蛋白
除调控nfat蛋白外,as4s4还调节其他凋亡相关蛋白。因此,通过蛋白质印迹分析研究as4s4和jq1的联合应用是否在其他凋亡相关蛋白中也具有协同作用。jq1的靶点brd4似乎不因jq1剂量的增加而发生明显下调,这可能与jq1在实体瘤治疗中的存在一定的耐药性有关。bet结构域蛋白能促进靶基因的转录,这其中包括癌基因c-myc。已有文献研究表明jq1能够有效降低多发性骨髓瘤模型中c-myc的表达。本发明进一步研究了as4s4和jq1的共同治疗是否是能够协同降低癌基因c-myc的表达。如图4所示,as4s4和jq1共处理组中的c-myc表达显着低于as4s4或jq1单药处理组。as4s4和jq1还在胃癌和结肠癌细胞中协同上调的促凋亡蛋白bax;并抑制抗凋亡蛋白bcl-2的表达。半胱天冬酶是细胞凋亡执行的核心组成部分。通常,它们参与细胞凋亡并且可分为始动因子和凋亡效应酶。本发明还发现as4s4和jq1的联合应用可以协同激活caspase-3,caspase-3是细胞凋亡中的关键效应分子。使用蛋白质印迹分析,发现caspase-3的前体procaspase-3在用as4s4和jq1共同处理的细胞中显着降低;与此同时,它们在裂解的的caspase-3的水平明显增加,如图4所示。
as4s4和jq1的联合应用在胃癌和结肠癌细胞中通过线粒体途径介导细胞凋亡
为了进一步确定as4s4和jq1能够协同诱导细胞凋亡,ags细胞经过空白照溶剂、1μmol/las4s4、1μmol/ljq1、10μmol/ljq1或as4s4和jq1联合处理24小时,然后用annexinv-fitc和pi染色。annexinv(早期凋亡)或annexinv加pi(晚期凋亡)阳性染色的细胞均被计为凋亡细胞。1μmol/las4s4或jq1单独处理可部分增加凋亡细胞百分比,而as4s4和jq1联合处理可使1μmol/ljq1和10μmol/ljq1的细胞凋亡率分别提高10.6%和25.6%,如图5a所示。
线粒体是多种抗癌药物的治疗靶标。本发明检测了as4s4和jq1的联合处理对ags细胞中mmp的影响,如图5b所示。使用微探针jc-1测定试剂盒检测暴露于as4s4、jq1或其组合的细胞mmp的变化。jc-1探针聚集在正常线粒体中,当膜电位崩溃时,颜色从红色变为绿色。在相应药物处理24小时后,用流式细胞术分析ags细胞的mmp。如图5b所示,单独用1μmol/las4s4或jq1处理可轻度损伤mmp,分别导致13.5%和15.7%的mmp损失。1μmol/las4s4和jq1联合治疗可导致mmp降低22.6%。单用10μmol/ljq1处理后,mmp降幅增加至33.2%。1μmol/las4s4加10μmol/ljq1对mmp具有额外的毒性,并且与单独使用10μmol/ljq1的处理相比额外造成12.2%的损失。这些结果表明,as4s4和jq1的共同处理协同降低胃癌细胞中的mmp。
as4s4和jq1协同抑制胃癌细胞的迁移能力
转移是肿瘤的重要特征之一,并且也是晚期癌症预后不良的原因。通过划痕实验测定as4s4和jq1的共同处理是否协同地减弱胃癌细胞的转移能力。用as4s4、jq1单药或组合处理ags细胞24小时。如图7a所示,与对照组相比,当用1μmol/las4s4或jq1处理时,ags细胞中的伤口愈合能力略微降低。1μmol/las4s4、jq1联合处理或10μmol/ljq1单独使用均可适度降低划痕愈合能力。然而,当用1μmol/las4s4和10μmol/ljq1共同处理时,ags划痕愈合能力进一步降低。在药物处理6小时后ags细胞的迁移率分别为18.34%,12.45%,10.23%,7.55%,9.43%和5.31%。12小时后的迁移率分别为28.48%,20.58%,24.65%,15.49%,12.75%和8.34%。同时,24小时后的迁移率分别为39.33%,29.63%,31.67%,25.47%,16.27%和10.18%(图7a)。
多种蛋白质参与肿瘤侵袭和转移,这其中包括mmp9,e-cadherin和vegf。mmp-9在肿瘤细胞中高度表达,其表达与侵袭性、肿瘤生长和血管生成有关。e-cadherin是e-cadherin/catenin蛋白的复杂粘附连接的关键成员之一,并且在emt和转移过程中起关键作用。vegf是一种可诱导血管生成的有效因子,它与肿瘤转移和预后密切相关。为了探讨as4s4和jq1共处理协同抑制细胞侵袭和转移是否与mmp-9,e-cadherin和vegf相关,在不同药物处理后的ags细胞中检测到这些蛋白质的表达情况。与划痕实验的结果一致,通过as4s4和jq1联合处理,参与肿瘤侵袭和转移的相关蛋白(包括mmp-9,e-cadherin和vegf)的水平均显着降低,如图7b、图7c和图7d所示,与单独使用as4s4和qj1相比,联合使用as4s4和qj1能够更加强的抑制肿瘤细胞的迁移。
为了进一步证实nfatc3和c-myc是参与凋亡信号传导途径的关键分子,还通过进行蛋白质印迹分析检查了它们在较早时间点的表达情况。as4s4和jq1在6小时时显着抑制nfatc3的蛋白水平,而在药物联合处理12小后观察到c-myc的表达水平也发生显着降低。这表明nfatc3和c-myc可能参与由as4s4和jq1诱导的凋亡信号传导途径中如图7c所示。
本发明提供了bet抑制剂jq1联合as4s4在胃癌和结肠癌细胞中对其存活率的作用。胃癌和结肠癌是导致癌症死亡的主要原因之一,预后不良,治疗效果尚不能令人满意。作为显著的bet抑制剂,jq1能干扰brd4识别乙酰化染色质标记,后者通过竞争性结合brd4的乙酰基赖氨酸识别区域促进基因转录激活。临床研究也显示jq1在血液恶性肿瘤中得到有效应用,而这些新药的生物活性实体肿瘤中通常受限。在大多数临床前肿瘤模型中,bet抑制剂几乎不能诱导肿瘤完全缓解,并且在实体瘤内诱导的疗效欠佳。因此,通过联合用药策略克服bet抑制剂的耐药性已成为近期研究的焦点。已有文献证实,jq1能够协同abt-263对抗结直肠癌细胞;冬凌草甲素能协同增强jq1诱导的肝细胞癌细胞凋亡;组蛋白去乙酰化酶抑制剂panobinostat和jq1在侵袭性神经母细胞瘤中协同发挥抗癌作用。
本发明中,还提供一种组合用药用于抗肿瘤治疗:通过与as4s4和jq1共同处理来改善bet抑制剂在实体肿瘤中疗效欠佳的策略。在as4s4和jq1联合应用中,as4s4能增强bet抑制剂在胃癌和结肠癌细胞的细胞凋亡诱导能力。as4s4在急性早幼粒细胞白血病(apl)中具有显著的抗癌活性,并在环孢菌素a对结直肠癌细胞的生长和c-myc表达中起协同抑制作用。通过抑制c-myc转录,as4s4和jq1联合应用在多种癌症中均显示出协同抗肿瘤活性,这也为进一步评估as4s4和jq1的联合治疗可能在胃癌和结肠癌中发挥协同作用提供可靠基础。
jq1在实体瘤细胞中的凋亡诱导效率不足导致了其耐药性。通过抑制bet蛋白brd4的活性以及其下游癌基因c-myc的有效抑制,本发明as4s4和jq1的联合应用显著抑制胃癌和结肠癌细胞中促存活基因的表达,这其中包括nfat蛋白家族和bcl-2。并进一步增强jq1介导的胃癌和结肠癌细胞的生长抑制和细胞凋亡。as4s4和jq1共同处理可导致胃癌和结肠癌细胞的线粒体功能障碍。联合应用as4s4和jq1能显著降低线粒体跨膜电位差和并进一步引起细胞色素c释放,从而导致细胞凋亡级联反应的激活。本发明中,as4s4和jq1的联合应用除了诱导细胞凋亡的能力之外,还能够协同地降低胃癌转移能力。
实体瘤细胞中存在的jq1抗性导致其在细胞凋亡诱导中的无效性,而线粒体保护作用也会拮抗bet溴结构域抑制剂介导的细胞死亡。线粒体是半胱天冬酶的关键调节因子,是内源性凋亡途径的重要组分。一旦线粒体膜通透性随着mmp的下降而改变,促凋亡分子将释放到细胞质中并引发下游细胞凋亡。
本发明提供的as4s4和jq1联合处理诱导的细胞凋亡效果,使用流式细胞术进行jc-1染色进行检测。在本发明的结果中,发现对比as4s4或jq1单一处理组,as4s4和jq1的联合处理更能显著降低mmp。伴随mmp去极化,凋亡损伤导致基质浓缩和细胞色素c向膜间隙的渗漏,导致细胞色素c释放和细胞死亡。因此,用蛋白质印迹分析检测细胞色素c和caspase-3的表达。结果证明as4s4和jq1的联合处理协同诱导细胞色素c释放并激活下游caspase-3。释放的细胞色素c然后在datp存在下靶向胞质蛋白apaf-1,促进形成称为“凋亡小体”的蛋白质复合物。凋亡体进一步激活前半胱天冬酶-9,其反过来导致胱天蛋白酶-3的活化和dna片段化。as4s4和jq1也协同上调bax的表达,同时抑制bcl2的蛋白质水平。由于bcl-2和bax都是调节线粒体介导的细胞凋亡的关键分子,它们的不平衡导致线粒体功能障碍和促凋亡因子的释放。bcl-2蛋白可被活化的胱天蛋白酶-3降解,从而削弱其抗细胞凋亡特性。一旦procaspase-3被切割激活,会导致不可逆的细胞凋亡。
在本发明中,阐明as4s4和jq1的联合应用能够通过线粒体介导的凋亡途径对胃癌和肠癌细胞发挥协同细胞毒作用,如图8所示。此外,as4s4和jq1共同处理导致细胞活力降低和侵袭性和转移能力受损。as4s4和jq1的联合应用对肿瘤细胞具有协同抑制作用,有助于减少每种单药的剂量,从而减轻了单药剂量过大可能引发的毒性。总之,本发明的数据表明as4s4和jq1联合应用可能提供一种新的癌症治疗策略。
结论
as4s4通过诱导线粒体介导的细胞凋亡从而有效增强jq1在胃癌和结肠癌细胞中的细胞毒性。as4s4和jq1的联合应用策略为bet溴结构域抑制剂在癌症治疗中的潜在应用提供了潜在可能。
- 还没有人留言评论。精彩留言会获得点赞!