氧化还原双敏感键桥连小分子前药及其自组装纳米粒的制作方法
本发明属于药物制剂新辅料和新剂型领域,涉及氧化还原双敏感键桥连前药自组装纳米粒的构建,具体涉及多个硒键和硫键桥连的氧化还原双敏感小分子前药和小分子前药自组装纳米粒的构建,以及其在药物传递中的应用。
背景技术:
癌症严重威胁着全人类的健康,据世界卫生组织(who)统计,全球每年有超过800万人死于癌症。化疗是癌症治疗中最常用和最有效的策略之一,尤其是对于那些不能通过手术切除和转移扩散的肿瘤。但大部分化疗药是细胞毒性药物,且存在溶解度低、稳定性差、治疗窗窄和药动学性质不佳等缺点。而现有的制剂策略递送效率低,肿瘤靶向性较差,导致化疗临床效果不佳且毒副作用严重。例如,紫杉醇(paclitaxel,ptx)作为一线化疗药在临床上被广泛用于治疗非小细胞肺癌和乳腺癌等。但是,由于紫杉醇的水溶性极低,市售的溶液剂泰素(taxol)使用聚氧乙烯蓖麻油和乙醇作为增溶剂和助溶剂,会引起很严重的辅料相关的毒副作用,极大地限制了其在临床上的应用。因此,如何改善化疗药物的不良性质并提高递送效率是临床上亟待解决的难题。
近年来,前体药物和纳米技术在药物传递领域的广泛应用极大地丰富了抗肿瘤药物的递送策略,且已经有多个制剂成功上市,如伊立替康(sn-38前体药物),紫杉醇白蛋白纳米粒,阿霉素脂质体等。前体药物本身没有生物活性或活性很低,经过体内代谢后变为有活性的物质。前药策略可以通过巧妙的结构修饰来改善化疗药物的不良性质,包括溶解度低,稳定性差,毒副作用大等。此外,基于纳米技术构建新型的纳米给药系统可以显著改善药物的药动学性质,延长化疗药物的体内循环时间,并能够通过主动靶向或被动靶向提高药物在肿瘤部位的蓄积,增加药物的细胞摄取,控制药物的释放速度,进而提高抗肿瘤效果,降低毒副作用。在此基础上,基于小分子前体药物的自组装纳米药物递送系统将前体药物和纳米技术的优点结合到一起,以其载药量高、稳定性好、毒副作用低等优势,已成为近几年化疗药物递送研究的热点。
不论是前药还是纳米递药系统,智能触发药物在靶部位的选择性释放对于制剂的有效性和安全性都非常重要。与正常细胞相比,肿瘤细胞内存在更高浓度的活性氧(reactiveoxygenspecies,ros)和谷胱甘肽(gsh),这种特殊的肿瘤细胞氧化还原微环境已被广泛用于设计刺激-响应型药物递送系统。目前针对肿瘤氧化还原微环境敏感的化学桥连种类较少,且主要以硫键为主。因此,开发新型智能响应型化学桥连具有重要的科学意义和实用价值。与硫同族的硒键(单硒键和二硒键)同样具有一定的氧化还原敏感性,但目前还未见基于硒键的智能响应型前体药物和自组装纳米递药系统的相关报道。同时,硒键和硫键在键角/二面角、氧化还原敏感响应能力以及抗肿瘤活性等方面都存在一定差异:(1)研究报道二硫键具有一个接近90°的键角和二面角,能够显著增强前药的自组装能力和稳定性。硒/硫键是否在键角/二面角上存在差异并影响前药的自组装和稳定性?(2)硒/硫键是否在氧化还原响应能力上存在差异并影响前药自组装纳米粒的药物释放和细胞毒性?(3)研究报道,硒具有一定的抗肿瘤效果,能够诱导肿瘤细胞产生ros。同时,硒键代谢的中间产物能够诱导肿瘤细胞凋亡。因此,硒/硫键是否在抗肿瘤效果上存在差异并影响前药自组装纳米粒的细胞毒性和药效学?这些科学问题都值得进行深入研究。
技术实现要素:
本发明所解决的技术问题是提供一种含有硒键(单硒键,二硒键)或硫键(单硫键,二硫键)桥连的氧化还原双敏感前药,并将该前药用于自组装纳米粒,从而实现载药量高、稳定性好、毒副作用低和肿瘤部位特异性快速释药的效果,进而提高抗肿瘤活性。同时,以含有碳键(单碳键,碳碳键)的前药作为对照,考察不同化学桥连在键角/二面角、氧化还原敏感响应能力以及抗肿瘤活性等方面的差异,以及对前药自组装纳米粒的稳定性、药物释放、细胞毒性、药动学、组织分布以及药效学产生的影响。
本发明的目的是设计和合成含有硒键(单硒键,二硒键)或硫键(单硫键,二硫键)桥连的氧化还原双敏感小分子前药以及含有碳键(单碳键,碳碳键)的对照前药,制备前药自组装纳米药物传递系统,探讨不同化学桥连对前药自组装纳米粒的稳定性、药物释放、细胞毒性、药动学、组织分布以及药效学产生的影响,综合筛选出效果最佳的化学桥连,为开发肿瘤微环境智能响应型药物递送系统提供新的策略和更多的选择,满足临床中对高效化疗制剂的迫切需求。
本发明通过以下技术方案实现上述目的:
本发明提供了一种氧化还原双敏感键桥连前药,以抗肿瘤药物和含有不饱和键和活性羟基的碳链通过硒键或硫键相连。
所述的抗肿瘤药物为含有活性羟基或氨基的抗癌药物,选自紫杉烷类化合物、核苷类化合物、蒽环类化合物或喜树碱类化合物;进一步地,所述的抗肿瘤药物为紫杉醇。
所述的含有不饱和键和活性羟基的碳链为维生素e、油酸-乙二醇酯、香茅醇、油醇、亚麻醇或亚油醇,进一步地,所述的含有不饱和键和活性羟基的碳链为香茅醇。
所述的硒键为单硒键或二硒键,所述的硫键为单硫键或二硫键。
具体地,
本发明选择紫杉醇和香茅醇作为模拟药物,将二者通过(a)硒代二丙酸,(b)3,3'-二硒代二丙酸,(c)硫代二丙酸或(d)3,3'-二硫代二丙酸相连制备含有硒键(单硒键,二硒键)或硫键(单硫键,二硫键)桥连的氧化还原双敏感小分子前药。同时,将紫杉醇和香茅醇以(e)庚二酸或(f)辛二酸相连合成对照前药,其结构式分别为:
本发明提供含有硒键(单硒键,二硒键)或硫键(单硫键,二硫键)桥连的氧化还原双敏感小分子前药和对照前药的合成方法,包括如下步骤:
首先将二元酸成酸酐,然后与香茅醇成酯得到中间产物。中间产物与紫杉醇成酯,得到终产物。
所述的二元酸选自:硒代二丙酸、3,3'-二硒代二丙酸、硫代二丙酸和3,3'-二硫代二丙酸。
具体地,本发明提供了系列紫杉醇-香茅醇小分子前药的合成方法:
将硒代二丙酸、3,3'-二硒代二丙酸、硫代二丙酸、3,3'-二硫代二丙酸、庚二酸或辛二酸溶解于乙酸酐中,室温下搅拌1-2个小时,将所得产物溶于二氯甲烷中,并加入香茅醇和4-二甲氨基吡啶,室温条件下搅拌1-2小时,通过制备液相分离得到中间产物;将中间产物、1-乙基-3(3-二甲基丙胺)碳二亚胺、1-羟基苯并三唑和4-二甲氨基吡啶溶于无水二氯甲烷中,冰浴1-2小时,然后加入紫杉醇,室温条件下搅拌24-48小时,所得产物经制备液相分离纯化,上述反应全程都在n2保护下进行。
本发明还提供了所述的系列紫杉醇-香茅醇小分子前药自组装纳米粒,所述的小分子前药自组装纳米粒可以是非peg化的小分子前药纳米粒、peg修饰的小分子前药纳米粒、包载荧光物质或疏水性药物的小分子前药纳米粒或主动靶向的小分子前药纳米粒。
本发明中所述的紫杉醇可以用其他含有活性羟基或氨基的抗癌药物,如其他紫杉烷类化合物(多西他赛、卡巴他赛等)、核苷类化合物、蒽环类化合物或喜树碱类化合物所代替。
香茅醇可以用其他含有不饱和键和活性羟基的碳链替代,如维生素e、油酸-乙二醇酯、油醇、亚麻醇或亚油醇所代替。
所述的荧光物质为香豆素-6、罗丹明、dir、dii、cy-5和cy-7,优选的荧光物质为香豆素-6和dir。
所述的疏水性药物可以为:喜树碱、羟基喜树碱、阿霉素。
本发明提供的紫杉醇-香茅醇小分子前药自组装纳米粒的制备方法如下:
将一定量的紫杉醇-香茅醇小分子前药或小分子前药与peg修饰剂/荧光物质/疏水性药物的混合物溶解到适量的乙醇中,搅拌下,将该乙醇溶液缓缓滴加到水中,前药自发形成均匀的纳米粒。最后,采用透析法除去制剂中的乙醇,得到不含任何有机溶剂的纳米胶体溶液。
所述的peg修饰剂为tpgs、dspe-peg、plga-peg和pe-peg等,优选的peg修饰剂为dspe-peg。
所述peg的分子量为1000-5000,优选为1000、2000和5000,更优选peg分子量为2000。
小分子前药与peg修饰剂的重量比为:90:10~70:30,在此范围条件下,紫杉醇可以发挥最好的抗肿瘤效果。
具体地,所述的紫杉醇-香茅醇小分子前药自组装纳米粒的制备方法如下:
(1)非peg化的小分子前药自组装纳米粒的制备方法:将一定量的前药溶解到适量的乙醇中,搅拌下,将该乙醇溶液缓缓滴加到水中,前药自发形成均匀的纳米粒。采用透析法除去制剂中的乙醇,得到不含任何有机溶剂的纳米胶体溶液。
(2)peg修饰的小分子前药自组装纳米粒的制备方法:将一定量的peg修饰剂(tpgs、dspe-peg、plga-peg或pe-peg)和前药溶解到适量的乙醇中,搅拌下,将该乙醇溶液缓缓滴加到水中,前药自发形成均匀的纳米粒。采用透析法除去制剂中的乙醇,得到不含任何有机溶剂的纳米胶体溶液。
(3)包载荧光物质或疏水性药物的小分子前药自组装纳米粒的制备方法:将一定量的荧光物质(香豆素-6、罗丹明、dir、dii、cy-5或cy-7)或疏水性药物和前药溶解到适量的乙醇中,搅拌下,将该乙醇溶液缓缓滴加到水中,前药自发形成均匀的纳米粒。采用透析法除去制剂中的乙醇,得到不含任何有机溶剂的纳米胶体溶液。
(4)主动靶向的小分子前药自组装纳米粒的制备方法:将一定量的茴香胺修饰的dspe-peg(dspe-peg-aa)和前药溶解到适量的乙醇中,搅拌下,将该乙醇溶液缓缓滴加到水中,前药自发形成均匀的纳米粒。采用透析法除去制剂中的乙醇,得到不含任何有机溶剂的纳米胶体溶液。
本发明具有以下有益效果:(1)设计合成了含有硒键(单硒键,二硒键)或硫键(单硫键,二硫键)桥连的氧化还原双敏感小分子前药和含有碳键(单碳键,碳碳键)桥连的对照前药,合成方法简单易行;(2)制备了均匀的小分子前药自组装纳米粒,制备方法简单易行,稳定性好,实现紫杉醇的高效包载;(3)考察了不同化学桥连在键角/二面角、氧化还原敏感响应能力以及抗肿瘤活性等方面的差异,以及对前药自组装纳米粒的稳定性、药物释放、细胞毒性、药动学、组织分布以及药效学产生的影响。综合筛选出效果最佳的化学桥连,为开发肿瘤微环境智能响应型药物递送系统提供新的策略和更多的选择,满足临床中对高效化疗制剂的迫切需求。
附图说明
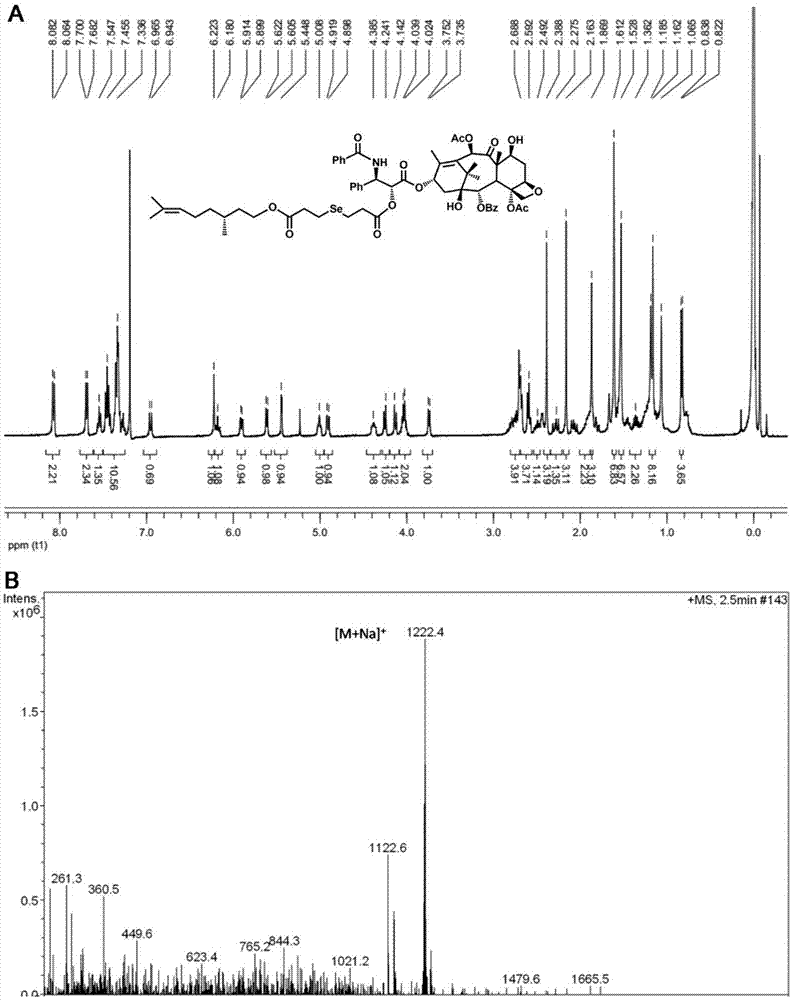
图1为本发明实施例1的单硒键桥连紫杉醇-香茅醇前药(ptx-se-cit)的1hnmr谱图和质谱图。
图2为本发明实施例2的二硒键桥连紫杉醇-香茅醇前药(ptx-sese-cit)的1hnmr谱图和质谱图。
图3为本发明实施例3的单硫键桥连紫杉醇-香茅醇前药(ptx-s-cit)的1hnmr谱图和质谱图。
图4为本发明实施例4的二硫键桥连紫杉醇-香茅醇前药(ptx-ss-cit)的1hnmr谱图和质谱图。
图5为本发明实施例5的单碳键桥连紫杉醇-香茅醇前药(ptx-c-cit)的1hnmr谱图和质谱图。
图6为本发明实施例6的碳碳键桥连的紫杉醇-香茅醇前药(ptx-cc-cit)的1hnmr谱图和质谱图。
图7为本发明实施例7的peg修饰的小分子前药自组装纳米粒的透射电子显微镜图。
图8为本发明实施例8的peg修饰的小分子前药自组装纳米粒的粒径-存储时间图。
图9为本发明实施例10的peg修饰的小分子前药自组装纳米粒的体外释放试验图
图10为本发明实施例11的peg修饰的小分子前药自组装纳米粒的细胞毒性图。
图11为本发明实施例11的peg修饰的小分子前药自组装纳米粒的肿瘤细胞内药物释放图。
图12为本发明实施例11的peg修饰的小分子前药自组装纳米粒对肿瘤细胞内ros水平影响图。
图13为本发明实施例12的peg修饰的小分子前药自组装纳米粒的细胞摄取图。
图14为本发明实施例13的peg修饰的小分子前药自组装纳米粒的血药浓度-时间曲线图。
图15为本发明实施例14的peg修饰的小分子前药自组装纳米粒的组织分布图。
图16为本发明实施例15的peg修饰的小分子前药自组装纳米粒的在体抗肿瘤实验图。
具体实施方式
下面通过实施例的方式进一步说明本发明,但并不因此将发明限制在所述的实施例范围之中。
实施例1:单硒键桥连紫杉醇-香茅醇小分子前药(ptx-se-cit)的合成
将适量硒代二丙酸加入到50ml圆底烧瓶中,并用3ml乙酸酐溶解,室温下搅拌2个小时,通过薄层色谱监测反应过程,之后将20ml的甲苯分三次加入体系中,并进行减压蒸馏干燥。将所得产物溶于30ml二氯甲烷中,并加入适量香茅醇和dmap,室温条件下搅拌1小时,通过薄层色谱监测反应过程,用硅胶柱色谱法纯化得到中间产物。最后将中间产物、edci、hobt和dmap溶于50ml无水二氯甲烷中,冰浴1小时,然后加入适量紫杉醇,在室温下再搅拌24小时,通过薄层色谱监测反应过程,目标产物通过制备液相色谱分离纯化既得。上述反应全程都在n2保护下进行。
采用质谱法以及核磁共振氢谱法来确定实施例1中前药的结构,结果如图1所示。核磁共振选用的溶剂为cdcl3,波谱解析结果如下:
1hnmr(400mhz,cdcl3):δ8.08(d,2h,ar-h,j=7.3hz),7.70(d,2h,ar-h,j=7.4hz),7.55(t,1h,ar-h,j=7.4hz),7.46-7.34(ar-h,10h),6.97(d,1h,j=9.2hz,-nh-),6.22(s,1h,10-h),6.18(t,1h,j=8.6hz,13-h),5.90(dd,1h,j=3.0hz,j=6.4hz,3'-h),5.62(d,1h,j=7.0hz,2-h),5.45(d,j=3.5hz,1h,h-2’,ptx),5.00(t,1h,(ch3)2cch),4.91(d,1h,j=8.0hz,5-h),4.39(dd,1h,j=6.5hz,j=4.2hz,7-h),4.24(d,1h,j=8.4hz,20α-h),4.14(d,1h,j=8.4hz,20β-h),4.04(m,2h,ch2oco),3.75(d,1h,j=7.0hz,3-h),2.69(t,4h,ch2ch2sech2ch2),2.59(t,4h,ch2ch2sech2ch2),2.49(m,1h,6α-h),2.39(s,3h,4-coch3),2.28(m,2h,14-h),2.16(s,3h,10-coch3),1.91(m,2h,ch2ch2oh),1.89(t,1h,6β-h),1.86(s,3h,18-ch3),1.68(s,3h,19-ch3),1.61(s,3h,(ch3)2cch,cis-),1.53(s,3h,(ch3)2cch,trans-),1.52(m,2h,(ch3)2cchch2),1.36(m,2h,ch2ch(ch3)ch2),1.19(s,3h,17-ch3),1.16(s,3h,16-ch3),1.07(m,1h,ch2ch(ch3)ch2),0.850(d,3h,ch2ch(ch3)ch2).ms(esi)m/zforc63h77no17sena[m+na]+:1222.4.
实施例2:二硒键桥连紫杉醇-香茅醇小分子前药(ptx-sese-cit)的合成
将适量3,3'-二硒代二丙酸加入到50ml圆底烧瓶中,并用3ml乙酸酐溶解,室温下搅拌2个小时,通过薄层色谱监测反应过程,之后将20ml的甲苯分三次加入体系中,并进行减压蒸馏干燥。将所得产物溶于30ml二氯甲烷中,并加入适量香茅醇和dmap,室温条件下搅拌1小时,通过薄层色谱监测反应过程,用硅胶柱色谱法纯化得到中间产物。最后将中间产物、edci、hobt和dmap溶于50ml无水二氯甲烷中,冰浴1小时,然后加入适量紫杉醇,在室温下再搅拌24小时,通过薄层色谱监测反应过程,目标产物通过制备液相色谱分离纯化既得。上述反应全程都在n2保护下进行。
采用质谱法以及核磁共振氢谱法来确定实施例2中前药的结构,结果如图2所示。核磁共振选用的溶剂为cdcl3,波谱解析结果如下:
1hnmr(400mhz,cdcl3):δ8.09(d,2h,ar-h,j=7.3hz),7.69(d,2h,ar-h,j=7.4hz),7.55(t,1h,ar-h,j=7.4hz),7.45-7.33(ar-h,10h),7.00(d,1h,j=9.2hz,-nh-),6.23(s,1h,10-h),6.19(t,1h,j=8.6hz,13-h),5.91(dd,1h,j=3.0hz,j=6.4hz,3'-h),5.62(d,1h,j=7.0hz,2-h),5.46(d,j=3.5hz,1h,h-2’,ptx),5.01(t,1h,(ch3)2cch),4.90(d,1h,j=8.0hz,5-h),4.39(dd,1h,j=6.5hz,j=4.2hz,7-h),4.24(d,1h,j=8.4hz,20α-h),4.14(d,1h,j=8.4hz,20β-h),4.02(m,2h,ch2oco),3.76(d,1h,j=7.0hz,3-h),2.98(t,4h,ch2ch2sesech2ch2),2.68(t,4h,ch2ch2sesech2ch2),2.50(m,1h,6α-h),2.39(s,3h,4-coch3),2.29(m,2h,14-h),2.16(s,3h,10-coch3),1.93(m,2h,ch2ch2oh),1.88(t,1h,6β-h),1.86(s,3h,18-ch3),1.68(s,3h,19-ch3),1.61(s,3h,(ch3)2cch,cis-),1.53(s,3h,(ch3)2cch,trans-),1.52(m,2h,(ch3)2cchch2),1.36(m,2h,ch2ch(ch3)ch2),1.19(s,3h,17-ch3),1.17(s,3h,16-ch3),1.07(m,1h,ch2ch(ch3)ch2),0.84(d,3h,ch2ch(ch3)ch2).ms(esi)m/zforc63h77no17se2na[m+na]+:1300.8.
实施例3:单硫键桥连紫杉醇-香茅醇小分子前药(ptx-s-cit)的合成
将适量硫代二丙酸加入到50ml圆底烧瓶中,并用3ml乙酸酐溶解,室温下搅拌2个小时,通过薄层色谱监测反应过程,之后将20ml的甲苯分三次加入体系中,并进行减压蒸馏干燥。将所得产物溶于30ml二氯甲烷中,并加入适量香茅醇和dmap,室温条件下搅拌1小时,通过薄层色谱监测反应过程,用硅胶柱色谱法纯化得到中间产物。最后将中间产物、edci、hobt和dmap溶于50ml无水二氯甲烷中,冰浴1小时,然后加入适量紫杉醇,在室温下再搅拌24小时,通过薄层色谱监测反应过程,目标产物通过制备液相色谱分离纯化既得。上述反应全程都在n2保护下进行。
采用质谱法以及核磁共振氢谱法来确定实施例3中前药的结构,结果如图3所示。核磁共振选用的溶剂为cdcl3,波谱解析结果如下:
1hnmr(400mhz,cdcl3):δ8.13(d,2h,ar-h,j=7.3hz),7.75(d,2h,ar-h,j=7.4hz),7.62(t,1h,ar-h,j=7.4hz),7.40-7.52(ar-h,10h),7.02(d,1h,j=9.2hz,-nh-),6.29(s,1h,10-h),6.25(t,1h,j=8.6hz,13-h),5.98(dd,1h,j=3.0hz,j=6.4hz,3'-h),5.69(d,1h,j=7.0hz,2-h),5.51(d,j=3.5hz,1h,h-2’,ptx),5.07(t,1h,(ch3)2cch),4.99(d,1h,j=8.0hz,5-h),4.45(dd,1h,j=6.5hz,j=4.2hz,7-h),4.21(d,1h,j=8.4hz,20α-h),4.11(d,1h,j=8.4hz,20β-h),4.09(m,2h,ch2oco),3.82(d,1h,j=7.0hz,3-h),2.75(t,4h,ch2ch2sch2ch2),2.54(t,4h,ch2ch2sch2ch2),2.50(m,1h,6α-h),2.45(s,3h,4-coch3),2.34(m,2h,14-h),2.23(s,3h,10-coch3),2.01(m,2h,ch2ch2oh),1.95(t,1h,6β-h),1.94(s,3h,18-ch3),1.68(s,3h,19-ch3),1.66(s,3h,(ch3)2cch,cis-),1.60(s,3h,(ch3)2cch,trans-),1.59(m,2h,(ch3)2cchch2),1.43(m,2h,ch2ch(ch3)ch2),1.25(s,3h,17-ch3),1.23(s,3h,16-ch3),1.23(m,1h,ch2ch(ch3)ch2),0.90(d,3h,ch2ch(ch3)ch2).ms(esi)m/zforc63h77no17sna[m+na]+:1174.3.
实施例4:二硫键桥连紫杉醇-香茅醇小分子前药(ptx-ss-cit)的合成
将适量3,3'-二硫代二丙酸加入到50ml圆底烧瓶中,并用3ml乙酸酐溶解,室温下搅拌2个小时,通过薄层色谱监测反应过程,之后将20ml的甲苯分三次加入体系中,并进行减压蒸馏干燥。将所得产物溶于30ml二氯甲烷中,并加入适量香茅醇和dmap,室温条件下搅拌1小时,通过薄层色谱监测反应过程,用硅胶柱色谱法纯化得到中间产物。最后将中间产物、edci、hobt和dmap溶于50ml无水二氯甲烷中,冰浴1小时,然后加入适量紫杉醇,在室温下再搅拌24小时,通过薄层色谱监测反应过程,目标产物通过制备液相色谱分离纯化既得。上述反应全程都在n2保护下进行。
采用质谱法以及核磁共振氢谱法来确定实施例4中前药的结构,结果如图4所示。核磁共振选用的溶剂为cdcl3,波谱解析结果如下:
1hnmr(400mhz,cdcl3):δ8.08(d,2h,ar-h,j=7.3hz),7.69(d,2h,ar-h,j=7.4hz),7.55(t,1h,ar-h,j=7.4hz),7.45-7.33(ar-h,10h),7.00(d,1h,j=9.2hz,-nh-),6.23(s,1h,10-h),6.18(t,1h,j=8.6hz,13-h),5.93(dd,1h,j=3.0hz,j=6.4hz,3'-h),5.63(d,1h,j=7.0hz,2-h),5.46(d,j=3.5hz,1h,h-2’,ptx),5.00(t,1h,(ch3)2cch),4.90(d,1h,j=8.0hz,5-h),4.38(dd,1h,j=6.5hz,j=4.2hz,7-h),4.24(d,1h,j=8.4hz,20α-h),4.14(d,1h,j=8.4hz,20β-h),4.04(m,2h,ch2oco),3.76(d,1h,j=7.0hz,3-h),2.80(t,4h,ch2ch2ssch2ch2),2.60(t,4h,ch2ch2ssch2ch2),2.49(m,1h,6α-h),2.39(s,3h,4-coch3),2.29(m,2h,14-h),2.16(s,3h,10-coch3),1.94(m,2h,ch2ch2oh),1.87(t,1h,6β-h),1.87(s,3h,18-ch3),1.61(s,3h,19-ch3),1.61(s,3h,(ch3)2cch,cis-),1.53(s,3h,(ch3)2cch,trans-),1.52(m,2h,(ch3)2cchch2),1.36(m,2h,ch2ch(ch3)ch2),1.19(s,3h,17-ch3),1.17(s,3h,16-ch3),1.12(m,1h,ch2ch(ch3)ch2),0.84(d,3h,ch2ch(ch3)ch2).ms(esi)m/zforc63h77no17s2na[m+na]+:1206.2.
实施例5:单碳键桥连紫杉醇-香茅醇小分子前药(ptx-c-cit)的合成
将适量辛二酸加入到50ml圆底烧瓶中,并用3ml乙酸酐溶解,室温下搅拌2个小时,通过薄层色谱监测反应过程,之后将20ml的甲苯分三次加入体系中,并进行减压蒸馏干燥。将所得产物溶于30ml二氯甲烷中,并加入适量香茅醇和dmap,室温条件下搅拌1小时,通过薄层色谱监测反应过程,用硅胶柱色谱法纯化得到中间产物。最后将中间产物、edci、hobt和dmap溶于50ml无水二氯甲烷中,冰浴1小时,然后加入适量紫杉醇,在室温下再搅拌24小时,通过薄层色谱监测反应过程,目标产物通过制备液相色谱分离纯化既得。上述反应全程都在n2保护下进行。
采用质谱法以及核磁共振氢谱法来确定实施例5中前药的结构,结果如图5所示。核磁共振选用的溶剂为cdcl3,波谱解析结果如下:
1hnmr(400mhz,cdcl3):δ8.08(d,2h,ar-h,j=7.3hz),7.66(d,2h,ar-h,j=7.4hz),7.54(t,1h,ar-h,j=7.4hz),7.45-7.34(ar-h,10h),6.84(d,1h,j=9.2hz,-nh-),6.23(s,1h,10-h),6.19(t,1h,j=8.6hz,13-h),5.90(dd,1h,j=3.0hz,j=6.4hz,3'-h),5.62(d,1h,j=7.0hz,2-h),5.43(d,j=3.5hz,1h,h-2’,ptx),5.01(t,1h,(ch3)2cch),4.91(d,1h,j=8.0hz,5-h),4.38(dd,1h,j=6.5hz,j=4.2hz,7-h),4.24(d,1h,j=8.4hz,20α-h),4.14(d,1h,j=8.4hz,20β-h),4.02(m,2h,ch2oco),3.75(d,1h,j=7.0hz,3-h),2.49(m,1h,6α-h),2.39(s,3h,4-coch3),2.26(m,2h,14-h),2.20(t,4h,ch2ch2ch2ch2ch2),2.16(s,3h,10-coch3),1.91(m,2h,ch2ch2oh),1.89(t,1h,6β-h),1.87(s,3h,18-ch3),1.68(s,3h,19-ch3),1.61(s,3h,(ch3)2cch,cis-),1.53(s,3h,(ch3)2cch,trans-),1.52(m,2h,(ch3)2cchch2),1.50(t,4h,ch2ch2ch2ch2ch2),1.36(m,2h,ch2ch(ch3)ch2),1.20(s,3h,17-ch3),1.19(t,2h,ch2ch2ch2ch2ch2),1.16(s,3h,16-ch3),1.12(m,1h,ch2ch(ch3)ch2),0.85(d,3h,ch2ch(ch3)ch2).ms(esi)m/zforc64h79no17na[m+na]+:1156.6.
实施例6:碳碳键桥连紫杉醇-香茅醇小分子前药(ptx-cc-cit)的合成
将适量辛二酸加入到50ml圆底烧瓶中,并用3ml乙酸酐溶解,室温下搅拌2个小时,通过薄层色谱监测反应过程,之后将20ml的甲苯分三次加入体系中,并进行减压蒸馏干燥。将所得产物溶于30ml二氯甲烷中,并加入适量香茅醇和dmap,室温条件下搅拌1小时,通过薄层色谱监测反应过程,用硅胶柱色谱法纯化得到中间产物。最后将中间产物、edci、hobt和dmap溶于50ml无水二氯甲烷中,冰浴1小时,然后加入适量紫杉醇,在室温下再搅拌24小时,通过薄层色谱监测反应过程,目标产物通过制备液相色谱分离纯化既得。上述反应全程都在n2保护下进行。
采用质谱法以及核磁共振氢谱法来确定实施例6中前药的结构,结果如图6所示。核磁共振选用的溶剂为cdcl3,波谱解析结果如下:
1hnmr(400mhz,cdcl3):δ8.08(d,2h,ar-h,j=7.3hz),7.68(d,2h,ar-h,j=7.4hz),7.54(t,1h,ar-h,j=7.4hz),7.45-7.34(ar-h,10h),6.85(d,1h,j=9.2hz,-nh-),6.23(s,1h,10-h),6.19(t,1h,j=8.6hz,13-h),5.90(dd,1h,j=3.0hz,j=6.4hz,3'-h),5.62(d,1h,j=7.0hz,2-h),5.44(d,j=3.5hz,1h,h-2’,ptx),5.01(t,1h,(ch3)2cch),4.92(d,1h,j=8.0hz,5-h),4.39(dd,1h,j=6.5hz,j=4.2hz,7-h),4.24(d,1h,j=8.4hz,20α-h),4.14(d,1h,j=8.4hz,20β-h),4.01(m,2h,ch2oco),3.75(d,1h,j=7.0hz,3-h),2.50(m,1h,6α-h),2.39(s,3h,4-coch3),2.31(m,2h,14-h),2.20(t,4h,ch2ch2ch2ch2ch2ch2),2.18(s,3h,10-coch3),2.09(m,2h,ch2ch2oh),1.87(t,1h,6β-h),1.82(s,3h,18-ch3),1.68(s,3h,19-ch3),1.61(s,3h,(ch3)2cch,cis-),1.53(s,3h,(ch3)2cch,trans-),1.52(m,2h,(ch3)2cchch2),1.50(t,4h,ch2ch2ch2ch2ch2ch2),1.36(m,2h,ch2ch(ch3)ch2),1.20(s,3h,17-ch3),1.19(t,4h,ch2ch2ch2ch2ch2ch2),1.16(s,3h,16-ch3),1.12(m,1h,ch2ch(ch3)ch2),0.85(d,3h,ch2ch(ch3)ch2).ms(esi)m/zforc65h81no17na[m+na]+:1170.8.
实施例7:peg修饰的小分子前药自组装纳米粒的制备
精密称取dspe-peg2k2mg和前药8mg,用1ml乙醇将其溶解,搅拌下,将该乙醇溶液缓缓滴加到4ml去离子水中,自发形成均匀的纳米粒(ptx-se-cit纳米粒,ptx-sese-cit纳米粒,ptx-s-cit纳米粒,ptx-ss-cit纳米粒,ptx-c-cit纳米粒,ptx-cc-cit纳米粒)。在25℃的条件下用去离子水透析除去纳米制剂中的有机溶剂。
如表1所示,纳米粒的粒径都在85nm左右,粒径分布小于0.2,表面电荷在-20mv左右,载药量都在50%以上。通过透射电子显微镜测定实施例7中制备的小分子前药自组装纳米粒的粒径和形态,结果如图7,透射电镜图表明载药纳米粒为均一的球形,粒径在90nm左右。
表1.peg修饰的小分子前药自组装纳米粒的粒径、粒径分布、表面电荷和载药量
实施例8:peg修饰的小分子前药自组装纳米粒的胶体稳定性试验
将实施例7中制备的peg修饰的小分子前药自组装纳米粒取出1ml,加入到20ml含有10%fbs的磷酸盐缓冲液(pbs,ph为7.4)中,在37℃的条件下孵育24小时,并且在预定的时间点(0,2,4,6,8,12和24小时)通过动态光散射法测定其粒径变化。结果如图8所示,ptx-sese-cit纳米粒胶体稳定性最好,在24小时内粒径没有发生明显的变化。相比之下,ptx-c-cit纳米粒和ptx-cc-cit纳米粒的胶体稳定性较差,随着孵化时间的延长,纳米粒的粒径逐渐增大。
实施例9:硒/硫/碳键在小分子前药中的键角
通过分子动态模拟,对不同连接键在小分子前药中的键角进行计算,结果为:单硒键(95.4°)、二硒键(89.9°/93.3°)、单硫键(97.8°)、二硫键(94.6°/97.9°)、单碳键(112.6°)、碳碳键(111.6°/115.1°)。二硒键具有最接近90°的键角,在前药的自组装过程中,二硒键能够降低空间位阻,平衡分子间作用力,增强纳米粒的稳定性。因此ptx-sese-cit纳米粒具有最好的胶体稳定性。相比之下,单碳键和碳碳键的键角最大,不能提供良好的空间灵活性,因此ptx-c-cit纳米粒和ptx-cc-cit纳米粒的胶体稳定性较差。同时,对二硒键、二硫键和碳碳键的二面角进行分子模拟计算:二硒键(106.5°),二硫键(164.5°),碳碳键(177.4°)。与碳碳键和二硫键相比,二硒键的二面角最接近90°,在自组装的过程中对纳米粒的稳定性的贡献最大。因此,ptx-sese-cit纳米粒具有最好的胶体稳定性。
实施例10:peg修饰的小分子前药自组装纳米粒的体外释放试验。
以含30%乙醇的ph7.4的磷酸盐缓冲液(pbs)为释放介质,考察小分子前药自组装纳米粒的体外释放情况。将1ml实施例7中制备的peg修饰的小分子前药自组装纳米粒(紫杉醇含量为200μg/ml)加入到30ml释放介质中,在37℃条件下,于设定的时间点取样,通过高效液相色谱测定释放出的紫杉醇浓度。向释放介质中加入一定浓度的双氧水(h2o2,1mm,10mm)或二硫苏糖醇(dtt,1mm,10mm),以分别考察纳米粒在氧化条件和还原条件下的释放情况。
结果如图9所示,硒/硫键桥连的前药纳米粒都具有氧化还原双重响应性,能够在h2o2或dtt的作用下快速释放出紫杉醇。其中,氧化敏感性大小顺序为单硒键>单硫键>>二硒键>二硫键。与硫元素相比,硒元素原子半径更大,电负性更低,键能更低,因此硒键与硫键相比更易被氧化。而单硫键和单硒键相对于二硫键和二硒键电负性更低,因此氧化敏感性更强。还原敏感性则相反,二硫键>二硒键>>单硒键/单硫键。与硫/硒键相比,碳键没有氧化还原响应性,紫杉醇释放量很低(<2%)。
实施例11:peg修饰的小分子前药自组装纳米粒的细胞毒性
采用mtt法考察peg修饰的小分子前药自组装纳米粒对人鳞状上皮癌(kb)细胞的细胞毒性。将状态良好的细胞消化,用培养液稀释至5000cells/ml细胞密度,吹匀后于96孔板中每孔加入细胞悬液100μl,置培养箱中孵育24h使其贴壁。待细胞贴壁后加泰素或实施例7中制备的前药纳米粒。本实验中药物溶液与纳米粒制剂的配制和稀释均用dmem培养液,并用0.22μm滤膜无菌过滤。受试溶液每孔加入100μl,每个浓度3个平行孔。对照组,即不加待测药液,单一补加100μl培养液,置培养箱中和细胞共同孵育。于加药后48和72h,将96孔板取出,每孔加入5mg/mlmtt溶液20μl,置培养箱中孵育4h后甩板,将96孔板倒扣于滤纸上充分吸干残留液体后,每孔加入200μldmso于振荡器上振荡10min以溶解蓝紫色结晶物。设定a1孔(只含有200μldmso)为调零孔。使用酶标仪在570nm处测定各孔调零后的吸光度值。
为了确定与kb细胞孵育后前药纳米粒释放的紫杉醇的量,在固定的时间点(48和72小时)收集细胞和培养基(紫杉醇初始当量浓度:50,100和200ng/ml)。超声处理和离心后,通过液相色谱-质谱联用仪测量上清液中游离紫杉醇的浓度。
考察泰素和前药纳米粒对肿瘤细胞内ros水平的影响。分别将泰素和前药纳米粒(紫杉醇初始当量浓度:100ng/ml)与kb细胞进行孵化,48小时之后通过流式细胞仪检测kb细胞内ros水平的变化。
细胞毒性结果如图10所示。与泰素组相比,前药纳米粒的细胞毒性降低。这是因为紫杉醇需要一定时间从前药纳米粒中释放出来,限制了紫杉醇药效的发挥。硒/硫/碳键对前药纳米粒的细胞毒性具有显著影响。各组纳米粒细胞毒性大小顺序为ptx-sese-cit纳米粒>ptx-se-cit纳米粒>ptx-ss-cit纳米粒>ptx-s-cit纳米粒>>ptx-c-cit纳米粒/ptx-cc-cit纳米粒。前药纳米粒细胞毒性与紫杉醇从纳米粒中的释放速度相关,药物释放速度越快,细胞毒性越强。因此,考察了前药纳米粒在kb细胞中紫杉醇的释放速度。从图11可知,细胞毒性与紫杉醇的释放速率正相关。ptx-sese-cit纳米粒和ptx-se-cit纳米粒释放紫杉醇的速度最快,ptx-c-cit纳米粒和ptx-cc-cit纳米粒几乎不释放紫杉醇。ptx-se-cit纳米粒能够最快地释放紫杉醇,是因为单硒键具有最强的氧化敏感性,能够在肿瘤细胞高表达的ros作用下快速断裂释放出母药。同时,文献报道,硒键能够诱导肿瘤细胞产生ros。因此,考察了泰素和前药纳米粒对kb细胞内ros水平的影响。结果如图12所示,与硫键和碳键相比,单硒键和二硒键能够更大程度上提高肿瘤细胞ros的表达,而ros能进一步促进硒键的氧化断裂。因此ptx-sese-cit纳米粒具有比ptx-ss-cit纳米粒和ptx-s-cit纳米粒更快的母药释放速度。同时,硒键在体内的代谢产物能够诱导肿瘤细胞凋亡,而二硒键具有两个硒原子,相比单硒键细胞毒性更强。综合各方面因素,ptx-sese-cit纳米粒表现出最强的肿瘤细胞毒性。
实施例12:peg修饰的小分子前药自组装纳米粒的细胞摄取
采用流式细胞仪测定peg修饰的小分子前药自组装纳米粒在kb细胞中的摄取情况。将kb细胞以5000cells/ml的密度接种到12孔板上,置培养箱中孵育24h使其贴壁,待细胞贴壁后加游离的香豆素-6或香豆素-6标记的前药纳米粒。香豆素-6的浓度为200ng/ml。在37℃孵化0.5h或2h后,将细胞清洗,收集并分散在pbs中,用流式细胞仪考察细胞对香豆素-6的摄取情况。
实验结果如图13所示,小分子前药自组装纳米粒处理的细胞显示出比游离香豆素-6处理的细胞更高的细胞内荧光强度。因此,制备的小分子前药自组装纳米粒具有比游离香豆素-6更高的细胞摄取效率。
实施例13:peg修饰的小分子前药自组装纳米粒的药代动力学研究
取体重在200-250g之间的sd大鼠,随机分组,给药前禁食12h,自由饮水。分别静脉注射taxol以及实施例7中制备的peg化的小分子前药自组装纳米粒。紫杉醇的剂量为2.5mg/kg。于规定的时间点眼眶取血,分离获得血浆。通过液相色谱-质谱联用仪测定血浆中的药物浓度。
实验结果如图14所示,由于半衰期短,泰素中的紫杉醇迅速从血液中清除。相比之下,小分子前药自组装纳米粒的循环时间明显延长。同时,硒/硫/碳键对前药纳米粒的药动学行为有显著影响。ptx-sese-cit纳米粒和ptx-se-cit纳米粒具有更高的auc和更长的循环时间。这是因为二硒键和二硫键的键角/二面角增强了自组装纳米粒的胶体稳定性。单硒键和单硫键具有极强的氧化敏感性,在血液循环中会逐渐释放出母药,因此ptx-se-cit纳米粒和ptx-s-cit纳米粒所释放出的紫杉醇auc更高。而ptx-c-cit纳米粒和ptx-cc-cit纳米粒由于胶体稳定性较差,在血液循环中纳米结构解体,因此auc和循环时间低于ptx-sese-cit纳米粒。
实施例14:peg修饰的小分子前药自组装纳米粒的组织分布实验
将kb细胞悬液接种于裸鼠,当肿瘤体积达到400mm3时,尾静脉注射给药:游离的dir和dir标记的前药自组装纳米粒,dir的给药剂量为1mg/kg。4小时或24小时后,将裸鼠处死,分离出主要器官(心,肝,脾,肺,肾)和肿瘤,用活体成像仪进行分析。
结果如图15所示,与dir溶液剂相比,peg化的小分子前药自组装纳米粒组在肿瘤组织的荧光强度显著增加。同时,dir溶液剂中荧光主要分布在肺部,在肿瘤组织中几乎没有分布。相比之下,peg化的小分子前药自组装纳米粒主要分布在肝脏和肿瘤组织,并且肿瘤中的荧光信号强度从4到24小时逐渐增加。此外,小分子前药自组装纳米粒的生物分布与其药代动力学行为完全一致,ptx-sese-cit纳米粒稳定性最好,体内循环时间最长,因此表现出最好的肿瘤蓄积能力。
实施例15:peg修饰的小分子前药自组装纳米粒的在体抗肿瘤实验
将kb细胞悬液(5x106cells/100μl)接种于雌性裸鼠腹侧皮下。待肿瘤体积生长至150mm3时,将荷瘤小鼠随机分组,每组五只,分别给与生理盐水、taxol和实施例7中制备的peg修饰的小分子前药自组装纳米粒。每隔1天给药1次,连续给药5次,按紫杉醇计算,给药剂量为8mg/kg。给药后,每天观察小鼠的存活状态,称体重,测量肿瘤体积。最后一次给药后一天将裸鼠处死,获取器官和肿瘤,进行进一步分析评价。收集主要器官(心脏,肝脏,脾脏,肺,肾脏)和肿瘤组织并用福尔马林固定用于h&e染色。
实验结果如图16所示,与生理盐水相比,taxol表现出一定的肿瘤抑制活性。小分子前药自组装纳米粒显示出比taxol更强的抗肿瘤活性,肿瘤体积几乎没有增长。其中,ptx-sese-cit纳米粒的抗肿瘤效果最好,其次为ptx-ss-cit纳米粒。相比之下,ptx-se-cit纳米粒和ptx-s-cit纳米粒由于胶体稳定性稍差,体循环时间短,在体循环中过早的释放出药物,因此抗肿瘤效果不如ptx-sese-cit纳米粒和ptx-ss-cit纳米粒。而ptx-c-cit纳米粒和ptx-cc-cit纳米粒胶体稳定性最差,不能及时释放出紫杉醇,因此抗肿瘤效果最差。结果表明纳米粒的稳定性、细胞毒性、药动学、组织分布和肿瘤部位响应释药能力都会影响最终的抗肿瘤效果。
如图16d所示,各组裸鼠体重没有明显变化。从图16e可知,各组裸鼠肝肾功能没有明显受损。这些结果说明peg化的小分子前药自组装纳米粒在具有明显的抗肿瘤效果的同时,没有对机体造成显著的非特异性毒性,是安全有效的抗癌药物传递系统。
- 还没有人留言评论。精彩留言会获得点赞!