一种蝎肽制剂的制作方法
本发明涉及天然药物领域,具体涉及一种蝎肽制剂。
背景技术:
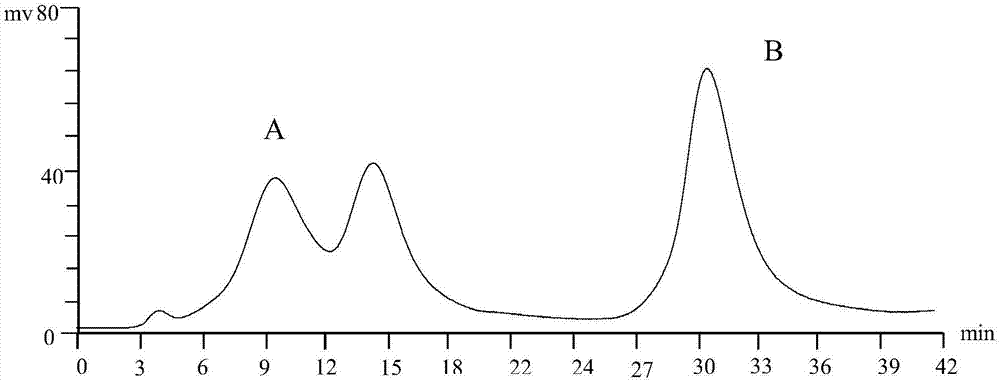
:蝎子属节肢动物门,蛛形纲,蝎目,钳蝎科。全蝎性味咸平,归足朔阴经,具有息风镇痉,攻毒散结,通络止痛的功效,可用于小儿惊风,抽搐痉挛,中风口歪,半身不遂,破伤风,风湿顽痹,偏正头痛,疮疡,瘰疬等疾病的治疗。经研究认为,蝎毒是全蝎药理作用的主要成分,蝎毒是活性多肽的混合物,包括昆虫类神经毒素,甲壳类神经毒素,哺乳动物神经毒素,抗癫痫活性的多肽,镇痛活性多肽等,能特异性作用于各种离子通道。蝎毒是新药发现的重要来源。目前的蝎毒研发所存在的技术问题是:蝎毒原料以蝎毒蛋白质或多肽混合物存在,不是单体,其纯度、质量不够稳定,有效成分不明确直接影响应用,没有具体定性、定量指标,难于满足对药品原料质量的要求。蝎毒多肽注射液受温度的影响而发生降解,温度越高,降解越快,一旦蝎肽含量低于其标示量的90%或有关物质的相对含量超过医药标准规定限度就不符合临床使用要求。因此,开发一种蝎肽单体及其制备方法、制剂,满足迫切的临床应用的需要。本申请是201710426683.0(一种蝎肽及其制备方法)的分案申请。技术方案本发明的目的在于提供一种蝎肽制剂及其制备方法,以及该蝎肽具有戒毒、镇痛、抗癫痫、抗成瘾、抗血栓、抗肿瘤、治疗风湿、治疗类风湿、治疗关节炎的活性。本发明涉及一种蝎肽,其特征在于:sqe1本发明涉及一种蝎肽,其特征在于:sqe1本发明涉及一种蝎肽,其特征在于:该蝎肽是从蝎毒中分离得到的,具体过程为,第1步、经过色谱得到a和b两部分;第2步、a部分经过脱水脱盐,冷冻干燥;第3步、经hplc分离纯化;第4步、脱水脱盐,冷冻干燥;第5步、分子量的测定;第6步、氨基酸序列的测定。本发明涉及一种蝎肽,其特征在于:该蝎肽是从蝎毒中分离得到的,具体过程为,第1步、经过凝胶离子交换色谱得到a和b两部分;第2步、a部分经过脱水脱盐,冷冻干燥;第3步、经hplc分离纯化;第4步、脱水脱盐,冷冻干燥;第5步、分子量的测定;第6步、氨基酸序列的测定。本发明涉及一种蝎肽,其特征在于:该蝎肽是从蝎毒中分离得到的,具体过程为,第1步、经过凝胶离子交换色谱得到a部分;将冻干的蝎毒用0.01mol/l的氢氧化钠和磷酸二氢钾溶解,然后上样至凝胶离子交换色谱进行分离,收集a部分;凝胶离子交换色谱的具体过程为,hplc色谱分析采用高效液相色谱仪、cxth-3000色谱工作站,色谱柱(sephadextmg-50、sephadextmg-75、sephadexlh-20、cmsepharosetm、bestaroseff、bestarosehp、deaebestaroseff200mm×250mm;200mm×600mm;200mm×400mm;200mm×800mm),流速:5.0-10.0ml·min-1,检测波长:260nm,进样量:2ml,流动相为:a:0.01mol/l的氢氧化钠和磷酸二氢钾,b:0.01mol/l的氢氧化钠、磷酸二氢钾和1mol/l氯化钠,洗脱程序:0~10min,a;10~35min,b;得到峰a和峰b;峰a的出峰时间;5-18min;峰b的出峰时间:27-35min;含有峰a的洗脱液为a部分;含有峰b的洗脱液为b部分。第2步、a部分经过脱水脱盐(透析袋)冷冻干燥;a部分经过脱水,脱盐,-20℃—-30℃冷冻4-6小时,移至冷冻干燥机,-50℃;减压干燥24-36小时,得到白色粉末。第3步、a部分的白色粉末经hplc分离纯化;具体过程为,hplc色谱采用高效液相色谱仪,色谱柱(chromdex75pg、chromdex100pg、chromdexs-100、c4、c8、c18、tskgelg2000色谱柱10mm×250mm,10mm×300mm,5μm,),流速:0.5-2.0ml·min-1,检测波长:260nm,进样量:50-500μl,流动相为:a:水-0.01%三氟乙酸,b:乙腈-水-0.01%三氟乙酸,梯度洗脱程序:0-5minb:5%5-10min,b:5-20%;10-40minb:20-55%;40-45minb:55-100%;45-55minb:100%;55-60minb:5%收集出峰时间;44-46min的部分。第4步、脱水脱盐,冷冻干燥;收集脱水脱盐,冷冻干燥;经过脱水,脱盐-20℃—-30℃冷冻4-6小时,移至冷冻干燥机,-50℃;减压干燥24-36小时,得到白色粉末,得到蝎毒单体bmkita;第5步、分子量的测定;样品与基质chca混合,用基质辅助激光解析电离-飞行时间串联质谱仪maldi-tof/tof(ultraflextreme,brucker,germany)在线性模式下检测。结果显示平均分子量为6732.7686。6732.7686为bmkita带1个电荷的质荷比,3368.4944为bmkita带2个电荷的质荷比,2245.5439为bmkita带3个电荷的质荷比。第6步、氨基酸序列的测定。蛋白样品经dtt还原和碘代乙酰胺烷基化处理后,加入胰蛋白酶酶解过夜。酶解后得到的肽段再经c18ziptip脱盐后,与基质α-cyano-4-hydroxycinnamicacid(chca)混合点板。最后用基质辅助激光解析电离-飞行时间质谱仪maldi-tof/tof(ultraflextremetm,brucker,germany)进行分析。激光能量6500,正离子模式,线性模式下检测。数据库检索是通过从www.matrixscience.com网站上ms/msionsearch页面处理的.检索参数:trypsin酶解,设两个漏切位点。设定半胱氨酸的烷基化为固定修饰,甲硫氨酸的氧化为可变修饰。鉴定所用的数据库为ncbiprot。检索结果:多肽编号q9xy87.1recname:full=beta-insectdepressanttoxinbmkita;short=bmkita;altname:full=bmkditap3;flags:precursor氨基酸序列为:dgyirgsngckvsclwgnegcnkecraygasygycwtwglacwcqglpddktwksesntcg6740.38本发明涉及一种蝎肽用于制备如下用途的组合物:治疗:小儿惊风,抽搐痉挛,中风口歪,半身不遂,破伤风,风湿顽痹,偏正头痛,疮疡,瘰疬。本发明涉及一种蝎肽用于制备如下用途的组合物:戒毒、镇痛、抗癫痫、抗成瘾、抗血栓、抗肿瘤、治疗风湿、治疗类风湿、治疗关节炎。本发明涉及一种蝎肽用于制备治疗如下用途的组合物:其特征在于:采用本领域的辅料制备得到药物、食品、保健品。本发明涉及一种蝎肽制剂,其特征在于,所述的制剂包括作为蝎肽和选自药学上允许的增溶材料。增溶材料选自,甲磺酸盐、盐酸盐、硫酸盐、氢溴酸盐、醋酸盐、酒石酸盐、马来酸盐、枸橼酸盐、氨基酸等。本发明涉及一种蝎肽制剂,水溶性好,制剂稳定性好。本发明涉及的每制剂单位含有0.1-200μg蝎肽。本发明涉及的每制剂单位含有0.5-100μg蝎肽。本发明涉及的每制剂单位含有1-50μg蝎肽。本发明涉及的制剂单位是指片剂的每片、胶囊剂的每粒胶囊、颗粒剂的每袋等药学上常规制剂的剂型单位。本发明注射制剂的制备方法包括:(1)所述的制剂为由蝎肽、增溶材料和注射用水配制的每制剂单位含有0.1-200μg蝎肽的注射剂。(2)所述的制剂为由蝎肽、增溶材料、骨架材料和注射用水配制的每制剂单位含有0.1-200μg蝎肽的冻干粉针剂。本发明涉及的蝎肽注射剂采用本领域技术人员常用的方法制备。本发明涉及的蝎肽注射剂采用如下方法制备:向蝎肽中加入增溶材料,加入注射用水,加热溶解,稀释,过滤,滤液超滤,灌装,封口制成,灭菌,检验,即得。本发明涉及的蝎肽冻干粉针剂采用本领域技术人员常用的方法制备,本发明涉及的蝎肽冻干粉针剂采用如下方法制备:向蝎肽中加入增溶材料,加入骨架材料和注射用水,加热过滤,滤液超滤,分装,冷冻干燥、封装。冷冻干燥分为四个阶段:(1)预冻3-4小时,温度在-30~-45℃;(2)减压干燥14小时,温度在-30~-45℃;(3)升温干燥4小时,温度在-15~-10c;(4)二次升温干燥4小时,温度在30℃。本发明所得蝎肽冻干成形良好,结晶优良、稳定性高,便于运输和贮存。本发明所述的氨基酸增溶材料为氨基酸或其盐酸盐,优选l-半胱氨酸盐酸、天门冬氨酸、精氨酸、甘氨酸、谷氨酸、赖氨酸、鸟氨酸、络氨酸、缬氨酸、组氨酸或盐。本发明所述的氨基酸增溶材料优选天门冬氨酸。本发明所述的骨架材料为乳糖、半乳糖、海藻糖、甘露醇、甘露醇-葡萄糖、甘露醇-右旋糖酐、葡萄糖或右旋糖酐。本发明所述的骨架材料优选海藻糖-葡萄糖、海藻糖-右旋糖酐,更优选比为5∶1的海藻糖-葡萄糖或4∶1的海藻糖-右旋糖酐。相对于现有技术,本发明具有如下优点:(1)本发明提供的蝎肽,纯度大于98%,蝎肽的破坏少、损耗少、收率高、纯度高、稳定性好;(2)本发明所提供的蝎肽制剂,水溶性良,稳定性好,安全可靠,质量稳定,不需在特定温度下的冰箱中保存,室温下贮存期长,节约了贮藏、运输成本,使用方便;附图说明:图1:峰a和峰b的洗脱图图2:蝎肽单体的洗脱图图3:蝎肽单体的maldi-tof/tof图图4:氨基酸序列的鉴定图图5:1423.6945的二级谱图图6:1868.9333的二级谱图原料蝎毒的来源包括而不限于市售、或按照本领域的常用技术制备、本发明的制备方法。该蝎肽是从蝎毒中分离得到的,实验的优选过程为,第1步、将冻干的蝎毒用0.01mol/l的氢氧化钠和磷酸二氢钾溶解,第2步、然后上样至凝胶离子交换色谱进行分离,收集a部分;凝胶离子交换色谱的具体优选过程为,本发明考察了不同的色谱柱(sephadextmg-50、sephadextmg-75、sephadexlh-20、cmsepharosetm、bestaroseff、bestarosehp、deaebestaroseff200mm×250mm;200mm×600mm;200mm×400mm;200mm×800mm),hplc色谱分析采用高效液相色谱仪、cxth-3000色谱工作站,流速:5.0-10.0ml·min-1,检测波长:260nm,进样量:2ml,流动相为a:0.01mol/l的氢氧化钠和磷酸二氢钾,b:0.01mol/l的氢氧化钠、磷酸二氢钾和1mol/l氯化钠,洗脱程序:0~10min,a;10~35min,b;得到峰a和峰b;峰a的出峰时间;5-18min;峰b的出峰时间:27-35min;含有峰a的洗脱液为a部分。含有峰b的洗脱液为b部分。单体的hplc分离纯化的优选过程为,hplc色谱采用高效液相色谱仪,色谱柱(chromdex75pg、chromdex100pg、chromdexs-100、c4、c8、c18、tskgelg2000色谱柱10mm×250mm,10mm×300mm,5μm,),流速:0.5-2.0ml·min-1,检测波长:260nm,进样量:50-500μl,流动相为a:水-0.01%三氟乙酸,b:乙腈-水-0.01%三氟乙酸,梯度洗脱,。洗脱程序:0-5minb:5%5-10min,b:5-20%;10-40min;b:20-55%;40-45minb:55-100%;45-55minb100%;55-60minb:5%收集出峰时间;44-46min的部分。色谱柱类型单体出峰时间chromdex75pg10mm×250mm43.2710mm×300mm45.68chromdex100pg10mm×250mm45.8110mm×300mm45.91chromdexs-10010mm×250mm44.2310mm×300mm45.12c410mm×250mm44.9810mm×300mm45.13c810mm×250mm44.8510mm×300mm44.63c1810mm×250mm45.2310mm×300mm44.81tskgelg2000色谱柱10mm×250mm462310mm×300mm45.398具体实施方式以下为本发明的具体实施方式,所述的实施例是为了进一步描述本发明,而不是限制本发明。实施例1:原料药蝎肽单体的制备第1步、经过色谱得到a和b两部分;将冻干的蝎毒用0.01mol/l的氢氧化钠和磷酸二氢钾溶解,然后上样至凝胶离子交换色谱进行分离,收集a部分:凝胶离子交换色谱的具体过程为,hplc色谱分析采用高效液相色谱仪、cxth-3000色谱工作站,色谱柱(sephadextmg-50200mm×250mm),流速:5.0-10.0ml·min-1,检测波长:260nm,进样量:2ml,流动相为:a:0.01mol/l的氢氧化钠和磷酸二氢钾,b:0.01mol/l的氢氧化钠、磷酸二氢钾和1mol/l氯化钠,洗脱程序:0~10min,a;10~35min,b;得到峰a和峰b;峰a的出峰时间;5-18min;峰b的出峰时间:27-35min;含有峰a的洗脱液为a部分。第2步、a部分经过脱水脱盐(透析袋)冷冻干燥;a部分经过脱水(聚乙二醇),脱盐(透析袋),-30℃冷冻5小时,移至冷冻干燥机,-50℃;减压干燥36小时,得到白色粉末。第3步、白色粉末经hplc分离纯化;具体过程为,hplc色谱采用高效液相色谱仪,色谱柱(chromdex75pg,10mm×300mm,5μm,),流速:0.5-2.0ml·min-1,检测波长:260nm,进样量:500μl,流动相为:a:水-0.01%三氟乙酸,b:乙腈-水-0.01%三氟乙酸,梯度洗脱程序:0-5minb:5%5-10min,b:5-20%;10-40min;b:20-55%;40-45minb:55-100%;45-55minb:100%;55-60minb:5%收集出峰时间;44-46min的部分。第4步、脱水脱盐(透析袋)冷冻干燥;经过脱水(聚乙二醇),脱盐(透析袋),-30℃冷冻5小时,移至冷冻干燥机,-50℃;减压干燥36小时,得到白色粉末。得到蝎毒单体。第5步、分子量的测定;蝎毒单体分子量的确定样品与基质chca混合,用基质辅助激光解析电离-飞行时间串联质谱仪maldi-tof/tof(ultraflextreme,brucker,germany)在线性模式下检测;结果显示平均分子量为6732.7686。第6步、氨基酸序列的测定。蝎毒单体样品经dtt还原和碘代乙酰胺烷基化处理后,加入胰蛋白酶酶解过夜;酶解后得到的肽段再经c18ziptip脱盐后,与基质α-cyano-4-hydroxycinnamicacid(chca)混合点板;用基质辅助激光解析电离-飞行时间质谱仪maldi-tof/tof进行分析。实施例2:原料蝎毒的制备将全蝎2kg,绞碎,匀浆,加入5升含5%醋酸的50%乙醇,低温5℃搅拌浸泡5次,过滤、离心过滤,取5次滤液,减压过滤,滤液通过d152型弱酸性阳离子树脂柱,以去离水洗脱,至洗脱液呈无色,然后用5%醋酸液洗脱(洗脱速度50ml/分),富集,合并、减压浓缩,浓缩物以氨水调ph8.0,低温5℃放置48小时,过滤、干澡,得白色沉淀物蝎毒。实施例3:蝎肽冻干粉针剂的制备5.0mg蝎肽加入5.0g精氨酸,加5.0g海藻糖溶解,加入注射用水,加热溶解,稀释至1000ml,过滤、滤液超滤,分装、冷冻干燥,完毕后压盖。上述冷冻干燥分为四个阶段:(1)预冻3小时,温度在-30℃;(2)减压干燥14小时,温度在-30℃;(3)升温干燥4小时,温度在-15℃(4)二次升温干燥4小时,温度在30℃。实施例4:蝎肽冻干粉针剂的制备5.0mg蝎肽加入5.0g谷氨酸,加5.0g海藻糖溶解,加入注射用水,加热溶解,稀释至1000ml,过滤、滤液超滤,分装、冷冻干燥,封装。上述冷冻干燥分为四个阶段:(1)预冻3小时,温度在-35℃;(2)减压干燥14小时,温度在-30℃;(3)升温干燥4小时,温度在-18℃(4)二次升温干燥4小时,温度在25℃。实施例5:蝎肽冻干粉针剂的制备5.0mg蝎肽加入5.0g精氨酸,加5.0g海藻糖-葡萄糖(4∶1)海藻糖溶解,加入注射用水,加热溶解,稀释至1000ml,过滤、滤液超滤,分装、冷冻干燥,封装。上述冷冻干燥分为四个阶段:(1)预冻3小时,温度在-30℃;(2)减压干燥14小时,温度在-32℃;(3)升温干燥4小时,温度在-15℃(4)二次升温干燥4小时,温度在20℃。实施例6:蝎肽冻干粉针剂的制备5.0mg蝎肽加入5.0g精氨酸,5.0g赖氨酸,加5.0g海藻糖-葡萄糖(4∶1)海藻糖溶解,加入注射用水,加热溶解,稀释至1000ml,过滤、滤液超滤,分装、冷冻干燥,封装。上述冷冻干燥分为四个阶段:(1)预冻3小时,温度在-30℃;(2)减压干燥14小时,温度在-32℃;(3)升温干燥4小时,温度在-15℃(4)二次升温干燥4小时,温度在20℃。实施例7:蝎肽冻干粉针剂的制备5.0mg蝎肽加入5.0g精氨酸,5.0g赖氨酸,加5.0g海藻糖-葡萄糖(4∶1)海藻糖溶解,加入注射用水,加热溶解,稀释至1000ml,过滤、滤液超滤,分装、冷冻干燥,封装。上述冷冻干燥分为四个阶段:(1)预冻3小时,温度在-30℃;(2)减压干燥14小时,温度在-32℃;(3)升温干燥4小时,温度在-15℃(4)二次升温干燥4小时,温度在20℃。实施例8:蝎肽注射液的制备5.0mg蝎肽加入5.0g精氨酸,5.0g天门冬氨酸,加5.0g海藻糖-葡萄糖(4∶1)海藻糖溶解,加入注射用水,加热溶解,稀释至1000ml,过滤、滤液超滤,分装、检验、封装、检验。实施例9:蝎肽注射液的制备5.0mg蝎肽加入5.0g精氨酸,加5.0g海藻糖溶解,加入注射用水,加热溶解,稀释至1000ml,过滤、滤液超滤,分装、检验、封装、检验。实施例10:蝎肽注射液的制备5.0mg蝎肽加入5.0g谷氨酸,加5.0g海藻糖溶解,加入注射用水,加热溶解,稀释至1000ml,过滤、滤液超滤,分装、冷冻干燥,封装。实施例11:蝎肽注射液的制备5.0mg蝎肽加入5.0g精氨酸,加5.0g海藻糖-葡萄糖(4∶1)海藻糖溶解,加入注射用水,加热溶解,稀释至1000ml,过滤、滤液超滤,分装、冷冻干燥,封装。实施例12:蝎肽注射液的制备5.0mg蝎肽加入5.0g精氨酸,5.0g赖氨酸,加5.0g海藻糖-葡萄糖(4∶1)海藻糖溶解,加入注射用水,加热溶解,稀释至1000ml,过滤、滤液超滤,分装、冷冻干燥,封装。实施例13:稳定性试验取制剂实施例1-12所制备的蝎肽制剂,根据《中国药典》2010年版二部附录xixc药物稳定性试验指导原则,进行了影响因素试验、加速试验和长期试验。考察项目包括:性状、鉴别、含量。(一)影响因素试验1、光照试验仪器:st-80c照度计,日光灯条件:4500±500lx将实施例3-12的样品,置日光灯下,分别于5天、10天取样测定各项有关指标。2、高温试验仪器:axgz-10型医用干燥箱取实施例3-12的样品,置60℃条件下,分别于5天、10天取样测定各项有关指标。本品在强光照射条件下,试验后含量降低。高温10天时,含量也有降低明显。本品的贮藏条件应低温、遮光、密闭保存。(二)低温长期放置试验样品:取实施例3-12的样品,样品包装:上市包装。试验仪器:恒温恒湿箱试验条件:温度2~6℃取实施例3-12的样品,放入恒温恒湿箱内,分别于3、6、9、12、18、24、36个月取样测定各项有关指标,测定。结果表明,本品在市售包装条件下,低温试验前后各项指标与0天比较无明显变化。(三)常温长期放置试验样品:取实施例3-12的样品,样品包装:上市包装。试验仪器:恒温恒湿箱条件:温度30±2℃、相对湿度60±10%取上市包装样品,置于留样室中,分别于3、6、9、12、18、24、36个月取样测定。结果表明,本品常温长期试验36个月,三批样品的各项指标与0天各项指标比较,均无明显变化。可见,本发明产品蝎肽制剂的稳定性良好。实施例14:毒理实验规格:6ml,实施例8的冷冻液态溶液,浓度:1.2mg/ml(以蝎肽计)药液配制方法静脉给药用0.9%氯化钠注射液溶解稀释至试验用浓度.肌肉注射给药用0.9%氯化钠注射液溶解稀释至试验用浓度。四、方法与结果1.静脉给药预试验取上述健康小鼠,试验前禁食16小时,体重相差不超过3g,按体重随机分为4组,每组4只动物,按下表剂量静脉注射给药,观察七天,记录小鼠的死亡情况。给药途径给药剂量(mg/kg)动物数(n)死亡动物数(n)静脉144静脉0.544静脉0.2543静脉0.12541参考预试结果,取上述小鼠,试验前禁食16小时,按体重随机分为5组,每组10只,按不同剂量组的剂量分别静脉给药,不同浓度等容积给药,给药剂距1:0.75,给药体积为0.2mi/10g小鼠体重,给药速度4~5秒/鼠。给药后连续观察14天,记录,动物的反应及死亡情况,静脉给药ld50为0.1789mg/kg,,肌肉注射给药iiu为0.3071mg/kg。静脉给药后,小鼠兴奋、行动姿势改变,呼吸困难,瞳孔缩小,角膜浑浊,较高剂量组小便失禁,强直性痉挛,抽搐,死亡。0.338mg/kg,0.246mg/kg剂量组死亡多在1分钟内,0.178mgag、0.129mg/kg死亡多在5分钟左右。死亡小鼠尸检,肉眼所见未见异常。2.肌肉注射给药1).预试验取上述徤康小鼠,试验前禁食16小时,体重相差不超过3g,按体重随机分为4组,每组4只动物,按下表剂量肌肉注射给药,观察七天,记录小鼠的死亡情况。给药途径给药剂量(mg/kg)动物数(n)死亡动物数(n)肌肉144肌肉0.543肌肉0.2541肌肉0.12540ld50测定参考预试结果,取上述小鼠,禁食16小时,按体重随机分为6组,每组10只,按不同剂量组的剂量分别肌肉注射给药,不同浓度等容积给药,给药剂距1:0.7(复试1:0.65),给药体积为0.lml/10g小鼠体重。给药后连续观察14天,记录动物的反应及死亡情况,计算ld50。给药剂距1:0.7复试肌肉注射后,小鼠行为姿态改变、呼吸困难,死亡,最快当年死亡,死亡时间1-2天,死亡小鼠尸检未见异常肌肉注射给药ld50为0.3098mg/kg。实施例15:一般药理学实验(一)、对中枢神经系统的影响1、对小鼠自发活动的影响取上述健康小鼠48只,按体重随机分为4组,分别肌肉给予蝎肽8μg/kg、4μg/kg、2μg/kg,给药体积0.2ml/10g,对照组给同体积氯化钠注射液,给药顺序按拉丁方设计,给药10分钟后,将小鼠放入zil-2程控自主活动箱中,每箱放1只动物,先适应5分钟,记录10分钟内小鼠活动数,进行t检验,结果如下。组别给药剂量(μg/kg)动物数(n)小鼠活动数(次/10分钟)对照01272.7±12.36蝎肽81286.8±24.32蝎肽41282.71±16.85蝎肽21276.9±23.89结果表明:蝎肽8μg/kg、4μg/kg、2μg/kg三剂量对小鼠自主活动均无明显影响。2、对戊巴比妥钠小鼠睡眠的影响取上述健康小鼠60只,按体重随机分为4组,分别肌肉给予蝎肽8μg/kg、4μg/kg,2μg/kg各剂量组,给药体积0.2ml/10g,对照组给同体积氯化钠注射液,给药后10分钟腹腔注射戊巴比妥钠(50mg/kg),以翻正反射消失为入睡时间,从翻正反射消失至恢复时间为睡眠持续时间。记录小鼠入睡时间、睡眠持续时间,分别进行t检验,结果如下。结果表明,蝎肽对给以戊巴比妥钠所致的小鼠的入睡时间、睡眠时间,与对照组相比无显著差别。3、小鼠转杆实验自制转杆装置(该装置由一个木制杆组成,外包橡胶皮套,该杆转轴同一马达相连,调节马达的转速为5-7周/min。该杆长28cm,外包纸挡板分成2段,可同时测试2只小鼠)。试验前一天,筛选能够停留在转杆上至少30sec的小鼠。取上述健康小鼠48只,按体重随机分为4组,分别静脉给予蝎肽8μg/kg、4μg/kg,2μg/kg各剂量组,给药体积0.2ml/10g,对照组给同体积氯化钠注射液,给药后15分钟,将小鼠放于转杆上,记录小鼠在转杆上停留的时间,超过60秒以60秒计。结果表明,蝎肽对小鼠在转杆上停留的时间与对照组相比无显著差别。组别给药剂量(μg/kg)动物数(n)停留时间(min)对照01210.9±3.8蝎肽81214.7±3.5蝎肽41212.3±3.7蝎肽21210.2±2.6(二)、对心血管系统的影响取健康猫5只,以苯巴比妥钠腹腔注射麻醉,剂量为175mg/kg,背位固定,分离一侧颈动脉,动脉插管,连接于pt14硅压力传感器,用ms2000多媒体化生物信号记录分析系统同步记录ii导联心电图、收缩压、舒张压。经股外侧肌肉分别给予1.6μg/kg、0.8μg/kg、0.4μg/kg不同剂量的药物,对照组给同体积氯化钠注射液,给药体积0.2ml/kg,每只猫给四次药(每个剂量各一次),给药次序按拉丁方设计,记录给药前及给药后15分钟、30分钟、60分钟、90分钟的心电、血压曲线,并对心率、qrs波时间、t波电压和血压进行t检验。结果表明:蝎肽1.60μg/kg、0.80μg/kg,0.40μg/kg各剂量组肌肉给药,给药后15分钟、30分钟、60分钟、90分钟与给药前比较,猫的心电图、qrs间期、t波电位均无显著改变,st段无明显位移,无心律失常发生;给药后猫的心率、血压均无异常改变。(三)、对呼吸系统的影响方法同试验(二),用jh-2肌张力换能器连接于ms2000多媒体化生物信号记录分析系统,记录给药前后呼吸曲线,并对呼吸频率及深度进行t检验。结果表明:蝎肽1.60μg/kg、0.80μg/kg、0.40μg/kg各剂量肌肉给药,对猫的呼吸频率及深度影响与给药前比较差别无显著意义。五、结论蝎肽一般药理试验结果表明,分别以8μg/kg、4μg/kg、2μg/kg肌肉给药对小鼠中枢神经系统、对戊巴比妥钠小鼠睡眠时间无明显影响;以8μg/kg、4μg/kg,2ug/kg尾静脉注射对小鼠在转杆上的停留时间无明显影响。1.6μg/kg、0.8μg/kg、0.4μg/kg肌肉给药,对猫的心血管系统、呼吸系统均无显著影响。实施例16:药效学试验报告动物昆明种小鼠,二级,起始体重15-17g,sd大鼠,二级,起始体重150-170g,♂♀各半。恒河猴,一级,♂性,体重2-4kg。药品及试剂受试药物:蝎肽产品,本发明实施例3的产品。阳性对照药:可乐定,北京第三制药厂生产。盐酸吗啡(mor):青海制药厂有限公司生产。盐酸纳洛酮,sigma产品。0.9%氯化钠注射液(ns)。药物的配制盐酸吗啡用生理盐水配制;蝎肽用生理盐水稀释或配制成所需浓度,每次现用现配。剂量设置主要根据该药推荐的临床剂量、急性毒性试验结果、预试验结果确定。蝎肽推荐的临床日剂量为20μg/日,按体表面积折算到小鼠的等效剂量为2.6μg/kg,大鼠的为1.8μg/kg,猴的为0.8μg/kg。给药途径及体积吗啡依赖性小鼠催促戒断治疗试验建立小鼠吗啡身体依赖性模型,mor采用s.c途径给药,给药体积为0.1ml/10g。蝎肽采用s.c途径给药,给药体积0.1ml/10g。吗啡依赖性大鼠催促戒断治疗试验建立大鼠吗啡身体依赖性模型,mor采用s.c途径给药,给药体积为0.1ml/100g。蝎肽采用s.c途径给药,给药体积0.1ml/100g。吗啡依赖性大鼠自然戒断治疗试验建立大鼠吗啡身体依赖性模型,mor采用s.c途径给药,给药体积为0.1ml/100g。蝎肽采用s.c途径给药,给药体积0.1ml/100g。吗啡依赖性猴自然戒断治疗试验建立猴吗啡身体依赖性模型采用i.m途径给药,给药体积0.4ml/kg。治疗给药采用i.m途径给药,模拟临床给药途径,给药体积0.2ml/kg。试验方法吗啡依赖性小鼠催促戒断试验小鼠按体重、性别随机分组,每组10只,♂♀各半。1组为ns组,其余各组为mor组。各组每天s.c给吗啡3次(8:00,14:00,20:00),连续给药8天,第8天早为吗啡末次给药。给药方案如下:吗啡依赖性小鼠催促戒断治疗试验mor剂量设置吗啡依赖性大鼠催促戒断治疗试验sd大鼠70只,♂♀各半,按体重和性别随机分为7组,每组10只。其中一组为ns组,另外6组为mor组。采用剂量递增法建立mor依赖性模型,mor按剂量给药。ns组每天s.c等体积的ns,各mor组s.cmor,每日s.c给吗啡3次(8:00,14:00,20:00),连续给mor15天,第15天8:00为mor末次给药。第15天末次s.cmor后8h后,用盐酸纳洛酮(4mg/kg,0.1ml/100g,i.p)催促戒断。催促戒断前30min进行治疗给药。ns组设为空白对照组,6个mor组分别设为mor模型组,可乐定组和蝎肽4个剂量组。对照组、mor模型组s.c等体积的生理盐水,可乐定组s.c0.1mg/kg可乐定,蝎肽各组分别s.c不同剂量的蝎肽。i.p纳洛酮后,立即观察60min内的戒断症状,并称量各组大鼠催促戒断前、催促戒断后30min和60min时的体重。以催促戒断前的体重为基值,计算催促戒断后各组大鼠体重的变化百分率。吗啡依赖性大鼠催促戒断治疗试验mor剂量设置吗啡依赖性大鼠自然戒断治疗试验sd大鼠60只,♂♀各半,按体重和性别随机分为6组,每组10只,其中一组为ns组,其余5组为mor组。mor采用剂量递增法,按剂量给药。ns组s.c等体积的ns,各mor组每天s.c3次mor(8:00,14:00和20:00),连续给药30天,第31天停止s.cmor。从第31天开始,每天进行治疗给药。ns组设为对照组,5个mor组分别设为mor模型组,可乐定组和蝎肽3个剂量组。对照组和mor模型组s.c等体积的ns,可乐定组s.c0.1mg/kg的可乐定,蝎肽组s.c不同剂量的的蝎肽。每天给药2次,给药时间8:00和20:00,连续s.c给药7天。从第30天开始至停mor后的第7天,每天称体重3次(8:00,14:00和20:00),连续称重8天。以停mor前1天的体重为基值,计算出停mor后每天大鼠体重变化百分率。吗啡依赖性大鼠自然戒断治疗试验mor剂量设置吗啡依赖性猴自然戒断治疗试验恒河猴36只,按体重随机分为7组,每组5只。7组分别为1个ns对照组和6个mor模型组,余下的一只放在mor组备用。盐酸mor采用剂量递增法,按剂量给药。ns组i.m等体积的ns,6个mor模型组每天i.m3次mor(8:00,14:00,20:00),连续给药90天,第91天停止i.mmor。吗啡依赖性猴自然戒断治疗试验mor剂量设置从第91天开始进行治疗给药。ns组设为对照组(i.m等体积ns),6个mor模型组按体重重新分组,使其各组体重基本一致。6组分别设为可乐定组(i.m0.02mg/kg)、mor模型组(i.m等体积ns)和蝎肽4个剂量组(i.m0.5、1.0、2.0和4.0μg/kg)。停吗啡后第1-2天每天给治疗药2次(8:00,16:00),第3天开始给治疗药1次(8:00),连续治疗给药7天。从第90天开始,每天称体重、测体温2次(8:00,16:00),每天观察戒断症状,连续8天。分别以停mor前1天的体重、体温为基值,计算出停药后每天猴体重、体温变化百分率。计算各组戒断症状分值。大鼠催促戒断症状观察表及评分标准组别:试验日期:年月日观察人:猴自然戒断症状观察表及评分标准评分标准(级差分+症状分):轻度:级差分5分,每个症状3分,同一个症状一天内重复出现时减1分;中度:级差分10分,每个症状4分,同一个症状一天内重复出现时减1分;重度:级差分17分,每个症状5分,同一个症状一天内重复出现时减1分;极重度:级差分32分,衰竭状态20分,死亡30分。厌食、食欲按当天最重记录一次数据处理数据以均数±标准差表示,各组数据之间的比较采用成组t检验。结果吗啡依赖性小鼠催促戒断治疗试验mor模型组小鼠在催促戒断后,跳跃次数和体重下降百分率明显高于对照组(p<0.01),表明小鼠对吗啡形成了明显的身体依赖性。蝎肽各剂量对吗啡依赖性小鼠催促戒断后的跳跃次数无明显的抑制作用。但蝎肽15.6、18.2和20.0μg/kg剂量对吗啡依赖性小鼠催促戒断后的体重下降产生明显的抑制作用。这表明蝎肽对mor依赖性小鼠的催促戒断反应具有明显的脱毒治疗作用。吗啡依赖性大鼠催促戒断治疗试验mor模型组大鼠在催促戒断后,戒断症状分值和体重下降百分率明显高于对照组(p<0.01),表明大鼠对吗啡形成了明显的身体依赖性。蝎肽0.02、0.2、1.0和2.0μg/kg剂量对戒断症状均产生明显的抑制作用(,p<0.01),但对体重下降没有产生明显的控制作用。吗啡依赖性大鼠自然戒断治疗试验mor模型组体重明显下降,表明大鼠对mor形成了明显的身体依赖性。蝎肽3个剂量中的0.8μg/kg剂量对吗啡依赖性大鼠戒断后的体重下降表现出一定的抑制作用,特别是在治疗给药的第6天,明显抑制大鼠的体重下降。这表明在该模型中,蝎肽表现出一定的脱毒治疗作用。吗啡依赖性猴自然戒断治疗试验在建立吗啡身体依赖性猴模型的过程中,有一只吗啡组的猴死亡。mor模型组猴产生明显的戒断症状、体重和体温明显下降,表明猴对mor形成了明显的身体依赖性。蝎肽4个剂量组对吗啡依赖性猴戒断后产生的戒断症状、体重和体温下降均表现出程度不同的抑制作用,其中1.0和2.0μg/kg剂量的效果最好。这表明蝎肽在该模型中,对吗啡样的戒断反应具有明显的脱毒治疗作用。蝎肽能显著降低吗啡依赖性动物催促戒断及自然戒断后所产生的戒断反应,具有明显的脱毒治疗作用。实施例17:本发明产品蝎肽制剂的镇痛作用1、小鼠热板(55℃)镇痛试验热板测痛仪(gj-8402型热板测痛仪)上进行热板法镇痛试验昆明种小白鼠,体重18-22g,雌雄兼用,随机分成11组,每组10只,试验前于50±0.5℃热板上筛选在5-30s内有舔后足反应的小鼠,间隔5min再次测定并记录,取平均值作为给药前阈值。分别于后腿两侧肌肉注射给予各剂量:受试药物:制剂实施例3的蝎肽冻干粉针剂(ssl3)。0.9%氯化钠注射液各剂量阳性对照药:盐酸吗啡(ptd),观察给药后30min、60min、120min小鼠于热板上,热板温度55℃,疼痛反应指标为舔后足,截止时间(cut-offtime)为60s,超过60s以60s记录。统计计算,测定疼痛反应的潜伏期。(mg/kg)阈值30min60min120min空白23.0±4.726.7±6.823.5±4.425.8±7.5组ssl30.00125.3±4.530.5±8.230.3±12.528.3±7.4ssl30.00224.8±5.135.3±8.3*38.2±13.4**38.2±14.3*ssl30.00426.5±5.234.8±4.2**39.2±8.5**38.7±8.8**ssl30.00826.0±4.237.2±9.4**45.6±10.7**36.9±9.5**ssl30.01625.2±5.340.8±11.3**48.2±13.5**48.1±11.7**ptd4.624.5±3.238.8±8.2"37.9±8.2**34.4±71**ptd9.224.1±5.839.4±11.832.7±10.4*34.5±12.6ptd18.326.7±4.944.8±14.4**36.3±12.5**36.2±14.1*ptd36.725.6±5.052.2±12.4**40.5±12.6**40.1±12.2**ptd73.425.2±5.656.4±11.4**47.7±12.2**42.1±15.1**结果显示,在小鼠热板(55℃)镇痛试验中,小鼠皮下注射实施例3的蝎肽产品可以产生明显的镇痛作用。研究资料表明,热板(55℃)疼痛的刺激作用较强。因此,上述推断的临床有效剂量适用于中重度疼痛病人。2、小鼠醋酸扭体镇痛试验昆明种小鼠,符合国家spf级实验动物标准。体重18~22g。笼养,每笼6~12只,室温20~24℃,自然光照,食水不限。将小鼠随机分组,每组16只,♂♀各半。阳性对照药物:盐酸吗啡(morphinehydrochloride)受试药物:实施例3的蝎肽冻干粉针剂。试验以0.6%醋酸为致痛剂。皮下注射给予不同剂量的:制剂实施例3的蝎肽冻干粉针剂(ssl3)盐酸吗啡(阳性对照药物),以溶剂为阴性对照。30min后,每只腹腔注射0.6%的醋酸0.2ml,立即记录15min内小鼠扭体次数。以小鼠出现腰部肌肉反复收缩、拱背、臀部扭转和后肢伸展为扭体反应阳性。将给药组和溶剂组小鼠扭体数进行比较,并式计算镇痛效率。计算公式:镇痛效率(%)=(对照组的扭体次数-实验组的扭体次数)/对照组的扭体次数×100%。实验结果用均数±标准误表示,采用spss统计软件进行方差分析(anova),组间比较选用lsd法,并用bliss法计算ed50。组别剂量(mg/kg)体重(g)扭体次数空白19.7±1.822.7±6.7ssl30.00119.6±1.916.8±9.5ssl30.00218.7±2.013.4±6.7*ssl30.00419.1±2.08.3±4.1**ssl30.00818.3±1_76.4±5.1**ssl30.01618.1±3.03.6±4.3**ptd4.619.2±1.99.6±5.4**ptd9.219.4±1.55.3±3.4**ptd18.319.9±1.43.6±1.7**ptd36.719.6±1.32.5±1.9**ptd73.419.1±2.32.4±1.6**本发明产品蝎肽制剂对小鼠化学性伤害刺激(0.6%醋酸)的镇痛作用注:均数±标准误.*p<0.05,**p<0.01,***p<0.001,与溶剂对照组比较结果显示,在小鼠醋酸(0.6%)扭体的镇痛试验中,给小鼠皮下注射实施例3的蝎肽冻干粉针剂可以明显抑制腹腔注射0.6%醋酸所致小鼠扭体的疼痛反应,呈剂量依赖性。因此,上述推断的临床有效剂量适用于中轻度疼痛病人。实施例18:本发明产品蝎肽体外抗肿瘤细胞生物活性—mtt法将对数生长期的细胞消化、离心,制成细胞悬液,吹匀并将密度调至6×105个/ml,以100μl/孔加入96孔微量培养板中,其间不断吹匀细胞,保证每孔的细胞数大致相等。于37℃,co2浓度为5%的细胞培养箱中孵育24小时,在倒置显微镜下观察细胞生长情况。生长情况良好,即可加入不同稀释浓度的实施例1的蝎肽样品、蝎毒。样品以rpmi1640培养基溶解,二倍体积稀释法稀释为五个浓度梯度,每个浓度设置三个复孔。阴性对照孔加入相同体积的培养液。另设仅加含相应的培养液(无细胞)为空白调零孔。于37℃,co2浓度为5%的细胞培养箱中继续培养48小时后弃去培养液,每孔加入100μlmtt(稀释至终浓度为0.5mg/ml),培养4小时后,吸弃上清,每孔加入150μl二甲基亚砜,室温置摇床上低速振荡10分钟,充分溶解后在酶标仪上测定490nm处各孔的吸光度值.根据每个样品的吸光度值计算每组样品对细胞的生长抑制率,利用spss13.0统计软件计算样品的半数抑制浓度ic50值(即在用药后存活的细胞数量减少一半时所需的药物浓度)。实验结果表明:与蝎毒组比较,实施例1的蝎肽样品的体外抗肿瘤细胞生物活性则有显著提高36.8%。序列表<110>赵恩成<120>1<160>1<170>siposequencelisting1.0<210>1<211>61<212>prt<213>人工合成序列(syntheticsequence)<400>1aspglytyrileargglyserasnglycyslysvalsercysleutrp151015glyasngluglycysasnlysglucysargalatyrglyalasertyr202530glytyrcystrpthrtrpglyleualacystrpcysglnglyleupro354045aspasplysthrtrplyssergluserasnthrcysgly505560当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1