一种血小板膜包裹载药多孔纳米颗粒及其制备方法与流程
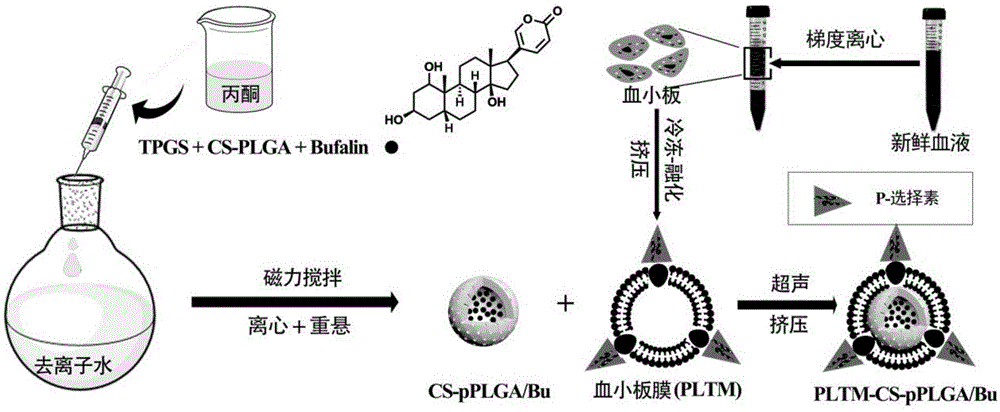
本发明属于载药纳米颗粒及其制备方法领域,特别涉及一种血小板膜包裹载药多孔纳米颗粒及其制备方法。
背景技术:
聚乳酸-羟基乙酸共聚物(plga)由于其良好的生物相容性和生物降解性已被广泛应用于癌症化疗药物的递送。但是由于其降解时间过慢,疏水性过高和形成的纳米颗粒结构过于致密,因此plga运载的化疗药物被注射体内后,释放的药物往往不能达到有效杀死癌细胞的剂量。为了解决此问题,使用tpgs作为致孔剂制备了多孔的plga基纳米颗粒,提高了药物释放速率(zhuh,chenh,zengx,etal.co-deliveryofchemotherapeuticdrugswithvitaminetpgsbyporousplgananoparticlesforenhancedchemotherapyagainstmulti-drugresistance[j].biomaterials,2014,35(7):2391-2400.)。此外,plga纳米颗粒虽然生物相容性良好,可以通过增强渗透于滞留效应(epr效应)被动靶向聚集到肿瘤部分,但是不利于被癌细胞摄取,同时,plga不能完成替代机体存在的复杂的界面物质,因此无法避免地被机体认为是外来入侵者进而引起严重的免疫效应。
血小板作为血液中的哨兵,具有凝血、止血,修复破损血管的作用。cd47是血小板的膜蛋白,参与了包括凋亡、增殖、粘附和迁移等细胞进程。此外,cd47在调节免疫反应方面具有重要作用,可以免于巨噬细胞的吞噬。更重要的是,血小板膜上的p-选择素高表达,可以与癌细胞膜上的cd44受体特异性结合,提高了癌细胞对其的摄取。因此,通过血小板膜对有机聚合物纳米颗粒进行仿生包衣,有利于提高其生物相容性,降低免疫原性,同时实现对肿瘤主动的主动靶向作用(huq,sunw,qianc,etal.anticancerplatelet-mimickingnanovehicles[j].advancedmaterials,2016,27(44):7043-7050)。
技术实现要素:
本发明所要解决的技术问题是提供一种血小板膜包裹载药多孔纳米颗粒及其制备方法,以克服现有技术中基于plga纳米颗粒释药率低以及被动靶向和引起的免疫效应的缺陷。
本发明所使用的材料都具有优异的生物相容性、低免疫原性,不仅解决了基于plga纳米颗粒降解过慢导致释药率低的问题,而且,由于血小板膜的伪装,避免了颗粒被网状内皮系统捕获,同时实现了对化疗药物主动靶向输送至肿瘤部位的效果,对靶向治疗癌症展现出了广阔的前景。
本发明首先将水溶性壳寡糖(cs)通过edc键合的方法接到plga上,通过纳米沉淀的方法制备了载有化疗药物蟾毒灵(bufalin)多孔cs-pplga纳米颗粒。随后经过超声、挤压处理将血小板膜包裹在纳米颗粒表面,不仅作为封口剂防止颗粒内在循环过程中药物突释,而且作仿生包衣和主动靶向剂,避免网状内皮系统的捕获,进而主动进攻肿瘤细胞。
本发明的一种载药多孔纳米颗粒,通过水溶性壳寡糖cs修饰plga后载蟾毒灵bufalin,然后被血小板膜包裹得到。
本发明的一种血小板膜包裹载药多孔纳米颗粒的制备方法,包括:
(1)将plga加到含有edc·hcl和nhs的溶液中活化,加入水溶性壳寡糖cs,氮气气氛下反应,透析,冷冻干燥,得到壳寡糖修饰的plga(cs-plga),其中,plga、edc·hcl和nhs的摩尔比为1:2-4:2-4,cs与plga的摩尔比为1:1-2:1;
(2)将步骤(1)中cs-plga和蟾毒灵bufalin以质量比为5:1-15:1溶解于溶剂中,搅拌下加入到tpgs水溶液中,在空气中搅拌反应,烘干溶剂,离心后倒掉上清液,然后用同体积的去离子水重悬,得到载有bufalin的多孔纳米颗粒cs-pplga/bunps,4℃下保存;其中cs-plga与tpgs的质量比为1:1-10:1;
(3)通过大鼠(例如sd雌性大鼠)心脏取血,获得新鲜血液,通过梯度离心的方法提取血小板,提取的血小板经过冷冻-融化循环得到中空的血小板,再经超声,得到血小板膜碎片,于含有蛋白酶抑制剂的pbs缓冲液中保存;
(4)将步骤(2)中cs-pplga/bunps与步骤(3)中血小板膜碎片混合,超声、挤压,得到血小板膜包裹载药多孔纳米颗粒pltm-cs-pplga/bunps,其中cs-pplga/bunps与步骤(3)中血液的比例为3-5mg:4-6ml。
所述步骤(1)中含有edc·hcl和nhs的溶液的溶剂为二甲基甲酰胺。
所述步骤(1)中活化温度为-5-5℃,活化时间为0.3-1h。
所述步骤(1)中加入水溶性壳寡糖cs是在升温至室温下进行的。
所述步骤(1)中反应时间为45-50h。
所述步骤(2)中溶剂为丙酮;溶剂与tpgs水溶液的体积比为1:6-1:4。
所述步骤(2)中搅拌反应温度为室温,搅拌反应时间为2-4h。
所述步骤(2)中搅拌速度为600-1000rpm。
所述步骤(2)中离心速度为7000-9000rpm,离心重复3次。
所述步骤(3)中梯度离心的方法具体为:将抗凝血加到含有分离液的离心管中250-300g下离心10-20min,吸取第一层血小板血浆加到另一个离心管中,加入pbs洗涤三次,得到血小板,其中抗凝血与分离液的体积比为1:2。
所述步骤(3)中含有蛋白酶抑制剂的pbs缓冲液中蛋白酶抑制剂的浓度为2mm。
所述步骤(4)中超声的工艺参数为:功率为80-120w,频率为30-50khz,时间为4-6min。
所述步骤(4)中挤压是用孔径为200nm的滤膜。
本发明制备的多孔cs-plga纳米颗粒,不仅解决了由于plga基材料降解慢、高疏水性导致的释药率过慢问题,而且由于表面壳寡糖氨基的存在,在弱酸性条件下发生质子化使得cs-plga纳米颗粒表面带正电,这样有利于带负电的血小板膜在其表面发生吸附,提高了稳定性。纳米颗粒在血小板膜的伪装下,可以免于网状内皮系统的捕获,获得了低免疫原性,提高了生物相容性。更重要的是,由于血小板膜蛋白p-选择素的高表达,可以靶向粘附癌细胞表面的cd44受体,实现了纳米颗粒主动靶向进攻癌细胞的效果。
有益效果
(1)本发明使用的plga、壳寡糖和tpgs都是生物相容性非常好的生物材料,不会对机体产生毒性。另外,血小板膜取于动物体,然后重新用于宿主动物,不会对机体产生免疫原性。
(2)本发明使用水溶性壳寡糖对plga进行修饰,使得cs-plga纳米颗粒在弱酸性条件下表面带正电荷,在超声和挤压的辅助下吸附带负电的血小板膜,提高了整体的稳定性。
(3)本发明使用血小板膜对纳米颗粒进行仿生包衣,表面蛋白cd47的存在,降低了网状内皮系统对其的捕获,提高了药物颗粒在体内的循环时间,有利于通过epr效应聚集到肿瘤部位。又由于表面p-选择素的存在,使得颗粒主动靶向进攻肿瘤组织,便于提高化疗治疗肿瘤的效果。
(4)本发明中多孔cs-plga纳米颗粒解决了由于plga基材料降解慢、高疏水性导致的释药率过慢的问题。
附图说明
图1为本发明血小板膜仿生包衣载药多孔纳米颗粒cs-pplganps的制备过程图。
图2为实施例1中合成的cs-plga和cs、plga分散在不同ph水溶液下zeta电位的变化情况。
图3为实施例2中制备的多孔纳米颗粒cs-pplganps和血小板膜包裹的cs-pplga纳米颗粒的tem图。
图4为实施例2中制备的多孔cs-pplga纳米颗粒和血小板膜包裹的cs-pplga纳米颗粒的fesem图。
图5为实施例2中制备的多孔cs-pplga纳米颗粒、血小板膜和血小板膜包裹的cs-pplga纳米颗粒在去离子水中的zeta电位图。
图6为实施例3中载药cs-plga/bu纳米颗粒、载药多孔cs-pplga/bu纳米颗粒和载药pltm仿生包裹的多孔pltm-cs-pplga/bu纳米颗粒在ph=7.4的pbs缓冲液中的释药曲线。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
材料和试剂:
plga(乳酸:已交酯=50:50,分子量:~21,000)购买于山东岱罡生物科技有限公司,壳寡糖(分子量~1200)购买于澳兴生物科技有限公司,edc·hcl、1.7mgnhs、tpgs购买于上海阿拉丁生化科技有限公司。蟾毒灵购买于宝鸡辰光生物科技有限公司,细胞膜提取试剂盒购买于天津灏洋生物科技有限公司。其他试剂(分析纯)购买于国药集团。
实施例1
(1)将105mgplga加入到含2.9mgedc·hcl和1.7mgnhs的10ml二甲基甲酰胺溶液中,在冰浴下活化0.5h。当温度升至室温时,加入9mg壳寡糖,氮气保护下反应48h。然后用截留分子量为7000的透析袋在ph=7.4的pbs缓冲液中透析3天,冷冻干燥得到cs-plga。
(2)将步骤(1)得到的cs-plga以及壳寡糖、plga分散于ph=5.0、7.4、8.6的水溶液中制备0.5mg/ml的分散液,分别测其zeta电位,如图2所示,ph由酸性变为碱性时,cs-plga的电位相应地从正值变为负值,而壳寡糖和plga的电性没有随之发生改变。结果表明,壳寡糖成功键合到了plga上,实现了响应ph的电位变化。有利于后续依静电力的作用吸附血小板膜,提高其稳定性。
实施例2
(1)将10mgcs-plga和1mgbufalin溶于1ml丙酮中,800rpm转速下逐滴加入到5mltpgs为20%(w/v)的去离子水中,空气中搅拌3h后,放入真空干燥箱中,除去残留的丙酮。然后用去离子水洗涤三次,除去tpgs,最后用同体积的去离子水重悬,获得多孔结构的载药纳米颗粒。为了设立对照,制备了未含有孔结构的载药cs-plga/bu纳米颗粒,方法跟上述方法相似,除了将混合丙酮溶液加到不含有tpgs的去离子水中。
(2)通过心脏取血,获得sd雌性大鼠新鲜血液,将抗凝血加到含有分离液的离心管中(抗凝血与分离液的体积比为1:2)300g下离心15min。吸取第一层血小板血浆加到另一个离心管中,加入pbs洗涤三次,得到血小板。提取的血小板经过-80℃冷冻,然后室温融化,此循环进行三次,得到中空的血小板,再经超声得到血小板膜碎片于含有蛋白酶抑制剂的pbs缓冲液(蛋白酶抑制剂的浓度为2mm)中保存。
(3)将上述5ml血液提取的血小板膜与4mg载药cs-pplga/bu纳米颗粒混合,100w,40khz下超声5min,然后用滤膜为200nm的挤压器挤压11次,制备血小板膜包裹的pltm-cs-pplga/bu纳米颗粒。
cs-pplga/bu纳米颗粒和pltm-cs-pplga/bu纳米颗粒的tem图如图3所示,cs-pplga/bu纳米颗粒显示出了核壳结构,归因于颗粒壳层水溶性壳寡糖的存在。右图是pltm-cs-pplganps的tem图,可以清晰地看到细胞膜结构覆盖在纳米颗粒表面,说明了血小板膜成功包裹在cs-pplga纳米颗粒的表面。图4是这两种颗粒的fesem图,从左图可以看出cs-pplga/bu纳米颗粒表面孔径的存在。右图显示,血小板膜成功包裹了cs-pplga/bu纳米颗粒。
实施例3
(1)各取2ml实施例2中cs-plga/bunps分散液、cs-pplga/bunps分散液和pltm-cs-pplganps分散液,分别装入到截留分子量为7000的透析袋中,随后分别浸入18mlph=7.4的pbs缓冲液中。
(2)将上述释药体系转移到37℃转速为100rpm的恒温摇床中48h,分别在0.25h、0.5h、1h、2h、4h、8h、12h、24h、48h取1ml在298nm下测其紫外吸光度,然后重新补给1ml相同条件的pbs缓冲液,收集数据并计算药物释放情况。
三种颗粒中的bufalin释放曲线如图6所示。在48h后,未有孔结构的cs-plga/bunps药物的累积释药量不到20%。然而有孔结构的cs-pplga/bunps药物的累积释药量高达90%,解决了plga基纳米颗粒由于其降解速度慢,疏水性较高导致的释药率过低问题。血小板膜包裹后,实现了药物的缓释,防止药物在体内循环过程中的提前释放。
- 还没有人留言评论。精彩留言会获得点赞!