姜黄素维生素E琥珀酸酯前药、纳米乳及其制备方法和用途与流程
本发明涉及姜黄素维生素e琥珀酸酯前药、纳米乳及其制备方法和用途,属于医药
技术领域:
。
背景技术:
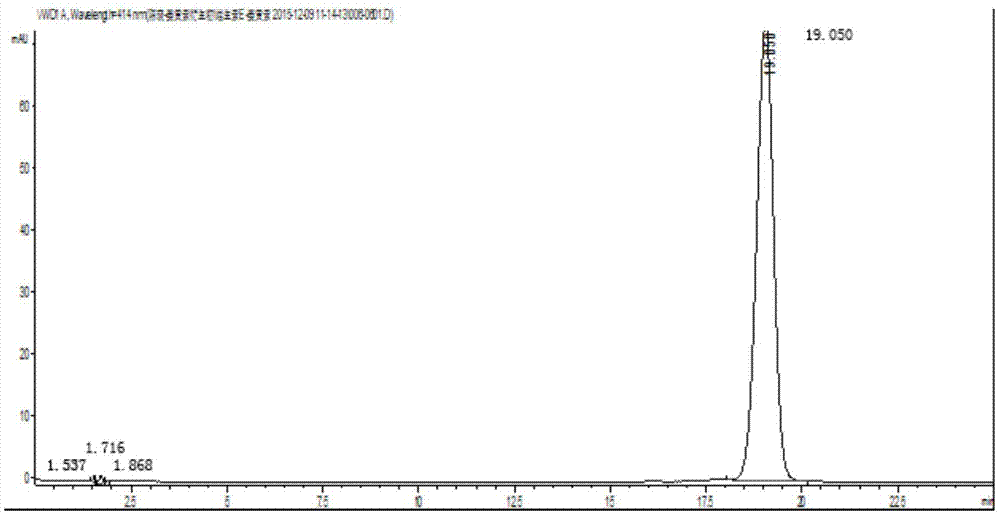
:姜黄素溶解性差,几乎不溶于水,在甲醇、氯仿等有机溶剂中溶解度也不高,游离药物易水解,生物利用度低,在生物体内高清除率成为限制其临床应用的主要因素和开发成临床应用的制剂的瓶颈。目前主要通过固体分散技术增溶、载体增溶、包合物技术、超临界法改善姜黄素生物利用度。通过结构修饰来改善姜黄素溶解度,可分为修饰苯环、修饰亚甲基以及修饰不饱和的羰基。在制剂学方面,则通过制备成固体分散体、脂质体、固体脂质纳米粒、纳米乳、微球与微囊等,实现靶向给药、缓释给药、提高难溶性药物溶解度与生物利用度、降低不良反应。尽管姜黄素的剂型研究也获得一定的成果,仍存在不少问题,如制剂稳定性差、药物释放不可控、体内易代谢等。如何通过药学手段,改善姜黄素的缺点,增加其溶解度及生物利用度,开发生物利用度高、高效、强效制剂,具有重要的理论和实践意义。技术实现要素:本发明的目的在于克服上述现有技术的不足之处而提供一种姜黄素维生素e琥珀酸酯前药、纳米乳及其制备方法和用途,本发明制备得到的姜黄素维生素e琥珀酸酯纳米乳与姜黄素纳米乳相比较,具有稳定性好、体外缓慢释放、包封率高等优点。为实现上述目的,本发明采取的技术方案为:一种姜黄素维生素e琥珀酸酯前药,所述姜黄素维生素e琥珀酸酯前药的结构式如下所示:第二方面,本发明提供了上述姜黄素维生素e琥珀酸酯前药的制备方法,所述制备方法为:维生素e琥珀酸酯和姜黄素发生反应,生成姜黄素维生素e琥珀酸酯前药,其合成路线如下所示:作为本发明所述姜黄素维生素e琥珀酸酯前药的制备方法的优选实施方式,包括如下步骤:(1)将维生素e琥珀酸酯和二环己基碳二亚胺加入二氯甲烷中溶解,氮气保护下搅拌反应;(2)然后加入姜黄素、4-二甲氨基吡啶的二氯甲烷溶液,氮气保护下继续反应,生成姜黄素维生素e琥珀酸酯前药。作为本发明所述姜黄素维生素e琥珀酸酯前药的制备方法的优选实施方式,所述维生素e琥珀酸酯与所述姜黄素的摩尔比为1:(1~1.5),所述二环己基碳二亚胺与所述姜黄素的摩尔比为(2~3):1;所述4-二甲氨基吡啶与所述姜黄素的摩尔比为(0.2~0.7):1。作为本发明所述姜黄素维生素e琥珀酸酯前药的制备方法的优选实施方式,所述步骤(1)中,搅拌反应的温度为15~25℃,时间为20~40min;所述步骤(2)中,反应温度为20~30℃,反应时间为7~9h。作为本发明所述姜黄素维生素e琥珀酸酯前药的制备方法的优选实施方式,在所述步骤(2)之后还包括姜黄素维生素e琥珀酸酯前药纯化的步骤(3):将反应液抽滤,滤液与柱层析硅胶混合制砂,硅胶柱色谱提纯,用石油醚和乙酸乙酯梯度洗脱,得到姜黄素维生素e琥珀酸酯前药。第三方面,本发明提供了一种姜黄素维生素e琥珀酸酯纳米乳,由上述姜黄素维生素e琥珀酸酯前药制备而得。第四方面,本发明提供了上述姜黄素维生素e琥珀酸酯纳米乳的制备方法,包括以下步骤:将姜黄素维生素e琥珀酸酯前药、dl-α生育酚、辛基酚聚氧乙烯醚-50分别溶于三氯甲烷中;按顺序先后取dl-α生育酚的三氯甲烷溶液、姜黄素维生素e琥珀酸酯前药的三氯甲烷溶液、辛基酚聚氧乙烯醚-50的三氯甲烷溶液于玻璃试管中,避光,n2吹干后,于真空干燥箱中干燥,取出后加入超纯水,在超声波细胞粉碎仪超声,制得姜黄素维生素e琥珀酸酯纳米乳。作为本发明所述姜黄素维生素e琥珀酸酯纳米乳的制备方法的优选实施方式,所述姜黄素维生素e琥珀酸酯前药、dl-α生育酚、辛基酚聚氧乙烯醚-50在三氯甲烷中的质量浓度分别为2mg/ml、150mg/ml、50mg/ml;所述dl-α生育酚的三氯甲烷溶液、姜黄素维生素e琥珀酸酯前药的三氯甲烷溶液、辛基酚聚氧乙烯醚-50的三氯甲烷的体积分别为50μl、125μl、83μl;所述干燥时间为2h,所述超纯水的体积为1ml;所述超声功率为240w,每隔3s超声3s,超声时间为3min。第五方面,本发明提供了上述姜黄素维生素e琥珀酸酯前药或上述姜黄素维生素e琥珀酸酯纳米乳在制备抗肿瘤药物中的应用。与现有技术相比,本发明的有益效果为:(1)本发明通过酯键连接姜黄素和维生素e制备得到姜黄素维生素e琥珀酸酯前药,在肿瘤细胞偏酸性的环境下有利于酯键发生断裂释放出母药姜黄素而发挥抗肿瘤作用;在hepg2肝癌细胞和caco-2结肠癌细胞的增殖抑制试验中,显示本发明制备的姜黄素维生素e琥珀酸酯前药与姜黄素具有相当的抑制肿瘤细胞生长的作用;(2)与现有合成技术相比,本发明设计不仅局限于对姜黄素进行结构修饰以期改善其理化性质,而且合成产物的结构设计与纳米乳的质量直接相关联;传统纳米乳的制备在筛选和优化药物组合时,并没有充分考虑药物、油相、乳化剂及助乳化剂的化学结构,而本发明的关键点在于设计姜黄素维生素e琥珀酸酯前药时,充分考虑姜黄素维生素e琥珀酸酯前药与药物组合中其他组分化学结构的相关性;本发明选择维生素e修饰姜黄素,同时纳米乳的油相也选择维生素e,因为两者在化学结构中均具有相同的维生素e链段,有利于大大提高药物和油相的相容性,在不使用助乳化剂的条件下,本发明也能制备得到稳定、可控、缓释的纳米乳;(3)本发明合成及分离提纯工艺具备良好的重现性,便于富集样品,进行后续的体外抗肿瘤活性研究及纳米制剂的研究;(4)本发明制备得到的姜黄素维生素e琥珀酸酯纳米乳与姜黄素纳米乳相比较,具有稳定性好、体外缓慢释放、包封率高等优点;与传统姜黄素纳米乳比较具有以下优势:a.通过提高药物在油相的溶解度而提高载药量;b.姜黄素维生素e琥珀酸酯与油相维生素e相容性好,有利于提高纳米乳的稳定性,避免药物过早释放;c.避免使用大量助乳化剂;d.姜黄素维生素e琥珀酸酯纳米乳的表面容易修饰,可以通过聚乙二醇化或者抗体修饰等进一步改善活性组分的药物动力学特点对肿瘤部位的主动靶向性。附图说明图1为姜黄素维生素e琥珀酸酯的hplc色谱图。图2为姜黄素维生素e琥珀酸酯的质谱图。图3为姜黄素维生素e琥珀酸酯的核磁共振氢谱图。图4为姜黄素维生素e琥珀酸酯的结构式氢原子编号图。图5为姜黄素维生素e琥珀酸酯的标准曲线图。图6为空白纳米乳的hplc色谱图。图7为姜黄素维生素e琥珀酸酯纳米乳的hplc色谱图。图8为姜黄素维生素e琥珀酸酯纳米乳的体外累积释放度曲线图。图9为姜黄素、姜黄素维生素e琥珀酸酯、姜黄素维生素e琥珀酸酯纳米乳对hepg2细胞增殖影响的统计图。图10为姜黄素、姜黄素维生素e琥珀酸酯、姜黄素维生素e琥珀酸酯纳米乳对caco-2细胞增殖影响的统计图。具体实施方式为更好地说明本发明的目的、技术方案和优点,下面将结合附图和具体实施例对本发明作进一步说明。实施例1姜黄素维生素e琥珀酸酯(cur-ve)的制备精密称定维生素e琥珀酸酯0.046g、二环己基碳二亚胺0.047g,加入二氯甲烷5ml使其溶解,15~25℃浴搅拌20~40min,氮气保护。然后,加入姜黄素纯品0.0312g(发明人实验室自制,纯度>98%),1ml的4-二甲氨基吡啶溶液(精密称定0.0544g,二氯甲烷定容至1ml),20~30℃反应7h,氮气保护。实施例2姜黄素维生素e琥珀酸酯的分离纯化装柱:取100~200目柱层析硅胶适量,以体积比石油醚:乙酸乙酯=4:1为溶剂,湿法装柱,静置过夜后备用;将反应7h后的反应液进行抽滤,将滤液与1g柱层析硅胶混合,挥干溶剂,即拌样完成;拌样:精密称取适量姜黄素维生素e琥珀酸酯的硅胶粉末,于蒸发皿中并用适量二氯甲烷溶解,加入2倍量的柱层析硅胶,置于60~70℃水浴,边搅拌边挥干,待溶剂挥干后,即完成拌样;分离:将拌好的样品加入已静置过夜的硅胶柱上,以体积比石油醚:乙酸乙酯=4:1为洗脱剂进行洗脱,待第一个色带流出时,用锥型瓶接收流出液;当第一个色带被完全洗脱下来后,弃去,洗脱剂更换为石油醚:乙酸乙酯=2:1,收集第二个色带的流出液;将流出液点于gf254硅胶板,以石油醚:乙酸乙酯=2:1为展开剂,合并斑点位置相同的流出液,于旋转蒸发仪上挥干溶剂,得到干燥粉末,产率为40%~60%。样品于-20℃冰箱密封避光保存。最后分别用ms、核磁共振、hplc技术对姜黄素维生素e琥珀酸酯进行纯度测定及结构确认。实施例3姜黄素维生素e琥珀酸酯的结构确证及纯度测定1.姜黄素维生素e琥珀酸酯的纯度测定(1)最大吸收波长的确定精密称定姜黄素维生素e琥珀酸酯纯品,加入适量的甲醇溶解,配制浓度为41.4mg/ml的样品储备液。取一定量的储备液,配制成浓度为20μg/ml的样品,按分光光度法,在200~700nm波长范围内进行扫描,姜黄素维生素e琥珀酸酯在414nm有最大吸收波长。(2)色谱条件色谱柱redclassicalc18柱,流动相:甲醇:水(含0.1%磷酸)=99:1,流速为lml/min,进样量为20μl,检测波长为414nm,柱温30℃。(3)纯度测定精密称定姜黄素维生素e琥珀酸酯纯品,加入适量的甲醇溶解,配制浓度为41.4mg/ml的样品储备液。取一定量的储备液,配制成浓度为60μg/ml,以0.45mm微孔滤膜过滤,按上述色谱条件注入hplc进行纯度测定,结果如图1所示。按峰面积归一化法计算,姜黄素维生素e琥珀酸酯的纯度为99.6%。2.姜黄素维生素e琥珀酸酯的结构确证姜黄素维生素e琥珀酸酯的质谱、核磁共振氢谱分别如图2、图3所示。姜黄素维生素e琥珀酸酯的结构式氢原子编号如图4所示。其核磁共振氢谱的解析数据如表1所示。表1由图2~4及表1可知,通过本发明的实施例1~2,已成功制备、分离纯化得到姜黄素维生素e琥珀酸酯,且纯度>98%。实施例4姜黄素纳米乳(cur-ne)的制备分别精密称取姜黄素10.0mg、dl-α生育酚1.5g、辛基酚聚氧乙烯醚-50500.0mg,取一定量三氯甲烷将其溶解成质量浓度分别为2mg/ml、150mg/ml、50mg/ml的溶液。分别按先后顺序取dl-α生育酚溶液50μl、姜黄素125μl、辛基酚聚氧乙烯醚-5083μl于1ml玻璃试管中,避光n2吹干后,于真空干燥箱中干燥2h,取出后加入1ml超纯水,在超声波细胞粉碎仪超声,制得姜黄素纳米乳(cur-ne),超声功率240w,超声3s,停3s,总耗时3min。实施例5姜黄素维生素e琥珀酸酯纳米乳(cur-ve-ne)的制备分别精密称取姜黄素维生素e琥珀酸酯2.0mg、dl-α生育酚1.5g、辛基酚聚氧乙烯醚-50500.0mg,取一定量三氯甲烷将其溶解成质量浓度分别为2mg/ml、150mg/ml、50mg/ml的溶液。分别按先后顺序取dl-α生育酚溶液50μl、姜黄素维生素e琥珀酸酯125μl、辛基酚聚氧乙烯醚-50583μl于1ml玻璃试管中,避光n2吹干后,于真空干燥箱中干燥2h,取出后加入1ml超纯水,在超声波细胞粉碎仪超声,制得姜黄素维生素e琥珀酸酯纳米乳(cur-ve-ne),超声功率240w,超声3s,停3s,总耗时3min。实施例6姜黄素维生素e琥珀酸酯的液相、质谱鉴定及液相含量检测1.对照品溶液的制备:精密称定姜黄素维生素e琥珀酸酯纯品,加入适量甲醇溶解,配制浓度为41.4mg/ml的对照品溶液。2.色谱条件:色谱柱redclassicalc18柱,流动相:甲醇:水(含0.1%磷酸)=99:1,流速为1ml/min,进样量为20μl,检测波长为414nm,柱温为30℃,以峰面积(y)与进样浓度(x)进行线性回归。3.线性考察取对照品溶液,配制浓度分别为60mg/ml、40mg/ml、20mg/ml、10mg/ml、5mg/ml的系列标准品浓度,按照色谱条件进样,以对照品的浓度为横坐标,峰面积为纵坐标,绘制标准曲线。得到回归方程y=27.096x-19.522,相关系数r=0.9998。姜黄素维生素e琥珀酸酯的标准曲线如图5所示,由图5可知,姜黄素维生素e琥珀酸酯在4.96mg/ml~59.6mg/ml内线性关系良好。4.精密度试验取60mg/ml姜黄素维生素e琥珀酸酯的对照品溶液,按上述色谱条件连续进样5次,测定其峰面积,计算精密度。精密度试验的样品峰面积如表2所示。表2样品峰面积11598.721602.431601.841599.651601.6rsd值0.1%由表2可知,rsd小于0.1%,精密度符合方法学要求。5.稳定性试验取40mg/ml姜黄素维生素e琥珀酸酯的对照品溶液,按上述色谱条件于0、1、7、14、28天进样,测定其峰面积,计算稳定性。稳定性试验的样品峰面积如表3所示。表3时间(天)峰面积01076.011074.571068.8141063.3281046.9rsd值1.10%由表3可知,在考察时间范围内,姜黄素维生素e琥珀酸酯溶液性质稳定。6.加样回收率取空白纳米乳1ml置于25ml量瓶中,加入甲醇溶解并稀释至刻度,超声5min进行破乳。精密吸取破乳溶液50ml于10ml容量瓶中,加入适量的姜黄素维生素e琥珀酸酯的对照品溶液,甲醇稀释至刻度,制备浓度为10mg/ml、20mg/ml、40mg/ml的姜黄素维生素e琥珀酸酯溶液。每个浓度平行制备3份,分别取20μl注入hplc,在上述色谱条件下测定并计算回收率。加样回收率的结果如表4所示。表4由表4可知,加样回收率均大于98%,符合方法学要求。7.专属性分别取空白纳米乳、姜黄素维生素e琥珀酸酯纳米乳1ml置于25ml量瓶中,加入甲醇溶解并稀释至刻度,超声5min进行破乳。各取20μl注入hplc检测分析,判断纳米乳辅料对主药的测定是否有干扰。空白纳米乳的hplc色谱图如图6所示,姜黄素维生素e琥珀酸酯纳米乳的hplc色谱图如图7所示。由图6和图7可知,纳米乳辅料对主药的测定无干扰。实施例7纳米乳、脂质体、聚合物胶束的制剂评价试验1.粒径与粒度分布吸取适量的姜黄素纳米乳、姜黄素维生素e琥珀酸酯纳米乳及其相应的空白纳米乳制剂,用超纯水稀释,动态光散射法(dls)测定粒径(size)和分散系数(pdi),结果如表5所示。表5纳米乳姜黄素纳米乳姜黄素维生素e琥珀酸酯纳米乳size(nm)108.41±1.08103.02±1.24pdi0.157±0.0100.222±0.020由表5可知,姜黄素纳米乳与姜黄素维生素e琥珀酸酯纳米乳的粒径均在100nm以下,粒度分布较均匀,姜黄素纳米乳与姜黄素维生素e琥珀酸酯纳米乳在粒径大小和粒度分布上无明显差异,均符合纳米制剂要求,并能满足后期体内外实验的需求。2.包封率和载药量(1)分别精密吸取制备好的姜黄素纳米乳和姜黄素维生素e琥珀酸酯纳米乳0.2ml(n=3),10ml容量瓶中甲醇稀释超声10min破乳,静置室温后定容,后取适量用0.22μm滤膜过滤,取续滤液进hplc,进样量5μl,得峰面积aa0。(2)分别精密吸取制备好的纳米乳0.2ml适量,用0.22μm微孔滤膜过滤,除去未包裹在纳米制剂内的游离沉淀药物,取过滤后液体制剂0.2ml,甲醇稀释,超声破乳,定容,过滤后,取5μl进hplc,得峰面积aa1。(3)分别取0.22μm微孔滤膜过滤后的纳米制剂0.2ml,加入超滤离心管中10000rpm离心20min后,取滤液进hplc,得峰面积aa2。其中,aa0为总药物的峰面积,包括游离药物、包封药物及以沉淀形式存在的药物;aa1为游离药物与包封药物的峰面积;aa2为游离药物的峰面积。按照下列公式计算:包封率%=ee%=(aa1-aa2)/aa0×100%。载药量%=ld%=包封药量/(投药量+乳化剂药量)×100%。包封率和载药量如表6所示。表6纳米乳姜黄素纳米乳姜黄素维生素e琥珀酸酯纳米乳包封率(%)67.8±7.2197.8±2.21**载药量(%)0.49±0.022.10±0.12*(**p<0.01,*p小于0.05)通过制剂处方和工艺的优化,由表6可知,姜黄素维生素e琥珀酸酯纳米乳包封率和载药量都高于姜黄素纳米乳,并具有显著性差异。说明,将姜黄素制成姜黄素维生素e琥珀酸酯后,有利于提高前药在油相维生素e中的相容性,进而提高药物的载药量和包封率。3.体外释放度采用透析法,以1%辛基酚聚氧乙烯醚-50-pbs(0.01mol)为释放介质,分别将4ml纳米乳置于预处理过的透析袋(分子截留量3500mm)中,100rpm下37℃恒温水浴震荡,分别于4、6、7、8、24、30、36、48h取样1.0ml,过0.2μmol微孔滤膜后进液相分析,进样量5μl,计算姜黄素维生素e琥珀酸酯纳米乳在不同时间点累计释放度,结果如图8所示。由图8可知,姜黄素维生素e琥珀酸酯纳米乳的释药具有缓释的作用,姜黄素维生素e琥珀酸酯纳米乳在48h时的累积释放度为59.0±1.8%,因姜黄素纳米乳稳定性较差,且载药量低,无法满足释放度试验要求,故无姜黄素纳米乳体外释放度数据。4.稳定性试验将姜黄素纳米乳、姜黄素维生素e琥珀酸酯纳米乳在4℃下密封避光储存,分别在第0、1、7、14、28天通过观察纳米乳外观并测定其粒径及包封率,考察纳米乳的稳定性,姜黄素维生素e琥珀酸酯纳米乳的结果如表7所示,姜黄素纳米乳的结果如表8所示。表7时间(天)是否分层、沉淀粒径包封率0否103.097.8%1否105.697.6%7否102.498.1%14否110.896.5%28否121.494.2%表8由表7和表8可知,姜黄素维生素e琥珀酸酯纳米乳在放置14天内,粒径及包封率变化不大,到第28天时粒径稍微变大,包封率有略微下降。而姜黄素纳米乳在制备后第7天开始,能观察到有药物沉淀析出,在第14天开始,药物沉淀明显变多,离心后对上清液进行破乳,进hplc检测,由于药物含量太低,低于检测限,无法测定包封率。说明姜黄素维生素e琥珀酸酯纳米乳显著改善了姜黄素纳米乳的稳定性。实施例8姜黄素维生素e琥珀酸酯纳米乳的体外抗肿瘤作用试验1.姜黄素维生素e琥珀酸酯纳米乳对hepg2细胞的生长抑制试验收集对数生长期hepg2细胞,调整细胞悬液浓度至6000个/ml,接种于96孔板中,每孔加入200μl,边缘孔用pbs填充。当孔板中细胞完全贴壁且处于对数生长期时,弃去原培养基,加入梯度浓度分别为100μmol/l、80μmol/l、60μmol/l、40μmol/l、20μmol/l、10μmol/l的姜黄素维生素e琥珀酸酯纳米乳、姜黄素维生素e琥珀酸酯、姜黄素,每个浓度梯度设置6个复孔,并设置空白组与对照组,于5%co2、37℃培养72h后,弃去孔内培养基,pbs润洗两次,加入新鲜的培养基200μl、40μl(2.5mg/ml)mtt溶液,于5%co2、37℃继续培养4h。4h后终止培养,弃去孔内溶液,加入200μldmso,37℃避光振荡10min,用酶标仪在490nm处测定各孔的光密度值(od),计算存活率。其中,细胞存活率%=(含药组od值-空白组od值)/(对照组od值-空白组od值)×100%。姜黄素、姜黄素维生素e琥珀酸酯、姜黄素维生素e琥珀酸酯纳米乳对hepg2细胞的增殖抑制作用的存活率如表9和图9所示。表9由表9和图9可知,72h内姜黄素、姜黄素维生素e琥珀酸酯、姜黄素维生素e琥珀酸酯纳米乳对hepg2细胞的增殖均有抑制作用。随着剂量的增加,细胞存活率逐渐降低,说明原药组和前药组、前药纳米乳对hepg2细胞的增殖抑制均呈现明显的浓度依赖关系。表10姜黄素姜黄素维生素e琥珀酸酯姜黄素维生素e琥珀酸酯纳米乳ic50(μmol/l)28.384±0.3132.985±0.1613.423±0.39表11表10为姜黄素、姜黄素维生素e琥珀酸酯、姜黄素维生素e琥珀酸酯纳米乳对hepg2细胞增殖抑制作用的ic50,表11为以ic50为因变量进行的多重比较。由表10和表11可知,姜黄素、姜黄素维生素e琥珀酸酯的ic50值差异无显著性意义(p>0.05),而姜黄素与姜黄素维生素e琥珀酸酯纳米乳、姜黄素维生素e琥珀酸酯与姜黄素维生素e琥珀酸酯纳米乳的ic50值有显著性差(p<0.05)。由此可说明,姜黄素与姜黄素维生素e琥珀酸酯对hepg2细胞的增殖抑制作用相当,但将姜黄素维生素e琥珀酸酯制备成纳米乳,其对hepg2细胞的增殖抑制作用明显强于姜黄素与姜黄素维生素e琥珀酸酯。2.姜黄素维生素e琥珀酸酯纳米乳对caco-2细胞的生长抑制试验收集对数生长期caco-2细胞,调整细胞悬液浓度至6000个/ml,接种于96孔板中,每孔加入200μl,边缘孔用pbs填充。当孔板中细胞完全贴壁且处于对数生长期时,弃去原培养基,加入梯度浓度分别为100μmol/l、80μmol/l、60μmol/l、40μmol/l、20μmol/l、10μmol/l的姜黄素维生素e琥珀酸酯纳米乳、姜黄素维生素e琥珀酸酯、姜黄素,每个浓度梯度设置6个复孔,并设置空白组与对照组,于5%co2、37℃培养72h后,弃去孔内培养基,pbs润洗两次,加入新鲜的培养基200μl、40μl(2.5mg/ml)mtt溶液,于5%co2、37℃继续培养4h。4h后终止培养,弃去孔内溶液,加入dmso200μl,37℃避光振荡10min,用酶标仪在490nm处测定各孔的光密度值(od),计算存活率。姜黄素、姜黄素维生素e琥珀酸酯、姜黄素维生素e琥珀酸酯纳米乳对caco-2细胞的增殖抑制作用的存活率如表12和图10所示。表12表13姜黄素姜黄素维生素e琥珀酸酯姜黄素维生素e琥珀酸酯纳米乳ic50(μmol/l)17.424±0.2223.773±0.2410.506±0.72表14表13为姜黄素、姜黄素维生素e琥珀酸酯、姜黄素维生素e琥珀酸酯纳米乳对caco-2细胞增殖抑制作用的ic50,表14为以ic50为因变量进行的多重比较。由表12~14可得,72h内姜黄素维生素e琥珀酸酯与姜黄素、姜黄素与姜黄素维生素e琥珀酸酯纳米乳的ic50值差异无显著性意义(p大于0.05),而姜黄素维生素e琥珀酸酯与姜黄素维生素e琥珀酸酯纳米乳的ic50值差异有显著性意义(p<0.05)。由此可说明,姜黄素与姜黄素维生素e琥珀酸酯对caco-2细胞的增殖抑制作用相当,但姜黄素维生素e琥珀酸酯纳米乳对caco-2细胞的增殖抑制作用明显强于游离药组,说明纳米乳载体有利于将药物输送至细胞内。最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1