一种超分子水凝胶载药体系及其制备方法与流程
本发明属于生物医用超分子材料技术领域,具体涉及可注射的新型可降解超分子水凝胶载药体系及其制备方法。
背景技术:
水凝胶具有良好的生物相容性、水渗透性,而且通过人工合成可得到不同微观结构和性能的水凝胶材料,这些性质使水凝胶在生物医学领域获得了广泛的应用。注射用可降解水凝胶能够侵入或填补创伤的任何缺陷或空洞,近年来已广泛用于组织再生中的药物或细胞递送。
α-环糊精结构独特,具有疏水性内腔,可以将各种分子装配到空腔中以形成超分子包合配合物,基于α-cd与生物可降解嵌段共聚物之间的包合配合物的自组装形成的超分子水凝胶,可以用作大分子药物的持续控制释放的有希望的可注射药物递送系统。
聚合物水凝胶一直引起生物医学应用的兴趣,因为它们通常具有良好的生物相容性,水含量高,对于递送生物活性剂如蛋白质具有吸引力。作为典型的例子,f127,即peo-ppo-peo三嵌段共聚物的溶胶-凝胶转变行为已被广泛研究并用于药物的递送多肽和蛋白质。但是由于peo-ppo-peo属于温敏性的材料,所以在使用过程中会因温度而受到限制,而且它成胶需要较高的浓度,材料比例过高,难免在应用过程中会增加副反应发生率。线性水溶性聚合物如peo可以穿透α-cd的内腔,形成具有项链状超分子结构的包合配合物。而α-cd-peo可注射药物输送系统,释放动力学过快,水凝胶仅适用于短期药物释放,peo不是可生物降解的,高分子量peo不适于通过人肾膜过滤。
而且目前出现的协同载药体系,很少有适合共同递送水溶性相反药物的,该领域很有价值进行进一步探索。
因此提供一种材料占比小,副作用小,具有可生物降解性能、能协同载送水溶性相反的药物,并且具有缓控释放性能的可注射的水凝胶以及其制备方法是目前具有挑战性的问题。
技术实现要素:
第一方面,本发明提供一种超分子水凝胶载药体系,该体系包含至少一种有效治疗剂量的疏水性药物,至少一种有效治疗剂量亲水性药物,以及足量的用于形成水凝胶的f127和α-cd。
该水凝胶制能协同载送疏水性药物和亲水性药物,缓控释放效果显著。并且具有可注射性、可降解性、成本低、良好的生物相容性、结构独特、凝胶时间短,材料占比小等优势,而且具有相对一般成胶方法低的多的原料用量。
在本发明中一些优选实施方案中,所述f127与α-cd的重量比为1:0.5~4;优选地,所述f127/α-cd超分子水凝胶中f127与α-cd的重量比为1:1~4。
在本发明一些具体实施方式中,所述的疏水性药物包含pncb,所述亲水性药物包含bfgf。
皮肤创伤愈合是一个复杂的过程,主要涉及炎症,增殖和重塑等几个阶段,其中炎症和细胞增殖阶段在整个愈合过程中起着不可或缺的作用。因此,包括抗炎和促进细胞增殖的药物组合将是伤口修复的有效方法。在该超分子水凝胶结构及其性能的基础上,我们大胆进行协同递送药物的尝试。生松素(pncb)具有抗炎作用,单独用药时用量难以控制;碱性成纤维细胞生长因子(bfgf)可促进细胞增殖和组织再生,但单纯的碱性成纤维细胞生长因子溶液极其容易降解,并随着温度的提升降解速度加快;由于这些缺点,抗炎药物和生长因子的组合从未获得令人满意的伤口愈合结果;现有的载体系统由于其在控制药物释放方面的能力和保护药物免于降解的有效性而将是有用的,但是由于这两种类型药物-疏水性pcnb和亲水性bfgf的水溶性相反,现有的载体无法同时载送疏水性药物和亲水性药物。本发明提供的超分子水凝胶由α-环糊精和pluronicf127之间的主客体相互作用形成的,同时负载所述的疏水性药物pncb和亲水性药物bfgf。该pncb/bfgf@α-cd/f127体系显示出良好的可注射能力,可降解性和持续释放性质,在组织修复中具有良好的效果。
第二方面,本发明提供上述所述的超分子水凝胶载药体系的制备方法,该方法包括如下步骤:步骤1)疏水性药物@f127胶束的制备;
步骤2)亲水性药物@α-cd体系的配制;
步骤3)疏水性药物/亲水性药物@α-cd/f127可注射的超分子水凝胶载药体系。
即本发明的发明人首先将f127与疏水性药物pncb形成胶束,然后再与负载了bfgf的α-cd形成超分子水凝胶。该pncb/bfgf@α-cd/f127体系显示出良好的可注射能力,可降解性和持续释放性质,在组织修复中具有良好的效果。
作为优选,所述的疏水性药物包含pncb,所述亲水性药物包含bfgf,所述步骤1)中的pncb@f127胶束的制备方法包含如下步骤:f127和pncb分别溶解到dmso中,磁力搅拌下将溶有pncb的dmso溶液,缓慢滴加到溶有f127的dmso溶液中,磁力搅拌,使在dmso中的f127和pncb达到平衡的状态;滴加纯水,透析;离心除去大颗粒,冻干即得pncb@f127胶束粉末。
作为优选,所述步骤2)中的)bfgf@α-cd体系的配制方法为:将α-cd粉末溶到pbs中,加入试验所需量的bfgf,保证α-cd在该bfgf@α-cd体系的最终重量百分比在10%~20%之间。
作为优选,所述的步骤3)中,将步骤1)的pncb@f127胶束粉末溶到1×pbs中,其中f127的重量百分数为2.5%~7.5%,然后和步骤2)中得到的bfgf@α-cd溶液等体积混匀,室温下静置成胶,即得到pncb/bfgf@α-cd/f127可注射的超分子水凝胶载药体系。
作为优选,步骤3)中,pncb@f127胶束粉末溶到1×pbs后,其中,f127的重量百分数为7.5%;此时,步骤2)中获得bfgf@α-cd溶液中的α-cd的重量百分数为10%。
作为优选,在磁力搅拌下以每3s一滴的速度滴加超纯水,持续磁力搅拌,然后将混合液加入到透析袋中透析,刚开始以每0.5h~1h换一次水,后面可适时延长换水间隔的时间,过夜透析;将透析液加入到离心管中,离心除去大颗粒,在-80℃冷冻结冰,放入冻干机中冻干即得pncb@f127胶束粉末。
第三方面,本发明提供一种可注射f127/α-cd超分子水凝胶的制备方法,其特征在于:该方法包括如下步骤:以pbs溶液为溶剂,配制浓度范围为5%-15%的f127溶液、浓度范围为10%~20%的α-cd溶液,将中配好的α-cd溶液和f127溶液等体积混匀。
f127共聚物和α-cd溶液凝胶化的驱动力是a-cd和peo嵌段之间的包合络合和中间ppo嵌段的疏水性相互作用力的组合。因此其特殊的结构和性能,成就了它良好的控制释放性能。室温下,我们制备了具有不同比率的f127/α-cd的超分子系列组合,并且f127的成胶比例成功从16%降低到2.5%,前者是f127独自成胶的最低浓度,后者是需要α-cd参与,其中最短成胶时间约为3分钟。
附图说明
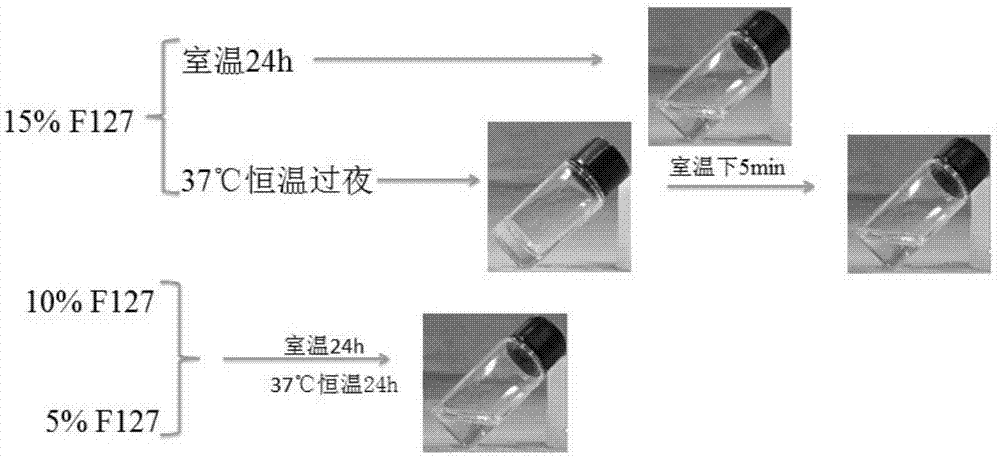
图1为单独的15%、10%、5%的f127溶液成胶结果。
图2为水凝胶在不同溶液中的降解效果。
图3为水凝胶的可注射性的体现。
图4为pncb@f127胶束电镜图。
图5为单独的f127和pncb@f127的粒径图。
图6为pncb/bfgf@α-cd/f127协同包载两种药物的释放率。
图7为pncb/bfgf@α-cd/f127和pncb两个体系的创面愈合率比较示意图。
具体实施方式
实施例1
(1)称取1.5gpluronicf127粉末,溶解在8.5g的1×的pbs中(4℃条件下静置过夜溶解),配成重量百分比为15%的f127溶液。
(2)称取1gpluronicf127粉末,溶解在9g的1×的pbs中(4℃条件下静置过夜溶解),配成重量百分比为10%的f127溶液。
(3)称取0.5gpluronicf127粉末,溶解在9.5g的1×的pbs中(4℃条件下静置过夜溶解),配成重量百分比为5%的f127溶液。
单独的15%、10%、5%的f127溶液成胶结果见图1,证明f127单独的浓度≦15%时,已经失去成胶的能力。
实施例2
(1)分别称取pluronicf127粉末0.5g、1.0g、1.5g,对应溶解到9.5g、9.0g、8.5g的1×pbs溶液中(4℃条件过夜溶解),配成重量百分数分别为5.0%、10%、15%的溶液。
(2)分别称取α-cd粉末0.5g、1.0g、2.0g,对应溶解到9.5g、9.0g、8.0g的1×pbs溶液中(加热溶解),配成重量分数为5.0%、10%、20%的溶液。
(3)将(1)和(2)两种溶液等体积混匀后,室温下静置即可,记录成胶时间。
如表1,证明在f127未能达到独自成胶浓度的情况下,α-cd能够帮助其成胶;从表格中可以看到,f127的浓度可以低至2.5%,而此时α-cd的浓度仅为5%,成功降低了该载药体系的材料占比。
表1为不同配比组合的f127/α-cd成胶结果
实施例3
选择f127和α-cd的质量比为5:10的水凝胶进行可降解性实验。
(1)称取pluronicf127粉末1.0g,对应溶解到9.0g的1×pbs溶液中(4℃条件过夜溶解),配成重量百分数分别为10%的溶液,加入丽春红进行上色。
(2)称取α-cd粉末2.0g,溶解到8.0g的1×pbs溶液中(加热溶解),配成重量分数为20%的溶液,加入丽春红上色。
(3)将(1)和(2)两种溶液等体积混匀后,注入到星星形状的模具中,室温下静置成胶,分别将其置于5种不同的溶液中(水/pbsph=5/pbsph=7/10%fbs/fbs)并在不同时间点观察拍照星星形状水凝胶的表面积,观察其降解性能。如图2,证明α-cd/f127水凝胶能很好的降解;
另外,参见图3,该水凝胶具有可注射性能,。
实施例4
(1)分别称取f127和生松素(pncb)90mg、18mg(5:1),分别溶解到400μl和100μl的dmso中(震荡溶解)。
(2)磁力搅拌下将溶有生松素(pncb)的dmso溶液,缓慢滴加到溶有f127的dmso溶液中,磁力搅拌1h,使在dmso中的f127和生松素(pncb)达到平衡的状态。
(3)在磁力搅拌下以每3s一滴的速度滴加超纯水4ml,滴加完毕后,持续磁力搅拌1h,然后将混合液加入到透析袋(分子量3500)中透析,刚开始以每0.5h—1h换一次水,后面可适时延长换水间隔的时间,过夜透析。
(4)将透析液加入到离心管中,以20000r/min的速度离心5min(除去大颗粒),在-80℃冷冻结冰,放入冻干机中冻干48h,即得pncb@f127胶束粉末。
胶束电镜图见图4,电镜图中的球状物体即证明pncb@f127胶束已成功制备)。
实施例5
(1)分别称取f127和生松素(pncb)90mg、18mg(5:1),分别溶解到400μl和100μl的dmso中(震荡溶解)。磁力搅拌下将溶有生松素(pncb)的dmso溶液,缓慢滴加到溶有f127的dmso溶液中,磁力搅拌1h,使在dmso中的f127和生松素(pncb)达到平衡的状态。
(2)称取f127粉末90mg溶解到400μl的dmso中(震荡溶解),与(1)同等条件下磁力搅拌1h。
(3)在磁力搅拌下以每3s一滴的速度分别向(1)和(2)溶液中滴加超纯水4ml,滴加完毕后,持续磁力搅拌1h,然后将混合液加入到透析袋(分子量3500)中透析,刚开始以每0.5h—1h换一次水,后面可适时延长换水间隔的时间,过夜透析。
(4)将(3)的两种透析液分别用0.22um的滤头过滤,然后20000r/min的速度离心10min(除去大颗粒),去测dls。
结果如图5,经过f127和pncb@f127的粒径比较,发现后者的粒径值右移,pncb@f127的粒径明显要大于单独的f127,说明疏水性药物pncb已经成功被包载。
实施例6
(1)配浓度为0.048mg/ml、0.024mg/ml、0.012mg/ml、0.006mg/ml、0.003mg/ml、0.0012mg/ml的pncb溶液,溶剂为dmso,用紫外测其在295处的吸光度,绘制标准曲线(y=0.0912x+0.0001r2=1)。
(2)将pncb@f127的冻干粉末溶于dmso中,配成浓度为c0(0.8mg/ml)的溶液,在295nm下测其吸光度,带入(1)中的标准曲线得到载药量m0(12.209ug/mg)(载药率=(m0/c0)×100%)。
实施例7
(1)称取pncb@f127胶束粉末4.4mg,溶到39.6mg的1×pbs中,配成重量百分比为10%的溶液。
(2)称取8.8mg的α-cd粉末,溶到28.16mg的1×pbs中,然后加入7.04μl的浓度为1mg/ml的bfgf溶液,配成最终α-cd的重量百分数为20%的溶液。
(3)将(1)和(2)得到的溶液混匀,注入到transwell小室中,transwell下室中注入500μl的生理盐水。
(4)在以下13个时间点取样生理盐水,每个时间点取两份样,各100μl,每个时间点补空白生理盐水200μl,将取得样放入-20℃保存。取样的时间点为5h、9h、18h、24h、2d、3d、4d、5d、6d、7d、8d、9d、10d、13d、15d。
(5)分别配制50mg/ml、5mg/ml、0.5mg/ml、0.05mg/ml、0.005mg/ml、0.0005mg/ml、0.00005mg/ml的生松素溶液,母液用dmso溶解,用生理盐水进行梯度稀释。将不同浓度的溶液加到96孔板中,每孔100μl,每个浓度设3个复孔。用酶标仪(波长为295nm)测生松素的吸光度,绘制标准曲线。
(6)将(4)收的不同时间点的样,用生理盐水稀释1倍,然后将其分别加入到96孔板中,每空孔100μl,每个时间点设两个复孔,用酶标仪(波长为295nm)测生松素的吸光度,将每个复孔的吸光度x带入(5)中的标准曲线,计算出生松素的释放量,求其平均值即得到上一时间点到这个时间点间的释放量,然后将前面时间段释放的量累积相加即得截至到改时间点的释放总量。
某时间点的释放率(%)=(截至到取样时间点的释放总量/pncb@f127中含的pncb的总量)×100%
(7)用人碱性成纤维生长因子elisa试剂盒测bfgf在每个时间点的释放量。
按照elisa试剂盒的说明书步骤进行实验,结果如图6,随着收样时间的延长,释放出的bfgf和pncb的量逐渐增加,结果证明该超分子水凝胶载药体系具有良好的缓控释放效果,而且能成功包载两种药物,能使两种药物都达到缓控释放的效果。
实施例8
实施例8a
步骤1)pncb@f127胶束的制备
(1)分别称取f127和生松素(pncb)90mg、18mg(5:1),分别溶解到400μl和100μl的dmso中(震荡溶解)。
(2)磁力搅拌下将溶有生松素(pncb)的dmso溶液,缓慢滴加到溶有f127的dmso溶液中,磁力搅拌1h,使在dmso中的f127和生松素(pncb)达到平衡的状态。
(3)在磁力搅拌下以每3s一滴的速度滴加超纯水4ml,滴加完毕后,持续磁力搅拌1h,然后将混合液加入到透析袋(分子量3500)中透析,刚开始以每0.5h—1h换一次水,后面可适时延长换水间隔的时间,过夜透析。
(4)将透析液加入到离心管中,以20000r/min的速度离心5min(除去大颗粒),在-80℃冷冻结冰,放入冻干机中冻干48h,即得pncb@f127胶束粉末。
步骤2)bfgf@α-cd体系的配制
(5)将α-cd粉末溶到1×pbs中(加热溶解),待其自然冷却后,加入自己所需量的bfgf(1.5mg/ml)液体即可,但是要保证α-cd在该bfgf@α-cd体系的最终重量百分为20%。
步骤3)pncb/bfgf@α-cd/f127超分子水凝胶协同载药体系
(6)将(4)中得到的pncb@f127胶束粉末溶到1×pbs中,配成重量百分数为10%的溶液,
(7)然后和(5)中得到的bfgf@α-cd溶液等体积混匀。
实施例8b
(1)将一袋pbs磷酸盐粉末溶到2l的超纯水中,配成ph7.2-7.4、浓度为0.01m的pbs溶液。
(2)称取1.31mg的pncb溶到50μl的无水乙醇中,从中取14.53μl,用1%的tween-80稀释成560μl的溶液(0.01m的pbs稀释)。
对本试验例实施例8a得到载药体系和实施例8b中的生松素进行伤口愈合实验,将其作用于急性伤口创面,每组7只,共两组,7天的时候二次给药。
伤口愈合率见图7,明显可以看到pncb/bfgf@α-cd/f127组要比pncb组愈合的快的多,该结果是对该超分子水凝胶体系具有协同载药能力,在生物学方面的验证;
另外pncb/bfgf@α-cd/f127组和pncb组对创面的作用见表2;
表2
以上情况反映了pncb/bfgf@α-cd/f127组较之生松素组对创面的治疗效果更为突出。
- 还没有人留言评论。精彩留言会获得点赞!