一种具有热场监控功能的微波消融装置的制作方法
本发明涉及一种微波消融装置,特别是一种具有热场监控功能的微波消融装置。
背景技术:
近年来逐渐兴起的肿瘤热消融技术是针对某一脏器中特定的一个或多个肿瘤病灶,利用热产生的生物学效应直接导致病灶组织中的肿瘤细胞发生不可逆损伤或凝固性坏死的一种精准微创治疗技术。微波消融治疗技术以其特有的创伤小、安全性高、手术时间短、术后恢复快等优点日益受到众多患者及医生的青睐。
目前,微波消融手术中的参数控制(功率、时间、温度)在很大程度上依赖于医生的主观经验。如果有一种集具有实时测温功能的微波消融针、具有热场精确监控和分析功能控制器的微波消融装置,实时监测微波消融手术中肿瘤的消融进度并控制微波消融设备适时关断,以此实现肿瘤的精准手术治疗,可大大减少由于消融灭活不彻底引起复发的风险和过度消融导致的严重并发症。
但是,肿瘤微波消融的实时温度监测及精准治疗方法一直没有得到实质性的解决。公开号为cn203619673u的专利公开了一种具有实时测温与消融为一体的高性能水冷微波消融天线。公开号为cn202605011u的专利公开了一种消融与测温一体式水冷微波针。这两种一体式微波消融天线综合了消融及测温功能,但是对温度数据的后期处理未做阐述,如果能有匹配的具有热场监控功能的控制器以上述微波消融针反馈的温度数据为控制依据,实时监控微波设备的关断即可实现肿瘤消融的精准手术治疗。
技术实现要素:
针对现有技术的不足,本发明提供了一种具有热场监控功能的微波消融装置,包括微波消融针和控制器;所述微波消融针具有实时测温功能,能够在手术中实时感知消融区域的温度;所述控制器具备术前规划及术中热场监控功能。
本发明中,所述微波消融针由针尾至针头依次为手柄、针杆、布置于针杆上的感温元件和微波发射针头。
所述感温元件固定于针杆外表面,用于消融过程中的组织温度的实时感知。
本发明中,所述感温元件一般为两个以上,从微波发射针头一端开始,沿针杆轴向布置于针杆外表面且间隔一定距离;所述每个感温元件所处的针杆外表面通过医学影像显影增强处理过。
进一步地,本发明中,在针杆外表面每个感温元件所处的位置处均设置有一圈喷砂环或显影涂层或显影涂漆。喷砂环或显影涂层(漆)的作用是在消融手术过程中,借助影像学手段,医生可以辨别消融针上感温元件的具体位置,以及肿瘤边界和感温元件的相对位置,从而达到术中监控效果,如果没有喷砂环或显影涂层,是无法辨别消融针上感温元件的具体位置,以及肿瘤边界和感温元件的相对位置的。
本发明还包括输出设备、输入设备和微波消融仪;所述控制器包括输入输出接口、电源管理模块、数据采集模块、数据处理及分析模块和数据存储模块;控制器通过输入输出接口与输出设备、输入设备,以及微波消融仪连接;
本发明中,所述电源管理模块用于对微波消融装置进行电源管理;所述数据采集模块用于从感温元件采集温度数据,并将采集的数据发送给数据处理及分析模块;所述数据存储模块中保存有基于肿瘤影像学体积数据以及对应的消融能量组的数据库;所述数据处理及分析模块用于对数据采集模块发送的温度数据实时分析,去处异常数据。所述数据处理及分析模块还用于判定肿瘤是否消融完全,以此作为控制器控制微波消融仪实时关断的依据。
本发明中,数据存储模块中的数据库通过如下步骤建立:
步骤a1,收集一定量的肿瘤手术中切除的肿瘤实体部分;
步骤a2,清除肿瘤表面血液及无关组织并对肿瘤组织称重,对肿瘤的影像学体积数据与肿瘤重量进行相关性分析,拟合出对应的函数关系式y=a*x+b,其中:y代表肿瘤重量,x代表肿瘤影像学体积数据,a、b为通过对多数影像学体积数据与肿瘤重量进行相关性分析得到的常数;
步骤a3,测量单位质量肿瘤中蛋白质含量c;
步骤a4,根据热量计算公式,造成肿瘤组织不可逆凝固性坏死所需热量q、蛋白质质量m、微波消融功率、微波消融时间之间有如下关系:
q=c*m*δt=y*t,
由:m=y*c=(a*x+b)*c,
得:y*t=c*(a*x+b)*c*δt,
其中,c表示蛋白质的比热容,y表示微波消融功率,t表示微波消融时间,c为单位质量肿瘤中的蛋白质含量(实验测得),δt为造成肿瘤组织不可逆凝固性坏死温度与初始温度的差值,y*t称为消融能量组;通过医学影像获得影像学体积数据之后,即能够计算出对应的消融能量组,将影像学体积数据以及对应的消融能量组建成数据库,保存在数据存储模块中。本发明中,不同脏器有单独对应的数据库(即对每一种肿瘤都执行步骤a1~步骤a4的过程,建立一个单独的数据库),而且每个数据库是随着样本数量的增加逐渐完善的,最终获得的影像学体积数据以及对应的消融能量组会越来越符合实际需求。
本发明中,所述影像学体积数据计算方法如下:将患者ct或mr增强扫描的薄层dicom格式数据(层厚为1.0mm)导入影像设备自带的三维数字重建成像系统,在肿瘤所在的轴位序列图像上,以计算机阈值分割为基础,辅以人工手动修正,勾画出每幅图像肿瘤的轮廓线,最后由计算机通过积分计算肿瘤的影像学体积数据。
本发明中,所述控制器通过如下流程实现术前规划功能:输入设备(例如计算机)通过控制器的输入输出接口将影像学体积数据录入控制器,控制器根据影像学体积数据在数据存储模块的数据库中匹配出最佳的消融能量组,并通过控制器的输入输出接口发送给输出设备(例如计算机显示器或者平板电脑),反馈给用户(例如医生)。术前规划为用户在微波消融手术中的功率、时间等参数设置提供了准确参考,避免缺乏经验用户由于主观判断造成失误,并且为经验丰富的用户提供更加准确的判断,从而避免功率或时间设置不合理而对患者造成肿瘤消融不彻底或过度消融的严重后果。另外,基于控制器中预存的数据库,本发明所述消融装置会根据肿瘤的影像学体积自动匹配出最佳的几组消融能量组(功率、时间),用户可以根据患者及手术现场的实际情况从中选取最合适的消融能量组(功率、时间),并在控制器中进行设置,结合本发明所述消融装置的术中热场监控功能,可以使消融效果达到最佳。
本发明中,所述控制器通过如下流程实现术中热场监控功能:
步骤b1,将微波消融针插入病灶并开启微波消融手术后,数据采集模块实时从微波消融针针杆上布置的感温元件处采集温度数据并传输给数据处理及分析模块;
步骤b2,随着消融时间的延长,消融区域逐渐增大,数据处理及分析模块对数据采集模块传输来的温度数据进行处理分析,通过如下方式判定异常数据,并去除异常数据:
设定共有n个感温元件,n取值为2或者大于2的自然数,当n取值为大于2的自然数时,记第一个感温元件为距离针头最近的感温元件,第n个感温元件为距离针头最远的感温元件,数据采集模块从第n个感温元件采集到的温度数据记为tn,则数据采集模块从感温元件采集到的温度数据应有如下关系:t1>t2>t3>……>tn;
若tn-2<tn-1,且tn-2>tn,则tn-1为异常数据;
本发明中,当n取值为2时,即只有两个感温元件,记第一个感温元件为距离针头最近的感温元件,其对应的温度数据为t1,另一个感温元件对应的温度数据为t2,如果t1<t2,则t2为异常数据;
步骤b3,数据处理及分析模块调用数据存储模块中的肿瘤影像学体积的数据(此数据预存在数据存储模块中),如果肿瘤的影像学体积的边沿与消融针的交叉点温度未达到引起肿瘤不可逆凝固性坏死的温度,表示消融未完全,控制器控制手术继续进行;若肿瘤的影像学体积的边沿与消融针的交叉点温度大于或等于引起肿瘤不可逆凝固性坏死的温度,表示消融已完全,此时控制器会通过输入输出接口在输出设备上显示并控制微波消融仪关断。微波消融手术中的功率设置、时间设置等参数在很大程度上依赖于医生的主观经验,若医生根据自己的主观经验判断失误,则会造成消融不彻底,从而导致肿瘤的风险,或者造成消融过渡,从而造成正常组织的损伤,延长患者的康复期并伴随其他并发症。本发明提供的具有热场监控功能的微波消融装置,不但可以术前规划,将最佳的治疗能量组(微波消融功率*微波消融时间)指示给用户,为用户在选择消融功率和消融时间时提供有效的参考,同时可以在术中监控消融区域的温度并适时关断微波消融仪,避免消融不彻底肿瘤复发或者消融过度损伤正常组织的严重后果,有效提高微波消融手术的精准治疗。
本发明中,所述针杆采用医用金属材质,内置射频同轴电缆及冷却水管,外表面涂覆防粘连涂层。所述微波发射针头采用医用金属材质,外表面涂覆防粘连涂层,具备穿刺及微波发射功能。针杆和微波发射针头均采用医用金属材质,符合生物相容性的要求,避免对人体组织产生毒副作用;针杆和微波发射针头外表面涂覆防粘连涂层,防止与组织粘连,造成不必要的损伤。
本发明提供了具有实时测温功能的微波消融针实时测量组织温度,基于运行具备术前规划及术中热场监控功能的控制器可以根据实测的组织温度控制消融仪实时关断,有效避免由于手术加温时间过长,温度过高等造成的正常组织损伤,实现肿瘤的精准治疗。
附图说明
下面结合附图和具体实施方式对本发明做更进一步的具体说明,本发明的上述或其他方面的优点将会变得更加清楚。
图1为本发明实施例的具有实时测温功能的微波消融针;
图2为本发明具有热场监控功能的微波消融装置总的技术方案;
图3为本发明实施例的肺肿瘤重量与影像学体积数据的相关性及拟合曲线;
图4为本发明实施例的肝肿瘤重量与影像学体积数据的相关性及拟合曲线;
图5为本发明实施例的肾肿瘤重量与影像学体积数据的相关性及拟合曲线;
图6为本发明实施例的肺肿瘤影像学体积数据的计算实例;
图7为本发明实施例的肝肿瘤影像学体积数据的计算实例;
图8为本发明实施例的肾肿瘤影像学体积数据的计算实例;
图9为本发明实施例的具有热场监控功能的微波消融装置中控制器的工作流程图;
具体实施方式
下面结合附图及实施例对本发明做进一步说明。
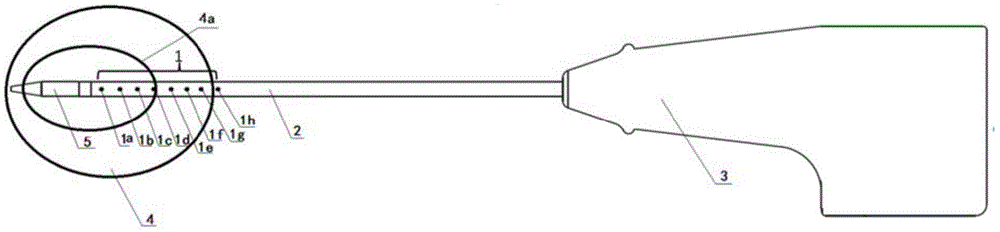
如图1和图2所示,本发明提供了一种具有热场监控功能的微波消融装置,包括微波消融针和控制器6;所述微波消融针具有实时测温功能,能够在手术中实时感知消融区域的温度;所述控制器6具备术前规划及术中热场监控功能。
本发明中,所述微波消融针由针尾至针头依次为手柄3、针杆2、布置于针杆2上的感温元件1和微波发射针头5。
所述感温元件1固定于针杆2外表面,用于消融过程中的组织温度的实时感知。
本发明中,所述感温元件1一般为两个以上,从微波发射针头5一端开始,沿针杆2轴向布置于针杆2外表面且间隔一定距离;所述每个感温元件所处的针杆2外表面通过医学影像显影增强处理过。在本发明实施例中,在针杆2外表面每个感温元件所处的位置处均设置有一圈喷砂环。
本发明还包括输出设备7、输入设备8和微波消融仪9;所述控制器6包括输入输出接口6a、电源管理模块6b、数据采集模块6c、数据处理及分析模块6d和数据存储模块6e;控制器6通过输入输出接口6a与输出设备7、输入设备8,以及微波消融仪9连接;所述电源管理模块6b用于对微波消融装置进行电源管理;所述数据采集模块6c用于从感温元件1采集温度数据,并将采集的数据发送给数据处理及分析模块6d;所述数据存储模块6e中保存有基于肿瘤手术影像学体积数据以及对应的消融能量组的数据库;所述数据处理及分析模块6d用于对数据采集模块6c发送的温度数据实时分析,去处异常数据。所述数据处理及分析模块6d还用于判定肿瘤是否消融完全,以此作为控制器6控制微波消融仪9实时关断的依据。
本发明中,数据存储模块6e中的数据库通过如下步骤建立:
步骤a1,收集一定量手术中切除的肿瘤实体部分;
步骤a2,清除肿瘤表面血液及无关组织并对肿瘤组织称重,对影像学体积数据与肿瘤重量进行相关性分析,拟合出对应的函数关系式y=a*x+b,其中:y代表肿瘤重量,x代表肿瘤影像学体积数据,a、b为通过对多数影像学体积数据与肿瘤重量进行相关性分析得到的常数;
步骤a3,测量单位质量肿瘤中蛋白质含量c;
步骤a4,根据热量计算公式,造成肿瘤组织不可逆凝固性坏死所需热量q、蛋白质质量m、微波消融功率、微波消融时间之间有如下关系:
q=c*m*δt=y*t,
由:m=y*c=(a*x+b)*c,
得:y*t=c*(a*x+b)*c*δt,
其中,c表示蛋白质的比热容,y表示微波消融功率,t表示微波消融时间,c为单位质量肿瘤中的蛋白质含量(实验测得),δt为造成肿瘤组织不可逆凝固性坏死温度与初始温度的差值,y*t称为消融能量组;通过医学影像获得影像学体积数据之后,即能够计算出对应的消融能量组,将影像学体积数据以及对应的消融能量组建成数据库,保存在数据存储模块6e中。
本发明中,所述影像学体积计算方法如下:将患者ct或mr增强扫描的薄层dicom格式数据(层厚为1.0mm)导入影像设备自带的三维数字重建成像系统,在瘤体所在的轴位序列图像上,以计算机阈值分割为基础,辅以人工手动修正,勾画出每幅图像瘤体的轮廓线,最后由计算机通过积分计算肿瘤的影像学体积。
本发明中,所述控制器6通过如下流程实现术前规划功能:输入设备8(例如计算机)通过控制器6的输入输出接口6a将影像学体积数据录入控制器6,控制器6根据影像学体积数据在数据存储模块6e的数据库中匹配出最佳的消融能量组,并通过控制器6的输入输出接口6a发送给输出设备7(例如计算机显示器或者平板电脑),反馈给用户(例如医生)。
本发明中,所述控制器6通过如下流程实现术中热场监控功能:
步骤b1,将微波消融针插入病灶并开启微波消融手术后,数据采集模块6c实时从微波消融针针杆2上布置的感温元件1处采集温度数据并传输给数据处理及分析模块6d;
步骤b2,随着消融时间的延长,消融区域逐渐增大,数据处理及分析模块6d对数据采集模块6c传输来的温度数据进行处理分析,通过如下方式判定异常数据,并去除异常数据:
设定共有n个感温元件,n取值为2或者大于2的自然数,当n取值为大于2的自然数时,记第一个感温元件为距离针头最近的感温元件,第n个感温元件为距离针头最远的感温元件,数据采集模块6c从第n个感温元件采集到的温度数据记为tn,则数据采集模块6c从感温元件采集到的温度数据应有如下关系:t1>t2>t3>……>tn,若tn-2<tn-1,且tn-2>tn,则tn-1为异常数据;
当n取值为2时,即只有两个感温元件,记第一个感温元件为距离针头最近的感温元件,其对应的温度数据为t1,另一个感温元件对应的温度数据为t2,如果t1<t2,则t2为异常数据;
步骤b3,数据处理及分析模块6d调用数据存储模块6e中的影像学体积的数据(此数据预存在数据存储模块6e中),如果肿瘤的影像学体积4的边沿(由于图1和图2是平面视图,因此肿瘤的影像学体积4表示成了一个圆圈,实际中是一个三维区域,这里指的就是三维区域的边沿)与消融针的交叉点温度未达到引起肿瘤不可逆凝固性坏死的温度,表示消融未完全,控制器6控制手术继续进行;若肿瘤的影像学体积4的边沿与消融针的交叉点温度大于或等于引起肿瘤不可逆凝固性坏死的温度,表示消融已完全,此时控制器6会通过输入输出接口6a在输出设备上显示并控制微波消融仪关断。
本发明中,所述针杆2采用医用金属材质,内置射频同轴电缆及冷却水管,外表面涂覆防粘连涂层。所述微波发射针头5采用医用金属材质,外表面涂覆防粘连涂层,具备穿刺及微波发射功能。
实施例
本发明含一种具有实时测温功能的微波消融针、一种具备术前规划及术中热场监控功能的控制器6两部分。
图1为本发明实施例的具有实时测温功能的微波消融针,由针尾至针头依次为手柄3、针杆2、布置于针杆上的感温元件1a、1b、1c、1d、1e、1f、1g、1h及微波发射针头5,此微波消融针(图1)可以在手术中实时感知消融区域的温度,其针杆2外径可用1-3mm,采用医用金属材质(本实施例中采用304不锈钢或者316不锈钢),且外表面涂覆防粘连涂层;感温元件1a、1b、1c、1d、1e、1f、1g、1h可选用光线测温传感器且为多个(本实施例中取8个),从微波发射针头5一端开始,沿针杆2轴向布置于针杆2外表面且间隔一定距离(本实施例中设置为3mm),感温元件1a、1b、1c、1d、1e、1f、1g、1h可以在消融过程中实测组织温度;微波发射针头5外径1-3mm,长度3-22mm,采用医用金属材质(本实施例中采用304不锈钢),外表面涂覆防粘连涂层,具备穿刺及微波发射功能。
图2为具有热场监控功能的微波消融装置总的技术方案,其中,6为控制器,6a为输入输出接口,6b为电源管理模块,6c为数据采集模块,6d为数据处理及分析模块,6e为数据存储模块,7为输出设备,8为输入设备,9为微波消融仪,通过输入设备8将肿瘤的影像学体积4的数据录入控制器6以后,数据处理及分析模块6d会与数据存储模块6e中数据库的数据比对,匹配出最佳治疗能量组(微波消融功率*微波消融时间),并通过输出设备7指示给用户。同时可以在术中监控消融区域的温度并适时关断微波消融仪9,完成微波消融手术的精准治疗。
本实施例通过如下过程建立数据库:
步骤a1,收集2000例肺肿瘤手术中切除的肿瘤实体部分;
步骤a2,用无菌生理盐水清除肿瘤表面血液及无关组织并用电子天平对肺肿瘤组织称重,用pearson分析法对肺肿瘤影像学体积数据与肺肿瘤重量进行相关性分析,拟合出对应的函数关系表达式y1=1.075*x1+0.532,其中:y1代表肺肿瘤重量,x1代表肺肿瘤影像学体积数据(图3所示),图3中,r=0.951(r为概率学中的线性相关系数),并且:
|r|<0.4为低度线性相关;
0.4≤|r|<0.7为显著性相关;
0.7≤|r|<1为高度线性相关.
此处,r大于0.9,非常接近1,说明具有很高的线性相关性;
步骤a3,用凯氏定氮法测得肺肿瘤单位质量肿瘤中蛋白质含量为c1。
步骤a4,根据热量计算公式,造成肺肿瘤组织不可逆凝固性坏死所需热量q1、蛋白质质量m1、微波消融功率、微波消融时间之间有如下关系:
q1=c1*m1*δt1=y1*t1,
由:m1=y1*c1=(ax1+b)*c1,
得:y1*t1=c1*(ax1+b)*c1*δt1
其中,c1表示蛋白质的比热容,y1表示微波消融功率,t1表示微波消融时间,c1为单位质量肿瘤中的蛋白质含量(实验测得),δt1为造成肿瘤组织不可逆凝固性坏死温度与初始温度的差值,y1代表肿瘤重量,x1代表肿瘤影像学体积数据,a、b为通过对多数影像学体积数据与肿瘤重量进行相关性分析得到的常数,y1*t1称为消融能量组;
根据步骤a4所述:
对于本实施例中的肺脏肿瘤得到如下消融能量组与肺脏肿瘤影像学体积数据的关系式:y1*t1=c1*(1.075*x1+0.532)*c1*δt1;
通过医学影像获得影像学体积数据之后,即能够计算出对应的消融能量组,将影像学体积数据以及对应的消融能量组建成数据库,保存在数据存储模块6e中。
方法同上,对于肝脏肿瘤,得到如下消融能量组与肝脏肿瘤影像学体积数据的关系式:y2*t2=c2*(1.413*x2-2.439)*c2*δt2,其中x2代表肝脏肿瘤影像学体积数据,c2表示用凯氏定氮法测得肝脏肿瘤单位质量肿瘤中蛋白质含量,y2表示微波消融功率,t2表示微波消融时间,c2表示蛋白质的比热容,δt2为造成肿瘤组织不可逆凝固性坏死温度与初始温度的差值;
方法同上,对于肾脏肿瘤,得到如下消融能量组与肾脏肿瘤影像学体积数据的关系式:y3*t3=c3*(0.476*x3-0.070)*c3*δt3,其中x3代表肾脏肿瘤影像学体积数据,c3表示用凯氏定氮法测得肾脏肿瘤单位质量肿瘤中蛋白质含量;y3表示微波消融功率,t3表示微波消融时间,c3表示蛋白质的比热容,δt3为造成肿瘤组织不可逆凝固性坏死温度与初始温度的差值;
影像学体积计算方法如下:将患者ct或mr增强扫描的薄层dicom格式数据(层厚为1.0mm)导入影像设备自带的三维数字重建成像系统,在瘤体所在的轴位序列图像上,以计算机阈值分割为基础,辅以人工手动修正,勾画出每幅图像瘤体的轮廓线,最后由计算机通过积分计算肿瘤的影像学体积数据(图6、图7、图8所示)。图6中,肺癌大小2.45x1.54x2.05cm,影像学体积3.807cm3;图7中,肝癌大小约4.56x4.60x3.56cm,影像学体积12.607cm3;图8中,肾癌大小约3.42x3.99x4.01cm,影像学体积27.724cm3。
基于上述描述,对于肺脏、肝脏、肾脏肿瘤得到的影像学体积数据及其对应消融能量组,分别建立独立的数据库,保存在数据存储模块6e中。
图9为本发明实施例的具有热场监控功能的微波消融装置工作流程图,本发明通过此实施例对所述控制器的术中热场监控功能做进一步的阐述:
步骤b1,将本发明所述的一种具有实时测温功能的微波消融针(图1)插入病灶并开启微波消融手术后,数据采集模块6c会从微波消融针针杆2上布置的光纤测温传感器1a、1b、1c、1d、1e、1f、1g、1h处实时采集温度数据,分别记为ta、tb、tc、td、te、tf、tg、th,并传输给数据处理及分析模块6d;
步骤b2,随着消融时间的延长,消融区域4a会逐渐增大(消融区域的边缘温度为60℃,因为60℃为引起肿瘤不可逆凝固性坏死的温度)。数据处理及分析模块6d对数据采集模块6c传输来的温度数据进行处理分析,通过如下方式判定异常数据,并去除异常数据:
如图1所示距离针头最近的感温元件为1a,对应的温度数据为ta,距离针头最远的感温元件为1h,对应的温度数据为th,则数据采集模块6c从感温元件1采集到的温度数据应有如下关系:ta>tb>tc>td>……>th,
若ta<tb,且ta>tc,则tb为异常数据;
同理,若tb<tc,且tb>td,则tc为异常数据;
依此类推。
步骤b3,数据处理及分析模块6d调用数据存储模块6e中的影像学体积4的数据(预存在数据库中),若肿瘤的影像学体积4的边沿与消融针(图1)的交叉点温度未达到引起肿瘤不可逆凝固性坏死的温度60℃,即:tg≥60*(1±5%),th<60*(1±5%),说明消融未完全,控制器6控制手术继续进行;若肿瘤的影像学体积4的边沿与消融针(图1)的交叉点温度大于等于引起肿瘤不可逆凝固性坏死的温度60℃,即:tg≥60*(1±5%),th≥60*(1±5%),说明消融已完全,此时控制器6会通过输入输出接口6a在输出设备7上显示并控制微波消融仪9关断,以达到在最佳治疗效果。
本实施例选取tg、th两个温度值做比对,是因为图2所示的肿瘤的影像学体积4边沿界与消融针针杆2上光纤测温传感器1g与1h之间,同理:如果处于光纤测温传感器1a与1b之间,则选用ta、tb两个温度值做比对,其他同理。针杆2上的感温元件1需要在医学影像下实现显影效果,可通过不同处理方式实现显影效果,本实施例中在针杆2外表面每个感温元件所处的的位置处设置有一圈喷砂环或显影涂层。
本发明提供了一种具有热场监控功能的微波消融装置,具体实现该技术方案的方法和途径很多,以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。本实施例中未明确的各组成部分均可用现有技术加以实现。
- 还没有人留言评论。精彩留言会获得点赞!