一种基于3D打印的细胞均一性分布的生物墨水及其装配方法与流程
本发明涉及一种生物墨水,尤其涉及一种基于3d打印的细胞均一性分布的生物墨水及其装配方法。
背景技术:
随着生物材料技术的进步,生物3d打印作为一项新兴的技术,因其具有较好的生物相容性、可实现生物再生修复等特点,在组织工程领域被寄予很高的应用前景。
其中,生物墨水、生物打印技术及目标生物细胞作为生物3d打印的三大要素被广泛、深入研究。因人体组织结构的多样性、复杂性、精密性,其仿生结构的3d生物打印过程耗时较长,生物墨水中的目标细胞由于重力作用,会下降、沉积在料筒底部,造成打印的组织结构中细胞分布不均。
技术实现要素:
有鉴于现有技术的上述缺陷,本发明所要解决的技术问题是在3d打印过程中,生物墨水中的目标细胞会沉积在料筒底部,导致打印完成的组织结构中细胞分布不均。
为解决上述技术问题,本发明提供了一种基于3d打印的细胞均一性分布的生物墨水,本发明的生物墨水添加了具有较好生物相容性的蚕丝蛋白,明显提高了生物墨水的粘度,使得生物活性细胞能够悬浮至生物墨水中且分布更加均匀。并且在制备生物墨水的过程中,意外的发现将蚕丝蛋白做成微球状加入生物墨水体系中,细胞均一性分布的效果更加明显。
在上述基础上,提出了本发明的技术方案。本发明的生物墨水包括生物墨水本体和悬浮于所述生物墨水本体中的生物活性细胞,所述生物墨水本体包括如下质量百分比的组分:
所述生物活性细胞的数量为1╳106~2╳106个。
优选地,所述蚕丝蛋白微球的粒径为0.1mm~0.4mm。此粒径区间的蚕丝蛋白微球超声混匀后,能够使所在生物墨水体系形成弱交联溶液,便于后续3d打印初步成型。
优选地,本发明的平衡缓冲溶液的ph为7.2~7.4,进一步优选地,为hepes平衡缓冲液,hepes是一种非离子两性缓冲剂,能有效控制ph值,具有较好的缓冲能力,在培养液内含20mmol/lhepes即可达到较好的缓冲能力。
优选地,所述光交联引发剂为光引发剂2959。
优选地,所述生物活性细胞为3t3细胞系或者husmc细胞系,根据实际情况对细胞系进行选择。
本发明的生物墨水固化成型后为水凝胶状态,具有微观纳米纤维网络结构。
为了使本发明生物墨水在3d打印过程中避免生物活性细胞的大量沉降,本发明的另一方面提供一种上述生物墨水的装配方法,通过添加浓度分层、具有较好生物相容性的蚕丝蛋白微球的方法,不同程度增加料筒中各层生物墨水的粘度,同时又不影响生物墨水的本体结构及其孔隙率,不增加因粘度改变而造成的生物打印过程中细胞收到的壁面剪切力带来的细胞损伤,通过增加生物活性细胞在生物墨水中受到的浮力,减缓生物墨水各层面的细胞下沉,改善生物3d打印过程中的细胞沉积现象,包括如下步骤:
(1)配置若干组生物墨水本体备用,若干所述生物墨水本体含有不同质量分数的蚕丝蛋白微球且蚕丝蛋白微球的质量分数依次递增;
(2)将生长状态良好的生物活性细胞等分为若干份,分别加入配置好的若干生物墨水本体中混匀,得到若干组生物墨水;
(3)取一定体积的、步骤(2)中含蚕丝蛋白微球质量分数最低的生物墨水置于料筒底部;
(4)将料筒底部置于冰水浴中,使生物墨水冷却15秒~30秒;
(5)取出料筒,在其余组生物墨水中,取一定体积的含蚕丝蛋白微球质量分数最低的生物墨水置于已凝固的生物墨水上;
(6)循环重复步骤(3)、(4)直至若干组生物墨水装料完毕;
(7)将装有若干生物墨水的料筒置于细胞培养箱中,使生物墨水复温均匀,取出后室温下打印;
(8)打印后采用波长为360nm-390nm的紫外光进行固化,打印完成后进行光交联会使打印成品二次加固成型。
本发明的一优选实施例,本发明的生物墨水的装配方法包括如下步骤:
(1)分别配置含蚕丝蛋白微球质量分数为0.5%,0.75%,1.0%,1.25%,1.5%的五组生物墨水本体备用;
(2)将生长状态良好的生物活性细胞等分为五份,每份为1╳106个,分别加入配置好的若干生物墨水本体中混匀,得到若干组生物墨水;
(3)取1ml、步骤(2)中含蚕丝蛋白微球质量分数为0.5%的生物墨水置于料筒底部;
(3)将料筒底部置于0℃冰水浴中,使生物墨水冷却15秒~30秒;
(4)取出料筒,取1ml含蚕丝蛋白微球质量分数为0.75%的生物墨水置于已凝固的生物墨水本体上;
(5)循环重复步骤(3)、(4)直至五组生物墨水装料完毕,由含蚕丝蛋白微球质量分数由低到高的顺序进行装配;
(6)将装有若干生物墨水的料筒置于细胞培养箱中,使生物墨水复温均匀,取出后室温下打印;
(7)打印后采用波长为360nm-390nm的紫外光进行固化。
优选地,采用如下方法制备生物墨水本体:将所述甲基丙烯酸酐化明胶按一定比例溶解于所述平衡缓冲溶液,加入一定量的光交联引发剂并在40℃~80℃下搅拌均匀,对所得溶液进行消毒,随后降温至20℃~40℃,加入一定量的蚕丝蛋白微球及胎牛血清,在超声作用下混合得到弱交联溶液。本发明的蚕丝蛋白微球经超声混合后,可以形成β折叠弱交联,便于后续的打印成型。
进一步优选地,将所述甲基丙烯酸酐化明胶按一定比例溶解于hepes平衡缓冲溶液,加入一定量的光交联引发剂,在50℃下搅拌,得到混合均匀的溶液,采用pes膜过滤器过滤消毒,随后降温至37℃,最后加入一定量的蚕丝蛋白微球及胎牛血清,搅拌均匀即可。
与现有技术相比,本发明的技术方案具有以下有益效果:
(1)本发明生物墨水的组分都为水溶性,具有良好的生物相容性,不具备细胞毒性,含有生物活性组分,且可被生物降解,在复杂、精细的生物打印及复合细胞生物打印中具有良好的应用前景。
(2)本发明中蚕丝蛋白微球超声混合后,可以形成β折叠弱交联,便于打印成型。
(3)本发明的生物墨水属于非牛顿流体,具有剪切稀变的特性,通过添加蚕丝蛋白微球来增加生物墨水的粘度,在减缓细胞沉积的同时并不增加壁面剪切力对细胞膜造成的损伤,仍能较好的维持打印过程的生物相容性。
(4)本发明的生物墨水固化成型后为水凝胶状态,具有微观纳米纤维网络结构,且添加入的蚕丝蛋白微球对此架构无影响,不影响细胞在其中的粘附、展开、生长、增殖等,在打印成型后予以第二次光固化交联,能较好解决目前生物3d打印水凝胶强度差的问题。
(5)本发明中的生物墨水含有生物活性组分,成型后具有空隙合适的纤维网状结构,可促进和引导细胞的粘附、展开、生长、迁移及增殖行为,具备重建组织结构再生微环境的功能。
(6)在装配时,蚕丝蛋白微球浓度分层分布的生物墨水体系在增加细胞分布的均一性的同时又不增加装料及打印过程对细胞造成的损伤,在改善生物打印过程中细胞沉积的现象具有较好的实用价值,同时能保证打印结构较高的细胞活性及功能。
附图说明
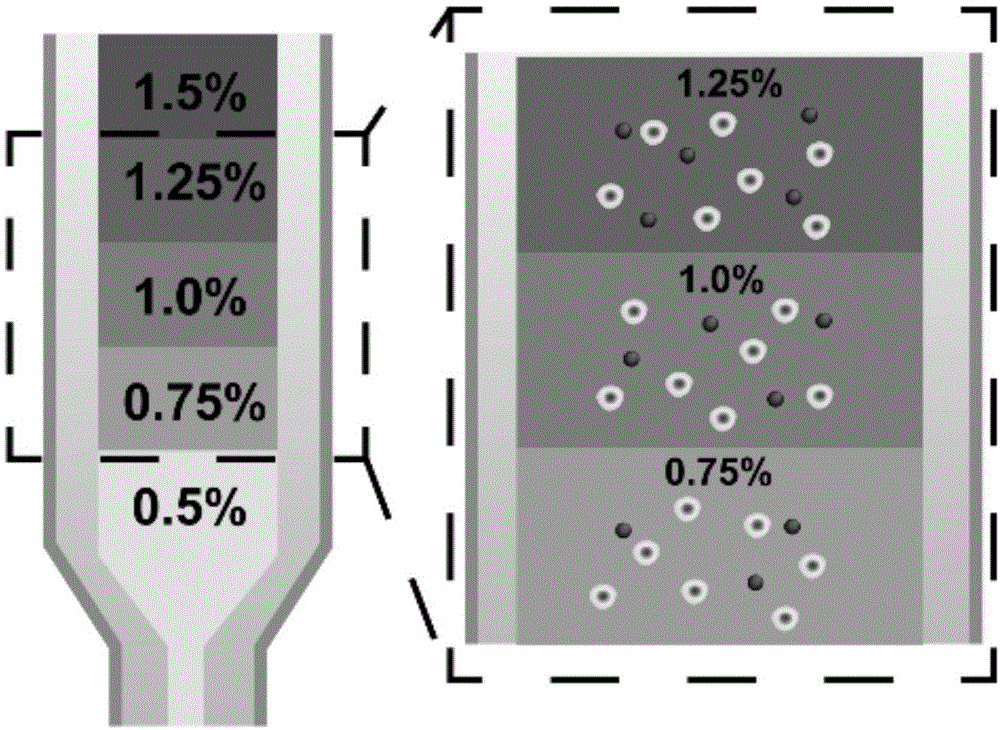
图1为实施例6的含不同浓度蚕丝蛋白微球的生物墨水装料完成的结构示意图;
图2为生物活性细胞在不含蚕丝蛋白微球(2a)、蚕丝蛋白微球浓度均一(2b)、蚕丝蛋白微球浓度分层(2c)的三种生物墨水中的分布状态图;
图3为比较例1(3a)、比较例2(3b)、实施例6(3c)三种生物墨水进行生物3d打印各时间阶段所对应的孔洞中的细胞分布图;
图4为图3的三种不同生物墨水进行生物3d打印各时间阶段所对应的孔洞中的细胞计数值。
以下将结合附图对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
具体实施方式
实施例1
本发明实施例的生物墨水本体a由以下质量分数的组分组成:
本发明实施例的生物墨水本体a的制备方法如下:将甲基丙烯酸酐化明胶按上述比例溶解于hepes平衡缓冲溶液,加入光引发剂2959,在50℃下搅拌,得到混合均匀的溶液,采用pes膜过滤器过滤消毒,随后降温至37℃,最后加入蚕丝蛋白及胎牛血清,超声混合均匀即可。
将1╳106个生物活性细胞加入配置好的生物墨水本体a中混匀,得到生物墨水a。
实施例2
本发明实施例的生物墨水本体b由以下质量分数的组分组成:
本发明实施例的生物墨水本体b的制备方法与实施例1一样。
将1╳106个生物活性细胞加入配置好的生物墨水本体b中混匀,得到生物墨水b。
实施例3
本发明实施例的生物墨水本体c由以下质量分数的组分组成:
本发明实施例的生物墨水本体c的制备方法与实施例1一样。
将1╳106个生物活性细胞加入配置好的生物墨水本体c中混匀,得到生物墨水c。
实施例4
本发明实施例的生物墨水本体d由以下质量分数的组分组成:
本发明实施例的生物墨水本体d的制备方法与实施例1一样。
将1╳106个生物活性细胞加入配置好的生物墨水本体d中混匀,得到生物墨水d。
实施例5
本发明实施例的生物墨水本体e由以下质量分数的组分组成:
本发明实施例的生物墨水本体e的制备方法与实施例1一样。
将1╳106个生物活性细胞加入配置好的生物墨水本体e中混匀,得到生物墨水e。
实施例6
将实施例1~5所制备的生物墨水a~e进行装配,装配方法如下:
(1)取1ml、生物墨水a置于料筒底部;
(2)将料筒底部置于0℃冰水浴中,使生物墨水a冷却30秒;
(3)取出料筒,取1ml生物墨水b置于底层凝固的生物墨水a上;
(4)循环重复步骤(3)、(4)直至生物墨水c~e装料完毕,在装料时按照蚕丝蛋白微球含量由低向高的顺序进行;
(5)将装有生物墨水a~e的料筒整体置于细胞培养箱中,使生物墨水a~e整体复温均匀,取出后室温下打印;
(6)打印后采用波长为360nm-390nm的紫外光进行固化。
图1为实施例6的含不同浓度蚕丝蛋白微球的生物墨水装料完成的示意图,由图1可以看出,各层含不同浓度蚕丝蛋白微球的生物墨水中的生物细胞分布均匀。
比较例1
按实施例1的方法制备不含蚕丝蛋白微球的生物墨水f,并进行装配,装配方法如下:
本发明实施例的生物墨水本体f由以下质量分数的组分组成:
本发明实施例的生物墨水f的制备方法如下:将甲基丙烯酸酐化明胶按上述比例溶解于hepes平衡缓冲溶液,加入光引发剂2959,在50℃下搅拌,得到混合均匀的溶液,采用pes膜过滤器过滤消毒,随后降温至37℃,加入胎牛血清,在超声作用下混合得到弱交联溶液得到生物墨水本体f,将1╳106个生物活性细胞加入配置好的生物墨水本体f中混匀,得到生物墨水f。
本发明实施例的生物墨水f的装配方法如下:
(1)取1ml生物墨水f置于料筒底部;
(2)将料筒底部置于0℃冰水浴中,使生物墨水f冷却30秒;
(3)将料筒及生物墨水f整体置于细胞培养箱中,使生物墨水f整体复温均匀,取出后室温下打印;
(4)打印后采用波长为360nm-390nm的紫外光进行固化。
比较例2
按实施例1的方法制备含蚕丝蛋白微球(粒径为0.1mm)质量分数为0.5%的生物墨水g,并进行装配,装配方法如下:
(1)取1ml生物墨水g置于料筒底部;
(2)将料筒底部置于0℃冰水浴中,使生物墨水g冷却30秒;
(3)将料筒及生物墨水g整体置于细胞培养箱中,使生物墨水g整体复温均匀,取出后室温下打印;
(4)打印后采用波长为360nm-390nm的紫外光进行固化。
比较例2的装配方法与实施例6的装配方法的区别在于,比较例2在装配时,蚕丝蛋白微球分布均一,比较例6装配时,蚕丝蛋白微球浓度分层。
图2显示了生物细胞在不含蚕丝蛋白微球(2a)、蚕丝蛋白微球浓度均一(2b)、蚕丝蛋白微球浓度分层(2c)的三种生物墨水中的分布状态。由图2可知,采用蚕丝蛋白微球浓度分层的方式进行装配,生物活性细胞分散的最为均匀,其他两种当时有一定程度的沉降现象。
将实施例6、比较例1、比较例2装配好的生物墨水在96孔板中进行生物3d打印模拟,分别在打印开始后的第0、5、10、15、20、25分钟所对应的孔洞中进行细胞荧光染色用以计算细胞数量,结果如图3所示。
由图3可知,比较例1中无蚕丝蛋白微球的生物墨水在15min后,生物活性细胞几乎全部沉积;比较例2中蚕丝蛋白微球均一的生物墨水在15min时迅速沉积,在25min时大部分已沉积;实施例6中蚕丝蛋白微球浓度分层的生物墨水在25min时,还有较多的生物活性细胞未沉积,因此,本发明实施例6的生物墨水及装配方式能够很好的减缓生物墨水中生物活性细胞的沉降速率。
图4记录了图3中三种不同生物墨水模拟打印各特定时间点所对应96孔板孔洞中的细胞计数值。若孔洞中的细胞数越少,证明沉积现象越严重。从图4中很明显看出,在25min时,蚕丝蛋白微球浓度分层的生物墨水的细胞数是最多的。
综上所述,本发明技术方案在生物墨水中添加具有较好生物相容性的蚕丝蛋白,并将蚕丝蛋白作成微球,适当增加生物墨水的粘度,提高生物活性细胞在生物墨水中受到的浮力从而使其分布更加均匀。同时,采用分层的装配方式不同程度增加料筒中各层生物墨水的粘度,同时又不影响生物墨水的本体结构及其孔隙率,不增加因粘度改变而造成的生物打印过程中细胞收到的壁面剪切力带来的细胞损伤,通过增加生物活性细胞在生物墨水中受到的浮力,减缓生物墨水各层面的细胞下沉,改善生物3d打印过程中的细胞沉积现象。
本发明技术方案提出的蚕丝蛋白微球浓度分层分布的生物墨水体系在增加细胞分布的均一性的同时又不增加装料及打印过程对细胞造成的损伤,在改善生物打印过程中细胞沉积的现象具有较好的实用价值,同时能保证打印结构较高的细胞活性及功能。
以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术人员无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!