用于治疗食管炎症的ECM水凝胶的制作方法
本申请要求2017年3月2日提交的美国临时申请第62/465,985号的权益,其通过引用整体并入本文。
发明领域
本申请涉及水凝胶领域,具体涉及胞外基质(ecm)水凝胶用于治疗食管炎症(诸如巴雷特食管)的用途。
背景技术:
食管腺瘤(eac)的发病率正迅速升高;超过所有其他癌症的增长率。食管腺瘤(eac)与预后不佳相关,五年生存率低于15%。受影响患者的数量与20世纪70年代相比高出多达600%(dubeczetal.,jgastrointestsurg.2013nov15;prasadetal.,amer.j.gastroentero.105(7):1490-502,2010)。
巴雷特食管(barrett'sesophagus)涉及食管下部(远端部分)的细胞化生,其特征在于由具有杯状细胞的简单柱状上皮代替食管的正常分层鳞状上皮衬里。巴雷特食管与食管腺瘤强相关。认为巴雷特食管的主要诱因是对反流性食管炎所致的慢性酸暴露的适应和反应。在活组织检查之后,巴雷特食管的细胞被分为四大类:非发育不良、低度发育不良、高度发育不良和明显的癌(frankcarcinoma)。通常通过内镜下切除术和内镜下治疗(诸如射频消融术)来治疗高度发育不良和早期腺瘤,而非发育不良和低度患者通常被建议每年接受内镜观察。仍需要能用于治疗食管炎症和巴雷特食管的方法和组合物。
发明概述
公开了抑制受试者的炎症和/或减轻食管炎症效果的方法。还公开了减少食管狭窄的方法。这些方法包括对受试者(诸如患有食管炎症或狭窄或有狭窄风险的受试者)的食管施用治疗有效量的胞外基质(ecm)水凝胶,其中所述ecm水凝胶具有以下特性:a)在约37℃的温度下达到50%凝胶化的时间少于30分钟;b)适合输注到食管中的流动粘度;和c)10-600帕斯卡(pa)的硬度,诸如,但不限于10-70pa。在特定的非限制性实例中,水凝胶可为食管ecm水凝胶。在另一个特定的非限制性实例中,受试者可具有巴雷特食管。
在其它实施方式中,公开了包含食管胞外基质(ecm)水凝胶的组合物,其中所述食管ecm水凝胶具有以下特性:a)在约37℃下达到50%凝胶化的时间少于10分钟;b)足以注入食管中的流动粘度;和c)10-70帕斯卡(pa)的硬度,其中所述组合物被配制为施用于食管。这些组合物用于本文所公开的方法中。
通过参考以下附图进行的以下详细描述,本发明的前述和其它目的、特征和优点将变得更加明显。
附图简述
图1.食管ecm水凝胶粘度曲线。
图2.食管ecm水凝胶硬度。
图3.食管ecm凝胶化时间。
图4a-4c.粘度曲线是组织特异性的。
图5a-5c.凝胶硬度是组织特异性的。
图6a-6c.ecm凝胶化时间是组织特异性的。
图7.ecm水凝胶促进了抗炎细胞因子的分泌。
图8a-8b.ecm促进了上皮和干细胞的趋化性。
图9.eac临床治疗中的动态交互作用。
图10a-10b.水凝胶施用效果。
图11.30日之后的水凝胶施用效果。
图12a-12b.eecm水凝胶的安全性评估。
图13a-13d.组织学。
图14.治疗狭窄的用途。
图15.组织学分析,对照犬。
图16.组织学分析,用ecm水凝胶治疗的犬。
发明详述
当制成水凝胶时,胞外基质(ecm)生物支架具有生物活性(freytesetal.,biomaterials29:1630-7,2008)。然而,ecm水凝胶具有独特的物理和机械特性。这些与众不同的特性将ecm的应用延伸到片状形式可应用的那些之外。与片状形式相比,ecm水凝胶可被递送至形状和尺寸不规则的表面区域,确保ecm与具有不规则拓扑结构的组织接触,不需要固定装置(例如,缝线和支架),并且不会对其植入区域赋予不利的硬度。水凝胶具有如下特性:其在室温下为液体(预-凝胶),但当暴露于体温(37℃)时成为凝胶,使得其容易通过类似针管、导管、冲洗器和探针等的装置递送。
片状形式的ecm已被用于治疗晚期食管发育不良和肿瘤性疾病,然而,对固定装置(即,支架)、片状形式的刚度以及植入的相对侵入性的需要不允许其扩展其应用。ecm水凝胶的与众不同的特性使其可理想地用于食管表面和/或治疗不能用片状形式治疗的食管病。ecm水凝胶的粘弹性和粘膜粘附特性支持其用于治疗食管病的潜力。另外,水凝胶可用于逆转食管中的癌性和癌前病变。
近来,片状形式已被成功用于治疗食管晚期癌性和癌前疾病。对于食管应用,将片材放置于周边并且通过支架固定就位。对于片状形式的使用存在限制,诸如需要固定装置(即,缝线或支架)、其不能充满尺寸不规则的缺陷以及其覆盖面积有限(受限于片的尺寸)。在食管中,这些限制将ecm片的使用局限于治疗晚期食管病,这是经证实可使用临时支架和先进程序的数种情况之一。
所公开的水凝胶可以口服施用到食管。水凝胶可被施用到食管的空腔中以覆盖表面。这是非侵入性应用。在一些实施方式中,应用是口服,例如通过吞咽。在其它实施方式中,应用可以是管饲。在食管组织的表面形成水凝胶。在一些实施方式中,水凝胶覆盖粘膜,并且不会侵入到下面的粘膜下层或肌肉组织中。
本文公开了水凝胶(诸如从食管ecm制成的水凝胶)可用于治疗巴雷特食管和抑制腺癌发展。ecm水凝胶可抑制炎症并且减轻炎症的影响。ecm水凝胶可减轻狭窄。在一些实施方式中,当以约2mg/ml至约20mg/ml(诸如约8mg/ml至约12mg/ml)的浓度使用时,ecm水凝胶是有效的。
术语
除非另外指明,技术术语根据常规用法使用。分子生物学中一般术语的定义可见于:benjaminlewin,genesv,publishedbyoxforduniversitypress,1994(isbn0-19-854287-9);kendrewetal.(eds.),theencyclopediaofmolecularbiology,publishedbyblackwellscienceltd.,1994(isbn0-632-02182-9);和roberta.meyers(ed.),molecularbiologyandbiotechnology:acomprehensivedeskreference,publishedbyvchpublishers,inc.,1995(isbn1-56081-569-8)。
为便于审阅本公开的各种实施方式,提供了以下对特定术语的解释:
酸性蛋白酶:切割肽键的酶,其中酶在酸性ph下具有提高的切割肽键的活性。例如但不限于,酸性蛋白酶可包括胃蛋白酶和胰蛋白酶。
巴雷特食管:食管下部(远端部分)细胞的异常改变(化生或发育不良)。当食管的正常复层鳞状上皮层衬里被带有杯状细胞的简单柱状上皮替代时,诊断为巴雷特食管。在5-15%的寻求胃食管反流病(gerd)的医疗护理的患者中发现巴雷特食管,尽管大部分患有巴雷特食管的患者子群没有症状。巴雷特食管与食管腺癌密切相关,并且被认为是一种癌前状态。认为巴雷特食管的主要原因是对因反流性食管炎所致的慢性酸暴露的适应。在活检后,巴雷特食管的细胞被分为四大类:非-发育不良、低度发育不良、高度发育不良和明显的癌。
碱:具有大于7的ph的化合物或化合物溶液。例如但不限于,碱是碱性氢氧化物或碱性氢氧化物的水溶液。在某些实施方式中,碱是naoh或在pbs中的naoh。
粉碎(捣碎和破碎):将较大颗粒减小到较小颗粒的过程,包括但不限于通过研磨、掺合、切碎、切片、磨碎、切割、切碎。ecm可以任何形式进行粉碎,包括但不限于,水合形式、冷冻、风干、冻干、粉末化、片状形式。
诊断:通过其迹象、症状和多种检查结果鉴定疾病的过程。通过该过程达到的结论也称为“诊断”。通常进行的检查形式包括血液检查、医学影像和活检。
胞外基质(ecm):组织和器官的非细胞组件。天然ecm(多细胞生物(诸如哺乳动物和人类)中发现的ecm)是结构和非结构生物分子的复杂混合物,包括但不限于,胶原、弹性蛋白、层粘连蛋白、糖胺聚糖、蛋白聚糖、抗菌剂、化学引诱物(chemoattractant)、细胞因子和生长因子。在哺乳动物中,ecm通常包含以各种形式存在以干重质量计约90%的胶原。可通过从给定组织或器官中去除细胞来产生生物支架。ecm的组成和结构根据组织的来源而变化。例如,小肠粘膜下层(sis)、膀胱基质(ubm)、食管(e)和肝基质ecm在其整体结构和组成上彼此不同,这是因为每种组织需要独特的细胞龛。完整的“胞外基质”和“完整ecm”生物支架由理想地保留其结构和非结构生物分子的活性的胞外基质组成,包括但不限于,胶原、弹性蛋白、层粘连蛋白、糖胺聚糖、蛋白聚糖、抗菌剂、化学引诱物、细胞因子和生长因子,诸如,但不限于如本文所述的粉碎的ecm。
ecm中的生物分子的活性可被化学或机械地去除,例如,通过化学或酶交联和/或通过透析ecm。完整ecm基本上没有经过酶消化、交联和/或透析,表示ecm在溶解之前没有经历消化、透析和/或交联过程或者没有经历ecm的存储和处理期间自然发生的过程之外的条件。因此,显著交联和/或透析的ecm(除了以基本不影响ecm在本文所述的其用途中的凝胶化和功能特性的微不足道的方式)不被认为是“完整的”。
食管胃十二指肠镜检查(egd)或上胃肠道内镜检查:使胃肠道的任何上部到十二指肠可视化的诊断性内窥镜检查程序。“食管内窥镜检查”是使食管可视化的内窥镜检查程序。食管内窥镜检查有时可作为egd或上胃肠道内窥镜检查的一部分。除非另外明确表明如此,否则这些术语互相并不排斥。
凝胶化:由溶胶形成凝胶。
胃食管反流病(gerd):因胃酸从胃反流到食管中引起的粘膜损伤的慢性症状。gerd通常因胃与食管之间的屏障改变引起,包括下食管括约肌(其通常保持胃顶部(近端部分)闭合)的异常松弛,食管对胃反流阻止作用受损,或食管裂孔疝。这些改变可以是永久性或临时性的。
流动粘度:流体对剪切应力或拉伸应力引起的逐渐变形的抵抗力的量度。粘度是以不同速度移动的流体中流体抵抗流体两个表面之间相对运动的特性。当流体被迫通过管时,组成流体的颗粒通常在靠近管轴处移动较快,而在靠近其壁处移动较慢。需要应力(诸如管两端之间的压力差)以克服颗粒层之间的摩擦以保持流体移动。对于给定的速度模式,所需的应力与流体粘度成比例。用粘度计和流变仪测量粘度。粘度可以帕斯卡秒(pa*s)测量。水在20℃时的粘度为1.002mpa*s。
水凝胶:亲水性的聚合物链的网络,有时发现其是以水为分散介质的胶体凝胶。水凝胶是高吸附性天然或合成的聚合物网络。水凝胶也具有类似于天然组织的一定程度的柔韧性。
炎症:因组织损伤引起的局部反应。炎症的特征在于出现在或迁移到任何组织空间、单元或区域中的任何种类的白细胞的数量超过在正常(健康)环境下在这种组织区域中发现的这类细胞的数量的情况。炎症是因血管组织对有害刺激(诸如病原体、受损细胞或刺激物)的复杂生物反应引起的。
等渗缓冲溶液:缓冲到ph为7.2-7.8之间并且具有促进等渗环境的平衡盐浓度的溶液。
(食管的)低度发育不良和高度发育不良:食管的病理学状况。通常,在食管发育不良中,在食管的内衬中缺少顶部粘蛋白。经常地,在发育不良的上皮中同时可见杯状细胞的缺失和非杯状的柱状细胞中粘蛋白耗尽。在低倍(lowpower)下,这些区域与其他不相关区域相比看起来染色程度更深。
对于高度发育不良,通常存在食管腺体结构的变形并且可标记;其由腺窝的分枝和侧芽(一种粘膜表面的绒毛状构造)组成,或者由上皮的腺体内桥组成,以形成筛状形式的“背靠背”腺体。在粘膜表面存在发育不良的上皮,伴有核极性的丧失,其特征为核的"浑圆(roundingup)",并且核彼此之间缺少一致性关系。
预防或治疗:抑制疾病是指抑制疾病的部分或全部发展,例如在患有诸如因炎症引起的疾病的风险的人中。有患食管腺瘤风险的人的实例是患有巴雷特食管或gerd的人。抑制疾病过程包括预防疾病发展。“治疗”是指改善疾病或病理学状况的迹象或症状的治疗性干预,诸如在其已开始发展之后。
剪切应力:与材料横截面共面的应力分量。剪切应力来自平行于横截面的力矢量分量。计算平均剪切应力的公式是每单位面积的力:
其中τ=剪切应力,f=施加的力,a=材料的横截面积,该横截面平行于所施加的力矢量。
狭窄(stricture):引起吞咽困难的食管狭窄或收紧。食管狭窄的症状包括胃灼热、嘴苦或嘴酸、窒息、咳嗽、呼吸短促、频繁打嗝或嗳气、吞咽疼痛或困难、吐血和/或体重减轻。食管狭窄可由胃食管反流病、食管炎、食管下括约肌功能障碍、运动障碍、碱液摄入或食管裂孔疝引起。在食管手术和其他治疗(如激光治疗或光动力治疗)后可形成狭窄。当该区域愈合时,形成疤痕,导致组织拉扯并收紧,引起吞咽困难。狭窄可以是炎症的结果。钡吞咽试验或上消化道内窥镜检查可用于诊断食管狭窄。
硬度(stiffness):物体或流体的硬度。胞外基质的硬度对于引导细胞的趋硬性(durotaxis)迁移是重要的。硬度可以帕斯卡(pa)为单位,即每平方米一牛顿。
治疗剂:以一般意义使用,其包括治疗剂、预防剂和替代剂。“治疗(treatment)”或”治疗(treating)”是指向患者提供足以可测量地减少、抑制或减轻任何疾病症状,减缓疾病进展或引起疾病消退的量的物质,例如ecm水凝胶。在某些实施方式中,可在患者呈现疾病症状之前开始疾病的治疗。所公开的方法抑制食管炎症和/或减轻食管炎症的影响。
治疗有效量:组合物(诸如ecm水凝胶)的“治疗有效量”表示当被施用给患者时有效提供治疗益处(诸如改善症状、减少疾病进展或引起疾病消退)的量。一定量的特定ecm水凝胶足以在所治疗的受试者中实现所需的效果,诸如抑制炎症和/或减轻这种炎症的影响,诸如狭窄。治疗有效量可被全身性或局部施用,诸如施用到食管。另外,有效量的ecm水凝胶可以单剂量施用,或者随时间以数个剂量施用。然而,有效量将取决于所应用的制剂、所治疗的受试者、痛苦的严重程度和类型以及化合物的施用方式。用于本文所公开的方法中的ecm水凝胶在医药和兽医环境中都有应用。因此,一般术语“受试者”或“患者”应被理解为包含所有动物,包括但不限于,人或兽医学受试者,诸如其它灵长类动物、犬、猫、马和牛。
除非另外说明,否则本文使用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常理解的含义相同的含义。除非上下文另有明确说明,否则单数术语“一/一个/一种(a/an)”和“所述/该(the)”包括复数指示物。类似地,除非上下文另有明确说明,否则词语“或”旨在包括“和”。还应理解,对于核酸或多肽给出的所有碱基大小或氨基酸大小,以及所有分子量或分子质量值是近似的,并且被提供用于描述。尽管与本文描述的那些类似或等同的方法和材料可用于本公开的实践或测试,但下文描述了合适的方法和材料。术语“包括”表示“包含”。术语“约”表示相差5%以内。本文提及的所有出版物、专利申请、专利和其他参考文献都通过引用整体并入。如有冲突,将以本说明书(包括术语解释)为准。另外,材料,方法和实施例仅是说明性的而不是限制性的。
胞外基质(ecm)水凝胶
在例如美国专利号8,361,503中公开了制备ecm水凝胶的方法。任何类型的胞外基质组织可用于制备可在本文所公开的方法中使用的水凝胶(参见涉及ecm的美国专利号4,902,508;4,956,178;5,281,422;5,352,463;5,372,821;5,554,389;5,573,784;5,645,860;5,771,969;5,753,267;5,762,966;5,866,414;6,099,567;6,485,723;6,576,265;6,579,538;6,696,270;6,783,776;6,793,939;6,849,273;6,852,339;6,861,074;6,887,495;6,890,562;6,890,563;6,890,564和6,893,666)。在某些实施方式中,从脊椎动物分离ecm,例如但不限于温血哺乳类脊椎动物,包括但不限于人、猴、马、猪、牛和绵羊。在特定的非限制性实例中,ecm是猪或人的。
ecm可来源于任何器官或组织,包括但不限于膀胱、肠、肝、食管和真皮。在一个实施方式中,ecm是从膀胱分离的。在另一个实施方式中,ecm来自食管。ecm可包括或不包括ecm的基底膜部分。在某些实施方式中,ecm包括至少一部分基底膜。在其他实施方式中,从细胞培养物中收获ecm。可通过两种或更多种组织来源的组合来生产ecm水凝胶。
如美国专利号8,361,503(其通过引用并入本文)中所公开的,通过以下方式制备膀胱ecm(诸如猪膀胱ecm):使用纵向擦拭动作以刀柄和湿纱布摩擦(abrading)膀胱组织以去除包含浆膜层和肌层的外层(腔外层)。在组织片段外翻之后,使用相同的擦拭动作将粘膜层的腔部分与下面的组织分层。在一些实施方式中,防止粘膜下层穿孔。在去除这些组织之后,得到的ecm主要由粘膜下层组成。在wolfetal.,biomaterials33:7028-7038,2012中公开了从去细胞的真皮ecm制备水凝胶,该文献通过引用并入本文。在例如badylaketal.jpediatrsurg.35(7):1097-103,2000和badylaketal.,jsurgres.2005september;128(1):87-97,2005中公开了从食管组织制备ecm,二者均通过引用并入本文。美国专利号6,893,666(通过引用并入本文)公开了从膀胱、皮肤、食管和小肠制备ecm。
在本文所述的方法、装置和组合物中也可使用可商购的ecm制剂。在一个实施方式中,ecm来源于小肠粘膜下层或sis。可商购的制剂包括但不限于:surgisistm、surgisis-estm、stratasistm和stratasis-estm(cookurologicalinc.;indianapolis,ind.)和graftpatchtm(organogenesisinc.;cantonmass.)。在另一个实施方式中,ecm来源于真皮。可商购的制剂包括但不限于pelvicoltm(在欧洲作为permacoltm售卖;bard,covington,ga.)、repliformtm(microvasive;boston,mass.)和allodermtm(lifecell;branchburg,n.j.)。在另一个实施方式中,ecm来源于膀胱。可商购的制剂包括但不限于ubm(acellcorporation;jessup,md.)。
用于制备ecm的源组织可以多种方式收获,在收获之后可使用收获组织的多个部分。也可从食管和小肠制备ecm,并且从这种ecm制备水凝胶,参见,例如,keaneetal.,tissueeng.parta,21(17-18):2293-2300,2015,该文献通过引用并入本文。可通过如下方式制备食管ecm:将粘膜和粘膜下层与外肌层机械分离,并在包含胰蛋白酶的缓冲液中消化粘膜层,随后暴露于蔗糖、
在一个实施方式中,从收获的猪膀胱分离ecm以制备膀胱基质(ubm)。从膀胱去除过量的结缔组织和残余尿液。可通过机械摩擦或通过酶处理、水化和摩擦(abrasion)的组合去除浆膜、肌层外膜、粘膜下层和大部分粘膜肌层。可通过使用纵向擦拭动作的摩擦来完成这些组织的机械去除以去除外层(特别是腔外平滑肌层)乃至粘膜层的腔部分(上皮层)。通过用例如adson-brown镊子和metzenbaum剪刀去除肠系膜组织并使用纵向擦拭动作以包裹在湿纱布中的手术刀手柄或其它坚硬物体擦除肌层和粘膜下层来实现这些组织的机械去除。也可通过将组织浸泡在去上皮溶液(例如但不限于,高渗盐水)中来使粘膜层的上皮细胞脱离。所得的ubm包含粘膜层的基底膜和相邻的固有膜,其用过乙酸进一步处理、冻干并粉末化,参见美国专利号8,361,503。
在一些实施方式中,可通过先将组织在去上皮溶液(诸如盐水,例如但不限于1.0n盐水)中浸泡10分钟至4小时范围内的时间而先将上皮细胞脱层。与高渗盐水溶液接触有效地将上皮细胞从下面的基底膜上去除。在最初的脱层程序之后残余的组织包含上皮基底膜和位于上皮基底膜腔外的组织层。接下来将该组织投入进一步处理以去除大部分腔外组织,但不去除上皮基底膜。通过机械摩擦或通过酶处理、水化和摩擦的组合从剩余的去上皮组织去除外浆膜、外膜、平滑肌组织、粘膜下层和大部分粘膜肌层。
可通过许多标准技术对ecm灭菌,包括但不限于暴露于过乙酸、低剂量γ辐射、气体等离子体灭菌、环氧乙烷处理、超临界co2或电子束处理。更典型地,通过在0.1%(v/v)过乙酸、4%(v/v)乙醇和95.9%(v/v)无菌水中浸泡2小时来获得ecm的灭菌。通过用pbs(ph=7.4)洗涤两次、每次15分钟并用无菌水洗涤两次、每次15分钟来除去过乙酸残余物。可以通过环氧丙烷或环氧乙烷处理、γ辐射处理(0.05至4mrad)、气体等离子体灭菌、过乙酸灭菌、超临界co2或电子束处理对ecm材料灭菌。也可以通过用会导致蛋白质材料交联的戊二醛处理对ecm灭菌,但是这种处理会显著改变材料,使其再吸收缓慢或根本不被再吸收,并引发不同类型的宿主重塑,这种重塑更加类似瘢痕组织形成或包封(encapsulation)而不是建设性重塑。也可用碳二亚胺或脱氢热或光氧化方法诱导蛋白质材料的交联。如美国专利号8,361,503中所公开的,通过在0.1%(v/v)过乙酸(a)、4%(v/v)乙醇和96%(v/v)无菌水中浸泡2小时来对ecm消毒。随后将ecm材料用pbs(ph=7.4)洗涤两次,每次15分钟,并用去离子水洗涤两次,每次15分钟。
在分离目的组织后,通过各种方法进行去细胞化,例如但不限于,暴露于高渗盐水、过乙酸、
ecm的消化溶液通常于室温保持一定时间的恒速搅拌。ecm消化物可立即使用或者在-20℃储存或冷冻,例如但不限于-20℃或-80℃。
一旦ecm溶解(通常基本完全溶解),溶液的ph升高到7.2和7.8之间,并且根据一个实施方式,升高到ph7.4。可使用碱(例如含有氢氧根离子的碱,包括naoh)提高溶液的ph。同样,可使用缓冲液(例如等渗缓冲液,包括但不限于磷酸盐缓冲盐水(pbs))使溶液达到目标ph,或有助于将凝胶的ph和离子强度维持在目标水平,例如生理ph和离子条件。这形成了“预凝胶”溶液。中和的消化溶液(预凝胶)可在接近37℃的温度凝胶化,其中所述温度接近生理温度。该方法通常在凝胶化之前不包括透析步骤,得到更完整的ecm样基质,后者通常在37℃以特定速率凝胶化(参见下文)。
因此,ecm通常可来源于哺乳动物组织,诸如,但不限于来自膀胱、食管或小肠之一。可从两个或更多个组织来源制备ecm水凝胶,诸如2、3或4个组织来源。在一个非限制性实施方式中,将ecm冻干和粉碎。随后将ecm用酸性蛋白酶在酸性溶液中溶解以制备消化的ecm,诸如食管ecm。酸性蛋白酶可以是但不限于胃蛋白酶或胰蛋白酶或其组合。随后可将ecm在适合于蛋白酶或对蛋白酶最佳的酸性ph(诸如,大于约ph2或介于ph和4之间)下溶解,例如在0.01mhcl溶液中。通常使用混合(搅拌、搅动、混合、掺合、旋转、倾斜等)将溶液溶解约12至约48h,取决于组织类型(例如,参见以下实施例)。优选通过以下方式制备ecm水凝胶:(i)粉碎胞外基质,(ii)通过用酸性蛋白酶在酸性溶液中消化来溶解完整的未透析或未交联胞外基质以制备消化溶液,(iii)将消化溶液的ph升高到ph7.2-7.8之间以生产中和的消化溶液(预-凝胶溶液),和(iv)将溶液在目的受试者的食管中在约37℃的温度下凝胶化。
ecm水凝胶在暴露于约37℃的温度下形成凝胶。“预-凝胶”形式的ecm水凝胶可被冷冻和存储在例如但不限于-20℃或-80℃的温度。”预-凝胶”形式的ecm水凝胶可于室温存储,诸如约25℃。因此,ecm水凝胶在低于37℃时为预-凝胶形式,诸如在25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4℃时。ecm水凝胶可被冷冻以存储,因此可在0℃以下存储。本文所用的术语“预-凝胶形式”或“预-凝胶”是指其中ph升高但尚未凝胶化的ecm水凝胶。例如但不限于,预-凝胶形式的ecm水凝胶具有介于7.2-7.8之间的ph。可诸如经口服、经由导管或在内窥镜视角下将ecm水凝胶以预-凝胶形式递送到患有食管炎症的受试者中。
预-凝胶形式的ecm水凝胶适于引入到患者食管中。一旦被引入约37℃的食管,ecm水凝胶凝胶化并涂覆食管。不受理论所限,ecm水凝胶包括多种天然可溶因子,诸如,但不限于,细胞因子。在本文中公开了由多种组织(诸如食管)制成的未透析(全ecm)的具体特性。水凝胶以如下动力学凝胶化:使得ecm水凝胶可经由口服施用、内窥镜施用或经由导管进入食管中,并且水凝胶随后在食管中凝胶化并涂覆食管。
在一些实施方式中,ecm水凝胶具有以下特性:a)在约37℃的温度下达到50%凝胶化的时间少于30分钟;b)适合输注到食管中的流动粘度;和c)i)约10至约300帕斯卡(pa),ii)约10至约450pa;iii)约10至约600pa,iv)约5至约1,000pa,v)约10至1,000pa或vi)约10至约70pa的硬度。
在实施方式中,ecm水凝胶具有以下特性:a)在约37℃的温度下达到50%凝胶化的时间少于30分钟;b)适合输注到食管中的流动粘度;和c)约10至约-300帕斯卡(pa)的硬度。在其它实施方式中,ecm水凝胶具有以下特性:a)在约37℃的温度下达到50%凝胶化的时间少于30分钟;b)适合输注到食管中的流动粘度;和c)约10至约450帕斯卡(pa)的硬度。在其它实施方式中,ecm水凝胶具有以下特性:a)在约37℃的温度下达到50%凝胶化的时间少于30分钟;b)适合输注到食管中的流动粘度;和c)约10至约600帕斯卡(pa)的硬度。
在其它实施方式中,ecm水凝胶具有以下特性:a)在约37℃的温度下达到50%凝胶化的时间少于30分钟;b)适合输注到食管中的流动粘度;和c)约5至约1,000帕斯卡(pa)的硬度。在其它实施方式中,ecm水凝胶具有以下特性:a)在约37℃的温度下达到50%凝胶化的时间少于30分钟;b)适合输注到食管中的流动粘度;和c)约10至约1,000帕斯卡(pa)的硬度。在更多实施方式中,ecm水凝胶具有以下特性:a)在约37℃的温度下达到50%凝胶化的时间少于30分钟;b)适合输注到食管中的流动粘度;和c)10-70帕斯卡(pa)的硬度。
在特定的非限制性实例中,ecm水凝胶是食管水凝胶。在其它特定的非限制性实例中,可从两种或更多种组织来源制备ecm水凝胶。在进一步的非限制性实例中,可从膀胱或小肠制备ecm水凝胶。
在其它具体的非限制性实例中,通过如下方式制备ecm水凝胶:(a)通过用酸性蛋白酶在酸性溶液中消化组织来溶解无细胞胞外基质(ecm)以制备消化的食管ecm;(b)将消化的ecm的ph升高至ph7.2-7.8以生产中和的消化溶液;(c)将消化的ecm稀释到浓度为约2mg/ml至约16mg/ml(诸如约8mg/ml至约12mg/ml)的ecm水凝胶。随后将该水凝胶引入受试者的食管中,在这里其凝胶化。ecm可为食管ecm。
在本文所公开的方法中使用的ecm水凝胶在37℃的温度下达到50%凝胶化的时间少于30分钟,诸如少于29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、1、10、9、8、7、6、5、4、3分钟。在一些实施方式中,ecm水凝胶在约37℃的温度下凝胶化的时间少于10分钟。在其它实施方式中,在约37℃的温度下达到50%凝胶化的时间为约3至约30分钟。在进一步的实施方式中,在约37℃的温度下达到50%凝胶化的时间为约4至约10分钟。在仍然其它的实施方式中,在约37℃的温度下达到50%凝胶化的时间为约5至约10分钟或约10至约20分钟。
所公开的ecm水凝胶可具有适合输注到食管中的流动粘度。在一些实施方式中,ecm水凝胶在0.2/s的剪切率下具有约10至约100pa*s的流动粘度,诸如在0.2/s的剪切率下约10、20、30、40、50、60、70、80或90pa*s。在进一步的实施方式中,ecm水凝胶在0.1/s的剪切率下具有约1至约40pa*s的流动粘度,诸如在0.1/s的剪切率下约1、2、3、4、5、6、7、8、9、10、15、20、25、30、35或40pa*s。
在其它实施方式中,ecm水凝胶在1000/s的剪切率下具有约0.01至约0.20pa*s的流动粘度或约0.01至约0.10pa*s的流动粘度,诸如在1000/s的剪切率下,约0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.10、0.11、0.12、0.13、0.14、0.15、0.16、0.17、0.19或0.2。
在更多实施方式中,ecm水凝胶在100/s的剪切率下具有约0.02至约0.8pa*s或约0.1至约0.8pa*s,诸如约0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.1、0.2、0.3、0.4、0.5、0.6、0.7或0.08pa*s。
在进一步的实施方式中,ecm水凝胶在0.2/s的剪切率下具有约10至约100pa*s的流动粘度和在1000/s的剪切率下具有约0.01至约0.10pa*s的流动粘度。在更多实施方式中,ecm水凝胶具有在0.1/s的剪切率下具有1-40pa*s的流动粘度和在1000/s的剪切率下具有0.01-0.2pa*s的流动粘度。
在其它实施方式中,ecm水凝胶在1/s的剪切率下具有约1至约40pa*s的流动粘度,诸如1至约30pa*s或1至约20pa*s或1至约10pa*s,诸如在1/s的剪切率下约1、2、3、4、5、6、7、8或9pa*s。在1/s的剪切率下,剪切率可为例如10、20、30或40pa*s。在其它实施方式中,ecm水凝胶在100/s的剪切率下具有约0.05至约0.20的流动粘度,诸如在100/s的剪切率下,约0.05、0.06、0.07、0.08、0.09、0.1、0.15或0.2。在1/s的剪切率下流动粘度为约0.1至约25pa*s,并且在100/s的剪切率下为约0.02至约0.8pa*s。在其它实施方式中,流动粘度在1/s的剪切率下为约1至约10pa*s和在100/s的剪切率下为约0.05至约0.20。
在进一步的实施方式中,ecm水凝胶在0.2/s的剪切率下具有约10至约100pa*s的流动粘度。在其它实施方式中,ecm水凝胶在1000/s的剪切率下具有约0.01至约0.10pa*s的流动粘度。在其它实施方式中,ecm水凝胶在0.1/s剪切率下具有约1至约40pa*s的流动粘度和在1000/s的剪切率下为0.01至0.2pa*s。
所公开的ecm水凝胶具有如下硬度:i)约10至约300帕斯卡(pa),ii)约10至约600pa,iii)约5至约1,000pa,iv)约10至1,000pa,或v)约10至约70pa。ecm水凝胶可具有约10至约300帕斯卡(pa)的硬度,诸如约10至约70pa,约10至约100帕斯卡(pa),或约10至约150pa,约10至约200pa,或约10至约250pa。在一些实施方式中,所公开的ecm水凝胶具有约10、15、20、25、30、35、40、45、50、55、60、65或70pa的硬度。在其它实施方式中,所公开的ecm水凝胶可具有约10至约80、90、100、110、120、130、140、150、160、170、180、190、200、210、220、230、240、250、260、270、280、290或300pa的硬度。在进一步的实施方式中,所公开的ecm水凝胶可具有约70、75、80、85、90、95、100、110、120、130、140、150、160、170、180、190、200、210、220、230、240、250、260、270、280、290或300pa的硬度。
在一些实施方式中,水凝胶中的ecm浓度为约2mg/ml至约20mg/ml,诸如约8mg/ml至约12mg/ml或约2mg/ml至约16mg/ml。在其它实施方式中,水凝胶中的ecm浓度为约2、3、4、5、6、7、8、9、10、11、12、13、14、15或16mg/ml。示例性的使用浓度包括但不限于约9mg/ml至约11mg/ml和约10/mg至约12mg/ml。其它示例性的浓度包括约8mg/ml至约10mg/ml,约8mg/ml至约11mg/ml,约8mg/ml至约13mg/ml,约8mg/ml至约14mg/ml,约8mg/ml至约15mg/ml和约8mg/ml至约16mg/ml。进一步的示例性使用浓度还包括约6mg/ml至约12mg/ml,约13mg/ml,约14mg/ml,约15mg/ml或约16mg/ml。
所公开的ecm水凝胶可作为试剂盒的组件提供。ecm水凝胶可以冷冻或冻干形式提供。在一些实施方式中,试剂盒可包含形成水凝胶所需的组件,诸如一个包含水凝胶(诸如冻干形式)的容器,一个包含用于溶解冻干水凝胶的溶液的容器,以及任选地包含用于中和溶解形式的中和溶液的容器。在其它实施方式中,试剂盒可包括包含溶解水凝胶的容器和包含中和剂的第二容器。
任选地,这样的试剂盒包含其它组件,诸如包装、使用说明和多种其它试剂,诸如缓冲液、底物(substrates)或其它治疗成分。试剂盒可包括容器和在容器上或与容器相关的标签或包装说明书(packageinsert)。合适的容器包括,例如,瓶子、小瓶、针筒等。容器可由多种材料形成,诸如玻璃或塑料。容器通常容纳包含ecm水凝胶(诸如冷冻或冻干形式)的组合物,其可有效抑制受试者的食管炎症和/或减轻食管炎症的影响。在若干实施方式中,容器可具有无菌进入口(例如容器可为具有可被皮下注射针刺穿的塞子的静脉内溶液包或小瓶)。标签或包装说明书表明所述组合物用于治疗特定病症,诸如巴雷特食管。
标签或包装说明书通常进一步包含使用说明。包装说明书通常包括经常被包含在治疗产品的商业包装中的说明,其包含与这些治疗产品的使用相关的适应症、使用方法、剂量、施用、禁忌症和/或警告的信息。说明材料可为以电子形式书写的(诸如计算机磁盘或光盘)或可为视觉化的(诸如视频文件)。试剂盒还可包含其它有利于所述试剂盒设计使用的特定应用的组件,诸如针或导管。试剂盒还可包含缓冲液和其它惯常用于特定方法实施的试剂。试剂盒及合适的内容物是本领域技术人员熟知的。
治疗方法
本文公开了治疗食管炎症的方法。还公开了减少食管狭窄的方法。不受理论限制,ecm水凝胶允许治疗早期肿瘤性食管病和发育不良食管病。所公开的水凝胶可用于治疗肿瘤前和肿瘤性食管病。所公开的水凝胶的多用性允许其用于治疗食管灼热、溃疡和可延伸到多个不相连食管区域的其它病理学异常。所公开的水凝胶还可用于治疗长段或分散的食管损伤而无需使用支架或侵入性技术。在这些状况下使用片状形式的ecm是不可行的,因为需要横跨食管表面的多个支架和ecm片。此外,ecm的片和水凝胶形式的主要区别在于活性组分。任何所公开的水凝胶可用于这些治疗方法中。本领域技术人员,例如熟练医师,能够容易地鉴定治疗功效。
因此,可选择患有食管炎症的受试者。可选择患有食管狭窄或处于患食管狭窄风险中的受试者。
在一些实施方式中,受试者看起来是健康的,诸如没有表现出食管腺癌(eac)症状(例如,没有eac和/或先前没有胃食管反流病(gerd)或巴雷特食管)但有食管炎症的受试者。在一些实例中,健康受试者是如果由医学专业人员检查则将被表征为健康且无症状(例如gerd)的受试者。然而,受试者患有食管炎症,例如通过内窥镜施用确定。在一些实施方式中,所公开的方法抑制这种炎症。
在其他实施方式中,受试者患有gerd和/或巴雷特食管。在特定的非限制性实例中,受试者可使用减酸药物(诸如质子泵抑制剂或组胺拮抗剂)来抑制胃食管不适。由于吸烟和/或饮酒,受试者可能面临更大的风险。受试者可具有食管的低度发育不良或高度发育不良。在一些实施方式中,受试者没有食管腺癌。然而,受试者可能处于患食管腺癌的风险中。
在一些实施方式中,所述方法抑制或逆转受试者中食管肿瘤的发展。在其他实施方式中,所述方法恢复受试者食管中的上皮屏障。在进一步的实施方式中,所述方法增加上皮细胞和/或干细胞对受试者食管中损伤部位的趋化性。在进一步的实施方式中,所述方法抑制食管腺癌的发展。在其他实施方式中,治疗允许受试者减少或避免使用质子泵抑制剂和/或组胺拮抗剂药物。然而,所公开的方法可与质子泵抑制剂和/或组胺拮抗剂药物联合使用。
在进一步的实施方式中,与对照(诸如不用ecm水凝胶治疗的受试者)相比,治疗减少了狭窄。与对照(诸如不用ecm水凝胶治疗的受试者)相比,治疗能增加食管的周长(circumference)。
如本文所公开的,ecm水凝胶被保持在等于或低于其凝胶化的温度,例如室温或低于室温(例如,约25℃)。ecm水凝胶可在施用前保持在例如25℃或4℃。然后将有效量的预凝胶形式的ecm水凝胶施用给受试者的食管。ecm水凝胶可以口服施用,使得水凝胶被受试者吞咽并在递送至食管时凝胶化。可使用导管或内窥镜施用将ecm水凝胶直接施用到食管。ecm水凝胶在受试者食管(其处于约37℃的温度)中凝胶化。在一些实施方式中,向受试者施用约5至约60ml的ecm水凝胶,诸如约10ml至约30ml的ecm水凝胶,诸如约10、15、20、25或20ml的ecm水凝胶。ecm水凝胶可以冻干或冷冻形式提供,并且在施用于受试者之前重构(reconstituted)。
所公开的方法包括向受试者(诸如但不限于,患有食管炎症的受试者,或者患有狭窄或有患狭窄风险的受试者)的食管施用治疗有效量的如本文所公开的预凝胶形式的ecm水凝胶,并允许水凝胶在受试者的食管中凝胶化。在一些实施方式中,所述ecm水凝胶:a)在约37℃的温度下达到50%胶凝化的时间小于30分钟,b)适于输注到食管中的流动粘度;c)10-70帕斯卡(pa)的硬度。然而,可使用上文中公开的任何水凝胶。在一些实施方式中,ecm水凝胶可衍生自任何哺乳动物组织,例如但不限于猪或人组织,并且在一些非限制性实例中,可以是膀胱、小肠或食管。上面公开的任何水凝胶可用于治疗受试者的食管炎症和/或用于恢复受试者食管中的上皮屏障。上面公开的任何水凝胶也可用于治疗狭窄。在一些实施方式中,局部递送至表面避免了任何不希望的副作用。在具体的非限制性实例中,受试者患有巴雷特食管或处于患巴雷特食管的风险中。
所公开的水凝胶可以预凝胶形式局部施用到食管粘膜。可使用非侵入性施加方法将水凝胶施用到食管腔以涂覆表面。在一些实施方式中,所述施加是口服,例如通过吞咽预凝胶形式的水凝胶。在其他实施方式中,施用可以是管饲法,其中将预凝胶形式的水凝胶置于所需位置。在一些实施方式中,水凝胶涂覆粘膜,并且不侵入下面的粘膜下层或肌肉组织。
本领域技术人员可容易地配制水凝胶,使得预凝胶形式可被所治疗的受试者吞咽。在另一个实施方式中,通过内窥镜提供预凝胶形式的水凝胶,以确保药物被局部递送,诸如,将其特别地递送到需要治疗的食管区域。例如,水凝胶的局部递送可通过内窥镜/胃镜。通常,对食管粘膜进行局部递送,以便非侵入性地递送预凝胶形式的水凝胶。水凝胶在表面凝胶化并涂覆粘膜的所需区域。在一些实施方式中,ecm水凝胶凝胶化并提供保护屏障以保护粘膜。
在一些实施方式中,可对目的受试者进行食管胃十二指肠镜检查(egd)或上胃肠道内窥镜检查。这些程序可在施加水凝胶之前进行,选择目的受试者。这些程序也可以在使用所公开的方法之后进行,以评估对受试者的影响,并确定是否需要其他应用。
示例性的实施方式
条款1.在受试者中抑制食管炎症或减少食管狭窄的方法,包括对患有食管炎症的受试者的食管施用治疗有效量的胞外基质(ecm)水凝胶,其中ecm水凝胶具有以下特性:a)在约37℃的温度下达到50%凝胶化的时间少于30分钟;b)适合输注到食管中的流动粘度;和c)如下硬度:i)约10至约300帕斯卡(pa),ii)约10至约450pa;iii)约10至约600pa,iv)约5至约1,000pa,v)约10至1,000pa,或vi)约10至约70pa,由此在受试者中抑制食管炎症或减少食管狭窄。
条款2.如条款1所述的方法,其中在约37℃下达到50%凝胶化的时间为约3至约30分钟。
条款3.如条款1所述的方法,其中在约37℃下达到50%凝胶化的时间为约3至约10分钟。
条款4.如条款2所述的方法,其中达到50%凝胶化的时间为约4至约10分钟。
条款5.如条款1-4中任一项所述的方法,其中流动粘度在约0.1/s的剪切率下为约1至约40pa*s,并且在1000/s的剪切率下为约0.01至约0.2pa*s。
条款6.如条款1-4中任一项所述的方法,其中流动粘度为在1/s的剪切率下为约0.1至约25pa*s,并且在约100/s的剪切率下为约0.02至约0.8pa*s。
条款7.如条款1-6中任一项所述的方法,其中ecm水凝胶具有10-70pa的硬度。
条款8.如条款1-7中任一项所述的方法,其中ecm水凝胶是食管ecm水凝胶。
条款9.如条款1-8中任一项所述的方法,其中水凝胶中的ecm浓度为2mg/ml至约16mg/ml。
条款10.如条款1-9中任一项所述的方法,其中ecm水凝胶经口服、内窥镜或经由导管施用。
条款11.如条款1-10中任一项所述的方法,其中ecm水凝胶通过以下方式制成:(a)通过在酸性溶液中用酸性蛋白酶进行组织消化来溶解去细胞的胞外基质(ecm)以制成消化的食管ecm;和(b)将消化的食管ecm的ph升高至介于7.2-7.8之间的ph以产生中和的消化溶液。
条款12.如条款11所述的方法,其中(b)将消化的ecm的ph升高包括添加碱或等渗缓冲液以升高消化的ecm的ph。
条款13.如条款10或条款11所述的方法,其中酸性蛋白酶是胃蛋白酶、胰蛋白酶或其组合。
条款14.如条款1-13中任一项所述的方法,其中在施用给受试者之前将ecm水凝胶保持在25℃或以下。
条款15.如条款1-14中任一项所述的方法,其中受试者患有巴雷特食管或处于巴雷特食管的风险中。
条款16.如条款15所述的方法,其中所述方法抑制受试者的食管瘤发展。
条款17.如条款1-16中任一项所述的方法,其中ecm水凝胶恢复受试者食管中的上皮屏障。
条款18.如条款1-17中任一项所述的方法,其中ecm水凝胶提高了上皮细胞和/或干细胞向受试者食管损伤部位的趋化性。
条款19.如条款1-18中任一项所述的方法,其中ecm水凝胶在受试者中减少食管狭窄。
条款20.包含胞外基质(ecm)水凝胶的组合物,其中ecm水凝胶具有以下特性:a)在37℃下,达到50%凝胶化的时间少于10分钟;b)足以注入食管中的流动粘度;c)如下硬度:i)约10至约300帕斯卡(pa),ii)约10至约450pa;iii)约10至约600pa,iv)约5至约1,000pa,v)约10至1,000pa,或vi)约10至约70pa,并且其中组合物被配制为施用于食管。
条款21.如条款20所述的组合物,其中在37℃下达到50%凝胶化的时间为:a)约3至约30分钟;b)约4至约10分钟;或c)约3至约10分钟。
条款22.如条款20或21所述的组合物,其中水凝胶具有约10至约70pa的硬度。
条款23.如条款20-22中任一项所述的组合物,其包含约2mg/ml至约16mg/ml的ecm水凝胶。
条款24.如条款21-23中任一项所述的组合物,其中ecm水凝胶通过以下方式制成:(a)在酸性溶液中使用酸性蛋白酶进行食管组织消化来溶解去细胞的胞外基质(ecm)以产生消化的食管ecm;(b)将消化的食管ecm的ph升高到ph介于7.2-7.8之间以生产中和的消化溶液;和(c)将消化的食管ecm的稀释到浓度为约8mg/ml至约12mg/ml的ecm水溶胶。
条款25.如条款24所述的组合物,其中(b)升高消化的ecm的ph包括添加碱或等渗缓冲液以调整消化的食管ecm的ph。
条款26.如条款24或条款25所述的组合物,其中酸性蛋白酶是胃蛋白酶、胰蛋白酶或其组合。
条款27.如条款20-26中任一项所述的组合物,其中ecm水凝胶被保持在25℃或以下。
条款28.如条款20-27中任一项所述的组合物,其用于在受试者中抑制食管炎症。
条款29.如条款20-27中任一项所述的组合物,其用于在受试者的食管中恢复上皮屏障。
条款30.如条款28或条款29所述的组合物,其中受试者患有巴雷特食管。
条款31.如条款20-27中任一项所述的组合物,其用于在受试者中减少食管狭窄。
条款32.一种试剂盒,其包含:a)容器,其中所述容器包含如条款20-31中任一项所述的组合物或其冻干形式;和b)该组合物的使用说明。
通过以下非限制性实施例说明本公开。
实施例
粘膜炎症或粘膜炎是一种炎性病症,其特征在于胃肠道粘膜衬里的肿胀、刺激和不适。粘膜炎可导致能遍布于胃肠道存在的糜烂或溃疡。作为经常涉及感染和/或溃疡的粘膜衬里的炎症,粘膜炎是严重且经常疼痛的病症。本文公开了胞外基质(ecm)水凝胶是治疗粘膜炎症(例如食管炎症)的潜在治疗剂。ecm水凝胶可提供防止粘膜连续损伤的保护屏障,促进抗炎环境,和/或促进受损和发炎粘膜的修复。
实施例1
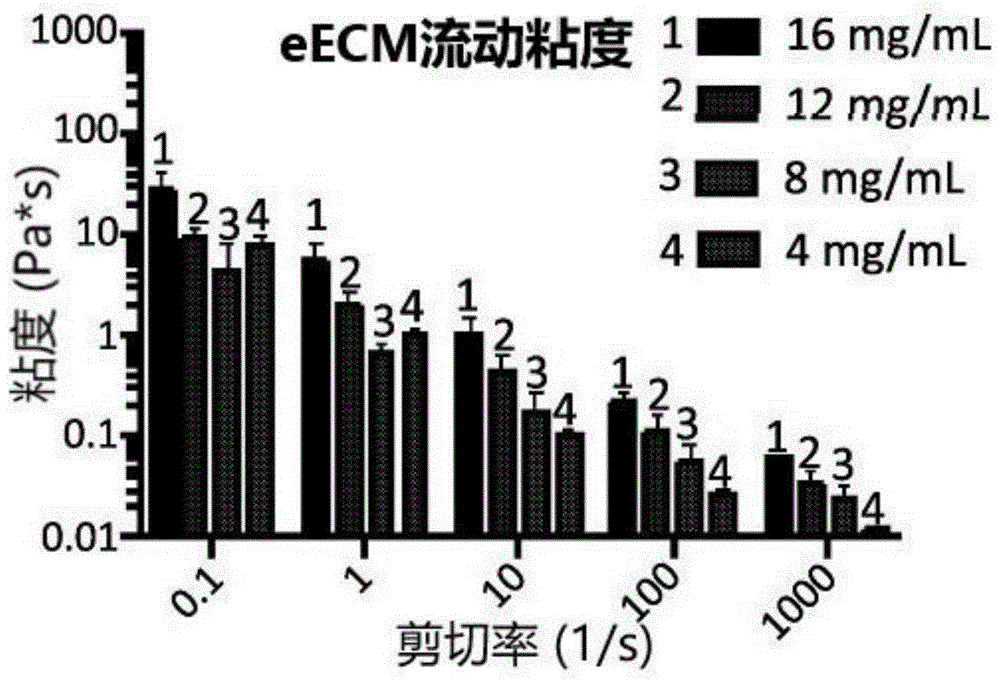
水凝胶的粘弹性特性
对一定ecm浓度范围(4-16mg/ml)内的同源食管ecm(eecm)水凝胶进行流变学检测。将样品置于10℃(远低于凝胶化温度的温度)的流变仪上,并进行稳态流动测试(剪切率0.1-1000l/s)以测定ecm预凝胶的粘度曲线(图1)。
在每个剪切率下,粘度随着ecm浓度的增加而增加,并且ecm预-凝胶是剪切稀化的(粘度随着剪切率的增加而降低)。剪切稀化是ecm预-凝胶的良好特性,所述ecm预凝胶可以通过导管注射,在这里它可经历10-1000l/s的剪切率范围。在视频中获得了可注射性的进一步证据,其显示ecm预凝胶(食管ecm和ubm,测试了8-12mg/ml,蓝色染色)均可通过口服灌胃法(5fr大小,~15.9g)注入。然后将温度迅速升至37℃以诱导凝胶化,并在37℃进行时间扫描(0.5%振荡应变)以测量凝胶硬度(图2)和凝胶化时间(图3)。图2显示形成的ecm水凝胶的存储模量(g')或“硬度”随着ecm浓度的增加而增加。对于形成的ecm水凝胶的损耗模量(g”)或粘性组分观察到类似趋势。在时间扫描测试期间测量达到50%凝胶化的时间(图3)。eecm显示了浓度依赖性凝胶化时间,即凝胶化时间随ecm浓度的增加而降低。
对两种异源ecm水凝胶进行流变学检测:膀胱基质ecm(ubm)和皮肤ecm(mirm5)。在图4-6中显示了与同源食管ecm(eecm)水凝胶相比的粘弹性特性。
eecm
ubm
decm
类似于图1所述地进行稳定剪切试验。真皮ecm(图4b)和ubm(图4c)显示了随着ecm浓度增加而浓度依赖性增加的粘度以及ecm水凝胶的剪切稀化曲线,即粘度随着每种ecm浓度的剪切率增加而降低。粘度范围对于每种组织类型是不同的。
ubmecm(图5c)显示了与食管ecm(图5a)类似,随着ecm浓度的增加,存储模量(硬度)增加。真皮ecm(图5b)在4mg/ml的低浓度下不形成水凝胶,表明并非所有来自不同组织来源的ecm水凝胶表现都相似。三种ecm水凝胶的硬度范围是不同的。
真皮ecm(图6b)显示了浓度依赖性的凝胶化时间,即凝胶化时间随ecm浓度增加而降低,类似于食管ecm(图6a),而ubm显示了非浓度依赖性的凝胶化时间,即凝胶化时间对于所有ecm浓度保持恒定(图6c)。不同的凝胶化曲线进一步证明了源自不同组织来源的ecm水凝胶的可变性。因此,食管水凝胶提供独特的性质,并且可以各种浓度使用,例如但不限于8mg/ml至约12mg/ml。
实施例2
用ecm水凝胶治疗粘膜炎症
粘膜炎症或粘膜炎是一种炎性病症,其特征在于胃肠道粘膜衬里的肿胀、刺激和不适。粘膜炎可导致能遍布于胃肠道存在的溃疡。作为经常涉及感染和/或溃疡的粘膜内衬里的炎症,粘膜炎是严重且经常疼痛的病症。
粘膜炎通常作为例如癌症化疗或放疗的并发症来发展。癌症治疗中的辐射和化疗的目标-杀死快速分裂的癌细胞-也会影响粘膜衬里区域(例如胃肠道)的上皮细胞,导致粘膜炎。暴露于辐射和/或化疗剂通常导致粘膜上皮和下面的结缔组织中细胞完整性的显著破坏,导致粘膜部位的炎症、感染和/或溃疡,例如在食管和胃肠道的其他部分。
胞外基质(ecm)水凝胶是治疗粘膜炎症的治疗剂。不受理论束缚,ecm可支持粘膜愈合的机制是:(1)通过形成提供对粘膜连续损伤的保护性屏障的水凝胶,(2)通过促进抗炎环境,和/或(3)通过促进受损和发炎粘膜的修复。如实施例1中所公开的,研究了食管水凝胶的性质。
当巨噬细胞暴露于ecm水凝胶时,其引发主要是抗炎的分泌细胞因子谱,包括升高水平的pge2(图7)。抗炎细胞因子的水平根据ecm来源的组织而变化。食管水凝胶提供强抗炎作用。
粘膜修复不仅需要炎症减少,还需要重建上皮屏障和/或物理屏障。ecm水凝胶可通过增加上皮细胞和干细胞的趋化性来促进上皮屏障的恢复。暴露于ecm的巨噬细胞的分泌产物增强了上皮细胞的迁移(图8a)。此外,ecm水凝胶直接促进食管干细胞的趋化性;这些效果取决于ecm来源的源组织(图8b)。食管干细胞优先向食管ecm和小肠ecm迁移。图9显示了巴雷特食管的示例性治疗。
图10a显示了口服后40分钟的效果,无论是否正常吞咽,水凝胶仍然涂覆粘膜并且可被鉴定。这是为了测试凝胶的体内粘膜粘附性以确认口服吞咽是有效的。如图10b所示,使用导管和内窥镜,将水凝胶递送到食管内的指定位置(在这种情况下为环形状)。由此,将水凝胶递送到食管内的特定局部位置。
图11还显示了水凝胶治疗的效果。上排是在患有食管炎症的动物中持续回流至少三个月的结果。左侧的三只犬用奥美拉唑(质子泵抑制剂)和食管ecm水凝胶治疗。最后一只动物(右图)仅用奥美拉唑治疗。治疗30天后,在接受ecm水凝胶的三只动物中可看到食管炎症的改善。仅接受奥美拉唑的动物未见改善(灰色框,右图)。
图12a-12b显示了ecm水凝胶的安全性评估。这些动物经历了增加酸反流以产生食管炎、随后产生巴雷特食管的过程。8只动物中没有一只在手术后体重减轻以引发be,在用水凝胶治疗期间也没有(图12a)。分析生理参数。在每天两次施用水凝胶30天后,动物的生理参数是稳定的并且不超出正常范围(图12b)。
在用ecm治疗之前的动物模型中,将用ecm水凝胶治疗的犬和不用ecm水凝胶治疗的犬都发展出柱状化生(图13a和13b)。在用ecm+奥美拉唑治疗后,接受治疗的犬得到改善并且没有看到柱状化生(图13c)。在未用ecm水凝胶治疗的对照动物中,在相同区域存在伴有小片鳞状上皮的柱状化生(图13d)。
实施例3
用ecm水凝胶治疗狭窄
材料和方法
在两只杂种犬中使用emr和esd技术的组合(nieponice,2009,18657808)进行5cm纵向宽度的全周粘膜切除。接受评估的治疗是每天两次施用ubm水凝胶和未治疗的对照。如果动物出现任何狭窄的临床症状或已达到术后1个月,则进行内窥镜检查。根据对动物的内窥镜检查结果,如果可能和必要,进行扩张。如果动物在球囊扩张后出现严重狭窄或达到2个月时间点,则对动物实施安乐死。在尸检时,测量动物组织以测定狭窄,并收集样品用于组织学分析。该动物模型允许测量以下终点:
1.切除区域的内窥镜检测外观
2.食管测量
3.最终时间点的组织学评估
手术程序和术后护理
每只犬用乙酰丙嗪(0.01mg/kg,sc)和氯胺酮(5-11mg/kg)诱导,并且用1-5%异氟烷通过气管内管保持手术平面麻醉。诱导后,将动物移至手术台并放置在无菌手术室内。在整个过程和观察中,对动物输注2ml/kg/h的乳酸林格氏溶液。通过置于动物下方的温水循环加热垫控制温度。在手术过程中监测生理参数,如心脏、呼吸率、体温和反应性。在开始手术前施用25mg/kg头孢唑啉的抗生素预防。
将动物置于仰卧位,用pentaxeg3430k内窥镜评估食管。测量从嘴到ge连接处的距离。在鉴定食管中的参考点后,使用olympusinjectorforce4mm23g针头注射盐水以分离粘膜和粘膜下层。使用esd和loopemr技术去除长度为5cm的粘膜的整个圆周(100%)。通过将液体或ecm注入粘膜/粘膜下层以将粘膜与粘膜下层分离,然后使用内窥镜tt刀切割该区域来完成esd技术。为进行emr,使用具有结扎带的cookduette试剂盒。然后使用勒除器(snare)切除粘膜。使用spotendoscopicmarker来标记切除区域。
在去除粘膜后,在该过程中,使用milaedc190内窥镜输送导管将50ml的12mg/mlubm水凝胶递送和施加到切除区域。将动物在麻醉下保持5分钟以使水凝胶凝胶化。手术后,回收动物并观察。
在手术和停止吸入麻醉后,连续监测动物24小时。每12小时测定并记录体温。将动物保持温暖和干燥以防止体温过低并且每半小时旋转一次直至它们保持胸骨位置。
将犬放在与其他动物独立的房屋中,直到动物稳定,然后放入正常生活设施中。在每次手术程序后施用丁丙诺啡(0.005-0.01mg/kgim或iv,q12h)5天以缓解疼痛,如果存在疼痛迹象则继续施用5天,并且施用头孢氨苄(35mg/kgq12)5天。
在程序后直到研究结束,监测动物的食管狭窄迹象(如食物消耗减少、体重减轻)和窘迫迹象,如通过呼吸形态增加、声音表达、催吐事件或吞咽食物困难和/或活动减少所确定的。如果存在这些迹象,则用对比食管造影术和/或内窥镜检查评估动物。
内窥镜监测和球囊扩张
在最初手术后一个月,如果存在任何狭窄的临床症状,则对动物进行内窥镜检查。另外,所有动物在安乐死之前进行内窥镜检查。用乙酰丙嗪(0.1-0.5mg/kg)诱导麻醉,并用异氟烷(1-5%)保持以进行内窥镜检查。
如果在内窥镜检查期间动物被诊断为轻度或中度狭窄,则进行球囊扩张。为进行扩张程序,使用olympus20mm球囊扩张器。在内窥镜引导下,用约10ml的无菌0.9%nacl溶液使球囊膨胀直到能鉴定中等或显著量的阻力,保持膨胀30-60秒。在扩张后,使用milaedc190导管立即将50mlecm施加到受损区域并使其凝胶化5分钟。在该过程之后,对动物禁食或禁水至少1小时。
ecm递送
使用60ml导管尖端注射器在15℃将ecm口服递送给动物。从第0天开始每天递送50ml两次直至研究完成。每次递送水凝胶后,对动物禁食或禁饮1小时。
尸检
在尸检时,如前所述地进行内窥镜检查。通过在麻醉下施用戊巴比妥钠iv(390mg/kgbw)进行安乐死。确认死亡后,收获食管,保持与体内相同的尺寸。间隔0.5cm获取食管测量结果并记录。
用ecm水凝胶治疗狭窄。如图14所示,在粘膜全周切除模型中(与巴雷特食管模型不同),用ecm水凝胶治疗动物长达81天。对照动物患有无法治愈的严重狭窄,并在14天后被安乐死。用ecm治疗的动物在第21天患有食管狭窄,使其接受扩张。在扩张后两个月,处死动物并进行食管测量。与对照相比,用ecm治疗的动物具有更宽的内周和更少的周长减少。
如图15所示,对照动物在14天时显示出无组织的胶原沉积,在产生粘膜切除的中心处具有高细胞浸润和侵蚀。如图16所示,接受治疗的动物在缺损中心显示出重新上皮化,具有较低的细胞浸润和更有组织和致密的胶原沉积。
鉴于所公开发明的原理可应用于许多可能的实施例,应该认识到所示实施例仅是本发明的优选实例,并且不应被视为限制本发明的范围。相反,本发明的范围由以下权利要求限定。因此,我们主张我们的发明为所有属于这些权利要求的范围和精神内的那些。
- 还没有人留言评论。精彩留言会获得点赞!