增强肾脏类器官发育的方法及其使用方法与流程
相关申请
本专利文献根据35u.s.c.§119(e)要求2017年6月9日提交的美国临时专利申请第62/517,536号的申请日权益,该美国临时专利申请通过引用并入本文。
联邦资助的研究或开发
本发明是在以下合同号的政府支持下完成的:由nationalinstitutesofhealth(nih)授予的合同第dk007527、u01dk107350、dk039773和tr002155号;由nih(re)buildingakidneyconsortium授予的合同第u01dk107350号;由officenavalresearchvannevarbushfacultyfellowshipprogram授予的合同第n000141612823号;以及由nihsupportingthewashingtonuniversityktrc授予的合同第p30dk079333号。
经由efs-web提交的序列表引用
该申请经由efs-web电子提交,并且包括以.txt格式电子提交的序列表。该.txt文件包含创建于2018年6月7日的序列表“hu6909sequencelisting”,大小为12,000字节。此.txt文件中包含的序列表是说明书的一部分,并且通过引用以其整体并入本文。
背景技术:
描述了增强肾脏类器官的发育的方法及其使用方法。
慢性肾病(ckd)在美国影响超过1,900万人,并且经常是涉及肥胖、糖尿病和高血压的代谢紊乱的结果。增长率可归因于高血压和非胰岛素依赖型糖尿病继发的肾衰竭的发展。例如,三分之一的糖尿病患者会发展为肾病。
现在全世界有超过200万人需要肾脏替代治疗以维持生命,但这可能只占需要该治疗的人的不到10%。另外112个国家中合计超过6亿的人根本无力负担肾脏替代治疗的费用,导致每年超过100万人因未治疗的肾衰竭而死亡。
慢性肾衰竭在人类和一些家养动物中普遍存在。肾衰竭的患者不仅经历肾功能丧失(尿毒症),而且由于骨髓不能经由红细胞生成产生足够数量的红细胞(rbc)而发展为贫血。
迄今为止,用于治疗慢性肾衰竭的临床方法包括透析和肾移植以恢复肾脏过滤和尿液产生,以及全身递送重组促红细胞生成素(epo)或epo类似物以恢复红细胞质量。透析为中晚期肾衰竭患者提供生存益处,但会导致严重的生活质量问题。对于晚期肾衰竭患者来说,肾移植是非常需要(且通常是唯一)的选择,但是,高质量的供体肾的供应不能满足肾衰竭人群的需求。例如,目前在美国有超过10万人在等待肾移植。
源自例如人多能干细胞(hpscs)的肾脏类器官(renalorganoids)为研究基本的肾发育、药物毒性和疾病建模提供了新平台。此外,它们可用作从自体和异体来源产生更大的肾组织和新的肾脏再生疗法的构建。在这些系统中概括的细胞异质性和肾小管结构是值得注意的,并且最近的研究表明,在将来源于类器官的足细胞移植到scid小鼠后,可形成具有宿主内皮细胞的血管化的肾小球。然而,在当前的体外类器官系统中,肾小球发育不完善,血管系统既不能灌注也不能纵向维持活力,从而限制了相关应用的程度,并限制了它们向人体内生理学的可翻译性。
因此,仍然需要增强肾脏类器官并克服这些限制的方法。具有更好地模拟体内发育的可灌注血管网络的增强型肾脏类器官可用于多种应用,包括但不限于肾病模型、肾小球疾病模型、药物毒理学研究、药物筛选模型、活透析设备、透析辅助设备以及可植入这些构建体以替代部分或全部肾功能的再生应用。
技术实现要素:
一些实施方式涉及生成血管化的肾组织构建体、类器官或在构建体中的类器官的方法,该方法包括在细胞培养基中培养细胞群以产生发育中的类器官,并将该发育中的类器官暴露于流体灌注以施加壁剪切力,或者换言之,流体剪切应力(fss)。施加fss在肾脏类器官中诱导血管发育以及肾小管和肾小球成熟,从而产生血管化的肾组织构建体、类器官或在构建体中的类器官。细胞群可以包括多能干细胞(pluripotentstemcells)、专能干细胞(multipotentstemcells)、祖细胞、终末分化细胞、内皮细胞、内皮祖细胞、肾单位祖细胞、永生化细胞系或原代细胞中的至少一种。细胞群包括人类胚胎干细胞(hesc)或人诱导多能干细胞(hipsc)中的至少一种。在该方法中,在施加fss的同时进行培养。在该方法中,在带有基材的可灌注芯片或摇摆器(rocker)上或通过使用旋转式生物反应器进行培养。下层基材(substrate)可以是塑料、丙烯酸材料、石英或玻璃。可以对下层基材进行等离子体处理或用一层以下物质中的至少一种涂布:基质胶、聚l-赖氨酸、geltrex、明胶、nitogen、纤连蛋白、胶原蛋白i、胶原蛋白iv、纤维蛋白原、甲基丙烯酸明胶、纤维蛋白、蚕丝、聚乙二醇化凝胶、甲基丙烯酸胶原蛋白、基底膜蛋白或任何其他生物材料。基材可以是明胶、纤维蛋白或胶原蛋白i的任何组合或任何其他基底膜蛋白。在该方法中,在施加fss的同时培养至少1天至最多200天。该方法可以进一步包括将发育中的类器官嵌入胞外基质材料(ecm)或基材中,其中所述嵌入包括以下步骤中的至少一项:将发育中的类器官放置在ecm顶上或将发育中的类器官嵌入ecm中。胞外基质材料可以是以下的至少一种:基质胶、聚l-赖氨酸、geltrex、明胶、nitogen、纤连蛋白、胶原蛋白i、胶原蛋白iv、纤维蛋白原、甲基丙烯酸明胶、纤维蛋白、蚕丝、聚乙二醇化凝胶、甲基丙烯酸胶原蛋白、基底膜蛋白或任何其他生物材料,或其组合。细胞培养基可以包含以下的至少一种:基础培养基、胎牛血清(fbs)、fgf9、chir、dorsomorphin、激活素a或视黄酸。fbs的浓度可以在约0.1%至约10%fbs范围内。fbs的浓度可以在约1%至约2%fbs范围内。fbs的浓度可以为约1.5%fbs。在该方法中,流体灌注在fss下为约0.001dyn/cm2至约50dyn/cm2;或者,在fss下的灌注为约0.01dyn/cm2至约10dyn/cm2。在该方法中,暴露步骤包括在1至200天的任意范围内连续或恒定地施加fss。在该方法中,fss可以是脉冲式的,以模拟常规心跳期间的血压变化。该方法可以进一步包括将发育中的类器官暴露于一种或多种生物剂、生物剂梯度、压力和/或氧张力梯度,从而诱导去往和/或来自肾脏类器官的毛细血管的血管新生、血管生成或小管形成。一种或多种生物剂、生物剂梯度、压力和/或氧张力梯度可以进一步指导发育中的类器官的发育、分化和/或作用。该方法可以进一步包括将发育中的类器官嵌入组织构建体中,包括:在基材上沉积一根或多根牺牲丝以形成血管图案,每条牺牲丝都包含逃逸墨水;在血管图案内沉积或打印发育中的类器官;用胞外基质组合物至少部分地围绕血管图案和/或发育中的类器官;除去逃逸墨水,从而形成包括嵌入或部分嵌入其中的发育中的类器官的组织构建体。
一些其他实施方式涉及通过本文所述的方法生产的血管化的肾组织构建体、器官或活动设备。
一些其他实施方式涉及通过本文所述方法生产的血管化的肾组织构建体、类器官、构建体中的类器官、器官、活动设备用于肾小球疾病建模、肾小管疾病建模、血管疾病建模、免疫反应建模、纤维化建模、药物毒性研究、药物筛选应用、活透析设备、重吸收设备和/或作为肾组织用于替代肾脏(再生医学)的用途。
一些另外的实施方式涉及试剂盒,其包含通过本文所述的方法产生的血管化的肾组织构建体或类器官,和具有用于培养基的单个入口和单个出口的外壳。试剂盒还可以包括培养基和/或灌注泵,和/或使用试剂盒的说明。
一些其他的实施方式涉及一种试剂盒,其包含通过本文所述的方法产生的血管化的肾组织构建体或类器官和具有单个入口和两个出口的外壳。试剂盒还可以包括培养基,和/或灌注泵,和/或使用试剂盒的说明。
附图说明
专利或申请文件包含至少一个彩色附图。专利局将根据要求并在缴纳必要的费用后提供带有彩色附图的本专利或专利申请公开的副本。
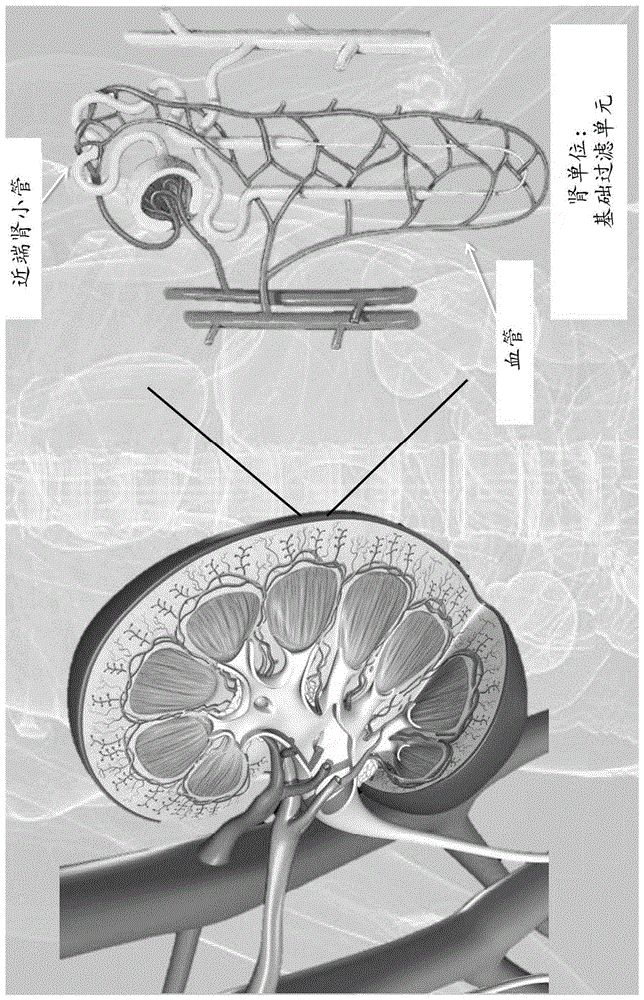
图1是肾脏及其基础过滤单元,肾单位,的示意图。
图2a示出了示例性的肾脏类器官如何重塑肾组织。
图2b示出了现有技术中发育中的类器官或类器官的示例性培养步骤的图示(morizane等人,naturebiotechnology,2015)。
图3描绘了在分化和成熟过程中将流体剪切应力(fss)施加给发育中的类器官或类器官的所述方法的示意图。
图4描绘了肾脏类器官芯片的设计和制造:(a)采用在左(入口)和右(出口)上插有灌注针用于培养基流动来定制在玻璃基材上打印的聚二甲基硅氧烷(pdms)垫片;(b)将打印的垫片/基材/针组件装在肾脏类器官芯片中,在玻璃基材的顶部添加经过工程化的ecm层(凝胶单丝)然后固化,发育中的类器官(第11至14天)放置在ecm层顶部并由钢壳和丙烯酸盖围绕。最后,将外部灌注管连接到针上;(c)通过芯片灌注培养基,该芯片被放置在培养箱中,在该培养箱中,培养基使用蠕动泵在闭环回路中流动;(d)芯片照片的俯视图和截面视图突出显示了ecm(粉红色)和类器官的位置;(e)模拟了体积流率为1ml/min时的截面流量曲线(来自comsol);(f)根据实验珠流测量值计算出的剪切应力,该测量结果是在通道的不同位置处靠近凝胶表面进行的。误差条代表线性回归分析得出的速度梯度的95%置信区间;(g)在通道中心,凝胶表面上方80μm处记录的速度随时间变化的测量结果,表明我们的灌注过程在较高流率下具有搏动性。
图5a描绘了通过本文所述的方法产生的示例性类器官,并与图5b中所示的现有技术类器官(takasato,m.,little,m.h.,dev.biol.(2016),hyperlinkhttp://dx.doi.org/10.1016/j.ydbio.2016.08.024和图5c中的成人肾组织比较。
图6描绘了在静态u型孔条件下类器官中血管标记物的整体共聚焦3d渲染,比例尺=100μm,显示本文所述的流体芯片设计和培养方法允许肾发生并促进肾脏类器官的血管化。
图7显示了在非贴壁与贴壁的下层ecm中增强的外周血管网络形成,比例尺=100μm。
图8显示了血管造影工具输出,其量化了各种培养条件下血管系统的丰度和特性,报告为相对于u型孔条件的倍数变化:在4个独立实验中的每个条件下,每个条件使用6-11个生物学重复,同时使用ipsc和hesc衍生的类器官,其中整个类器官代表一个重复。
图9显示了qpcr的结果,其描述了在高流量条件下,*p<0.05,**p<0.01,***p<0.001的pecami表达增加。
图10表明在流动条件下培养增强了肾脏类器官的血管潜能。(a)从祖细胞到持续的终末标记物表达,发育中的肾脏的内皮成熟图。(b)第21天在芯片上,解离的完整类器官的流式细胞术描绘了内皮祖细胞(epc)群体对高流量响应与静态条件相比的约3倍扩增。(c、d)内皮细胞标记物在发育中的类器官中的qpcr显示出其在第21天高流量条件后的上调。(e)在高流量条件下上调的关键基质标记物,可能是由于壁细胞与增强的血管系统相关,如图11所示。
图11显示了包裹肾小管的血管系统,其具有清晰的稳定周细胞(pdgfrbeta细胞)募集,比例尺=15μm。
图12显示了血管标记物的整体共聚焦3d渲染,揭示了与仅成熟(中间)和中间(右)标记物相反,在共同染色的样品中(左)最好地可视化了一些血管系统区域,比例尺=30μm。白色箭头突出显示pecami+mcam-区域,表明这两个标记物并不总是共同表达。
图13示出了(a)来自图23的单个z切片,其中白色箭头突出显示了开放的腔,比例尺=30μm。(b-d)tem图像示出了,当将(b、c)经受高流量的肾脏类器官与(d)体内的e14.5小鼠胚胎肾脏进行比较时,由反射血管腔的薄膜所包围的圆形开口,并注意到分级的腔直径从2至接近20μm变化(红色加号表示血管腔),(b、d)中比例尺=10μm,(c)中为2μm。(e、f)高流量下肾脏类器官的底部的z切片,示出了(e)血管网络和(f)荧光珠在血管网络内的积累,比例尺=100μm。(g)两个相邻类器官之间的血管系统桥接的整体共聚焦3d渲染(用白色虚线勾勒,比例尺=100μm。dapi:4',6-联脒-2-苯基吲哚,pecam1:cd31,mcam:cd146,kdr:flk1,podxl:足细胞标记蛋白,pdgfr-β:血小板衍生的生长因子受体β,*p<0.05,**p<0.01,***p<0.001。
图14示出了响应于芯片上的高流量条件,肾小管上皮成熟并经历形态发生,变成与血管系统接触的极化的纤毛区室:(a)在静态和高流量条件下的小管截面示出了在两种情况下胶原蛋白iv的适当基材表达,以及在第21天在高流量下ltl的适当顶端表达,比例尺=5μm,下面黄色的图示出了通过上图中黄色箭头表示的线扫描的ltl强度;(b)小管截面示出了在芯片上的高流量下相对于静态条件下,具有较高普遍性的纤毛的顶端存在(图27),并且在第21天的atp1a1(na/katpase)的适当基材外侧表达,比例尺=5μm。
图15示出了在静态和高流量下纤毛细胞百分比的图表。
图16a、16b、16c和16d进一步示出了响应于芯片上的高流量条件,肾小管上皮成熟并经历形态发生,从而变成与血管系统接触的极化的纤毛区室:(a-c)纤毛标记物、溶质转运体、药物转运体和成人转录因子的qpcr示出了在第21天的高流量条件下相较于芯片上的静态条件和未分化的hpsc的上调;(d)具有代表性的高流量样品的整个类器官3d共聚焦成像堆栈(di,所有比例尺=50μm)用于证明在imaris3d表面再现(dii和diii)和距离转换软件(div和dv)中小管与血管系统的关联的分析方法,来发现(图17(c)),与在静态条件下相比,在高流量下一个体素中与ltl+肾小管重叠的血管系统表面积的百分比显著增加。此外,可以通过在培养基中定量大量的vegf或添加vegf抑制剂来消除紧密的血管-肾小管缔合。
图17示出了免疫染色,表明在第21天在高流量下在横向和纵向平面中的pecam1+网络与肾小管结构相关联,比例尺=20μm(a和b)。完整的类器官3d共聚焦成像堆栈用于在imaris3d表面再现和距离转换软件中分析肾小管与血管系统的关联,来发现在(c)中,与在静态条件下相比,在高流量下一个体素中与ltl+肾小管重叠的血管系统表面积的百分比显著增加。此外,通过在培养基中定量大量的vegf可以消除紧密的血管-肾小管关联(c)。类似地,在高流量条件下(d),血管系统与肾小管之间的3d平均距离会减小,但在静态和高流量+vegf条件下没有统计上的显著差异。注意到,(c、d)中的数据代表在两个独立实验中测试的每个条件下,n=3至6个生物学完整类器官生物学重复。dapi:4',6-联脒-2-苯基吲哚,ltl:四角莲凝集素,pecam1:cd31,podxl:足细胞标记蛋白,tuba4a:微管蛋白α4a(也称为乙酰化微管蛋白),aqp1:水通道蛋白1,slc34a1:na/phos共转运体,atp1a1:na/katpase,abcb1:mdr1,lrp2:megalin,bnc2:碱核蛋白2,npas2:神经元pas结构域蛋白2,trps1:转录阻遏物gata结合1,pkd1:多囊蛋白1,pkd2:多囊蛋白2,nphp1:nephrocystin1,nphp6:nephrocystin6,pkhd1:fibrocystin。*p<0.05,**p<0.01,***p<0.001。
图18a示出了podxl+簇中血管侵入的3d渲染共聚焦图像,示出了输入和输出的血管,比例尺=40μm。
图18b的条形图示出了podxl+簇的百分比,在静态和高流量条件下血管包裹或侵入±vegf添加或抑制表示在4个独立实验中每个条件下n>14个类器官。
图18c的条形图示出了vegf的qpcr,其示出了在第21天在芯片上的高流量条件下的显著上调。
图19示出了:(a)在血管化类器官中s形体中毛细血管侵入的3d渲染共聚焦图像,比例尺=10μm;(b)单共聚焦z切片示出了pecam1+mcam+细胞(白色箭头)和mcam+血管前体(cd146+细胞)的毛细血管侵入,比例尺=10μm;(c)mcam+pecam1+肾小球簇状构造,示出为共聚焦的单个z切片,比例尺=10μm;(d-f)第21天与肾脏类器官中if图像相关的结构的tem图像,(d,e)中比例尺为=4μm和(f)中=10μm;示出了e14.5小鼠肾脏中的相应阶段(gi),其中红色虚线描绘了分裂,白色箭头表示毛细血管侵入,b=bowman的囊状结构,红色加号表示rbc,(g、h)的比例尺=8μm且(i)=50μm。
图20描绘了:(a)在第21天高流量下的肾小球状结构的tem图像,示出了壁膜包裹着内脏细胞簇(左),其表现出交叉指状的细胞质突起延伸穿过并进入放大倍数较高的区域(右),比例尺=10μm(左)和1μm(右);和(b)第21天时,在高流量下的肾小球状隔室的tem图像(左),其中较高的放大倍数示出足细胞足突邻接肾小球的簇状构造(右),比例尺=2μm(左)和200nm(左)。
图21描绘的条形图示出了qpcr结果,其描绘了足细胞足突蛋白和成人转录因子的显著上调的转录物。ssb:s形体,cls:毛细血管环阶段,dapi:4',6-联脒-2-苯基吲哚,mcam:cd146,pecam1:cd31,podxl:足细胞标记蛋白,synpo:突触足蛋白,nphs1:肾病蛋白,pdgfr-β:血小板衍生的生长因子受体β,vegfa:血管内皮生长因子a,casz1:蓖麻锌指蛋白1*p<0.05,**p<0.01,***p<0.001。
图22示出了在静态条件下的肾脏类器官-ecm的相互作用。在第14天将发育中的类器官放置在不同的胞外基质(ecm)上一周,以研究它们对血管发育的影响。非粘附基质定义为类器官中的细胞未保持附着或不与基材强烈相互作用的基质,包括:(a)经等离子体处理的玻璃,(b)组织培养塑料,(c)纤维蛋白,和(d)纤维蛋白和胶原蛋白i网络,比例尺=300μm。在贴壁的ecm上,(e)凝胶蛋白(明胶-纤维蛋白网络)和(f)基质胶,肾脏类器官表现出牢固的附着,并且不受振荡、灌注或摇动的干扰,比例尺=300μm。
图23示出了在肾脏类器官中流体流动增强的血管化的量化:(a-d)非粘附性u型孔条件,ecm上的静态、低流量和高流量条件下类器官的明视场图像,其中(e-h)对应于整体的pecam1染色(红色)z堆栈的最大强度突起,比例尺=100μm;(i-l)相应突起的angiotool分析,其中粗白线表示血管路径,蓝点表示血管连接点,黄线突出显示所计数的血管结构的外边缘,而外部周围的细白线限制了明视场图像确认的类器官中进行血管结构分析的整个区域。pecam1:cd31。
图24示出了分化第8天时存在血管前体细胞kdr+(flk1+)。流式细胞仪数据示出,与未染色的活细胞对照(b)相比,flk1+细胞占门控细胞群的1.7%(a)(基于所示的均质活细胞)。
图25证明了在高流量培养的类器官中,荧光珠通过pecam1+网络中的开放腔灌注。在第21天,在高流量培养的类器官培养培养基中灌注荧光珠(直径200μm);珠也被添加到静态培养培养基中并摇动2小时。珠的z堆栈共聚焦图像是在高流量(a、b)和静态条件(c)下实时捕获的。(d)然后将类器官固定并进行dapi和pecam1染色,渲染的共聚焦z堆栈的面积相同(a),而3d渲染的(b、c)则呈现高流量下遍及的pecam1+网络。此外,对于高流量条件(在顶部类器官表面以下>300μm),在z堆栈中最深的切片显示出珠粒在pecam1+区域(白色点线圆)中聚集,这表明珠可以穿过类器官厚度并聚集在pecam1+腔内血管中穿过类器官的深度。比例尺=100μm。dapi:4',6-联脒-2-苯基吲哚,pecam1:cd31,mcam:cd146。
图26示出在高流量条件下培养的肾脏类器官中的血管网络表现出提示血管新生以及诱导静脉和动脉谱系的特征:(a)在分化的第21天的高流量条件下的肾脏类器官的免疫染色描绘了缺少pdgfr-β+壁细胞衬里的pecam1+芽状结构(白色箭头),这在更高口径的血管网络中可以看到(芽状结构从中形成),比例尺=15μm。(b)对与(a)类似的样品进行免疫染色,示出pecam1+网络的末端部分采用端细胞形态(白虚线所示),提示血管新生,比例尺=20μm。(c、d)分化第21天在高流量条件下对肾脏类器官的免疫染色示出(c)静脉标记emcn+的血管系统染色区域,并与(d)与动脉诱导一致的平滑肌状acta2+细胞相关联,比例尺=40μm(c)和20μm(d)。dapi:4',6-联脒-2-苯基吲哚,pecam1:cd31。podxl:足细胞标记蛋白,emcn:内皮粘蛋白,acta2:α平滑肌肌动蛋白(αsma)。
图27示出了在体外在高流量条件下培养的胚胎小鼠肾脏、成人肾脏和血管化的肾脏类器官中观察到具有细胞质突起的细长足细胞。小鼠胚胎肾脏中的肾小球区域的sem图像,第e14.5天(a)和在高流量条件下培养的类器官(b)示出,外壳内的薄壁上皮和新生足细胞样细胞,比例尺=5μm。较高放大倍数的图像(c)和(d)示出足细胞样细胞的内脏上皮层伸长(白色箭头),比例尺=2μm。(e)在sem上可见的成人肾足突,比例尺=200nm,经许可转载(erlandsen等人,coloratlasofhistology,mosbyinc,1992)。(f)足突在足细胞之间相互作用处的高流量下肾脏类器官的sem,比例尺=200nm。
图28提供了在高流量条件下培养的血管化的肾脏类器官中肾小球和足细胞足突的血管侵入的证据:(a-c)在第21天高流量下足细胞样细胞的tem图像示出了若干管腔开口,比例尺=2μm,红色箭头指向可能的内皮窗孔形成区域,表现为假定的内皮膜薄破裂;(d、e)足细胞的tem图像,显示一级和二级足突状结构,比例尺=200nm;和(f、g)如下的sem图像:(f)肾小球样结构,其中壁膜包裹内脏细胞簇,(g)表现出细胞质突起,它们相互交叉并与共同的方向对齐,比例尺=10μm(f)和200nm(g)。
图29示出了在高流量条件下培养的血管化的肾脏类器官内形成了明显的足突:(a、b)sem图像;(c、d)第21天的肾脏类器官的tem图像示出,与芯片上的静态条件相比,在高流量条件下,足突状构造更为明显。此外,从培养的第20天到第21天接受阿霉素(dox)24小时治疗的高流量下的肾脏类器官示出肾小球特异性损害的证据,包括足突融合(fusion)或消失(effacement)。所有比例尺=1μm。
图30示出了微孔阵列中肾脏类器官的生成。在分化的第8天,以5,000个细胞/微孔,将衍生自h9的肾单位祖细胞接种到具有图案化微孔表面的6孔培养板上。(a)明视场图像示出其随时间的形态变化。分化日期显示在明视场图像的顶部。比例尺=200mm。(b)在分化的第22天进行全孔扫描的明视场图像(左)。第22天的肾脏类器官的免疫荧光图像(右)。ltl:四棱莲凝集素。podxl:足细胞标记蛋白之类。dapi:4',6-联脒-2-苯基吲哚。比例尺:5mm(左)和200mm(右)。
图31示出了对血管前体细胞kdr+(flk+)的流动影响。流式细胞仪数据显示,kdr+细胞占(a)未染色对照中的0.0%,(b)芯片上静态类器官中的4.25%,和与(a)相比,(c)在第21天,在分离的类器官中,在高流量下的总活细胞中的11.2%。(d-f)设门策略将活细胞分为肾脏类器官的小细胞和大细胞部分。在大单线态细胞中,kdr+细胞占(g)未染色对照中的0.0%,(h)芯片上静态条件下的0.54%,相比之下(i)高流量下的3.11%。
图32示出,与成人内皮细胞和成纤维细胞共培养抑制了正在发育的肾脏类器官的肾发生。(a)在分化的第8天,将源自h9的npc以100,000个细胞/孔接种到96孔板上。将人肾小球内皮细胞(gmec)的原代培养物与npc以1,000或10,000个细胞/孔混合。在分化的第10天,对照孔中开始形成球体,而添加的gmec减少了球体结构的形成。在分化的第15天,对照样品形成具有上皮结构的肾脏类器官,而具有添加的gmec的那些在类器官形成期间受到抑制。比例尺=100μm。(b)在纤维蛋白凝胶内以3d形式放置在预先形成的人脐静脉内皮细胞(huvec)和人新生儿真皮成纤维细胞(hndf)床上的类器官没有导致肾脏类器官的成熟度提高。此外,这些类器官没有与ecm整合,并且实现了它们的分化的规律性进行,即在3d整体共聚焦成像中几乎看不到管状结构,比例尺=100μm。dapi:4',6-联脒-2-苯基吲哚,pecam1:cd31,mcam:cd146,podxl:足细胞标记蛋白。
具体实施方式
2014年11月4日提交的国际专利申请第pct/us2014/063810号;2016年3月3日提交的国际专利申请第pct/us2016/20601号;2016年5月4日提交的国际专利申请第pct/us2016/30710号;2013年11月5日提交的美国临时专利申请第61/900,029号;2015年3月3日提交的美国临时专利申请第62/127,549号;以及2015年11月3日提交的美国临时专利申请第62/250,338号;2015年5月5日提交的美国临时专利申请第62/157,286号;2016年9月6日提交的美国临时专利申请第62/383,928号,所有通过引用整体并入本文。
另外,pct公开第wo2015/057261和morizane等人,naturebiotechnology(2015),通过引用整体并入本文。
本文引用的所有专利、专利申请和出版物以及其他文献参考文献均通过引用整体并入本文。这些出版物的公开内容通过引用整体并入本申请,以便更全面地描述截至本文所述和要求保护的发明的日期的本领域技术人员已知的现有技术水平。
迄今为止,发现肾脏类器官缺乏强健的血管系统和肾小球发育。先前开发的类器官的进一步限制是血管系统自然发育,然后死亡;肾小球中毛细血管环无法在体外正常形成;且这些类器官具有通过肾小管和血管结构的受限的内部灌注。
与人类成年肾脏相比,静态培养中的肾脏类器官显示出未成熟的血管化和基因表达(takasato,m.等人,“kidneyorganoidsfromhumanipscellscontainmultiplelineagesandmodelhumannephrogenesis,”nature526,564-568(2015);和wu,h.等人,“comparativeanalysisofkidneyorganoidandadulthumankidneysinglecellandsinglenucleustranscriptomes,”biorxiv,doi:10.1101/232561(2017))。鉴于与血管系统的多谱系通讯与体内上皮成熟有关(camp,j.g.等人,“multilineagecommunicationregulateshumanliverbuddevelopmentfrompluripotency,”nature546,533-538(2017)),假设当经历环境诱因时,在hpsc衍生的人肾组织中在体外可促进增强的血管化和成熟。为了检验我们的假设,开发了一种流体培养系统,以探测胞外基质(ecm)和培养基的各种组合物、可变流体剪切应力(fss)以及与人内皮细胞共培养对发育中的肾脏类器官的影响。
首先,为了梳理变量,考虑了以下几个问题,包括:gmec的并入是否有影响,化学添加剂对类器官的发育有什么影响,rv的年龄是否有影响,灌注(直接或间接)有什么影响,以及下层基材有什么影响。
出人意料地,目前发现,当将fss施加于发育中的类器官时,血管密度增加,包括肾小球中的血管整合和与肾小管相关的血管系统。
本文描述了使用fss生产增强的肾小球和肾小管成熟的血管化的肾脏类器官或由增强的成熟度的类器官制成的肾组织构建体的方法。图3描绘了向发育中的类器官施加fss以产生增强的肾小球和肾小管成熟度的血管化的肾脏类器官或由增强的成熟度类器官制成的肾组织构建体的本方法的示例性示意图。该方法包括在细胞培养基中培养细胞群以产生发育中的类器官,并将该发育中的类器官暴露于流体灌注以施加fss以诱导类器官中的血管发育以及肾小管和肾小球成熟,从而产生血管化的肾组织构建体或类器官。
在某些实施方式中,将发育中的肾脏类器官放置在工程化的胞外基质(ecm)上,容纳在定制的灌注芯片内,并经历受控的流量和fss。参见图3和图4。
除非另有定义,否则本文中使用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常理解的相同含义。尽管与本文描述的那些类似或等同的方法和材料可以用于所公开的方法和组合物的实践中,但是本文描述了示例性的方法、组合物、设备和材料。
如本文和所附权利要求书中所使用的,单数形式的“一个”、“和”和“该”包括复数指代物,除非上下文另外明确指出。因此,例如,“一种蛋白质”包括多种这样的蛋白质,并且“该祖细胞”包括本领域技术人员已知的一种或多种祖细胞,等等。
术语“肾组织构建体”、“肾脏类器官”,“发育中的类器官”或“前管聚集体(pretubularaggregate)”可以互换使用,并且是指通过培养一种或几种类型的细胞而产生或合成的三维组织培养物,例如,如在已经历一定程度分化的基材上的人多能或专能干细胞。肾组织构建体或肾脏类器官形成为三维球形、椭球形或其他三维形状。随着细胞的分化,肾脏类器官的发育经历了几个阶段,以形成增强的肾小球和肾小管成熟度的血管化的肾脏类器官,或由增强的成熟度的类器官制成的肾组织体。术语“肾组织构建体”还涵盖嵌入或打印到组织构建体中的肾脏类器官。包含类器官的肾组织构建体或类器官本身具有类似于哺乳动物肾脏的解剖学特征,诸如肾小管结构(图1)以及与哺乳动物肾脏相同或相似或部分的功能特征。
术语“增强的肾小球和肾小管成熟度的血管化类器官”是指通过本文所述的方法生产或合成的肾组织构建体,其包括解剖学特征,包括类似于哺乳动物肾脏的血管网络。
类器官通过培养以下的至少一种来产生:多能干细胞、专能干细胞、肾单位祖细胞、祖细胞、终末分化细胞、内皮细胞、内皮祖细胞永生化细胞系或原代细胞,详细信息如下。
关于“将发育中的类器官嵌入胞外基质材料(ecm)中”中的术语“嵌入”,是指将发育中的类器官或类器官(一种或多种)置于ecm顶上或将其嵌入ecm或打印到ecm中。
关于“将类器官嵌入组织构建体中”中的术语“嵌入”,是指将发育中的类器官(一种或多种)放置在组织构建体之上,或将它们嵌入组织构建体中,或将它们打印到组织构建体中。
在一个实施方式中,一种生成血管化的肾组织构建体或类器官的方法包括以下步骤:在细胞培养基中培养细胞群以产生发育中的类器官,并将该发育中的类器官暴露于流体灌注以施加fss以诱导血管化并增强发育中的类器官中的肾小球和肾小管发育,从而产生血管化的肾组织构建体或类器官。
流体流动是涉及细胞处理、培养或分选的每个微系统的基本特征。流不可避免地生成fss。“fss”的“流体剪切应力”是指沿材料的横截面的应力共面分量,也称为壁切应力。这是由于分量的力矢量类似于横截面而发生的。它与垂直于材料横截面的力矢量所产生的法向应力相矛盾。
发育中的类器官暴露于流体灌注以施加fss来诱导血管化和发育中的类器官中的增强的肾小球和肾小管发育。
可以在大约0.000001dyn/cm2至大约100dyn/cm2中的任何fss下流体灌注;或者可替代地,可以在大约0.01dyn/cm2至大约50dyn/cm2的fss下流体灌注;或者可替代地,可以在大约0.01dyn/cm2至大约10dyn/cm2的fss下流体灌注;可以在大约0.01dyn/cm2至大约5dyn/cm2的fss下流体灌注;可以在大约0.01dyn/cm2至大约1dyn/cm2的fss下流体灌注。fss暴露可以是恒定、连续或间歇的,可以持续1天至200天。在某些替代实施方式中,还可以在正常心跳期间脉动剪切应力以模拟血压变化。在某些其他实施方式中,fss可以是间歇的。术语“恒定的”和“连续的”可以互换使用,并且是指在指定的和延长的时间段(例如1至200天)内不间断和/或稳定地暴露于fss。术语“间歇的”是指间断或不稳定地暴露于fss。关于间歇性暴露,可以以规则的时间间隔(例如每5秒、每10秒或每15秒等)将发育中的类器官暴露于fss指定的暴露时间量(例如1至200天),例如,暴露时间为1秒、2秒、3秒、4秒、5秒等。或者可替代地,关于间歇性暴露,可以以不规则的间隔将发育中的类器官暴露于fss。可以预先设定暴露于fss的类型。
在某些实施方式中,培养细胞群的步骤可以是同时施加fss。
在某些实施方式中,培养步骤在具有下层基材的可灌注芯片上进行,或通过使用旋转式生物反应器,或在摇动装置(诸如,轨道振荡器或摇动器或类似设备)中的基材进行。
下层基材可以是塑料、丙烯酸材料、石英或玻璃。可以对下层基材进行等离子体处理或涂覆至少一层基质胶、聚l-赖氨酸、geltrex、明胶、nitogen、纤连蛋白、胶原蛋白i、胶原蛋白iv、纤维蛋白原、甲基丙烯酸明胶、纤维蛋白、丝、聚乙二醇化凝胶、甲基丙烯酸胶原蛋白、基底膜蛋白或任何其他生物材料。基材可以是明胶、纤维蛋白或胶原蛋白i的任何组合或任何其他基底膜蛋白。
细胞群可以是多能干细胞、专能干细胞、祖细胞、肾单位祖细胞、终末分化细胞、内皮细胞、内皮祖细胞、永生化细胞系或原代细胞中的至少一种。在某些实施方式中,细胞群包含人类胚胎干细胞(hesc)或诱导性多能干细胞(hipsc)中的至少一种。
可以将细胞培养至少1天,并且可以无限期培养,直到不再需要培养为止。在一些实施方式中,细胞培养物可以生长30天或更长时间,例如,细胞可以培养2个月、3个月、6个月、9个月、12个月、24个月、30个月、36个月、42个月等。还考虑了在提到的用于培养细胞的时间段之间的任何时间段。例如。在某些实施方式中,可以将细胞培养至少2天、至少3天、至少4天、至少5天、至少6天、至少7天、至少8天、至少9天、至少10天、至少11天;至少12天;至少13天;至少14天;至少15天;至少16天;至少17天;至少18天;至少19天;至少20天;至少21天;至少22天;至少23天;至少24天;至少25天;至少26天;至少27天;至少28天;至少29天;至少30天;或至少31天;或更长。
在某些其他实施方式中,该方法还可包括将发育中的类器官嵌入胞外基质材料或ecm中的步骤。“嵌入”可以是通过将发育中的类器官放置在ecm顶上,或将发育中的类器官嵌入ecm内,或两者兼而有之。
ecm可以是或可以包括基质胶、聚l-赖氨酸、geltrex、明胶、nitogen、纤连蛋白、胶原蛋白1、胶原蛋白iv、纤维蛋白原、甲基丙烯酸明胶、纤维蛋白、丝、聚乙二醇化凝胶、甲基丙烯酸胶原蛋白、基底膜蛋白或任何其他生物材料中的至少一种,或其组合。
培养细胞群的步骤可以在细胞培养基中。术语“培养基”具有本领域普通技术人员所理解的共同含义。细胞培养基可以包含基础培养基、胎牛血清(fbs)、fgf9、chir、dorsomorphin、激活素a或视黄酸中的至少一种。示例性的培养基包括例如,但不限于,dulbecco改良的伊格尔培养基(dmem)、hank平衡盐培养基、格拉斯哥极限必需培养基、ames培养基、click氏培养基、营养混合物hamf-10和hamf-12、高级rpmi、apel、dmem:f12。术语“培养基”和“培养培养基”是等同的并且可以互换使用。用于所述方法的示例性细胞培养基包括基础培养基、胎牛血清(fbs)或fgf9中的至少一种。
在某些实施方式中,fbs的浓度可以在约0.1%至约10%fbs范围内。在其他实施方式中,fbs的浓度可以在约1%至约2%fbs范围内。在进一步的实施方式中,fbs的浓度可以为约1.5%fbs。
整体并入本文的pct公开第wo2017/049243a1号提供了示例性浓度的不同培养基成分,这些成分可包含在本文所述方法中使用的培养基中。
在某些另外的实施方式中,生成血管化的类器官或增强的/血管化的肾组织构建体的方法还可以包括以下步骤:将发育中的类器官暴露于一种或多种生物剂、生物剂梯度、压力和/或氧张力梯度,从而诱导毛细血管到/或来自肾脏类器官的血管新生。一种或多种生物剂、生物剂梯度、压力和/或氧张力梯度进一步指导发育中的类器官的发育、分化和/或作用。
示例性的生物剂可以包括血管内皮生长因子(vegf)或pma、fbs或其他促血管生成刺激剂。
在某些实施方式中,生成血管化的类器官或增强的/血管化的肾组织构建体的方法还可包括将发育中的类器官暴露于生物剂梯度的步骤。术语“生物剂梯度”是指在组织构建体中产生生长因子分布的梯度,其可以赋予血管系统或肾小管或两者化学引诱特性。
在某些实施方式中,生成血管化的类器官或增强的/血管化的肾组织构建体的方法还可以包括以下步骤:将发育中的类器官暴露于跨越其宽度的压力梯度,从而引起类器官沿着压力梯度的主要亚成分的模式表达。
在某些实施方式中,生成血管化的类器官或增强的/血管化的肾组织构建体的方法还可包括将发育中的类器官暴露于氧张力梯度或具有变化的氧浓度区域的组织构建体的步骤。
在某些另外的实施方式中,生成血管化的肾组织构建体的方法还可以包括将发育中的类器官嵌入组织构建体中。这包括:在基材上沉积一根或多根牺牲丝以形成血管图案,每根牺牲丝均包含逃逸墨水;在血管图案内沉积或打印发育中的类器官;用胞外基质组合物至少部分地围绕血管图案和/或发育中的类器官;除去逃逸墨水,从而形成包含嵌入其中的发育中的类器官的组织构建体。可以将“沉积在基材上”的丝理解为直接沉积在基材上或直接沉积在先前沉积或形成在基材上的另一丝、通道或部分上。
术语“内丛(internalplexus)”是指位于发育中的类器官或类器官的内部和/或表面上的血管内皮细胞的互连网络。
在一个示例性的实施方式中,参考图3,将esc或ipsc在常规组织培养塑料上培养8天。在这段时间内,向细胞提供如图3所示的培养基。然后,将细胞收集、沉淀并在非粘附u孔中培养2天。然后,在第11天或第12、13或14天,将细胞转移到具有下层基材的可灌注芯片中,并应用fss。请注意,细胞可以嵌入ecm中,也可以位于其顶部。另外,请注意,如果嵌入日在第11-14天(用于形成血管化的肾小球+形成强健的血管系统)或第15-18天(对于基本上没有血管化的肾小球的血管系统),则该方法有效。
某些其他实施方式涉及通过本文所述方法产生的血管化的肾组织构建体或类器官。
具体地,血管化的肾组织构建体或类器官包括至少单个类器官,其使用本文所述的方法经过fss的帮助而被血管化。肾组织构建体可以包括嵌入ecm中的多个类器官,类器官的血管系统通过管腔连接到使用打印技术制成的血管图案或通道。通过本文所述方法生产的血管化的肾组织构建体或类器官可用于肾小球疾病建模(例如fsgs,或使用药物如阿霉素研究肾小球的损害)、肾小管疾病建模(例如pkd)、血管疾病建模(例如,高血糖症或纤维化的影响)、药物毒性研究(例如,研究任何抗体、小分子、rna或其他芯片疗法的机械安全性,并具体确定哪个肾脏隔室受到影响以及受损程度如何以及药品运输的地点)、药物筛选应用(生产具有单基因病的组织,然后研究芯片上的基因疗法解决方案,筛选限制芯片上纤维化的药物)、活透析设备、以及作为肾组织以替代肾脏(再生医学)。
在某些实施方式中,对于活透析设备,血管化的肾脏构建体可用于将全血引入肾组织构建体的打印图案中,以确定增强的类器官是否能够过滤血液并产生对构建具有活细胞成分的肾脏辅助设备所必需的滤液。对于再生医学的应用,我们希望构建将类器官搭连到嵌套在用于收集尿液的收集导管系统中的传入和传出打印血管的构建体。血管化类器官的各个部分将搭入这些连接,并在体外产生可工作的肾单位,这些肾单位可成熟并植入以替代肾功能。
出人意料地,在流体剪切应力下培养肾脏类器官具有释放肾小球疾病建模,足细胞/血管成熟以及体外肾小球滤过屏障发展的新机会的潜力。
考虑到在体外表现出滤过屏障的潜力,在流体剪切应力下培养肾脏类器官也具有释放再生医学和透析的新机会的潜力。
具体地,在一个实施方式中,根据以下实施例部分中描述的方法制备前管聚集体(pa)。
图5a示出了通过本文所述的方法产生的类器官,与图5b中的现有技术类器官和图5c中的人成年肾组织相比。显然,目前产生的类器官非常类似于成年的肾组织,包括强健的血管系统。
所描述的3d打印的流体芯片具有简化的设计,该设计使类器官能够经受超灌流(流过其顶部表面),并因此可以控制壁剪切或fss(图3和4(a-g))。
在某些实施方式中,芯片可以如下制备:通过使用硅酮基的墨水对3d打印定制的灌注垫片进行制备,其中可以放置发育中的肾脏类器官。可以使用任何合适的硅酮基的墨水。在某些实施方式中,墨水可以由碱比催化剂为10:1(基于重量)的双组份硅酮弹性体(se1700,dowchemical)组成,使用离心混合机将其均化2分钟(2000rpm,ae-310,thinkycorp,日本)。
在某些实施方式中,芯片可以使用定制-设计的多材料3d生物打印机生产,后者配有安装在动作控制的3-轴吊架(gantry)上的四个可独立寻址的打印头,建造体积为725mmx650mmx125mm(agb10000,aerotechinc.,pittsburgh,pa美国)。通过应用空气压力(例如,800ultradispensingsystem,efdinc.,eastprovidence,rl,美国)将墨水通过沉积喷嘴挤出,所述压力在例如10-140psi范围内,对应于1mm/s至5cm/s的打印速度。
在打印之后,可以将灌注芯片在80℃的烘箱中固化>1h,在室温下存储,并且在使用前进行高压灭菌。
在某些实施例中,垫片包括类器官腔室,例如,宽15mm,高3.6mm,长60mm。
在某些实施例中,如图4(d)所示,可以将每个芯片4至25之间的类器官放置在宽8mm,高3.6mm,长20mm的区域的中央。
在某些另外的实施方式中,产生血管化的肾组织构建体或类器官的方法可进一步包括将发育中的类器官嵌入组织构建体中。将发育中的类器官嵌入组织构建体中可以包括:在基材上沉积一根或多根牺牲丝以形成血管图案,每条牺牲细丝都包含逃逸墨水;在血管图案内沉积或打印发育中的类器官;用胞外基质组合物至少部分地围绕血管图案和/或发育中的类器官;除去逃逸墨水,从而形成包含嵌入其中的发育中的类器官的组织构建体。
出人意料地发现,发育中的肾脏类器官是贴壁的,并部分嵌入约1mm厚的明胶纤维蛋白(凝胶蛋白)ecm层中,该层覆盖打印芯片的底部,从而允许fss的应用(图22)。有趣的是,与非粘附性基质(例如玻璃、塑料、纤维蛋白±胶原蛋白1型)相比,这种粘附性基质在静态条件下在1周内导致血管标记物pecam1及其前体mcam的增强外周表达(图7)。测试了几种培养基组合物以及与原代人内皮+/-成纤维细胞的共培养;然而,它们中的许多抑制肾单位形成或未能增强血管化。通常在内皮培养基中使用1.5%的低fbs浓度,允许在静态条件下在发育中的肾脏类器官中肾发生并形成一些血管网络。
在某些实施方式中,为了确定fss的作用,可以将发育中的类器官放置在凝胶蛋白ecm层上,并在闭环系统中用基础类器官培养基基以0.04ml/min的最小流率(低fss,~0.0001dyn/cm2)超灌流过夜。在某些实施方式中,可以向培养基补充1.5%的fbs。然后可以使类器官经受变化的流率(0.04-4.27ml/min),同时继续公布的分化方案(图3和图4)(morizane等人,“generationofnephronprogenitorcellsandkidneyorganoidsfromhumanpluripotentstemcells,”natprotoc12,195-207(2017);和morizane,r.等人,“nephronorganoidsderivedfromhumanpluripotentstemcellsmodelkidneydevelopmentandinjury,”naturebiotechnology,doi:10.1038/nbt.3392(2015))。高流率范围(高fss,例如0.008-0.035dyn/cm2,与1-4.27ml/min的流率相关)可以在灌注10天后(共21天)增强mcam+pecam1+血管网络,随时间形成肾单位(例如,参见图6)。
在某些实施方式中,为了量化血管化,可公开获得的imagej的angiotool插件可用于评估整个类器官图像(zudaire,e.,gambardella,l.,kurcz,c.&vermeren,s.acomputationaltoolforquantitativeanalysisofvascularnetworks.plosone6,e27385,doi:10.1371/journal.pone.0027385(2011))。
在某些实施方式中,高fss条件可诱导pecam1+血管网络,其血管%面积比低fss条件下高5倍(图8和图23)。类似地,在高fss的情况下,与静态和低fss对照物相比,所得的pecam1+网络的接头密度(即,每单位面积的分支点)和平均血管长度(即,结间距离)可能呈现出10倍的增加(图9)。同时,pecam1转录本被上调了5倍(图9)。值得注意的是,在闭环系统中,经受每个类器官0.2ml或1ml的总培养基的高流量样品缺乏血管系统上的统计学显著差异(未示出),反映出在此范围内可变的营养供应对血管化没有可辨别影响。因此,得出的结论是,出人意料地,高fss是在体外促进肾脏类器官的血管化的测试中最重要的环境因素。
在肾脏发育过程中,血管发育被认为是经由血管形成(vasculogenesis),通过内皮祖细胞(epc)的分化和聚结的血管的新形成,以及血管新生(angiogenesis),从预先存在的血管中萌发的新血管的形成,的组合而发生(munro,d.a.d.等人,“cyclesofvascularplexusformationwithinthenephrogeniczoneofthedeveloping鼠kidney,”scientificreports7,3273(2017);anddaniel,e.等人,“spatiotemporalheterogeneityandpatterningofdevelopingrenalbloodvessels,”angiogenesis,1-18(2018))。在体内发育中的哺乳动物肾脏中,命运映射示出,kdr+(flk1)细胞充当中间mcam+细胞和最终pecam1+成熟内皮的epc(图10a)((robert,b.等人,“directvisualizationofrenalvascularmorphogenesisinflk1heterozygousmutantmice,”americanjournalofphysiology-renalphysiology275,f164-f172(1998);和mcmahon,a.p.,“developmentofthemammaliankidney,”curr.top.dev.biol.117,31-64(2016))。类似于体内后肾间充质(mm)(abrahamson,d.r.,“developmentofkidneyglomerularendothelialcellsandtheirroleinbasementmembraneassembly,”organogenesis5,275-287(2009)),kix+epc可能与six2+pax2+sall1+同时诱导肾单位祖细胞(npc)(未示出),占mm细胞的1.7%(图24(ab))。高fss将kdr+epc扩展到整个类器官中的细胞的11.2%,而在芯片上的静态培养中则为4.25%(图10(b))。此外,高流量10天后的第21天,kdr和mcam的转录本被上调(图10(c、d)),表明fss是扩展血管潜力的关键环境线索。pdgfr-β的转录本也被上调(图10(b)),这是周细胞的标记物,我们发现它在高fss下被募集到类器官中的pecam1+血管中(图11)。随着血管网络在芯片上的进化,发现了血管前体和成熟标记物的异源表达,并指出了灌注10天后第21天的mcam+、pecam1+或mcam+pecam1+区域(图12)。受mcam和pecam1阳性的束缚,缺乏核成分(dapi-)的开放式圆形结构(图13(a))、以及hpsc衍生的肾脏类器官(图13(b、c))和e14.5胚胎小鼠肾脏(图13(d))之间的类似结构描绘了直径可变的管腔构造,提示分层的血管构造。用ulexeuropaeusi凝集素对血管内皮进行染色的肾脏类器官外围的时移活细胞监测,证实了在单步骤方法中在单个子集中具有荧光珠(直径为100nm,在开始珠灌注后的数分钟内进行)的内皮细胞的腔管灌注。
由于组织散射,使在整个类器官内的珠可视化是一项挑战,因此可以采用两步法。首先,珠可能会在培养基中超灌流2-3小时,从而使其在类器官内累积。接下来,可以在嵌入ecm的类器官的底部实时拍摄z-stack共聚焦图像。然后可以对类器官进行固定,对pecam1进行免疫染色,并与基准标记物配准。值得注意的是,珠存在于发现较大的pecam1+血管的位置,离超灌流的珠培养基表面几百微米(图13(e、f)和图25(a-c))。有趣的是,分支的pecam1+网络包含缺乏pdgfr-β+细胞衬里的末端芽状结构,并可能表示从存在的血管生长的新血管,提示血管新生(图26(a、b))。出人意料的是,肾脏类器官可能在培养的仅24小时内融合,并且芯片上相邻类器官之间形成的血管系统强健且相互连接(图13(g))。此外,pecam1+网络与acta2+平滑肌样细胞的关联表明动脉谱系细胞成熟(scheppke,l.等,“notchpromotesvascularmaturationbyinducingintegrin-mediatedsmoothmusclecelladhesiontotheendothelialbasementmembrane,”blood119,2149-2158,doi:10.1182/blood-2011-04-348706(2012)),而静脉标记物emcn则对推定的静脉谱系细胞进行染色(图26(c、d))。结合两者,出人意料地发现,在芯片上培养类器官增强发育中的肾脏类器官的血管潜力,最终形成越发成熟且可灌注的变化口径和谱系的血管网络。
在静态条件下的肾脏类器官表现出有限的血管系统,其与肾小管上皮细胞相关,证明了与早期妊娠肾脏(1sttrimesterkidney)类似的未成熟基因表达谱和形态。囊下移植到小鼠肾脏后,通过极化、形成发达的刷状缘和体内纤毛组装证明了肾小管结构的逐步形态发生(vandenberg,c.w.等,“renalsubcapsulartransplantationofpsc-derivedkidneyorganoidsinducesneo-vasculogenesisandsignificantglomerularandtubularmaturationinvivo,”stemcellreports10,751-765,doi:https://doi.org/10.1016/j.stemcr.2018.01.041(2018))。天然肾脏是一种高流动性的环境,在管腔和间隙之间发生大量流体转移,如,约98%的肾小球滤液被重新吸收到健康肾脏的间质中。假设当经受高fss,在体外在hpsc衍生的肾小管细胞中可能发生相似的形态发生以及基因表达谱成熟。出乎意料的是,在10天高fss后的第21天,芯片上的肾小管极性增强,导致刷状缘标记物四棱莲凝集素(ltl)的顶端富集(图14(a))。类似地,乙酰化微管蛋白显示出顶端富集(图14(b)),原发纤毛的存在在静态至高fss条件下分别从50%增加到89%(图15)。与极化和成熟相关的纤毛组装一致,纤毛蛋白(pkd1、pkd2、nphp1、nphp6、pkhd1)的表达上调(图16(a))。同时,与静态对照和未分化细胞相比,包括aqp1、溶质转运蛋白(slc34a1、atp1a1、slc6a19、slc9a3、slc2a2)和药物转运蛋白(abcb1、lrp2)的肾小管上皮转运蛋白的表达上调(图16(b)),这可能反映出增加的功能潜力。成年转录因子(bnc2、npas2、trps1)的上调证明了肾小管上皮细胞的成熟(图16(c)),其被报道为,通过成人肾脏中的单细胞rna-seq的成熟的近端肾小管标记物(wu,h.等人,“comparativeanalysisofkidneyorganoidandadulthumankidneysinglecellandsinglenucleustranscriptomes,”biorxiv,doi:10.1101/232561(2017))。
另外,在高fss下增强的pecam1+网络与横向和纵向的肾小管结构相关联(图16(d)和图17)。研究人员使用imaris表面再现、距离转换和遮罩工具量化了pecam1+网络与ltl+肾小管之间的关联,并揭示了在高流量条件下与肾小管接触的血管表面积的百分比相比于静态培养的类器官增加了近3倍(图17(d))。
此外,从静态到高流量条件,肾小管和血管之间的平均距离降低了3倍以上(图17(a))。有趣的是,在高流量培养的10天中,向基质中添加100ng/mlvegf或添加vegf抑制剂会使这些关联分离,并返回与静态培养水平一致的值。因此,发现在芯片上的内源性vegf梯度维持对于血管肾小管相互作用至关重要,并且由于hpsc衍生的类器官的发育过程中的谱系间内皮-上皮通信,上皮成熟可能会发生。这些结果出人意料地示出,在体外流动下培养类器官支持类器官中的肾小管上皮成熟和形态发生。
在一个实施方式中,可以在组织构建体中使用vegf或其他有效的化学引诱剂或其梯度,以促进血管系统在特定方向图案化,以与能够或迫使流过类器官中的肾单位的打印通道或储库连接。流可以是培养基流,或全血流,或有或无生长因子的血液替代品,例如vegf。vegf可以在ecm中被图案化或在培养基中递送,并且可以在培养基中或在指定的持续时间内连续添加,例如在培养的第11至14天,但是可以指定任何时间。出人意料的是,vegf的添加引起内皮样细胞的强健生长,因此可以在构建体中在时间和空间上设计暂时的生长,以使与现有或打印的血管发生搭连或血管新生。去除外源添加的vegf将使血管网络稳定并与会自然分泌vegf的肾脏结构(如足细胞和肾小管细胞)结合。请注意,尽管在fss下培养的血管丰度没有随培养基中添加的vegf变化而变化,但在静态培养的类器官中添加外源性vegf确实会增加其血管丰度。
在静态培养中的肾脏类器官的肾小球结构大部分是无血管的。在动物移植后,肾脏的类器官的宿主衍生的血管化促进肾小球血管化。为了确定fss诱导的类器官的体外血管化是否扩展到肾小球隔室,使用共聚焦成像技术在静态和高fss条件下对mcam1+pecam1+血管结构侵入的podxl+足细胞簇进行量化(图18a和图18b)。在高fss下,mcam+pecam1+的血管侵入从静态对照的10%到20%显著增加到60%以上,而围绕podxl+簇的包裹血管形态增加到近100%(图18b),与动物研究中肾小球组装所必需的血管流量一致。鉴于高fss会显著上调vegf-a表达(图18c),在流动条件下培养的类器官可用于研究vegf在体外肾小球血管化中的作用。
有趣的是,vegf抑制(贝伐单抗250μg/ml,持续10天,在芯片上)和vegf添加(100ng/ml,持续10天,在芯片上)均显著降低了高流量下pecam1+mcam+血管网络对podxl+肾小球样隔室侵入的发生(图18b)。由于内源性vegf、vegf添加和vegf抑制之间的血管%面积没有变化,因此肾小球血管化的差异不能归因于单独的血管系统丰度增加。同时,在不受干扰的vegf条件下,接头密度的降低和平均血管长度的增加可解释为血管向内源性vegf梯度生长,而在无梯度的情况下则随机分布。在高流量条件下随着内源性vegf梯度的增长,血管可能会及时到达肾小球样隔室,从而侵入而不是包裹鲍曼氏囊状结构。
肾小球的体内血管化开始于单个毛细血管环侵入s形体(ssb),周围的足细胞合并形成原始的鲍曼氏囊(毛细血管环阶段,cls),然后血管扩张至在早期小体中形成新生的肾小球簇。在整个实验方案的第21天,暴露于高fss的10天后,体外肾小球的光谱在ssb、cls和早期小体样结构之间的范围变化。与ssb的血管侵入一致,pecam1+血管侵入ssb样结构中的裂口(图19(a))。同时,侵入podxl+细胞簇的mcam+pecam1+血管的“管腔”被推定的鲍曼氏囊围绕的特征,提示cls样肾小球发育(图19(b))。肾脏小体样结构包含mcam+pecam1+血管系统提示的毛细血管环(图19(c)。tem示出高流量类器官中的发育中的肾小球和e14.5小鼠肾脏之间的类似结构,揭示了芯片上的类器官可能通过ssb、毛细血管环和早期小体阶段跟随体内肾小球发育(图19(d-i))。重要的是,类器官肾小球中的毛细血管环状结构表现出没有红血球细胞的开放管腔,其存在于小鼠的毛细血管中(图18(g-i))。扫描电子显微镜(sem)示出了一个薄层的囊结构,提示了上皮细胞的顶层(鲍曼氏囊),所述囊结构包含圆形细胞体并具有狭长的细胞质突起,表明上皮的内脏层(足细胞)(图20(a))。以类似于e14.5胚胎小鼠肾脏和成人肾脏的方式,高流量下类器官中的内脏上皮细胞的葡萄状簇由圆形细胞体组成,它们具有相互交叉的足突状结构(图27(a-f))。细胞质突起,其由主茎和次级侧分支组成,出现极化和毛细管环状结构的邻接薄层膜(图20(b)和图28(a-g)),其与足突一致。相较于静态条件下,在高fss的情况下,足突样结构显得更为突出,具有编码足突蛋白的nphs1(肾病蛋白)和synpo(突触足蛋白)的显著上调(图21,图29(a-d))。同时,足细胞成人转录因子(wt1、casz1、cux1、tead1)的表达显著增强(图21)。此外,这些足突状结构可以用阿霉素处理24小时而融合或消失,如在成人肾脏中观察到的那样(图29(e))。这些数据出人意料地表明,在芯片上培养类器官可以促进肾小球血管化和足突成熟,这是体外促进足细胞功能形态发生所必需的。
总之,我们已经证明,在芯片上经受高fss的发育中的肾脏类器官在血管系统的丰度和成熟度方面具有显著增强,并在体外伴随着肾小管上皮细胞和肾小球的形态发生。体外产生血管化的肾脏类器官的能力将有助于研究血管和肾脏发育、肾毒性、肾小管和肾小球疾病以及肾脏再生。fss应用于其他类器官的方法可能会类似地促进它们在体外从胚胎阶段发展为功能更多的器官当量。在类似的实施方式中,fss对其他类器官的应用还可以促进体外血管化和细胞成熟。
基于本文所述的研究,确定包括成年外源性gmec对血管系统的形成并不重要,事实上,这可能是有害的。添加vegf和pma也无济于事,但1.5至2%的fbs有助于维持血管生长。出乎意料的是,还示出rv的年龄非常重要:越早(越年轻)越好,灌注的第11-14天最适合肾小球发育,但对于血管发育,更长的范围也足够。出人意料的是,灌注的效果(直接或间接)是显著的:对于在剪切应力
某些另外的实施方式涉及试剂盒,其包含通过本文所述的方法产生的血管化的肾组织构建体或类器官,以及具有用于培养基的单个入口和单个出口的外壳。试剂盒还可以包括培养基和/或灌注泵,和/或使用试剂盒的说明。
某些其他实施方式涉及试剂盒,其包含通过本文所述的方法产生的血管化的肾组织构建体或类器官和具有单个入口和两个出口的外壳。试剂盒还可以包括培养基和/或灌注泵,和/或使用试剂盒的说明。
实施例
方法:
如图2a所示,来自人类胚胎干细胞(hescs)和诱导多能干细胞(hipscs)的早期肾单位类器官(发育中的类器官)被嵌入3d可灌注芯片中的胞外基质(ecm)中和上(图3)。
具体地,如图2所示,将前管聚集体(培养步骤的第11-14天)置于胞外基质材料(ecm)上方或之中的可灌洗芯片中。应用fss1至55天或更长时间。
通过免疫染色、rt-qpcr和流式细胞术评估flk1、cd146和cd31在常规间隔下当经受可变程度的流体剪切应力和生长因子(包括vegf)时,与静态芯片中的对照相比的程度、分布和成熟度。
结果:
本文描述的结果示出,通过使肾组织类器官经受下层ecm、培养基成分和流体切应力的正确组合,血管系统的丰度、肾小球裂隙的毛细血管侵入的发生、血管化的肾小球结构的数量以及肾小管周围血管系统显著增强。我们还证明了血管系统包含可通过荧光珠可视的开放管腔,这表明类器官中的血管系统是可灌注的。
实施例1:化学添加剂对肾脏类器官的影响
方法:为了确定化学添加剂对发育中的类器官的影响,在静态和灌注条件下,在基础的高级rpmi培养基中,用vegf添加剂、gmec培养基、pma添加剂、抗生素或fbs或fcs添加剂和其他成分处理囊泡(年龄为11、12、13和14天)。使用免疫染色研究了血管系统的幅度(extent)和丰度。
结论:图22囊括了大多数测试条件(ecm、培养基添加剂、类器官的天数/年龄等)。当用抗生素、vegf、pma或gmec培养基处理细胞时,cd31+细胞群没有可测量的影响。添加fbs的显著效果很明显–在这种情况下,形成的血管系统(cd31+细胞)具更大丰度。在第11天rv和第14天rv可以看到血管系统。
实施例2:比较灌注对不同年龄的肾囊泡的影响(rv的年龄重要吗?)
方法:尝试使用凝胶蛋白基材(2wt%明胶,10mg/ml纤维蛋白,0.2%tg)将不同年龄的发育中的类器官(第9-14天)嵌入到灌注芯片上。他们用高级的rpmi基质+1.5%fbs灌注,fss在0.000001至10dyns/cm2之间变化。
结论:在fss下,在第9或第10天嵌入的类器官太脆弱且消散或从未分化。图22(b)突出显示了如果使用第11天的发育中的类器官,它们有可能形成高度分化的结构,并伴有肾小球裂隙的毛细血管侵入。第12和13天的发育中类器官的结果与第11天的相似。如果在第14天嵌入,观察到肾小球结构的血管侵入水平明显降低。
实施例3:灌注或fss对肾脏类器官发育的影响
方法:使用凝胶蛋白基材(2wt%明胶,10mg/ml纤维蛋白,0.2%tg)将不同年龄的发育中的类器官(第11-14天)嵌入到灌注芯片上。他们用高级的rpmi基质+1.5%fbs灌注,fss在0至10dyns/cm2之间变化。
结论:图6示出了灌注对肾脏类器官发育的影响。图6示出,在较高的fss条件(0.01dyn/cm2或更高)下,血管系统的丰度显著增加。
rt-qpcr结果进一步证实了这些结果。具体而言,与静态和低fss对照相比,qpcr在高fss条件下发现了更高水平的血管标记物和前体,vegf、flk1、cd146和cd31。
实施例4:类器官中的血管随时间的发育
方法:使用凝胶蛋白基材(2wt%明胶,10mg/ml纤维蛋白,0.2%tg)将不同年龄的发育中的类器官(第11-14天)嵌入在灌注芯片上。发育中的类器官用高级rpmi培养基+1.5%fbs灌注,fss在0至10dyns/cm2之间变化。
结论:图6描绘了类器官中的血管随时间的发育。它们从第12天的细胞椭球体转变为分化的肾小管结构,其血管系统数量随时间增加(例如,与第12天相比,在第16天和21天可见血管系统增加)。
实施例5:基材对类器官生长的影响
方法:为了确定发育中的肾脏类器官的最佳基材,在静态和fss条件下测试了各种基材(例如,玻璃、塑料、纤维蛋白+胶原蛋白1、凝胶蛋白)。理想地,基材必须允许类器官的附着以及基质的一定程度的间质侵入和重塑。
结论:图22(a)说明了在各种下层基材上的类器官生长。结果表明,具有附着细胞结合位点的纳米孔成分的基材(例如基质胶或明胶)会引起类器官强力粘着,并允许间质和血管细胞群长出,最终导致最佳的血管结果(最大增强的类器官血管化和成熟)。
出人意料的是,单独的具有附着性细胞结合位点的大孔基材,如胶原蛋白i或纤维蛋白,或其组合,没有产生增强的类器官。
此外,将类器官放置在预先形成的血管系统床上,例如纤维蛋白中的huvec和hndf细胞的组合,不会产生增强的类器官。
同样,有趣的是,随着时间的流逝,类器官在降解生物材料基材和用其自身的细胞衍生基质替代它方面是极好的。
此外,纳米孔材料的量非常重要。已发现,在凝胶蛋白基材中,如果明胶浓度超过8wt%,则血管系统将被阻塞,且无法在类器官内部和周围适当地成形。
实施例6:用成人血管细胞产生或嵌入其附近的类器官对类器官或肾小球发育和肾小球-血管整合中的血管系统的丰度几乎没有影响。
方法:在第8天,将肾小球微血管内皮细胞(gmec)用1%和10%的six2+细胞沉淀。还将gmecs并入到嵌入ecm中以及嵌入ecm的类器官附件的生物打印通道中,在施加或不施加fss下。
结论:图32示出,当在第8天将gmec引入沉淀时,它会导致类器官无法正常形成;基本上没有管状结构。接近类器官的gmec在血管系统的丰度上也几乎没有差别,并且没有观察到gmec与类器官衍生的cd31+细胞之间的联系。
实施例7:肾脏类器官在体外的流增强血管化和成熟
材料和方法
肾脏类器官微流控芯片的制造。
将硅酮基的墨水用于3d打印定制的灌注垫片,其中将发育中的肾脏类器官放置在工程化的ecm层(1mm厚)上,并经受受控的流体剪切应力环境。墨水可以由碱比催化剂为10:1(基于重量)的双组份硅酮弹性体(se1700,dowchemical)组成,使用离心混合机将其均化2分钟(2000rpm,ae-310,thinkycorp,日本)。在与催化剂混合的2小时内用硅酮墨水打印。将墨水装载到注射器中(efdinc.,eastprovidence,ri),并在室温下打印前,离心以去除气泡。芯片使用定制-设计的多材料3d生物打印机制造,后者配有安装在动作控制的3-轴吊架(gantry)上的四个可独立寻址的打印头,建造体积为725mmx650mmx125mm(agb10000,aerotechinc.,pittsburgh,pa美国)。硅酮(pdms)墨水容纳在注射器筒中,经由鲁二锁(luer-lock)(efdinc.,eastprovidence,ri,usa)注射器筒与410μm直径的喷嘴连接。通过应用空气压力(例如,800ultradispensingsystem,efdinc.,eastprovidence,rl,美国)将墨水通过沉积喷嘴挤出,所述压力在10-90psi范围内,对应于1mm/s至5cm/s的打印速度。通过将硅酮墨水穿过410μm锥形喷嘴沉积在50mmx75mm的玻璃载片上来打印定制的灌注芯片垫片。使用自定义matlab脚本创建垫片工具路径,该脚本为最终的垫片结构生成g代码。打印后,将灌注芯片在80℃的烘箱中固化>1小时,在室温下储存,并在使用前进行高压灭菌。类器官腔室宽15mm,高3.6mm,且长60mm;ecm放置在灌注垫片的底部,厚度为1mm。将每个芯片4至25之间的类器官放置在宽8mm,高3.6mm,且长20mm的区域的中央,如图4(d)所示。
工程化的胞外基质(ecm)的制备和流变学。
胞外基质(ecm)由明胶和纤维蛋白(凝胶蛋白)的网络组成。为了制备ecm成分,首先通过将明胶粉添加到dpbs(1xdulbelco's磷酸盐缓冲盐水且不含钙和镁)的温热溶液(70℃)中,制备15wt/v%的明胶溶液(a型,300bloomfromporcineskin,sigma)。通过在70℃搅拌12小时来处理明胶,然后使用1mnaoh将ph调节至7.5。将该溶液无菌过滤并等份保存在4℃下以备后用(<3个月)。通过在37℃将冻干的牛血浆蛋白(millipore)溶解在不含钙和镁的无菌dpbs中,制成纤维蛋白原溶液(50mg/ml)。将该溶液在不搅拌的情况下保持在37℃至少45分钟,以使其完全溶解。通过将冻干粉末(moogloo,ti)溶解在不含钙和镁的dpbs中并轻轻混合20秒钟,制得转谷氨酰胺酶(tg)溶液(tg)(60mg/ml)。然后将溶液在37℃保持20分钟,并在使用前进行无菌过滤。通过将cacl2沉淀溶解在无菌水中来制备cacl2储备溶液(250mm)。为了制备凝血酶的储备溶液,使用无菌水将冻干的凝血酶(sigmaaldrich)以500u/ml的浓度重构,并储存在-20℃下。凝血酶等份试样在即将使用前解冻。
在3d打印芯片中浇注工程ecm层之前,预先以合适的浓度混合几种成分,包括10mg/ml纤维蛋白原、2wt%明胶、2.5mmcacl2和0.2wt%tg。然后在用于提高ecm的光学清晰度之前,将该溶液在37℃下平衡15-20分钟。接下来,将溶液与凝血酶储备溶液以250:1的比例快速混合,得到最终凝血酶浓度为2u/ml。在37℃下2分钟内,可溶性纤维蛋白原固化为纤维蛋白凝胶。因此,必须在与凝血酶混合后立即将ecm溶液浇注在灌注芯片的底部。然后将带有ecm的垫片放在无菌容器中,并在培养箱中至少放置30分钟,然后再与外壳、培养基和前管聚集体合并组装在一起。
具有40mm直径、2°圆锥和板几何形状的受控应力流变仪(dhr-3,tainstruments,newcastle,de)用于测量ecm的流变性质。在1hz的频率和0.01的振荡应变(γ)下测量了剪切储能(g′)和损耗(g″)的模量。通过将预混合的含有凝血酶的ecm溶液在保持在37℃的peltier板上进行时间扫描。最终固化的工程化ecm的g'约为800pa。
以10mg/ml或25mg/ml的纤维蛋白与2u/ml凝血酶和2.5mmcacl2一起使用来制备图s2的扩展数据中所示的ecm制剂。通过将终浓度为25mg/ml的纤维蛋白原溶液与胶原蛋白i(来自corning的鼠尾胶原蛋白i,1mg/ml)在ph=7.5、2u/ml凝血酶浓度和2.5mmcacl2下混合来制备纤维蛋白/coliecm。将基质胶(corning)用无菌pbs稀释50%,并在37℃下固化。
还制备并评估了另一种ecm制剂,其中包括纤维蛋白以及人脐静脉内皮细胞(huvec)和人新生儿真皮成纤维细胞(hndf)。以5:1的比例结合huvecs:hndfs来制备huvecs和hndfs与形成网络,其在10mg/ml纤维蛋白凝胶中的浓度为2m细胞/ml。将细胞在1:1dmem:egm-2(dulbecco改良的eagle培养基,内皮生长培养基2,lonza)加5%fbs中培养3天,以使自发性肾小管发生产生,然后再将前管聚集体装载到支撑huvec:hndf网络的纤维蛋白凝胶上。此时,将培养基改变为egm2:arpmi(advancedroswellparkmemorialinstitute+1x谷氨酰胺)并在静态条件下保持7天。
在打印芯片上的类器官组装和灌注。
为了组装芯片上的肾脏类器官,将在培养基中的前管聚集体(年龄在第11天至第14天之间)移取到图4(d)所示的窗口/区域中的垫片上的ecm的顶部。大量的类器官可以安装在芯片上,通常每次运行使用4至25个,但如果需要,可以安装100个以上。类器官在8x20mm的窗口内随机分布。然后将垫片放入机加工的不锈钢底座中。将不锈钢销钉在入口和出口处穿过pdms,并放置使其位于ecm表面上方的位置。最后,将厚丙烯酸盖放在上面(图4(a-e))。用四个螺丝将盖子和底座夹紧在一起,围绕打印的硅酮垫片形成密封。接下来,用培养基填充无菌的双挡块式蠕动管(pharmedbpt),并将其连接到无菌过滤器的出口,该过滤器连接到用作培养基容器的10ml注射器筒(efdnordson)。在37℃的培养箱中,在5%co2下平衡>3小时的类器官培养基(arpmi+1x谷氨酰胺+1.5%fbs和1%抗真菌/抗生素溶液)添加到培养基容器中,出自容器的管路连接到芯片的入口(金属空心灌注针)。管路也通过其相应的不锈钢销钉连接到芯片的出口。然后使用注射器向筒中的培养基上施加轻微压力,迫使其进入并完全填充开口的垫片区域,并格外小心以免干扰前管聚集体。在灌注芯片的入口和出口处添加了软管夹钳,以防止与蠕动泵断开连接时不受控的流。为了完成闭合的灌注回路,将出口的管路连接到培养基容器。始终通过在培养基容器顶部的无菌过滤器在培养箱中用大气条件平衡培养基容器。培养基每2至3天更换一次。每个芯片上的类器官和ecm上的静态培养基的通常体积为0.5至0.8ml。u型孔中每个类器官的通常培养基体积为0.2ml。已确定,每个类器官的培养基体积在每个类器官0.2ml至1ml范围内,对高流量条件下所得的芯片上血管系统没有可测量的影响。此外,测量了类器官高度,以了解类器官发育过程中芯片上动态变化。
已发现,在低和高fss下的肾脏类器官最初变平,然后生长到比u型孔对照更大的高度。因此,总的形态高度变化不是控制血管化增强的主要变量,因为到第21天,在低和高fss条件下,高度都相似,而仅高fss下,血管系统才显著增强(图3)。
使用蠕动泵以在40μl/min至4.27ml/min范围内的体积流率将培养基引导到闭环回路中的垫片中。在芯片上培养的最初12到24小时内,前管聚集体经受40μl/min或更低的低流率。这些极低的流率提供了养分供应,而没有高剪切应力可能破坏聚集体与下方ecm之间形成的连接。24小时后,将聚集体牢固地结合,并且将体积流率(q)提高至1.0至4.27ml/min之间的值。
流曲线分析。
使用comsolmultiphysics仿真软件进行流动建模。通过假设斯托克斯流(stoke'sflow)并使用1ml/min的体积流率来计算流体流速曲线。通道包括凝胶的弯曲表面、两侧的硅酮壁和灌注芯片盖。为了直接测量凝胶-通道界面处的流体剪切应力,在类器官接种区域内以各种体积流率跟踪荧光珠。为了使流可视化,将灌注芯片安装在共聚焦显微镜载物台上,并用含有0.4%v/v的0.5μm488nm荧光珠(thermofisher)的2%固体溶液的pbs灌注。泵经由60ft长的硅酮管路连接到芯片,以抑制脉动,从而获得时间平均剪切应力。沿着8mm长的横向线进行分析,该横向线位于通道的中线和位于灌注芯片入口和出口之间距离的三分之二处的类器官接种区域的中心。使用沿通道600μm和跨度90μm的窗口捕获珠流的共聚焦视频。为了估计速度梯度用于计算凝胶-通道界面处的剪切应力,在凝胶表面正上方40μm高的间隔处捕获了四个视频。通过在平行于珠流的方向上执行视频帧的互相关,在每个高度上提取平均珠速度。互相关的峰值位置表示珠在用于互相关的两个图像的时间范围内的平均位移。增大互相关时间范围,直到视频互相关的峰值下降到本底噪声的6个标准差以下。计算速度为互相关峰位移与用于互相关的两个帧之间的时间差之比。计算视频每一帧的速度,并取平均值。使用在四个不同高度处的平均速度的线性回归来测量速度梯度。然后计算出流体剪切应力为梯度与在37℃下dmem的动态粘度0.78cp的乘积30。为了测量流动脉动,在通道中线、入口和出口之间的距离的三分之二处捕获了50秒的视频,并使用上述互相关方法测量随时间的珠速度(图4(e-g))。如果假定是矩形横截面,则使用comsol进行的预测流曲线和使用珠流进行的直接测量结果吻合良好。使用以下公式计算通过矩形横截面(τ,表示为fss)的壁流体剪切应力:
τ=6μq/bh2,
其中μ是培养基粘度,
b是通道宽度,并且
h是通道高度(有流体流通过的空通道近似为矩形横截面(b=14mm;h=2.6mm),是类器官所在的位置。
在该研究中,改变体积流率以引起从0.0000001至0.0001dyn/cm2的低fss和从0.008至0.035dyn/cm2的高fss。请注意,可以通过简单地增加ecm高度来减小通道尺寸,在给定的体积流率下产生更高的fss。我们构建的通道高度小至b=0.5mm,导致fss约为~1dyn/cm2,与经受0.008至0.035dyn/cm2fss那些相比,在此芯片上培养的类器官表现出相当的血管性和肾小管/肾小球成熟度增强。
细胞培养。
如先前报道,使用补充有10ng/mlfgf2(peprotech)的stemfitbasic02(ajinomotoco.,inc.)在无饲养层培养中维持人类esc,h9(wicell)和人类ipsc,bjff(由华盛顿大学的sanjayjain教授提供)。使用egm2培养基(lonza)培养人肾小球微血管内皮细胞(gmec)和rfp表达(angio-proteomie),并使用至第9代。使用egm-2培养基(lonza)培养人脐静脉内皮细胞(huvec)和rfp表达(angio-proteomie),并使用至第9代。按照供应商的说明培养人类新生儿真皮成纤维细胞(hndf)和gfp表达(angio-proteomie),并使用至第15代。
类器官的制备和培养。在其他地方(morizane,r.&bonventre,j.v.,“generationofnephronprogenitorcellsandkidneyorganoidsfromhumanpluripotentstemcells”,natprotoc,12:195-207(2017))中详细介绍了类器官的制备,但简要地hpsc通过3步定向分化方案被分化为后肾间充质细胞,其中包括six2+肾单位祖细胞,效率约为80-90%(图3,底部)。后肾间充质细胞在悬浮培养中分化为前管聚集体,然后将聚集体转移到芯片上(图3,顶部,在第11天和第14天工作之间的任何时间(图22b)。通过相同的分化方案(如前述报道)模拟到类器官的进一步分化,除了添加了1.5%fbs(热灭活,gibco)(morizane,r.&bonventre,j.v.,“generationofnephronprogenitorcellsandkidneyorganoidfromhumanpluripotentstemcells”,natprotoc,12:195-207(2017))。可以使用相同的过程大规模扩大使用elplasiatm(具有图案化微孔(kuraray)的培养板)的肾脏类器官的生产(图30)。使用传统方法,肾脏类器官包含大约100,000个细胞/聚集体。但是,在与6孔板中的单个孔相同的占用面积内,可以生产约1,000个微型类器官,其包含约5,000个细胞/聚集体。值得注意的是,当将这些微型类器官放置在芯片上的当前工程化的微环境中时,它们的行为类似于较大的类器官,并在高fss条件下表现出增强的血管化。这些微型类器官具有优势,因为它们的组装具有很高的可扩展性,并且可以通过共聚焦显微镜在其整个深度上成像。
接下来,研究了几种不会导致增强的血管化的实验条件。特别是,通过在第8天将成人原代gmec与肾单位祖细胞聚集或将成人原代gmec置于肾聚集体或囊泡附近的培养基或ecm中来添加成人原代gmec并不成功(图20)。发育中的肾脏类器官可能在第8天不能适当形成,或者huvecs、hndf和成年gmec不能分别整合到正在形成的类器官中(图32)。
阿霉素(dox)暴露。
从培养的第20天到第21天,在静态或高fss条件下,以10μm将化学治疗药物dox(sigma)给药24小时。
珠灌注。
在静态或灌注条件下分化的第21天,将100nm荧光珠以1:1000的稀释比例添加至培养基(来自thermofisher的fluospheres,羧酸盐终端)。对于静态情况,在载有珠的培养基存在下,将类器官在培养箱中轻轻晃动2小时。对于灌注条件,在培养箱中,在高fss条件下,用载有珠的培养基灌注芯片上的肾脏类器官2小时。然后使用共聚焦显微镜对肾脏类器官进行成像,以确定荧光珠在其中的分布。样品中的基准标记用于确保,在固定、清洗和染色pecam1(cd31)后,使用内皮标记收集同一共聚焦z堆栈,并且可以与珠位置正确关联。注意,在清洗以及初次和二次染色过程中,珠几乎被完全冲洗掉。渲染z堆栈图像和重建图像(图13和25)。
虽然发现珠非特异性地结合到静态和灌注的类器官,但是它们在较大的管腔cd31+结构中集中并且在高fss条件下贯穿那些类器官的整个深度在那些管腔空间中观察到。
为了获得实时灌注珠影像,使用了稍微不同的技术。首先,实时成像需要对血管系统进行非常明亮且持久的染色。已尝试使用荧光团耦联抗体对cd31和cd146进行实时标志,但信号不强。取而代之的是,使用了罗丹明耦联的凝集素(ulex:来自vectorlaboratories的荆豆凝集素i(ueai)),因为该信号与cd31和cd146重叠并且明亮。由于从厚类器官组织散射和仅通过超灌流引起的珠非特异性沉积是已知问题,因此,替代地,对在开始珠灌注的前15分钟内进行血管实时成像。我们在类器官的底部附近、靠近玻璃的位置成像,此处与类器官的顶部相比,灌注可能受到限制,但非特异性珠粒的摄取也是如此。在成像之前,将类器官在培养基中以1:200的ulex稀释比例灌注。用3倍体积稀释比例的新鲜培养基快速冲洗掉ulex,并用1:1000稀释比例的培养基+珠代替。在帧之间以400ms拍摄了900帧图像,并关闭了ulex激光的一半,以便仅在芯片上捕获珠流。该视频以每秒20帧渲染。
流式细胞术。
为了制备用于流式细胞术的活细胞,需要几个消化步骤。首先,将类器官(每个条件下10至15种)从ecm上切下,并放入15mlfalcon管中。除去过量的培养基,并用不含ca+2和mg+2的pbs洗涤样品。然后在37℃下添加100ul的10mmedta(sigma-aldrich)中的2.5%胰蛋白酶(corning)2分钟。然后添加1.9ml不含ca+2和mg+2的pbs,并将管以300xg离心4分钟。吸出上清液,添加200μl胶原酶iv(stemcelltechnologies),并移取悬浮液以进一步分解类器官。将样品在37℃下孵育10分钟。再次移液后,添加5mlpbs,并将样品以300xg离心4分钟。吸出上清液,将细胞与在无ca+2和mg+2的pbs中以1:10稀释的flk1-555(bioss)在冰上孵育30分钟。将样品用不含ca+2和mg+2的pbs洗涤3次,然后将其悬浮在流体共300μl的bdfacsflowbuffer中的dapi(sigma)或sytoxred(thermofisher1:1000稀释)中。在流式细胞仪成像之前,将样品通过falcon70μm过滤器。通过流式细胞仪(bdlsrfortessa)分析细胞,并从每个样品的n=100,000个细胞收集数据。用于确保对活的、均质细胞进行计数的所有门均显示在图31中。请注意,在图31(d、f)中,观察到第21天异质肾脏类器官的大和小细胞尺寸的双峰群体。可以预料的是,发现kdr+epc主要在小组分中。据推测,保留在大细胞组分中的kdr+细胞归因于具有形态变化的内皮分化。
qrt-pcr。
通过移液管从可灌注芯片手动提取肾脏类器官。根据制造商的方案,使用trizol(invitrogen)从肾脏类器官样品中分离rna。每个样品至少使用6种类器官。使用高容量cdna反转录试剂盒(appliedbiosystems)合成cdna。实时定量pcr使用itaqsybrgreensupermix(bio-rad)和bio-radiq5多色实时pcr检测系统进行。引物序列是使用fasta序列设计的(pubmed),并使用primer3进行了验证,引物对中的一个引物设计为包含外显子-外显子接头。将靶基因标准化为甘油醛3-磷酸脱氢酶(gapdh)表达。使用2-δδct方法计算mrna表达,表示为相对于对照组的n倍差异,并用标准误差条报告。值得注意的是,通过看家基因、gapdh的dna凝胶电泳在样品之间证实了cdna质量。
引物
获得小鼠胚胎肾脏。
所有程序均符合《美国国立卫生研究院关于实验动物的管理和使用指南》,并已由brighamandwomen’shospital的机构动物管理和使用委员会批准。从定时怀孕的雌性(charlesriver)中分离出处于e14.5阶段(注入日=e0.5)的胚胎肾脏。
电子显微镜。
对于透射电子显微镜(tem),使用在0.1m二甲胂酸钠缓冲液(ph7.4)中的2.5%戊二醛、1.25%多聚甲醛和0.03%苦味酸将肾脏类器官或小鼠胚胎肾脏固定就位最少几个小时。切下小样品(1mmx1mm),并在0.1m的二甲胂酸盐缓冲液中洗涤,并在1%的四氧化锇(oso4)(ems)和1.5%的亚铁氰化钾(kfecn6)(sigma)中浸浴1小时,在水中洗涤3次并在1%醋酸双氧铀水溶液(ems)中孵育1小时,然后在水中洗涤2次,随后在不同等级的酒精中脱水(每次10分钟;50%、70%、90%,2x10分钟100%)。然后将类器官或小鼠肾脏放入环氧丙烷(ems)中1小时,并在环氧丙烷与taabepon(marivaccanadainc.st.laurent,canada)的1:1混合物中孵育过夜。第二天,将样品嵌入taabepon中,并在60℃下聚合48小时。在reichertultracut-s切片机上切割超薄切片(约60nm),放置在铜栅上,用柠檬酸铅染色,并在jeol1200ex透射电子显微镜中检查,并使用amt2kccd相机记录图像。
对于扫描电子显微镜(sem),再次使用在0.1m二甲胂酸钠缓冲液(ph7.4)中的2.5%戊二醛、1.25%多聚甲醛和0.03%苦味酸将肾脏类器官或小鼠胚胎肾脏固定就位最少几个小时。然后将它们用pbs洗涤3次,直到苦味酸(黄色)被洗掉。将类器官/小鼠肾脏置于30%蔗糖的pbs溶液中1小时。然后除去该溶液,并用pbs中30%蔗糖溶液:最佳切割温度(oct)冷冻培养基(electronmicroscopyscience)的1:1混合物在室温下代替30-45分钟。然后将类器官置于冷冻模具中冷冻,除去多余的流体,将oct放在顶部以填充模具。将类器官冷冻并置于-20℃冰箱中过夜。然后将样品在切片机(thermofisher)中切成5微米切片,安装在载玻片上,并用苏木精和曙红染色。看到鲍曼氏囊的开口后,便停止切片。然后通过将样品加热到40℃、从oct上物理去除样品、用水充分洗涤然后使组织脱水,从而将类器官从oct中解除。随后需要使用不同等级的乙醇进行脱水(每次20分钟;30%、50%、70%、90%,3x20分钟100%)。然后将样品置于50%乙醇和50%六甲基二硅氮烷(hmds)中30分钟,然后是100%hmds3x30分钟。所有步骤均在密闭的玻璃容器中进行。在用hmds进行最终清洗后,将样品取出并放在通风橱中的开放容器中干燥。使用导电碳带将干燥后的样品安装到铝销架上,用5nm的金或铂进行溅射涂覆,并用ultraplusfieldemissionsem(zeiss)在1kev下成像。
免疫染色。
使用免疫染色然后共聚焦显微镜来评估类器官内或附近的细胞或细胞外蛋白的定位。免疫染色之前,将每个类器官样品用pbs洗涤,然后使用10%缓冲福尔马林固定1小时。使用在pbs中的几次洗涤去除固定液数小时,然后使用含的1wt%驴血清在pbs中封闭过夜。将的一抗与该构建体在下表中列出的稀释液中在0.5%bsa和0.125wt%tritonx-100的溶液中于4℃下孵育2天。使用针对pbs或0.5wt%bsa和0.125wt%tritonx-100在pbs中的溶液的洗涤步骤,完成未结合的一抗的去除1天。将二抗与构建体在0.5wt%bsa和0.125wt%tritonx-100的pbs溶液中以1:500稀释度孵育数小时。样品用dapi复染,然后在成像前在pbs中清洗至少几个小时。
免疫染色然后共焦显微检查用于评估类器官内或附近的细胞或细胞外蛋白的定位。在免疫染色之前,将每个类器官样品用pbs清洗,随后使用10%缓冲福尔马林固定1h。使用在pbs中数次清洗数小时来去除固定剂,随后使用在pbs中的1wt%驴血清和0.125wt%tritonx-100阻断整夜。将所关注的蛋白质或生物标记物的一抗与构建体一起以下表中所列的稀释比例在0.5wt%bsa和0.125wt%tritonx-100的溶液中温育1日。未结合一抗的去除以如下方式进行:使用pbs溶液或在pbs中的0.5wt%bsa和0.125wt%tritonx-100进行1日的清洗步骤。将二抗与构建体一起以1:500的稀释比例在0.5wt%bsa和0.125wt%tritonx-100的pbs溶液中温育数小时。将样品用dapi复染色,随后在成像前在pbs中清洗至少数小时。
抗体
图像渲染和分析。
使用具有1.25x至40x物镜范围的倒置的leicadmil显微镜进行相差显微研究。采用具有405、488、514、561和633nm波长的光谱激光器,使用具有5x至40x水浸物镜范围的直立zeisslsm710进行共聚焦显微研究。使用具有最大像素强度设置的z投影函数在imaris中进行z堆栈的图像重建。亮度的任何增加均在整个z投影图像上均匀进行。还使用imaris软件进行了3d图像重建和旋转影像。cytosmart(lonza)培养箱系统用于捕获延时成像。共聚焦z堆栈用于计数纤毛细胞的百分比(图15),每个条件>64个计数,包括4个生物学重复,以及被血管细胞侵入或包裹的podxl+簇的数量(图18b),每个条件n>14个生物学重复,在高流量和静态条件下超过4个独立实验,以及每个条件6至16次生物学重复(整个类器官),对于vegf抑制和添加超过2个独立实验。
angiotool分析
在各种培养条件下,从ipsc和esc衍生的固定的整个类器官中提取pecam1的共聚焦z-堆栈。在每个样品的共聚焦深度的极限处获取z堆栈,每个样品大约250μm,表示每个被分析的类器官的体积大致相同。然后使用imagej将这些z堆栈展平为2d最大强度投影(按angiotool的要求进行输入)。在angiotool上使用默认设置进行分析,并对每个类器官分析了4、7、10和14的血管直径。在所有情况下,整个类器官都用于分析。
imaris分析
在各种培养条件下,从ipsc和esc衍生的固定的整个类器官中提取pecam1和ltl的共聚焦z-堆栈。在每个样品的共聚焦深度的极限处获取z堆栈,每个样品大约250μm,表示每个被分析的类器官的体积大致相同。然后在imaris成像软件中打开这些z堆栈。共聚焦3d渲染变成了血管表面和肾小管表面。然后,使用表面积接触工具上的imaris表面来量化3d血管和肾小管表面之间的重叠百分比,其值在图17(d)中报告。为了评估血管系统与肾小管的平均距离,首先在肾小管表面进行了imaris距离转换。然后,所得通道被血管表面掩蔽,以创建新的掩蔽距离转换通道。在fiji(imagej)中打开了该掩蔽距离转换通道,以获取所有3d点的直方图,从中我们获得了每个样品的几何平均值,如图17(c)所报告。
统计分析
所有图中的数据表达为平均值±标准偏差。使用matlab和graphpadprism7进行统计分析,并使用tukey's多重成对比较试验的anova确定统计显著性值p<0.05。不同的显著性水平(p值)用星号表示,例如:*p<0.05,**p<0.01,***p<0.001。
在整个说明书中,已经给出了关于所要求保护的发明的优选和替代实施方式的各种指示。然而,前述详细描述应被认为是说明性的而不是限制性的,并且本发明不限于所提供的实施方式中的任何一个。应该理解的是,包括所有等同物的所附权利要求旨在限定本发明的精神和范围。
序列表
<110>哈佛大学的校长及成员们
布里格姆及妇女医院股份有限公司
<120>增强肾脏类器官发育的方法及其使用方法
<130>14968-136(hu6909)
<150>us62/517,536
<151>2017-06-09
<160>58
<170>patentinversion3.5
<210>1
<211>20
<212>dna
<213>人工序列
<220>
<223>abcb1基因的正向引物
<400>1
ccatgctcagacaggatgtg20
<210>2
<211>20
<212>dna
<213>人工序列
<220>
<223>abcb1基因的反向引物
<400>2
ttcctgtcccaagatttgct20
<210>3
<211>20
<212>dna
<213>人工序列
<220>
<223>aqp1基因的正向引物
<400>3
gtccaggacaacgtgaaggt20
<210>4
<211>20
<212>dna
<213>人工序列
<220>
<223>aqp1基因的反向引物
<400>4
gaggaggtgatgcctgagag20
<210>5
<211>20
<212>dna
<213>人工序列
<220>
<223>atp1a1基因的正向引物
<400>5
ccaattgtgttgaaggcacc20
<210>6
<211>23
<212>dna
<213>人工序列
<220>
<223>atp1a1基因的反向引物
<400>6
ccgtgatgatgtggataaaatgt23
<210>7
<211>21
<212>dna
<213>人工序列
<220>
<223>bnc2基因的正向引物
<400>7
ctatgttctagcccagacccc21
<210>8
<211>22
<212>dna
<213>人工序列
<220>
<223>bnc2基因的反向引物
<400>8
tatgttggcactgtgtctgtct22
<210>9
<211>20
<212>dna
<213>人工序列
<220>
<223>casz1基因的正向引物
<400>9
cactgtcaagaacggactgc20
<210>10
<211>20
<212>dna
<213>人工序列
<220>
<223>casz1基因的反向引物
<400>10
acgtcctgcttactcgtgaa20
<210>11
<211>25
<212>dna
<213>人工序列
<220>
<223>cux1基因的正向引物
<400>11
gctgaagtgaaaaatcaagaggtta25
<210>12
<211>20
<212>dna
<213>人工序列
<220>
<223>cux1基因的反向引物
<400>12
gctttgaggtggtggacatc20
<210>13
<211>20
<212>dna
<213>人工序列
<220>
<223>gapdh基因的正向引物
<400>13
caatgaccccttcattgacc20
<210>14
<211>20
<212>dna
<213>人工序列
<220>
<223>gapdh基因的反向引物
<400>14
gacaagcttcccgttctcag20
<210>15
<211>22
<212>dna
<213>人工序列
<220>
<223>kdr基因的正向引物
<400>15
aggacttccagggaggaaataa22
<210>16
<211>22
<212>dna
<213>人工序列
<220>
<223>kdr基因的反向引物
<400>16
aaagtaatttcaggacccctgg22
<210>17
<211>20
<212>dna
<213>人工序列
<220>
<223>lrp2基因的正向引物
<400>17
tgtgatgcagccatcgaact20
<210>18
<211>20
<212>dna
<213>人工序列
<220>
<223>lrp2基因的反向引物
<400>18
tgcatttggggaggtcagtc20
<210>19
<211>21
<212>dna
<213>人工序列
<220>
<223>mcam基因的正向引物
<400>19
cgtctcgtaagagcgaacttg21
<210>20
<211>22
<212>dna
<213>人工序列
<220>
<223>mcam基因的反向引物
<400>20
cgatgtatttctctccctggtc22
<210>21
<211>20
<212>dna
<213>人工序列
<220>
<223>nfia基因的正向引物
<400>21
acaggtggggttcctcaatc20
<210>22
<211>19
<212>dna
<213>人工序列
<220>
<223>nfia基因的反向引物
<400>22
tgggtgtcgagtaggttgg19
<210>23
<211>23
<212>dna
<213>人工序列
<220>
<223>npas2基因的正向引物
<400>23
ttttgcagaaacacaatgaagtc23
<210>24
<211>19
<212>dna
<213>人工序列
<220>
<223>npas2基因的反向引物
<400>24
ccaaggagaggcgtgatac19
<210>25
<211>21
<212>dna
<213>人工序列
<220>
<223>nphp1基因的正向引物
<400>25
accggtgaagaatacatcgct21
<210>26
<211>25
<212>dna
<213>人工序列
<220>
<223>nphp1基因的反向引物
<400>26
tataaggctctaggtaggttctggg25
<210>27
<211>20
<212>dna
<213>人工序列
<220>
<223>nphp6基因的正向引物
<400>27
aggataccaaaggagcccaa20
<210>28
<211>23
<212>dna
<213>人工序列
<220>
<223>nphp6基因的反向引物
<400>28
tcttcaagactgctgattgtacg23
<210>29
<211>20
<212>dna
<213>人工序列
<220>
<223>nphs1基因的正向引物
<400>29
gacccagcttcccatcacta20
<210>30
<211>20
<212>dna
<213>人工序列
<220>
<223>nphs1基因的反向引物
<400>30
gcattggagaggagcagaag20
<210>31
<211>21
<212>dna
<213>人工序列
<220>
<223>pecam1基因的正向引物
<400>31
tcattacggtcacaatgacga21
<210>32
<211>20
<212>dna
<213>人工序列
<220>
<223>pecam1基因的反向引物
<400>32
gagtatctgctttccacggc20
<210>33
<211>20
<212>dna
<213>人工序列
<220>
<223>pdgfr-beta基因的正向引物
<400>33
atacccccgcaaagaaagtg20
<210>34
<211>20
<212>dna
<213>人工序列
<220>
<223>pdgfr-beta基因的反向引物
<400>34
cactctccgtcacattgcag20
<210>35
<211>20
<212>dna
<213>人工序列
<220>
<223>pkd1基因的正向引物
<400>35
aacaagtctttggccatcac20
<210>36
<211>20
<212>dna
<213>人工序列
<220>
<223>pkd1基因的反向引物
<400>36
tactcgttcagcacggtgac20
<210>37
<211>20
<212>dna
<213>人工序列
<220>
<223>pkd2基因的正向引物
<400>37
tcttggcaatttcagccttt20
<210>38
<211>20
<212>dna
<213>人工序列
<220>
<223>pkd2基因的反向引物
<400>38
gcacaacgatcacaacatcc20
<210>39
<211>20
<212>dna
<213>人工序列
<220>
<223>pkhd1基因的正向引物
<400>39
ccattctctgccaggttagc20
<210>40
<211>20
<212>dna
<213>人工序列
<220>
<223>pkhd1基因的反向引物
<400>40
acccctaatcagcacagtgg20
<210>41
<211>23
<212>dna
<213>人工序列
<220>
<223>slc2a2基因的正向引物
<400>41
gctgctgaataagttctcttgga23
<210>42
<211>20
<212>dna
<213>人工序列
<220>
<223>slc2a2基因的反向引物
<400>42
ctaaagcagcaggacgtggt20
<210>43
<211>20
<212>dna
<213>人工序列
<220>
<223>slc6a19基因的正向引物
<400>43
acaactgcgagaaggactcg20
<210>44
<211>20
<212>dna
<213>人工序列
<220>
<223>slc6a19基因的反向引物
<400>44
gtgctgaagcagtcgtcgta20
<210>45
<211>21
<212>dna
<213>人工序列
<220>
<223>slc9a3基因的正向引物
<400>45
ggcaggagtacaagcatctgt21
<210>46
<211>19
<212>dna
<213>人工序列
<220>
<223>slc9a3基因的反向引物
<400>46
cccggtcctgtttctcgtc19
<210>47
<211>20
<212>dna
<213>人工序列
<220>
<223>slc34a1基因的正向引物
<400>47
tcacgaagctcatcatccag20
<210>48
<211>20
<212>dna
<213>人工序列
<220>
<223>slc34a1基因的反向引物
<400>48
ttcctcagggactcatcacc20
<210>49
<211>20
<212>dna
<213>人工序列
<220>
<223>synpo基因的正向引物
<400>49
gccgcaaatccatgtttact20
<210>50
<211>20
<212>dna
<213>人工序列
<220>
<223>synpo基因的反向引物
<400>50
ctcatccgctgtctgtacca20
<210>51
<211>19
<212>dna
<213>人工序列
<220>
<223>tead1基因的正向引物
<400>51
caaggtttgagaatggccg19
<210>52
<211>21
<212>dna
<213>人工序列
<220>
<223>tead1基因的反向引物
<400>52
tccctgtttgttaccaccaat21
<210>53
<211>21
<212>dna
<213>人工序列
<220>
<223>trps1基因的正向引物
<400>53
tttcccgacactacaggagag21
<210>54
<211>20
<212>dna
<213>人工序列
<220>
<223>trps1基因的反向引物
<400>54
ccgttggctgtagtgatgtc20
<210>55
<211>23
<212>dna
<213>人工序列
<220>
<223>vegfa基因的正向引物
<400>55
gtccaacatcaccatgcagatta23
<210>56
<211>21
<212>dna
<213>人工序列
<220>
<223>vegfa基因的反向引物
<400>56
gctgtaggaagctcatctctc21
<210>57
<211>20
<212>dna
<213>人工序列
<220>
<223>wt1基因的正向引物
<400>57
gggtacgagagcgataacca20
<210>58
<211>20
<212>dna
<213>人工序列
<220>
<223>wt1基因的反向引物
<400>58
tctcaccagtgtgcttcctg20
- 还没有人留言评论。精彩留言会获得点赞!