用于骨组织再生的集成生物材料及其制备方法与流程
【技术领域】
本发明涉及一种用于骨组织再生的集成生物材料及其制备方法,且更具体地,涉及一种用于骨组织再生的、包括由细胞外基质蛋白和骨矿物质组成的下部结构和由细胞外基质蛋白组成的上层的集成生物材料及其制备方法。
背景技术:
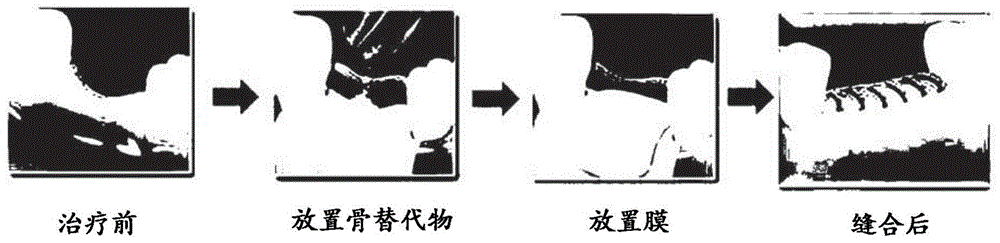
支持牙齿的牙周组织大致由牙槽骨、构成牙槽骨和牙齿之间的牙周膜的结缔组织、上皮组织和牙周韧带组织组成。由于牙周炎的进展而导致的牙槽骨损失会伴随牙周韧带组织的损失,并且由于牙周治疗后组织损失部位的结缔组织的过度生长,牙槽骨和牙周韧带组织的正常恢复是不可能的。另外,即使在产生新骨时,牙周韧带组织也可能无法正常分化,从而导致牙齿功能丧失。因此,为了解决这些问题,将人工屏障膜与骨替代物移植一起用作牙槽骨再生手术。单独使用骨移植材料时,存在的缺点在于,骨移植材料难以保持在移植部位,并且因此使用骨移植材料填充骨损失部位并在其上放置屏蔽(屏障)膜并缝合所述膜(参见图1)的方法来诱导组织再生。同时使用骨移植材料和屏障膜时,种植在下侧的骨移植材料和上侧的屏障膜必须彼此紧密接触以促进骨再生,因此增加骨移植成功率。相反,如果骨移植材料和屏障膜之间存在间隙,则骨再生的成功率降低。然而,应用骨移植材料和屏障膜的单独产品使两种产品之间不可能实现完美的紧密接触。因此,如果开发出兼具骨移植材料和屏障膜功能的集成产品,则可以增加骨再生的成功率。可以在一种产品中同时获得骨移植材料的骨传导性和屏障膜的结缔组织预防作用,并且因此可以提高使用便利性(参见图2a和2b)。
直到最近,用于骨再生手术的最常用的移植材料包括自体骨移植材料、同种异体骨移植材料、异种骨移植材料和合成骨移植材料,但是自体骨需要二次手术进行骨收集,使得难以获得此类骨,同种异体骨在被疾病污染的可能性方面存在问题,而合成骨与天然骨组织的生物相容性低,并且因此异种骨被广泛使用。
至于屏障膜,据报道在过去的20年中已经使用屏障膜有效地诱导牙周组织的再生(j.gottlow等人,j.clin.perio,13,(1986)第604-616页),并且自那时以来,已经使用各种材料作为屏障膜进行了组织诱导和再生的研究。最近,在可生物降解的屏障膜中,由胶原制成的屏障膜使用最为广泛,但具有局限性,诸如机械强度弱和与骨移植材料不完全紧密接触。
同时,人体中的骨和牙齿含有大约80%的矿物质和水以及20%的有机物,而有机物中的80%由胶原蛋白组成,且其中的20%由非胶原蛋白组成。这些蛋白组分不仅有助于维持硬组织的产生以及结构强度和弹性,而且还可以作为基质用于诱导硬组织形成细胞(诸如成骨细胞)的粘附和用于定向构成硬组织组分的无机离子组分(anselme,osteoblastadhesiononbiomaterials,biomaterials,21(7):667-81,2000)。
现有的异种骨衍生的骨移植材料仅含有矿物质组分,从这些材料中蛋白被完全去除,并且因此不具有与天然骨相同的结构。为了解决这一问题,正在开发引入了构成骨组织的蛋白诸如胶原的生物材料。然而,不可能通过简单地混合胶原和骨移植材料制备稳定的生物材料,并且现有的生物材料制备方法在制备具有屏障膜功能的生物材料方面具有局限性。
同时,已经尝试了分别制备上层和下部结构并在最终产品阶段中使用化学交联剂通过共价键合使所述上层与所述下部结构结合的方法,但是在固相状态中几乎不发生交联反应,使得无法形成足够的键合,并且当允许产品充分吸收生理盐水溶液或与之水合使用时,存在诸如上层和下部结构之间分离的问题。另外,使用化学交联剂时,产品中应不存在化学交联剂残留,但是如果残留,则可能会在移植部位引起毒性,并且因此化学交联剂在安全方面表现出不利的影响。另外,当分别种植下部结构和上层时,两个结构之间产生空间,并且因此结缔组织可以不仅从上侧而且从侧表面浸润其中,从而干扰从下侧开始的骨再生过程,导致骨再生效率显著降低。
因此,为了解决上述问题,需要开发一种不仅实现骨组织环境,而且具有能够防止结缔组织浸润的屏障膜功能的集成生物材料。
因此,由于付出巨大努力来解决上述常规问题,本发明的发明人开发了集成生物材料,细胞外基质和骨矿物质组分被有机地结合到所述集成生物材料上,以便具有与骨组织相似的组成,并且具有屏障膜功能,并且确认了这种集成生物材料对骨再生具有优异的效果,因此完成了本发明。
技术实现要素:
【技术问题】
因此,鉴于以上问题提出了本发明,并且本发明的目的是提供一种用于骨组织再生的集成生物材料及其制备方法,所述集成生物材料不仅实现了骨组织环境,而且还防止了结缔组织浸润,从而显示出最大化的骨组织再生能力。
【技术方案】
根据本发明,上述和其他目的可以通过提供用于骨组织再生的集成生物材料来实现,所述集成生物材料包含:包括细胞外基质蛋白和骨矿物质组分的下部结构;和包括细胞外基质蛋白的上层。
根据本发明的一个方面,上述和其他目的可以通过提供用于骨组织再生的集成生物材料的用途来实现,所述集成生物材料包含:包括细胞外基质蛋白和骨矿物质组分的下部结构;和包括细胞外基质蛋白的上层。
根据本发明的另一个方面,提供了骨组织再生方法,所述方法包括将集成生物材料种植到需要骨组织再生的个体中,所述集成生物材料包含:包括细胞外基质蛋白和骨矿物质组分的下部结构;和包括细胞外基质蛋白的上层。
根据本发明的另一个方面,提供了一种制备用于骨组织再生的集成生物材料的方法,所述集成生物材料包含:包括细胞外基质蛋白和骨矿物质组分括的下部结构;和包细胞外基质蛋白的上层,所述方法包括:(a)模制包括细胞外基质蛋白和骨矿物质颗粒的下部结构混合物;(b)对齐包括细胞外基质蛋白和骨矿物质颗粒的下部结构混合物的结构;(c)在所述结构上放置包括细胞外基质蛋白的上层;(d)使所述上层与所述下部结构结合;(e)冻干所得结构;以及(f)热交联上层的细胞外基质蛋白。
【附图说明】
根据以下具体实施方式结合附图将更清楚地理解本发明的上述及其他目标、特征及其他优点,其中:
图1是展示一般骨移植程序的示意图,其中,在首先填充骨移植材料之后,在所述材料上放置屏障膜并缝合;
图2a是集成了骨移植材料和屏障膜功能的集成生物材料的示意图,图2b是集成了骨移植材料和屏障膜功能的集成生物材料的差示扫描电子显微镜图像,并且图2c展示了分别使用移植材料和屏障膜或集成了骨移植材料和屏障膜功能的集成生物材料的骨再生过程;
图3展示了显示根据实施例1、实施例2和实施例3制备的集成生物材料的差示扫描显微镜图像,其中箭头表示胶原层;
图4展示了观察胶原酶对实施例1、实施例2和实施例3的每种集成生物材料的上部胶原层的降解程度的结果,其中箭头表示胶原层;并且
图5展示了观察在将实施例1、实施例2和实施例3的每种集成生物材料种植到兔的骨缺损部位后的骨再生程度的结果,其中箭头表示胶原层,g表示骨移植材料,且nb表示新骨。
【具体实施方式】
除非另外定义,否则本文所用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常所理解的相同的含义。通常,本文所用的命名法在本领域中为熟知的并且为通常使用的。
在本发明中,已经确认,当将通过在由细胞外基质蛋白和骨矿物质组成的下部结构上形成由细胞外基质蛋白形成的上层而制备的集成生物材料用作骨移植材料时,所述下部结构实现了促进新骨再生的骨组织环境,并且上层使得骨移植材料能够稳定地保持在骨缺损部位,并且通过防止上皮组织或结缔组织的浸润而在移植部位实现了天然的骨组织环境,从而使骨组织的再生能力最大化。
另外,可以通过在初始制备过程中诱导两个结构之间的物理结合来制备集成生物材料,而不使用除主要原料以外的其他试剂,诸如化学交联剂,并且因此可以避免由化学交联剂引起的毒性问题,并且即使在水合之后,上层和下层也不会彼此分离,因此还实现了结构稳定性。
另外,与其中当分别种植下部结构和上层时,结缔组织浸润两个结构之间的空间并因此干扰骨再生过程的情况相比,集成生物材料在两者之间没有空间,并且因此,结缔组织不会浸润集成生物材料侧面,使得顺利且有效地诱导了从集成生物材料底部开始的骨再生过程(参见图2c)。
因此,本发明的实施方案涉及用于骨组织再生的集成生物材料,所述集成生物材料包含包括细胞外基质蛋白和骨矿物质组分的下部结构和包括细胞外基质蛋白的上层。
本发明的另一个实施方案涉及集成生物材料用于骨组织再生的用途,所述集成生物材料包含:包括细胞外基质蛋白和骨矿物质组分的下部结构;和包括细胞外基质蛋白的上层。
本发明的另一个实施方案涉及一种骨组织再生的方法,所述方法包括将集成生物材料种植到需要骨组织再生的个体中,所述集成生物材料包含:包括细胞外基质蛋白和骨矿物质组分的下部结构;和包括细胞外基质蛋白的上层。
本发明的另一个实施方案涉及制备用于骨组织再生的集成生物材料的方法,所述方法包括:(a)模制包括细胞外基质蛋白和骨矿物质颗粒的下部结构混合物;(b)对齐包括细胞外基质蛋白和骨矿物质颗粒的下部结构混合物的结构;(c)在所述结构上放置包括细胞外基质蛋白的上层;(d)使所述上层与所述下部结构结合;(e)冻干所得结构;以及(f)热交联上层的细胞外基质蛋白。
在本发明中,包括细胞外基质蛋白的上层必须有机结合至包括细胞外基质蛋白和骨矿物质组分的、作为骨组织样生物材料的下部结构,并且在体内应用时,不得与下部结构分离。另外,由于包括细胞外基质蛋白的上层当在体内种植时必须保持至少一个星期,因此通过蛋白酶(诸如胶原酶)的降解程度相对于总重量应为10%(w/w)或更低。在本发明中,在根据实施例1至实施例3制备的所有集成生物材料中,在胶原降解后两周的时间点,胶原酶对上层的胶原降解率在2.41%(w/w)至5.90%(w/w)的范围内,由此可以确认,上层作为屏障膜的保持可以持续一周或更长时间。
在本发明的过程(a)中,用包括细胞外基质蛋白和骨矿物质颗粒的下部结构混合物填充模具并模制。
在本发明的过程(b)中,细胞外基质蛋白和骨矿物质颗粒的下部结构混合物的结构的对齐意指由于蛋白链之间的距离变窄而在蛋白链之间形成疏水键、氢键等,从而使蛋白链排列对齐,产生结构稳定。
本发明的过程(c)中使用的细胞外基质蛋白的浓度在0.5%(w/w)至10%(w/w)的范围内,更优选地在2%(w/w)至5%(w/w)的范围内,相对于生物材料的总浓度。
本发明的过程(d)是使用强碱通过胶凝作用使所述上层(即细胞外基质蛋白层)和所述下部结构(即包括细胞外基质蛋白和骨矿物质颗粒的混合物)结合的过程,并且强碱可以选自氢氧化钠、氢氧化钾、氢氧化钙、氢氧化钡、氢氧化铵、碳酸钙、碳酸钾和氨,但是本发明不限于此。
本发明的过程(e)可通过在-1.5℃下冷冻2小时或更长时间,随后以1℃/min的冷冻速率在-20℃下冷冻来进行,但是可以应用本领域内通常使用的冻干法。
本发明的过程(f)旨在通过对上层的细胞外基质蛋白进行脱氢热处理来延长降解时间,并且可以通过在140℃至160℃下将其处理48小时至168小时来进行热交联。
同时,制备用于骨组织再生的集成生物材料的方法可以还包括:在过程(e)之后,(g)添加抗微生物或抗炎功能材料;以及(h)冻干。
在本发明中,下部结构和上层的细胞外基质蛋白可以是选自胶原、透明质酸、弹性蛋白、硫酸软骨素和丝素蛋白中的一种或多种。正因如此,可以使用细胞外基质,衍生自人或动物的基质或任何来自微生物的重组蛋白。具体地,在胶原的情况下,优选使用从猪皮肤分离的1型或3型。
在本发明中,骨矿物质组分可以是选自源自同种异体骨或异种骨的活生物体衍生的骨矿物质粉末、合成羟基磷灰石和磷酸三钙微粉中的一种或多种。
在本发明中,骨矿物质组分与细胞外基质蛋白的比例可以改变,并且相对于集成生物材料的总重量,骨矿物质组分的含量优选为80wt%或以上,更优选在80wt%至95wt%的范围内。相对于集成生物材料的总重量,下部结构的细胞外基质蛋白和上层的细胞外基质蛋白的总含量优选为5wt%或以上,更优选在5wt%至20wt%的范围内。
同时,上层的细胞外基质蛋白与下部结构的细胞外基质蛋白的量比(重量比)优选在0.13-1.3:1的范围内,并且具体地,当上层的细胞外基质蛋白与下部结构的细胞外基质蛋白的含量比(重量比)为0.5:1时,这在新骨形成能力的显著增加方面是最优选的。在这种情况下,相对于1重量份的下部结构的细胞外基质蛋白,当上层的细胞外基质蛋白的含量小于0.13重量份时,上层太薄(约200μm或更少),并且因此不能用作防止结缔组织浸润的屏障膜,并且相应地,这种情况不适合用作骨组织再生的集成生物材料。相对于1重量份的下部结构的细胞外基质蛋白,当上层的细胞外基质蛋白的含量大于1.3重量份时,上层的细胞外基质蛋白的浓度远高于下部结构中的细胞外基质蛋白浓度,因此显示出更高的密度,并且因此在放置上层并将上层与下部结构结合的过程中,由于密度差上层和下部结构之间的界面变得模糊不清,且下部结构中包括的骨矿物质引入上层,使得上层的细胞外基质蛋白层不能适当地充当屏障膜,并且因此这种情况不适合用作骨组织再生的集成生物材料。
在本发明中,包括细胞外基质蛋白的上层的厚度优选为整个生物材料厚度的20%至35%。优选地,上层的厚度在0.5mm至1.5mm的范围内,并且下部结构的厚度在1mm至6mm的范围内。更优选地,上层的厚度可以是1mm,并且下部结构的厚度可以在2mm至4mm的范围内,但是本发明不限于此。
根据本发明的集成生物材料可以还包含抗微生物或抗炎功能材料,并且所述抗微生物或抗炎功能材料可以是但不限于选自抗微生物剂、抗生素以及具有抗炎功能的肽或蛋白中的任何一种或多种。
在本发明中,抗微生物剂可以是但不限于乙二胺四乙酸钠、叶绿素铜钠、含氟或氯的合成材料诸如氟化钠或苄索氯铵、包括苯甲酸等的芳族羧酸、尿囊素或生育酚乙酸酯。
在本发明中,抗生素可以是但不限于米诺环素、四环素、强力霉素、氯己啶、氧氟沙星、替硝唑、酮康唑或甲硝唑。
抗微生物肽可以是衍生自人β-防御素的肽,并且所述抗微生物肽可以选自具有seqidno:1至3的氨基酸序列的肽,但是本发明不限于此。
seqidno:1(bd3-3):g-k-c-s-t-r-g-r-k-c-c-r-r-k-k
seqidno:2(bd3-3-m1):g-k-c-s-t-r-g-r-k-c-m-r-r-k-k
seqidno:3(bd3-3-m2):g-k-c-s-t-r-g-r-k-m-c-r-r-k-k
[实施例]
在下文中,将参考以下实施例进一步详细描述本发明。提供这些实施例仅出于展示目的,并且对于本领域普通技术人员而言清楚的是,本发明的范围不应解释为受这些实施例限制。因此,本发明的实质范围应由所附权利要求书及其等同物限定。
实施例1:集成了由牛骨衍生的骨矿物质颗粒和胶原组成的下部结构与胶原上层的集成生物材料(集成生物材料:含7.7%胶原,上层胶原浓度:0.5%)
制备具有0.4mm至0.8mm的粒径的牛骨衍生的骨矿物质颗粒。将27g骨矿物质组分与50ml溶于0.5m乙酸的4.0%(w/v)猪皮衍生的胶原(2g胶原)溶液混合,并且用所得混合物填充模具,并在干净的工作台上对齐下部结构。单独地,将50ml溶于0.5m乙酸的0.5%(w/v)猪皮衍生的胶原(0.25g胶原)溶液分配在混合物上以形成上部胶原层。所用胶原的重量为总重量的7.7%(w/w)。分配上部胶原层后,将所述层放置在干净的工作台上一段时间。将所得层在用25%至30%氨水饱和的氨蒸气中放置3小时或更长时间直至胶凝,并且然后用纯化水洗涤以中和ph值。
洗涤后,将所得产物在-1.5℃下冷冻2小时或更长时间,并且然后以1℃/min的冷冻速率冷冻至-20℃。确认集成生物材料在-20℃完全冷冻后,进行冻干48小时。将已冻干的集成生物材料在140℃的真空烘箱中交联120小时,从而完成集成生物材料的制备。
实施例2:集成了由牛骨衍生的骨矿物质颗粒和胶原组成的下部结构与上部胶原层的集成生物材料(集成生物材料:含10.0%胶原,上层胶原浓度:2.0%)
制备具有0.4mm至0.8mm的粒径的牛骨衍生的骨矿物质颗粒。将27g骨矿物质组分与50ml溶于0.5m乙酸的4.0%(w/v)猪皮衍生的胶原(2g胶原)溶液混合,并且用所得混合物填充模具,并在干净的工作台上对齐下部结构。单独地,将50ml溶于0.5m乙酸的2.0%(w/v)猪皮衍生的胶原(1g胶原)溶液分配在混合物上以形成上部胶原层。所用胶原的重量为总重量的10.0%(w/w)。分配上部胶原层后,将所述层放置在干净的工作台上一段时间。将所得层在用25%至30%氨水饱和的氨蒸气中放置3小时或更长时间直至胶凝,并且然后用纯化水洗涤以中和ph值。洗涤后,将所得产物在-1.5℃下冷冻2小时或更长时间,并且然后以1℃/min的冷冻速率冷冻至-20℃。确认集成生物材料在-20℃完全冷冻后,进行冻干48小时。将已冻干的集成生物材料在140℃的真空烘箱中交联120小时,从而完成集成生物材料的制备。
实施例3:集成了由牛骨衍生的骨矿物质颗粒和胶原组成的下部结构与上部胶原层的集成生物材料(集成生物材料:含14.3%胶原,上层胶原浓度:5.0%)
制备具有0.4mm至0.8mm的粒径的牛骨衍生的骨矿物质颗粒。将27g骨矿物质组分与50ml溶于0.5m乙酸的4.0%(w/v)猪皮衍生的胶原(2g胶原)溶液混合,并且用所得混合物填充模具,并在干净的工作台上对齐下部结构。单独地,将50ml(2.5g胶原)溶于0.5m乙酸的5.0%(w/v)猪皮衍生的胶原(2.5g胶原)溶液分配在混合物上以形成上部胶原层。所用胶原的重量为总重量的14.3%(w/w)。分配上部胶原层后,将所述层放置在干净的工作台上一段时间。将所得层在用25%至30%氨水饱和的氨蒸气中放置3小时或更长时间直至胶凝,并且然后用纯化水洗涤以中和ph值。洗涤后,将所得产物在-1.5℃下冷冻2小时或更长时间,并且然后以1℃/min的冷冻速率冷冻至-20℃。确认集成生物材料在-20℃完全冷冻后,进行冻干48小时。将已冻干的集成生物材料在140℃的真空烘箱中交联120小时,从而完成集成生物材料的制备。
比较实施例1:仅由下部结构组成的生物材料,所述下部结构由牛骨衍生的骨矿物质颗粒和胶原组成(生物材料:含6.90%胶原,上层胶原浓度:0%)
制备具有0.4mm至0.8mm的粒径的牛骨衍生的骨矿物质颗粒。将27g骨矿物质组分与50ml溶于0.5m乙酸的4.0%(w/v)猪皮衍生的胶原(2g胶原)溶液混合,并且用所得混合物填充模具,并在干净的工作台上对齐下部结构。所用胶原的重量为总重量的6.90%。分配上部胶原层后,将所述层放置在干净的工作台上一段时间。通过强碱使上部胶原层胶凝,并且然后用纯化水洗涤以中和ph值。洗涤后,将所得产物在-1.5℃下冷冻2小时或更长时间,并且然后以1℃/min的冷冻速率冷冻至-20℃。确认集成生物材料在-20℃完全冷冻后,进行冻干48小时。将已冻干的集成生物材料在140℃的真空烘箱中交联120小时,从而完成集成生物材料的制备。下表1中显示了使用的骨移植材料和胶原的量。
[表1]
实验实施例1:已制备的集成生物材料的结构观察
使用差示扫描电子显微镜观察根据实施例1至实施例3制备的集成生物材料和作为对照的我们的市售产品(ocs-bxenomatrix胶原,nibec,韩国)。每个组织结构化的模拟物均涂有铂,并用场发射扫描电子显微镜(fe-sem,jeol,s-4700,日本)观察。
图3是实施例1至实施例3的集成生物材料的一组差示扫描显微镜图像。观察到在实施例1至实施例3中制备的复合结构中胶原和骨矿物质组分均匀地混合,并且已确认由骨矿物质和胶原组成的下部结构与上部胶原层牢固地结合在一起,二者之间没有空隙。
实验实施例2:胶原酶降解试验
在hbss(盐溶液)溶液中含有20μg/ml的胶原酶(0.247u/mg冻干物),并且将实施例1至实施例3的集成生物材料放置一段时间,并检查其降解程度。
公式:
a:降解性试验前的重量(g)
b:降解性试验后的重量(g)
*由于骨移植材料不会被胶原酶降解,因此其不会影响胶原的降解率。
2周后,对作为整个结构的上部胶原层和下部结构(混合的骨移植材料和胶原)中的胶原降解活性进行试验,并且结果显示相对于试验前的重量最大降解至多6.90%且至少1%。考虑到在对照中下部结构中的胶原的降解率为1%,通过减去1%分别获得的各实施例1至实施例3中的仅上层中的胶原的降解率为2.41%至5.90%。
已确认上部胶原层被保留直到2周,并且在实施例2和实施例3中,上部胶原层的降解率保持在3%或以下。
下表2中显示了根据胶原酶浓度的降解程度。
[表2]
*1)胶原在集成结构(包括上部胶原层和下部结构)中的降解率
*2)用于制备上部胶原层的胶原的降解率
图4展示了显示实施例1至实施例3和对照的集成生物材料的表面的差示扫描电子显微镜图像,其中这些图像在完成降解试验以确定上层中胶原的降解程度之后获取。
实验实施例3:动物骨再生试验
在兔的颅骨中形成8mm的缺损,并且将实施例1至实施例3的每种集成生物材料和比较实施例1的生物材料作为对照植入其中8周,并且然后观察了新骨的形成程度和周围组织的再生能力(参见图5)。
当种植实施例2的生物材料时,形成了比其他组更多的新骨。另外,与比较实施例1相比,实施例2的集成生物材料在新骨的面积方面显示出约50%的增加。下表3显示了其组织形态测定结果。
[表3]
虽然已经参考本发明的具体实施方案具体描述了本发明,但是对于本领域普通技术人员来说显而易见的是,提供这些示例性实施方案仅用于展示性目的,并不旨在限制本发明的范围。因此,本发明的实质范围应由所附权利要求书及其等同物限定。
【工业实用性】
在根据本发明的用于骨组织再生的集成生物材料中,由细胞外基质蛋白和骨矿物质组分组成的下部结构实现了天然的骨组织环境,并且因此促进了新骨再生,并且具体地,将由细胞外基质蛋白的上层以适当的比例放置,并且因此不仅防止上皮组织或结缔组织的浸润,而且使骨组织再生能力最大化。
序列表自由文本
所附电子文件
sequencelisting
<110>纳米智能生物医学工程有限公司
首尔大学校产学协力团
<120>用于骨组织再生的集成生物材料及其制备方法
<130>pf-b2308
<140>pct/kr2017/008112
<141>2017-07-27
<150>kr10-2017-0077400
<151>2017-06-19
<160>3
<170>patentinversion3.5
<210>1
<211>15
<212>prt
<213>人工序列
<220>
<223>人β-防御素衍生肽(humanbeta-defensinderivedpeptide)(bd3-3)
<400>1
glylyscysserthrargglyarglyscyscysargarglyslys
151015
<210>2
<211>15
<212>prt
<213>人工序列
<220>
<223>人β-防御素衍生肽(humanbeta-defensinderivedpeptide)(bd3-3-m1)
<400>2
glylyscysserthrargglyarglyscysmetargarglyslys
151015
<210>3
<211>15
<212>prt
<213>人工序列
<220>
<223>人β-防御素衍生肽(humanbeta-defensinderivedpeptide)(bd3-3-m2)
<400>3
glylyscysserthrargglyarglysmetcysargarglyslys
151015
- 还没有人留言评论。精彩留言会获得点赞!