包含源于正分化成软骨细胞之干细胞的外排体的用于软骨细胞分化诱导或软骨组织再生的组合物的制作方法
本发明涉及用于诱导软骨细胞分化或用于使软骨组织再生的组合物。所述组合物可以包含来源于正分化成软骨细胞的干细胞的外排体作为活性成分。本发明可以包括用于诱导软骨细胞分化的培养基组合物、用于使软骨组织再生的注射制剂和用于治疗软骨病症的药物组合物,其所有都包含用于诱导软骨细胞分化或用于使软骨组织再生的组合物。本发明还可以包括使用所述组合物来治疗软骨病症的方法。
背景技术:
由于软骨组织的多种特征,当大面积受损时通过自然愈合难以使软骨组织再生。因此,已经开发了用于治疗受损的软骨组织的技术。例如,已经使用外科手术操作来治疗受损的软骨组织,所述外科手术操作例如人工关节置换操作、关节软骨的软骨成形术、微骨折技术等。然而,前述外科手术技术需要形成切口,这有问题地引起瘢痕并且产生耐久性较低的纤维软骨。因此,即使通过复杂的操作,外科手术技术的治疗效果还是不令人满意。因此,已经开发了使用水凝胶的可注射制剂,其可以采用无需形成大切口的简单外科手术过程进行递送,并且产生快速的治疗效果。例如,已经开发了使用透明质酸之亚烷基二胺交联水凝胶用于关节内施用的可注射溶液(参见韩国专利公开号2013-0028012)、包含胶原蛋白和透明质酸用于修复软骨组织的组合物(参见韩国专利登记号1279812)、包含氯膦酸和透明质酸用于治疗骨关节炎的药物制剂(参见韩国专利公开号2008-0082657)等。然而,尽管这些方法可以暂时减轻疼痛,但是其不足以诱导软骨组织再生。因此,需要有效地诱导细胞分化以使软骨组织再生的因素。
目前,用于诱导软骨组织再生的细胞治疗方法包括将体外培养的细胞移植到受损的组织区域。例如,已经开发了使用自体同源软骨细胞(参见韩国专利公开号2013-0072983)、来源于脐带的干细胞(参见韩国专利公开号2013-0009651)等的治疗方法。然而,使用自体同源软骨细胞来治疗大受损区域的治疗方法并不有效。这是因为使用自体同源软骨细胞的方法包括从患者收获细胞,培养细胞,并将细胞移植到患者中。另外,由于包括移植外科手术在内患者经历至少两次手术,故患者通常遭受身体疼痛和经济负担。干细胞治疗通常包括使用干细胞(例如脐带血、脂肪组织、滑膜和肌肉的干细胞)来进行细胞治疗。然而,干细胞治疗可能导致例如以下问题:在体内移植干细胞之后以低速率分化成软骨细胞、软骨细胞由于血管浸润而钙化、以及由与细胞肥大有关的基因表达引起的细胞凋亡。由于细胞数量和分化能力根据收集部位而不一致以及细胞表型由于在体外培养期间发生细胞去分化而改变,可能发生干细胞治疗的并发症。
如上所述,常规治疗技术利用以下方法:其中将从患者获得的软骨细胞或成体干细胞体外培养,分散在水凝胶中,并随后移植到受损的组织区域。由于细胞是直接注射的,因此可再生为接近正常的软骨组织。然而,常规治疗技术具有一些问题。例如,常规治疗技术不可避免地需要进行外科手术操作以获得细胞。此外,常规治疗技术可包括进行困难的体外培养过程,可根据受损组织区域的大小受细胞数量限制,并且可使细胞在体内以低速率分化成软骨组织。水凝胶分散细胞的一次施用可以暂时减轻疼痛并提高关节的活动性,但是最终难以用单次治疗立刻使受损的软骨组织再生。
为了解决现有技术的问题,本发明人从正分化成软骨细胞的干细胞只分离外排体并且发现包含该分离外排体的组合物的软骨再生作用,从而完成本发明。
(专利文献1)韩国专利公开号2013-0028012
(专利文献2)韩国专利登记号1279812
(专利文献3)韩国专利公开号2008-0082657
(专利文献4)韩国专利公开号2013-0072983
(专利文献5)韩国专利公开号2013-0009651
发明概述
本发明的一个方面是提供用于诱导软骨细胞分化或使软骨组织再生的组合物,其包含来源于正分化成软骨细胞的干细胞的外排体作为活性成分。
本发明的另一个方面是提供用于诱导软骨细胞分化的培养基组合物,其包含用于诱导软骨细胞分化或使软骨组织再生的组合物。
本发明的又一个方面是提供用于使软骨组织再生的注射制剂,其包含用于诱导软骨细胞分化或使软骨组织再生的组合物。
本发明的再一个方面是提供用于治疗软骨病症的药物组合物,其包含用于诱导软骨细胞分化或使软骨组织再生的组合物。
本发明的又一个方面是提供用于治疗软骨病症的方法,其包括向哺乳动物施用治疗有效量的用于诱导软骨细胞分化或使软骨组织再生的组合物。
发明详述
本发明的一个实施方案提供了用于诱导软骨细胞分化或使软骨组织再生的组合物,其包含来源于正分化成软骨细胞的干细胞的外排体作为活性成分。
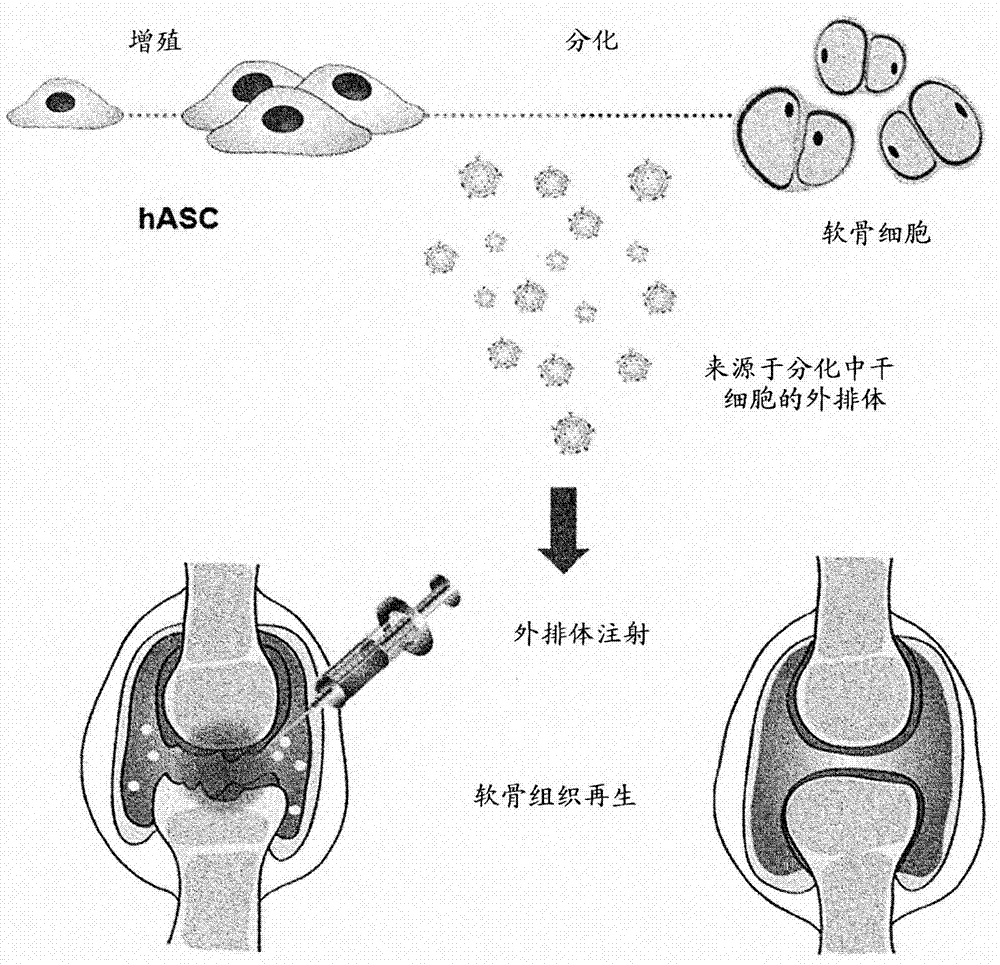
如本文中使用的,术语“正分化成软骨细胞的干细胞”是指目前正从干细胞分化成软骨细胞的干细胞,如图1所示。从正分化成软骨细胞的干细胞,可以分离包含任何软骨细胞遗传信息、蛋白质和生长因子的外排体。
当干细胞分化成软骨细胞时,细胞的形状和特征改变。可以在分化期间在细胞的形状和特征改变时分离外排体而不是从未分化的干细胞分离外排体。
如本文中使用的,术语“外排体”是指由膜包围的囊泡,其可以由多种类型的细胞分泌。外排体可以执行多种作用,例如通过与第二细胞和组织结合来将材料从第一细胞和组织转移到第二细胞和组织。通过外排体转移的材料可以包含任何膜组分、蛋白质和核糖核酸(rna)。
来源于正分化成软骨细胞之干细胞的外排体可以携带限定干细胞的基本特征的材料。例如,来源于正分化成软骨细胞的干细胞的外排体可以包含任何重要生长因子、多种生物活性蛋白和关于软骨细胞分化的遗传信息。
外排体可以通过使用本领域已知的外排体分离方法来制备。例如,外排体可以如下制备:
1)使干细胞增殖;
2)使增殖的干细胞分化成软骨细胞;并且
3)从正分化成软骨细胞的干细胞分离并纯化外排体。
术语“诱导软骨细胞分化”可以是指促使干细胞分化成软骨细胞。
术语“使软骨组织再生”可以是指通过修复受损的软骨组织或通过诱导产生新的软骨组织来使软骨组织再生。
正分化成软骨细胞的干细胞可以是能够分化成软骨细胞的成体干细胞。
能够分化成软骨细胞的成体干细胞可以是骨髓干细胞、脐带血干细胞或脂肪源性干细胞。在一些具体实施方案中,成体干细胞可以是脂肪源性干细胞。
骨髓干细胞、脐带血干细胞和脂肪源性干细胞任意可以是来源于人、动物或植物的干细胞。
根据本发明用于软骨再生的组合物包含来源于正分化成软骨细胞之干细胞的外排体作为用于有效地使软骨再生的活性成分。与常规技术中使用的组合物不同,来源于正分化成软骨细胞的干细胞的外排体有效地诱导软骨再生。由组合物中分离并纯化的外排体携带的与细胞增殖和分化有关的多种生长因子有效且一致地促使软骨组织再生。因此,可以解决以上讨论的常规方法的问题,例如由自体同源软骨细胞或成体干细胞的体外细胞培养产生的缺陷、纤维软骨的产生或由于细胞凋亡的组织钙化。
在干细胞分化成软骨细胞期间分离的干细胞源性外排体具有干细胞的特征,并且可以有效地递送与干细胞分化成软骨细胞有关的活性因子。由此,干细胞源性外排体具有与先前使用干细胞的治疗相同的益处,同时使先前利用干细胞的治疗的不良作用最小化。
根据本发明的一些实施方案,在干细胞向软骨细胞分化时分离的干细胞源性外排体是由细胞分泌的生物膜囊泡。此外,由于外排体具有与细胞膜类似的脂质结构,因此其在注射到体内时具有优异的到外周细胞中的吸收率。因此,可以通过将有效物质从外排体快速地递送到受损组织区域中来诱导软骨组织的有效再生。
本发明的另一个实施方案提供了用于诱导软骨细胞分化的培养基组合物。所述培养基包含上述用于诱导软骨细胞分化或使软骨组织再生的组合物。
培养基组合物可以包含浓度为1至100μg/ml的外排体。在一个具体实施方案中,培养基组合物包含浓度为1至60μg/ml,例如浓度为50μg/ml的外排体。然而,该浓度不限于此。
用于诱导软骨细胞分化的培养基组合物还可以包含可以促使干细胞分化成软骨细胞的分化诱导物质,例如任意地塞米松、胰岛素、抗坏血酸盐、igf(胰岛素样生长因子,insulin-likegrowthfactor)(软骨发生的生长因子)和tgf-β1(转化生长因子β1,transforminggrowthfactorβ1)等,但是实施方案不限于此。
本发明的又一个实施方案提供了用于使软骨组织再生的注射制剂。注射制剂可以包括用于诱导软骨细胞分化或使软骨组织再生的组合物。
注射制剂还可以包含磷酸缓冲盐水(pbs)。即,注射制剂可以包含包含在pbs溶液中的用于诱导软骨细胞分化或使软骨组织再生的组合物。
注射制剂可以包含水凝胶代替pbs。
水凝胶可以包含透明质酸、明胶、藻酸盐、壳聚糖、纤维蛋白、弹性蛋白、胶原和甲基纤维素中的任一种。在一个具体实施方案中,水凝胶可以是透明质酸的水凝胶,但是实施方案不限于此。
注射制剂可以包含浓度为1至1000μg/ml,特别地浓度为10至900μg/ml,更特别地浓度为10至800μg/ml的外排体。例如,注射制剂可以包含浓度为500μg/ml的外排体,但是注射制剂不限于此。
注射制剂可以通过将注射制剂注射到包含受损软骨的区域中等来施用于哺乳动物,例如大鼠、小鼠、家畜或人。
根据本发明一些实施方案的用于软骨再生的组合物可以相对快速地且以低成本施用于患者,因为所述组合物容易地以注射制剂的形式注射到体内。根据本发明一些实施方案的组合物减轻以其他方式使用常规方法治疗的患者的痛苦、后遗症和经济负担。此外,在干细胞分化成软骨细胞期间分离的外排体包含用于诱导细胞外基质的物质以及多种与细胞增殖和分化有关的生长因子。由此,外排体有效地诱导受损软骨组织的再生。因此,使用所述组合物进行一次治疗可以期望长期效果。所述组合物可以被使用而没有常规问题。例如,所述组合物不需要为了产生持续效果而以多个周期治疗施用。
本发明的另一个实施方案包括用于治疗软骨病症的药物组合物,其包含用于诱导软骨细胞分化或使软骨组织再生的组合物。
如本文中使用的,术语“软骨病症”可以是由软骨组织损伤引起的软骨病症。在一个具体实例中,软骨病症可以选自骨关节炎、骨关节病、软骨发育不良、变性关节炎、类风湿性关节炎、骨软化、纤维性骨炎和再生障碍性骨病,但是不限于此。
如本文中使用的,术语“软骨病症的治疗”可以是指通过经由关节内途径注射用于治疗软骨病症的组合物以使受损的软骨再生来治疗软骨组织损伤。
根据上述实施方案的药物组合物可以包括多种经口或肠胃外制剂。所述制剂可以使用稀释剂或赋形剂,例如常用的填料、增重剂、黏合剂、润湿剂、崩解剂、表面活性剂等来制备。药物组合物的用于经口施用的固体制剂可以包括片剂、丸剂、散剂、颗粒剂、胶囊剂等。这样的固体制剂可以通过将至少一种化合物与一种或更多种赋形剂,例如淀粉、碳酸钙、蔗糖或乳糖、明胶等中的一种或更多种混合来制备。此外,除简单的赋形剂之外,固体制剂还可以包含润滑剂,例如硬脂酸镁、滑石等。药物组合物的用于经口施用的液体制剂可以包括混悬剂、内用液体、乳剂、糖浆剂等。除常用的简单稀释剂(例如水和液体石蜡)之外,用于经口施用的液体制剂还可以包含多种赋形剂,例如润湿剂、甜味剂、矫味剂、防腐剂等。药物组合物的用于肠胃外施用的制剂可以包括任意无菌水溶液、非水性溶剂、混悬剂、乳剂、冻干制剂和栓剂。
根据本发明一些实施方案的药物组合物可以包含非水性溶剂和助悬剂。例如,药物组合物可以包含植物油,例如任意的丙二醇、聚乙二醇和橄榄油。根据一些实施方案,药物组合物可以包含可注射酯,例如油酸乙酯等。包含药物组合物的栓剂还可以包含witepsol、聚乙二醇、吐温61、可可脂、月桂精、甘油、明胶等。
根据上述实施方案的药物组合物的剂型可以是外排体复合物的可药用盐的形式,或者外排体复合物可以单独或以与其他药物活性化合物的合适组合使用。外排体复合物的盐不受特别限制,只要其是可药用的即可,并且可以包括例如盐酸、硫酸、硝酸、磷酸、氢氟酸、氢溴酸、甲酸、乙酸、酒石酸、乳酸、柠檬酸、富马酸、苹果酸、琥珀酸、甲磺酸、苯磺酸、甲苯磺酸、萘磺酸等。
根据一个实施方案的药物组合物可以根据目的用途肠胃外或经口施用。日剂量可以为0.1至500mg/1kg体重。例如,日剂量可以为1至100mg/1kg体重。施用频率可以为每天一次或每天数次。用于特定患者的有效剂量可以根据患者的体重、年龄、性别、健康状况、饮食、排泄速率、疾病的严重程度等以及期望的施用时间和施用方法而改变。
根据上述实施方案的药物组合物可以根据常规方法被配制成任何适用于药物制剂的形式,包括经口制剂,例如散剂、颗粒剂、片剂、胶囊剂、混悬剂、乳剂、糖浆剂、气雾剂等;外用制剂,例如软膏剂、霜剂等;栓剂;以及无菌可注射制剂溶液。
根据一些实施方案的药物组合物可以使用多种途径(例如任意的肠胃外途径、经口途径等)施用于哺乳动物,例如大鼠、小鼠、家畜、人等。尽管可以期望所有的施用途径,但是其可以优选地经口、经直肠或者通过静脉内、肌内、皮下、子宫内或脑室内注射来施用。
根据一些实施方案的药物组合物还可以包含分化诱导物质以使干细胞分化成软骨细胞,所述分化诱导物质例如地塞米松;胰岛素;抗坏血酸盐;igf(胰岛素样生长因子),其是用于软骨发生的生长因子;以及tgf-β1(转化生长因子β1);等等,但是不限于此。
本发明的又一些实施方案包括用于治疗软骨病症的方法,其包括向哺乳动物施用治疗有效量的用于诱导软骨细胞分化或使软骨组织再生的组合物。
施用的组合物可以是用于治疗软骨病症的药物组合物,其包含用于诱导软骨细胞分化或使软骨组织再生的组合物。施用的组合物可以是用于软骨再生的注射制剂,其包含用于诱导软骨细胞分化或使软骨组织再生的组合物。关于用于治疗软骨病症的药物组合物或用于软骨再生的注射制剂的详情可以类似地适用于治疗方法。
可以向患有软骨病症的哺乳动物施用组合物。例如,哺乳动物可以是患有软骨病症的任意大鼠、小鼠、家畜、人等。
术语“治疗有效量”是指在哺乳动物中提供用于治疗软骨病症的治疗响应的足够组合物量。
给药形式可以通过肠胃外施用或经口施用,或者例如所述方法可以包括通过将组合物注射到哺乳动物的受损区域(例如受损软骨部位)来施用组合物。
在本发明的一个实施方案中,确定来源于增殖中干细胞的外排体(asc-exo)和来源于正分化成软骨细胞之干细胞的外排体(软骨-exo)的尺寸。结果,asc-exo外排体的平均直径为约88.17nm,软骨-exo外排体的平均直径为约83.6nm(参见图3)。
在本发明的另一个实施方案中,当向干细胞施加包含来源于正分化成软骨细胞之干细胞的外排体(软骨-exo)的培养基组合物用于软骨发生时,在用外排体处理的第21天后显示出与阳性对照类似的水平的前软骨凝聚,并且观察到软骨特异性基质。然而,当向干细胞施加来源于增殖中干细胞的外排体(asc-exo)或阴性对照用于软骨发生时,没有观察到前软骨凝聚和软骨特异性基质。当用asc-exo或阴性对照处理时,仅观察到干细胞的增殖(参见图5和6)。
在本发明的一个实施方案中,当向体内注射包含来源于正分化成软骨细胞之干细胞的外排体(软骨-exo)的组合物时,软骨组织有效地再生(图7和8)。
有益效果
根据本发明一个具体实施方案的用于诱导软骨细胞分化或软骨再生的组合物包含来源于正分化成软骨细胞之干细胞的外排体作为活性因子。在干细胞分化期间分泌的外排体包含与软骨细胞分化有关的生长因子以及与干细胞增殖和再生有关的基因和蛋白质。因此,所述外排体可以用于诱导软骨组织再生。此外,与常规细胞治疗剂相比,使用外排体作为细胞源性载剂,所述组合物可以稳定且快速地将活性物质递送到细胞中,同时具有更少的副作用。因此,通过使用用于预防和治疗软骨病症的可注射组合物进行简单操作可以减轻患者的疼痛,并且在操作之后可以持续且有效地治疗软骨病症。
附图简述
图1为根据一个实施方案来源于正分化成软骨细胞的干细胞的外排体和施加外排体的示意图。
图2示出了根据一个实施方案从正分化成软骨细胞的干细胞分离外排体时的时间。图2示出了正分化成软骨细胞的干细胞的形状变化以及通过阿辛蓝染色确定的软骨特异性基质合成。
图3是来源于正分化成软骨细胞之干细胞的外排体(软骨-exo)和来源于增殖中干细胞的外排体(asc-exo)的特征的图:
(a)软骨-exo的结构和形状(透射电子显微镜);
(b)软骨-exo的尺寸(纳米颗粒分析仪,动态光散射);
(c)asc-exo的结构和形状(透射电子显微镜);以及
(d)asc-exo的尺寸(纳米颗粒分析仪,动态光散射)。
图4示出了根据一个实施方案使用来源于正分化成软骨细胞之干细胞的外排体的膜表面标志物的exo-checktm外排体抗体阵列获得的图像。
图5示出了根据一个实施方案诱导人脂肪源性干细胞分化成软骨细胞的结果:标记“gm”表示干细胞的生长培养基;标记“asc-exo”表示来源于增殖中干细胞的外排体;标记“软骨-exo”表示来源于正分化成软骨细胞的干细胞的外排体;标记“dm”表示软骨细胞的分化培养基;以及虚线表示在此出现前软骨凝聚(precartilagecondensation)现象的区域。
图6示出了根据一个实施方案在诱导人脂肪源性干细胞分化成软骨细胞21天后的分析结果。在图6中,标记“a”表示酸性黏多糖(例如酸性黏液物质和酸性黏蛋白)的合成。图6中观察到的酸性黏多糖为软骨特异性基质的一部分,如通过阿辛蓝染色确定的。标记“b”表示通过番红o染色确定的作为软骨特异性基质的蛋白聚糖的合成。标记“gm”表示干细胞的生长培养基。标记“软骨-exo”是指来源于正分化成软骨细胞的干细胞的外排体。标记“dm”是指软骨细胞的分化培养基。
图7示出了以下小鼠的经番红o染色的关节腔的100x显微图像:具有正常软骨的小鼠、注射有磷酸缓冲盐水(pbs)的患有骨关节炎的小鼠和根据一个实施方案注射有来源于正分化成软骨细胞之干细胞的外排体的患有骨关节炎的小鼠。特别地,图7确定了与正常软骨和pbs对照组相比在注射来源于正分化成软骨细胞之干细胞的外排体(软骨-exo)之后软骨组织的再生程度。在图7中,标记“t”表示小鼠胫骨,标记“f”表示小鼠股骨。
图8基于表1示出了显示指示股骨髁和胫骨平台中骨关节炎的诱导程度的mankin评分的图。标记“pbs”是指作为阴性对照组的注射有pbs的模型,标记“软骨-exo”是指注射有来源于正分化成软骨细胞的干细胞的外排体的模型。
实施例
在下文中,将参照非限制性实施例对本发明进行描述。然而,应理解,这些实施例仅仅用于说明目的,并非旨在限制本发明的范围。因此,本领域技术人员可由本发明的详细描述和实施例容易考虑到的那些被理解为落入本发明的范围。
<实施例1>从正分化成软骨细胞的干细胞分离外排体
为了从正分化成软骨细胞的干细胞分离外排体,将人脂肪源性干细胞在正常生长培养基(例如包含10重量%胎牛血清和1重量%青霉素/链霉素的高葡萄糖dulbecco改良eagle培养基(dmem))中培养到80%至90%汇合。然后,用分化培养基(例如包含5重量%胎牛血清、1重量%青霉素/链霉素、100nm地塞米松、0.15mm抗坏血酸、1xits(胰岛素-转铁蛋白-亚硒酸钠)和10ng/mltgf-β1(转化生长因子β1)的高葡萄糖dulbecco改良eagle培养基(dmem))更换该培养基。将人脂肪源性干细胞培养共5周,以使人脂肪源性干细胞分化成软骨细胞。
在用分化培养基更换正常生长培养基之后,在分离外排体之前将干细胞放置在无血清培养基和无酚红dmem培养基中,并在其中维持24小时。然后,回收细胞培养物上清液。将回收的细胞培养物上清液以300xg离心10分钟以除去细胞,并以2,000xg离心30分钟以除去细胞分泌物。此后,通过使用配备有分子量为3,000的滤膜的离心管(分子量截留值=3,000,amicon管)以5,000xg离心60分钟来使细胞浓缩。将在浓缩步骤之后获得的上清液与外排体分离试剂以1∶0.5(以重量计)比例混合并在4℃下储存1天。随后,将细胞以10,000xg离心60分钟以获得外排体沉淀物,然后将其通过0.22μm过滤器过滤,并用磷酸缓冲盐水(pbs)洗涤。特别地,通过外排体旋转柱过滤外排体沉淀物。将经洗涤的外排体沉淀物以10,000xg离心60分钟,并随后在pbs中重悬。在回收上清液之后,再次添加分化培养基以诱导干细胞的软骨细胞分化。重复干细胞的软骨细胞分化、上清液的回收和从上清液分离外排体直到第5周。如图2所示,在添加分化培养基后14天,开始在干细胞分化成软骨细胞期间观察到前软骨凝聚。在35天之后,确认了分化软骨细胞的集落的形成。因此,从诱导分化后14天(2周)至35天(5周)回收的上清液分离外排体,在此期间清楚地观察到细胞形状的变化。
<比较例1>从增殖中干细胞分离外排体
为了比较来源于正分化成软骨细胞的干细胞的外排体的效力,从增殖中的人脂肪源性干细胞分离外排体并将其用作比较组。具体地,以与参照实施例1所述相同的方式从增殖中的人脂肪源性干细胞分离外排体(asc-exo),不同之处在于不使用分化培养基。
<实施例2>外排体的显微分析
通过透射电子显微镜和纳米颗粒分析仪(使用动态光散射)确定实施例1中从正分化成软骨细胞之干细胞分离的外排体和从增殖中干细胞分离的外排体的尺寸和形状。使用exo-checktm外排体抗体阵列确定外排体膜表面蛋白,其指示特异性蛋白质表达的存在或不存在。
如图3a和3c所示,分离的外排体的形状可以通过透射电子显微镜确定。此外,如图3b和3d所示,外排体的直径被确定为平均约83.6nm(软骨-exo)和87.17nm(asc-exo)。
如图4所示,使用外排体抗体阵列通过抗体反应确定已知为外排体膜表面标志物的外排体特异性标志物(例如,cd63、cd81、alix、flot1、icam1、epcam、anxa5和tsg101)的表达。
<实施例3>使用外排体诱导软骨细胞分化
为了使用外排体来诱导人脂肪源性干细胞的软骨细胞分化,使用包含来源于增殖中干细胞之外排体(acs-exo)的培养基组合物和包含来源于正分化成软骨细胞之干细胞的外排体(软骨-exo)的培养基组合物。通过向干细胞的生长培养基(例如包含5重量%胎牛血清和1重量%青霉素/链霉素的高葡萄糖dulbecco改良eagle培养基(dmem))添加浓度为10μg/ml的外排体来使用培养基组合物。
作为阴性对照组(在图5中由生长培养基(gm)表示),使用干细胞的生长培养基,其包括含有5重量%胎牛血清和1重量%青霉素/链霉素的高葡萄糖dulbecco改良eagle培养基(dmem)。作为阳性对照组(在图5中表示为分化培养基(dm)),使用软骨细胞的分化培养基,其包括含有5重量%胎牛血清、1重量%青霉素/链霉素、100nm地塞米松、0.15mm抗坏血酸、1xits(insulin-transferrin-sodiumselenite,胰岛素-转铁蛋白-亚硒酸钠)和10ng/mltgf-β1(转化生长因子β1)的高葡萄糖dulbecco改良eagle培养基(dmem)。
每3天更换培养基组合物持续35天,并使用显微镜确定在诱导分化成软骨细胞期间干细胞的细胞形状变化。
如图5所示,在诱导分化21天之后,在用软骨-exo处理的细胞中前软骨凝聚以与阳性对照类似的水平显现。此外,确认了阴性对照组(gm)和经外排体(asc-exo)处理的组中的细胞增殖而没有发生前软骨凝聚。
<实施例4>使用外排体的软骨细胞分化能力的分析
为了确认使用外排体的软骨细胞分化诱导,使用包含来源于正分化成软骨细胞之干细胞的外排体(软骨-exo)的培养基组合物。通过向干细胞生长培养基添加浓度为5、10、30、50μg/ml的来源于正分化成软骨细胞之干细胞的外排体来使用培养基组合物。生长培养基包括含有5重量%胎牛血清和1重量%青霉素/链霉素的高葡萄糖dulbecco改良eagle培养基(dmem)。
作为阴性对照组,使用干细胞的生长培养基,其包括含有5重量%胎牛血清和1重量%青霉素/链霉素的高葡萄糖dulbecco改良eagle培养基(dmem)。作为阳性对照组,使用用于诱导分化成软骨细胞的分化培养基,其包括含有5重量%胎牛血清、1重量%青霉素/链霉素、100nm地塞米松、0.15mm抗坏血酸、1xits(胰岛素-转铁蛋白-亚硒酸钠)和10ng/mltgf-β1(转化生长因子β1)的高葡萄糖dulbecco改良eagle培养基(dmem)。
对于各个样品,每3天一次地更换培养基组合物持续21天,并通过阿辛蓝染色和番红o染色分析细胞的分化。
如图6所示,当进行来源于正分化成软骨细胞之干细胞的外排体(软骨-exo)的处理时,形成软骨细胞特异性细胞外基质。如标记为“a”的样品中所示,阿辛蓝将软骨特异性基质中的酸性黏多糖(例如酸性黏液物质和酸性黏蛋白)染成蓝色。如标记为“b”的样品中所示,番红o将软骨特异性基质中的蛋白聚糖染成红色。
此外,每种染色均确认了当向干细胞施加不同浓度的外排体时形成软骨特异性基质。甚至在包含低浓度(5μg/ml)的外排体的培养基中,也确定干细胞分化成软骨细胞。
因此,确认来源于正分化成软骨细胞之干细胞的外排体显示出优异的诱导从干细胞分化成软骨细胞的作用。
<实施例5>使用来源于正分化成软骨细胞之干细胞的外排体的体内软骨再生的评价
使用dmm(内侧半月板失稳)关节炎诱导小鼠模型确认来源于正分化成软骨细胞之干细胞的外排体的实质体内软骨组织再生作用,所述模型为常用的骨关节炎模型。
具体地,在干净地除去每只小鼠的膝部周围的毛发之后,使用外科手术用工具沿着髌骨侧将膝关节切开约1cm。在使关节囊的部分暴露并将其切开之后,切割与内侧半月板连接的内侧半月板胫骨韧带,按顺序闭合关节囊和皮肤,并以缝合结束。
在操作之后,从第5周至第10周每周一次地向关节腔内注射包含外排体的组合物,在该时间期间骨关节炎发展。通过在磷酸缓冲盐水(pbs)中携带实施例1中来源于正分化成软骨细胞之干细胞的外排体而制备外排体组合物。外排体组合物中外排体的终浓度为500μg/ml。向每只小鼠的关节腔内注射6μl组合物(3μg/6μl每只小鼠)。使用磷酸缓冲盐水(pbs)作为阴性对照。在11周之后,使用番红o染色确定软骨组织的再生。
如图7所示,确认了与阴性对照相比,当施用包含来源于正分化成软骨细胞之干细胞的外排体的组合物时,以相对大的量合成软骨特异性基质,并且类似于天然软骨地使软骨再生而不损害软骨表面(浅表区)。再生的软骨被染成红色。因此,确认包含来源于正分化成软骨细胞之干细胞的外排体的组合物具有优异的软骨组织再生作用。
此外,基于由骨关节炎诱导的软骨表面损伤、软骨细胞可染色性、作为软骨和骨之间边界的潮标的变化,使用mankin评分(mankin评分是用于评价骨关节炎的一种基本组织病理学观察)进行评价并用评分分级。评分越高表示骨关节炎诱导的程度越高,即软骨损伤的程度越高,mankin评分的结果示于下表1和2中。
[表1]股骨髁
[表2]胫骨平台
如图8和上表的结果中所示,当注射包含来源于正分化成软骨细胞之干细胞的外排体的组合物时,软骨的表面损伤和细胞过多(hypercellularity)较低,并且软骨特异性基质的合成被判断为高,因此确定mankin评分降低(表1、表2和图8)。
- 还没有人留言评论。精彩留言会获得点赞!