一种睾丸间质干细胞分离培养分化方法与流程
本发明涉及生物技术领域,特别涉及一种睾丸间质干细胞分离培养分化方法。
背景技术:
当前干细胞相关技术及成果不断涌现,干细胞研究正在经历一场轰轰烈烈的研究热潮。包括胚胎干细胞、诱导性多能干细胞及成体干细胞在内的多种干细胞研究都取得了巨大的进展。成体干细胞因其低免疫原性及与体细胞较高的分化相似度使得其在临床应用中获得了更多的亲睐。骨髓间质干细胞在20多年前就进入了研究人员的视野中,脂肪间质干细胞等今年来也取得了丰硕的成果和长足的进展。动物睾丸中蕴含了大量的干细胞,除雄性生殖干细胞外,睾丸间质干细胞也是极为重要的可利用的干细胞资源。然而,睾丸中的间质干细胞的分离、培养、分化方法仍然缺乏。
技术实现要素:
为解决上述技术问题,本发明提供了一种睾丸间质干细胞分离培养分化方法,采用通过对睾丸组织进行分离培养分化,解决了睾丸中的间质干细胞的分离、培养、分化方法的空缺。
为达到上述目的,本发明的技术方案如下:一种睾丸间质干细胞分离培养分化方法,包括以下步骤:
步骤1,对取得的睾丸组织体外进行分离、培养、扩增;
步骤2,将P4代细胞进行培养,形成类胚体;
步骤3,将类胚体进行接种分化。
作为本发明的进一步改进,所述步骤1对取得的睾丸组织体外进行分离的方法为:将取得的睾丸组织用胰蛋白酶和DNase进行消化,再用等体积的DMEM/F12和浓度为10%FBS溶液终止酶消化,在室温下300g*5min离心,弃上清;用5mL DMEM/F12和浓度为10%FBS溶液重悬细胞,室温300g*5min离心,弃上清。
作为本发明的进一步改进,所述步骤1对取得的睾丸组织体外进行分离的方法为:将取得的睾丸组织用2mg/mL胶原酶、20μg/mL DNase和2mg/mL分解酶消化20min,之后用1mg/mL胰蛋白酶和10μg/mL DNase消化10min,再用等体积的DMEM/F12加10%FBS溶液终止酶消化,在室温下300g*5min离心,弃上清;用5mL DMEM/F12加10%FBS溶液重悬细胞,室温300g*5min离心,弃上清。
作为本发明的进一步改进,步骤1中对取得的睾丸组织体外进行培养、扩增的方法为:用5mL DMEM/F12加10%FBS重悬细胞,调整细胞密度,按照100cells/60mm皿接种细胞,用DMEM/F12加10%FBS培养,6d后取间质干细胞,重新接种于新的24孔板上,进行培养扩增。
作为本发明的进一步改进,步骤2,将步骤1中培养状态良好的P4代细胞经0.25%胰蛋白酶消化、300g*5min离心后,用PBS缓冲液重悬,300g*5min进行离心;用DMEM/F12加10%FBS重悬细胞,血细胞计数板计数,调整细胞密度,制成800~1000cells/25uL的小滴,倒置培养3天,形成类胚体。
作为本发明的进一步改进,步骤3,将步骤2中制备好的类胚体接种于48孔板中,每孔中接种1个类胚体,用DMEM/F12加20%FBS使类胚体自发分化7d,之后检测三胚层分化效果。
作为本发明的进一步改进,对步骤1中正在培养的细胞进行免疫荧光染色:用4%PFA室温固定15分钟,然后PBS洗三遍;用0.2%Triton X-100通透10分钟,PBS洗三遍;用1%BSA室温封闭30分钟,一抗4度过夜,PBS洗三遍;二抗室温1小时,PBS洗三遍;用5ug/mL Hoechst33342室温染核5min,PBS洗三遍,直接荧光下照相记录。
作为本发明的进一步改进,对步骤2中形成的类胚体进行成骨诱导分化或脂肪诱导。
通过上述技术方案,本发明技术方案的有益效果是:研究证实,本发明能够有效获得睾丸间质干细胞,所得干细胞具有间质干细胞的典型形态;表达间质干细胞的有效标记如:CD29、CD166等;表达干细胞标记如:OCT4、NANOG等;能形成EB,诱导后能向脂肪、成骨等细胞分化。证实本发明可以有效获得睾丸间质干细胞,并进行诱导分化。本发明方法简单有效,通过将睾丸组织酶解成单细胞悬液后以极低的密度在DMEM/F12+10%FBS中培养,有效获得睾丸间质干细胞,并能将其诱导分化成脂肪、成骨等细胞,可控性强。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为实施例5步骤1中培养的睾丸间质干细胞的形态学照片。
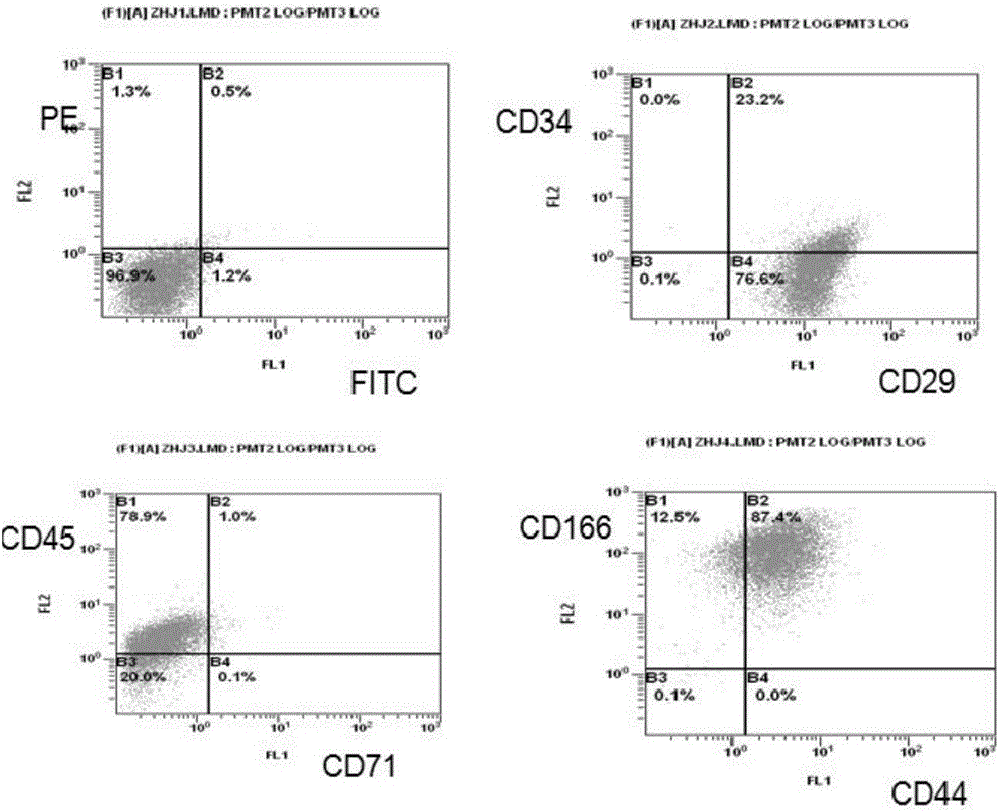
图2为实施例5步骤1中培养的睾丸间质干细胞用流式细胞仪的检测图片。
图3为实施例5步骤1中培养的睾丸间质干细胞的免疫荧光染色照片。
图4为实施例5的诱导分化照片。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例
一种睾丸间质干细胞分离培养分化方法,包括以下步骤:
步骤1,将取得的睾丸组织用胰蛋白酶和DNase进行消化,再用等体积的DMEM/F12和浓度为10%FBS溶液终止酶消化,在室温下300g*5min离心,弃上清;用5mL DMEM/F12和浓度为10%FBS溶液重悬细胞,室温300g*5min离心,弃上清,然后进行培养、扩增;
步骤2,将P4代细胞进行培养,形成类胚体;
步骤3,将类胚体进行接种分化。
实施例2
一种睾丸间质干细胞分离培养分化方法,包括以下步骤:
步骤1,将取得的睾丸组织体外进行分离的方法为:将取得的睾丸组织用2mg/mL胶原酶、20μg/mL DNase和2mg/mL分解酶消化20min,之后用1mg/mL胰蛋白酶和10μg/mL DNase消化10min,再用等体积的DMEM/F12加10%FBS溶液终止酶消化,在室温下300g*5min离心,弃上清;用5mL DMEM/F12加10%FBS溶液重悬细胞,室温300g*5min离心,弃上清,然后进行培养、扩增;
步骤2,将步骤1中培养状态良好的P4代细胞经0.25%胰蛋白酶消化、300g*5min离心后,用PBS缓冲液重悬,300g*5min进行离心;用DMEM/F12加10%FBS重悬细胞,血细胞计数板计数,调整细胞密度,制成800~1000cells/25uL的小滴,倒置培养3天,形成类胚体;
步骤3,将类胚体进行接种分化。
实施例3
一种睾丸间质干细胞分离培养分化方法,包括以下步骤:
步骤1,将取得的睾丸组织体外进行分离的方法为:将取得的睾丸组织用2mg/mL胶原酶、20μg/mL DNase和2mg/mL分解酶消化20min,之后用1mg/mL胰蛋白酶和10μg/mL DNase消化10min,再用等体积的DMEM/F12加10%FBS溶液终止酶消化,在室温下300g*5min离心,弃上清;用5mL DMEM/F12加10%FBS溶液重悬细胞,室温300g*5min离心,弃上清,然后进行培养、扩增;
步骤2,将步骤1中培养状态良好的P4代细胞经0.25%胰蛋白酶消化、300g*5min离心后,用PBS缓冲液重悬,300g*5min进行离心;用DMEM/F12加10%FBS重悬细胞,血细胞计数板计数,调整细胞密度,制成800~1000cells/25uL的小滴,倒置培养3天,形成类胚体;
步骤3,步骤3,将步骤2中制备好的类胚体接种于48孔板中,每孔中接种1个类胚体,用DMEM/F12加20%FBS使类胚体自发分化7d,之后检测三胚层分化效果。
实施例4
一种睾丸间质干细胞分离培养分化方法,包括以下步骤:
步骤1,将取得的睾丸组织体外进行分离的方法为:将取得的睾丸组织用2mg/mL胶原酶、20μg/mL DNase和2mg/mL分解酶消化20min,之后用1mg/mL胰蛋白酶和10μg/mL DNase消化10min,再用等体积的DMEM/F12加10%FBS溶液终止酶消化,在室温下300g*5min离心,弃上清;用5mL DMEM/F12加10%FBS溶液重悬细胞,室温300g*5min离心,弃上清,用5mL DMEM/F12加10%FBS重悬细胞,调整细胞密度,按照100cells/60mm皿接种细胞,用DMEM/F12加10%FBS培养,6d后取间质干细胞,重新接种于新的24孔板上,进行培养扩增;
步骤2,将步骤1中培养状态良好的P4代细胞经0.25%胰蛋白酶消化、300g*5min离心后,用PBS缓冲液重悬,300g*5min进行离心;用DMEM/F12加10%FBS重悬细胞,血细胞计数板计数,调整细胞密度,制成800~1000cells/25uL的小滴,倒置培养3天,形成类胚体;
步骤3,步骤3,将步骤2中制备好的类胚体接种于48孔板中,每孔中接种1个类胚体,用DMEM/F12加20%FBS使类胚体自发分化7d,之后检测三胚层分化效果。
实施例5
结合图1至图4,一种睾丸间质干细胞分离培养分化方法,包括以下步骤:
步骤1,将取得的睾丸组织体外进行分离的方法为:将取得的睾丸组织用2mg/mL胶原酶、20μg/mL DNase和2mg/mL分解酶消化20min,之后用1mg/mL胰蛋白酶和10μg/mL DNase消化10min,再用等体积的DMEM/F12加10%FBS溶液终止酶消化,在室温下300g*5min离心,弃上清;用5mL DMEM/F12加10%FBS溶液重悬细胞,室温300g*5min离心,弃上清,用5mL DMEM/F12加10%FBS重悬细胞,调整细胞密度,按照100cells/60mm皿接种细胞,用DMEM/F12加10%FBS培养,6d后取间质干细胞,重新接种于新的24孔板上,进行培养扩增。
对步骤1培养的睾丸间质干细胞进行形态学、表面标记、分化潜能等指标检测,观察图1,为睾丸间质干细胞的形态学照片。将培养状态良好的P4代细胞经0.25%胰蛋白酶消化、300g*5min离心后,用PBS重悬、300g*5min离心,100uL PBS重悬,按照试剂要求加入CD34、CD29、CD45、CD71、CD166、CD44抗体,室温孵育45min后,上机检测,得出图2照片。对步骤1中正在培养的细胞进行免疫荧光染色:用4%PFA室温固定15分钟,然后PBS洗三遍;用0.2%Triton X-100通透10分钟,PBS洗三遍;用1%BSA室温封闭30分钟,一抗4度过夜,PBS洗三遍;二抗室温1小时,PBS洗三遍;用5ug/mL Hoechst 33342室温染核5min,PBS洗三遍,直接荧光下照相记录,得到图3。通过将睾丸组织酶解成单细胞悬液后以极低的密度(50cells/60mm皿)在DMEM/F12+10%FBS中培养,7天后挑选典型的间质干细胞克隆,进一步扩大培养并检测其是否具有间质干细胞的典型标记及功能,结合图1至图3,可以看出通过上述方法高效分离得到了睾丸间质干细胞。
步骤2,将步骤1中培养状态良好的P4代细胞经0.25%胰蛋白酶消化、300g*5min离心后,用PBS缓冲液重悬,300g*5min进行离心;用DMEM/F12加10%FBS重悬细胞,血细胞计数板计数,调整细胞密度,制成800~1000cells/25uL的小滴,倒置培养3天,形成类胚体;
步骤3,步骤3,将步骤2中制备好的类胚体接种于48孔板中,每孔中接种1个类胚体,用DMEM/F12加20%FBS使类胚体自发分化7d,之后检测三胚层分化效果。
对诱导分化进行检测:结合图4,成骨诱导:AP染色:将待染色细胞用4%PFA室温固定15min,将1mgα萘酚磷酸盐+5mg坚固红溶解于5mL PH8.2-8.6的0.1M Tris-HCl中制成染色液,染色液加入细胞中室温染色15-30min,记录试验结果。脂肪诱导:油红O染色:诱导细胞用4%PFA室温固定15分钟;PBS洗2次;新鲜配制的0.3%油红O染色20min;PBS洗2次;显微镜下照相记录结果。通过图4可以看出形成的类胚体,诱导后能向脂肪、成骨等细胞分化。
通过上述具体实施例,本发明的有益效果是:研究证实,本发明能够有效获得睾丸间质干细胞,所得干细胞具有间质干细胞的典型形态;表达间质干细胞的有效标记如:CD29、CD166等;表达干细胞标记如:OCT4、NANOG等;能形成EB,诱导后能向脂肪、成骨等细胞分化。证实本发明可以有效获得睾丸间质干细胞,并进行分化。本发明方法简单有效,通过将睾丸组织酶解成单细胞悬液后以极低的密度在DMEM/F12+10%FBS中培养,有效获得睾丸间质干细胞,并能将其诱导分化成脂肪、成骨等细胞,可控性强。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
- 还没有人留言评论。精彩留言会获得点赞!