一种富血小板血浆及其制备方法与应用与流程
本发明涉及血浆领域,具体而言,涉及一种富血小板血浆及其制备方法与应用。
背景技术:
富血小板血浆(platelet-rich plasma,PRP)是将全血通过离心获得的含高浓度血小板的血浆成分[1]。Kingsley等[2]于1954年首次提出富血小板血浆的概念,Childs等[3]发现血浆中含有血小板来源的生长因子,具有促进细胞生长的作用,Okuda等[4]首次发现其具有修复骨缺损的作用。目前认为,富血小板血浆的血小板含量是正常人血浆血小板含量的3-4倍以上[5],并根据其中白细胞的含量分为富白细胞富血小板血浆和贫白细胞富血小板血浆。
富血小板血浆富含多种生长因子,如血小板源性生长因子、转化生长因子-β3、胰岛素样生长因子、表皮生长因子、血管内皮生长因子等[6]。这些生长因子具有促进伤口愈合、组织修复和再生的作用[7]。研究表明,富血小板血浆已经被广泛应用于骨缺损、软组织损伤修复、创面愈合、感染治疗、功能重建皮肤慢性溃疡等领域的研究和实验性治疗[8,9],目前已经成为再生医学研究领域的热点。
目前富血小板血浆来源于全血,主要通过自体全血多次离心制备而成,由该方法制备富血小板血浆存在一些问题,比如全血不易获得、在富血小板血浆的制备过程中需要消耗大量的全血,极大地增加了制备成本;另外,其制备过程也相当繁琐、制备量又少[10]。富血小板血浆的上述缺陷严重限制了其实验研究和临床应用。
因此,本领域急需对现有的富血小板血浆制备方法进行改进,寻找一种来源广泛、成本低的原料用于替代全血作为来源制备富血小板血浆,从而扩大富血小板血浆的制备规模,降低成本,使富血小板血浆的应用更为广泛。
另外,骨髓间充质干细胞(MSC)是干细胞家族的重要成员,Fridennestien等[11]发现,因为其具有来源广泛、易于分离、具有多向分化潜[12-15]等优点而应用于组织再生、脊髓修复,尤其在骨软骨损伤等领域应用广泛[16]。有研究表明富血小板血浆可以促进间充质干细胞分化为成骨细胞和软骨细胞,参与修复骨损伤。更为重要的是,富血小板血浆能够促进MSC增殖,从而提供更多的种子细胞,促进组织修复。但由于全血来源的富血小板血浆的成本高、制备步骤繁琐,大大限制了富血小板血浆在间充质干细胞,尤其是骨髓间充质干细胞中的应用。因此,本领域亟待提供一种成本较低、同时能够促进间充质干细胞、特别是骨髓间充质干细胞的增殖的富血小板血浆,并将其应用于上述间充质干细胞的增殖。
有鉴于此,特提出本发明。
技术实现要素:
本发明的第一目的在于提供一种白膜层来源的富血小板血浆的制备方法,所述方法以医疗废物白膜层细胞为原料,能够低成本、规模化地制备富血小板血浆。
本发明的第二目的在于提供由上述方法制备而成的白膜层细胞来源的富血小板血浆,所述富血小板血浆能够有效刺激间充质干细胞增殖。
本发明的第三目的在于提供上述富血小板血浆在间充质干细胞增殖中的应用。
为了实现本发明的上述目的,特采用以下技术方案:
一种白膜层来源的富血小板血浆的制备方法,所述方法包括从白膜层细胞中分离富血小板血浆的步骤。
本发明还涉及由上述方法制备而成的白膜层细胞来源的富血小板血浆。
本发明还涉及上述白膜层细胞来源的富血小板血浆在间充质干细胞增殖中的应用。
本发明的富血小板血浆的制备方法具有成本低、可规模化生产的优点。
具体实施方式
本发明一方面涉及白膜层来源的富血小板血浆的制备方法,所述方法包括从白膜层细胞中分离富血小板血浆的步骤。
本发明所述方法选择白膜层细胞为原料制备富血小板血浆。白膜层细胞是指全血分离为浓缩红细胞和血浆后残留的部分,这部分残留血液因为其成分复杂、保存困难等诸多原因难以加以利用,一般直接作为医疗废物丢弃。但本发明意外地发现用该废弃的白膜层细胞代替全血作为原料可以有效地分离获得富血小板血浆。传统的富血小板血浆是以全血为原料分离获得,在制备过程中需要消耗大量的全血,制备所述富血小板血浆的量也低,因此,传统制备方法的成本高,且不适合大规模生产。而由于选择来源广泛的医疗废料——白膜层细胞为原料,本发明所述方法能够极大地降低制备成本,并且可以大量制备,使富血小板血浆的应用更为广泛。
在一些实施方案中,上述方法具体包括以下步骤:将白膜层细胞与血小板激活剂混合、孵育后形成的凝胶破碎(例如,捣碎)、离心,收集上层清液,即为白膜层来源的富血小板血浆;优选的,所述白膜层细胞为全血分离后(例如,浓缩红细胞和血浆)剩余的白膜层细胞。
本发明上述方式将白膜层细胞与血小板激活剂混合形成凝胶,能够有效地将白膜层细胞中残留的白细胞和红细胞保留在凝胶中,从而更好地将白细胞和红细胞从白膜层细胞中去除,获得分离效果更好的富血小板血浆。另外,本发明所述方法在分离富血小板血浆的同时激活血浆中的血小板,将分离和激活步骤合一,所得富血小板血浆即可直接使用。
在一些实施方式中,血小板激活剂包括CaCl2和凝血酶的混合物、ADP、肾上腺素、胶原、瑞斯托霉素或花生四烯酸中的一种或多种。
在一些实施方式中,白膜层细胞和所述血小板激活剂按体积比1:5~10混合,优选地,按体积比1:9混合。
在一些实施方式中,孵育温度为25~37℃,优选为37℃,孵育时间为0.5~1.5h,优选为1h。
在一些实施方式中,离心力为2500~3500×g,优选为3000×g,离心时间为10~30min,优选为20min,离心温度为4~8℃,优选为8℃。
在一些实施方式中,血小板激活剂由CaCl2和凝血酶混合而成,其中,用于制备血小板激活剂的CaCl2的质量分数为5~15%,优选为10%,凝血酶的加入量为10-30U/mL白膜层细胞,优选为20U/mL白膜层细胞。
本发明上述方法对制备过程中所用到的试剂和制备条件进行进一步优化,使本发明所述方法的制备效率更高,制备出来的富血小板血浆的品质更优。
本发明还涉及由上述方法制备而成的白膜层细胞来源的富血小板血浆。
本发明所述白膜层细胞来源的富血小板血浆是一种新的富血小板血浆,其组分与传统的全血来源富血小板血浆有所不同,但上述两血浆中的血小板形态结构相似,胞内均可见类圆形的颗粒状物,这些颗粒通常是α-颗粒,内含大量生长因子。并且,本发明所述白膜层细胞来源的富血小板血浆与传统全血来源的富血小板血浆在生理功能上具有一致性,都能促进间充质干细胞的增殖。
因此,本发明提供了一种新的、比传统全血来源的富血小板血浆成本低但生理功能基本相同的白膜层细胞来源富血小板血浆。
本发明还涉及上述白膜层细胞来源的富血小板血浆在培养间充质干细胞增殖中的应用。
本发明所述应用选择白膜层来源的富血小板血浆刺激间充质干细胞,不但具备与传统刺激方式相似的增殖效果,而且具有成本低、可以大规模制备间充质干细胞的优点。
在一些实施方式中,上述间充质干细胞为人源、鼠源、猪源或兔源;优选地,上述间充质干细胞为骨髓间充质干细胞、脐血间充质干细胞或脂肪间充质干细胞。
与现有技术相比,本发明的有益效果为:
1)、本发明提供一种全新的富血小板血浆的制备方法,所述方法用白膜层细胞代替全血作为制备原料。白膜层细胞在现有技术中一直被认为是医疗废料,本领域可以低廉地、大量地获得白膜层细胞。因此,以白膜层细胞为原料制备富血小板血浆可以克服现有技术中以全血为原料制备富血小板血浆的缺陷,例如,全血来源不易,制备成本高,难以大量制备等。本发明所述制备方法能够低成本、大规模地制备富血小板血浆。
2)、本发明所述富血小板血浆的制备方法包括将白膜层细胞与血小板激活剂孵育形成凝胶的过程,在该凝胶形成过程中,白细胞和红细胞被有效地保留在凝胶中,因此能够更好地将富血小板血浆与红、白细胞分离,获取质量更优的富血小板血浆。并且,本发明所述制备方法将富血小板血浆的分离与血小板的激活步骤合二为一,分离获得的富血小板血浆即为激活的血浆,能够直接应用,例如直接用于刺激间充质干细胞的增殖。
3)、本发明所述方法制备了一种新的、白膜层细胞来源的富血小板血浆,该富血小板血浆具有与传统富血小板血浆基本相同的生理效果,将其用于培育间充质干细胞,能够有效地刺激间充质干细胞的增殖,大量制备间充质干细胞。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为不同富血小板血浆的总体形态,其中,左管显示的是白膜层来源的富血小板血浆(A),右管显示的是全血来源的富血小板血浆(B);
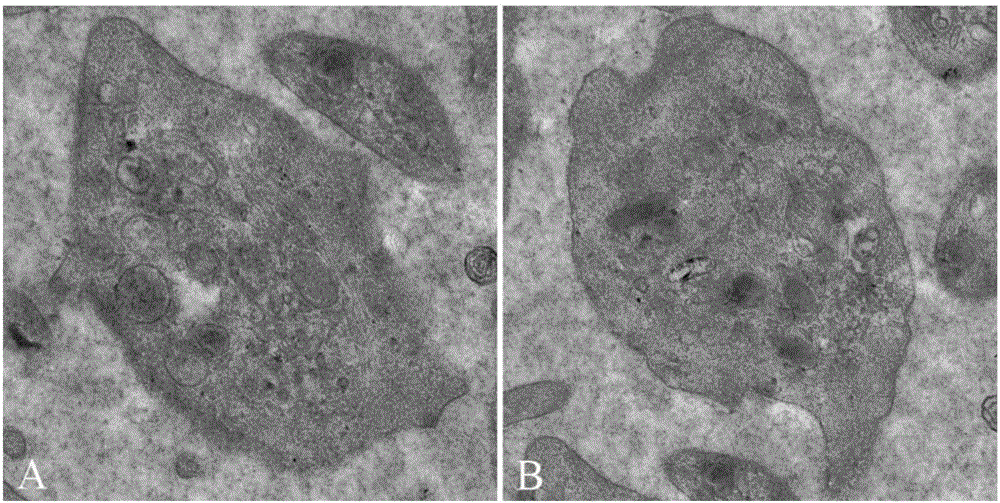
图2为富血小板血浆中血小板的透射电镜图像,其中,左图显示的白膜层细胞来源的富血小板血浆,右图显示的是全血来源的富血小板血浆;
图3为全血和白膜层细胞来源的富血小板血浆的FACS分析,其中,全血来源的富血小板血浆细胞中的CD41a+CD42b+细胞为94.09%±1.05﹪(A),与白膜层细胞来源的富血浆血小板(B)(84.34%±0.88﹪)相近;缩写:FACS,荧光激活细胞分选术;
图4为HBMSC细胞形态图,图中所示细胞已经融合,呈小纺锤状或梭状;
图5为HBMSC的多向分化,其中,对成脂分化诱导组进行油红O染色(A),对成骨分化诱导组进行ALP染色(B)和von Kossa染色(C);
图6为使用CCK-8检测细胞增殖的试验结果;在将HBMSC与全血来源的富血小板血浆或白膜层细胞来源的富血小板血浆接种到培养基后第1,3,6,9,12天后检测HBMSC的吸光度;
图7为使用CCK-8检测细胞增殖的试验结果;在将HBMSC与不同剂量(低剂量、中剂量和高剂量)的全血来源的富血小板血浆和白膜层细胞来源的富血小板血浆培养6天后检测HBMSC的吸光度,*P<0.05,**P<0.01。
下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
本发明实施例中所涉及的试剂包括:α-MEM培养基(美国Hyclone公司产品);间充质干细胞培养专用胎牛血清(Fetal Bovine Sserum,FBS,美国Gibco公司产品);碱性磷酸酶染色试剂盒(美国,Sigma公司产品);PE-labeled anti-CD41a(美国,eBioscience公司产品);FITC-labeled anti-CD42b(美国,eBioscience公司产品);二甲亚砜(dimethylsulfoxide,DMSO,美国Sigma公司产品);人外周血淋巴细胞分离液(天津灏洋生物制品科技有限责任公司);地塞米松、维生素C磷酸盐、IBMX(美国Sigma公司产品);25cm2/75cm2培养瓶和48孔培养板(美国Corning-costar公司)、15ml塑料离心管(美国Corning公司)。
本发明实施例中所涉及的研究设备主要包括:细胞培养箱(美国Thermo Forma公司)、超净工作台、流式细胞仪(Coulter EPICSXL,美国BD公司)、生物净化工作台(北京中化生物技术研究所/伟达净化技术研究所,X90-3)、倒置显微镜(日本Olympus公司)、DNA thermal cycler(Perkin-Elmer,美国)、台式离心机(Beckman,美国)、低温高速离心机(GS-1 5R Beckman,美国)、电镜(TEM,HITACHI,日本)、富血小板血浆制备套装(威高公司)、血细胞分析仪(普朗医疗器械公司)。
实施例1
1、全血来源的富血小板血浆的制备
本发明开展人体样本相关研究均严格遵守《中国人民解放军总医院医学伦理学研究条例》。
从肘前静脉取5名健康成人志愿者的全血20ml,用含1ml EDTA的抗凝管储存血液,20℃保存,1h内进行血细胞分析,并通过二次离心法制备富血小板血浆:第一次离心,离心力为3000×g,离心时间为10min,离心机温度为20℃,离心后可见全血分为2层,上层淡黄清亮部分为贫血小板血浆和富血小板血浆,下层为红细胞和白细胞。将上层淡黄部分和下层1-2mm部分取出进行第二次离心,离心条件为1200×g离心10min,离心机温度20℃;将第二次离心后的上层约75%体积的清亮液体去除,剩余部分约1-2ml液体即为富血小板血浆。将质量分数为10%的CaCl2与牛凝血酶混合,将富血小板血浆和含CaCl2和牛凝血酶的混合液按体积比1:9混合,牛凝血酶的用量为每毫升PRP中加入20U,于37℃孵育1h;将孵育后形成的凝胶捣碎,于3000×g离心20min离心,离心机温度4℃;将上层清亮液体与下层凝块分离,清亮液体即为激活的富血小板血浆;将其放于-80℃保存备用。
2、白膜层细胞来源的富血小板血浆的制备
从肘前静脉取5名健康成人全血400ml,装于含有40ml EDTA的抗凝袋中。取2ml于1h内进行血细胞分析,其余部分于解放军总医院输血科进行常规全血成分分离。全血分离为浓缩红细胞和血浆后,将剩余部分收集即为白膜,4℃保存。将收集的白膜约30-40ml平均分到4个15ml的离心管中。将质量分数为10%的CaCl2与牛凝血酶混合,将富血小板血浆和含CaCl2和牛凝血酶的混合液按体积比1:9混合,牛凝血酶的用量为每毫升白膜加入20U,37℃孵育1h。将孵育后形成的凝胶捣碎,于3000×g离心20min离心,离心机温度4℃。将上层清亮液体与下层凝块分离,收集清亮液体放于-80℃保存备用。
本发明所制备全血来源富血小板血浆和白膜层来源富血小板血浆的大体形态如图1所示,其中,左管为白膜来源的富血小板血浆,右侧管为经典的全血富血小板血浆。根据图1可知,白膜来源的富血小板血浆比全血来源的富血小板血浆颜色更深。
实施例2
全血来源富血小板血浆和白膜层细胞来源的富血小板血浆的形态学分析
分别取30μl全血来源富血小板血浆和白膜层细胞来源的富血小板血浆,在1200×g、4℃条件下离心10min。吸取上层液体,将下层沉淀部分用5%戊二醛,4℃固定4h,PBS冲洗3遍。然后用2%四氧化锇,4℃固定2h,乙醇梯次脱水。在环氧树脂812中包埋,最后切成超薄片(75nm),用乙酸双氧铀和枸橼酸铅染色。将薄皮用HITACHI H-600电镜在80KV下观察和记录细胞形态。
全血来源富血小板血浆和白膜层细胞来源的富血小板血浆的细胞形态如图2所示,全血来源富血小板血浆和白膜层细胞来源富血小板血浆中血小板的形态相似,均呈椭圆形,胞膜均有些许突起,胞内均可见类圆形的颗粒状物,排列紧密,大小不一,白膜完整,这些颗粒通常是α-颗粒,内含大量生长因子。
实施例3
1、全血来源富血小板血浆和白膜层细胞来源的富血小板血浆细胞成份分析
分别取全血来源富血小板血浆和白膜层细胞来源的富血小板血浆共10个样本,加入含EDTA的抗凝管中(EDTA用量为2.0mg/ml),立即颠倒混匀8次,取70μl血样放于采血针下吸样,上血细胞分析仪(普朗医疗器械公司)进行血细胞分析检测,分析两种类型富血小板血浆红细胞、白细胞、血小板的含量,比较血小板平均体积和血小板回收率的区别。实验重复3次。
如表1所示,本发明制备的全血来源富血小板血浆中白细胞浓度约为(6.18±1.73)×109/L,红细胞浓度约为(0.238±0.064)×1012/L,血小板浓度约为(1175±138.7)×109/L,血小板平均体积为5.14±0.33fl。白膜层细胞来源富血小板血浆中白细胞浓度约为(16.2±5.82)×109/L,红细胞浓度约为(2.066±0.8)×1012/L,血小板浓度约为(1105.4±140)×109/L,血小板平均体积为(5.08±0.16)。对2种富血小板血浆的主要成份差异进行统计学比较发现有意义的是,两种类型富血小板血浆中血小板浓度相似(P>0.05),而血小板是富血小板血浆发挥治疗作用的主要活性成份,该结果提示从白膜层细胞中获得的富血小板血浆很可能具有与传统富血小板血浆相似的功效。白膜层细胞来源富血小板血浆中白细胞和红细胞浓度均大于全血来源富血小板血浆(P<0.05)。
表1.不同PRPs中红细胞、白细胞和血小板的定量
缩写:PRP,富血小板血浆,WBC,白细胞;RBC,红细胞;PLT,血小板;MPV,血小板体积。
2、血小板回收率的比较
在本发明中,20ml全血可制备0.816±0.09ml的富血小板血浆,而一份白膜层细胞可以分离获得0.865±0.055ml的富血小板血浆,2种方法的得率无统计学差异(P>0.05)(表2)。换算后可知,全血来源富血小板血浆的血小板回收率为70.4%±6.57%,白膜层细胞来源的富血小板血浆血小板回收率为55.4%±7.02%,两者具有统计学差异,全血来源富血小板血浆制备方法血小板回收较高。全血来源富血小板血浆的血小板浓度是全血的8.64±0.224倍,白膜层细胞来源的富血小板血浆血小板浓度是全血的6.68±0.226倍,全血来源的富血小板血浆血小板回收率较高,两者具有统计学差异。
表2.全血离心之后血小板的产量和回收率
缩写:PLT,血小板
实施例4
全血来源富血小板血浆和白膜层细胞来源的富血小板血浆流式细胞术检测
分别取20μl富血小板血浆和白膜来源富血小板血浆共10个样本,用4℃PBS洗涤2次后制成细胞悬液(3×106/ml),100μl,加入鼠抗人CD41a-PE,CD42b-FITC 5μl,混匀,室温避光20min,PBS洗两遍后用1%多聚甲醛400μl重悬、固定。将固定后的标本上流式细胞仪测定。实验重复3次。
CD41a和CD42b是具有生理活性的血小板表面标记,本发明用流式细胞术检测了两种富血小板血浆中CD41a和CD42b双阳的血小板亚群分别为94.09%±1.05﹪和84.34%±0.88﹪(具体结果参见图3)
实施例5
人骨髓间充质干细胞的分离、培养和流式细胞鉴定
取5名健康志愿者的骨髓,每人取6ml,通过密度梯度离心法分离原代骨髓间充质干细胞。用含100μg/ml链霉素和100U/ml青霉素的90%α-MEM和10%胎牛血清培养基15ml,在25cm2×75cm2培养瓶中,于37℃,5%CO2饱和湿度的培养箱培养细胞。24h后更换培养液,将未贴壁的细胞去掉,之后每3d全换液,每天相差显微镜观察细胞形态和增值情况。根据细胞生长状态,当细胞生长到80%-90%时按照1:3进行细胞传代、冻存。取3-4代细胞用鼠抗人CD29-PE,CD31-PE,CD34-FITC,CD44-PE,CD45FITC,CD90-APC,CD105-FITC,HLA-DR-FITC,CD73-FITC,CD51/61-FITC标记,经流式细胞仪鉴定细胞。细胞鉴定后,取3-4代细胞用于实验。实验重复3次。
从骨髓中分离获得的人骨髓间充质干细胞(hBMSC)贴壁生长,呈现为成纤维细胞样形态(具体参见图4)。
实施例6
HBMSC成骨、成脂分化诱导及鉴定
取3-4代HBMSC,按照细胞密度2×103/cm2接种于48孔板,3个复孔,每孔培养液300μl。接种24h,细胞贴壁完全时将培养基吸干、替换为成骨(Vc,β-磷酸甘油,地塞米松)、成脂诱导液(地塞米松,IBMX),每孔总体系为300μl,24h后补液至500μl,每3d全换液。当细胞培养到14d时进行油红O和ALP染色,28d时进行AgNO3染色。
成脂诱导诱导14d后,进行油红“O”染色,可见较多胞内脂滴(参见图5A)。成骨诱导14d后,进行碱性磷酸酶(ALP)染色,可见ALP酶阳性(参见图5B)。成骨诱导28d后进行von Kossa染色,可见钙盐结节形成(参见图5C)。由此可见分离的hBMSC具有多系分化潜能。
实施例7
全血来源富血小板血浆和白膜层细胞来源的富血小板血浆对HBMSC增殖的影响
取3-4代细胞,按照细胞密度2×103/cm2接种于48孔板,3个复孔,每孔培养液300μl。实验组分为高、中、低浓度富血小板血浆3组,血小板浓度分别为1200×106/ml、800×106/ml和400×106/ml,富血小板血浆与培养液体积比为1:9。24h后补液至500μl,每3d全换液。用CCK-8细胞增殖检测试剂和紫外分光光度计检测细胞增殖情况。
如CCK-8增殖实验结果所示(图6),全血来源富血小板血浆和白膜层细胞来源富血小板血浆均具有显著的促进hBMSC增殖作用,这种促增殖作用具有时间依赖性。培养的第3天即可见hBMSC增殖作用强于未添加富血小板血浆组,培养的第6天促增殖作用达到顶点(P<0.05),此作用至少可以维持到第12天。如图7所示,3种浓度(400×109/L、800×109/L、1200×109/L)的全血来源富血小板血浆和白膜层细胞来源的富血小板血浆均具有促进干细胞增值的作用,3种浓度之间高浓度作用最强,中浓度次之,低浓度最差(图7)。对相同浓度的2种富血小板血浆的促增殖作用进行比较,但无统计学差异(P>0.05),说明白膜层细胞来源富血小板血浆的促干细胞增殖作用与传统方法分离得到的全血来源富血小板血浆无差异,具有相似的生物学功能。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,但本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
参考文献:
1.Borrione P,Gianfrancesco AD,Pereira MT,et al.Platelet-rich plasma in muscle healing.Am J Phys Med Rehabil,2010;89(10):854–861.
2.Kingsley CS.Blood coagulation;evidence of an antagonist to factor VI in platelet-rich human plasma.Nature,1954;173(4407):723-724.
3.Childs CB,Proper JA,Tucker RF,et al.Serum contains a platelet-derived transforming growth factor.Proc Natl Acad Sci USA,1982;79(17),5312-5316.
4.Okuda K,Kawase T,Momose M,et al.Platelet-rich plasma contains high levels of platelet derived growth factor and transforming growth factor-beta and modulates the proliferation of periodontally related cells in vitro.J Periodontol,2003;74(6):849-857.
5.Eppley BL,Woodell JE,Higgins J.Platelet quantification and growth factor analysis from plateletrich plasma:implications for wound healing.Plast Reconstr Surg,2004;114(6):1502-1508.
6.Masuki H,Okudera T,Watanebe T,et al.Growth factor and pro-inflammatory cytokine contents in platelet-rich plasma(PRP),plasma rich in growth factors(PRGF),advanced platelet-rich fibrin(A-PRF),and concentrated growth factors(CGF).Int J Implant Dent,2016;2(1):19.
7.De La Mata J.Platelet rich plasma.A new treatment tool for the rheumatologist?Reumatol Clin,2013;9(3):166–171.
8.Arshdeep,Kumaran MS.Platelet-rich plasma in dermatology:boon or a bane?Indian J Dermatol Venereol Leprol,2014;80(1):5-14.
9.Dhillon MS,Behera P,Patel S,et al.Orthobiologics and platelet rich plasma.Indian J Orthop,2014,48(1):1-9.
10.Paola RA,Rosana BVC,Marcus VTT,et al.Platelet-rich plasma preparation for regenerative medicine:optimization and quantification of cytokines and growth factors.Stem Cell Res Ther,2013;4(3):67.
11.Fridenstein A,Piatetskii S,Petrakova KV,et al.Osteogenesis in transplants of bone marrow cells.Arkh Anat Gistol Embriol,1969;56(3):3-1
12.Zhu H,Guo ZK,Jiang XX,et al.A protocol for isolation and culture of mesenchymal stem cells from mouse compact bone.Nat Protoc,2010;5(3):550-560.
13.Ding L,Zhu H,Yang Y,et al.Functional mesenchymal stem cells remain present in bone marrow microenvironment of patients with leukemia post-allogeneic hematopoietic stem cell transplant.Leuk Lymphoma,2014;55(7):1635-1644.
14.李欣,武文卿,丁丽,等.悬浮培养的小鼠骨间充质干细胞对T细胞的调节作用及其机制研究.中国实验血液学杂志,2016;24(2):584-589.
15.洪佳琼,高雅,宋洁,等.人羊膜间充质干细胞与骨髓间充质干细胞的生物学特性及免疫抑制作用的比较.中国实验血液学杂志,2016;24(3):858-864.
16.张浩,廖伟雄,李冀,等.兔骨髓栓来源的间充质干细胞的分离培养及其生物学特性的研究.中国实验血液学杂志,2015;23(2):500-505。
- 还没有人留言评论。精彩留言会获得点赞!