从人胎盘羊膜制备羊膜间充质干细胞的方法及其应用与流程
本发明属于干细胞治疗技术领域,涉及从人胎盘羊膜制备羊膜间充质干细胞的方法,还涉及由该方法制备获得的羊膜间充质干细胞,以及它们的治疗用途。
背景技术:
干细胞是再生医学发展的基础,其有效的应用是实现人类健康长寿、防癌抗衰、永保年轻状态、持续提高生活质量等终极梦想的有效方法。近年来,胚胎干细胞与成体干细胞在细胞生物学以及再生医学研究领域倍受重视。然而,尽管胚胎干细胞具有其他细胞无法企及的全能性,但致瘤性、同种异体移植后的免疫排斥性以及无法避免的伦理争议等因素在很大程度上限制了其在临床的应用,而成体干细胞在组织中含量较少,缺乏特异性的表面标志的特点也成为其临床应用的桎梏。
由于干细胞的多项分化潜能及其分泌多种细胞因子的功能,备受研究者的青睐。近年来,干细胞在组织损伤与修复中的应用越来越广泛,而干细胞的来源一直是人们关注的焦点。骨髓间充质干细胞是较早被认识的成体干细胞之一。但由于抽取骨髓给患者带来痛苦,而且骨髓干细胞的含量极少,使大量获得受到限制。其他来源如脂肪组织,皮肤组织等都需取材于人体自体或异体组织,也不易取材或可能涉及伦理问题。
人羊膜来源于人胎盘组织,无血管、神经及淋巴,具有一定的弹性,厚0.02-0.5mm,在电镜下,其分为5层:上皮层、基底膜、致密层、纤维母细胞层和海绵层。羊膜属于孕妇生产后的废弃物,一个胎盘的羊膜面积大约有600cm2,而且羊膜易于从胎盘上剥离,所以因羊膜具有取材方便,原料充足的特点而被认为是目前间充质干细胞的最佳来源。
人羊膜为半透明的薄膜,有多种促进细胞增殖的营养成分。羊膜基底膜和羊膜基质层含有大量不同的胶元,主要为I、Ⅲ、Ⅳ、Ⅴ、Ⅶ型胶原和纤维粘连蛋白、层粘连蛋白等成分。新鲜羊膜能产生一些生长因子,如:碱性成纤维细胞生长因子、肝细胞生长因子和转化生长因子β等。目前,正在研究利用羊膜干细胞治疗多种疾病,包括神经系统疾病、心肌梗死、肌萎缩症、糖尿病及肝纤维化等。有研究表明羊膜间充质干细胞通过有高的血管生成能力和移植成活力,能促进糖尿病大鼠伤口的愈合。
人羊膜来源的干细胞包括人羊膜上皮细胞(humanamnioticepithelialcells,hAEC)和人羊膜间充质干细胞(humanamnioticmes-enchymalstromalcells,hAMSC),它们均能够表达多种胚胎干细胞标记物,并且均具有较全面的多向分化潜能。
已有研究发现,培养的人羊膜间充质干细胞除表达神经干细胞的特异性标志蛋白nestin外,还表达干细胞特异性转录因子八聚体连接蛋白4(octamer-binding protein4,Oct-4),且表达能力比骨髓间充质干细胞更强。近来报道证实了其有向三胚层细胞分化的潜能:外胚层(神经)、中胚层(骨骼肌、心肌、内皮等)、内胚层(胰腺、肝)。有研究表明,培养3~4周后得到大量的贴壁间充质干细胞,形态学类似于骨髓间充质干细胞,且其比骨髓来源的MSCs具有更强的增殖能力。试验中流式细胞仪检测的结果符合以上结论,说明羊膜细胞具有与间充质干细胞相似的表面标志。在体外至少可以传到第15代而保持其形态不变。大量的试验研究也证实了hMSCs比骨髓间充质干细胞有更强的增殖能力及干细胞特性。
已经有诸多关于羊膜上取细胞的制备方法的报道。例如
CN102191218A(中国专利申请号201110080968.6,遵义)公开了一种完全培养基及人羊膜间充质干细胞(hAMSCs)的培养方法。完全培养基是按体积比向低糖-Dulbecco极限必须培养基溶液中加入3%-10%的人自体脐带血血清配制而成;培养方法包括:(1)分离;(2)原代培养;(3)传代培养。本发明采用前述完全培养基用于hAMSCs培养的优点为:回避了使用胎牛血清的风险,且无需添加L-谷氨酰胺、非必需氨基酸、2-巯基乙醇和丙酮酸等,仍可保持hAMSCs较好的增殖特性和表型特征及一些干细胞多向分化潜能标志基因和蛋白表达;传代培养中hAMSCs贴壁的牢固程度明显低于FBS培养条件,消化时间明显缩短,减少了胰酶消化对细胞的损伤和细胞数量的损失。
CN101914490A(中国专利申请号201010252201.2)涉及一种人羊膜间充质干细胞无血清培养基及其培养方法。该培养基为DMEM/F12基础培养基中添加人血清白蛋白、人转铁蛋白、人胰岛素和亚硒酸钠;其培养方法是将人羊膜先用胰蛋白酶消化,然后用胶原酶IV及脱氧核糖核酸酶I消化,过滤制成单细胞悬液;再通过VDMEM∶VF12=1∶1DMEM/F12基础培养基中添加人血清白蛋白、转铁蛋白、胰岛素和亚硒酸钠,使人羊膜间充质干细胞在无血清条件下,置于37℃、饱和湿度、体积分数为5%的CO2培养箱中,通过换液和传代,实现体外培养和扩增,并维持多向分化的潜能,扩增后的细胞能够在体外诱导成软骨细胞、成骨细胞和脂肪细胞。具有无其他动物源性、来源广泛、不受伦理限制的特点。
CN102559586A(中国专利申请号201110404587.9,遵义)公开了一种人羊膜间充质干细胞的分离纯化方法,包括以下步骤:第一,无菌采集人足月剖宫产胎盘,机械法将羊膜从胎盘组织上剥离,用D-Hank’s液冲洗数次以清除残留血迹,将羊膜剪成碎片;第二,羊膜碎片加入含0.02%EDTA的0.05%胰蛋白酶消化溶液,于37℃,旋转消化弃上清;重新加入消化液,于37℃旋转消化弃上清,留取未消化的羊膜碎片;第三,D-Hank’s液冲洗未消化的羊膜碎片,加入含有0.075mg/ml DNase I的0.75mg/ml 的胶原酶,于37℃,旋转消化约2h至组织完全消化,300目钢网过滤,收集细胞滤液,离心得到原始的人羊膜间充质干细胞;第四,将分离的原始的人羊膜间充质干细胞重新悬浮于LG-DMEM培养基中,将细胞密度接种于6孔培养板,置于CO2培养箱培养,在倒置显微镜下除去完全未贴壁生长的羊膜上皮细胞,第3天更换新的培养基;待细胞汇合度达80~90%后,用胰蛋白酶—EDTA溶液消化,加入培养基终止胰蛋白酶作用,离心弃上清,细胞沉淀用培养基重新悬浮,以1×107/L的细胞密度传代。
CN104450610A(中国专利申请号201410715000.X,赛莱拉)公开了一种人羊膜间充质干细胞传代培养方法,其特征在于包括以下步骤:(1)原料清洗:待原代培养分离后的人羊膜间充质干细胞融合度达到80~90%后,吸去培养皿中的培养液,加入PBS清洗,然后吸去培养皿中的PBS;(2)消化:往培养皿中加入tryplE,转移至CO2培养箱孵育1~2min后,加入完全培养基,用巴氏吸管反复吹打,至80~90%的细胞不再贴壁,终止消化;(3)离心:将步骤(2)得到细胞悬液离心管中,1000rpm/min离心5min;(4)计数:离心结束后,弃去上清液,用完全培养基重悬细胞沉淀,吹打混匀,得到的细胞悬液用细胞计数仪计数;(5)铺板及培养:将步骤(4)的细胞悬液接种培养皿中,调整细胞密度为1.3×104/cm2,然后加入含有10ng/ml的EGF的完全培养基,将培养基转至CO2细胞培养箱中进行培养。
CN103789258A(中国专利申请号201210506430.1,陆华)公开了一种人羊膜间充质干细胞的分离方法,其应用于酶消化法联合EGF培养人羊膜间充质干细胞的过程,所述培养过程包括如下步骤:hAMSCs的分离,hAMSCs的原代培养,hAMSCs的传代培养与扩增,hAMSCs的冻存和复苏,以及hAMSCs细胞免疫表型的检测;其特征在于,所述hAMSCs的分离步骤包括:无菌条件下取产后弃置的新鲜胎盘,采用机械法将羊膜从胎盘组织上剥离,用D-Hanks液冲洗数次以清除残留血迹,将漂洗后的羊膜用眼科剪剪成约1mm3碎块,加入胰蛋白酶37℃消化10分钟;加入含小牛血清的DMEM终止消化,并轻柔吹打混匀后200目细胞筛过滤;过滤后的羊膜组织中加入II型胶原酶消化液,37℃消化30分钟;加入含小牛血清的DMEM终止消化,轻柔吹打混匀后200目细胞筛过滤,收集细胞;1000转/分钟离心5分钟;台盼兰染色计数活细胞,调整细胞密度为1×106/ml,接种至培养瓶,加入含bFGF和FBS的DMEM培养基;置37℃、饱和湿度、体积分数5%的CO2培养箱内培养;倒置相差显微镜下每日观察原代和传代细胞的生长情况和形态特征,隔天换液1次,并摄片记录;待细胞汇合度达80%后,用0.25%胰蛋白酶-0.02%EDTA溶液于37℃消化2-3分钟,加入培养基终止胰蛋白酶作用,1000转/分钟离心5分钟,弃上清,细胞沉淀用培养基重新悬浮后,以1×107/ml的细胞密度传代;以及传代过程中,隔日换液1次,待细胞长满70%瓶底重复以上步骤。
CN1810959A(中国专利申请号200610033007.9,北科)公开了一种人羊膜间充质干细胞的分离及培养方法及医用组合物,分离及培养方法是将人羊膜用胰蛋白酶、胶原酶、脱氧核糖核酸酶相继消化,然后过滤制成单细胞悬液,再采用加有体积百分含量为10%-20%的胎牛血清和终浓度为10-20ng/ml 的碱性成纤维生长因子的VDMEM∶VF12=1∶1的DMEM/F12培养基,置于37℃、饱和湿度、体积分数为5%的CO2培养箱中进行培养,通过换液和传代,使人羊膜间充质干细胞逐渐得到扩增和纯化。据信该发明方法具有来源广泛,不受伦理限制等优越性,具有广阔的应用前景,本发明的医用组合物可用于神经替代治疗、用于心肌梗塞的治疗、用于糖尿病的治疗、用于骨组织工程、应用于整形外科等。
CN105420179A(中国专利申请号201510963676.5,斯坦姆)公开了一种从脐带和胎盘羊膜组织同时提取上皮细胞和间充质干细胞的方法,其特征在于:步骤如下:⑴脐带和胎盘羊膜取材和接种:①高温消毒手术器械和大玻璃皿,同时紫外线消毒超净工作台;②配制培养基:完全培养基的组成是:DMEM/F12加完全培养基总体积5%的胎牛血清、完全培养基总体积1%的胰岛素、铁传递蛋白和硒的混合添加物,完全培养基中终浓度为20毫微克/毫升的表皮生长因子和完全培养基中终浓度为20毫微克/毫升的碱性纤维母细胞生长因子,无菌过滤,4℃保存;所述DMEM/F12中DMEM:F12的体积比为1:1;所述混合添加物及在混合添加物中的终浓度为胰岛素5微克/毫升、铁传递蛋白10微克/毫升和亚硒酸钠5毫微克/毫升;③严格筛选供者,血液化验排除传染病;④低温冰盒中运送脐带和胎盘:机械剥离胎盘羊膜之后,将脐带和胎盘羊膜分别置于大玻璃皿中,以下步骤都在无菌条件下进行,将脐带剪成1cm长的小段,将胎盘羊膜剪成约5X5cm长的方块,用磷酸缓冲盐水+总体积1%的青霉素+总体积1%的链霉素清洗组织两次,洗干净脐带的血液;⑤将脐带和胎盘羊膜组织放在4℃的磷酸缓冲盐水中,以防止组织在机械剪碎时过热而影响到细胞存活,使用组织剪碎机来分别破碎成1-3mm的碎块,使用低速破碎组织,同时保持细胞活性,得到破碎的脐带和羊膜组织;⑥将破碎的脐带和羊膜组织分别转移到T175细胞培养瓶中,并用组织刮取器将其平铺于培养瓶底,小心加入少量完全培养基,使培养液既能覆盖破碎的脐带和羊膜组织块,又不至于使其漂浮起来,置于37℃、饱和湿度5%CO2培养箱中培养;⑵间充质干细胞和羊膜上皮细胞在培养瓶中扩增和传代:①培养过程中观察可见细胞从组织块逐渐游移出来,并进一步实现贴壁生长和增殖,在培养的第3-4天、当细胞生长融合成片时,用无菌磷酸缓冲盐水洗去残存的组织,全部换为新鲜完全培养基继续培养;②此后每4天换一次培养液直到细胞长满90-100%培养瓶底面积,便进行胰酶消化传代;③胰酶消化传代:倒弃培养液,用PBS洗细胞2次,每T175用10毫升质量百分数为0.25%的胰酶-EDTA在37℃消化10分钟,待细胞悬浮后每个T175加入1毫升胎牛血清以中和胰酶反应,1000转/分离心10分钟,再悬浮于完全培养基中,按1∶4细胞数比例传代到新T175培养瓶中;⑶间充质干细胞和羊膜上皮细胞的鉴定:①胰酶消化传到第三代时,用流式细胞仪鉴定培养细胞的纯度:羊膜上皮细胞的标记物包括:角蛋白CK19,CD29,和CD34;胎盘和脐带间充质干细胞的标记物包括:CD73,CD90,和CD105;②流式细胞仪验证细胞纯度达到90%以上,化验排除常见的传染病,并排除细菌,支原体污染,即是符合标准,即得上皮细胞和间充质干细胞的混合物。据信该发明的方法成本低、简单快速,使用组织剪碎机来将脐带和胎盘羊膜剪碎成极小的碎块,极为利于直接接种到培养瓶之后细胞向组织外游移;不使用任何蛋白酶试剂,从而大幅度地降低成本,减少制备时间,使得短时间大规模细胞制备成为现实;该方法使用添加生长因子及其它营养物的细胞培养基,节省了血清。
CN 103013913A(中国专利申请号201210505486.5,陆华)公开了供一种酶消化法联合表皮生长因子(EGF)培养人羊膜间充质干细胞(hAMSCs)的方法,其包括如下步骤:hAMSCs的分离,hAMSCs的原代培养,hAMSCs的传代培养与扩增,hAMSCs的冻存和复苏,以及hAMSCs细胞免疫表型的检测。本发明采用胰蛋白酶和胶原酶分步多次消化来收集羊膜细胞,通过加入4ng/mlEGF,将贴壁培养和消化时间控制相结合,获得纯度和活性较高人羊膜间充质干细胞(hAMSCs)。本发明的酶消化法联合联合EGF具有操作简单,快速实用等优点,是一种较为有效的分离纯化hAMSCs的方法。
CN 104450612A(中国专利申请号201410741509.1,敖云霞)公开了一种人羊膜间充质干细胞的分离与鉴定方法,采用组织块贴壁法分离出羊膜间充质干细胞并传代培养,对P1-P3代细胞进行细胞形态的观察,用流式细胞仪检测细胞膜表面阳性分子和阴性分子并采用六孔板法检测细胞增殖情况,本实验从胎盘羊膜组织中分离出细胞是hAMSCs,为进一步研究hAMSCs的生物学和免疫学特性、分化能力、核型稳定性,以及将其作为临床应用的种子细胞等提供了基础。
CN103555663A(中国专利申请号,道培)公开了一种培养人羊膜间充质干细胞的方法。它包括如下步骤:取新鲜采集的人羊膜,清洗,放入羊膜保护液中2-8℃保存备用;取浸泡在羊膜保护液中不超过48小时的人羊膜,清洗,再依次置临用新配的青霉素钠和硫酸链霉素含量分别为2500-3500U/mL和3500-4500U/mL的氯化钠溶液和每毫升含30-50U注射用两性霉素B的甲硝唑注射液中进行浸洗,最后再清洗后置于一次性无菌培养皿中进行备用,然后分离,培养至细胞融合度达80-90%即得。据信该发明能避免动物血清及动物来源的试剂带来的潜在的危险性;48小时内均可用于羊膜间充质干细胞的培养,可操作性强;可大大减少因霉菌、厌氧菌污染造成的间充质干细胞分离培养不合格的几率。
CN103422176A(中国专利申请号201310323661.3,庞希宁)公开了一种人羊膜间充质干细胞库的构建方法。其方法是取人羊膜进行检测,用磷酸缓冲液冲洗涤后粉碎,加磷酸缓冲液稀释,用胰蛋白酶消化后,用胶原酶Ⅳ及脱氧核糖核酸酶I消化,过滤制成单细胞悬液;再通过VDMEM:VF12=1:1DMEM/F12基础培养基中添加人血清白蛋白、转铁蛋白、胰岛素和亚硒酸钠,使人羊膜间充质干细胞在无血清条件下,置于培养箱中,换液和传代。将体外培养和扩增获得间充质干细胞置液氮冷冻,按新生儿性别和ABO/Rh分型及HLA分型保存,建立细胞信息档案,构建出人羊膜间充质干细胞库。据信该发明具有无其他动物源性、来源广泛、不受伦理限制的特点。可提供间充质干细胞进行细胞治疗及其他应用。
CN104450611A(中国专利申请号201410715077.7,赛莱拉)公开了一种人羊膜间充质干细胞原代分离及培养方法,包括以下步骤:提供人类羊膜组织、用PBS缓冲液冲洗然后剪碎、加入质量浓度为0.1~0.3%的胰蛋白酶进行消化、加入I型胶原酶及高糖DMEM基本培养基至I型胶原酶终浓度为0.1~0.2%消化、离心分离,取沉淀物、沉淀物用PBS溶液重悬,过滤后离心分离,弃去上清液,获得人羊膜间充质干细胞。与现有技术相比,据信该发明利用少量胰蛋白酶预处理羊膜组织,使羊膜组织疏松,进而利用组织特异性更好的I型胶原酶处理羊膜,大大缩短了消化的时间,简化了原代分离的步骤,而且能够获得较高的干细胞产量,获得的干细胞活力也相比现有技术大大提高。
CN103642751A(中国专利申请号201310650384.7,同泽)公开一种从人羊膜中制取干细胞的方法,具体指一种羊膜中分离上皮细胞和间充质干细胞方法,涉及细胞分离技术领域。通过自制的无菌、高效、稳定的胎盘保护液对胎盘进行采集,利用消化法和爬片法的组合,将羊膜上皮细胞与羊膜间充质干细胞分离开来,分别得到高纯度的羊膜上皮细胞和羊膜间充质干细胞。本发明解决了现有技术中存在人羊膜采集污染率高、采集后的细胞活性差,直接影响了后续的细胞分离及培养的问题。是对从人羊膜中分离干细胞的方法进行改良和创新,形成了一套标准化的分离方案,能够更稳定,充分利用羊膜的干细胞资源,无污染,纯度高,细胞数量更多,在保持细胞活性的同时,保证了干细胞的原始特性。
CN105062959A(中国专利申请号201510597698.4,领航)公开了一种人羊膜间充质干细胞的分离培养方法,经过人胎盘羊膜组织的采集、羊膜组织消毒、洗涤、剪碎、混合胶原酶消化、获得间充质干细胞,再进行间充质干细胞体外培养。本发明能够从人羊膜组织中获得大量表型均一稳定,增殖能力强,并有多向分化潜能的间充质干细胞,通过培养基体外扩增,纯化细胞,满足冻存或临床使用的数量。细胞培养周期短,重复性强。此方法获得的干细胞具有CD105+,CD90+,CD73+的表型。
然而,本领域仍然期待有新的方法来制备人羊膜间充质干细胞,并且期待这种方法呈现出一种或者多种有益的技术效果。
技术实现要素:
本发明的目的在于提供一种从胎盘羊膜制备人羊膜间充质干细胞的方法,期待该方法呈现出一种或者多种有益的技术效果。
本发明第一方面提供了一种从胎盘羊膜制备人羊膜间充质干细胞的方法,该方法包括以下步骤:
(1)从胎盘样品采集盒中取出胎盘,置于白瓷盘中,使用基础平衡盐溶液反复冲洗表面,对胎盘进行消毒处理;
(2)用手术镊慢慢撕取胎膜外层羊膜置于150mm玻璃皿中,使用基础平衡盐溶液反复清洗表面污血,剪碎成直径为5mm的羊膜组织小块;用300目滤网过滤,生理盐水冲洗残血,组织块转移至50ml 离心管;
(3)组织消化:在37℃恒温摇床中,将组织块用1倍组织体积的混合酶消化液以100rpm振荡消化30~60min;消化结束后,加2ml胎牛血清混匀终止;用200目滤网过滤并用大量生理盐水清洗,收集滤液;
(4)分别对滤液部分和组织块部分进行细胞培养:
滤液部分:收集的滤液以1500rpm离心5min,去上清,用生理盐水重悬清洗细胞沉淀;以1500rpm离心5min,去上清,将细胞沉淀用完全培养基重悬;计数仪计取有核细胞数并用台盼兰染色测定细胞活率;以每瓶2×106个细胞接种于75cm2培养瓶中,添加20ml完全培养基,晃匀后在5%CO2、37℃培养箱中培养;定期换液;培养10~15天(通常可以是12天左右)后传代至P1代,继续用完全培养基培养;
组织块部分:将收集的组织块置于75cm2培养瓶中,使组织块能够覆盖培养瓶中一半的培养面积,添加完全培养基没过组织,晃匀后于5%CO2、37℃培养箱中培养;2d后补液10ml完全培养基,继续培养;较多间充质干细胞爬出后去组织,定期换液;培养10~15天(通常可以是12天左右)后传代至P1代,继续用完全培养基培养;
(5)P1代细胞收获:用胰酶消化液将上一步骤中的两部分合并后的P1代细胞消化后,收集细胞,计数并测定细胞活率,冻存,即得P1代的羊膜间充质干细胞,必要时对其进行传代培养。
根据本发明第一方面任一实施方案的方法,其中所述基础平衡盐溶液中包括链霉素和青霉素两种抗生素。
根据本发明第一方面任一实施方案的方法,其中所述基础平衡盐溶液是通过如下方式配制得到的:将0.4g的KCl、0.06g的KH2PO4、0.132g的Na2HPO4.12H2O、8g的NaCl、0.35g的NaHCO3、1.0g的D-葡萄糖、0.10g的链霉素、0.06g的青霉素用水溶解并定容成1L的溶液。
根据本发明第一方面任一实施方案的方法,其中所述混合酶消化液中包含:0.1mg/ml的I型胶原酶,0.3mg/ml的II型胶原酶,0.1mg/ml的透明质酸酶和0.05mg/ml的中性蛋白酶。
根据本发明第一方面任一实施方案的方法,其中所述完全培养基包括:DMEM-F12培养基、FBS、青霉素、链霉素。
根据本发明第一方面任一实施方案的方法,其中所述DMEM-F12培养基是DMEM-F12以体积比1:1配制的培养基。
根据本发明第一方面任一实施方案的方法,其中所述完全培养基包括:DMEM-F12(1:1)培养基、10%FBS、100μg/mL青霉素、50μg/mL链霉素。在一个实施方案中,所述的完全培养基中还添加了0.01~0.05%(例如0.01~0.04%、例如0.01~0.03%)硝酸硫胺和0.05~0.1%(例如0.06~0.1%、例如0.07~0.1%) 麦芽糖。已经出人意料地发现,向培养基中添加微量的硝酸硫胺和麦芽糖两者后,可以显著地提高人羊膜间充质干细胞的产量,而不使用它们二者或者仅增添其中之一时无法获得这种效果。
根据本发明第一方面任一实施方案的方法,其中步骤(4)中,通常是培养10~15天(通常可以是12天左右)后传代至P1代。
根据本发明第一方面任一实施方案的方法,其中步骤(5)中,胰酶消化液是包括0.25%的胰蛋白酶和0.02%的EDTA的消化液。
进一步的,本发明第二方面提供了一种人羊膜间充质干细胞,其是通过本发明第一方面所述方法制备得到的。
根据本发明第二方面的人羊膜间充质干细胞,其是通过包括如下步骤的方法制备得到的:
(1)从胎盘样品采集盒中取出胎盘,置于白瓷盘中,使用基础平衡盐溶液反复冲洗表面,对胎盘进行消毒处理;
(2)用手术镊慢慢撕取胎膜外层羊膜置于150mm玻璃皿中,使用基础平衡盐溶液反复清洗表面污血,剪碎成直径为5mm的羊膜组织小块;用300目滤网过滤,生理盐水冲洗残血,组织块转移至50ml离心管;
(3)组织消化:在37℃恒温摇床中,将组织块用1倍组织体积的混合酶消化液以100rpm振荡消化30~60min;消化结束后,加2ml胎牛血清混匀终止;用200目滤网过滤并用大量生理盐水清洗,收集滤液;
(4)分别对滤液部分和组织块部分进行细胞培养:
滤液部分:收集的滤液以1500rpm离心5min,去上清,用生理盐水重悬清洗细胞沉淀;以1500rpm离心5min,去上清,将细胞沉淀用完全培养基重悬;计数仪计取有核细胞数并用台盼兰染色测定细胞活率(通常可得大于1×107细胞,细胞活率大于95%);以每瓶2×106个细胞接种于75cm2培养瓶中,添加20ml完全培养基,晃匀后在5%CO2、37℃培养箱中培养;定期换液;培养10~15天(通常可以是12天左右)后传代至P1代,继续用完全培养基培养;
组织块部分:将收集的组织块置于75cm2培养瓶中,使组织块能够覆盖培养瓶中一半的培养面积,添加完全培养基没过组织,晃匀后于5%CO2、37℃培养箱中培养;2d后补液10ml完全培养基,继续培养;较多间充质干细胞爬出后去组织,定期换液;培养10~15天(通常可以是12天左右)后传代至P1代,继续用完全培养基培养;
(5)P1代细胞收获:用胰酶消化液将上一步骤中的两部分合并后的P1代细胞消化后,收集细胞,计数并测定细胞活率,冻存,即得P1代的羊膜间充质干细胞,必要时对其进行传代培养。
根据本发明第二方面的人羊膜间充质干细胞,其中所述基础平衡盐溶液中包括链霉素和青霉素两种抗生素。
根据本发明第二方面的人羊膜间充质干细胞,其中所述基础平衡盐溶液是通过如下方式配制得到的:将0.4g的KCl、0.06g的KH2PO4、0.132g的Na2HPO4.12H2O、8g的NaCl、0.35g的NaHCO3、1.0g的D-葡萄糖、0.10g的链霉素、0.06g的青霉素用水溶解并定容成1L的溶液。
根据本发明第二方面的人羊膜间充质干细胞,其中所述混合酶消化液中包含:0.1mg/ml的I型胶原酶,0.3mg/ml的II型胶原酶,0.1mg/ml的透明质酸酶和0.05mg/ml的中性蛋白酶。
根据本发明第二方面的人羊膜间充质干细胞,其中所述完全培养基包括:DMEM-F12培养基、FBS、青霉素、链霉素。
根据本发明第二方面的人羊膜间充质干细胞,其中所述DMEM-F12培养基是DMEM-F12以体积比1:1配制的培养基。
根据本发明第二方面的人羊膜间充质干细胞,其中所述完全培养基包括:DMEM-F12(1:1)培养基、10%FBS、100μg/mL青霉素、50μg/mL链霉素。在一个实施方案中,所述的完全培养基中还添加了0.01~0.05%(例如0.01~0.04%、例如0.01~0.03%)硝酸硫胺和0.05~0.1%(例如0.06~0.1%、例如0.07~0.1%)麦芽糖。
根据本发明第二方面的人羊膜间充质干细胞,其中步骤(4)中,通常是培养10~15天(通常可以是12天左右)后传代至P1代。
根据本发明第二方面的人羊膜间充质干细胞,其中步骤(5)中,胰酶消化液是包括0.25%的胰蛋白酶和0.02%的EDTA的消化液。
进一步的,本发明第三方面提供了本发明第二方面任一实施方案所述人羊膜间充质干细胞在制备作为细胞治疗剂的药物中的用途。
根据本发明第三方面任一实施方案的用途,其中所述人羊膜间充质干细胞是通过包括如下步骤的方法制备得到的:
(1)从胎盘样品采集盒中取出胎盘,置于白瓷盘中,使用基础平衡盐溶液反复冲洗表面,对胎盘进行消毒处理;
(2)用手术镊慢慢撕取胎膜外层羊膜置于150mm玻璃皿中,使用基础平衡盐溶液反复清洗表面污血,剪碎成直径为5mm的羊膜组织小块;用300目滤网过滤,生理盐水冲洗残血,组织块转移至50ml离心管;
(3)组织消化:在37℃恒温摇床中,将组织块用1倍组织体积的混合酶消化液以100rpm振荡消化30~60min;消化结束后,加2ml胎牛血清混匀终止;用200目滤网过滤并用大量生理盐水清洗,收集滤液;
(4)分别对滤液部分和组织块部分进行细胞培养:
滤液部分:收集的滤液以1500rpm离心5min,去上清,用生理盐水重悬清洗细胞沉淀;以1500rpm离心5min,去上清,将细胞沉淀用完全培养基重悬;计数仪计取有核细胞数并用台盼兰染色测定细胞活率(通常可得大于1×107细胞,细胞活率大于95%);以每瓶2×106个细胞接种于75cm2培养瓶中,添加20ml完全培养基,晃匀后在5%CO2、37℃培养箱中培养;定期换液;培养10~15天(通常可以是12天左右)后传代至P1代,继续用完全培养基培养;
组织块部分:将收集的组织块置于75cm2培养瓶中,使组织块能够覆盖培养瓶中一半的培养面积,添加完全培养基没过组织,晃匀后于5%CO2、37℃培养箱中培养;2d后补液10ml完全培养基,继续培养;较多间充质干细胞爬出后去组织,定期换液;培养10~15天(通常可以是12天左右)后传代至P1代,继续用完全培养基培养;
(5)P1代细胞收获:用胰酶消化液将上一步骤中的两部分合并后的P1代细胞消化后,收集细胞,计数并测定细胞活率,冻存,即得P1代的羊膜间充质干细胞,必要时对其进行传代培养。
根据本发明第三方面任一实施方案的用途,其中所述基础平衡盐溶液中包括链霉素和青霉素两种抗生素。
根据本发明第三方面任一实施方案的用途,其中所述基础平衡盐溶液是通过如下方式配制得到的:将0.4g的KCl、0.06g的KH2PO4、0.132g的Na2HPO4.12H2O、8g的NaCl、0.35g的NaHCO3、1.0g的D-葡萄糖、0.10g的链霉素、0.06g的青霉素用水溶解并定容成1L的溶液。
根据本发明第三方面任一实施方案的用途,其中所述混合酶消化液中包含:0.1mg/ml的I型胶原酶,0.3mg/ml的II型胶原酶,0.1mg/ml的透明质酸酶和0.05mg/ml的中性蛋白酶。
根据本发明第三方面任一实施方案的用途,其中所述完全培养基包括:DMEM-F12培养基、FBS、青霉素、链霉素。
根据本发明第三方面任一实施方案的用途,其中所述DMEM-F12培养基是DMEM-F12以体积比1:1配制的培养基。
根据本发明第三方面任一实施方案的用途,其中所述完全培养基包括:DMEM-F12(1:1)培养基、10%FBS、100μg/mL青霉素、50μg/mL链霉素。在一个实施方案中,所述的完全培养基中还添加了0.01~0.05%(例如0.01~0.04%、例如0.01~0.03%)硝酸硫胺和0.05~0.1%(例如0.06~0.1%、例如0.07~0.1%)麦芽糖。
根据本发明第三方面任一实施方案的用途,其中步骤(4)中,通常是培养10~15天(通常可以是12天左右)后传代至P1代。
根据本发明第三方面任一实施方案的用途,其中步骤(5)中,胰酶消化液是包括0.25%的胰蛋白酶和0.02%的EDTA的消化液。
本发明任一方面或该任一方面的任一实施方案所具有的任一技术特征同样适用其它任一实施方案或其它任一方面的任一实施方案,只要它们不会相互矛盾,当然在相互之间适用时,必要的话可对相应特征作适当修饰。下面对本发明的各个方面和特点作进一步的描述。
本发明所引述的所有文献,它们的全部内容通过引用并入本文,并且如果这些文献所表达的含义与本发明不一致时,以本发明的表述为准。此外,本发明使用的各种术语和短语具有本领域技术人员公知的一般含义,即便如此,本发明仍然希望在此对这些术语和短语作更详尽的说明和解释,提及的术语和短语如有与公知含义不一致的,以本发明所表述的含义为准。
通常地讲,一个胎盘羊膜的面积约600平方厘米,本发明羊膜干细胞即取材于胎盘上的羊膜。
本发明方法的整个流程操作简单,可控,P1代即可收获大量细胞,为临床应用和研究提供了可能。
已以发现,本发明所得人羊膜间充质干细胞经免疫细胞化学和免疫荧光染色检测,结果均显示,这些细胞均呈现人羊膜间充质干细胞的典型特征。例如,针对本发明获得的流式检测显示:CD73、CD90、CD105阳性为阳性,CD34、CD45、HLADR、CD11b、CD19阴性;诱导分化结果显示其:成软骨、成脂、成骨为阳性。此外,已经发现,通过使用本发明方法,每400平方厘米羊膜可以得到108个以上的人羊膜间充质干细胞。
附图说明
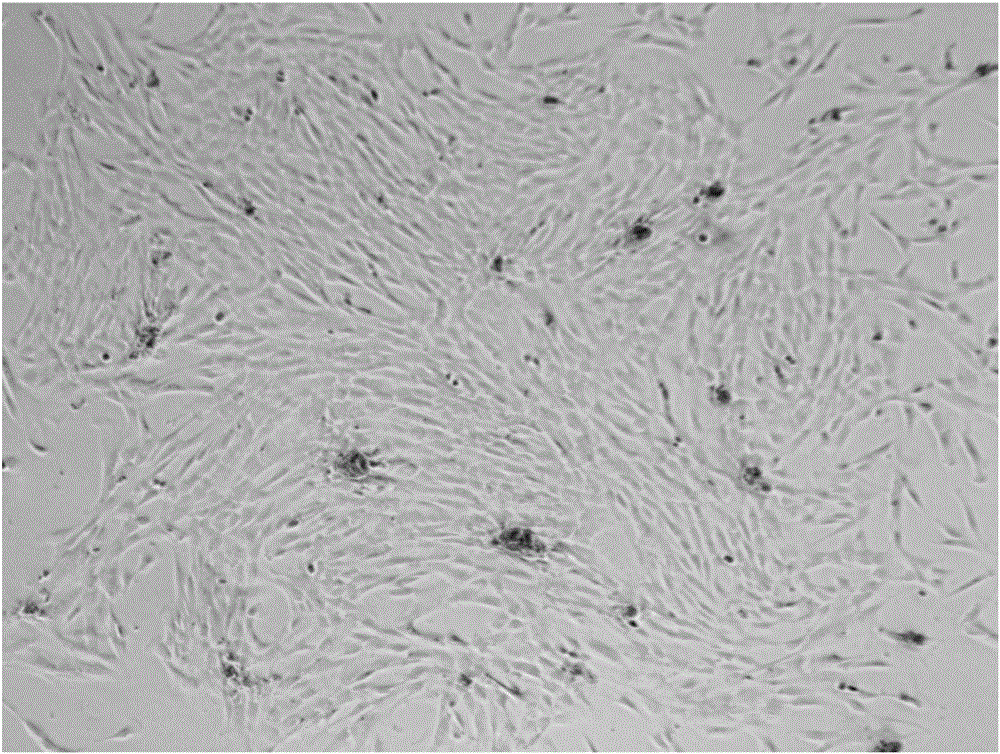
图1显示了本发明人羊膜间充质干细胞细胞显微图(培养3天,100倍放大);
图2显示了本发明人羊膜间充质干细胞细胞显微图(培养10天,40倍放大);
图3显示了本发明人羊膜间充质干细胞细胞显微图(培养10天,100倍放大);
图4显示了本发明人羊膜间充质干细胞细胞诱导分化的成骨测试结果;
图5显示了本发明人羊膜间充质干细胞细胞诱导分化的成软骨测试结果;
图6显示了本发明人羊膜间充质干细胞细胞诱导分化的成脂测试结果。
具体实施方式
通过下面的实施例可以对本发明进行进一步的描述,然而,本发明的范围并不限于下述实施例。本领域的专业人员能够理解,在不背离本发明的精神和范围的前提下,可以对本发明进行各种变化和修饰。本发明对试验中所使用到的材料以及试验方法进行一般性和/或具体的描述。虽然为实现本发明目的所使用的许多材料和操作方法是本领域公知的,但是本发明仍然在此作尽可能详细的描述。
本发明下文试验中所使用的材料例如其中所使用的试剂是本领域已知的,其可以采用公知方法配制或者直接从市场购得。
实施例1:从胎盘羊膜制备人羊膜间充质干细胞
(1)从胎盘样品采集盒中取出胎盘,置于白瓷盘中,使用基础平衡盐溶液(将0.4g的KCl、0.06g的KH2PO4、0.132g的Na2HPO4.12H2O、8g的NaCl、0.35g的NaHCO3、1.0g的D-葡萄糖、0.10g的链霉素、0.06g的青霉素用水溶解并定容成1L的溶液,即得)反复冲洗表面,对胎盘进行消毒处理;
(2)用手术镊慢慢撕取胎膜外层羊膜置于150mm玻璃皿中,使用基础平衡盐溶液反复清洗表面污血,剪碎成直径为5mm的羊膜组织小块;用300目滤网过滤,生理盐水冲洗残血,组织块转移至50ml离心管;
(3)组织消化:在37度恒温摇床中,将组织块用1倍组织体积的混合酶消化液(内含:0.1mg/ml的I型胶原酶,0.3mg/ml的II型胶原酶,0.1mg/ml的透明质酸酶和0.05mg/ml的中性蛋白酶)以100rpm振荡消化40min;消化结束后,加2ml胎牛血清混匀终止;用200目滤网过滤并用大量生理盐水清洗,收集滤液;
(4)分别对滤液部分和组织块部分进行细胞培养:
滤液部分:收集的滤液以1500rpm离心5min,去上清,用生理盐水重悬清洗细胞沉淀;以1500rpm离心5min,去上清,将细胞沉淀用完全培养基(DMEM-F12(1∶1)培养基、10%FBS、100μg/mL青霉素、50μg/mL链霉素)重悬;计数仪计取有核细胞数并用台盼兰染色测定细胞活率(通常可得大于1×107细胞,细胞活率大于95%);以每瓶2×106个细胞接种于75cm2培养瓶中,添加20ml完全培养基,晃匀后在5%CO2、37℃培养箱中培养;定期换液;培养12天后传代至P1代,继续用完全培养基培养;
组织块部分:将收集的组织块置于75cm2培养瓶中,使组织块能够覆盖培养瓶中一半的培养面积,添加完全培养基没过组织,晃匀后于5%CO2、37℃培养箱中培养;2d后补液10ml完全培养基,继续培养;较多间充质干细胞爬出后去组织,定期换液;培养12天后传代至P1代,继续用完全培养基培养;
(5)P1代细胞收获:用胰酶消化液(包含0.25%的胰蛋白酶和0.02%的EDTA的消化液)将上一步骤中的两部分合并后的P1代细胞消化后,收集细胞,计数并测定细胞活率,冻存,即得P1代的羊膜间充质干细胞,必要时对其进行传代培养。
实施例2:从胎盘羊膜制备人羊膜间充质干细胞
(1)从胎盘样品采集盒中取出胎盘,置于白瓷盘中,使用基础平衡盐溶液(将0.4g的KCl、0.06g的KH2PO4、0.132g的Na2HPO4.12H2O、8g的NaCl、0.35g的NaHCO3、1.0g的D-葡萄糖、0.10g的链霉素、0.06g的青霉素用水溶解并定容成1L的溶液,即得)反复冲洗表面,对胎盘进行消毒处理;
(2)用手术镊慢慢撕取胎膜外层羊膜置于150mm玻璃皿中,使用基础平衡盐溶液反复清洗表面污血,剪碎成直径为5mm的羊膜组织小块;用300目滤网过滤,生理盐水冲洗残血,组织块转移至50ml离心管;
(3)组织消化:在37度恒温摇床中,将组织块用1倍组织体积的混合酶消化液(内含:0.1mg/ml的I型胶原酶,0.3mg/ml的II型胶原酶,0.1mg/ml的透明质酸酶和0.05mg/ml的中性蛋白酶)以100rpm振荡消化30min;消化结束后,加2ml胎牛血清混匀终止;用200目滤网过滤并用大量生理盐水清洗,收集滤液;
(4)分别对滤液部分和组织块部分进行细胞培养:
滤液部分:收集的滤液以1500rpm离心5min,去上清,用生理盐水重悬清洗细胞沉淀;以1500rpm离心5min,去上清,将细胞沉淀用完全培养基(DMEM-F12(1:1)培养基、10%FBS、100μg/mL青霉素、50μg/mL链霉素)重悬;计数仪计取有核细胞数并用台盼兰染色测定细胞活率(通常可得大于1×107细胞,细胞活率大于95%);以每瓶2×106个细胞接种于75cm2培养瓶中,添加20ml完全培养基,晃匀后在5%CO2、37℃培养箱中培养;定期换液;培养10天后传代至P1代,继续用完全培养基培养;
组织块部分:将收集的组织块置于75cm2培养瓶中,使组织块能够覆盖培养瓶中一半的培养面积,添加完全培养基没过组织,晃匀后于5%CO2、37℃培养箱中培养;2d后补液10ml完全培养基,继续培养;较多间充质干细胞爬出后去组织,定期换液;培养15天后传代至P1代,继续用完全培养基培养;
(5)P1代细胞收获:用胰酶消化液(包含0.25%的胰蛋白酶和0.02%的EDTA的消化液)将上一步骤中的两部分合并后的P1代细胞消化后,收集细胞,计数并测定细胞活率,冻存,即得P1代的羊膜间充质干细胞,必要时对其进行传代培养。
实施例3:从胎盘羊膜制备人羊膜间充质干细胞
(1)从胎盘样品采集盒中取出胎盘,置于白瓷盘中,使用基础平衡盐溶液(将0.4g的KCl、0.06g的KH2PO4、0.132g的Na2HPO4.12H2O、8g的NaCl、0.35g的NaHCO3、1.0g的D-葡萄糖、0.10g的链霉素、0.06g的青霉素用水溶解并定容成1L的溶液,即得)反复冲洗表面,对胎盘进行消毒处理;
(2)用手术镊慢慢撕取胎膜外层羊膜置于150mm玻璃皿中,使用基础平衡盐溶液反复清洗表面污血,剪碎成直径为5mm的羊膜组织小块;用300目滤网过滤,生理盐水冲洗残血,组织块转移至50ml离心管;
(3)组织消化:在37度恒温摇床中,将组织块用1倍组织体积的混合酶消化液(内含:0.1mg/ml的I型胶原酶,0.3mg/ml的II型胶原酶,0.1mg/ml的透明质酸酶和0.05mg/ml的中性蛋白酶)以100rpm振荡消化60min;消化结束后,加2ml胎牛血清混匀终止;用200目滤网过滤并用大量生理盐水清洗,收集滤液;
(4)分别对滤液部分和组织块部分进行细胞培养:
滤液部分:收集的滤液以1500rpm离心5min,去上清,用生理盐水重悬清洗细胞沉淀;以1500rpm离心5min,去上清,将细胞沉淀用完全培养基(DMEM-F12(1:1)培养基、10%FBS、100μg/mL青霉素、50μg/mL链霉素)重悬;计数仪计取有核细胞数并用台盼兰染色测定细胞活率(通常可得大于1×107细胞,细胞活率大于95%);以每瓶2×106个细胞接种于75cm2培养瓶中,添加20ml完全培养基,晃匀后在5%CO2、37℃培养箱中培养;定期换液;培养15天后传代至P1代,继续用完全培养基培养;
组织块部分:将收集的组织块置于75cm2培养瓶中,使组织块能够覆盖培养瓶中一半的培养面积,添加完全培养基没过组织,晃匀后于5%CO2、37℃培养箱中培养;2d后补液10ml完全培养基,继续培养;较多间充质干细胞爬出后去组织,定期换液;培养10天后传代至P1代,继续用完全培养基培养;
(5)P1代细胞收获:用胰酶消化液(包含0.25%的胰蛋白酶和0.02%的EDTA的消化液)将上一步骤中的两部分合并后的P1代细胞消化后,收集细胞,计数并测定细胞活率,冻存,即得P1代的羊膜间充质干细胞,必要时对其进行传代培养。
经本发明实施例1~3的方法制备P1代的人羊膜间充质干细胞,针对不同胎盘样本,平均地讲,每400平方厘米羊膜可以得到(1.51~2.07)×108个人羊膜间充质干细胞。但是经本发明实施例4~6的方法制备P1代的人羊膜间充质干细胞,针对不同胎盘样本,平均地讲,每400平方厘米羊膜可以得到(8.83~10.77)×108个人羊膜间充质干细胞,显著地高于实施例1~3方法。本发明在参照实施例4~6的补充试验中,发现如果在完全培养基中硝酸硫胺和麦芽糖二者只添加其中的一种,则此时制备P1代的人羊膜间充质干细胞,针对不同胎盘样本,平均地讲,每400平方厘米羊膜可以得到(1.58~1.91)×108个人羊膜间充质干细胞,这表明将硝酸硫胺和麦芽糖之一增补到完全培养基中无法有效地提高人羊膜间充质干细胞的产量。此外,本发明人参考其它现有技术文献,例如本发明已经引用的专利文献中的方法制备P1代(以P1代为比较参数,更具可比性)的人羊膜间充质干细胞时,其平均每400平方厘米羊膜可以得到的人羊膜间充质干细胞小于1.5×108个。
实施例4:从胎盘羊膜制备人羊膜间充质干细胞
(1)从胎盘样品采集盒中取出胎盘,置于白瓷盘中,使用基础平衡盐溶液(将0.4g的KCl、0.06g的KH2PO4、0.132g的Na2HPO4.12H2O、8g的NaCl、0.35g的NaHCO3、1.0g的D-葡萄糖、0.10g的链霉素、0.06g的青霉素用水溶解并定容成1L的溶液,即得)反复冲洗表面,对胎盘进行消毒处理;
(2)用手术镊慢慢撕取胎膜外层羊膜置于150mm玻璃皿中,使用基础平衡盐溶液反复清洗表面污血,剪碎成直径为5mm的羊膜组织小块;用300目滤网过滤,生理盐水冲洗残血,组织块转移至50ml离心管;
(3)组织消化:在37度恒温摇床中,将组织块用1倍组织体积的混合酶消化液(内含:0.1mg/ml的I型胶原酶,0.3mg/ml的II型胶原酶,0.1mg/ml的透明质酸酶和0.05mg/ml的中性蛋白酶)以100rpm振荡消化40min;消化结束后,加2ml胎牛血清混匀终止;用200目滤网过滤并用大量生理盐水清洗,收集滤液;
(4)分别对滤液部分和组织块部分进行细胞培养:
滤液部分:收集的滤液以1500rpm离心5min,去上清,用生理盐水重悬清洗细胞沉淀;以1500rpm离心5min,去上清,将细胞沉淀用完全培养基(DMEM-F12(1∶1)培养基、10%FBS、100μg/mL青霉素、50μg/mL链霉素、0.02%硝酸硫胺、0.085%麦芽糖)重悬;计数仪计取有核细胞数并用台盼兰染色测定细胞活率(通常可得大于1×107细胞,细胞活率大于95%);以每瓶2×106个细胞接种于75cm2培养瓶中,添加20ml完全培养基,晃匀后在5%CO2、37℃培养箱中培养;定期换液;培养12天后传代至P1代,继续用完全培养基培养;
组织块部分:将收集的组织块置于75cm2培养瓶中,使组织块能够覆盖培养瓶中一半的培养面积,添加完全培养基没过组织,晃匀后于5%CO2、37℃培养箱中培养;2d后补液10ml完全培养基,继续培养;较多间充质干细胞爬出后去组织,定期换液;培养12天后传代至P1代,继续用完全培养基培养;
(5)P1代细胞收获:用胰酶消化液(包含0.25%的胰蛋白酶和0.02%的EDTA的消化液)将上一步骤中的两部分合并后的P1代细胞消化后,收集细胞,计数并测定细胞活率,冻存,即得P1代的羊膜间充质干细胞,必要时对其进行传代培养。
图1显示了本实施例人羊膜间充质干细胞细胞显微图(培养3天,100倍放大);图2显示了本实施例人羊膜间充质干细胞细胞显微图(培养10天,40倍放大);图3显示了本实施例人羊膜间充质干细胞细胞显微图(培养10天,100倍放大);图4显示了本实施例人羊膜间充质干细胞细胞诱导分化的成骨测试结果;图5显示了本实施例人羊膜间充质干细胞细胞诱导分化的成软骨测试结果;图6显示了本实施例人羊膜间充质干细胞细胞诱导分化的成脂测试结果。
实施例5:从胎盘羊膜制备人羊膜间充质干细胞
(1)从胎盘样品采集盒中取出胎盘,置于白瓷盘中,使用基础平衡盐溶液(将0.4g的KCl、0.06g的KH2PO4、0.132g的Na2HPO4.12H2O、8g的NaCl、0.35g的NaHCO3、1.0g的D-葡萄糖、0.10g的链霉素、0.06g的青霉素用水溶解并定容成1L的溶液,即得)反复冲洗表面,对胎盘进行消毒处理;
(2)用手术镊慢慢撕取胎膜外层羊膜置于150mm玻璃皿中,使用基础平衡盐溶液反复清洗表面污血,剪碎成直径为5mm的羊膜组织小块;用300目滤网过滤,生理盐水冲洗残血,组织块转移至50ml离心管;
(3)组织消化:在37度恒温摇床中,将组织块用1倍组织体积的混合酶消化液(内含:0.1mg/ml的I型胶原酶,0.3mg/ml的II型胶原酶,0.1mg/ml的透明质酸酶和0.05mg/ml的中性蛋白酶)以100rpm振荡消化30min;消化结束后,加2ml胎牛血清混匀终止;用200目滤网过滤并用大量生理盐水清洗,收集滤液;
(4)分别对滤液部分和组织块部分进行细胞培养:
滤液部分:收集的滤液以1500rpm离心5min,去上清,用生理盐水重悬清洗细胞沉淀;以1500rpm离心5min,去上清,将细胞沉淀用完全培养基(DMEM-F12(1:1)培养基、10%FBS、100μg/mL青霉素、50μg/mL链霉素、0.01%硝酸硫胺、0.1%麦芽糖)重悬;计数仪计取有核细胞数并用台盼兰染色测定细胞活率(通常可得大于1×107细胞,细胞活率大于95%);以每瓶2×106个细胞接种于75cm2培养瓶中,添加20ml完全培养基,晃匀后在5%CO2、37℃培养箱中培养;定期换液;培养10天后传代至P1代,继续用完全培养基培养;
组织块部分:将收集的组织块置于75cm2培养瓶中,使组织块能够覆盖培养瓶中一半的培养面积,添加完全培养基没过组织,晃匀后于5%CO2、37℃培养箱中培养;2d后补液10ml完全培养基,继续培养;较多间充质干细胞爬出后去组织,定期换液;培养15天后传代至P1代,继续用完全培养基培养;
(5)P1代细胞收获:用胰酶消化液(包含0.25%的胰蛋白酶和0.02%的EDTA的消化液)将上一步骤中的两部分合并后的P1代细胞消化后,收集细胞,计数并测定细胞活率,冻存,即得P1代的羊膜间充质干细胞,必要时对其进行传代培养。
实施例6:从胎盘羊膜制备人羊膜间充质干细胞
(1)从胎盘样品采集盒中取出胎盘,置于白瓷盘中,使用基础平衡盐溶液(将0.4g的KCl、0.06g的KH2PO4、0.132g的Na2HPO4.12H2O、8g的NaCl、0.35g的NaHCO3、1.0g的D-葡萄糖、0.10g的链霉素、0.06g的青霉素用水溶解并定容成1L的溶液,即得)反复冲洗表面,对胎盘进行消毒处理;
(2)用手术镊慢慢撕取胎膜外层羊膜置于150mm玻璃皿中,使用基础平衡盐溶液反复清洗表面污血,剪碎成直径为5mm的羊膜组织小块;用300目滤网过滤,生理盐水冲洗残血,组织块转移至50ml离心管;
(3)组织消化:在37度恒温摇床中,将组织块用1倍组织体积的混合酶消化液(内含:0.1mg/ml的I型胶原酶,0.3mg/ml的II型胶原酶,0.1mg/ml的透明质酸酶和0.05mg/ml的中性蛋白酶)以100rpm振荡消化60min;消化结束后,加2ml胎牛血清混匀终止;用200目滤网过滤并用大量生理盐水清洗,收集滤液;
(4)分别对滤液部分和组织块部分进行细胞培养:
滤液部分:收集的滤液以1500rpm离心5min,去上清,用生理盐水重悬清洗细胞沉淀;以1500rpm离心5min,去上清,将细胞沉淀用完全培养基(DMEM-F12(1:1)培养基、10%FBS、100μg/mL青霉素、50μg/mL链霉素、0.03%硝酸硫胺、0.07%麦芽糖)重悬;计数仪计取有核细胞数并用台盼兰染色测定细胞活率(通常可得大于1×107细胞,细胞活率大于95%);以每瓶2×106个细胞接种于75cm2培养瓶中,添加20ml完全培养基,晃匀后在5%CO2、37℃培养箱中培养;定期换液;培养15天后传代至P1代,继续用完全培养基培养;
组织块部分:将收集的组织块置于75cm2培养瓶中,使组织块能够覆盖培养瓶中一半的培养面积,添加完全培养基没过组织,晃匀后于5%CO2、37℃培养箱中培养;2d后补液10ml完全培养基,继续培养;较多间充质干细胞爬出后去组织,定期换液;培养10天后传代至P1代,继续用完全培养基培养;
(5)P1代细胞收获:用胰酶消化液(包含0.25%的胰蛋白酶和0.02%的EDTA的消化液)将上一步骤中的两部分合并后的P1代细胞消化后,收集细胞,计数并测定细胞活率,冻存,即得P1代的羊膜间充质干细胞,必要时对其进行传代培养。
试验例1:羊膜间充质干细胞的验证:
使用流式细胞仪检测下列项目
CD73检测:准备两支流式管,编号,其中一支为质控管一支为样品管,将CD73的control试剂摇匀,向质控管中加入20ul,再将CD73试剂摇匀,向样品管中加入20ul CD73试剂,然后将样品震荡摇匀向两支流式管中各加入600ul样品,然后混匀,置于4℃左右避光孵育30分钟,然后向质控管和流式管中分别加入1毫升PBS,混匀后1500转/分钟离心5分钟,后弃去上清,加入240ul的PBS后混匀上机,检测阳性结果≧95%则为合格,出具细胞表面标记物检测合格报告。
CD90检测:准备两支流式管,编号,其中一支为质控管一支为样品管,将CD90的control试剂摇匀,向质控管中加入20ul,再将CD90试剂摇匀,向样品管中加入10ul CD90试剂,然后将样品震荡摇匀向两支流式管中各加入600ul样品,然后混匀,置于4℃左右避光孵育30分钟,然后向质控管和流式管中分别加入1毫升PBS,混匀后1500转/分钟离心5分钟,后弃去上清,加入240ul的PBS后混匀上机,检测阳性结果≧95%则为合格,出具细胞表面标记物检测合格报告。
CD105检测:准备两支流式管,编号,其中一支为质控管一支为样品管,将CD105的control试剂摇匀,向质控管中加入10ul,再将CD105试剂摇匀,向样品管中加入5ulCD105试剂,然后将样品震荡摇匀向两支流式管中各加入600ul样品,然后混匀,置于4℃左右避光孵育30分钟,然后向质控管和流式管中分别加入1毫升PBS,混匀后1500转/分钟离心5分钟,后弃去上清,加入240ul的PBS后混匀上机,检测阳性结果≧95%则为合格,出具细胞表面标记物检测合格报告。
备注:所有细胞表型检测所用试剂的量均为经过实验可行后确定的使用量。
CD45检测:准备两支流式管,编号,其中一支为质控管一支为样品管,将CD45的control试剂摇匀,向质控管中加入20ul,再将CD45试剂摇匀,向样品管中加入20ul CD45试剂,然后将样品震荡摇匀向两支流式管中各加入600ul样品,然后混匀,置于4℃左右避光孵育30分钟,然后向质控管和流式管中分别加入1毫升PBS,混匀后1500转/分钟离心5分钟,后弃去上清,加入240ul的PBS后混匀上机,检测阳性结果≦2%则为合格,出具细胞表面标记物检测合格报告。
HLA-DR检测:准备两支流式管,编号,其中一支为质控管一支为样品管,将HLA-DR的control试剂摇匀,向质控管中加入20ul,再将HLA-DR试剂摇匀,向样品管中加入20ulHLA-DR试剂,然后将样品震荡摇匀向两支流式管中各加入600ul样品,然后混匀,置于4℃左右避光孵育30分钟,然后向质控管和流式管中分别加入1毫升PBS,混匀后1500转/分钟离心5分钟,后弃去上清,加入240ul的PBS后混匀上机,检测阳性结果≦2%则为合格,出具细胞表面标记物检测合格报告。
羊膜间充质干细胞向成骨细胞的诱导分化:1)碱性磷酸酶染色:成骨细胞会产生大量碱性磷酸酶,蓝紫色染色为碱性磷酸酶阳性。2)钙盐沉积染色:成骨细胞会产生钙盐的沉积,橙红色着色为阳性。这样的结果是典型的向成骨细胞的诱导分化的阳性结果。
其它检测项目亦可使用本领域公知的方法进行。
通过本试验例1的测试方法测试本发明实施例1~6所得人羊膜间充质干细胞,经检测,结果显示各参数均与人羊膜间充质干细胞典型特征相符。例如,经流式检测,实施例1~6所得人羊膜间充质干细胞其CD73、CD90、CD105阳性为阳性,CD34、CD45、HLADR、CD11b、CD19阴性;这些羊膜间充质干细胞的诱导分化结果显示其:成软骨、成脂、成骨为阳性。结果显示这些标志物或诱导分化性能均与人羊膜间充质干细胞符合。
- 还没有人留言评论。精彩留言会获得点赞!
- 从人胎盘羊膜制备羊膜间充质干细胞的方法及其应用与流程
- 一种脐疗贴的制备方法及应用与流程
- 一种干细胞制剂及其在制备治疗慢性肾炎的药物中的应用的制作方法与工艺
- 脐带间充质干细胞在制备治疗角膜损伤的干细胞制剂中的应用的制作方法与工艺
- 脐带间充质干细胞联合黄芪多糖在制备治疗高血糖和糖尿病肾病药物中的应用的制作方法与工艺
- 由脐带间充质干细胞制备CD34阳性细胞的方法与流程
- 基因重组干细胞制剂的制备方法及其在皮肤损伤修复、瘢痕抑制中的应用与流程
- 一种大规模制备人脐带间充质干细胞因子用诱导分泌培养基的制作方法与工艺
- 一种人母乳干细胞的制备方法及其应用与流程
- 间充质干细胞联合维生素E在制备肾脏组织细胞修复药物中的应用的制作方法与工艺