培养基、细胞培养用试剂盒及细胞培养方法与流程
本申请是申请号为201110127667.4,发明名称为培养基、细胞培养用试剂盒及细胞培养方法的中国发明专利申请(申请日为2011年5月17日)的分案申请。
本发明涉及培养基、细胞培养用试剂盒及细胞培养方法,特别是用于上皮细胞培养的培养基、细胞培养用试剂盒及细胞培养方法。
背景技术:
人体重要器官如肺、肾、肝、胰腺和皮肤都由器官特异性分化的上皮细胞为其组成成分。这些特异性分化的上皮细胞与不同器官的特异性功能直接相关,如肺的气体交换功能、肾的过滤功能、肝的解毒及中和功能、胰腺细胞产生胰岛素、皮肤具有保护机体免受外界环境的伤害。而这些重要器官一旦发生病变或退化就会威胁人类的健康,因为这些重要器官是很难被替换的,不同器官的特异性细胞也不能相互取代其它器官的细胞。
特异性分化的细胞,如肾上皮细胞、胰腺的胰岛素产生细胞、真皮的毛囊和腺体细胞都是很难再生的,更不要说在体外进行培养增殖了。实验动物(包括各种转基因和克隆动物)是用于疾病发病机理研究和新药研发的必要工具。但是,对于分离自人和哺乳动物的原代上皮细胞的体外培养仍然是很困难的。应用目前的无血清培养基,有的只能进行短期的原代培养(存活数天,如肺和胰腺等上皮细胞),有的只能进行有限的传代培养(1-3代,如气管/支气管及前列腺等上皮细胞),有的甚至根本不能体外培养(如肝和结肠等上皮细胞),只有来自于人体皮肤的角化上皮细胞可以传代培养10代左右。而且从每个动物或活体组织样品中获得的上皮细胞产量仍然很低,包括细胞的数量、直接分离或短期培养的细胞纯度都是很低的,这些原代和传代上皮细胞的增殖速度也极为有限。
为了在体外进行上皮细胞的培养,目前国外尝试通过遗传操作,如转入病毒(sv40t或hpv16e6e7)或细胞癌基因,可以延长体外细胞存活的代数。然而遗传操作的最大缺点是会改变这些细胞的遗传背景和表型,以致让这些正常上皮细胞丢失其正常生理功能,如p53和prb信号通路常常被抑制。而且,这些经遗传修饰的细胞是不可能重新再移植进机体的。但是由于目前缺乏有效的体外培养上皮细胞的技术,上述这些细胞在当今世界的医学和生命科学研究中仍然备受青睐。在非癌症研究领域,它们就代表着最初来源的“功能”性的组织或器官。在癌症研究领域,它们还常常被用来作为“正常细胞”对照。而且它们的市场价格还非常昂贵。
抗肿瘤药物研究的第一步就是药物对癌细胞的特异性毒性实验,目前所用的癌细胞株(如hela和a539等)多在体外传代数年甚至数十年,它们在很大程度上已不能反应同类型人体恶性肿瘤的特性,一些实验室还存在大量癌细胞株的交叉污染。而且对于不同的个体,即使同一类型的肿瘤也可能由不同的原因或机制所导致,因此对于每一种肿瘤,都需要有能代表其特定发病机制的细胞株来进行新药研发。更为突出的例子,如前列腺癌的研究领域根本没有人类原发前列腺癌的细胞系,仅有的细胞系(lncap,pc-3,du-145)都是来自转移后的肿瘤组织。尽管如此,全世界90%以上的肿瘤研究和几乎所有抗癌新药的研究还在继续使用着可能根本没有代表性的癌细胞株。因此,目前癌症研究和新药研发要解决的关键问题是,如何能获得反应各种类型人体肿瘤特性、同种肿瘤代表不同个体特性或不同发病机制的癌细胞。当然,归根结底的真正难题是缺乏有效的上皮细胞的原代和传代培养技术。另外,抗肿瘤药物存在的很多毒副作用,很大程度上是因为新药研究缺乏正常的细胞对照。若能得到来自于同一个体同一组织的癌细胞和正常细胞(美国asterand公司用上述hpve6e7转化得到的所谓的“正常”和癌的前列腺细胞,价格虽然高达1,2000美金/对,但还是十分抢手),新药研发的第一步将会回归科学,抗癌新药研究的历史必将重写。
再生医学是现代临床医学的一种崭新的治疗模式,即以再生、再造、代替和新生为基本治疗原理的现代干细胞移植治疗术,利用干细胞(胚胎干细胞和成体干细胞)具有向各种细胞分化转变能力,治疗临床上众多的、目前尚无治疗办法的变性、坏死性和损伤性疾病,具有显著和独特的医疗效果。然而目前面临的困境是,虽然胚胎干细胞具有分化能力,再生性和可塑性强,但可能致瘤和面临伦理争议,如何诱导其定向分化和增加移植的成活率仍然是未解的难题;而成体干细胞来源稀少,难以识别、分离及纯化,因此阻碍了其临床应用;目前新兴的研究热点——诱导性多能干细胞,由于其涉及遗传操作导致细胞遗传背景的改变,且导入的外源基因和病毒基因有致癌或致畸的潜能而不能用于临床治疗。
个体化医学是现代医学今后的发展方向。根据临床病人的疾病发生/发展有关的遗传背景及相关因素,在最短时间内准确地对疾病进行诊断、监测,制定真正的个体化治疗方案是解决问题的关键。例如,世界卫生组织调查发现药物安全性问题是住院病人致死最重要的原因之一。药物反应个体差异所致不良反应已成为危害人类健康的重要公共卫生问题。而遗传因素是造成药物反应个体差异的主要原因。在美国,已经有70余种药物经fda批准贴上了遗传标签,用于指示不同基因型的临床患者在应用药物时对疗效和毒性的预测作用,而遗传背景清晰的新药研发必将成为未来发展的趋势。如何利用极其微量的活检组织(如针吸细胞等)对恶性肿瘤等疾病进行早期快速诊断、体外药敏实验、疗效监测是对肿瘤患者个体化治疗的关键。所有这些都将依赖于快速、有效的原代细胞培养技术才能真正实现。
生物银行(时代周刊称之为改变世界的十大观念之一)正在全世界范围兴起。美国国立卫生研究院的研究人员正努力创建全美首个保存人类生物组织样本、肿瘤细胞、dna,以及血液的全国性生物银行。英、加、挪威和瑞典已设立了这类全国性的机构。搜集和储藏足够多的,从癌症、大脑紊乱到新陈代谢疾病的生物组织样本,为建立个体化医学和新药研发奠定基础,让筛选和治疗患者更有针对性。但是目前生物银行所储存的只是包括冰冻组织、固定的组织、dna、rna、蛋白质、血液、血浆、血清和尿液等,这些极其宝贵的资源用之即去,无法再生。有效的原代和传代细胞培养技术必将为生物银行注入真正的“活”力。这种具有“再生”能力的生物银行的出现将对现代医学研究、个体化诊断和治疗、新药研发具有里程碑意义。
综上所述,目前急需解决的问题是,如何快速、有效地进行组织器官来源的原代上皮细胞的增殖以及这些上皮细胞的传代培养,并且能有效地延长上皮细胞的培养代数,同时又不能改变细胞的遗传背景。
技术实现要素:
本发明人针对上述问题进行了深入研究,提出了新的培养基和试剂盒,通过使用该培养基或试剂盒体外增殖原代上皮细胞和传代培养上皮细胞,能够在不改变细胞遗传背景的情况下,有效地延长上皮细胞的培养代数。
即,本发明提供下述培养基(也称作本发明的培养基):
1.一种培养基,其包含
血清,
钙成分,和
rock抑制剂。
2.根据项1所述的培养基,其中,所述血清的含量是1.0~35v/v%。
3.根据项1所述的培养基,其中,所述rock抑制剂是选自法舒地尔、h-1152、y-27632、ha1100、ha1077和gsk429286中的一种或两种以上。
4.根据项1所述的培养基,其用于培养上皮细胞。
5.根据项4所述的培养基,其中,所述上皮细胞是非角质上皮细胞。
6.根据项4所述的培养基,其中,所述上皮细胞是原代细胞。
7.根据项4所述的培养基,其中,所述上皮细胞是传代细胞。
8.根据项4所述的培养基,其中,所述上皮细胞是肿瘤细胞。
9.根据项5所述的培养基,其中,所述非角质上皮细胞是鳞状上皮细胞、柱状上皮细胞、腺体上皮细胞或过渡类型上皮细胞。
10.根据项5所述的培养基,其中,所述非角质上皮细胞是口腔的、鼻粘膜的,气管的、支气管的、肺上皮的、食管上皮的,胃粘膜上皮的、大肠上皮的、小肠上皮的、肝细胞的、胆管上皮的,胆囊的,胰腺的、胰岛β细胞,肾的、膀胱的、尿道上皮的、睾丸上皮的、卵巢上皮的、甲状腺的、甲状腺滤泡上皮细胞、肾上腺的、胸腺的、前列腺的、乳腺的、扁桃腺的,垂体的细胞,角膜上皮细胞,视网膜色素上皮细胞。
11.根据项1所述的培养基,其中,所述钙成分的含量以钙离子计为0.1μm~30mm。
12.根据项1所述的培养基,其中,该培养基还包含饲养细胞。
13.根据项1所述的培养基,其中,该培养基中包含条件培养基。
此外,本发明还提供下述试剂盒(也称作本发明的试剂盒):
14.一种试剂盒,其包含培养基、血清和rock抑制剂。
15.根据项14所述的试剂盒,该试剂盒用于培养上皮细胞。
16.根据项15所述的试剂盒,其中,所述上皮细胞是非角质上皮细胞。
17.根据项15所述的试剂盒,其中,所述上皮细胞是原代细胞。
18.根据项15所述的试剂盒,其中,所述上皮细胞是传代细胞。
19.根据项15所述的试剂盒,其中,所述上皮细胞是肿瘤细胞。
20.根据项16所述的试剂盒,其中,所述非角质上皮细胞是鳞状上皮细胞、柱状上皮细胞、腺体上皮细胞或过渡类型上皮细胞。
21.根据项16所述的试剂盒,其中,所述非角质上皮细胞是口腔的、鼻粘膜的,气管的、支气管的、肺上皮的、食管上皮的,胃粘膜上皮的、大肠上皮的、小肠上皮的、肝细胞的、胆管上皮的,胆囊的,胰腺的、胰岛β细胞,肾的、膀胱的、尿道上皮的、睾丸上皮的、卵巢上皮的、甲状腺的、甲状腺滤泡上皮细胞、肾上腺的、胸腺的、前列腺的、乳腺的、扁桃腺的,垂体的细胞,角膜上皮细胞,视网膜色素上皮细胞。
22.根据项14所述的试剂盒,其还包含钙成分。
23.根据项14所述的试剂盒,其还包含饲养细胞。
24.根据项23所述的试剂盒,其中,所述饲养细胞是低温冻存的。
25.根据项23所述的试剂盒,其中,所述饲养细胞是低温储存的。
26.根据项14所述的试剂盒,其中,其还包含用于在进行细胞培养时单独盛放所述饲养细胞的容器,该容器具有可通透性膜结构。
27.根据项23所述的试剂盒,其中,所述饲养细胞是小鼠或人的成纤维细胞。
28.根据项14所述的试剂盒,其中,所述培养基包含条件培养基。
29.根据项14所述的试剂盒,其中,所述rock抑制剂是选自法舒地尔、h-1152、y-27632、ha1100、ha1077和gsk429286中的一种或两种以上。
30.一种试剂盒,其包含项1~13中任一项所述的培养基和饲养细胞。
31.根据项30所述的试剂盒,其中,所述饲养细胞是低温冻存的。
32.根据项30所述的试剂盒,其中,所述饲养细胞是低温储存的。
33.根据项30所述的试剂盒,其中,其还包含用于在进行细胞培养时单独盛放所述饲养细胞的容器,该容器具有可通透性膜结构。
此外,本发明还提供下述的培养上皮细胞的方法(也称作本发明的培养方法):
34.一种培养上皮细胞的方法,该方法包括
步骤a:使用项1~13中任一项所述的培养基将上皮细胞与饲养细胞共培养。
35.根据项34所述的培养上皮细胞的方法,其中,所述上皮细胞是原代细胞。
36.根据项34所述的培养上皮细胞的方法,其中,所述上皮细胞是传代细胞。
37.根据项34所述的培养上皮细胞的方法,其中,所述上皮细胞是肿瘤细胞。
38.根据项34所述的培养上皮细胞的方法,其中,所述上皮细胞是非角质上皮细胞。
39.根据项38所述的培养上皮细胞的方法,其中,所述非角质上皮细胞是鳞状上皮细胞、柱状上皮细胞、腺体上皮细胞或过渡类型上皮细胞。
40.根据项38所述的培养上皮细胞的方法,其中,所述非角质上皮细胞是口腔的、鼻粘膜的,气管的、支气管的、肺上皮的、食管上皮的,胃粘膜上皮的、大肠上皮的、小肠上皮的、肝细胞的、胆管上皮的,胆囊的,胰腺的、胰岛β细胞,肾的、膀胱的、尿道上皮的、睾丸上皮的、卵巢上皮的、甲状腺的、甲状腺滤泡上皮细胞、肾上腺的、胸腺的、前列腺的、乳腺的、扁桃腺的,垂体的细胞,角膜上皮细胞,视网膜色素上皮细胞。
41.根据项34所述的培养上皮细胞的方法,其中,该培养上皮细胞的方法是上皮细胞传代培养方法。
42.根据项34所述的培养上皮细胞的方法,其中,该培养上皮细胞的方法是原代上皮细胞增殖培养方法。
43.根据项34所述的培养上皮细胞的方法,其中,将上皮细胞与饲养细胞置于同一培养器皿中。
44.根据项34所述的培养上皮细胞的方法,其中,将饲养细胞单独置于具有可通透性膜结构的容器中。
45.根据项34所述的培养上皮细胞的方法,其中,所述饲养细胞是小鼠或人的成纤维细胞。
46.一种培养上皮细胞的方法,该方法包括
步骤b:使用项12或13所述的培养基培养上皮细胞。
47.根据项46所述的培养上皮细胞的方法,其中,所述上皮细胞是原代细胞。
48.根据项46所述的培养上皮细胞的方法,其中,所述上皮细胞是传代细胞。
49.根据项46所述的培养上皮细胞的方法,其中,所述上皮细胞是肿瘤细胞。
50.根据项46所述的培养上皮细胞的方法,其中,所述上皮细胞是非角质上皮细胞。
51.根据项50所述的培养上皮细胞的方法,其中,所述非角质上皮细胞是鳞状上皮细胞、柱状上皮细胞、腺体上皮细胞或过渡类型上皮细胞。
52.根据项50所述的培养上皮细胞的方法,其中,所述非角质上皮细胞是口腔的、鼻粘膜的,气管的、支气管的、肺上皮的、食管上皮的,胃粘膜上皮的、大肠上皮的、小肠上皮的、肝细胞的、胆管上皮的,胆囊的,胰腺的、胰岛β细胞,肾的、膀胱的、尿道上皮的、睾丸上皮的、卵巢上皮的、甲状腺的、甲状腺滤泡上皮细胞、肾上腺的、胸腺的、前列腺的、乳腺的、扁桃腺的,垂体的细胞,角膜上皮细胞,视网膜色素上皮细胞。
53.根据项46所述的培养上皮细胞的方法,其中,该培养上皮细胞的方法是上皮细胞传代培养方法。
54.根据项46所述的培养上皮细胞的方法,其中,该培养上皮细胞的方法是原代上皮细胞增殖培养方法。
通过使用本发明的培养基或试剂盒培养上皮细胞,能够在不改变细胞遗传背景的情况下,有效增殖培养原代上皮细胞,并有效地延长上皮细胞的培养代数。
附图说明
图1是本发明培养方法示意图,其中,方案①、②、③是本发明的培养基与饲养细胞组合的三种培养系统。
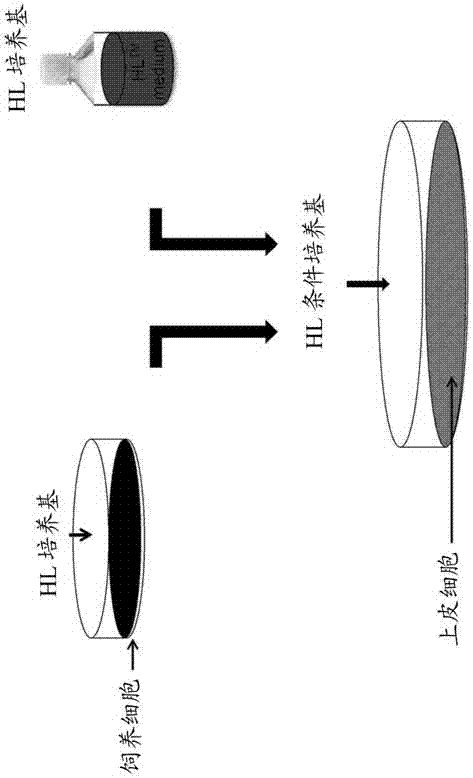
图2是采用本发明的条件培养基进行上皮细胞培养的工作流程图。
图3是采用本发明的饲养细胞间接(transwell)共培养系统进行上皮细胞培养的工作流程图。
图4是采用本发明的饲养细胞与上皮细胞直接共培养系统的工作流程图。
图5是正常人的支气管原代上皮细胞在无血清培养基(左)和含血清培养基(右)中培养的生长状态比较。图中显示,支气管上皮细胞在含血清的培养基中不能增殖。按实施例5的方法分离制备原代支气管上皮细胞,最后将获得的细胞沉淀重新悬浮于完全的dmem培养基[成分为dmem,加入10%胎牛血清(fbs),100u/ml青霉素(penicillin)和100μg/ml链霉素(streptomycin)]中,或者是无血清的上皮细胞培养基sfm(gibco#10744-019)(见实施例10)。一周后,在常规倒置显微镜下观察并照相。虽然培养效果不佳,但无血清培养基仍然广泛用于常规的上皮细胞原代与传代培养。
图6是培养的正常人支气管原代上皮细胞生长状态比较。图中显示,对于支气管上皮细胞,采用本发明的三种培养系统进行培养,细胞的生长增殖明显优于使用常规的无血清培养基。按实施例5的方法分离制备原代支气管上皮细胞,将获得的细胞沉淀重新悬浮于实施例8的条件培养基中(方法见图2),或者重悬细胞于本发明的hl培养基(见实施例2,hl培养基6)中,按图3的方法和实施例9所说明的饲养细胞间接共培养,或按图4和实施例6进行原代培养。一周后,在常规倒置显微镜下观察并照相。本图示的研究中所需要的饲养细胞按照实施例1进行传代和保种。本图示的研究中所需要的hl培养基按实施例2制备。本图示的研究中所需要的饲养细胞按实施例3和4获得。
图7是正常人支气管上皮细胞体外传代培养的比较。横坐标表示培养天数,纵坐标表示细胞增殖的倍数。图中显示,对于支气管上皮细胞,采用本发明的三种培养系统进行培养,细胞可以在体外传代至少10代左右,明显优于采用无血清培养基的培养。按实施例5的方法分离制备原代支气管上皮细胞,将获得的细胞沉淀重新悬浮于实施例8的条件培养基中(方法见图2),或者重悬细胞于本发明的hl培养基(见实施例2,hl培养基6)中,按图3的方法和实施例9所说明的饲养细胞间接共培养,或按图4和实施例6和7的说明进行传代培养。本图示的研究中所需要的饲养细胞按照实施例1进行传代和保种。本图示的研究中所需要的hl培养基按实施例2制备。本图示的研究中所需要的饲养细胞按实施例3和4获得。
图8总结了本发明方法已经成功培养的上皮细胞的种系和类型。这些细胞分别来自于人、小鼠和大鼠。这些细胞的组织类型有,但不限定于:口腔、气管、支气管、肺上皮、胃、结肠、前列腺、乳腺、肝、胰腺、膀胱、卵巢和扁桃腺。具体实施步骤按实施例5的方法分离制备原代上皮细胞,将获得的细胞沉淀重新悬浮于实施例8的条件培养基中进行培养(方法见图2),或者重悬细胞于本发明的hl培养基(见实施例2,其中hl培养基1用于乳腺、前列腺、胃、膀胱来源的上皮细胞培养;hl培养基2用于肝来源的上皮细胞培养;hl培养基3用于结肠、扁桃腺、乳腺、胃来源的上皮细胞培养;hl培养基4用于卵巢、扁桃腺来源的上皮细胞培养;hl培养基5用于胰腺、扁桃腺来源的上皮细胞培养;hl培养基6用于口腔、气管、支气管、肺来源的上皮细胞培养),按图3和实施例9所说明的饲养细胞间接共培养,或按图4和实施例6和7的说明进行培养传代。本图示的研究中所需要的饲养细胞按照实施例1进行传代和保种。本图示的研究中所需要的hl培养基按实施例2制备。本图示的研究中所需要的饲养细胞按实施例3和4获得。
图9所示为来源于人、大鼠和小鼠上皮细胞的培养实例。左图是来源于人的前列腺上皮细胞,按实施例5的方法分离制备原代上皮细胞,将获得的细胞沉淀重悬于实施例8的hl条件培养基(即由hl培养基1与饲养细胞共培养,按图示2方法得到)中培养。中图和右图分别是来源于大鼠的乳腺上皮细胞和小鼠的肺上皮细胞,按实施例5的方法分离制备原代上皮细胞,将获得的细胞沉淀重悬于实施例2中的hl培养基1或hl培养基6,按图4和实施例6和7的方法进行传代培养。本图示的研究中所需要的饲养细胞按照实施例1进行传代和保种。本图示的研究中所需要的hl培养基按实施例2制备。本图示的研究中所需要的饲养细胞按实施例3和4制备。
图10比较不同胎牛血清浓度对上皮细胞生长的影响。按实施例2配制hl培养基,加入胎牛血清使其终浓度分别为1%,2%,5%,10%。15%,20%。将5000个第二代的正常人支气管上皮细胞(来自图7研究中,实施例9的方法)分别悬浮于3毫升上述的含不同胎牛血清浓度的hl培养基中,然后置于6孔的细胞培养板中,再将500000个饲养细胞(按实施例3制备)置于transwell筐(corning公司产品)中,按照图3的方法,在5%co2,37℃的培养箱中培养6天。弃去transwell筐以及其中盛装的饲养细胞,弃去培养板中剩余的培养基,以无钙镁的磷酸缓冲液洗一次,加入1ml0.05%edta/胰酶消化液,37℃孵育约2-3分钟,待细胞完全脱壁后,加入2ml含10%胎牛血清的dmem培养基,充分混匀细胞,取出50ul细胞悬液混合于50ul的4%的台盼蓝(trypanblue)中染色,按常规方法进行细胞计数。
图11本发明的培养基所添加的rock抑制剂的化学结构。
图12显示rock抑制剂的浓度对上皮细胞生长的影响。按实施例2配制hl培养基6,加入不同的rock抑制剂使其终浓度分别为1um,5um,10um,20um,50um。将5000个第二代的正常支气管上皮细胞(从图7研究中,实施例9的方法)分别悬浮于3毫升上述的含不同浓度rock抑制剂的hl培养基6中,然后置于6孔的细胞培养板中,再将500000个饲养细胞(按实施例3制备)置于transwell筐(corning公司产品)中,按照图3的方法,在5%co2,37℃的培养箱中培养8天。弃去transwell筐以及其中盛装的饲养细胞,弃去培养孔中剩余的培养基,以无钙镁的磷酸缓冲液洗一次,加入1ml0.05%edta/胰酶消化液,37℃孵育约2-3分钟,待细胞完全脱壁后,加入2ml含10%胎牛血清的dmem培养液,充分混匀细胞,取出50ul细胞悬液混合于50ul的4%的台盼蓝(trypanblue)中染色,按常规方法进行细胞计数。
发明的具体实施方式
本发明的培养基
本发明的第一方面涉及一种培养基(也称作本发明的培养基,即hl培养基),其包含血清、钙成分和rock抑制剂。
本说明书中,培养基是指用于培养生物材料的基质。对于生物材料没有特殊限制,可以是病毒、细胞(例如微生物细胞、动物细胞、植物细胞)、组织(例如动物组织、植物组织)等。本发明的培养基优选是用于细胞培养的培养基,即细胞培养基。本发明的培养基更优选是用于上皮细胞培养的培养基。本说明书中的上皮细胞可以为例如非角质上皮细胞,例如来源于腺体,包括乳腺、前列腺、肝和肠道上皮的非角质上皮细胞。非角质上皮细胞分化为具有吸收或分泌功能的活性细胞,非角质上皮细胞并不是高度角质化结构的鳞状上皮细胞。可用本发明的培养基培养的非角质上皮细胞可以来源于任何种类的组织器官。可以培养的非角质上皮细胞包括但不限定为如下类型:口腔的、鼻粘膜的,气管的、支气管的、肺上皮的、食管上皮的、胃粘膜上皮的、大肠上皮的、小肠上皮的、肝细胞的、胆管上皮的、胆囊的、胰腺(包括胰岛β细胞)、肾的、膀胱的、尿道上皮的、睾丸上皮的、卵巢上皮的、甲状腺的、甲状腺滤泡上皮细胞、肾上腺的、胸腺的、前列腺的、乳腺的、扁桃腺的,垂体的细胞、角膜上皮细胞、视网膜色素上皮细胞。此外,本发明的培养基可以是固体粉末状培养基,也可以是液体培养基,优选是液体培养基。当本发明的培养基是固体粉末状培养基时,优选在使用时将其调制成液体培养基来进行细胞培养,在调制过程中可以添加血清、钙成分和rock抑制剂等各种成分,使其满足本发明的要件。
本说明书中,当对象为细胞时,“培养”或“细胞培养”是指在体外进行人工维系,使细胞得以增殖。细胞培养通常在无菌条件下进行,可以是培养单个细胞或组织。
本发明的培养基中应该含有血清。作为血清,可以使用细胞培养中常用的血清,例如小牛血清或胎牛血清,优选胎牛血清。作为血清,还包括各种血清替代物,血清替代物包括但不限定于商品化购买的产品(例如invitrogen公司的knockouttm血清替代物,pallcorporation公司的ultrosertm),还包括牛奶及牛奶成分(例如过滤的脱脂牛奶干粉)。对于培养基中的血清的量没有特殊限制,可以与常规的细胞培养中添加至培养基中的血清的量相同,并且本领域技术人员可以根据需要进行适当调整。优选地,以体积比计(v/v%),培养基中血清含量的下限可以是1.0%、更优选2.0%、更优选3.0%、更优选4.0%、更优选4.5%、更优选5.0%;培养基中血清含量的上限可以是35%、更优选30%、更优选25%、更优选20%、更优选17%、更优选15%、更优选13%、更优选11%、更优选10%。
本说明书中,rock是指rho激酶1(rock1)和/或rho激酶2(rock2)。抑制rock是指降低rock1或rock2中的至少一种酶的活性、表达或功能。与未经处理的细胞相比,rock活性、表达或功能可以被完全抑制即达到无活性、无表达或无功能,也可以是活性、表达或功能水平降低。本说明书中,rock抑制剂是指:具有抑制rock的作用的物质。对于rock抑制剂,没有特殊限制,可以使用本领域公知的rock抑制剂,例如法舒地尔(fasudil),h-1152,y-27632,ha1100,ha1077和gsk429286等,这些都是商品化的常用试剂。此外,rock抑制剂还包括在pct申请(wo03/059913,wo03/064397,wo05/003101,wo04/112719,wo03/062225和wo03/062227)中公开的、或者在美国授权专利(7,217,722和7,199,147)和美国申请专利(2003/0220357,2006/0241127,2005/0182040和2005/0197328)中公开的小分子rock抑制剂。对于本发明的培养基中rock抑制剂的含量没有特殊限制,只要是有效量即可。所述有效量是指能够抑制rock的量,确定有效量的方法是本领域技术人员公知的,本领域技术人员可以根据所培养的细胞的种类、所使用的rock抑制剂的种类等条件适宜地确定有效量。例如,虽然可能因细胞的种类、rock抑制剂的种类、细胞培养条件等而异,但一般而言,rock抑制剂含量可以在0.1μm~1mm之间。
本发明的培养基中还可以包含饲养细胞。本说明书中,饲养细胞是指:与希望培养的细胞共同培养的细胞,其中,所述希望培养的细胞优选是非角质上皮细胞。饲养细胞一般是经过gamma射线照射和/或丝裂霉素处理的,其有丝分裂受到抑制,但仍可维持代谢活性。因此,饲养细胞是具有代谢能力但不能分裂的非增殖细胞。处理和阻断细胞有丝分裂并维持细胞代谢活性的方法可以是细胞生物学的常规方法。饲养细胞可以来源于任何哺乳动物,但其来源要与希望培养的细胞(优选非角质上皮细胞)来源的种属不同。饲养细胞可以是但不限定于以下来源,如小鼠、大鼠、狗、猫、牛、马、猪、灵长类以及人类的饲养细胞。典型的饲养细胞类型包括脾细胞、巨噬胸腺细胞和/或成纤维细胞,它们经处理后成为非增殖细胞。另外,本发明中也可以利用j2作为饲养细胞,j2细胞是建系的鼠成纤维细胞swiss3t3细胞系的亚克隆,经gamma射线照射和/或丝裂霉素处理。对于本发明的培养基中所包含的饲养细胞的量没有特殊限制,本领域技术人员可以根据需要适宜确定,通常饲养细胞与希望培养的上皮细胞的比例可以是1:9~9:1,优选2:8~8:2。
此外,本发明的培养基中可以包含条件培养基。本说明书中,条件培养基是指包含饲养细胞分泌物和/或提取物的培养基。典型的条件培养基是用培养基培养饲养细胞一段时间后,再除去饲养细胞而得到的培养基。此处,用于培养饲养细胞的培养基优选是包含血清、钙成分和rock抑制剂的培养基,例如本发明的培养基。对于培养饲养细胞的时间,没有特殊限制,本领域技术人员可以根据需要适宜确定,通常可以是1~300小时,优选5~200小时,更优选10~150小时,更优选10~150小时,更优选20~100小时,更优选24~72小时,更优选35~60小时,更优选40~50小时。一般而言,制备条件培养基例如包括将细胞培养于一种培养基中(如f培养基),几天后收集这些培养基。条件培养基可以是,用新鲜培养基按一定比例稀释后的条件培养基,也可以是不经稀释的收集后的条件培养基。新鲜培养基:条件培养基的稀释比例可以是1:99~99:1,依具体实验条件而定。本发明中所述的“条件培养基”包括经任何比例稀释或不稀释的条件培养基。优选地,本发明的培养基可以是含有血清、钙成分和rock抑制剂的未经稀释的条件培养基。
本发明的培养基可以使用用于细胞培养的常规培养基来制备。常规培养基是指本技术领域公知的用于细胞培养(优选用于上皮细胞培养)的培养基,包括但不限于:dmem(dulbecco’smodifiedessentialmedium),ham’sf12培养基,ham’sf-10培养基,rpmi1640,eagle’sbasalmedium(ebm),eagle’sminimumessentialmedium(mem),hepes,medium199以及相关类型培养基。常规培养基也可以是两种以上培养基的组合,例如dmem和f12的混合培养基。常规培养基的配方中一般不包含血清,因此,当使用常规培养基来制备本发明的培养基时,可以另行添加一定量的血清,使得培养基中的血清含量在上述限定的范围内。增加或减少培养基中的血清的操作是本技术领域的常规操作。
本发明的培养基中应该含有钙成分。此处所称的“钙成分”是指能够为本发明的培养基提供钙离子(ca2+)的成分,包括但不限于含钙的化合物。通常,钙成分来源于血清或血清替代物,或者来源于培养基中添加的含钙的盐类。所述钙成分例如可以以钙盐(例如氯化钙、硫酸钙)的形式添加至培养基中。钙成分的含量范围(以钙离子计)可以与用于细胞培养的常规培养基中的钙成分含量相同,并且本领域技术人员可以根据需要进行适当调整。例如,以ca2+计,钙成分含量的下限可以是0.1μm、优选10μm、更优选100μm、更优选200μm、更优选400μm、更优选500μm、更优选800μm、更优选1mm、更优选1.2mm、更优选1.3mm、更优选1.5mm;钙成分含量的上限可以是30mm、更优选25mm、更优选20mm、更优选15mm、更优选12mm、更优选10mm、更优选8mm、更优选7mm、更优选6mm、更优选5mm、更优选4mm、更优选3mm、更优选2.8mm、更优选2.5mm。
当使用常规培养基来制备本发明的培养基时,优选进行调整使得钙成分含量在上述限定的范围内。如果常规培养基的经典配方中包含钙且钙成分含量在上述限定的范围内,则就钙成分含量而言,该常规培养基无需进行调整;如果常规培养基的经典配方中包含钙但钙成分含量不在上述限定的范围内,则应该相应地增加或减少配方中的钙,使得培养基的钙成分含量在上述限定的范围内;如果常规培养基的经典配方中不包含钙,则应该在配方中增加钙,使得培养基的钙成分含量在上述限定的范围内。增加或减少培养基中的钙成分含量的操作是本技术领域的常规操作。
本发明的培养基中可以添加其它常规成分,包括但不限定于:氨基酸类、维生素类、无机盐类、腺嘌呤、乙醇胺(ethanolamine)、d-葡萄糖、肝素(heparin)、n-[2-羟乙基(hydroxyethylpiperazine)-n'-[2-乙磺酸(ethanesulfonicacid)](hepes)、皮质醇(hydrocortisone)、insulin(胰岛素)、表皮生长因子(egf)、肾上腺素(epinephrine)、硫辛酸(lipoicacid)、酚红、磷酸乙醇胺(phosphoethanolamine)、腐胺(putrescine)、霍乱毒素(choleratoxin)、丙酮酸钠(sodiumpyruvate)、三碘甲腺原氨酸(triiodothyronine,t3)、胸腺嘧啶和运铁蛋白(transferrin)。其中,肝素和运铁蛋白可以用柠檬酸铁(ferriccitrate)或螯合硫酸铁(ferroussulfatechelates)替代。上述添加成分均可以商品化购买。
本发明的培养基中的氨基酸类包括但不限定于:l-丙氨酸、l-精氨酸、l-天冬酰胺(l-asparagine)、l-天冬氨酸、l-半胱氨酸、l-谷氨酸、l-谷氨酰胺、甘氨酸、l-组氨酸、l-异亮氨酸、l-亮氨酸、l-赖氨酸、l-甲硫氨酸、l-苯丙氨酸、l-脯氨酸、l-丝氨酸、l-苏氨酸、l-色氨酸、l-酪氨酸和l-缬氨酸。
本发明的培养基中的维生素类包括但不限定于:生物素、氯化胆碱(cholinechloride)、d-ca+2-泛酸(pantothenate)、叶酸(folicacid)、i-肌醇(i-inositol)、烟酰胺(niacinamide)、多醇(pyridoxine)、核黄素(riboflavin)、维生素b1(thiamine)和维生素b12。
无机盐类成分包括但不限定于:钙盐(如cacl2)、cuso4、feso4、kcl、镁盐(如mgcl2)、锰盐(如mncl2)、醋酸钠、nacl、nahco3、na2hpo4、na2so4,以及痕量的其它元素如硒(selenium)、硅、钼(molybdenum)、钒(vanadium)、镍、锡、锌,这些痕量元素可以以多种形式出现,但最好是盐类的形式,如na2seo3,na2sio3,(nh4)6mo7o24,nh4vo3,niso4,sncl和znso4.
本发明的培养基的其它添加成分包括但不限定于:肝素、表皮生长因子(epidermalgrowthfactor,egf)、至少一种可以增加细胞内环腺苷一磷酸(cyclicadenosinemonophosphate,camp)水平的因子、至少一种成纤维细胞生长因子(fibroblastgrowthfactor,fgf)。上述添加成分可以直接加入到基础培养基中,也可以用dpbs(dulbecco'sphosphatebufferedsaline)缓冲液配制成混合液,冷冻保存直至配制培养基时再行添加。本发明的培养基中的肝素可以商业化购买。肝素的主要作用是稳定生长因子的活性,如fgf。肝素在基础培养基中的添加浓度为1-500u.s.p.units/l。egf也可以商业化购买,egf在基础培养基中的添加浓度为0.00001-10mg/l。
本发明的培养基中可以包含多种种类的能增加细胞内camp水平的因子,可以是直接增加camp水平的[如二丁酰(dibutyryl)camp],也可以是通过与细胞g蛋白相互作用导致细胞内camp水平升高[如霍乱毒素和毛喉素(forskolin)],或者作为β-肾上腺素受体(β-adrenergicreceptors)的拮抗剂(如异丙肾上腺素)增加细胞内camp水平、或者通过抑制camp磷酸二酯酶的活性而使细胞内camp水平增加[如isobutylmethylxanthine(ibmx)和茶碱(theophylline)]。上述这些化合物都可以商业化购买。
本发明的试剂盒
本发明的第二方面涉及一种试剂盒(本发明的试剂盒),其包含培养基、血清、钙成分和rock抑制剂。
本发明的试剂盒优选用于培养细胞。所述细胞优选是上皮细胞,更优选是非角质上皮细胞。
所述培养基可以是任何用于培养细胞的培养基,例如上述的常规培养基,优选可以是上述的条件培养基。所述血清、钙成分和rock抑制剂同上述。本发明的试剂盒可以用于配制上述本发明的培养基。本发明的试剂盒中,培养基、血清和rock抑制剂三者的比例优选满足将三者混合后能够形成上述本发明的培养基。
优选地,本发明的试剂盒还包含钙成分,此时,培养基、血清、钙成分和rock抑制剂四者的比例优选满足将四者混合后能够形成上述本发明的培养基。
优选地,本发明的试剂盒还包含饲养细胞。所述饲养细胞同上述。所述饲养细胞可以是常规贴壁的,常温下可存活3-5天;所述饲养细胞也可以是低温冻存的,低温冻存是指在-80℃以下长期储存,一般可以储存几天至几年。所述饲养细胞还可以是低温储存的,低温储存是指在4℃下储存,一般可以储存1~7天。
优选地,本发明的试剂盒还包含用于在进行细胞培养时单独盛放所述饲养细胞的容器,该容器具有可通透性膜结构。特别是,在本发明的试剂盒包含饲养细胞的情况下,优选其还包含所述容器。所述容器的作用是,在进行细胞培养时,将饲养细胞与需要培养的细胞隔离开来进行培养,并使得饲养细胞的分泌物通过上述可通透性膜结构进入到培养需要培养的细胞的培养基中。对于所述容器的形状、材质、规格等均无特殊限制,本领域技术人员可以根据需要适宜选择。例如,可以使用transwell筐(corning公司产品)。
优选地,本发明的试剂盒包含本发明的培养基和饲养细胞,更优选还包含所述容器。
本发明的试剂盒中还可以包含用于添加到培养基中的其它成分,包括但不限于在前述的“本发明的培养基”一节中描述的添加成分。
本发明的试剂盒中还可以包含用于细胞培养的其它成分或组件,例如指示剂、胰酶、培养瓶、培养皿、使用说明书等。
本发明的试剂盒中,优选所述各成分分开放置,更优选分别置于独立的容器中。
本发明的培养方法
本发明的第三方面涉及一种培养上皮细胞的方法(也称本发明的培养方法),该方法包括
步骤a:使用上述本发明的培养基将上皮细胞与饲养细胞共培养;或
步骤b:使用上述的包含饲养细胞或条件培养基的本发明的培养基培养上皮细胞(见图2)。
本发明的培养方法可以是上皮细胞传代培养方法,也可以是原代上皮细胞增殖培养方法。
这里,所述上皮细胞和饲养细胞均同前述。
步骤a中可以将上皮细胞与饲养细胞直接共培养,也可以将上皮细胞与饲养细胞间接共培养。所述直接共培养是指将上皮细胞与饲养细胞置于同一培养器皿中,进行培养(见图4);所述间接共培养是指将饲养细胞单独置于上述的具有可通透性膜结构的容器(例如transwell筐)中,然后,可以例如再将该装有饲养细胞的容器置于培养上皮细胞的培养基中,进行培养(见图3)。
本发明的培养方法中的其它步骤可以按照本技术领域的常规方法进行。
细胞的接种密度可以根据具体的实验条件进行适当调整。常规的一次性塑料培养器皿中,一般接种细胞数为1x104~10x105细胞/cm2,即75cm2培养瓶接种细胞数例如为1x106。每一次传代都要根据具体实验要求对细胞密度进行调整。
哺乳动物细胞通常培养于37℃、适当co2浓度(3~10%)、一定湿度的培养箱中,温度、co2浓度和湿度可以根据具体实验条件进行调整。培养基的ph的范围可以根据需要调整,通常为ph7.1~7.6,优选为ph7.1~7.3
细胞培养基通常1-2天更换一次,也可根据具体培养的细胞类型进行调整。只要细胞在培养器皿中生长至满丰度,就可以进行传代了。本说明书中,细胞传代是指将细胞分种一部分至新的培养器皿中。
实施例
以下,通过实施例对本发明进行更具体的说明,但本发明不受这些实施例的限制。此外,实施例中未经特别标注的试剂,均购自gibco公司。
实施例1swiss3t3细胞的培养传代
swiss3t3细胞从harvarduniversity的howardgreen教授实验室获得。所需试剂:
完全的dmem培养基:dmem(gibco#11965-092),10%胎牛血清(fbs),100u/ml青霉素(penicillin)和100μg/ml链霉素(streptomycin)
胰酶消化液:0.05%胰酶/edta(gibco#25300-062)
无钙镁磷酸缓冲液:ca2+,mg2+freepbs
传代培养操作步骤:
接种1x105swiss3t3细胞于t75细胞培养皿,加入10ml上述的完全dmem培养基,置于co2培养箱在5%co2,37℃培养2-5天。当细胞单层丰度为80-90%时,移去培养皿中的培养基,以10ml无钙镁磷酸缓冲液洗涤细胞单层2次,加入2ml胰酶消化液,在37℃孵育1分钟。轻拍培养皿以充分释放贴壁的细胞,以10ml完全的dmem培养基中和消化反应。4℃离心5分钟(1000转/分钟)沉淀细胞,移去上清,重悬细胞沉淀于10ml完全的dmem培养基中培养。根据需要可以1:10,1:20或1:50比例传代于新的t75(10-15ml完全的dmem培养基)或t175(25-30ml完全的dmem培养基)的培养皿中,根据需要每周更换新鲜完全的dmem培养基2-3次。必要时可将1x106细胞重悬于1-2ml的细胞冻存液(60%dmem,30%胎牛血清和10%dmso)中,储存于液氮中备用。
实施例2hl培养基
hl培养基1为dmem(gibco#11965-092)与ham’sf-12nutrientmix(gibco#11765-054)的混合培养基,体积配比为3:1,同时添加5%的胎牛血清,以及0.4μg/ml皮质醇(hydrocortisone),5μg/ml胰岛素(insulin),8.4ng/ml霍乱毒素(choleratoxin),10ng/ml表皮生长因子(epithelialgrowthfactor(egf)),24μg/ml腺嘌呤(adenine),100u/ml青霉素(penicillin)和100μg/ml链霉素(streptomycin),0.25μg/ml两性霉素b(fungizone,)30μm法舒地尔(fasudil)(或0.5μmh-1152或5μmy-27632,30μmha1100,10umgsk429286),上述培养基需经0.22μ孔径滤膜过滤。
hl培养基2为在dmem(lowglucose,noglutamine,gibco#11054-020)中添加10%的胎牛血清,以及0.4μg/ml皮质醇(hydrocortisone),5μg/ml胰岛素(insulin),8.4ng/ml霍乱毒素(choleratoxin),10ng/ml表皮生长因子(epithelialgrowthfactor(egf)),24μg/ml腺嘌呤(adenine),100u/ml青霉素(penicillin)和100μg/ml链霉素(streptomycin),0.25μg/ml两性霉素b(fungizone,)30μm法舒地尔(fasudil)(或0.5μmh-1152或5μmy-27632,30μmha1100,10μmgsk429286),上述培养基需经0.22μ孔径滤膜过滤。
hl培养基3为rpmi培养基1640(gibco#22400-121)含5mmhepes,添加8%的胎牛血清,以及0.4μg/ml皮质醇(hydrocortisone),5μg/ml胰岛素(insulin),8.4ng/ml霍乱毒素(choleratoxin),10ng/ml表皮生长因子(epithelialgrowthfactor(egf)),24μg/ml腺嘌呤(adenine),100u/ml青霉素(penicillin)和100μg/ml链霉素(streptomycin),0.25μg/ml两性霉素b(fungizone,)30μm法舒地尔(fasudil)(或0.5μmh-1152或5μmy-27632,30μmha1100,10μmgsk429286),上述培养基需经0.22μ孔径滤膜过滤。
hl培养基4为在l-15(leibovitz)培养基(l-glutamine,nohepes,gibco#11415064)中添加5%的胎牛血清,以及0.4μg/ml皮质醇(hydrocortisone),5μg/ml胰岛素(insulin),8.4ng/ml霍乱毒素(choleratoxin),10ng/ml表皮生长因子(epithelialgrowthfactor(egf)),24μg/ml腺嘌呤(adenine),100u/ml青霉素(penicillin)和100μg/ml链霉素(streptomycin),0.25μg/ml两性霉素b(fungizone,)30μm法舒地尔(fasudil)(或0.5μmh-1152或5μmy-27632,30μmha1100,10μmgsk429286),上述培养基需经0.22μ孔径滤膜过滤。
hl培养基5为在培养基199(withearle'ssaltsbutnol-glutamine,nosodiumbicarbonate,gibco#11825015)中添加10%的胎牛血清,以及0.4μg/ml皮质醇(hydrocortisone),5μg/ml胰岛素(insulin),8.4ng/ml霍乱毒素(choleratoxin),10ng/ml表皮生长因子(epithelialgrowthfactor(egf)),24μg/ml腺嘌呤(adenine),100u/ml青霉素(penicillin)和100μg/ml链霉素(streptomycin),0.25μg/ml两性霉素b(fungizone,)30μm法舒地尔(fasudil)(或0.5μmh-1152或5μmy-27632,30μmha1100,10μmgsk429286),上述培养基需经0.22μ孔径滤膜过滤。
hl培养基6为dmem(gibco#11965-092)与无血清培养基sfm(gibco#10744-019的混合培养基,体积配比为1:3,同时添加5%的胎牛血清,以及0.4μg/ml皮质醇(hydrocortisone),5μg/ml胰岛素(insulin),8.4ng/ml霍乱毒素(choleratoxin),10ng/ml表皮生长因子(epithelialgrowthfactor(egf)),24μg/ml腺嘌呤(adenine),100u/ml青霉素(penicillin)和100μg/ml链霉素(streptomycin),0.25μg/ml两性霉素b(fungizone,)30μm法舒地尔(fasudil)(或0.5μmh-1152或5μmy-27632,30μmha1100,10μmgsk429286),上述培养基需经0.22μ孔径滤膜过滤。
实施例3饲养细胞(失去分裂能力的swiss3t3细胞)的制备(丝裂酶素c处理swiss3t3细胞)
1)作为饲养细胞的swiss3t3细胞,宜采用传代培养早期的细胞。当swiss3t3细胞生长至满丰度时,培养基中加入终浓度为10μg/ml的丝裂酶素c(溶于水,储存液浓度为0.5mg/ml),37℃处理2小时;
2)再加入温浴的1xpbs或无血清的培养基(dmem)洗3次,弃洗液;
3)加入0.05%胰酶/edta预消化细胞30-40秒后弃去,再次加入0.05%胰酶/edta消化30秒,轻拍培养皿使细胞分散,然后加入完全培养基(含10%胎牛血清的dmem)中和反应;
4)低速离心(1000rpm)去上清,获得细胞沉淀;
5)沉淀下来的细胞可以直接用作饲养细胞,或者贮存备用;
a)直接用作饲养细胞的情况,操作步骤如下:
-加入温浴的1xpbs洗细胞沉淀1次,再次离心
-将细胞悬于hl培养基中
-以适当的比例(如1:3)将饲养细胞与一定数量的上皮细胞混悬于hl培养基中,上皮细胞最适接种浓度为2.5x105个/100mm的培养皿;
b)饲养细胞是第二天备用的情况,操作步骤如下:
-加入温浴的1xpbs洗细胞沉淀1次,再次离心
-将细胞悬于完全dmem培养基(含10%胎牛血清的dmem)
-以1:3的比例接种于培养皿中,培养过夜
-第二天用温浴的1xpbs洗细胞2次,换成hl培养基
-再将上皮细胞接种于含饲养细胞的培养皿中,上皮细胞最适接种浓度为2.5x105个/100mm的培养皿;
c)饲养细胞是贮存备用的情况,操作步骤如下:
-加入温浴的1xpbs洗细胞沉淀1次
-将饲养细胞重悬于6ml的冻存液(90%胎牛血清和10%dmso)中,分于3支冻存管中
-冻存于液氮或–150℃条件下
-临用时取1支复苏,加入完全dmem培养基(含10%胎牛血清的dmem)接种于100mm培养皿
备注:被用作饲养细胞的3t3细胞经丝裂酶素c处理后,需在3-5天内使用或者低温冻存备用。
实施例4.饲养细胞(失去分裂能力的swiss3t3细胞)的制备(放射线处理swiss3t3细胞)
作为饲养细胞的swiss3t3细胞,宜采用传代培养早期的细胞,这些细胞培养于dmem培养基中,生长至近满丰度,用不含ca2+/mg2+的1xpbs洗细胞1次,加入1ml0.05%胰酶消化细胞20-40秒,然后加入9ml完全dmem培养基(含10%胎牛血清的dmem)中和消化反应,于4℃低速离心1000rmp收集细胞沉淀,加入10mldmem重悬细胞,放射线照射细胞悬液,即cesium-137射线仪(jlshepherdmark)处理3000rad(30grey)。这些经放射线处理的swiss3t3细胞,接种于hl培养基中直接用作饲养细胞;或者培养于完全dmem培养基或置于4℃储存并于1-7天之内使用;或者长期冻存于-80℃或液氮中备用。
实施例5.新鲜组织中分离培养原代上皮细胞
在病人或病人监护人知情同意的情况下,收集人的正常或肿瘤组织样品。
具体操作步骤如下:
1.消化液的配制:含胶原酶/透明质酸酶(终浓度为1x的混合液)的hl培养基(即dmem:f12体积比3:1的混合培养基),添加5%fbs。根据新鲜组织的大小决定消化液的用量,通常需要10倍于样品体积的消化液的用量,例如2-3个小鼠前列腺需2-5ml消化液;
2.用95-100%的乙醇洗分离的新鲜组织1次,再用pbs洗2次,然后将组织放入含预冷pbs的无菌培养皿中,在解剖显微镜下,用解剖镊子和剪刀去除组织中残留的脂肪。
3.将组织样品放入含上述消化液的14ml或50ml离心管中,37℃消化1-3小时。
4.将消化后的组织低速离心(1000rpm)5分钟,去除上清。
5.将细胞沉淀重悬于2-5ml的0.25%胰酶/edta中,置于冰上1小时或室温10分钟。
6.然后加入10ml含10%fbs的dmem培养基,低速1000rmp离心5分钟。
7.尽量将上清去除干净。
8.加入2ml温浴的5mg/ml分散酶和200μl的1mg/mldnasei,用无菌的p1000一次性塑料枪头反复吹打样品1分钟。
9.加入10ml含10%fbs的dmem,用40-70μm孔径的过滤器过滤细胞悬液,收集过滤后的细胞悬液,低速1000rmp离心5分钟,去除上清。
10.重悬细胞沉淀于hl培养基中,接种于t25或t75的培养瓶中按本发明的任一方案(见图1-4)培养。
实施例6.饲养细胞/上皮细胞的直接共培养(见图4和图6)
上述丝裂酶素c处理或放射线照射的饲养细胞(失去分裂能力的swiss3t3细胞)作为饲养层与上皮细胞的共培养按以下三种方式进行:
1.直接饲养细胞/上皮细胞共培养。加入温浴的1xpbs洗饲养细胞沉淀1次,再次离心,将细胞悬于hl培养基中,以1:3比例将饲养细胞与一定数量的上皮细胞混悬于hl培养基中,上皮细胞最适接种浓度为2.5x105个/100mm的培养皿,将培养瓶置于37℃,5%co2条件下培养。
2.饲养细胞先行贴壁,再加入上皮细胞共培养。将上述丝裂酶素c处理或放射线照射的饲养细胞悬于完全dmem培养基(含10%胎牛血清的dmem),以1:3的比例接种于培养皿中,37℃培养2-3小时或过夜,用温浴的1xpbs洗细胞2次,换成hl培养基,再将上皮细胞接种于含饲养细胞的培养皿中,上皮细胞最适接种浓度为2.5x105个/100mm的培养皿,贴壁的饲养细胞可于3-5天任何时间内使用。将培养瓶置于37℃,5%co2条件下培养。
3.饲养细胞在4℃或液氮贮存备用。将上述丝裂酶素c处理或放射线照射的饲养细胞悬于完全dmem培养基(含10%胎牛血清的dmem)存于4℃(1-7天)或长期储存于液氮,复苏后按上述方法2进行与上皮细胞的共培养(hl培养基中)。上皮细胞最适接种浓度为2.5x105个/100mm的培养皿。将培养瓶置于37℃,5%co2条件下培养。
不论以上述哪种方式的共培养,第二天应更换新鲜的hl培养基。当多于50%的饲养细胞脱落时,应补充新鲜的上述丝裂酶素c处理或放射线照射的饲养细胞,直到上皮细胞生长至70-90%丰度需要传代时。
实施例7.饲养细胞/上皮细胞的分离传代
1.上皮细胞生长至70-90%丰度,吸出培养基,用温浴的pbs洗1次,
2.吸出pbs,加入10-12ml温浴的含0.02%edta(0.68mm)的pbs洗涤细胞,以去除饲养细胞swiss3t3;特别注意,洗涤细胞需尽量快速,先将edta溶液加到培养皿外周的细胞,旋转摇动培养皿,然后再使edta溶液回旋至培养皿内周的细胞,重复回旋洗涤细胞10次。
3.吸出edta洗液,再次加入0.02%edta至培养皿内侧的细胞,旋转摇动培养皿,然后使edta溶液回旋至培养皿外侧的细胞,重复回旋洗涤细胞30次。通常人的角质上皮细胞需要40次edta洗涤,其它细胞根据贴壁紧密程度不同,可适当调整洗涤次数。
4.吸出edta洗液,加入温浴的pbs洗3次,始终保持培养皿倾斜。最后一次洗涤液吸出之前,在显微镜下观察,确认所有饲养细胞swiss3t3已经被完全洗掉,否则,需再次增加edta洗涤次数。
5.采用常规胰酶方法消化上皮细胞,对于角质上皮细胞而言,胰酶常温消化2分钟,吸出消化液,再次于37℃胰酶消化5分钟,轻拍培养皿使细胞分散,重悬细胞于hl培养基中。然后接种上皮细胞于丝裂霉素c或放射线处理过的饲养细胞上,最适细胞接种密度为2.5x105个/100mm的培养皿;
7.必要时可将1x106上皮细胞重悬于1-2ml的细胞冻存液(90%胎牛血清和10%dmso)中,储存于液氮中备用。
实施例8.饲养细胞条件培养基的制备和上皮细胞的培养传代(见图2和图6)
按照图2,将上述丝裂酶素c处理或放射线照射的饲养细胞培养于hl培养基中(t75培养瓶:2x106细胞,15mlhl培养基;t175:5x106细胞,35mlhl培养基)在37℃、5%co2的培养箱中培养48小时。收集培养基,2000rpm离心15分钟,经0.22μ滤膜过滤,按1:5比例(可按1:99-99:1优化)与新鲜配制的hl培养基混合即得到hl条件培养基。将分离制备的原代细胞悬液或者传代细胞直接于hl条件培养基中进行培养,培养条件是37℃、5%co2。当细胞增殖至70-90%丰度时,1xpbs洗涤细胞两次,0.05%胰酶/edta消化单层细胞2-5分钟,10ml完全的dmem中和消化反应,1000rmp离心5分钟,去上清,以一定比例(1:2,1:3,1:4,1:5均可,只要可以维持细胞贴壁和正常生长)重悬细胞沉淀于10mlhl条件培养基中接种培养。必要时可将1x106上皮细胞重悬于1-2ml的细胞冻存液(90%胎牛血清和10%dmso)中,储存于液氮中备用。
实施例9.上皮细胞/饲养细胞间接共培养(transwell培养系统)及传代(见图3和图6)
按照图3,将上述丝裂酶素c处理或放射线照射的饲养细胞置于transwell筐(transwellinsert,corning公司)中,分离制备的原代细胞悬液或者传代细胞可直接于hl培养基中进行培养,培养条件是37℃、5%co2。当细胞增殖至70-90%丰度时,先移去transwell筐,1xpbs洗涤上皮细胞两次,0.05%胰酶/edta消化单层细胞2-5分钟,10ml完全的dmem中和消化反应,1000rpm离心5分钟,去上清,以一定比例(1:2,1:3,1:4,1:5均可,只要可以维持细胞贴壁和正常生长)重悬细胞沉淀于10mlhl培养基中接种培养。必要时可将1x106上皮细胞重悬于1-2ml的细胞冻存液(90%胎牛血清和10%dmso)中,储存于液氮中备用。
实施例10.含血清培养基和无血清培养基用于上皮细胞的培养(见图5)
完全的dmem培养基:dmem,10%胎牛血清(fbs),100u/ml青霉素(penicillin)和100μg/ml链霉素(streptomycin)
无血清培养基:无血清的上皮细胞培养基sfm(gibco#10744-019),庆大霉素(10μg/ml)
胰酶消化液:0.05%胰酶/edta
无钙镁磷酸缓冲液:ca2+,mg2+freepbs
分离制备的原代细胞悬液或者传代细胞直接于上述完全dmem培养基或无血清培养基中进行培养,培养条件是37℃、5%co2。当细胞增殖至70-90%丰度时,1xpbs洗涤细胞两次,0.05%胰酶/edta消化单层细胞2-5分钟,10ml完全的dmem培养基中和消化反应,1000rmp离心5分钟,去上清,以一定比例(通常是1:2或1:3)重悬细胞沉淀于10ml完全dmem或无血清培养基中培养。必要时可将1x106细胞重悬于1-2ml的细胞冻存液(90%胎牛血清和10%dmso)中,储存于液氮中备用。
还需要说明的是,在可实施且不明显违背本发明的主旨的前提下,在本说明书中作为某一技术方案的构成部分所描述的任一技术特征或技术特征的组合同样也可以适用于其它技术方案;并且,在可实施且不明显违背本发明的主旨的前提下,作为不同技术方案的构成部分所描述的技术特征之间也可以以任意方式进行组合,来构成其它技术方案。本发明也包含在上述情况下通过组合而得到的技术方案,并且这些技术方案相当于记载在本说明书中。
以上通过具体实施方式和实施例对本发明进行了说明,但本领域技术人员应该理解的是,这些并非意图对本发明的范围进行限定,本发明的范围应由权利要求书确定。
工业实用性
本发明的培养基、细胞培养用试剂盒、上皮细胞培养方法以及通过该方法获得的上皮细胞可以广泛应用于基础细胞生物学研究、肿瘤研究、衰老研究、新药研发、基因治疗、体外转基因和基因敲除研究、组织再生、临床再生医学、临床个性化治疗、分子及遗传流行病学研究等各个领域。
- 还没有人留言评论。精彩留言会获得点赞!