细胞培养基和方法与流程
技术领域
本文提供了与新类型的细胞培养基、进料和补充物有关的组合物、方法和用途。所述培养基、进料和补充物具有几种期望的性能,所述性能包括、但不限于:具有超过它们的正常溶解度限度的某些组分、增加的辐射耐受性、延长的释放性能、高溶解度、增加的贮存期限和热稳定性。在某些实施方案中,这样的特征将改善用户工作流和生物反应器生产力。
附图说明
下文描述的且并入本说明书中和构成本说明书的一部分的以下附图解释了示例性实施方案,它们不应当视为限制本公开内容的范围。
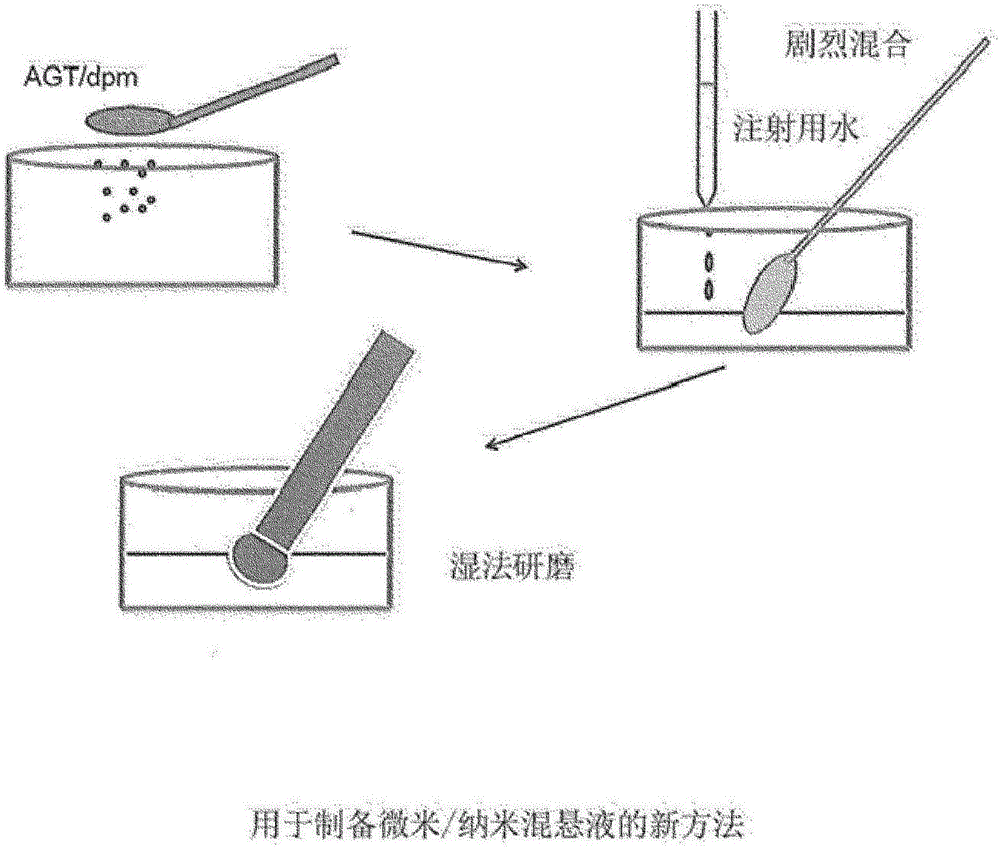
图1显示了为制备细胞培养基、进料和/或补充物组分的微米/纳米混悬液而开发的新方法。
图2显示了微米混悬液和液体进料的细胞生长、蛋白生产和递送的性能对比。微米混悬液在试验的条件下的性能与液体进料相当,并表现出比液体进料更高的递送效力。
图3是包囊的微米混悬液珠子的示意图,所述珠子被另外包被以延长释放。
图4显示了PLGA包衣对延迟组分从微囊化的微米混悬液制品内的释放的影响。a)上图:无包衣;b)下图:使用PLGA A和PLGA B的包衣的对比。A和B具有不同的丙交酯:乙交酯比率。具有85:15比率的PLGA B表现出良好的延长释放性能,并维持它的形状,具有在溶液中释放组分>15天的能力。
图5显示了辐照对本公开内容的制品的影响。用以下物质培养的细胞中的蛋白生产效率的对比:i)辐照的微米混悬液;ii)干燥的、包囊的微米混悬液,其与iii)中的那些类似;iii)未辐照的对照液体进料,其通过过滤来灭菌。
图6表明,当在辐照的试验进料中培养细胞时,大约30kGy的辐照不会负面地影响(a)细胞生长(上图);或者,(b)蛋白生产(下图)。还试验了另外的补充物68和86,并且表现出类似的结果(数据未显示)。
图7表明,γ辐照对微米混悬液和对干燥的、包囊的微米混悬液存在可忽略的影响。该图显示了与未辐照的液体对照相比,在微胶囊(“珠子”)中或作为微米混悬液(MS),30kGy的γ如何影响包囊的化合物(参见最右侧)。NG=没有γ辐照,和G=γ-辐照。
图8显示了包含不稳定组分的微囊化珠子的示意图,所述不稳定组分被包埋和/或包裹在抗氧化剂中以通过减少在辐照过程中产生的氧化物质的影响来保护不稳定的分子。
图9显示了反应性物质的螯合作用以及痕量元素中的金属离子与氨基酸的示例性配位络合物的形成。
图10显示了制备微米混悬液和包囊的微米混悬液的方法的示意图。
图11显示了辐照的、微囊化的珠子向生物反应器中的直接添加的2种选择。左图显示了在可高压灭菌的多孔金属过滤器内添加的珠子;或者,右图表明,可以将珠子直接加入培养物中。
图12:在以下情况下,使用多孔金属过滤器装置引入培养物中的补充物的延长释放的对比:(a)具有PLGA包衣的微米混悬液珠子:上图,和(b)没有珠子,仅AGT进料。
发明概述
在本公开内容中描述的培养基、进料和补充物组合物具有几种期望的性能,所述性能包括、但不限于:(i)以“超浓缩”水平递送某些组分的能力,所述“超浓缩”水平远远超过它们在培养系统中的正常溶解度限度,(ii)即使在辐射灭菌以后,增加的维持培养基/进料功能性的能力,(iii)增加的延长释放内部组分的能力,(iv)高溶解度且快速的溶解,(v)干燥形式下的较长的贮存期限,(vi)增加的热稳定性,(vii)多达8个log的减小的病毒污染风险,(viii)与其它灭菌技术(诸如UV、过滤和/或HTST巴氏消毒)相组合的能力,(ix)应用于多种培养基形式(诸如AGT、DPM、APM)以及具有较高浓度的不稳定组分的制剂的能力,(x)应用于多种产品类型(诸如培养基、进料、补充物、功能性添加剂等)的能力。由于这些特征,所述组合物可以直接加入生物反应器中或加入已经在进行中的培养物中,并由此可以改善用户工作流和生物反应器生产力。
因此,在本公开内容中描述的组合物、方法和用途部分地涉及包含微米混悬液的细胞培养基、浓缩进料、功能性添加剂、补充物;还可以涉及包含一种或多种包囊的微米和/或纳米混悬液的新细胞培养基、进料和/或补充物组合物;还可以涉及使用辐射将以上组合物灭菌,使得所述培养基/进料的功能性即使在暴露于辐射以后也得到维持。本公开内容也提供了制备这样的培养基的方法,包括此类培养基的特征及其用途。贯穿本公开内容,有时可能仅提及细胞培养基,但是它在适用的情况下也包括进料和/或补充物。
在一个实施方案中,本公开内容涉及一种制备培养基、进料或补充物组合物的方法,所述方法包括:将最小体积的水溶液加入到培养基、进料或补充物的干粉中以制备糊状物;和剧烈混合所述糊状物以制备微米混悬液。
在另一个实施方案中,本公开内容涉及一种制备包含不稳定组分的组合物的方法,所述方法任选地包括:将有效量的抗氧化剂与所述不稳定组分的微米混悬液混合以形成混合物;将所述微米混悬液或步骤2中的混合物包囊在合适的囊材料中,使得形成微胶囊或珠子;和干燥所述微胶囊或珠子。在一个实施方案中,所述不稳定物质附着于树枝状聚合物。在这些实施方案的任一个中,所述囊材料可以选自,例如,海藻酸盐、聚-L-乳酸、壳聚糖、琼脂糖、明胶、透明质酸、硫酸软骨素、葡聚糖、硫酸葡聚糖、肝素、硫酸肝素、硫酸类肝素、结冷胶、黄原胶、瓜尔胶、水溶性的纤维素衍生物和角叉菜胶。
在所述方法的另一个实施方案中,用延长所述不稳定组分从珠子的释放的材料进一步包被珠子。在另一个方面,所述包衣选自,例如,聚乙醇酸、PLGA(聚乳酸-共-乙醇酸)、胶原、聚羟基烷酸酯(PHA)、聚-ε-己内酯、聚原酸酯、聚酸酐、聚膦腈、聚氨基酸、聚二甲基硅氧烷、聚氨基甲酸酯、聚四氟乙烯、聚乙烯、聚砜、聚甲基丙烯酸甲酯、聚甲基丙烯酸-2-羟基乙酯、聚酰胺、聚丙烯、聚氯乙烯、聚苯乙烯和聚乙烯吡咯烷酮。
在一个实施方案中,辐照所述珠子,且在另一个实施方案中,用γ-射线辐照所述珠子。在某些实施方案中,另外用紫外射线辐照所述珠子,此后,所述珠子可以不具有PPV和MMV病毒。
在几个实施方案中,所述培养基是干燥形式培养基,且要保护的不稳定组分选自:多胺、生长因子、细胞因子和维生素。
在某些实施方案中,所述囊材料在用水性溶剂重构后是可溶的。在其它实施方案中,所述包囊基质包裹树枝状聚合物-不稳定组分复合物。在某些实施方案中,所述树枝状聚合物是聚酰胺胺树枝状聚合物、聚丙烯亚胺树枝状聚合物或聚丙胺(POPAM)树枝状聚合物。
在以上实施方案中的任一个中,描述的方法可以例如实现关于培养基、进料、补充物或功能性添加剂的以下一项或多项:1)使它们更耐受辐照(例如,基于效力或功能性的保留而测量的);2)增加在环境温度下的稳定性;3)允许一些组分的延长释放;4)增加在环境温度下的运输稳定性;5)增加对温度波动的稳定性。
在以上方法中使用的组合物可以包含粉末状细胞培养基,所述粉末状细胞培养基还包含不稳定的化合物,和/或至少一种浓缩的组分。
本公开内容也涉及下述组合物:包含培养基/进料组分的微米混悬液的培养基、进料或补充物组合物。在一个实施方案中,所述培养基、进料或补充物组合物包含不稳定组分和抗氧化剂的混合物,所述混合物被微囊化在囊基质内成为珠子。在另一个实施方案中,所述囊材料选自,例如,海藻酸盐、聚-L-乳酸、壳聚糖、琼脂糖、明胶、透明质酸、硫酸软骨素、葡聚糖、硫酸葡聚糖、肝素、硫酸肝素、硫酸类肝素、结冷胶、黄原胶、瓜尔胶、水溶性的纤维素衍生物和角叉菜胶。在另一个实施方案中,用包衣溶液包被所述珠子。在另一个实施方案中,所述包衣溶液选自:聚乙醇酸、PLGA(聚乳酸-共-乙醇酸)、胶原、聚羟基烷酸酯(PHA)、聚-ε-己内酯、聚原酸酯、聚酸酐、聚膦腈、聚氨基酸、聚二甲基硅氧烷、聚氨基甲酸酯、聚四氟乙烯、聚乙烯、聚砜、聚甲基丙烯酸甲酯、聚甲基丙烯酸-2-羟基乙酯、聚酰胺、聚丙烯、聚氯乙烯、聚苯乙烯、聚乙烯吡咯烷酮、聚-L-赖氨酸和聚鸟氨酸。
在另一个实施方案中,所述组合物还包含螯合的反应性物质。在该实施方案的另一个方面,所述反应性物质是阳离子、金属离子或痕量元素。在另一个方面,所述螯合部分选自EDTA、柠檬酸盐、琥珀酸盐、环糊精、笼形化合物、树枝状聚合物和氨基酸。
在上述组合物中的任一种中,可以辐照所述组合物。在另一个方面,可以用γ-射线进行辐照;在一个具体的方面,所述γ-射线可以是约25-100kGy。在一个优选的方面,使用30-50kGy的γ-射线。在一个具体实施方案中,所述γ-射线是30kGy。本领域技术人员能够确定这样的辐照水平:其使目的(例如活病毒的减少或其它灭菌)最大化,同时使对例如培养基的功能性或培养基的特定组分的功能性的影响最小化(例如,通过对辐照或采用的任意灭菌技术特别敏感的组分而测量的)。
在本发明的一个方面,本文所述的方法可以与另外的步骤组合,所述另外的步骤的目的是测量所述培养基或组合物在灭菌以后(或在任意最终的加工或完工步骤以后)的功能参数。例如,在辐照以后,可以对样品进行用于测量辐照对特定组分或组分集合的影响的功能测定。该步骤可以用于证实,例如,所述组合物适当地不含有病毒,并且所述培养基的组分保持在对于预期用途而言令人满意的条件下。
在一个实施方案中,将上述的培养基、进料或补充物微米混悬液和/或包囊的微米混悬液组合物中的任一种无菌地直接加入到生物反应器中。在另一个实施方案中,将上述的培养基、进料或补充物微米混悬液和/或包囊的微米混悬液组合物中的任一种置于生物反应器内的、可高压灭菌的多孔金属圆筒中。
上述的培养基、进料或补充物中的任一种可以是无血清的、无蛋白的、或无血清和蛋白的。上述的培养基、进料或补充物中的任一种可以专门设计用于悬浮细胞培养、用于哺乳动物细胞培养、用于昆虫细胞培养、用于杂交瘤细胞培养、用于干细胞培养、用于诱导的多能细胞培养、用于多能细胞培养、用于组织外植体和/或器官培养、用于在人工细胞基质上的三维细胞培养、以及本领域技术人员可以应用本公开内容中的教导的其它细胞和组织培养应用。
上述的培养基、进料或补充物中的任一种可以包含粉末状细胞培养基,且在一个优选的实施方案中,所述粉末状细胞培养基是AGT(高级造粒技术细胞培养基)。
上述的培养基、进料或补充物中的任一种可以用于生产干燥形式细胞培养基。
上述的培养基、进料或补充物中的任一种可以增加细胞培养基的贮存期限。
上述的培养基、进料或补充物中的任一种可以用于生产重组蛋白,用于生产疫苗,用于生产细胞(包括干细胞),用于生产生物燃料,或用于生产营养物。
上述的培养基、进料或补充物中的任一种可以在环境温度下储存和操作,可以耐受温度波动,可以耐受HTST和/或UHT巴氏消毒,可以耐受对灭菌辐射波长(诸如γ、紫外线和本领域已知的其它波长)的暴露。
发明详述
现在将详细参考不同的示例性实施方案。应当理解,提供下述详细描述以给读者提供本公开内容的一些方面的某些实施方案、特征和细节的更完整理解,并且所述详细描述不应解释为对本公开内容的范围的限制。
定义
为了可以更容易地理解本公开内容,首先定义某些术语。其它定义在详细描述中进行了阐述。
本申请中使用的术语“高级造粒技术”或AGT表示一种制备细胞培养基的方法,所述方法包括:将一种或多种水溶液喷洒在空气悬浮的粉末状培养基组分上,在敏感组分不会损失其效力的条件下温和地快速蒸发水,从而产生附聚的颗粒和喷洒的成分在附聚的颗粒中的同质分布。在以下文献中讨论了造粒的粉末(AGT):Fike等人,Cytotechnology,2006,36:33-39,和申请人的专利和/或专利申请:2002年5月7日授权的美国专利号6,383,810;2009年8月11日授权的美国专利号7,572,632;和2007年1月31日提交的美国专利申请号11/669,827,它们的公开内容特此通过引用整体并入。简而言之,AGT培养基是干燥的粉末状培养基,其由于诸如以下性能而在工业中是非常期望的:大颗粒尺寸、在处理时减小的细粉尘量、高可润湿能力、在溶剂中的低溶解时间、自动pH和自动渗透压维持等.
另一种类型的干粉形式是作为“高级粉末培养基”的APM粉末,其具有不像DPM粉末一样细、且不像AGT颗粒一样大的颗粒尺寸的有利性能。
本申请中使用的术语“敏感的化合物”或“敏感化合物”或“不稳定化合物”表示,要被保护免于降解或与存在于干燥形式培养基中的“反应性物质”反应的物质、化学试剂或化合物。在细胞培养基中的这样的化合物的例子包括、但不限于:乙醇胺、维生素、细胞因子、生长因子、激素等。
术语“包囊剂”在本申请中有时可以被称作“掩蔽剂”,且表示将细胞培养基或进料中的敏感的化学物质或组分包囊、保护、分离或隔离,远离增强降解的条件或与其它反应性化学物质诸如氨基酸、痕量金属元素(诸如锰、铜等)、无机缓冲剂(诸如碳酸氢钠和其它磷酸钠)和有机缓冲剂(诸如MOPS、HEPES、PIPES等)(它们可以与敏感化合物缓慢地反应,由此使得不稳定组分随时间过去丧失其期望的性能)的反应性。可替代地,可以进行包囊、保护、分离或隔离,以保护敏感的化学试剂或组分免于物理损伤(例如,辐射损伤或热损伤)或物理应激,免于暴露于水分/凝结,或免于脱水等。术语“保护”或“分离”或“隔离”或“包囊”在本公开内容中可以互换使用,并表达保护敏感的化学试剂或化合物免于降解条件或化学物质的概念。“可溶的掩蔽剂”本身在用水性介质重构以后可以是可溶的,由此它释放出“敏感的”被包囊的材料。或者,“不溶性的掩蔽剂”在用水性介质重构以后可以是不溶性的,由此在释放出“敏感的”被包囊的材料以后,它可以通过诸如过滤、倾析等方式从重构的终产物中回收。
可以用于微囊化的基质的例子包括、但不限于:海藻酸盐、聚-L-乳酸(PLL)、壳聚糖、琼脂糖、明胶、透明质酸、硫酸软骨素、葡聚糖、硫酸葡聚糖、肝素、硫酸肝素、硫酸类肝素、结冷胶、黄原胶、瓜尔胶、水溶性的纤维素衍生物、角叉菜胶诸如此类。
任选地,由于以下几个原因之一,可以包被微胶囊:延长和缓慢地释放微胶囊组分;保护不稳定组分免于任何类型的损伤,即辐射、热、脱水等。包衣可以包括、但不限于:聚乙醇酸、PLGA(聚乳酸-共-乙醇酸)、胶原、聚羟基烷酸酯(PHA)、聚-ε-己内酯、聚原酸酯、聚酸酐、聚膦腈、聚氨基酸、聚二甲基硅氧烷、聚氨基甲酸酯、聚四氟乙烯、聚乙烯、聚砜、聚甲基丙烯酸甲酯、聚甲基丙烯酸-2-羟基乙酯、聚酰胺、聚丙烯、聚氯乙烯、聚苯乙烯、聚乙烯吡咯烷酮等。
不稳定的培养基或进料组分包括、但不限于:化合物诸如维生素,例如,硫胺素、B12;氨基酸如谷氨酰胺;多胺如乙醇胺;细胞因子;生长因子,等。
用于将培养基内的反应性分子螯合、灭活或封闭的试剂包括、但不限于:化合物诸如EDTA、柠檬酸盐、琥珀酸盐、环糊精、笼形化合物、树枝状聚合物、氨基酸等。
所述细胞培养基优选地是粉末状细胞培养基。在一个实施方案中,所述粉末状细胞培养基是高级造粒技术(AGT)细胞培养基。所述细胞培养基也表示进料、浓缩的补充物、浓缩的培养基,和在某些情况下,液体培养基(如果适用的话)。
本申请中使用的术语“细胞培养”或“培养”表示,将细胞维持在人工(例如,体外)环境中。但是,应当理解,术语“细胞培养”是通用词,且可以用于不仅包括单一原核(例如,细菌)或真核(例如,动物、植物和真菌)细胞的培养,而且包括组织、器官、器官系统或整个生物体的培养,对于此,术语“组织培养”、“器官培养”、“器官系统培养”或“器官型培养”有时可以与术语“细胞培养”互换使用。
在本申请中使用的术语“培养”表示,在有利于细胞的生长、分化或连续生存力(处于活跃或休眠状态)的条件下,将细胞维持在人工环境中。因而,“培养”可以与“细胞培养”或上述的它的同义词中的任一个互换使用。
在本申请中使用的术语“细胞培养基”、“培养介质”或“培养基”(和在每种情况下的复数形式)表示支持细胞的培养和/或生长的有营养的组合物。所述细胞培养基可以是完全制剂(即,无需补充即可培养细胞的细胞培养基),可以是不完全制剂(即,需要补充的细胞培养基),或可以是可补充不完全制剂的培养基,或者在完全制剂的情况下,可以改善培养或培养结果。除非上下文中另外指出,否则术语“细胞培养基”、“培养介质”或“培养基”(和在每种情况下的复数形式)表示尚未与细胞一起温育的未调节的细胞培养基。这样,术语“细胞培养基”、“培养介质”或“培养基”(和在每种情况下的复数形式)区别于“用完的”或“经调节的”培养基,后者可以含有培养基的许多原始组分、以及多种细胞代谢物和分泌的蛋白。
在本申请中使用的术语“粉末”或“粉末状”表示以颗粒形式存在的组合物,其可以与或未与溶剂(诸如水或血清)形成复合物或附聚物。术语“干粉”可以与术语“粉末”互换使用;但是,本文中使用的“干粉”仅表示造粒材料的总外观,无意表示所述材料完全不含有复合的或附聚的溶剂,除非另外指出。
“1X制剂”表示,含有在细胞培养基中发现的一些或所有处于工作浓度的成分的任意水溶液。“1X制剂”可以表示,例如,细胞培养基或该培养基的任意成分亚组。1X溶液中的成分的浓度与在用于体外维持或培养细胞的细胞培养制剂中发现的成分的浓度大约相同。用于体外培养细胞的细胞培养基被定义为1X制剂。当存在许多成分时,1X制剂中的每种成分的浓度大约等于细胞培养基中的那些成分的浓度。这些氨基酸的“1X制剂”大约含有相同浓度的溶液中的这些成分。因而,当提及“1X制剂”时,其意指溶液中的每种成分具有与在描述的细胞培养基中发现的相同或大约相同的浓度。细胞培养基的1X制剂中的成分的浓度是本领域普通技术人员众所周知的。参见Cell Culture Technology for Pharmaceutical and Cell-Based Therapies,42-50(Sadettin Ozturk和Wei-Shou Hu编,Taylor and Francis Group 2006),其通过引用整体并入本文。但是,1X制剂中的渗透压和/或pH可以不同于培养基,特别是当1X制剂中含有更少的成分时。
本公开内容涉及微米混悬液和干燥的微胶囊珠子,其中在微米/纳米混悬液中浓缩相同成分的浓度,并且以干燥的包囊的珠子形式甚至进一步浓缩。因此,“7X制剂”意在表示这样的浓度:其中在该微米/纳米混悬液或包囊的珠子中的每种成分比对应的液体细胞培养基/进料或补充物中的相同成分浓缩了约7倍。“10X制剂”意在表示这样的浓度:其中在该微米/纳米混悬液或包囊的珠子中的每种成分比液体细胞培养基/进料或补充物中的相同成分浓缩了约10倍。易于理解,“5X制剂”、“25X制剂”、“50X制剂”、“100X制剂”、“500X制剂”和“1000X制剂”是指这样的制剂:与1X细胞液体培养基、进料或补充物相比,其分别含有约5-25、25-50、50-70、70-100、100-500、500-1000倍浓度的成分。培养基制剂和浓缩溶液的渗透压和pH也可以变化。制剂可以含有就特定细胞培养方案而言为1X的组分或成分,但是就不同的培养方案或不同的基础培养基而言为例如2、2.5、5、6.7、9、12等倍(X)的浓度。
微米混悬液
通常将营养物进料、功能性添加剂或补充物提供为透明液体浓缩物或粉剂,所述粉剂被重构进透明液体浓缩物中用于直接递送进生物反应器中。这意味着,其中的组分没有超过它们的溶解度限度。如果将它们制成超过它们的溶解度限度,众所周知,将形成沉淀物,作为絮片或细沉淀物,通常是在瓶子中的白色混浊。这些组分的沉降会在几小时内发生,这意味着,浓缩的溶液不能用于递送准确量的进料。
本公开内容提供了以浓缩的组分不会沉淀出来的方式制备培养基、进料和/或补充物组分的技术。这通过从具有一种或多种浓缩组分的干粉细胞培养基或进料制备微米混悬液和/或纳米混悬液(也被称作微米/纳米混悬液)来实现。
微米/纳米混悬液是在水性溶剂基质中的微米/纳米尺寸的固体,在一个实施方案中,其不会随时间分离。微米/纳米混悬液例如提供了浓缩一种或多种培养基/进料组分超过该组分的溶解度限度的方式。微米/纳米混悬液的一些期望的性能包括、但不限于:在最小体积中实现增加的营养物补充物浓度(例如,氨基酸);微米/纳米混悬液组分在水溶液中非常快速的溶解(与在没有这样的制品存在下的培养基溶解相比更快);包囊能力(即用于包囊形式的组分的灭菌和保护);将无菌的微米/纳米混悬液珠子直接加入生物反应器中的现存培养物中的能力;增加在生物反应器中的效率和制备进程的能力。
已经在其它工业中(例如,在制药或化妆品工业中)制备微米混悬液,通常使用2个方案:i)自顶向下方案,和ii)自底向上方案。在自顶向下方案中,通过研磨过程诸如碾磨机(用于精确颗粒尺寸减小的工业标准),粉碎干粉的颗粒,直到得到微米混悬液,或通过湿磨法或通过使用微流态化仪来得到纳米混悬液。在自底向上方案中,通过温和操作参数如pH或聚合参数,使溶液内的组分逐渐沉淀出来,直到得到微米/或纳米混悬液。这些方法不能用于制备本文所述的微米/或纳米混悬液。鉴于在本文中使用的培养基和补充物的敏感性质,申请人认识到对用于制备培养基、进料的这些微米/或混悬液的新方法的需求。如在实施例1中和在图1中所述,申请人从干燥的培养基、进料或补充物粉末开始,并通过向干粉中添加最小量的注射用水,将所述浆料剧烈混合成同质糊状物,使得所有颗粒都被水相包被,形成微米/纳米混悬液。本领域技术人员考虑到本文公开内容会知道,除了水以外的任意水性基质,例如,缓冲液、平衡盐溶液、液体培养基或包含一种或多种培养基组分(包括氨基酸、脂质等)的任意溶液,可以加入到任意粉末状制剂中以制备本公开内容中描述的微米/纳米混悬液。技术人员还可以改进在建议的方案中使用的任意步骤或材料:例如,加入步骤的次序、混合步骤的次序和数目、液体的体积、混合时间、用于混合浆料至同质性的设备或装置、培养基或进料制剂等,并且他们知道如何操作条件以适应期望的微米/纳米混悬液的稠度和性质。
在一个实施方案中,使用本文描述的技术或所述技术的变体,可以将培养的细胞所需的任意结构或信息分子、任意营养物制备进微米/纳米混悬液中。除了培养基和进料以外,结构和/或信息分子的例子可以包括、但不限于:维生素、氨基酸、肽、大分子、抗氧化剂、激素、生长因子、诸如此类。在某些实施方案中,可以制备与细胞营养物复合的细胞支架基质的微米/纳米混悬液,以便使细胞在混悬液内三维地生长。
如上所述制备的微米/纳米混悬液组合物可以用在许多应用中,例如,用在营养物补充中,以显著增加组分浓度超过目标组分的溶解度水平,使得向反应器的添加体积是最小的;或者,如下所述,用于包囊微米混悬液,和制备干燥形式的包囊的珠子,其产生可以直接加入生物反应器中的“超浓缩的”补充物,这在以前尚未实现。
在一个实施方案中,微米混悬液可以从需要以浓缩形式提供于培养物中的任意组分的任意形式的干粉来制备,并且提供比在溶液中具有相同组分的等同液体浓缩物或进料高至少2-5倍、5-10倍、10-15倍、15-20倍、20-25倍、25-30倍、30-50倍、50-70倍、70-100倍浓度的微米混悬液组分。
微囊化
本公开内容提供了一种微囊化上述的微米/纳米混悬液的方法,所述混悬液从干粉状细胞培养基、进料、补充物或浓缩物制成。得到的包囊的产物在本公开内容中可以被称作‘微胶囊’、‘包囊的珠子’、‘珠子’、‘胶囊剂’或‘微珠’。当将包囊的微米/纳米混悬液干燥成珠子时,干燥步骤提供更大的包囊的微米/纳米混悬液浓缩程度。微囊化可以如下完成:例如,将在复杂混合物诸如细胞培养基/进料中的敏感的或不稳定的组分“分隔”或隔离。因而,包囊可以产生更高浓度的某些进料组分(例如,氨基酸),使得这些进料可以作为浓缩的高营养补充物而直接加入任意培养系统中,例如,加入补料分批培养物中。胶囊的进一步包被可以影响营养物向细胞培养物中的延迟释放(在下面讨论)。包囊可以通过以下方法实现:(a)用于在几小时内“温和释放”一些或所有组分的微米混悬液和纳米混悬液的标准微囊化过程;(b)替代性的珠子胶凝过程,以显著延缓内部组分释放。在实施例中和在图3、4和8中可以找到延迟释放的示例性论证。
在一个具体实施方案中,用于包囊或包埋不稳定组分的试剂是海藻酸盐。海藻酸盐微胶囊已经被用于许多目的,包括药物递送和在细胞培养物中生长的细胞的固定化(以增强细胞生长和生存力)。参见例如,Serp等人,Biotechnology and Bioengineering,2000,70(1):41-53;Breguet等人,Cytotechnology,2007,53:81-93;Chayosumrit等人,Biomaterials,2010,31:505-14;美国专利号7,482,152;和美国专利号7,740,861,它们都通过引用整体并入。
在申请人的共同未决的申请PCT/US2012/024194中也描述了包囊技术,该申请描述了将某些不稳定的、敏感的或易受影响的化合物(诸如乙醇胺、维生素、生长因子如胰岛素等)捕集在囊材料(包括、但不限于,海藻酸盐)中。
不希望受任何理论的约束,将敏感组分包囊或包埋在另一种分子内似乎会减少不稳定化合物与促进其降解或降低其稳定性的其它组分或条件的直接接触。在申请人的共同未决的申请PCT/US2012/024194中描述了通过微囊化来制备用于减少乙醇胺降解的微胶囊的方法,该申请于2012年2月7日提交,其公开内容通过引用整体并入本文。尽管那些方法主要在乙醇胺稳定的背景下来举例说明,但是可以使用/改进它们来稳定培养基、进料或补充物中的任何敏感的或不稳定的化学试剂或化合物。应当理解,其中描述的微囊化方法可以用于稳定细胞培养所需的任何敏感的化合物,包括、但不限于,维生素如硫胺素、B12等,不稳定的氨基酸诸如谷氨酰胺,细胞因子,生长因子,敏感的和有价值的蛋白或肽等,和用于增强被稳定的化合物的递送,且可以应用于细胞培养基开发以外的领域。在本公开内容中,使包囊技术适用于微米/纳米混悬液珠子,这需要改进几个步骤和技术。例如,在PCT/US2012/024194申请中的敏感化合物的捕集步骤缺少几个步骤。为了包囊微米混悬液,将囊材料(诸如海藻酸盐)与微米混悬液混合和掺合。然后将该混合物抽吸进分配装置(诸如移液器或滴管)中,并通过将所述混合物轻轻滴在不粘表面上(例如,石蜡膜上)来逐渐产生包囊的微米混悬液的微滴。然后,将交联剂加入到滴中以形成珠子。将这些珠子干燥并真空干燥以除去水分,通常称作“包囊的微米混悬液珠子”或仅称作“珠子”。
本领域技术人员基于本发明的公开内容将知道,可以改进在建议的方案(参见实施例2)中使用的任意步骤或材料。例如,可以使用多种囊材料,或者可以使用多种滴递送装置,包括移液器、滴管、注射器或其任意改进,或者可以使用任意交联剂,或者可以通过多种方式将珠子干燥或脱水至不同干度和/或硬度程度。本领域技术人员能够确定用于即将到来的目的的适当的包囊剂,例如,海藻酸盐、聚-L-乳酸(PLL)、壳聚糖、琼脂糖、明胶、透明质酸、硫酸软骨素、葡聚糖、硫酸葡聚糖、肝素、硫酸肝素、硫酸类肝素、结冷胶、黄原胶、瓜尔胶、水溶性的纤维素衍生物、角叉菜胶诸如此类。
微胶囊通常是具有2mm或更小直径的球形颗粒,经常在0.05-1.5mm的直径范围内。通常,海藻酸盐微胶囊通过聚阴离子海藻酸盐与二价或三价多价阳离子(诸如氯化钙)之间的交联而形成。用于交联的其它盐可以是二价或三价阳离子,诸如氯化镁、氯化钡和硫酸铝。
包囊具有几个优点,其中的一些包括、但不限于:保护不稳定组分免于降解或免于不希望的反应;或者,延迟和/或延长包囊的组分在细胞培养物中的释放时间,在一个实施方案中,保护是由于培养基的微囊化;或者,增加包含不稳定化合物的细胞培养基、进料和补充物在环境温度下的稳定性和贮存期。可以将包囊的化合物干燥成珠子,然后可以将所述珠子与其它培养基组分掺合和/或混合。因此,微米/纳米混悬液可以导致培养基/不稳定组分功能性的任何损失的1-5%、5-10%、10-15%、15-20%、20-25%、25-30%、30-35%、35-40%、40-50%、50-60%、60-70%、70-80%、80-90%或90-100%的减少,所述功能性可以使用本领域已知的技术(包括在本申请中公开的方法)通过包囊的不稳定组分或培养基组分的合适功能测定来测量。功能测定的例子可以是,包含微胶囊的培养基/进料组合物的随天数增加细胞生存力的能力,或培养系统中的细胞数目,或重组蛋白生产,或表达的重组蛋白的量和/或功能的增加(例如,酶或受体功能测定,或可以在培养过程中评价包囊的不稳定组分如谷氨酰胺的稳定性等,如本领域技术人员已知的)。
在一个实施方案中,使用掩蔽剂(如海藻酸盐)来包囊或包埋乙醇胺-树枝状聚合物复合物。树枝状聚合物是多分支的合成大分子,其可以使用受控连续过程来制备,以给它们提供确定的结构和分子量特征;综述见:Astruc等人,Chem.Rev.2010,110:1857-1959,其特此通过引用整体并入。树枝状聚合物也可以用于制备本发明的包囊的微米混悬液。在另一个实施方案中,在PCT/US2012/024194描述的方法中使用的树枝状聚合物是聚酰胺胺,且它可以经改进用在包囊的微米/纳米混悬液中。可以在本申请描述的方法中使用的其它树枝状聚合物包括、但不限于:聚丙烯亚胺(PPI)树枝状聚合物、磷树枝状聚合物、聚赖氨酸树枝状聚合物、聚丙胺(POPAM)树枝状聚合物、聚乙烯亚胺树枝状聚合物、蝶烯树枝状聚合物、脂族聚(醚)树枝状聚合物或芳族聚醚树枝状聚合物。
在一个实施方案中,微囊化的微米/纳米混悬液可以制备用于需要以浓缩形式提供于培养物中的任意组分,并且提供比在溶液中具有相同组分的等同液体浓缩物或进料高至少2-5倍、5-10倍、10-15倍、15-20倍、20-25倍、25-30倍、30-50倍、50-70倍、70-100倍浓度的包囊的微米/纳米混悬液的组分。在一个示例性实施方案中,如在图中所见的,浓缩的进料制品的微米混悬液制品比它的对应液体进料浓缩了约7倍,而干燥的包囊形式的相同微米混悬液比它的对应液体进料浓缩了约10倍。
抗氧化剂
本公开内容还描述了,在包囊过程之前,可以将胶囊内的不稳定化合物进一步与一种或多种保护物质(诸如抗氧化剂)组合。因此,在某些实施方案中,在包囊之前,可以将抗氧化剂和粉末状培养基、进料或补充物中的不稳定组分的混合物用作起始原料来制备微米混悬液制品。示例性的抗氧化剂包括、但不限于:维生素如抗坏血酸、β-胡萝卜素、维生素A、E、番茄红素、黄酮类化合物、硒等。在图8中描绘了抗氧化剂对归因于辐照的保护的影响。
在一个实施方案中,在微囊化之前由抗氧化剂引起的保护可以导致培养基/不稳定组分功能性的损失的1-5%、5-10%、10-15%、15-20%、20-25%、25-30%、30-35%、35-40%、40-50%、50-60%、60-70%、70-80%、80-90%或90-100%的减少,所述功能性可以通过不稳定组分或培养基组分的合适功能测定来测量。然后可以将干燥的微胶囊珠子掺合进其它培养基组分中和/或与其它培养基组分混合。
螯合作用
本公开内容还描述了螯合剂,其为将存在于培养基内的反应性分子螯合、灭活或封闭的试剂,所述反应性分子包括阳离子、金属离子、痕量元素等。反应性分子会不利地与培养基中的不稳定化合物相互作用并降低它们的效力。通过螯合/络合反应性化合物,化合物诸如EDTA、柠檬酸盐、琥珀酸盐、环糊精、笼形化合物、树枝状聚合物、氨基酸等将降低它们的反应性。另外,可以设计螯合物以保持分隔在包含不稳定化合物的微胶囊/珠子之外。在图9中描述了螯合作用对不稳定化合物的保护的影响。
在一个实施方案中,在微胶囊外面由反应性组分和/或产生活性氧(ROS)的培养基/进料组分的螯合作用而引起的保护可以导致培养基/不稳定组分功能性的损失的1-5%、5-10%、10-15%、15-20%、20-25%、25-30%、30-35%、35-40%、40-50%、50-60%、60-70%、70-80%、80-90%或90-100%的减少,所述功能性可以通过不稳定组分或培养基组分的合适功能测定来测量。功能测定的例子可以是,包含微胶囊和螯合组分的培养基/进料组合物的随天数增加细胞生存力的能力,或培养系统中的细胞数目,或重组蛋白生产,或表达的重组蛋白的量和/或功能的增加(例如,酶或受体功能测定,或可以在培养过程中评价包囊的不稳定组分如谷氨酰胺的稳定性等,如本领域技术人员已知的)。
延迟释放
在一个实施方案中,任选地,可以用保护性包衣如PLGA进一步包被微胶囊,用于延迟释放或延长释放微胶囊内的组分。用于延迟释放的典型培养基组分可以包括、但不限于:维生素、葡萄糖、氨基酸、生长因子或细胞因子。组分可以以相同速率从相同微胶囊内释放,或以不同速率和在不同时间从不同微胶囊释放,取决于延迟释放制剂。这样的双形式延迟释放培养基的一种示例性用途是,在培养早期释放生长组分(例如,葡萄糖、氨基酸等),随后在进入培养的后对数期(post-log phase)以后释放生产组分(例如,重组蛋白表达诱导物诸如半乳糖等)。这样的培养基不需要用户操作,因为双形式培养基会照料必要组分的适时释放。另一个实例是,维持2种或更多种组分分离直到指定的时间,此时由于特定目的而需要它们一起在培养物中反应。
可以施加可在微囊化以后用于包被的包衣溶液以提供另外的层,且其包括、但不限于:聚乙醇酸、PLGA(聚乳酸-共-乙醇酸)、胶原、聚羟基烷酸酯(PHA)、聚-ε-己内酯、聚原酸酯、聚酸酐、聚膦腈、聚氨基酸、聚二甲基硅氧烷、聚氨基甲酸酯、聚四氟乙烯、聚乙烯、聚砜、聚甲基丙烯酸甲酯、聚甲基丙烯酸-2-羟基乙酯、聚酰胺、聚丙烯、聚氯乙烯、聚苯乙烯、聚乙烯吡咯烷酮、聚-L-赖氨酸或聚鸟氨酸。可以进一步包囊形成珠子且在外面包被的包囊组分本身,使得可得到宽范围的释放选择,这取决于周围包衣和各个珠子包衣的包被特征。
所述额外的外包衣可以选自海藻酸盐、聚-L-乳酸、壳聚糖、琼脂糖、明胶、透明质酸、硫酸软骨素、葡聚糖、硫酸葡聚糖、肝素、硫酸肝素、硫酸类肝素、结冷胶、黄原胶、瓜尔胶、水溶性的纤维素衍生物和角叉菜胶。在实施例中和在图3、4和8中证实和讨论了包衣的影响。在一个实施方案中,内部组分从微胶囊的延迟释放可以导致包囊的组分在细胞培养系统中维持经历6-24小时、24-48小时、48-72小时,经历1天、2天、3-5天、5-10天、10-15天、15-20天、20-25天、25-30天、30-40天、40-50天,经历培养持续时间。通过胶囊内的不稳定组分或培养基组分的合适限时释放测定可以测量延迟释放,并且还可以任选地包被以延长释放。下面讨论了一个示例性的限时释放测定。功能测定的其它例子可以是,包含包被的微胶囊的培养基/进料组合物的随天数增加细胞生存力的能力,或培养系统中的细胞数目,或重组蛋白生产,或表达的重组蛋白的量和/或功能的增加(例如,酶或受体功能测定,或可以在培养过程中评价包囊的不稳定组分如谷氨酰胺的稳定性等,如本领域技术人员已知的)。
除了典型培养基组分如维生素、葡萄糖、氨基酸、生长因子或细胞因子以外,还可以靶向以下细胞培养营养物/试剂以延迟释放。它们包括、但不限于,用于促进细胞代谢(不论是为了生长还是产物合成和分泌)的所有化学物质或组合物,诸如葡萄糖和其它形式的己糖、氨基酸、盐、肽、蛋白诸如胶原和蛋白级分、脂质、激素、维生素、核苷酸/核苷、痕量元素、核糖核苷酸/核糖核苷、血清、血清级分诸如牛白蛋白和血浆铜蓝蛋白、以及不会直接代谢而是给培养物中的细胞提供细胞培养相关优点的其它组分,诸如不同类型的普流尼克(pluronic)诸如阻止细胞聚集的F68,纤连蛋白和肽序列诸如支持细胞附着的RGD和消泡剂。除了单一或多种单独组分以外,可以在该延迟释放方法中包括组分的混合物。粉末本身可以是细磨的或造粒的(AGT)形式。
用于检测延迟释放的示例性测定
释放延迟的检测包括:在一段时间内测定目标组分,和观察随时间的增加。典型CHO细胞营养补充物的一个实例是,测量葡萄糖。将含有葡萄糖的补充物加入水中,并抽取和保留T=0样品。然后,在以后的时间段(诸如在24、48、72小时),可以抽取另外的样品。如果在补充物中存在延迟释放组分,那么将观察到葡萄糖随时间升高。一种用于测量葡萄糖的测定是测量葡萄糖氧化酶,其以试剂盒形式商购可得。这里的原理是,葡萄糖氧化酶与葡萄糖反应以产生葡糖酸和过氧化氢。过氧化氢与邻-二茴香胺反应以产生氧化的邻-二茴香胺,后者在暴露于硫酸后形成粉红色颜色。这可以通过分光光度计法来读出。用于葡萄糖测量或用于其它补充物组分(诸如氨基酸)的另一种测定是通过HPLC。该方法测量释放组分随时间的连续增加,这是延迟释放的标志。
灭菌
在本公开内容中,不稳定的、敏感的或易受影响的化合物包括但不限于对物理、化学、辐射降解/破坏敏感的物质。典型的敏感的培养基物质可以是对与活性氧的化学相互作用敏感的,对金属(包括痕量金属)敏感的,对高温、对辐照(γ、X-射线、紫外线、电离等)、对冷冻温度、对冻融、对压力、搅拌等敏感的。在该实施方案的另一个方面,可以将痕量元素或产生活性氧(ROS)的物质等螯合和/或保持在包含不稳定组分的微胶囊的外面。
本公开内容提供了一种在保护辐照不稳定组分(例如,通过抗氧化剂包被和/或随后的包囊)的同时使用辐照将包含包囊组分的培养基灭菌的方法。灭菌性辐照包括诸如γ射线、紫外射线和其它电离辐射等光波长。使用的灭菌性γ辐照可以是5kGy至100kGy。在一个实施方案中,可以通过高达约50kGy的γ辐照将包含包囊组分的培养基灭菌,而不损失培养基或进料功能性,和/或具有病毒的约8-log的减少。这满足>10e-8的猪细小病毒(PPV)和/或鼠细小病毒(MMV)的SAL(无菌度确保水平)。在某些实施方案中,可以通过大于50kGy直至100kGy的γ辐照的组合将包含包囊组分的培养基灭菌,而不损失培养基或进料功能性。
在某些实施方案中,观察到约6-8log的SAL或病毒(如MMV和PPV)的减少。与其它灭菌技术(诸如紫外辐照)相组合,SAL的进一步减小是可能的,高达约8log的SAL,而不损失培养基或进料功能性。另外,可以如下将重构的培养基巴氏消毒:通过诸如HTST(高温短时)或UHT(超高温)等技术,和/或通过穿过0.1-0.2μm孔径的抗病毒过滤器过滤,这可以提供病毒(诸如囊病毒、猪环状构象病毒和在生物技术工业中造成问题的其它小的有包膜病毒)的进一步减少,而不损失培养基或进料的功能性。
由于它们的被灭菌的能力,且因为不存在培养基或进料功能性损失,因此,本公开内容的组合物适合于增强的细胞培养工作流,并提高了生物反应器生产力,因为它们可以在现存的细胞培养过程中直接加入生物反应器中。在某些实施方案中,添加物可以作为包囊的珠子,或在其它实施方案中,添加物可以作为微米/纳米混悬液。另一个实例是,将无菌微胶囊直接加入生物反应器中,加入过滤水,混合,然后加入细胞。
可以以至少2种方式将微胶囊用于生物反应器中的营养补充:1)可以将无菌微胶囊直接加入生物反应器中,它们在其中以限时释放方式释放组分(右),或2)可以将它们加入具有约0.22μ孔径的多孔金属圆筒、笼或任意类似的设备中,保持珠子免于接触培养物中的细胞。对于选项1,珠子可能干扰过滤,或可能降低细胞计数或生产力。对于选项2,仅仅生物反应器搅拌足以使营养补充物从多孔金属笼内部溶解和传入生物反应器中。
细胞培养基
细胞培养基由许多成分组成,并且这些成分在各培养基之间不同。细胞培养基可以是完全制剂(即,无需补充即可培养细胞的细胞培养基),可以是不完全制剂(即,需要补充的细胞培养基),或可以是用于补充不完全制剂的培养基,或者在完全制剂的情况下,可以改善培养或培养结果。
通常,在重构后,细胞培养基具有溶解在溶剂中的溶质。所述溶质提供渗透力以平衡跨细胞膜(或细胞壁)的渗透压。此外,所述溶质为细胞提供营养物。一些营养物是细胞工作的化学燃料;一些营养物可以是细胞用于合成代谢的原料;一些营养物可以是机器,例如促进细胞代谢的酶或载体;一些营养物可以是结合和缓冲细胞使用的成分的结合剂或是结合或鳌合有毒细胞产品的结合剂。
取决于细胞和细胞的预期用途,细胞培养基的成分最佳地以经过平衡从而优化细胞培养性能的浓度存在。根据一种或多种期望的特征,例如细胞数目、细胞质量、细胞密度、O2消耗、培养成分(例如葡萄糖或核苷酸)的消耗、生物分子的生产、生物分子的分泌、废物或副产物(例如代谢物)的形成、对指示剂或信号分子的活性等,测量性能。因此,优选地将每种成分或一些成分优化至用于预期目的的工作浓度。
通常使用基础培养基来维持细胞培养,且基础培养基可以含有许多成分,包括氨基酸、维生素、有机和无机盐、糖和其它组分,每种成分以支持细胞体外培养的量存在。
本文描述的包含微米混悬液和/或包囊的微米混悬液的培养基可以是1X制剂,或者可以被浓缩为例如5X,10X,20X,50X,500X,或1000X培养基制剂。如果将各种培养基成分制备成单独的浓缩溶液,则将适当(充足)量的每种浓缩物与稀释剂组合以产生1X培养基制剂。通常,使用的稀释剂是水,但可以使用其它溶液,包括水性缓冲液、盐水溶液、或其它水性溶液。培养基可以是需要向其中添加另外的组分的基础培养基,或可以是完全培养基,其不需要另外的添加剂并且能够在重构后使细胞生长。
在一个实施方案中,从干粉重构的含有微米混悬液和/或包囊的微米混悬液的培养基产生自动-pH和/或自动-渗透压的培养基/进料,因为,它已经平衡了缓冲剂浓度和/或盐浓度,其有助于自动实现适合于培养某种细胞类型的期望的pH和渗透压,而无需另外的pH或盐浓度调节。
在另一个实施方案中,或在进一步的实施方案中,从干粉重构的含有微米混悬液和/或包囊的微米混悬液的培养基产生化学成分确定的细胞培养基。培养基蛋白的存在使得重组蛋白的纯化是困难的、费时的、并且是昂贵的,并且还可以导致降低的产品收率和/或纯度。因而,在一个实施方案中,所述细胞培养基是无血清的和无蛋白的,却是完整的,使得它可以支持特定细胞类型的生长。可替代地,从干粉重构的培养基可以是无血清的,但是仍然含有源自一种或多种非动物衍生来源(无动物来源-AOF)如源自植物、酵母、藻类、真菌的蛋白,或源自重组来源例如细菌、真菌、植物、酵母、藻类等的蛋白,所述蛋白呈水解物的形式,或呈纯化的蛋白或水解物级分的形式。在其它情况下,无血清培养基仍然可以含有一种或多种各种动物衍生的组分,包括白蛋白、胎球蛋白、各种激素和其它蛋白。在另一个实施方案中,所述培养基或培养基补充物不含蛋白,并且进一步,不含有脂质、水解物或生长因子。
本公开内容的培养基或补充物可以用于补料分批培养。细胞的补料分批培养通常被用于生物分子(例如蛋白)的工业生产,以增加细胞浓度和延长培养寿命,实现高产品浓度和体积生产力。补料分批培养涉及一种或多种营养物(例如葡萄糖)向基础培养基中的受控添加。营养物如下帮助控制细胞培养物的生长:防止营养物耗尽或积累和副产物积累,由此将重要参数(例如渗透压和CO2浓度)维持在促进细胞生长或使细胞死亡最小化从而实现最佳产物表达的水平内。
细胞和病毒
如本文中所述的,含有微米混悬液和/或包囊的微米混悬液的培养基/进料还可以用于培养多种细胞。在一个实施方案中,所述培养基被用于培养真核细胞,包括植物或动物细胞,例如哺乳动物细胞、鱼细胞、昆虫细胞、藻细胞、两栖动物细胞或鸟类细胞,或者用于生产病毒、病毒样颗粒。
可以用本文描述的培养基/进料培养的哺乳动物细胞包括:原代上皮细胞(例如,角质形成细胞、宫颈上皮细胞、支气管上皮细胞、气管上皮细胞、肾上皮细胞和视网膜上皮细胞)和建立的细胞系及其品系(例如,293胚胎肾细胞、BHK细胞、HeLa宫颈上皮细胞和PER-C6视网膜细胞、MDBK(NBL-1)细胞、911细胞、CRFK细胞、MDCK细胞、CHO细胞、BeWo细胞、Chang细胞、Detroit 562细胞、HeLa 229细胞、HeLa S3细胞、Hep-2细胞、KB细胞、LS180细胞、LS174T细胞、NCI-H-548细胞、RPMI 2650细胞、SW-13细胞、T24细胞、WI-28VA13、2RA细胞、WISH细胞、BS-C-I细胞、LLC-MK2细胞、克隆M-3细胞、1-10细胞、RAG细胞、TCMK-1细胞、Y-1细胞、LLC-PK1细胞、PK(15)细胞、GH1细胞、GH3细胞、L2细胞、LLC-RC 256细胞、MH1C1细胞、XC细胞、MDOK细胞、VSW细胞和TH-I、B1细胞或其衍生物)、得自任意组织或器官(包括、但不限于心脏、肝、肾、结肠、肠、食管、胃、神经组织(脑、脊髓)、肺、血管组织(动脉、静脉、毛细管)、淋巴组织(淋巴腺、腺样体、扁桃体、骨髓和血液)、脾)的成纤维细胞,和成纤维细胞和成纤维细胞样细胞系(例如,CHO细胞、TRG-2细胞、IMR-33细胞、Don细胞、GHK-21细胞、瓜氨酸血症细胞、Dempsey细胞、Detroit 551细胞、Detroit 510细胞、Detroit 525细胞、Detroit 529细胞、Detroit 532细胞、Detroit 539细胞、Detroit 548细胞、Detroit 573细胞、HEL 299细胞、IMR-90细胞、MRC-5细胞、WI-38细胞、WI-26细胞、MiCl1细胞、CHO细胞、CV-1细胞、COS-1细胞、COS-3细胞、COS-7细胞、Vero细胞、DBS-FrhL-2细胞、BALB/3T3细胞、F9细胞、SV-T2细胞、M-MSV-BALB/3T3细胞、K-BALB细胞、BLO-11细胞、NOR-10细胞、C3H/IOTI/2细胞、HSDM1C3细胞、KLN2O5细胞、McCoy细胞、小鼠L细胞、2071品系(小鼠L)细胞、L-M品系(小鼠L)细胞、L-MTK-(小鼠L)细胞、NCTC克隆2472和2555、SCC-PSA1细胞、Swiss/3T3细胞、印度黄麂细胞、SIRC细胞、CII细胞和Jensen细胞或其衍生物)。
还可以在适合于生长和生物燃料生产的条件下在本公开内容的包含微米混悬液和/或包囊的微米混悬液的培养基组合物中培养真核细胞(包括藻细胞)以生产生物燃料。
由本文所述的培养基支持的细胞还可以衍生自任何动物,优选哺乳动物,并且更优选小鼠或人。根据本文中公开的方法培养的细胞可以是正常细胞、病变细胞、转化细胞、突变细胞、体细胞、生殖细胞、干细胞、前体细胞或胚胎细胞,其中任一种可以是建立的细胞系或转化的细胞系,或得自天然来源。可以将细胞用于实验目的或用于生产有用的组分。
在一个实施方案中,将本文描述的培养基用于培养中国仓鼠卵巢(CHO)细胞,包括重组CHO细胞或CHO-衍生的细胞系如CHOS、CHOK1、DG44、RevO等。术语CHO细胞包括描述的重组CHO细胞和所有CHO-衍生的细胞系。CHO细胞已经被归类为衍生自中国仓鼠卵巢的上皮细胞和成纤维细胞。起始于中国仓鼠卵巢的细胞系(CHO-K1)(Kao,F.-T.和Puck,T.T.,Proc.Natl.Acad.Sci.USA 60:1275-1281(1968))已经被培养很多年,但是始终没有证实其本质。由于细胞系具有许多优点诸如人样糖基化模式、精确的翻译后修饰和人类病毒传播的低风险性,大部分生物制药厂目前在CHO细胞中生产蛋白。
细胞的培养
根据研究人员确定的实验条件,可以培养由本文描述的培养基支持的细胞。应当理解,本领域普通技术人员仅使用例行实验就可以确定给定的动物细胞类型的最佳铺展和培养条件。对于常规的单层培养条件而言,通过使用本文描述的细胞培养基,可以在没有附着因子的情况下将细胞铺展在培养容器的表面上。可替换地,所述容器可以用天然的、重组的或合成的附着因子或肽片段(例如,胶原、纤连蛋白、玻璃体结合蛋白、层粘连蛋白等,或其天然或合成片段)预涂布,它们可商业得自例如Life Technologies,Corp.(Carlsbad,CA R&D Systems,Inc.(Rochester,Minnesota),Genzyme(Cambridge,Massachusetts)和Sigma(St.Louis,Missouri)。还可以将细胞接种进天然或合成的三维支持基质(例如预制的胶原凝胶或合成的生物聚合材料)的内部或表面上。对于悬浮培养而言,通常将细胞悬浮于本文描述的培养基中,并引入促进细胞悬浮培养的培养容器中,例如旋转烧瓶、灌注装置或生物反应器。理想地,将培养基和悬浮的细胞的搅拌最小化,以避免在培养过程中培养基组分的变性和细胞的剪切。
可以针对使用的具体培养条件优化每个实验条件的细胞接种密度。对于在塑料培养容器中的常规单层培养而言,1-5x 105个细胞/cm2的初始接种密度是优选的,而对于悬浮培养而言,可以使用更高的接种密度(例如,5-20x 105个细胞/cm2)。
通常在细胞培养箱中在约37℃下培养哺乳动物细胞。培养箱气氛应当是湿润的,并且应当含有在空气中的约3-10%的二氧化碳,更优选在空气中的约8-10%的二氧化碳,并且最优选在空气中的约8%的二氧化碳,尽管某些细胞系的培养可能需要在空气中高达20%的二氧化碳才能获得最佳结果。培养基pH通常应该在约6.2-7.8的范围内,优选约7.1-7.4,最优选约7.1-7.3。可以在不同条件(pH、温度和/或二氧化碳)下培养细胞以增加蛋白生产。
当细胞达到约1.5-2.0x 106个细胞/ml的密度时,封闭培养物或分批培养物中的细胞应当经历完全培养基交换(即,用新鲜培养基替换耗尽的培养基)。在灌注培养中(例如,在生物反应器或发酵罐中)的细胞将在连续再循环基础上接受新鲜培养基。
病毒和疫苗生产
除了以悬浮培养或单层培养来培养细胞以外,本发明的培养基还可以用在从哺乳动物细胞生产病毒的方法中。这样的方法包括:(a)在适合于促进病毒感染细胞的条件下,使细胞(例如哺乳动物细胞)与病毒接触;和(b)在适合于促进细胞生产病毒的条件下,在本文描述的培养基中培养细胞。在培养基中培养细胞之前、期间或之后,可以使细胞与病毒接触。用病毒感染哺乳动物细胞的最佳方法是本领域众所周知的,并且是普通技术人员熟知的。可以预见到,与在本文描述的细胞培养基以外的细胞培养基中培养的细胞相比,在本文描述的培养基中培养的病毒感染的哺乳动物细胞生产更高的病毒滴度(例如,2、3、5、10、20、25、50、100、250、500或1000倍的更高滴度)。
这些方法可以用于生产多种哺乳动物病毒和病毒载体,包括、但不限于腺病毒、腺伴随病毒、逆转录病毒等,并且最优选地用于生产腺病毒或腺伴随病毒。在本文所述的培养基中培养受感染的细胞以后,可以将使用的含有病毒、病毒载体、病毒颗粒或其组分(蛋白和/或核酸(DNA和/或RNA))的培养基用于多种目的,包括疫苗生产、用于细胞转染或基因治疗的病毒载体的生产、动物或细胞培养物的感染、病毒蛋白和/或核酸的研究等。可替换地,根据本领域普通技术人员熟知的蛋白和/或核酸分离技术,可以任选地从使用的培养基中分离出病毒、病毒载体、病毒颗粒或其组分。
重组蛋白生产
本发明的培养基还可以用在从细胞(包括悬浮培养的真核细胞,但是优选哺乳动物细胞)和特别是从悬浮培养的哺乳动物细胞生产重组蛋白的方法中。根据本公开内容生产多肽的方法包括:在适合于细胞表达多肽的条件下,在本文描述的培养基中培养已经被遗传工程改造以生产多肽的细胞(例如,哺乳动物细胞)。在遗传上工程改造哺乳动物细胞以表达目标多肽的最佳方法是本领域众所周知的,并且因此是普通技术人员熟知的。在本公开内容的培养基中培养之前,可以对细胞进行遗传工程改造,或者在将细胞置于培养基中进行培养之后,可以用一种或多种外源核酸分子转染细胞。根据上述的方法,可以在本发明的培养基中培养遗传工程改造的细胞,作为单层培养物,或者更优选地作为悬浮培养物。培养细胞之后,根据本领域普通技术人员熟知的蛋白分离技术,可以任选地从细胞和/或使用的培养基中纯化目标多肽。
实施例
实施例1:用于制备微米混悬液和/或纳米混悬液的方法
本文提供了一种制备包含培养基组分的微米或纳米混悬液的方法。该方法可以例如如下允许浓缩培养基和/或补充物超过溶解度:通过某些组分的微米混悬液(ms)和/或纳米混悬液(ns),和进一步,通过包囊微米混悬液(ms)和/或纳米混悬液(ns)以形成珠子,随后干燥包囊的珠子,进一步增加组分的浓度。
制备微米混悬液(参见图1)
为了制备约7X浓度的培养基组分的微米混悬液(没有磷酸钠):
1)将30g干燥形式的粉末状培养基、补充物或进料(没有磷酸钠)称量进研钵中。
2)加入7.5ml WFI(注射用水)。
3)使用绿色塑料柔软刮勺,混合直到粉末被润湿并开始“吸收”水和形成糊状物。将糊状物快速地彻底混合达到同质性,其为微米混悬液。
4)将1ml另外的WFI加入微米混悬液中并彻底混合。
5)将微米混悬液收集进容器中,并使用刮勺将最后量的微米混悬液“刮”入容器中用于递送。体积为约29ml。
6)为了递送,使用活塞-递送装置(例如;注射器型装置)。
实施例2:在海藻酸盐微胶囊中的微米混悬液和纳米混悬液
微囊化可以提供在物理上分离或隔离不稳定组分(特别是与粉末状细胞培养基中的反应性成分分离或隔离)的机制。作为例子,海藻酸盐或任意其它包囊基质或囊材料可以用于微囊化。
制备包囊的微米混悬液的方法
为了制备包囊的微米混悬液(这是进一步浓缩培养基、补充物或进料的方式):
1)制备没有磷酸钠的培养基、补充物或进料的微米混悬液(例如,如上所述)。
2)将13.5ml的6%海藻酸盐加入微米混悬液中,并用刮勺彻底混合以掺合进海藻酸盐中。体积等于约40.5ml。
3)切割石蜡膜圆以覆盖4-侧(培养基)聚丙烯一次性的称量皿的底部。将石蜡膜放入称量皿底部。
4)如下制备Eppendorf Repeater-Plus尖头:用剪刀剪掉末端的约1/64”,确保切口不会远至当充分压缩时柱塞的末端的位置。
5)使用Eppendorf Repeater-Plus与设定在位置1(25μl)的2.5ml注射器,缓慢地将微米混悬液吸入注射器中。确保不会将空气抽吸进注射器中,因为这会保留在粘稠的微米混悬液中和改变递送的体积。
6)压迫Eppendorf杆几次以启动(prime)注射器。在微米混悬液流出注射器末端以后,擦掉注射器的末端。然后将注射器末端保持垂直离石蜡膜表面几mm,压迫杆并保持在相同斑点约5秒,以允许所有25μl滴被递送至石蜡膜表面。然后移动至邻近位置并重复。继续将微滴放在石蜡膜的整个表面上。在石蜡膜上静置几秒以后,海藻酸盐-微米混悬液微滴将形成凸出的、球形的形状。
7)为了交联海藻酸盐和形成水凝胶,将25ml的133g/L的氯化钙(无水)溶液递送进称量皿中。可能必须使用镊子将石蜡膜(和海藻酸盐-微米混悬液微滴)保持在氯化钙溶液表面下面,因为微滴会发生漂浮(如果Ca溶液在下面的话)。
8)将石蜡膜和海藻酸盐-微米混悬液微滴在氯化钙下面保持30秒。形成珠子。
9)30秒以后,使用镊子抓住石蜡膜的一端,并抖动以松动和取下所有珠子。它帮助将石蜡膜倒置在称量皿中并在氯化钙中来回挥动。珠子将容易地脱离石蜡膜。
10)立即进行步骤11-18,因为在置于吸收面巾纸上(步骤16)之前,微米混悬液将在加工过程中缓慢地溶解。
11)立即将称量皿对折并倒出氯化钙溶液,小心地用狭窄末端将珠子保持在称量皿内。
12)松握称量皿,并立即加入(倒入)足够的WFI以半填满。
13)立即如之前对折称量皿并倒出WFI。
14)松握称量皿,并立即倒入足够的WFI以半填满。
15)立即如之前对折称量皿并倒出WFI。
16)将每个称量皿翻转和倒在双重面巾纸上以从珠子吸收尽可能多的水。
17)将面巾纸保持在称量皿上面,并使用塑料白色柔性刮勺舀珠子。
18)使用2个白色塑料刮勺分离珠子,使得它们不会彼此接触。
19)在通风橱下面放置过夜。
20)次日早晨,将珠子放入真空干燥室中在CaSO4上面。
21)干燥3天,然后取出,并从称量皿表面取下珠子(它们轻微附着于此处)。将干净的称量盘倒置,并用于将珠子覆盖在它们的称量盘中。使一端轻微翘起,将白色柔性刮勺伸到称量盘的表面上以取下珠子。取下全部珠子以后,放入新称量盘中并放回到真空干燥室中在CaSO4上面,保持另外4天以确保干度。
实施例3:微量培养基组分诸如维生素的包囊
如果包囊靶标是微量培养基组分诸如维生素,步骤I包括:将要包囊的组分的浓缩溶液直接混合进2%海藻酸盐溶液中。所述溶液足够浓,使得需要1%或更小体积的2%海藻酸盐。不需要形成微米混悬液。然后将该海藻酸盐-组分溶液作为25μl滴添加,直接落入133g/LCaCl2溶液中,并保持30秒。
a)排出CaCl2溶液的珠子,并迅速地冲洗2次。
b)分离珠子,并在平坦表面上干燥几天,以确保<1%的含水量。
c)然后放在真空干燥器中在CaSO4上面,保持几天,直到珠子变脆和硬。
d)干燥的珠子即可用于进一步使用。
像将几乎100%的营养补充物化学试剂加入生物反应器中一样使用干燥的珠子。
实施例4:将延长释放包衣施加于海藻酸盐包囊的微米混悬液上的方法
由于无法获得珠子包被设备,开发了一种替代方法。已发现,必须确保在珠子的延长释放包衣层中绝对不存在孔或薄弱区域。由于手工添加的有机相的性质,不可能均匀地重复包被完整珠子。因此,开发了载玻片替代包被和试验测定。
1)如上所述制备海藻酸盐-微米混悬液。
2)使用Eppendorf移液器,将5μl海藻酸盐-微米混悬液点在红色环形玻片的透明玻璃圆形区域内。
3)立即使用塑料刮勺或其它柔性工具“平整”或弄平5μl海藻酸盐-微米混悬液,以填充尽可能多的圆形玻璃透明区域(目的是尽可能地降低海藻酸盐-微米混悬液的表面,以辅助随后的PLGA包被:高的珠子不会起作用,因为它们在载玻片上向上凸起过高)。
4)将载玻片放入133g/L氯化钙溶液中,保持约20-30秒。
5)通过浸入WFI中进行冲洗。
6)排出载玻片的WFI(使纸巾(tissue)触及每个孔,以吸收多余的水),并在通风橱中干燥过夜。
7)然后放在真空中在CaSO4上面干燥。
8)以25mg/0.6ml氯仿储备PLGA。加入50μL在氯仿中的PLGA,以覆盖红色环形玻片中的孔。50μL体积将“填充”圆形孔区域和上面的珠子,以在孔上面产生凹陷的突起。该体积的PLGA-氯仿将容易地蒸发以在干燥的海藻酸盐-微米混悬液上面形成扁平的接触镜样覆盖物。延迟:3层包衣>2层包衣>1层包衣。
9)在PLGA已经干燥以后,用于与不同的浓度和乙醇酸:乳酸比进行延长释放对比。
在干燥的珠子上得到溶液(如PLGA)的均匀包衣是一项挑战。使用多种方法进行了几次尝试。上面提供了起作用的方法,其从得到期望的包被水平的方法改进而成。例如,弄平珠子将提供对于延长释放应用而言最佳的包被结果。为了达到最佳结果,必须优化几个参数如包衣组分浓度、珠子大小、海藻酸盐百分比、包被方法、干燥条件和干度水平、用于预包被的溶剂等。
实施例5:不同的PLGA浓度和乙醇酸:乳酸比的延长释放对比:测定
1.将55ml PBS置于50ml离心管中。
2.添加相同PLGA组合物的一个载玻片,其覆盖所有14个孔。在室温水平地温育。
3.针对葡萄糖测定了一个示例性的包囊的葡萄糖珠子,以研究不同比率的包衣材料组分(乙醇酸:乳酸比)的延长释放性能。
4.对于在不同时间的取样,我们进行了针对葡萄糖的Sigma葡萄糖氧化酶测定(Sigma Glucose Oxidase Assay,GAGO):
a)将0.10ml样品从50ml离心管移入10x75mm玻璃试管或1.5ml带有橡胶塞的Wheaton玻璃化学分析瓶中。
b)将0.20ml试剂加入相同试管中,混合。
c)在37℃下温育15min。
d)加入0.20ml 12N硫酸,混合。
e)对照:1:10稀释1g/L葡萄糖溶液(0.1ml+0.9ml WFI,等于100ug/ml);系列2倍稀释(0.5ml葡萄糖+0.5ml WFI)至12.5ug/ml。对照是100、50、25和12.5ug/ml葡萄糖。也包括WFI空白。
f)作为指导,当来自所有14个孔的所有微米混悬液溶解时,需要将样品1:4稀释至在对照标准品的范围内[施加的总葡萄糖应当是0.022g/载玻片,在14个孔中,pg 69NB 1138]。
为了读取输出结果,使用SpectraMax 384:在96孔托盘中的350μl样品。透明壁或深色壁起相同作用,没有差异。读取540nm处的吸光度。
计算:[来自Sigma葡萄糖(GO)测定试剂盒,产品代码GAGO-20]
mg葡萄糖=(试验的ΔA@540)(标准品中的mg葡萄糖*)
*4种稀释度的最接近的标准品的浓度。
Δ是指试验或标准品的OD读数减去空白的读数之间的差。
**将上面确定的mg葡萄糖乘以在样品制备时使用的稀释因子。
实施例6:多孔金属圆筒
给多孔金属圆筒填充海藻酸盐包囊的微米混悬液的干燥珠子,并放在含有搅拌棒的1L烧杯内,以模拟在生物反应器内的条件。不存在用于延迟释放的珠子的PLGA包衣。图11中的图表明,仅仅在生物反应器内搅拌就足以从珠子获得营养补充物,并将其溶解和传递进“生物反应器”中。多孔金属圆筒不需要泵送、管道等即可将补充物传递入细胞培养物中。事实上,其非常快速,在一个试验实验中,在单独海藻酸盐珠子(没有PLGA包衣)中的补充物在约20小时内完全释放出它的负载。即使当珠子是在多孔金属内时,延长释放也需要PLGA包衣。图11的下图表明,单独的AGT粉末可以相对快速地穿过多孔金属圆筒,但是单独的AGT不会起延迟释放的作用。要指出的一点是,可以将与生物反应器连接的多孔金属圆筒高压灭菌,可以在培养过程中的任意时间添加补充物珠子。
图11显示,可以以至少2种方式将延迟释放的微胶囊用于生物反应器的营养补充:1)可以将无菌微胶囊直接加入生物反应器中,它们在其中以限时释放方式释放组分(右),或2)可以将它们加入具有约0.22μ孔径的多孔金属圆筒中,保持珠子免于接触培养物中的细胞。对于选项1,珠子可能干扰过滤,或可能降低细胞计数或生产力。对于选项2,仅仅生物反应器的搅拌就足以使营养补充物从多孔金属笼内部溶解和传入生物反应器中。
一些示例性实施方案
一种制备培养基、进料或补充物组合物的方法,所述方法包括:
将最小体积的水溶液加入到培养基、进料或补充物的干粉中以制备糊状物;
剧烈混合所述糊状物以制备微米混悬液。
一种制备培养基组合物的方法,其包括:
根据权利要求1制备培养基的微米混悬液;
任选地,将有效量的抗氧化剂与微米混悬液混合以形成混合物;
将所述微米混悬液或步骤2的混合物包囊在合适的囊材料中,使得形成微胶囊或珠子;
干燥所述微胶囊或珠子,
其中所述培养基包含不稳定物质。
根据权利要求2所述的方法,其中所述不稳定物质附着于树枝状聚合物。
根据权利要求2所述的方法,其中针对一种或多种选自以下的性能制备培养基:至少一种组分处于超浓度,增加的稳定性,增加的对辐射暴露的抗性,热稳定性,延长的贮存期限,和不稳定组分的延长释放。
根据权利要求2所述的方法,其中通过选自以下的测定,测定所述培养基组合物:测定包囊组分的延长释放,测定热稳定性,测定病毒数目的减少,测定辐照以后的功能性,测定延长的贮存期限,测定在运输过程中的稳定性,和测定在环境温度下的贮存。
根据权利要求2所述的方法,其中所述囊材料选自:海藻酸盐、聚-L-乳酸、壳聚糖、琼脂糖、明胶、透明质酸、硫酸软骨素、葡聚糖、硫酸葡聚糖、肝素、硫酸肝素、硫酸类肝素、结冷胶、黄原胶、瓜尔胶、水溶性的纤维素衍生物和角叉菜胶。
根据权利要求2所述的方法,其中所述珠子用包衣进一步包被,所述包衣延长所述不稳定组分从所述珠子的释放。
根据权利要求5所述的方法,其中所述包衣选自:聚乙醇酸、PLGA(聚乳酸-共-乙醇酸)、胶原、聚羟基烷酸酯(PHA)、聚-ε-己内酯、聚原酸酯、聚酸酐、聚膦腈、聚氨基酸、聚二甲基硅氧烷、聚氨基甲酸酯、聚四氟乙烯、聚乙烯、聚砜、聚甲基丙烯酸甲酯、聚甲基丙烯酸-2-羟基乙酯、聚酰胺、聚丙烯、聚氯乙烯、聚苯乙烯和聚乙烯吡咯烷酮。
根据权利要求2所述的方法,其中辐照所述珠子。
根据权利要求8所述的方法,其中针对无菌度测定所述珠子。
根据权利要求4所述的方法,其中用γ-辐照来辐照所述珠子。
根据权利要求5所述的方法,其中另外用紫外射线辐照所述珠子。
根据权利要求5所述的方法,其中所述珠子不具有PPV和MMV病毒。
根据权利要求1或2所述的方法,其中所述组合物是干燥形式的培养基。
根据权利要求1或2所述的方法,其中所述不稳定组分选自:多胺、生长因子、细胞因子和维生素。
根据权利要求2所述的方法,其中所述囊材料在用水性溶剂重构后是可溶的。
根据权利要求3所述的方法,其中所述包囊基质包囊树枝状聚合物-不稳定组分复合物。
根据权利要求14所述的方法,其中所述树枝状聚合物是聚酰胺胺树枝状聚合物、聚丙烯亚胺树枝状聚合物或聚丙胺(POPAM)树枝状聚合物。
根据权利要求1-15中的任一项所述的方法,其中所述组合物包含含有一种或多种氨基酸的粉末状细胞培养基。
一种培养基、进料或补充物组合物,其包含含有组分的微米混悬液。
一种培养基、进料或补充物组合物,其包含不稳定组分和抗氧化剂的混合物,所述混合物被囊基质微囊化为珠子。
根据权利要求18所述的培养基、进料或补充物组合物,其中所述囊材料选自:海藻酸盐、聚-L-乳酸、壳聚糖、琼脂糖、明胶、透明质酸、硫酸软骨素、葡聚糖、硫酸葡聚糖、肝素、硫酸肝素、硫酸类肝素、结冷胶、黄原胶、瓜尔胶、水溶性的纤维素衍生物和角叉菜胶。
根据权利要求18所述的培养基、进料或补充物组合物,其中所述珠子被包衣溶液包被。
根据权利要求20所述的培养基、进料或补充物组合物,其中所述包衣溶液选自:聚乙醇酸、PLGA(聚乳酸-共-乙醇酸)、胶原、聚羟基烷酸酯(PHA)、聚-ε-己内酯、聚原酸酯、聚酸酐、聚膦腈、聚氨基酸、聚二甲基硅氧烷、聚氨基甲酸酯、聚四氟乙烯、聚乙烯、聚砜、聚甲基丙烯酸甲酯、聚甲基丙烯酸-2-羟基乙酯、聚酰胺、聚丙烯、聚氯乙烯、聚苯乙烯、聚乙烯吡咯烷酮、聚-L-赖氨酸和聚鸟氨酸。
根据权利要求18所述的培养基、进料或补充物组合物,其中所述组合物还包含螯合的反应性物质。
根据权利要求21所述的培养基、进料或补充物组合物,其中所述反应性物质是阳离子、金属离子或痕量元素。
根据权利要求21所述的培养基、进料或补充物组合物,其中所述螯合部分选自:EDTA、柠檬酸盐、琥珀酸盐、环糊精、笼形化合物、树枝状聚合物和氨基酸。
根据权利要求17-23中的任一项所述的培养基、进料或补充物组合物,其中辐照所述组合物。
根据权利要求24所述的培养基、进料或补充物组合物,其中辐照是用γ-射线。
根据权利要求25所述的培养基、进料或补充物组合物,其中所述γ-射线为25-100kGy。
根据权利要求26所述的培养基、进料或补充物组合物,其中所述γ-射线为30-50kGy。
根据权利要求26所述的培养基、进料或补充物组合物,其中所述γ-射线为30kGy。
根据权利要求17-28中的任一项所述的培养基、进料或补充物组合物,其无菌地加入到生物反应器中。
根据权利要求17-29中的任一项所述的培养基、进料或补充物组合物,其中所述细胞培养基、进料或补充物是无蛋白的。
根据权利要求17-30中的任一项所述的培养基、进料或补充物组合物,其中用于所述微米混悬液的粉末状细胞培养基是AGT(高级造粒技术细胞培养基)。
上述任一种组合物用于生产干燥形式的细胞培养基的用途。
上述任一种组合物用于增加细胞培养基的贮存期限的用途。
上述任一种组合物用于在环境温度下储存和操作的用途。
除非另有定义,在本文中使用的所有技术和科学术语具有本领域普通技术人员通常理解的相同含义。如果出现矛盾,以本说明书及其中的定义为准。相关领域的普通技术人员将容易明白,对本文描述的方法和应用的其它合适的修饰和修改是显而易见的,并且可以做出这些修饰和修改而不偏离本公开内容或其任何实施方案的范围。另外,所述的材料、方法和实施例仅仅是示例性的,无意成为限制性的。在本文中引用的所有专利、专利申请和公开的参考文献特此通过引用整体并入。
本说明书还包括下列内容:
1.一种制备培养基、进料或补充物组合物的方法,所述方法包括:
将最小体积的水溶液加入到所述培养基、进料或补充物的干粉中以制备糊状物;
剧烈混合所述糊状物以制备微米混悬液。
2.一种制备培养基组合物的方法,所述方法包括:
根据实施方式1制备所述培养基的微米混悬液;
任选地,将有效量的抗氧化剂与所述微米混悬液混合以形成混合物;
将所述微米混悬液或步骤2的混合物包囊在合适的囊材料中,使得形成微胶囊或珠子;
干燥所述微胶囊或珠子,
其中所述培养基包含不稳定物质。
3.一种培养基、进料或补充物组合物,其包含含有组分的微米混悬液。
4.一种培养基、进料或补充物组合物,其包含不稳定组分和抗氧化剂的混合物,所述混合物被囊基质微囊化为珠子。
5.根据实施方式3所述的培养基、进料或补充物组合物,其中所述囊材料选自:海藻酸盐、聚-L-乳酸、壳聚糖、琼脂糖、明胶、透明质酸、硫酸软骨素、葡聚糖、硫酸葡聚糖、肝素、硫酸肝素、硫酸类肝素、结冷胶、黄原胶、瓜尔胶、水溶性的纤维素衍生物和角叉菜胶。
6.根据实施方式5所述的培养基、进料或补充物组合物,其中所述珠子被包衣溶液包被。
7.根据实施方式6所述的培养基、进料或补充物组合物,其中所述包衣溶液选自:聚乙醇酸、PLGA(聚乳酸-共-乙醇酸)、胶原、聚羟基烷酸酯(PHA)、聚-ε-己内酯、聚原酸酯、聚酸酐、聚膦腈、聚氨基酸、聚二甲基硅氧烷、聚氨基甲酸酯、聚四氟乙烯、聚乙烯、聚砜、聚甲基丙烯酸甲酯、聚甲基丙烯酸-2-羟基乙酯、聚酰胺、聚丙烯、聚氯乙烯、聚苯乙烯、聚乙烯吡咯烷酮、聚-L-赖氨酸和聚鸟氨酸。
8.根据实施方式6所述的培养基、进料或补充物组合物,其中所述组合物还包含螯合的反应性物质。
9.根据实施方式8所述的培养基、进料或补充物组合物,其中所述反应性物质是阳离子、金属离子或痕量元素。
10.根据实施方式8所述的培养基、进料或补充物组合物,其中螯合部分选自:EDTA、柠檬酸盐、琥珀酸盐、环糊精、笼形化合物、树枝状聚合物和氨基酸。
11.根据实施方式1-10中的任一项所述的培养基、进料或补充物组合物,其中所述组合物是被辐照的。
12.根据实施方式11所述的培养基、进料或补充物组合物,其中所述辐照是用γ-射线。
13.根据实施方式12所述的培养基、进料或补充物组合物,其中所述γ-射线为25-100kGy。
14.根据实施方式12所述的培养基、进料或补充物组合物,其中所述γ-射线为30-50kGy。
15.根据实施方式14所述的培养基、进料或补充物组合物,其中所述γ-射线为30kGy。
16.根据以上实施方式中的任一项所述的培养基、进料或补充物组合物,其无菌地加入到生物反应器中。
17.根据以上实施方式中的任一项所述的培养基、进料或补充物组合物,其中所述细胞培养基、进料或补充物是无蛋白的。
18.根据以上实施方式中的任一项所述的培养基、进料或补充物组合物,其中用于所述微米混悬液的粉末状细胞培养基是AGT(高级造粒技术细胞培养基)。
19.上述任一种组合物用于生产干燥形式的细胞培养基的用途。
20.上述任一种组合物用于增加细胞培养基的贮存期限的用途。
21.上述任一种组合物用于在环境温度下储存和操作的用途。
- 还没有人留言评论。精彩留言会获得点赞!