组蛋白去乙酰化酶抑制剂在细胞培养中的用途及细胞培养基的制作方法
本公开涉及细胞培养领域,具体地,涉及一种组蛋白去乙酰化酶抑制剂在细胞培养中的用途及细胞培养基。
背景技术:
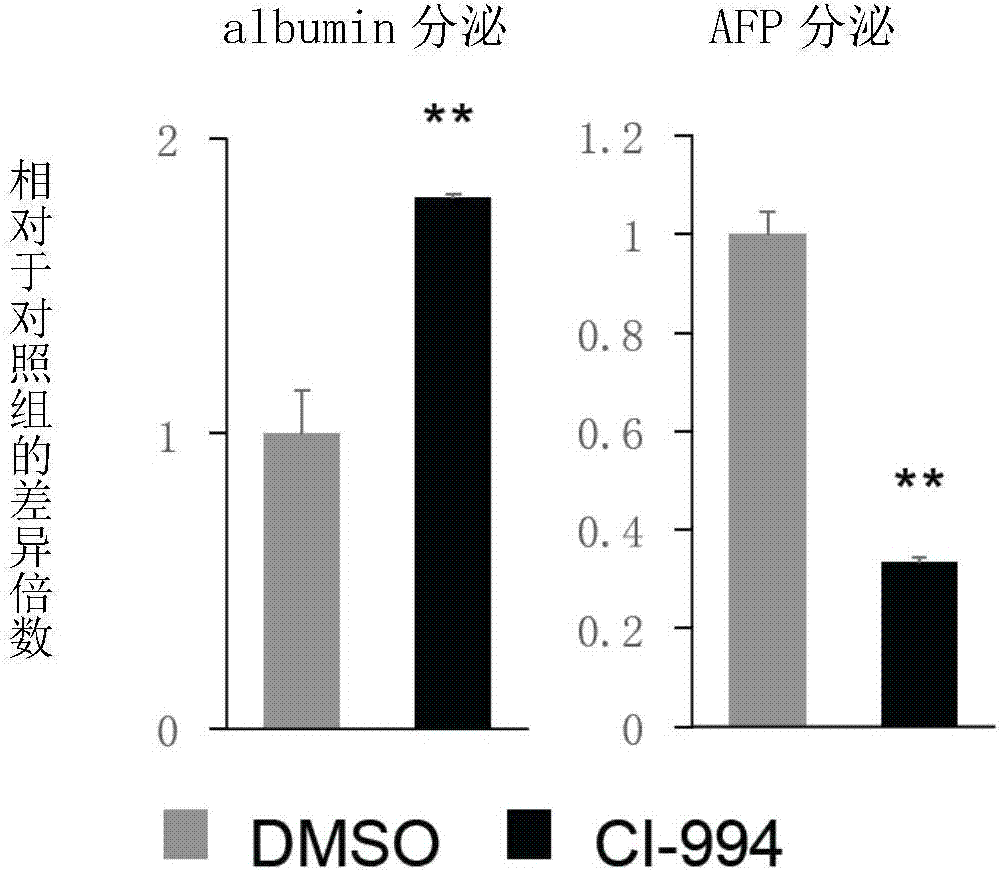
:多能干细胞(pluripotentstemcells,pscs)在体外特定生长因子诱导下可定向分化得到肝脏细胞,是肝脏细胞生物功能分析、药物筛选、毒理检测、体内移植等操作的潜在的重要细胞来源。但目前由多能干细胞分化所得到的肝脏细胞大都存在以下缺陷:1)细胞成熟性不够,分化得到的肝脏细胞大都处于发育的幼稚期,表现为幼稚肝脏细胞标示物afp(alphafetalprotein)蛋白水平较高,一些解毒酶(如cyp3a4)活性较低等;2)细胞群体处于杂合状态,体外分化效率无法达到100%,在主要细胞群体外混杂有多种其他细胞类型,表现为肝脏细胞标示物(如albumin白蛋白)染色比例<100%;3)不同多能干细胞株系的定向分化效率相差较大,不同多能干细胞株系建立方法和来源差异以及遗传和表观遗传背景差异,导致不同株系分化得到不同功能体细胞的体外分化效率相差很大,表现为不同干细胞株分化后得到的肝脏细胞在成熟标记物(如albumin白蛋白)表达水平和表达细胞比例相差较大。由于上述问题的存在,多能干细胞分化得到的肝脏细胞在基础科研和转化医学方面的应用受到较大限制。为进一步改善体外分化体系,提高所得肝脏细胞的质量,需要对体外分化体系进行针对性的改进。另一方面,体外培养的原代肝脏细胞(来源于人、鼠或其他模式动物肝脏组织)在培养较短时间内肝脏细胞特征会有大量丢失,表现为细胞形态变化,肝脏标示物(如albumin)表达水平等显著下降。为解决该问题,需要进一步改善原代肝脏细胞的体外培养体系,减缓原代肝脏细胞肝脏特征的丢失。目前用于改进肝脏细胞体外定向分化体系和原代细胞培养体系的方法主要有两种,第一种是通过调整生长因子或化合物的使用对体外分化体系或培养体系进行优化,该方法的缺陷在于使用的生长因子和化合物种类来源有限制,且往往价格较贵;第二种方法是优化体外二维培养体系,通过增加滋养层细胞或利用三维培养体系,对体外分化体系或培养体系进行优化,该方法的缺陷在于需要复杂的培养体系,体系的复杂程度高也导致可变因素増多、培养难度大且难以保证细胞培养的稳定性和安全性。技术实现要素:本公开的目的是克服现有的肝脏细胞体外定向分化诱导技术和原代肝脏细胞体外培养技术中存在的上述缺陷,提供一种简便、高效的肝脏细胞体外定向分化及原代肝脏细胞体外培养技术。为达到以上目的,本公开的第一个方面提供组蛋白去乙酰化酶抑制剂在细胞培养中的用途,其中,所述用途为多能干细胞向肝脏细胞的体外定向分化培养或原代肝脏细胞的体外培养。可选的,所述组蛋白去乙酰化酶抑制剂为ci-994(tacedinaline,cas号:112522-64-2)、ms-275(entinostat,cas号:209783-80-2)、fk228(romidepsin,cas-号:128517-07-7)。可选的,所述用途为多能干细胞向肝脏细胞的体外定向分化培养,包括在诱导不成熟肝脏细胞向成熟肝脏细胞分化的培养基中添加浓度为5-10μmol/l的组蛋白去乙酰化酶抑制剂。可选的,所述的用途包括以下步骤:(1)将多能干细胞在含有激活素a和/或p13k抑制剂的第一诱导培养基中培养获得内胚层细胞;(2)将所述内胚层细胞在含有骨形态发生蛋白4和/或成纤维生长因子2的第二诱导培养基中培养获得肝脏祖细胞;(3)将所述肝脏祖细胞在含有肝细胞生长因子的第三诱导培养基中培养获得不成熟肝脏细胞;(4)将所述不成熟肝脏细胞在含有5-10μmol/l的组蛋白去乙酰化酶抑制剂以及制瘤素m、肝细胞生长因子和地塞米松的第四诱导培养基中培养获得肝脏细胞。可选的,所述用途为原代肝脏细胞体外培养,包括在含有工作浓度为5-10μmol/l的组蛋白去乙酰化酶抑制剂的原代肝脏细胞体外培养基中进行原代肝脏细胞体外培养。可选的,所述原代肝脏细胞体外培养基的组成成分包括:在基础原代肝脏培养基中添加5-10μmol/l的组蛋白去乙酰化酶抑制剂。本公开的第二个方面提供一种多能干细胞向肝脏细胞体外定向分化培养体系,其中,在诱导不成熟肝脏细胞向成熟肝脏细胞分化的培养基中添加浓度为5-10μmol/l的组蛋白去乙酰化酶抑制剂,所述组蛋白去乙酰化酶抑制剂为ci-994、ms-275或fk228。可选的,所述培养体系包括:第一诱导培养基:以rpmi-1640为基础培养基,添加0.8-1.2%的b27补充物、80-120ng/ml激活素a和4-6μm的p13k抑制剂;第二诱导培养基,以rpmi-1640为基础培养基,添加0.8-1.2%的b27补充物、16-24ng/ml的骨形态发生蛋白4、4-6ng/ml的成纤维生长因子2和0.4-0.6%二甲基亚砜;第三诱导培养基,以rpmi-1640为基础培养基,添加0.8-1.2%的b27补充物、16-24ng/ml肝细胞生长因子和0.4-0.6%二甲基亚砜;第四诱导培养基,以肝脏培养基为基础培养基,添加16-24ng/ml肝细胞生长因子、16-24ng/ml制瘤素m、80-120nm地塞米松、0.4-0.6%二甲基亚砜和5-10μmol/l的组蛋白去乙酰化酶抑制剂。本公开的第三个方面提供一种原代肝脏细胞体外培养基,其中所述培养基含有浓度为5-10μmol/l的组蛋白去乙酰化酶抑制剂。可选的,所述培养基为以原代肝脏培养基为基础培养基添加浓度为5-10μmol/l的ci-994、ms-275或fk228。组蛋白去乙酰化酶抑制剂(histonedeacetylaseinhibitor,hdaci),简称hdacis,是一类化合物,有干扰与组蛋白去乙酰化酶的功能。组蛋白去乙酰化酶抑制剂通常可分为两大类:nad+依赖性酶和zn2+依赖性酶。zn2+依赖性蛋白酶包括hdacsi、ii、iv亚族;nad+依赖性酶主要是hdacsiii亚族。组蛋白去乙酰化酶抑制剂通过增加细胞内组蛋白的乙酰化程度,提高p21等基因的表达水平等途径,抑制肿瘤细胞的增殖,诱导细胞分化和(或)凋亡。本公开的发明人在对肝脏细胞体外定向分化培养的研究和原代肝脏细胞体外培养的研究过程中意外的发现,在培养体系中添加hdaci特别是4-乙酰氨基-n-(2-氨基苯基)苯甲酰胺(ci-994)能显著促进分化所得到的肝脏细胞的质量和减缓原代肝脏细胞体外培养过程中肝脏特征的丢失。因此,利用本公开所提供的技术方案一方面可以促进多能干细胞向肝脏细胞的分化,获得分化程度均一、细胞特征保持良好的成熟干细胞;另一方面在原代肝脏细胞的体外培养过程中,能够帮助原代肝脏细胞在长时间体外培养后仍较好的保持其肝脏细胞特征。本公开的其他特征和优点将在随后的具体实施方式部分予以详细说明。附图说明附图是用来提供对本公开的进一步理解,并且构成说明书的一部分,与下面的具体实施方式一起用于解释本公开,但并不构成对本公开的限制。在附图中:图1是肝脏细胞成熟标记物白蛋白(albumin)细胞染色;图2是肝脏细胞成熟标记物白蛋白(albumin)分泌量和不成熟标记物甲胎蛋白(afp)分泌量;图3是多种肝脏细胞成熟标记物mrna表达水平;图4是体外培养不同天数后,肝脏细胞的细胞形态;图5是体外培养不同天数后,肝脏细胞成熟标记物白蛋白(albumin)细胞染色;图6是体外培养7天数后,肝脏细胞成熟标记物白蛋白(albumin)分泌量;图7是体外培养7天数后,多种肝脏细胞成熟标记物mrna表达水平。具体实施方式以下结合附图对本公开的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本公开,并不用于限制本公开。本公开的第一个方面提供组蛋白去乙酰化酶抑制剂在细胞培养中的用途,其中,所述用途为多能干细胞向肝脏细胞的体外定向分化培养或原代肝脏细胞体外培养,其中所述组蛋白去乙酰化酶抑制剂为ci-994(4-乙酰氨基-n-(2-氨基苯基)苯甲酰胺,tacedinaline,cas号:112522-64-2)、ms-275(entinostat,cas号:209783-80-2)、fk228(romidepsin,cas-号:128517-07-7)。在本公开的一种优选的实施方式中,所述用途为4-乙酰氨基-n-(2-氨基苯基)苯甲酰胺(ci-994)细胞培养中的用途。当所述组蛋白去乙酰化酶抑制剂为4-乙酰氨基-n-(2-氨基苯基)苯甲酰胺(ci-994)时,诱导获得的干细胞的成熟性更高、细胞纯度高,原代肝细胞体外培养后肝脏特征保持效果好。其中,所述多能干细胞为具有自我更新、自我复制能力的多潜能细胞,在本公开中,所述多能干细胞可以为任何具有向干细胞方向分化能力的干细胞,其来源可以为从动物体直接分离的多能干细胞,也可以为通过诱导方法所获得的诱导多能干细胞。可选的,所述用途为多能干细胞向肝脏细胞的体外定向分化培养,包括在诱导不成熟肝脏细胞向成熟肝脏细胞分化的培养基中添加浓度为5-10μmol/l的组蛋白去乙酰化酶抑制剂,特别优选的,所述组蛋白去乙酰化酶抑制剂的浓度为8-10μmol/l。在本公开中,所述不成熟肝脏细胞的概念为本领域技术人员所公知,是指多能干细胞向肝脏细胞定向分化过程中的一个阶段,即由肝脏祖细胞进一步分化而来但是还没有完全发育为成熟肝脏细胞的细胞分化阶段。以胚胎肝脏细胞发育为例,所述不成熟肝脏细胞可以对应为胎儿肝脏(fetalliver)。所述不成熟肝脏细胞为甲胎蛋白(afp)高表达、白蛋白(albumin)低表达或不表达特征的细胞;诱导获得的成熟肝脏细胞为具有甲胎蛋白低表达,白蛋白(albumin)、抗去唾液酸糖蛋白受体(asgpr)等高表达特征的细胞。本公开中,对于诱导多能干细胞向肝脏细胞定向分化的方法和所使用的试剂没有特别的限制,可以为本领域常规使用的方法和试剂,只要在诱导不成熟肝脏细胞向成熟肝脏细胞分化的培养基中添加组蛋白去乙酰化酶抑制剂即可。可选的,可以为二维或三维培养体系定向分化方法。在本公开的一种具体的实施方式中,所述用途包括以下步骤:(1)将多能干细胞在含有激活素a和/或p13k抑制剂的第一诱导培养基中培养3-4天获得内胚层细胞,其中第一诱导培养基具体组成成分包括以rpmi-1640为基础培养基,添加0.8-1.2%的b27补充物、80-120ng/ml激活素a和4-6μm的p13k抑制剂;(2)将所述内胚层细胞在含有骨形态发生蛋白4或成纤维生长因子2的第二诱导培养基中培养5天获得肝脏祖细胞,其中第二诱导培养基具体组成为包括以rpmi-1640为基础培养基,添加0.8-1.2%的b27补充物、16-24ng/ml的骨形态发生蛋白4、4-6ng/ml的成纤维生长因子2和0.4-0.6%二甲基亚砜;(3)将所述肝脏祖细胞在含有肝细胞生长因子的第三诱导培养基中培养5天获得不成熟肝脏细胞,其中第三诱导培养基具体组成成分包括以rpmi-1640为基础培养基,添加0.8-1.2%b27补充物、16-24ng/ml肝细胞生长因子和0.4-0.6%二甲基亚砜;(4)将所述不成熟肝脏细胞在含有5-10μmol/l的组蛋白去乙酰化酶抑制剂以及制瘤素m、肝细胞生长因子和地塞米松的第四诱导培养基中培养10-15天获得肝脏细胞,其中第四诱导培养基具体组成成分包括以肝脏培养基为基础培养基,添加16-24ng/ml肝细胞生长因子、16-24ng/ml制瘤素m、80-120nm地塞米松、0.4-0.6%二甲基亚砜和5-10μmol/l的组蛋白去乙酰化酶抑制剂。其中,所述肝脏培养基,可以为本领域常规使用的用于肝脏细胞培养的培养基、用于将不成熟肝脏细胞定向分化培养为成熟肝脏细胞的培养基。可以通过购买商品化产品的方式获得,或者配制获得。值得注意的是,针对不同来源的多能干细胞株,所述组蛋白去乙酰化酶抑制剂的最适用量可能存在一定的差异,可以根据细胞标记物变化整体分析确定最适用量,而这样的调整应被视为没有脱离本公开的保护范围。在本公开的一种实施方式中,所述用途为原代肝脏细胞体外培养,包括在含有工作浓度为5-10μmol/l的组蛋白去乙酰化酶抑制剂的原代肝脏细胞体外培养基中进行原代肝脏细胞体外培养;优选的,组蛋白去乙酰化酶抑制剂的浓度为8-10μmol/l。其中,所述原代肝脏细胞的来源可以为通过直接胶原酶灌注消化动物肝脏组织或者通过商业服务机构购买获得的原代肝脏细胞。本方法对于原代肝脏细胞培养方法和培养基的组成方式没有特别的限制,可以按照本领域常规的肝脏原代细胞培养方法进行,可以理解的是,只要在原代肝脏细胞的体外培养过程中的任何时间段添加组蛋白去乙酰化酶抑制剂即可在一定程度降低肝细胞特征的丢失和细胞形态变化;优选的,在整个原代肝脏细胞的培养过程中都添加组蛋白去乙酰化酶抑制剂。在本公开的一种实施方式中,原代肝脏细胞体外培养的方法为:将获得的原代肝脏细胞接种在胶原酶预处理的培养板中,在原代肝脏细胞体外培养基中培养若干天,所述原代肝脏细胞体外培养基为基础原代肝脏培养基中添加5-10μmol/l的组蛋白去乙酰化酶抑制剂。本公开的第二个方面提供一种多能干细胞向肝脏细胞体外定向分化培养体系,其中,在诱导不成熟肝脏细胞向成熟肝脏细胞分化的培养基中添加浓度为5-10μmol/l的组蛋白去乙酰化酶抑制剂,所述组蛋白去乙酰化酶抑制剂为ci-994(tacedinaline,cas号:112522-64-2)、ms-275(entinostat,cas号:209783-80-2)、fk228(romidepsin,cas-号:128517-07-7)。优选的,所述组蛋白去乙酰化酶抑制剂为ci-994,添加浓度为5-10μmol/l。其中,所述不成熟肝脏细胞为甲胎蛋白(afp)高表达、白蛋白(albumin)低表达或不表达特征的细胞;诱导获得的成熟肝脏细胞为具有甲胎蛋白低表达,白蛋白(albumin)、抗去唾液酸糖蛋白受体(asgpr)等高表达特征的细胞。本公开中,对于诱导多能干细胞向肝脏细胞定向分化的方法和所使用的培养体系的种类没有特别的限制,可以为领域常规培养体系,只要在诱导不成熟肝脏细胞向成熟肝脏细胞分化的培养基中添加组蛋白去乙酰化酶抑制剂即可。可选的,可以为二维或三维培养体系定向分化培养体系。在本公开的一种优选的实施方式中,所述培养体系包括:第一诱导培养基:以rpmi-1640为基础培养基,添加0.8-1.2%的b27补充物、80-120ng/ml激活素a和4-6μm的p13k抑制剂;第二诱导培养基,以rpmi-1640为基础培养基,添加0.8-1.2%的b27补充物、16-24ng/ml的骨形态发生蛋白4、4-6ng/ml的成纤维生长因子2和0.4-0.6%二甲基亚砜;第三诱导培养基,以rpmi-1640为基础培养基,添加0.8-1.2%b27补充物、16-24ng/ml肝细胞生长因子和0.4-0.6%二甲基亚砜;第四诱导培养基,以肝脏培养基为基础培养基,添加16-24ng/ml肝细胞生长因子、16-24ng/ml制瘤素m、80-120nm地塞米松、0.4-0.6%二甲基亚砜和5-10μmol/l的组蛋白去乙酰化酶抑制剂。本公开的第三个方面提供一种原代肝脏细胞体外培养基,其中,所述培养基含有浓度为5-10μmol/l的组蛋白去乙酰化酶抑制剂。在本公开的一种具体的实施方式中,所述培养基为基础原代肝脏培养基(购自gibco,货号17705-021)中添加5-10μmol/l的ci-994、ms-275或fk228。优选的,所述组蛋白去乙酰化酶抑制剂为4-乙酰氨基-n-(2-氨基苯基)苯甲酰胺,添加浓度为8-10μmol/l。实施例以下将通过实施例对本发明进行详细描述。以下实施例中,如无特别说明,所用的各试剂均可通过商购获得,所用的方法为本领域的常规方法。实施例1多能干细胞体外定向分化为肝脏细胞(1)将1016诱导性人多能干细胞在含有激活素a或p13k抑制剂的第一诱导培养基中培养3-4天获得内胚层细胞。第一诱导培养基具体组成为以rpmi-1640为基础培养基(购自invitrogen,货号11875093),添加1%的b27补充物(购自invitrogen,货号12587010)、100ng/ml激活素a(购自peprotech,货号af-120-14e)和5μm的p13k抑制剂(ly-294002,购自selleck,货号s1105);(2)将所述内胚层细胞在含有骨形态发生蛋白4或成纤维生长因子2的第二诱导培养基中培养5天获得肝脏祖细胞。第二诱导培养基具体组成为以rpmi-1640为基础培养基(购自invitrogen,货号11875093),添加1%的b27补充物(购自invitrogen,货号12587010)、20ng/ml的骨形态发生蛋白4(bmp4,购自peprotech,货号120-05)、5ng/ml的成纤维生长因子2(fgf2,购自peprotech,货号af-100-18b)和0.5%的二甲基亚砜(dmso);(3)将所述肝脏祖细胞在含有肝细胞生长因子的第三诱导培养基中培养5天获得不成熟肝脏细胞。第三诱导培养基具体组成为以rpmi-1640为基础培养基(购自invitrogen,货号11875093),添加1%的b27补充物(购自invitrogen,货号12587010)、20ng/ml的肝细胞生长因子(hgf,购自peprotech,货号100-39)和0.5%的二甲基亚砜(dmso)10mol/l的组蛋白去乙酰化酶抑制剂以及制瘤素m、肝细胞生长因子和地塞米松的第四诱导培养基中培养10-15天获得肝脏细胞。第四诱导培养基具体组成为以肝脏培养基为基础培养基(购自lonza,货号cc-3198),添加20ng/ml的肝细胞生长因子(hgf,购自peprotech,货号100-39)、20ng/ml的制瘤素m(oncostatinm,购自peprotech,货号300-10)、100nm的地塞米松(dexamethasone,购自sigma,货号d4902)、0.5%的二甲基亚砜(dmso)和10μmol/l的组蛋白去乙酰化酶抑制剂(ci-994,购自selleck,货号s2818)。定向诱导分化获得肝脏细胞1。实施例2利用实施例1的方法将1016诱导性人多能干细胞体外定向分化为肝脏细胞,区别仅在于,所述组蛋白去乙酰化酶抑制剂ci-994的用量为5μmol/l。获得肝脏细胞2。实施例3利用实施例1的方法诱导多能干细胞体外定向分化为肝脏细胞,区别仅在于,所述多能干细胞为hues9人胚胎多能干细胞,组蛋白去乙酰化酶抑制剂ci-994的用量为10μmol/l。获得肝脏细胞3。实施例4利用实施例1的方法将多能干细胞体外定向分化为肝脏细胞,区别仅在于,所述多能干细胞为hues9人胚胎多能干细胞,组蛋白去乙酰化酶抑制剂ci-994的用量为5μmol/l。获得肝脏细胞4。实施例5利用实施例1的方法将多能干细胞体外定向分化为肝脏细胞,区别仅在于,所述多能干细胞为bjrips人诱导性多能干细胞,组蛋白去乙酰化酶抑制剂ci-994的用量为10μmol/l。获得肝脏细胞5。实施例6利用实施例1的方法将多能干细胞体外定向分化为肝脏细胞,区别仅在于,所述多能干细胞为bjrips人诱导性多能干细胞,组蛋白去乙酰化酶抑制剂ci-994的用量为5μmol/l。获得肝脏细胞6。对比例1利用实施例1的方法将1016诱导性人多能干细胞体外定向分化为肝脏细胞,区别仅在于,所述组蛋白去乙酰化酶抑制剂替换为等量的dmso。获得肝脏细胞7。对比例2利用实施例1的方法将hues9人胚胎多能干细胞体外定向分化为肝脏细胞,区别仅在于,所述组蛋白去乙酰化酶抑制剂替换为等量的dmso。获得肝脏细胞8。对比例3利用实施例1的方法将bjrips人诱导性多能干细胞体外定向分化为肝脏细胞,区别仅在于,所述组蛋白去乙酰化酶抑制剂替换为等量的dmso。获得肝脏细胞9。测试例1本测试例用于检测上述肝脏细胞1-9的分化效果。(1)免疫荧光方法检测肝脏细胞成熟标记物白蛋白(albumin)表达量对所述肝脏细胞1和7进行albumin免疫荧光染色,激光共聚焦显微镜下观察细胞的荧光强度。图1为肝脏细胞1和肝脏细胞7的免疫荧光染色结果,结果显示,利用本公开所提供的方法的肝脏细胞1的白蛋白细胞表达量显著增加。(2)利用酶联免疫吸附测定法(elisa)检测肝脏细胞成熟标记物白蛋白(albumin)分泌量和肝脏细胞不成熟标记物甲胎蛋白(afp)分泌量,并用细胞总的rna量进行细胞量的标准化,结果显示为与相对应的对照组相比的倍数变化,如表1和图2所示。表1肝脏细胞albumin分泌量(倍数变化)afp分泌量(倍数变化)1016-ci-994-10μmol/l1.790.331016-ci-994-5μmol/l2.560.89hues9-ci-994-10μmol/l2.580.31hues9-ci-994-5μmol/l4.840.95bjrips-ci-994-10μmol/l1.890.67bjrips-ci-994-5μmol/l1.950.231016-dmso11hues9-dmso11bjrips-dmso11图2为肝脏细胞1和肝脏细胞7的检测结果,结果显示,相比于dmso处理组,利用本公开所提供的方法的肝脏细胞1的白蛋白细胞表达量显著增加,afp分泌量下降。(3)利用荧光定量pcr法检测多种肝脏细胞成熟标记物mrna表达水平,并用细胞18s表达水平进行标准化,结果显示为与相对应的对照组相比的倍数变化,如表2和图3所示。表2肝脏细胞albafpa1atasgprcyp3a4glut2115.70.322.912.420.982.45220.10.902.572.310.992.3233.10.511.253.140.872.98410.10.982.122.780.892.8754.050.982.572.890.982.8963.970.582.782.741.033.12711111181111119111111图3为肝脏细胞1和肝脏细胞7的检测结果,结果显示,相比于dmso处理组,利用本公开所提供的方法的肝脏细胞多种肝脏细胞成熟标记物mrna表达水平显著上升(cyp3a4没有显著变化),肝脏细胞不成熟标记物甲胎蛋白(afp)表达量显著降低。当所述组蛋白去乙酰化酶抑制剂的用量为10μmol/l范围内时,对多能干细胞向肝脏细胞分化的促进效果更好。实施例7本实施例用于说明原代肝脏细胞的体外培养。(1)取8-10周的小鼠,用胶原酶灌流方法进行原代肝脏细胞分离;(2)将获得的原代肝脏细胞接种在胶原酶(购自sigma,货号为c3867-1vl)预处理的培养板中,接种密度为1×105/cm2;(3)在培养基中培养7天后进行收样观察。所述培养基为基础原代肝脏培养基(购自gibco,货号17705-021)中添加10μmol/l的组蛋白去乙酰化酶抑制剂。获得原代肝脏细胞1。实施例8利用实施例1的方法进行原代肝脏细胞的体外培养,区别仅在于,所述组蛋白去乙酰化酶抑制剂ci-994的用量为5μmol/l。获得原代肝脏细胞2。对比例4利用实施例1的方法进行原代肝脏细胞的体外培养,区别仅在于,所述组蛋白去乙酰化酶抑制剂替换为等量的dmso。获得原代肝脏细胞3。测试例2本测试例用于检测上述原代肝脏细胞1和2的培养效果。(1)镜检观察体外培养第3天、第5天、第7天原代肝脏细胞形态。图4为原代肝脏细胞1和原代肝脏细胞3的细胞形态,结果显示,利用本公开所提供的方法的原代肝脏细胞1的形态保持好,原代肝脏细胞3的形态呈现为扁平化、细胞边缘以及细胞核形态模糊等凋亡状态。(2)免疫荧光方法检测原代肝脏细胞培养第3天、第5天、第7天成熟标记物白蛋白(albumin)表达量。对所述原代肝脏细胞1和3进行albumin免疫荧光染色,激光共聚焦显微镜下观察细胞的荧光强度差异。图5为原代肝脏细胞1和原代肝脏细胞3的免疫荧光染色结果,结果显示,利用本公开所提供的方法的原代肝脏细胞1的白蛋白细胞表达量更高。(3)利用酶联免疫吸附测定法(elisa)检测肝脏细胞成熟标记物白蛋白(albumin)分泌量,并用细胞总的rna量进行细胞量的标准化,结果显示为与相对应的对照组相比的倍数变化,如表3和图6所示。表3原代肝脏细胞albumin分泌量(倍数变化)12.7722.331图6为原代肝脏细胞1和肝脏细胞8的检测结果,结果显示,培养7天后,相比于dmso处理组,利用本公开所提供的方法的肝脏细胞1的白蛋白细胞表达量维持在较高水平。(3)为利用荧光定量pcr法检测多种肝脏细胞成熟标记物mrna表达水平,并用细胞18s表达水平进行标准化,结果显示为与相对应的对照组相比的倍数变化,如表4和图7所示。表4原代肝脏细胞albasgprapoa1apoa5apoc3arg1glut2ces1g18.917.63.418.13.94.32.612.225.613.63.115.22.53.52.19.8311111111图7为原代肝脏细胞1和原代肝脏细胞3的检测结果,结果显示,相比于dmso处理组,培养7天后,利用本公开所提供的方法的原代肝脏细胞多种肝脏细胞成熟标记物mrna表达水平维持在较高水平。当所述组蛋白去乙酰化酶抑制剂的用量为10μmol/l时,对原代肝脏细胞体外培养过程中肝脏细胞特征保持的效果更好。以上结合附图详细描述了本公开的优选实施方式,但是,本公开并不限于上述实施方式中的具体细节,在本公开的技术构思范围内,可以对本公开的技术方案进行多种简单变型,这些简单变型均属于本公开的保护范围。另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本公开对各种可能的组合方式不再另行说明。此外,本公开的各种不同的实施方式之间也可以进行任意组合,只要其不违背本公开的思想,其同样应当视为本公开所公开的内容。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种含有组氨酸去乙酰化酶抑制剂衍生物的抗肿瘤药物的制造方法与工艺
- 氨甲酰基吡啶酮HIV整合酶抑制剂的方法和中间体与流程
- 氨甲酰基吡啶酮HIV整合酶抑制剂的方法和中间体与流程
- 一类组蛋白去乙酰化酶抑制剂及其制备方法和用途与流程
- 组蛋白去乙酰化酶抑制剂于改变蜂王浆中MRJP3蛋白质的新颖用途的制造方法与工艺
- 用于治疗疾病的硫酸乙酰肝素生物合成抑制剂的制造方法与工艺
- 酚氧类氮氧化物作为去乙酰化酶抑制剂的抗肿瘤应用的制造方法与工艺
- 作为NADPH氧化酶抑制剂的酰氨基噻二唑衍生物的制造方法与工艺
- 利用组蛋白脱乙酰酶抑制剂治疗白血病的制造方法与工艺
- 组蛋白去乙酰化酶HDAC6的抑制剂在制备防治急性肾损伤药物中的用途的制造方法与工艺
- 含有色氨酸基本骨架的邻苯二胺类选择性组蛋白去乙酰化酶抑制剂及其制备方法和应用
- 一种生产贝利司他中间体的工艺方法
- 组蛋白去乙酰化酶抑制剂治疗β亚科疱疹病毒的新用图
- 一种含有苯甘氨酸的肉桂酰胺类组蛋白去乙酰化酶抑制剂及其制备方法和应用
- 2-(1-(4-氯苯甲酰基)-5-甲氧基-2-甲基-1氢-吲哚-3-基)-n-羟基乙酰胺作为组蛋白去 ...的制作方法
- Hif羟化酶抑制剂的药物制剂的制作方法
- 一种组蛋白去乙酰酶抑制剂2-(1-(4-氯苯甲酰基)-5-甲氧基-2-甲基-1氢-吲哚-3-基-n ...的制作方法
- 一种组蛋白去乙酰酶抑制剂(e)-3-(2-(1-(4-氯苯甲酰基)-5-甲氧基-2-甲基-1氢-吲哚 ...的制作方法
- 广谱的去乙酰化酶抑制剂及其应用
- 广谱的去乙酰化酶抑制剂乙酰化赖氨酸及其应用
- 一种制备自噬小体型瘤苗的培养基添加剂及其制备方法与制造工艺
- N-萘烷基取代的含氮杂环衍生物、制备方法及其抗肿瘤用途与制造工艺
- 作为BET蛋白抑制剂的1H‑吡咯并[2,3‑c]吡啶‑7(6H)‑酮和吡唑并[3,4‑c]吡啶‑7(6H)‑酮的制造方法与工艺
- 一种人肿瘤抑制蛋白变体及其应用的制造方法与工艺
- 一种人肿瘤抑制蛋白变体及其应用的制造方法与工艺
- G蛋白信号调节因子6及其抑制剂在治疗脂肪肝和Ⅱ型糖尿病中的功能和应用的制造方法与工艺
- 蛋白酶体抑制剂在制备降低动物脂含量或脂储积能力产品中的应用的制造方法与工艺
- GINS2基因或蛋白的抑制剂在制备抗肿瘤药物中的应用的制造方法与工艺
- ZNF383蛋白在制备抑制p53蛋白活性的产品中的应用的制造方法与工艺
- 蛋白酶体抑制剂MLN9708的合成方法与制造工艺