N-萘烷基取代的含氮杂环衍生物、制备方法及其抗肿瘤用途与流程
本发明涉及制药领域,具体涉及N-萘烷基取代的含氮杂环衍生物、其制备方法及其在预防或治疗肿瘤疾病药物中的应用。
背景技术:
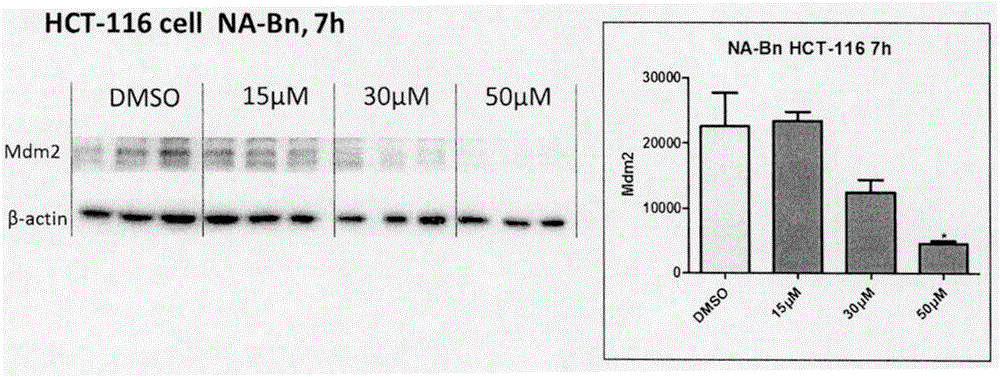
:癌症是全世界严重关切的公共健康问题,也是尚未攻克的人类健康的最大威胁之一。肿瘤的发生是以细胞自身对调节细胞生长、分化、功能及凋亡等信号的错误应答为特征的。目前,在临床上使用的抗肿瘤药物包括细胞毒类药物、激酶抑制剂、蛋白酶体抑制剂、HDAC抑制剂和hedgehog抑制剂等。Mdm2是一个泛素连接酶,其至关重要的功能是对p53进行多聚泛素化,促进其进入蛋白酶体降解。p53被称为细胞的“基因卫士”,正常细胞中p53基因维持稳定的低转录水平,且细胞中浓度低到几乎难以检测,其主要原因是Mdm2对p53的泛素化降解作用和转录功能抑制作用(CellDeathDiffer.2010,17(1):86-92)。细胞受到DNA损伤、原癌因子的激活、活性氧的刺激、营养匮乏等压力刺激时,p53将被激活,稳定且激活的p53就可以招募一些辅转录因子结合到DNA的特定区域内转录调控下游基因的表达,产生一系列的生物学效应,调控细胞的生长、衰老、凋亡和代谢。研究表明,许多肿瘤组织中Mdm2过表达,从而使得肿瘤细胞中p53蛋白的转录功能和水平都有很大程度的下降,进而减弱p53对肿瘤细胞的抑制作用(Curr.CancerDrugTargets2005,5,3-8)。此外,Mdm2还通过非p53依赖的途径而产生致癌作用(TrendsinBiochemicalSciences2009,34(6):279-286),例如,Mdm2可通过多聚泛素化导致抑癌因子Rb蛋白降解(Nature1995,375,694-698;EMBOJ.2005,24,160-169);Mdm2通过激活E2F1的转录功能进而促进细胞周期进程(Nature1995,375,691-694);Mdm2可促进抑癌因子p21的蛋白酶体降解(EMBOJ.2003,22,6365-6377)等。总之,Mdm2在调控细胞凋亡及细胞周期进程中发挥关键作用,是一个确证的致癌因子。因此,抑制Mdm2的功能有望成为肿瘤治疗的新途径。目前,基于Mdm2的抗肿瘤新药研究主要是研制Mdm2-p53蛋白-蛋白相互作 用抑制剂(Curr.Med.Chem.2014;21(5):553-74),且已有若干Mdm2-p53蛋白-蛋白相互作用抑制剂(如:AMG232、DS-3032b、MI-77301等)进入临床研究阶段。尽管Mdm2-p53蛋白-蛋白相互作用抑制剂在临床试验中显示了一定的抗肿瘤作用,但该类抑制剂具有明显的作用机制相关的局限性,例如,该类药物的疗效高度依赖p53的状态,因而对p53突变肿瘤(在50%以上的肿瘤中p53是突变或缺失的)疗效有限(CellCycle2011,10,1590-1598)。此外,Mdm2-p53蛋白-蛋白相互作用抑制剂可显著提高细胞中Mdm2的表达(Mdm2是p53的靶基因,p53水平的升高反而会促进Mdm2的表达),并通过抑制Mdm2的自身泛素化降解而增加Mdm2的稳定性,其结果是负反馈地增强了Mdm2的致癌效应,并因此而可能产生药物抵抗(CellCycle2011,10,1590-1598)。近年来,去泛素化酶USP7作为抗肿瘤新靶标受到了关注。USP7可通过对Mdm2去泛素化而抑制Mdm2的泛素化降解,从而提高其稳定性(MolCell.2004,26;13(6):879-86)。研究表明,USP7在前列腺癌和多发性骨髓瘤等肿瘤中过表达(Nature2008,455,813-818;CancerCell2012,22,345-358)。USP7抑制剂可以有效降低细胞中Mdm2的含量,并通过p53依赖和非p53依赖的途径发挥抑制肿瘤的作用(CancerCell2012,22,345-358;CellDeathandDisease2013,4,e867;NatCellBiol.2006,8(10):1064-73;Nature2008,455,813-818)。目前在研的USP7抑制剂种类较少,且选择性较差(中国药物化学杂志2013,23,486-492)。此外,现有USP7抑制剂与USP7的结合位点及作用方式也尚不清楚。代表性的USP7抑制剂包括P5091,其对多发性骨髓瘤具有显著的抑制作用(CancerCell2012,22,345-358)。综上所述,与Mdm2-p53蛋白-蛋白相互作用抑制剂相比,能够降低Mdm2稳定性进而降低其含量的药物在抗肿瘤疗效方面更具优势。技术实现要素:本发明人基于USP7底物结合域-Mdm2肽的蛋白共晶结构(PLoSBiol2006,4(2):e27),采用片段生成法,设计并合成了一系列新型化合物,通过抗肿瘤生物活性评价及作用机制研究,发现了一类具有全新结构的抗肿瘤活性化合物。该类化合物可显著降低肿瘤细胞中Mdm2的含量,且具有剂量依赖性。本发明公开了如 下式I所示的化合物或其药学上可接受的盐或溶剂化物:其中,K、M独自选自CH、N或CR4;L为CH、N或CR5;R1为H、NO2、卤素、CN、三氟甲基、Y-R8、COR9、COOR10、CONR11R12、SO2NR11R12、或非取代的或一个或多个取代的芳基或杂芳基;R2为H、NO2、卤素、CN、三氟甲基、甲酰基、CH(R6)XR7、COR9、COOR10、CONR11R12、1~12个碳的烷基、取代的烷基、非取代的或一个或多个取代的芳基或杂芳基R3、R6独自选自H、1~12个碳的烷基、取代的烷基、非取代的或一个或多个取代的芳基或杂芳基;n为0~2;R7为H、1~12个碳的烷基、取代的烷基、取代或非取代的苄基、非取代的或一个或多个取代的芳基或杂芳基;R4、R5独自选自H、卤素、甲酰基、COR9、COOR10、CONR11R12、1~12个碳的烷基、取代的烷基、取代或非取代的苄基、非取代的或一个或多个取代的芳基或杂芳基;或R5和R6与其他原子一起形成一个4~8元环;R8为H、COR9、SO2R13、1~12个碳的烷基、取代的烷基、取代或非取代的苄基、非取代的或一个或多个取代的芳基或杂芳基、取代或非取代的杂芳基甲基;R9、R10、R11、R12、R13独自选自H、1~12个碳的烷基、取代的烷基、取代或非取代的苄基、非取代的或一个或多个取代的芳基或杂芳基;X为NR14或O;Y为O、NR14、S、SO或SO2;R14独自选自H、1~12个碳的烷基、取代的烷基、非取代的或一个或多个取代的芳基或杂芳基。在本发明中,K优选CH或CR4;M优选N或CH;L优选CH或CR5;R1优选Y-R8、COR9、COOR10、CONR11R12、SO2NR11R12、或非取代的或一个或多个取代的芳基或杂芳基;R2优选CH(R6)XR7、1~12个碳的烷基、取代的烷基、非取代的或一个或多个取代的芳基或杂芳基R3、R6优选自H、1~12个碳的烷基、取代的烷基、非取代的或一个或多个取代的芳基或杂芳基;n优选0或1;R7优选H、1~12个碳的烷基、取代的烷基、取代或非取代的苄基、非取代的或一个或多个取代的芳基或杂芳基;R4、R5优选H、卤素、甲酰基、COR9、COOR10、CONR11R12、1~12个碳的烷基、取代的烷基、取代或非取代的苄基、非取代的或一个或多个取代的芳基或杂芳基;或R5和R6与其他原子一起形成一个4~8元环;R8优选H、1~12个碳的烷基、取代的烷基、取代或非取代的苄基、非取代的或一个或多个取代的芳基或杂芳基、取代或非取代的杂芳基甲基;R9、R10、R11、R12、R13优选1~12个碳的烷基、取代的烷基、取代或非取代的苄基、非取代的或一个或多个取代的芳基或杂芳基;X优选NR14或O;Y优选O、NR14、S、SO或SO2;R14优选H、1~12个碳的烷基、取代的烷基、非取代的或一个或多个取代的芳基或杂芳基。进一步地,本发明的优选化合物如下:本发明的另一目的是提供了该类化合物的合成方法.具体包括以下步骤:(1)将化合物I与R5-X在碱性条件下发生亲核取代反应制得化合物II-a,采用的碱性试剂选自碳酸钾、碳酸钠、碳酸铯、氢化钠,优选碳酸钾;采用的溶剂选自DMF、丙酮、乙腈,优选DMF;采用的反应时间为1-24小时;采用温度为零下20℃至120℃,优选60℃至100℃。(2)化合物II或II-a发生还原反应制得化合物III或III-3,采用的还原试剂选自硼氢化钠、硼氢化钾、四氢铝锂,优选硼氢化钠;采用的溶剂选自甲醇、乙醇、四氢呋喃,优选甲醇;采用的反应时间为0.5-10小时;采用温度为零下20℃至100℃,优选0℃至30℃。(3)化合物III或III-3与卤化试剂发生取代反应生成化合物IV或IV-a,采用的卤化试剂选自三溴化磷、液溴、四溴化碳、氯化亚枫,优选三溴化磷;采用的溶剂选自二氯甲烷、乙腈、乙醚,优选二氯甲烷;采用的反应时间为1-24小时;采用温度为零下20℃至60℃,优选0℃至25℃。(4)化合物IV或IV-a与含NH的杂环或芳杂环在碱性条件下发生亲核取代反应制得化合物V或V-a。采用的碱性试剂选自碳酸钾、碳酸钠、碳酸铯,优选碳酸钾;采用的溶剂为DMF、丙酮、乙腈,优选DMF;采用的反应时间为1-24小时;采用温度为零下20℃至120℃,优选60℃至120℃。(5)化合物VI-1发生还原反应制得化合物VI-1a,采用的还原试剂选自硼氢化钠、硼氢化钾、四氢铝锂,优选硼氢化钠;采用的溶剂选自甲醇、乙醇、四氢呋喃,优选甲醇;采用的反应时间为0.5-10小时;采用温度为零下20℃至100℃,优选0℃至30℃。(7)化合物VI-2发生还原胺化反应制得VI-2a,采用的还原试剂为硼氢化钠、氰基硼氢化钠、三乙酰氧基硼氢化钠,优选腈基硼氢化钠;采用的溶剂为甲醇、乙醇、二氯甲烷、四氢呋喃,优选甲醇;采用的反应时间为1-24小时;采用温度为零下20℃至100℃,优选25℃至50℃。(8)化合物VI-3在碱性条件下发生烷基化反应制得VI-3a,采用的碱性试剂选自甲醇钠、乙醇钠、叔丁醇钾;采用的溶剂为甲醇、乙醇、乙腈,优选甲醇;采用的反应时间为1-24小时;采用温度为零下20℃至120℃,优选20℃至80℃。具体的化合物制备方法参照实施例。本发明的又一目的是提供了化合物或药学上可接受的盐或溶剂化物在制备预防和治疗肿瘤的药物中的用途。药效学实验结果表明,本发明中化合物具有显著的抗肿瘤细胞增殖作用。下面是本发明的化合物的部分药理实验及结果。【1】体外细胞活性药理实验1.实验目的:采用CCK-8染色法测定各化合物对人结肠癌细胞HCT116体外增殖活性的影响,并计算各自的半数抑制浓度IC50。2.实验材料:本发明化合物用DMSO溶解配制成母液,使用前采用完全培养基稀释成适当浓度;试剂:CCK-8试剂盒购自南京建成生物科技有限公司;培 养基:改良型RMPI-1640培养基:购自Hyclone公司;类胎牛血清:购自Hyclone公司;96孔细胞培养板购自Costar公司。3.实验方法:取活细胞比例达90%以上的细胞进行实验。细胞增殖抑制试验采用EnoGeneCellTMCountingKit-8(CCK-8)细胞活力检测试剂盒。细胞消化、计数、制成浓度为3×104个/ml的细胞悬液,96孔板中每孔加入100μl细胞悬液(每孔3×103个细胞);96孔板置于37℃,5%CO2培养箱中培养24小时;用完全培养基稀释药物至所需浓度,每孔加入100μL相应的含药物的培养基,同时设立阴性对照组,溶媒对照组。每组5个复孔;96孔板置于37℃,5%CO2培养箱中培养72小时;每孔加入10μLCCK-8溶液,将培养板在培养箱内孵育3.5小时,用酶标仪测定在450nm处的OD值,计算不同浓度状态下的细胞抑制率并计算出IC50值。4.实验结果:本发明化合物对人结肠癌细胞HCT116细胞株体外增殖的抑制活性(IC50)见下表。化合物IC50(μM)化合物IC50(μM)化合物IC50(μM)化合物IC50(μM)I-19.906I-14>100I-30>100I-4518.85I-210.08I-1530~100I-3130~100I-46>100I-311.26I-1630~100I-3230~100I-478.495I-49.077I-17>100I-33>100P509112.21I-59.875I-18>100I-355.060I-611.57I-19>100I-37>100I-75.055I-20>100I-38>100I-811.03I-21>100I-39>100I-94.68I-22>100I-4030~100I-10>100I-23>100I-417.782I-1114.55I-24>100I-424.177I-1211.25I-2529.27I-4328.55I-1313.1I-277.799I-4430~100上述测试结果显示,本发明化合物对结肠癌细胞的生长具有不同程度的抑制作用。部分化合物显示了比阳性药P5091更强的抗肿瘤活性。该结果提示本发明化合物可以用于制备抗肿瘤药物。【2】正常细胞毒性药理实验用类似于肿瘤细胞抑制活性类似的方法,选用代表化合物I-1进行了正常细胞毒性的药理实验检测,实验结果如下:结果表明,代表化合物I-1具有对肿瘤细胞和正常细胞的选择性,同时其抗肿瘤活性具有一定的P53依赖性。【3】体外分子水平药理实验——肿瘤细胞Mdm2的水平测试(Westernblot)1.实验目的:采用Westernblot方法测定化合物对人结肠癌细胞HCT116中Mdm2含量的影响2.实验材料:本发明化合物用DMSO溶解配制成母液,使用前采用完全培养基稀释成适当浓度;试剂购自生兴生物公司;培养基:改良型RMPI-1640培养基:购自Hyclone公司;类胎牛血清:购自Hyclone公司;96孔细胞培养板购自Costar公司。3.实验方法:取活细胞比例达90%以上的细胞进行实验。细胞消化、计数、制成浓度为100000个/ml的细胞悬液,12孔板中每孔加入1000μl细胞悬液(每孔2×105个细胞);12孔板置于37℃,5%CO2培养箱中培养24小时贴壁,吸去上层培养基;用完全培养基稀释药物至所需浓度,每孔加入1000μL相应的含药物的培养基,同时设立阴性对照组,溶媒对照组。每组3个复孔;12孔板置于37℃,5%CO2培养箱中培养7小时,除去上层培养基;用PBS清洗细胞后使用细胞裂解液裂解细胞,提取蛋白;将HCT-116细胞用阳性药及化合物I-1作用,浓度选择0μM、15μM、30μM和50μM,相应时间后裂解细胞,用10%分离胶电泳。结果表明:随阳性药或化合物I-1浓度的升高,Mdm2的细胞水平显著降低(图1,2)。本发明所述的化合物及其组合物可用于制备抗肿瘤药物。所述肿瘤包括但不限于如下这些:骨癌,包括(例如):骨源性肉瘤(骨肉瘤)、纤维肉瘤、恶性纤维组织细胞瘤、软骨肉瘤、尤因氏肉瘤、恶性淋巴瘤(网状细胞肉瘤)、多发性骨髓瘤、恶性巨细胞瘤脊索瘤、骨软骨瘤(顾软管型外生骨疣)、良性软骨瘤、成软骨细胞 瘤、软骨及瘤样纤维瘤、骨样骨瘤和巨细胞瘤。血液科癌症,包括(例如):血液癌症,如急性骨髓性白血病、慢性骨髓性白血病、急性淋巴细胞系白血病、慢性淋巴细胞系白血病、骨髓增生性疾病、多发性骨髓瘤和骨髓增生异常综合征、霍奇金氏淋巴瘤(恶性淋巴瘤)和瓦尔登斯特伦巨球蛋白血症。神经系统癌症,包括(例如):头骨癌,如骨癌、血管瘤、肉芽瘤、黄瘤和畸形性骨炎;脑膜癌,如脑膜瘤、脑膜肉瘤和神经胶质瘤;脑癌,如星形细胞瘤、成神经管细胞瘤、神经胶质瘤、室管膜瘤、生殖细胞瘤(松果体瘤)、多形性成胶质细胞瘤、少突神经胶质细胞瘤、神经鞘瘤、成视网膜细胞瘤和先天性肿瘤;以及脊髓瘤,如纤维神经瘤、脑膜瘤、神经胶质瘤和肉瘤。胃肠瘤,包括(例如):食道癌症,如鳞状细胞癌、腺癌、平滑肌肉瘤和淋巴瘤;胃癌,如肿瘤、淋巴瘤和平滑肌肉瘤;胰腺癌,如导管腺癌、胰岛瘤、胰高血糖素瘤、胃泌素瘤、类癌瘤和血管活性肠肽瘤;小肠癌,如腺癌、淋巴瘤、类癌瘤、卡波济氏肉瘤、平滑肌瘤、血管瘤、脂肪瘤、纤维神经瘤和纤维瘤;大肠癌,如腺癌、小管腺癌、绒毛状腺瘤、错构瘤和平滑肌瘤。泌尿系统癌症,包括(例如):肾癌,如腺癌、维尔姆斯瘤(肾母细胞瘤)、淋巴瘤和白血病;膀胱和尿道癌,如鳞状细胞癌、移行细胞癌和腺癌;前列腺癌,如腺癌和肉瘤;睾丸癌,如精原细胞瘤、畸胎瘤、胚胎性癌、畸胎瘤、绒毛膜癌、肉瘤、间质细胞癌、纤维瘤、纤维腺瘤、腺瘤样瘤和脂肪瘤。肺癌,包括(例如):支气管癌,如鳞状细胞癌、未分化小细胞癌、未分化大细胞癌和腺癌;细支气管肺泡癌;支气管腺瘤;肉瘤;淋巴瘤;肺软骨瘤性错构瘤和间皮瘤。肝癌,包括(例如):肝细胞癌,如肝细胞癌;胆管癌;肝胚细胞瘤;血管肉瘤;肝细胞腺瘤和血管瘤。皮肤癌,包括(例如):恶性黑素瘤、基底细胞癌、鳞状细胞癌、卡波济氏肉瘤、发育异常性痣、脂肪瘤、血管瘤、皮肤纤维瘤、瘢痕瘤、银屑病。本发明还提供了一种预防和治疗肿瘤的药物组合物,其中含有治疗有效量的该化合物或其药学上可接受的盐或溶剂化物作为活性成份和药学上可接受的载体。所述药物组合物可以是普通片剂或胶囊、缓释片剂或胶囊、控释片剂或胶囊、 颗粒剂、散剂、糖浆剂、口服液、注射剂等制剂学上常规的制剂形式。本发明药物组合物中该化合物或其药学上可接受的盐或溶剂化物的剂量随症状和年龄等不同而不同。也可根据疾病程度的不同和剂型的不同而偏离此剂量范围。施用本发明所述化合物进行治疗或预防时,也可与现有治疗癌症的方法(例如,通过化疗、放疗或手术)组合施用。因此本发明还提供了一种治疗癌症的方法,包括向患者使用治疗有效量的根据该化合物或其可药用的盐形式或制剂的同时向患者施用治疗有效量的一种或多种其他的癌症化疗剂。对于任何具体的患者,具体的药物组合形式及具体的治疗有效剂量水平需根据多重因素而定,所述因素包括所治疗的肿瘤类型、特征和其恶性程度;所采用的具体化合物的活性;患者的年龄、体重、一般健康状况、性别和饮食;所采用的具体化合物的给药时间、给药途径和排泄率;治疗持续时间及医疗领域公知的类似因素。合适的化疗剂的例子包括但不限于以下这些:烷化剂:氮芥类,环磷酰胺、异环磷酰胺、美法仑、苯丁酸氮芥、苯达莫司汀、雌莫司汀;乙撑亚胺类,塞替哌、亚胺醌;磺酸酯及多元醇类,白消安、二溴甘露醇;亚硝基脲类,环己亚硝、卡氮芥、嘧啶亚硝脲、甲环亚硝脲;三氮烯咪唑类,甲氮咪胺;肼类,甲基苄肼。抗代谢药:嘧啶拮抗剂,氟尿嘧啶、阿糖胞苷、呋氟尿嘧啶、双呋氟尿嘧啶;嘌呤拮抗剂,巯嘌呤、磺巯嘌呤钠、硫唑嘌呤、硫鸟嘌呤;叶酸拮抗剂,甲氨蝶呤、氨蝶呤。抗肿瘤抗生素:丝裂霉素C、博来霉素、放线菌素D、光神霉素、柔红霉素、阿霉素、色霉素A3、恩霉素、新制癌素、抗癌霉素、素道霉素。植物类抗癌药:长春新碱、秋水仙碱、喜树碱、羟基喜树碱、斑蝥素、靛玉红。激素:肾上腺素皮质激素,泼尼松、氢化泼尼松、氢化可的松、地塞米松;雌激素,己烯雌酚、溴乙酰己烷雌酚;雄激素及同化激素,丙酸睾丸酮、甲睾酮、苯丙酸诺龙、萘氧啶、三苯氧胺。其他类型:顺氯氨铂、干扰素、左旋门冬酰胺酶、羟基脲、丙亚胺、丙咪腙、血卟啉;免疫制剂。附图说明图1显示阳性药p5091作用于HCT-116细胞时,细胞内Mdm2水平降低随药物浓度增加而降低;图2显示化合物I-1作用于HCT-116细胞时,细胞内Mdm2水平降低随药物浓度增加而降低;图3是化合物I-1的核磁氢谱;图4是化合物I-1的核磁碳谱。具体实施方式下面通过实施例具体说明本发明的内容。在本发明中,以下所述的实施例是为了更好的阐述本发明,并不是用来限制本发明的范围。实施例16-苄氧基-萘-2-醛(II)的制备将6-羟基-2-萘酚(150mg,0.87mmol)、碳酸钾(361mg,2.61mmol)加入干燥的DMF(3ml)中,室温下搅拌30分钟。向反应液中滴加2-氯-溴苄(223mg,155μl,1.31mmol)后,置于80℃油浴,搅拌至反应完全。加水淬灭反应,用乙酸乙酯萃取,合并有机层,饱和食盐水洗涤,无水硫酸钠干燥。蒸干后硅胶柱层析得目标化合物(200mg,收率87.5%)。1HNMR(300MHz,DMSO)δ10.06(s,1H),8.48(s,1H),8.07(d,J=9.0Hz,1H),7.92(d,J=8.6Hz,1H),7.83(d,J=8.5Hz,1H),7.55(s,1H),7.50(d,J=6.7Hz,2H),7.45-7.21(m,4H),5.25(s,2H).实施例2(6-苄氧基-萘-2-基)-甲醇(III)的制备将6-苄氧基-萘-2-醛(II)(200mg,0.76mmol)溶解于干燥甲醇(5ml)中,加入干燥硼氢化钠(43mg,1.14mmol),室温下搅拌2h至反应完全。将溶剂蒸干,用乙酸乙酯萃取,合并有机层,饱和食盐水洗涤,无水硫酸钠干燥。蒸干后硅胶柱层析得目标化合物III粗品,直接投入下步反应。(190mg,粗品收率94.3%)实施例32-苄氧基-6-溴甲基-萘(IV)的制备将(6-苄氧基-萘-2-基)-甲醇(III)(150mg,0.57mmol)溶于二氯甲烷(5ml)中,0℃冰浴下滴加三溴化磷的二氯甲烷溶液(384mg,135μl,1.42mmol/1ml),自然升温至室温搅拌4h。加水淬灭,二氯甲烷萃取,饱和食盐水洗涤,无水硫酸钠干燥。蒸干后硅胶柱层析得目标化合物V粗品,直接投入下步反应。(110mg,粗品收率59.2%)实施例41-[(6-苄氧基-萘-2-基)甲基]-1H-咪唑-2-甲醛(1)的制备将2-苄氧基-6-溴甲基-萘(100mg,0.31mmol)、碳酸钾(93mg,0.67mmol)、2-甲醛-咪唑(48mg,0.50mmol)溶于DMF,80℃下搅拌至反应完全,升至室温,加水淬灭,乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥。蒸干后硅胶柱层析得目标化合物1粗品,直接投入下步反应。(110mg,粗品收率94.35%)实施例51-{1-[(6-苄氧基萘-2-基)甲基]-1H-咪唑-2-基}-N-甲基甲胺(I-1)的制备将1-[(6-苄氧基-萘-2-基)甲基]-1H-咪唑-2-甲醛(100mg,0.29mmol)溶于干燥甲醇,加入甲胺醇溶液(0.5ml),加入过量干燥无水硫酸钠作为附水剂,室温搅拌过夜;滤去硫酸钠固体,反应液中加入干燥硼氢化钠固体(17mg,0.44mmol),室温搅拌至反应完全。将溶剂蒸干,用乙酸乙酯萃取,合并有机层,饱和食盐水洗涤,无水硫酸钠干燥。蒸干后硅胶柱层析得目标化合物I-1(90mg,收率86.2%)1HNMR(300MHz,DMSO)δ7.70(d,J=8.9Hz,2H),7.56-7.18(m,9H),7.03(s,1H),6.91(s,1H),5.36(s,2H),5.19(s,2H),3.85(s,2H),2.47(s,3H).13CNMR(75MHz,CDCl3)δ157.14,148.90,145.67,136.69,134.04,131.67,129.35,128.82,128.61,128.05,127.72,127.51,125.66,125.26,120.82,119.72,107.14,70.07,49.71,47.36.35.81.实施例61-{1-{[6-(2-氯苄氧基)萘-2-基]甲基}-1H-咪唑-2-基}-N-甲基甲胺(I-2)的制备反应步骤参照实施例1-5,得目标化合物I-2(65mg,收率62.50%)。1HNMR(300MHz,CDCl3)δ7.73(s,1H),7.70(s,1H),7.64-7.59(m,1H),7.46(s,1H),7.42(s,1H),7.29(s,3H),7.22(m,2H),7.02(s,1H),6.90(s,1H),5.34(s,2H),5.29(s,2H),3.82(s,2H),2.45(s,3H).13CNMR(75MHz,CDCl3)δ156.81,146.32,134.00,131.95,129.42,129.06,128.96,128.81,127.76,127.49,126.97,126.91,125.61,125.34,120.66,119.51,107.31,67.18,49.62,47.79,36.10.实施例71-{1-{[6-(3-甲氧基苄氧基)萘-2-基]甲基}-1H-咪唑-2-基}-N-甲基甲胺(I-3)的制备反应步骤参照实施例1-5,得目标化合物I-3(85mg,收率81.70%)。1HNMR(300MHz,CDCl3)δ7.71(s,1H),7.68(s,1H),7.45(s,1H),7.36-7.25(m,2H),7.21(s,2H),7.04(m,3H),6.96(s,H),6.84(s,H),5.33(s,2H),5.15(s,2H),3.80(s,3H)3.11(s,2H),2.44(s,3H).13CNMR(75MHz,CDCl3)δ159.88,157.08,146.32,138.32,134.02,131.84,129.66,129.34,128.86,127.70,127.48,125.63,125.29,120.66,119.66,113.51,113.01,107.22,69.94,55.22,49.62,47.77,36.09.实施例81-{1-{[6-(3-氯苄氧基)萘-2-基]甲基}-1H-咪唑-2-基}-N-甲基甲胺(I-4)的制备反应步骤参照实施例1-5,得目标化合物I-4(63mg,收率43.27%)。1HNMR(300MHz,CDCl3)δ7.69(d,J=8.6Hz,2H),7.47(d,J=8.8Hz,2H),7.40-7.06(m,6H),7.01(s,1H),6.89(s,1H),5.33(s,2H),5.14(s,2H),3.80(s,2H),2.43(s,3H).13CNMR(75MHz,CDCl3)δ157.22,146.69,139.23,134.98,134.38,132.43,130.29,129.89,129.38,128.57,128.12,127.95,127.84,126.06,125.80,125.77,121.09,119.94,107.65,69.61,50.03,48.20,36.50.实施例91-{1-{[6-(4-氟苄氧基)萘-2-基]甲基}-1H-咪唑-2-基}-N-甲基甲胺(I-5)的制备反应步骤参照实施例1-5,得目标化合物I-5(90mg,收率43.27%)。1HNMR(300MHz,CDCl3)δ7.70(d,J=8.3Hz,2H),7.45(s,2H),7.42(s.1H),7.26-7.16(m,3H),7.08(m,2H),7.02(s,1H),6.89(s,1H),5.33(s,2H),5.12(s,2H),3.81(s,2H), 2.44(s,3H).13CNMR(75MHz,CDCl3)δ164.17,160.90,156.95,146.35,133.99,131.95,129.41,129.29,127.68,127.48,125.64,125.36,120.65,119.60,115.64,115.36,107.20,69.39,49.60,47.79,36.10.实施例101-{1-{[6-(4-甲基苄氧基)萘-2-基]甲基}-1H-咪唑-2-基}-N-甲基甲胺(I-6)的制备反应步骤参照实施例1-5,得目标化合物I-6(67mg,收率58.44%)。1HNMR(300MHz,CDCl3)δ7.68(dd,J=8.4,4.6Hz,2H),7.45(s,1H),7.37(d,J=7.8Hz,2H),7.23(m,5H),7.01(s,1H),6.89(s,1H),5.32(s,2H),5.13(s,2H),3.80(s,2H),2.44(s,3H),2.37(s,3H).13CNMR(75MHz,CDCl3)δ157.63,146.76,143.78,138.26,134.47,134.10,132.18,129.71,129.23,128.10,128.06,127.90,126.05,125.67,121.07,120.18,107.58,70.45,50.06,48.21,36.52,21.57.实施例111-{1-{[6-(4-氯苄氧基)萘-2-基]甲基}-1H-咪唑-2-基}-N-甲基甲胺(I-7)的制备反应步骤参照实施例1-5,得目标化合物I-7(220mg,收率75.55%)。1HNMR(300MHz,CDCl3)δ7.70(d,J=8.3Hz,2H),7.46(s,1H),7.39(m,4H),7.21(m,3H),7.02(s,1H),6.90(s,1H),5.35(s,2H),5.15(s,2H),3.82(s,2H),2.45(s,3H).13CNMR(75MHz,CDCl3)δ156.85,146.23,135.23,133.96,133.85,131.96,129.44,128.92,128.77,128.65,127.69,127.52,125.64,125.37,120.68,119.55,107.23,69.28,49.62,47.74,36.06.实施例121-{1-{[6-(4-硝基苄氧基)萘-2-基]甲基}-1H-咪唑-2-基}-N-甲基甲胺(I-8)的制备反应步骤参照实施例1-5,得目标化合物I-8(60mg,收率55.81%)。1HNMR(300MHz,CDCl3)δ8.28(d,J=8.5Hz,2H),7.70(dd,J=19.8,8.8Hz,4H),7.32-7.11(m,4H),7.03(s,1H),6.91(s,1H),5.36(s,2H),5.30(s,2H),3.83(s,2H),2.45(s,3H).13CNMR(75MHz,CDCl3)δ148.64,146.74,136.48,134.76,132.28,130.34,130.21,130.06,129.80,128.27,128.10,126.45,123.32,122.65,121.94,117.18,109.91,71.32,52.24,50.13,38.57.实施例131-{1-{[6-(4-溴苄氧基)萘-2-基]甲基}-1H-咪唑-2-基}-N-甲基甲胺(I-9)的制备反应步骤参照实施例1-5,得目标化合物I-9(105mg,收率53.14%)。1HNMR(300MHz,CDCl3)δ7.68(d,J=8.6Hz,2H),7.52(d,J=8.1Hz,2H),7.45(s,1H),7.34(d,J=8.1Hz,2H),7.28-7.18(m,2H),7.17(s,1H),7.01(s,1H),6.85(d,J=17.8Hz,1H),5.33(s,2H),5.22-5.02(m,2H),3.75(d,J=33.2Hz,2H),2.43(s,3H).13CNMR(75MHz,CDCl3)δ157.25,146.71,136.18,134.37,132.43,132.15,129.87,129.48,129.35,128.10,127.96,126.06,125.80,122.37,121.08,119.96,107.67,69.72,50.03,48.22,36.50.实施例141-{1-{[6-(萘-2-基)萘-2-基]甲基}-1H-咪唑-2-基}-N-甲基甲胺(I-10)的制备反应步骤参照实施例1-5,得目标化合物I-10(50mg,收率65.57%)。1HNMR(300MHz,CDCl3)δ7.95(s,1H),7.87(m,3H),7.72(d,J=8.6Hz,2H),7.60(d,J=8.5Hz,1H),7.56-7.48(m,2H),7.47(s,1H),7.03(s,1H),6.90(s,1H),5.36(s,2H),5.34(s,2H),3.82(s,2H),2.45(s,3H).13CNMR(75MHz,CDCl3)δ157.16,146.28,134.20,134.04,133.32,133.12,131.82,129.39,128.89,128.43,127.93,127.73,127.65,127.47,126.37,126.27,126.11,125.65,125.30,125.24,120.67,119.71,107.32,61.62,49.64,47.70,36.06.实施例151-{1-[(6-异丁基氧基萘-2-基)甲基]-1H-咪唑-2-基}-N-甲基甲胺(I-11)的制备反应步骤参照实施例1-5,得目标化合物I-11(66mg,收率56.90%)。1HNMR(300MHz,CDCl3)δ7.69(t,J=8.2Hz,2H),7.47(d,J=11.2Hz,1H),7.27-7.08(m,2H),7.02(s,1H),6.90(s,1H),5.33(s,2H),3.85(d,J=6.5Hz,2H),3.81(s,2H),2.44(s,3H),2.20(dd,J=15.8,9.2Hz,1H),2.12(s,1H),1.08(d,J=6.7Hz,6H).13CNMR(75MHz,CDCl3)δ157.62,146.42,134.14,131.51,129.16,128.61,127.56,127.47,125.62,125.19,120.66,119.71,106.52,77.45,77.03,76.61,74.48,49.64,47.86,36.16,28.24,19.29.实施例161-[(6-苄氧基萘-2-基)甲基]-2-丙基-1H-咪唑(I-12)的制备反应步骤参照实施例1-4,得目标化合物I-12(60mg,收率53.47%)。1HNMR(300MHz,CDCl3)δ7.70(dd,J=8.6,5.1Hz,2H),7.52-7.13(m,9H),7.01(d,J=1.2Hz,1H),6.85(d,J=1.3Hz,1H),5.18(s,4H),2.67-2.59(m,2H),1.82-1.69(m,2H),0.95(t,J=7.4Hz,3H).13CNMR(75MHz,CDCl3)δ157.14,148.62,136.71,134.02,131.77,130.93,129.36,128.86,128.65,128.09,127.74,127.55,127.30,125.38,125.02,119.76,107.14,70.09,49.53,28.84,21.31,13.95.实施例171-[(6-苄氧基萘-2-基)甲基]-2-异丙基-1H-咪唑(I-13)的制备反应步骤参照实施例1-4,得目标化合物I-13(50mg,收率65.57%)。1HNMR(300MHz,CDCl3)δ7.69(dd,J=8.2,6.2Hz,2H),7.50-7.10(m,9H),7.03-6.77(m,2H),5.20(s,2H),5.17(s,2H),3.02(tt,J=13.5,6.9Hz,1H),1.28(d,J=6.8Hz,6H).13CNMR(75MHz,CDCl3)δ136.65,133.95,131.85,129.26,128.54,127.98,127.64,127.43,127.26,127.14,125.80,125.24,124.85,119.67,119.49,115.46,107.13,70.02,49.21,25.96,21.73.实施例181-[(6-苄氧基萘-2-基)甲基]-2-羟甲基-1H-咪唑(I-14)的制备将1-[(6-苄氧基-萘-2-基)甲基]-1H-咪唑-2-甲醛(100mg,0.29mmol)溶于干燥甲醇(5ml),加入干燥硼氢化钠固体(17mg,0.44mmol),室温搅拌至反应完全。将溶剂蒸干,用乙酸乙酯萃取,合并有机层,饱和食盐水洗涤,无水硫酸钠干燥。蒸干后可作为I-14粗品直接投入下步反应(160mg,粗品收率113.62%),硅胶柱层析可得到目标化合物纯品。1HNMR(300MHz,DMSO)δ7.78(dd,J=8.7,2.8Hz,1H),7.67(s,1H),7.50(d,J=6.9Hz,1H),7.46-7.29(m,2H),7.24(dd,J=9.0,2.4Hz,0H),7.16(s,0H),6.85(s,0H),5.74(s,1H),5.37(s,2H),5.21(s,2H),4.51(s,2H).13CNMR(75MHz,DMSO)δ156.88,147.59,137.31,134.03,133.11,129.71,128.83,128.74,128.27,128.17,127.62,126.91,126.49,126.35,121.47,119.60,107.64,69.74,56.09,49.19.实施例191-[(6-甲氧基-萘-2-基)甲基]-1H-咪唑-2-甲醛(V-a)的制备参考实施列四,将6-甲氧基-2-溴甲基-萘、2-甲醛咪唑,碳酸钾加入干燥DMF中,80℃下搅拌至反应完全。加水淬灭反应,用乙酸乙酯萃取,合并有机层,饱和食盐水洗涤,无水硫酸钠干燥。蒸干后硅胶柱层析将目标化合物粗品V-a(500mg,粗品收率32.58%)。实施例20N-苄基-1-{1-[(6-甲氧基萘-2-基)甲基]-1H-咪唑-2-基}甲胺(I-15)的制备1-[(6-甲氧基-萘-2-基)甲基]-1H-咪唑-2-甲醛(100mg,0.38mmol)溶于干燥甲醇,滴加苄胺(44.26mg),加入过量干燥无水硫酸钠作为附水剂,室温搅拌过夜;滤去硫酸钠固体,反应液中加入干燥硼氢化钠固体(7.1mg),室温搅拌至反应完全。将溶剂蒸干,用乙酸乙酯萃取,合并有机层,饱和食盐水洗涤,无水硫酸钠干燥。蒸干后硅胶柱层析得目标化合物16(120mg,收率89.40%)1HNMR(300MHz,CDCl3)δ7.66(dd,J=14.4,8.7Hz,2H),7.39(s,1H),7.35-7.05(m,8H),7.01(s,1H),6.90(s,1H),5.29(s,2H),3.91(s,3H),3.84(s,2H),3.79(s,2H),3.46(m,1H).13CNMR(75MHz,CDCl3)δ157.97,146.46,139.83,134.07,131.72,129.28,128.70,128.55,128.36,128.22,127.58,127.44,127.11,127.01,125.71,125.35,120.72,119.32,105.72,55.31,53.45,49.65,45.31.实施例21N-甲基-1-{1-[(6-甲氧基萘-2-基)甲基]-1H-咪唑-2-基}甲胺(I-16)的制备反应步骤参照实施例20,得目标化合物17(80mg,收率75.72%)。1HNMR(300MHz,CDCl3)δ7.69(dd,J=12.6,8.7Hz,2H),7.44(s,1H),7.20(dd,J=8.5,1.3Hz,1H),7.16(dd,J=8.9,2.4Hz,1H),7.12(s,1H),7.00(s,1H),6.89(s,1H),5.33(s,2H),3.91(s,3H),3.80(s,2H),2.43(s,3H).13CNMR(75MHz,CDCl3)δ157.99,145.83,134.09,131.60,129.26,128.70,127.64,127.53,125.66,125.28,120.80,119.37,105.71,55.30,49.68,47.48,35.86.实施例22N-乙基-1-{1-[(6-甲氧基萘-2-基)甲基]-1H-咪唑-2-基}甲胺(I-17)的制备反应步骤参照实施例20,得目标化合物I-17(100mg,收率90.15%)。1HNMR(300MHz,CDCl3)δ7.69(dd,J=13.5,8.7Hz,2H),7.46(s,1H),7.29-7.10(m,3H),7.01(s,1H),6.90(s,1H),5.34(s,2H),3.92(s,3H),3.84(s,2H),2.66(q,J=7.1Hz,2H),1.08(t,J=7.1Hz,3H).13CNMR(75MHz,CDCl3)δ157.96,146.74,134.06,131.77,129.25,128.71,127.59,127.45,125.62,125.30,120.57,119.35,105.70,55.29,49.60,45.86,43.84,15.11.实施例23N-异丁基-1-{1-[(6-甲氧基萘-2-基)甲基]-1H-咪唑-2-基}甲胺(I-18)的制备反应步骤参照实施例20,得目标化合物I-18(86mg,收率70.81%)。1HNMR(300MHz,CDCl3)δ7.68(dd,J=12.7,8.8Hz,2H),7.45(s,1H),7.29-7.07(m,3H),6.99(s,1H),6.88(s,1H),5.35(s,2H),3.90(s,3H),3.83(s,2H),3.45(s,1H),2.42(d,J=6.7Hz,2H),1.70(dt,J=13.2,6.6Hz,1H),0.87(d,J=6.6Hz,6H).13CNMR(75MHz,CDCl3)δ157.96,146.50,134.07,131.75,129.24,128.71,127.59,127.35,125.68,125.36,120.70,119.33,105.71,77.45,77.03,76.60,57.62,55.29,49.66,46.22,28.26,20.58.实施例246-{[2-(甲氨基甲基)-1H-咪唑-1-基]甲基}萘-2-酚(I-19)的制备将化合物I-16(35mg)溶于2mlDCM中,于-20度加入三溴化磷(4M,2ml),完成后缓慢升至室温,室温搅拌3.5h,将反应液倒入冰水中,用碳酸氢钠中和至中性,EA∶THF=1∶1萃取,无水硫酸钠干燥,硅胶层析柱纯化的目标化合物I-19(32mg,收率91.4%)。1HNMR(300MHz,CDCl3)δ7.69(dd,J=12.6,8.7Hz,1H),7.44(s,0H),7.20(dd,J=8.5,1.3Hz,1H),7.16(dd,J=8.9,2.4Hz,0H),7.12(s,0H),7.00(s,1H),6.89(s,0H),5.33(s,1H),3.91(s,2H),3.80(s,1H),2.43(s,2H).实施例251-[(6-苄氧基萘-2-基)甲基]-3-(2-噻吩基)-1H-吡唑-5-甲酸乙酯(I-20)的制备反应步骤参照实施例1-4,得目标化合物I-20(20mg,收率27.9%)。1HNMR(300MHz,CDCl3)δ7.79-7.17(m,14H),7.08(s,1H),5.92(s,2H),5.17(s,2H),4.33(dd,J=13.9,6.9Hz,2H),1.36(t,J=6.9Hz,3H).13CNMR(75MHz,CDCl3)δ159.41,156.88,145.64,136.83,135.72,133.96,133.35,132.34,129.53,128.82,128.57,127.97,127.50,127.12,126.35,126.06,124.89,124.07,119.24,108.43,107.08,77.41,76.99,76.56,70.01,61.13,55.14,14.15.实施例261-[(6-苄氧基萘-2-基)甲基]-2,4,5-三溴-1H-咪唑(I-21)的制备反应步骤参照实施例1-4,得目标化合物I-21(35mg,收率41.56%)。1HNMR(300MHz,CDCl3)δ7.73(d,J=8.6Hz,2H),7.57-7.17(m,9H),5.34(s,2H),5.20(s,2H).13CNMR(75MHz,CDCl3)δ157.31,136.63,134.18,129.44,129.19,128.69,128.60,128.05,127.80,127.48,125.92,124.78,119.89,118.70,117.12,107.12,105.67,70.07,51.42.实施例271-[(6-苄氧基萘-2-基)甲基]-2-异丁基-1H-1,2,4-三氮唑-2-甲酸甲酯(I-22)的制备反应步骤参照实施例1-4,得目标化合物I-22(18mg,收率31.55%)。1HNMR(300MHz,CDCl3)δ8.10(s,1H),7.77(s,1H),7.73(d,J=4.1Hz,2H),7.53-7.29(m,7H),7.28(s,1H),7.24(s,1H),5.55(s,2H),5.20(s,2H),4.02(s,3H).13CNMR(75MHz,CDCl3)δ157.57,144.36,136.57,134.55,130.85,129.50,128.80,128.75,128.62,128.48,128.15,128.09,127.75,127.50,125.92,120.07,107.14,70.10,54.75,52.72.实施例281-[(6-苄氧基萘-2-基)甲基]-3,4,5-三溴-1H-吡唑(I-23)的制备反应步骤参照实施例1-4,得目标化合物I-23(47mg,收率55.82%)。1HNMR(300MHz,CDCl3)δ7.83-7.64(m,3H),7.56-7.31(m,6H),7.28-7.20(m,2H),5.49(s,2H),5.19(s,2H).13CNMR(75MHz,CDCl3)δ157.26,136.69,134.28,130.86,129.93, 129.52,128.72,128.60,128.29,128.04,127.64,127.50,126.92,125.72,119.71,116.26,107.12,70.06,56.08.实施例291-[(6-苄氧基萘-2-基)甲基]-3-(4-氯苯基)-1H-吡唑(I-24)的制备反应步骤参照实施例1-4,得目标化合物I-24(15mg,收率23.1%)。1HNMR(300MHz,CDCl3)δ7.75(m,4H),7.67(s,1H),7.50(d,J=7.2Hz,2H),7.41(m,7H),7.26(m,3H),6.56(d,J=2.2Hz,1H),5.48(s,2H),5.20(s,2H).13CNMR(75MHz,CDCl3)δ157.15,151.23,150.44,136.74,134.17,131.51,130.70,129.44,128.85,128.71,128.61,128.04,127.60,127.52,126.97,126.87,126.76,126.11,119.59,107.15,103.28,70.07,56.33.实施例301-[(6-苄氧基萘-2-基)甲基]-2-十二烷基-1H-咪唑(I-25)的制备反应步骤参照实施例1-4,得目标化合物I-25(30mg,收率41.9%)。1HNMR(300MHz,CDCl3)δ7.71(dd,J=8.5,5.2Hz,2H),7.53-7.31(m,7H),7.20(dd,J=19.7,5.9Hz,2H),7.03(s,1H),6.87(s,1H),5.19(s,4H),2.73-2.61(t,2H),1.72(m,J=7.6Hz,2H),1.29-1.20(m,16H),0.90(t,J=6.3Hz,3H).13CNMR(75MHz,CDCl3)δ157.14,148.78,136.70,134.00,132.13,131.74,130.86,129.31,128.81,128.60,128.04,127.70,127.49,127.24,125.38,124.99,119.72,107.13,77.40,76.98,76.56,70.07,49.54,31.86,29.56,29.44,29.39,29.29,27.91,26.90,22.64,14.06.实施例311-{1-[(6-苄氧基萘-2-基)甲基]-2-丁基-4-甲酰基-5-氯-1H-咪唑(I-26)的制备反应步骤参照实施例1-4,得目标化合物I-26(收率41.9%)。1HNMR(300MHz,CDCl3)δ9.78(s,1H),7.68(dd,J=8.6,3.6Hz,2H),7.39(dq,J=19.1,7.1Hz,6H),7.19(dd,J=12.0,7.1Hz,3H),5.67(s,2H),5.17(s,2H),2.73-2.57(m,2H),1.67(dt,J=15.4,7.6Hz,2H),1.33(tt,J=11.4,5.7Hz,2H),0.86(t,J=7.3Hz,3H).13CNMR(75MHz,CDCl3)δ177.98,157.15,154.66,136.69,134.03,130.80,129.33,128.78,128.60,128.04,127.76,127.50,125.08,124.76,124.35,119.75,114.59,107.12,70.07,48.30, 29.18,26.56,22.36,13.58.实施例321-{1-[(6-苄氧基萘-2-基)甲基]-2-丙基-4-甲基-1H-咪唑(I-27)的制备反应步骤参照实施例1-4,得目标化合物I-27(收率48%)。1HNMR(300MHz,CDCl3)δ7.71(d,J=8.5Hz,2H),7.50(d,J=7.2Hz,2H),7.41(dd,J=13.0,5.5Hz,4H),7.26(d,J=11.0Hz,2H),7.18(d,J=8.4Hz,1H),6.56(s,1H),5.19(s,2H),5.11(s,2H),2.73-2.61(m,2H),2.23(s,3H),1.30(d,J=7.5Hz,3H).13CNMR(75MHz,CDCl3)δ157.06,148.94,136.70,136.07,133.95,131.94,129.32,128.83,128.61,128.04,127.63,127.51,125.31,125.06,119.68,116.11,107.09,70.04,49.27,20.19,13.52,12.38.实施例331-[(6-苄氧基萘-2-基)甲基]-2-丙基-1H-咪唑-4,5-二甲酸二乙酯(I-28)的制备反应步骤参照实施例1-4,得目标化合物I-28(23mg,收率30%)。1HNMR(300MHz,CDCl3)δ7.68(dd,J=8.6,4.0Hz,2H),7.40(ddd,J=19.4,16.6,7.2Hz,6H),7.24(dd,J=8.9,2.4Hz,1H),7.21(s,1H),7.14(dd,J=8.5,1.6Hz,1H),5.53(s,2H),5.18(s,2H),4.44-4.35(m,2H),4.22(q,J=7.1Hz,2H),2.74-2.64(m,2H),1.74(dd,J=15.3,7.6Hz,2H),1.40(t,J=7.1Hz,3H),1.18(t,J=7.1Hz,3H),0.93(t,J=7.4Hz,3H).13CNMR(75MHz,CDCl3)δ163.04,160.60,157.11,151.82,136.69,133.96,130.98,129.34,128.77,128.59,128.03,127.69,127.50,124.82,124.53,119.71,107.10,70.05,61.20,48.32,29.12,21.24,14.25,13.83.实施例341-[(6-苄氧基萘-2-基)甲基]-4-甲基-5-甲酰基-1H-咪唑(I-29)的制备反应步骤参照实施例1-4,得目标化合物I-29(收率42%)。1HNMR(300MHz,CDCl3)δ9.86(s,1H),7.72(dd,J=8.6,4.0Hz,2H),7.61(d,J=4.7Hz,2H),7.49(d,J=7.0Hz,2H),7.46-7.28(m,4H),7.27-7.18(m,2H),5.60(s,2H),5.19(s,2H),2.53(s,3H).13CNMR(75MHz,CDCl3)δ178.68,157.19,153.61,144.13,143.22,142.10,142.05,136.67,134.17,130.94,129.46,128.79,128.61,128.04,127.66,127.51,126.69,125.81,119.70,107.06,70.03,50.45,13.34.实施例351-[(6-苄氧基萘-2-基)甲基]-1H-咪唑-4-甲酸乙酯(I-30)的制备反应步骤参照实施例1-4,得目标化合物I-30(40mg,收率67.74%)。1HNMR(300MHz,CDCl3)δ7.82(s,1H),7.76-7.66(m,3H),7.53-7.19(m,8H),5.65(s,2H),5.19(s,2H),4.29(dd,J=14.1,7.1Hz,2H),1.37-1.30(m,3H).13CNMR(75MHz,CDCl3)δ160.27,157.15,142.13,137.92,136.71,134.10,131.39,129.42,128.83,128.59,128.01,127.61,127.48,126.27,125.61,122.75,119.64,107.12,70.05,60.46,50.15,14.20.实施例361-[(6-苄氧基萘-2-基)甲基]-2,3-二氰基-1H-咪唑(I-31)的制备反应步骤参照实施例1-4,得目标化合物I-31(17mg,收率30.53%)。1HNMR(300MHz,DMSO)δ8.55(s,1H),7.89-7.77(m,3H),7.53-7.25(m,8H),5.60(s,2H),5.23(s,2H).13CNMR(75MHz,DMSO)δ157.32,144.06,137.25,134.49,131.93,130.01,129.94,129.09,128.89,128.61,128.34,128.23,128.14,127.48,126.30,119.97,112.82,108.92,107.76,69.81,51.28.实施例371-[(6-苄氧基萘-2-基)甲基]-2-苯基-1H-咪唑(I-32)的制备反应步骤参照实施例1-4,得目标化合物I-32(10mg,收率16.8%)。1HNMR(300MHz,CDCl3)δ7.71(t,J=8.7Hz,2H),7.60(dd,J=6.3,2.7Hz,2H),7.55-7.28(m,10H),7.21(m,3H),7.02(s,1H),5.35(s,2H),5.20(s,2H).13CNMR(75MHz,CDCl3)δ157.15,148.27,136.71,133.99,132.17,131.92,130.57,129.38,128.97,128.89,128.81,128.62,128.55,128.05,127.75,127.50,125.34,124.92,121.30,119.73,107.16,70.08,50.47.实施例381-[(6-苄氧基萘-2-基)甲基]-2-硝基-1H-咪唑(I-33)的制备反应步骤参照实施例1-4,得目标化合物I-33(20mg,收率36.42%)。1HNMR(300MHz,CDCl3)δ7.74(dd,J=8.6,3.2Hz,2H),7.62(s,1H),7.57-7.32(m,5H),7.29(dd,J=8.6,2.2Hz,2H),7.23(d,J=2.0Hz,1H),7.18(s,1H),7.09(s,1H),5.72(s,2H),5.20(s,2H).13CNMR(75MHz,CDCl3)δ157.50,136.58,134.43,130.86,129.49,129.22,128.75,128.62,128.41,128.07,127.50,127.13,125.73,125.60,120.03,114.57,107.13,70.09,53.55.实施例391-[(6-苄氧基萘-2-基)甲基]-2-甲酰基-1H-吡咯(I-34)的制备反应步骤参照实施例1-4,得目标化合物I-34(收率52.3%)。1HNMR(300MHz,CDCl3)δ9.59(d,J=0.8Hz,1H),7.73-7.64(m,2H),7.57-7.46(m,3H),7.46-7.28(m,4H),7.25-7.17(m,2H),7.04-6.95(m,2H),6.32-6.23(m,1H),5.70(s,2H),5.18(s,2H).13CNMR(75MHz,DMSO)δ179.95,156.79,137.34,134.11,133.94,132.77,131.52,130.07,129.71,128.86,128.72,128.64,128.30,128.21,127.50,126.17,125.82,124.83,119.56,110.43,107.66,69.75,51.31.实施例401-{1-[(6-苄氧基萘-2-基)甲基]-1H-吡咯-2-基}-N-甲基甲胺(I-35)的制备反应步骤参照实施例5,得目标化合物I-35(收率74%)。1HNMR(300MHz,CDCl3)δ7.67(d,J=8.5Hz,2H),7.49(d,J=7.1Hz,1H),7.40(dd,J=18.2,8.4Hz,4H),7.19(dd,J=18.5,9.5Hz,3H),6.73(s,1H),6.27(s,1H),6.15(s,1H),5.37(s,2H),5.18(s,2H),4.40-4.25(m,1H),3.76(s,2H),2.40(s,3H).13CNMR(75MHz,CDCl3)δ156.91,136.76,133.84,133.39,129.33,128.90,128.57,127.98,127.49,126.66,125.10,125.02,123.36,119.46,110.99,107.46,107.10,70.02,50.77,45.59,33.74.实施例411-[(6-苄氧基萘-2-基)甲基]-4-甲酰基-1H-咪唑(I-36)的制备反应步骤参照实施例1-4,得目标化合物I-36(收率30%)。1HNMR(300MHz,CDCl3)δ9.87(s,1H),7.77-7.68(m,2H),7.68-7.57(m,3H),7.48(d,J=7.1Hz,2H),7.45-7.31(m,3H),7.29(d,J=2.4Hz,1H),7.23(dd,J=5.7,2.1Hz,2H),5.27(s,2H), 5.18(s,2H).13CNMR(75MHz,CDCl3)δ186.17,157.52,138.82,136.54,134.43,130.89,129.53,129.42,129.42,128.81,128.64,128.64,128.22,128.22,128.11,128.11,127.53,127.53,126.96,125.45,124.60,120.13,107.12,70.09,51.68.实施例421-{1-[(1-溴代萘-2-基)甲基]-1H-咪唑-2-基}-N-甲基甲胺(I-37)的制备反应步骤参照实施例2-5。得目标化合物I-37(收率85.90%)。1HNMR(300MHz,CDCl3)δ8.34(d,J=8.4Hz,1H),7.77(2H),7.59(2H),7.04(s,1H),6.89(s,1H),6.80(d,J=8.4Hz,1H),5.53(s,2H),3.79(s,2H),2.43(s,3H).13CNMR(75MHz,CDCl3)δ146.73,133.96,133.91,132.18,128.43,128.18,127.92,127.86,127.13,126.93,124.70,122.64,120.67,50.49,47.88,36.20.实施例431-(6-甲氧基萘-2-基)-2-(2-异丙基-1H-咪唑-1-基)-乙醇(I-38)的制备a.反应步骤参照实施例4。得化合物2-(2-异丙基-1H-咪唑-1-基)-1-(6-甲氧基萘酚-2-基)-乙酮(收率47.07%)。b.将2-(2-异丙基-1H-咪唑-1-基)-1-(6-甲氧基萘酚-2-基)-乙酮(20mg,0.065mmol)溶于干燥甲醇(5ml),加入干燥硼氢化钠固体(5mg,0.13mmol),室温搅拌至反应完全。将溶剂蒸干,用乙酸乙酯萃取,合并有机层,饱和食盐水洗涤,无水硫酸钠干燥。蒸干后硅胶柱层析得目标化合物I-38(20mg,收率99.35%)。1HNMR(300MHz,CDCl3)δ7.78-7.66(m,3H),7.34(d,1H),7.21-7.10(m,2H),7.01(s,1H),6.92(5,1H),5.33(s,1H),5.10(s,2H),4.19(s,2H),2.97-2.88(m,1H),1.25(d,6H).实施例441-[1-(萘-1-基甲基)1H-咪唑-2-基]-N-甲基甲胺(I-39)的制备反应步骤参照实施例2-5。得目标化合物I-39(收率50.14%)。1HNMR(300MHz,CDCl3)δ7.94(s,2H),7.83(d,J=8.4Hz,1H),7.55(d,J=9.2Hz,2H),7.40(t,J=7.6Hz,1H),6.99(s,1H),6.90(d,J=7.1Hz,1H),6.78(s,1H),5.70(s,2H),3.83(s,2H),2.45(s,3H).13CNMR(75MHz,CDCl3)δ146.51,133.61,132.00,130.58,128.90,128.68,127.45,126.74,126.13,125.47,124.77,122.51,120.64.47.94,47.36,36.22.实施例451-{1-{[6-(吡啶-4-基甲氧基)萘-2-基]甲基]-1H-咪唑-2-基}-N-甲基甲胺(I-40)的制备反应步骤参照实施例1-5。得目标化合物I-40(收率25.89%)。1HNMR(300MHz,CDCl3)δ8.62(d,J=6.0Hz,2H),7.69(t,J=9.1Hz,2H),7.44(s,1H),7.39(d,2H),7.26-7.17(m,2H),7.13(d,1H),7.00(s,1H),6.89(s,1H),5.34(s,2H),5.19(s,2H),3.80(s,2H),2.43(s,3H).13CNMR(75MHz,CDCl3)δ150.02,146.11,145.88,133.86,132.16,129.62,129.03,127.70,127.56,127.53,125.62,125.46,121.46,120.72,119.33,107.24,68.17,49.60,47.66,36.02.实施例461-{1-{[6-(1,1-二苯基甲氧基)萘-2-基]甲基]-1H-咪唑-2-基}-N-甲基甲胺(I-41)的制备反应步骤参照实施例1-5。得目标化合物I-41(收率82.05%)。1HNMR(300MHz,CDCl3)δ7.66(d,J=9.0Hz,1H),7.58(d,J=8.5Hz,1H),7.47(d,J=7.1Hz,3H),7.41(s,1H),7.31(dddd,J=9.7,7.3,5.6,1.6Hz,7H),7.20(d,J=2.2Hz,1H),7.14(dd,J=6.7,1.8Hz,2H),7.00(s,1H),6.86(s,1H),6.36(s,1H),5.30(s,2H),3.79(s,2H),2.43(s,3H),2.19(s,2H).13CNMR(75MHz,CDCl3)δ156.30,146.08,140.98,133.85,131.80,129.26,128.79,128.63,128.41,128.10,127.81,127.76,127.67,127.49,126.85,125.89,125.52,125.12,120.67,120.08,109.40,81.86,49.61,47.65,36.00.实施例47(E)-1-{1-{[6-(肉桂氧基)萘-2-基]甲基}-1H-咪唑-2-基}-N-甲基甲胺(I-42)的制备反应步骤参照实施例1-5。得目标化合物I-42(收率48.04%)。1HNMR(300MHz,CDCl3)δ7.71(dd,J=8.6,5.2Hz,2H),7.45(d,J=11.1Hz,3H),7.38-7.21(m,5H),7.03(s,1H),6.91(s,1H),6.80(d,J=16.0Hz,1H),6.48(dt,J=16.0,5.7Hz,1H),5.30(s,2H),4.82(d,J=5.7Hz,2H),3.82(s,2H),2.45(s,3H).13CNMR(75MHz,CDCl3)δ134.02,133.22,131.79,129.34,128.80,128.57,127.93,127.66,126.55,125.62,125.28,124.11,120.67,119.62,107.05,68.67,49.62,47.79,36.09,29.65.实施例481-{1-[(6-苯磺酰氧基萘-2-基)甲基]-1H-咪唑-2-基}-N-甲基甲胺(I-43)的制备反应步骤参照实施例1-5。得目标化合物I-43(收率63.20%)。1HNMR(300MHz,CDCl3)δ7.76(d,J=7.5Hz,2H),7.65-7.55(m,3H),7.43(t,J=7.7Hz,2H),7.36(s,2H),7.19(d,J=5.8Hz,1H),7.00(dd,J=8.9,2.2Hz,1H),6.93(s,1H),6.80(s,1H),5.30(s,2H),3.70(s,2H),2.34(s,3H).13CNMR(75MHz,CDCl3)δ147.39,146.24,135.40,134.96,134.27,132.87,131.77,129.67,129.16,128.74,128.47,127.73,125.78,125.41,121.78,120.67,119.85,49.46,47.82,36.08.实施例491-{1-{[6-(1-苯甲酰基)甲氧基萘-2-基]甲基}-1H-咪唑-2-基}-N-甲基甲胺(I-44)的制备a.将6-羟基-萘-2-醛(I)(200mg,1.16mmol)溶解于干燥甲醇(5ml)中,加入干燥硼氢化钠(89mg,2.32mmol),室温下搅拌2h至反应完全。将溶剂蒸干,用乙酸乙酯萃取,合并有机层,饱和食盐水洗涤,无水硫酸钠干燥。蒸干后硅胶柱层析得6-羟甲基-2-萘酚粗品,直接投入下步反应。(200mg,粗品收率98.84%)b.将6-羟甲基-2-萘酚粗品(200mg,1.15mmol)、碳酸钾(317mg,2.3mmol)、1-溴苯乙酮(343mg,1.72mmol)溶于干燥DMF,80℃下搅拌至反应完全,升至室温,加水淬灭,乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥。蒸干后硅胶柱层析得2-[(6-羟甲基萘酚-2-基)氧基]-1-苯基-乙基酮粗品,直接投入下步反应。(304mg,粗品收率90.58%)c.将2-[(6-羟甲基萘酚-2-基)氧基]-1-苯基-乙基酮(300mg,1.03mmol),三苯基膦(808mg,3.08mmol)溶于干燥二氯甲烷中,0℃冰浴下滴加四溴化碳(1.02g,3.08mmol)的二氯甲烷溶液,自然升温至室温搅拌2h。加水淬灭,二氯甲烷萃取,饱和食盐水洗涤,无水硫酸钠干燥。蒸干后硅胶柱层析得2-[(6-溴甲基萘酚-2-基)氧基]-1-苯基-乙基酮粗品,直接投入下步反应。(142mg,粗品收率42.24%)d.反应步骤参照实施例4-5。得目标化合物I-44(收率48.04%)。1HNMR(300MHz,CDCl3)δ8.03(d,J=7.4Hz,2H),7.72-7.59(m,3H),7.51(t,J=7.6Hz,2H),7.38(s,1H),7.27(dd,J=8.9,2.3Hz,1H),7.12(dd,J=14.0,5.3Hz,2H),7.02(s,1H),6.81(s,1H),5.38(s,2H),5.20(s,2H),3.01(dq,J=20.5,6.9Hz,1H),1.26(d,J=6.8Hz, 6H).13CNMR(75MHz,DMSO)δ156.50,152.59,134.86,134.24,133.89,133.05,129.69,129.28,128.80,128.34,127.75,126.00,125.88,125.27,120.85,119.44,114.56,107.80,70.71,49.11,25.50,22.11.实施例501-{1-[(6-苄硫基萘-2-基)甲基]-1H-咪唑-2-基}-N-甲基甲胺(I-45)的制备a.6-溴-2-萘酸(500mg,1.99mmol)溶于20ml干燥甲醇中,滴加1ml浓硫酸,80℃下加热回流2h至反应完全。将溶剂蒸干,饱和NaHCO3中和后,用乙酸乙酯萃取,合并有机层,饱和食盐水洗涤,无水硫酸钠干燥。蒸干后硅胶柱层析得6-溴-2-萘酸甲酯粗品,直接投入下步反应。(520mg,粗品收率98.50%)b.将6-溴-2-萘酸甲酯(265mg,1mmol),二异丙基乙基胺(259mg,350μl,2mmol)溶于5ml无水二氧六环,滴加苯硫醇(248mg,235μl,2mmol)后,加入Pd2(dba)3(46mg,5%),Xantphos(58mg,5%),在氩气保护下,105℃下加热回流16h至反应完全。将溶剂蒸干,用乙酸乙酯萃取,合并有机层,饱和食盐水洗涤,无水硫酸钠干燥。蒸干后硅胶柱层析得6-苄硫基-2-萘酸甲酯粗品,直接投入下步反应。(300mg,粗品收率97.32%)c.将6-苄硫基-2-萘酸甲酯(600mg,1.95mmol)溶于8ml干燥四氢呋喃中,0℃冰浴下加入四氢铝锂固体(148mg,3.89mmol),自然升温至室温搅拌2h。加水淬灭,二氯甲烷萃取,饱和食盐水洗涤,无水硫酸钠干燥。蒸干后硅胶柱层析得(6-苄硫基萘-2-基)甲醇粗品,直接投入下步反应。(337mg,粗品收率61.78%)d.将(6-苄硫基萘-2-基)甲醇(337mg,1.2mmol),三苯基膦(946mg,3.61mmol)溶于干燥二氯甲烷中,0℃冰浴下滴加四溴化碳(1.20g,3.61mmol)的二氯甲烷溶液,自然升温至室温搅拌2h。加水淬灭,二氯甲烷萃取,饱和食盐水洗涤,无水硫酸钠干燥。蒸干后硅胶柱层析得苄基[(6-溴甲基)萘2-基]硫醚粗品,直接投入下步反应。(270mg,粗品收率65.44%)e.反应步骤参照实施例3-5。得目标化合物I-45(收率71.98%)。1HNMR(300MHz,CDCl3)δ7.62-7.54(m,3H),7.32(m,2H),7.26-7.10(m,6H),6.94(s,1H),6.82(s,1H),5.27(s,2H),4.13(s,2H),3.72(s,2H),2.35(s,3H).13CNMR(75MHz,CDCl3)δ146.30,134.71,133.95,133.14,131.67,128.79,128.52,128.35,128.24,128.15,128.02,127.62,127.26,127.17,125.48,125.32,120.72,49.60,47.81,38.73,36.10.实施例511-[(6-苄氧基萘-2-基)甲基]-1H-吡咯-2-甲酸甲酯(I-46)的制备反应步骤参照实施例1-4。得目标化合物I-46(收率38.9%)。1HNMR(300MHz,CDCl3)δ7.80-7.66(m,3H),7.50-7.23(m,9H),7.04(dd,J=3.8,1.6Hz,1H),6.93(s,1H),5.69(s,2H),5.18(s,2H),3.78(s,3H).实施例523′-((6-(苄氧基)萘-2-基)甲基)-1,7′-二甲基-2′-丙基-1H,3′H-2,5′-而苯丙[d]咪唑(I-47)的制备反应步骤参照实施例1-4。得目标化合物I-47(收率47.0%)。1HNMR(300MHz,CDCl3)δ7.83-7.72(m,1H),7.70-7.59(m,2H),7.52-7.10(m,14H),5.50(s,2H),5.14(s,2H),3.65(s,3H),3.00-2.87(m,2H),2.78(s,3H),1.85(dt,J=14.9,7.5Hz,2H),1.03(t,J=7.3Hz,3H).实施例53药用组合物的制备:片剂将化合物I-1(1g)与乳糖(23g)和微晶纤维素(5.7g)用混合机混合。用滚轴压紧机将所得混合物压制成型,值得薄片状压制物料。用锤式粉碎机将所述薄片状压制物料研磨成粉,使所得粉状物料通过20目筛过筛。将一份轻质二氧化硅(0.3g)和硬脂酸镁(0.3g)加入到已过筛的物料中,并混合。所得混合产物用制片机压片,制备片剂。实施例54药用组合物的制备:明胶胶囊剂将化合物I-1(1g)与微晶纤维素(0.35g)和乳糖(0.15g)用水制粒,然后将该颗粒与铰链羧甲基纤维素钠(0.04g)和硬脂酸镁(0.01g)混合。所得混合产物填充明胶胶囊,制备明胶胶囊剂。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 苯并双(噻二唑)衍生物、包含其的油墨、以及使用了其的有机电子装置的制造方法
- 具有含硫取代基的杀有害生物活性杂环衍生物的制造方法与工艺
- 具有含硫取代基的杀有害生物活性杂环衍生物的制造方法与工艺
- 一种苯并噻咯类衍生物及其制备方法和有机发光器件与制造工艺
- 苯并噻吩并咔唑类衍生物及其制备方法和有机发光器件与制造工艺
- 苯并二氮杂*衍生物的2-萘磺酸盐及晶型和它们的制备方法与制造工艺
- 靛红杂合喹唑啉类化合物合成的靛红衍生物及其在制备抗肿瘤药物中的应用的制造方法与工艺
- 一种杂环衍生物及使用该杂环衍生物的有机发光器件的制造方法与工艺
- 一种二氰基甲烯基苯并四氢呋喃衍生物及其制备方法与制造工艺
- 一种含氮杂环衍生物及使用该含氮杂环衍生物的有机发光器件的制造方法与工艺