缺少C5结合的Coversin变体的制作方法
发明领域
本发明涉及适用于治疗由类二十烷酸(eicosanoid)介导的疾病和病况的组合物,且尤其涉及用于治疗由白三烯和羟基类二十烷酸(且尤其为ltb4)介导的疾病和病况的具有白三烯/羟基类二十烷酸(lk/e)结合活性的修饰的蜱源性化合物。
背景技术:
类二十烷酸为通过三种主要酶途径衍生自20个碳原子的脂肪酸二十碳四烯酸(aa)的氧化生物活性脂质介质的家族,所述三种主要酶途径为:环氧化酶(cox)、脂肪氧化酶(lo)和细胞色素p450单加氧酶(cyp450)。类二十烷酸包括衍生自cox途径的前列腺素类(包括前列腺素pg和血栓素txb)、来自lo途径的白三烯(lk)以及来自lo和p450单加氧酶途径的羟基二十碳四烯酸(hete)和环氧二十碳三烯酸(eet)(curtis-prior,2004;peters-goldenandhendersonjr.,2007)。类二十烷酸对多种细胞类型和器官介导多种作用。这些作用包括调节毛细血管和小静脉的血管张力和渗透性(pg、tbx、lk)、肌肉的收缩或放松(pg、tbx、半胱氨酰基lk)、血小板功能的刺激或抑制(tbx、pg、lk)、肾血流和矿物质代谢调节(imig,2000;haoandbreyer,2007)、控制恶性细胞的生长和或扩散(schwartzetal.,2005;aya,2006),以及活化白细胞,尤其在自身免疫和发炎性病况中活化白细胞(lk、hete)(samuelsson,1983;kimandluster,2007)。
白三烯b4(ltb4)是已描述的具有最强趋化性(chemotactic)和化学增活性(chemokinetic)的类二十烷酸,并且通过上调整合素来促进嗜中性粒细胞粘附至血管内皮(hooveretal.,1984)。它还是嗜中性粒细胞的完全促泌素(secretagogue),诱导嗜中性粒细胞的聚集并且增加微血管渗透性。ltb4募集和活化自然杀伤细胞、单核细胞和嗜酸性粒细胞。ltb4增加超氧自由基形成(harrison和murphy,1995)且调节基因表达,包括产生多种可加强和延长组织炎症的促炎性细胞因子和介质(ford-hutchinson,1990;showelletal.,1995)。ltb4还在诱导和管理适应性免疫反应中有作用。举例来说,调节树突状细胞运输至引流淋巴结(klaasetal.,2005;delpreteetal.,2007)、从肺t细胞产生th2细胞因子il-13(miyaharaetal.,2006)、募集抗原特异性效应cd8+t细胞(taubeetal.,2006)以及人类b淋巴细胞的活化和增殖(yamaokaetal.,1989)。
白三烯b4(ltb4)和羟基类二十烷酸通过blt1和blt2g蛋白偶联受体介导其作用(yokomizoetal.,1997,2000)。人类blt1为特异性针对ltb4的高亲和力受体(kd0.39-1.5nm;tagerandluster,2003),其中只有20位羟基取代的ltb4和12-epiltb4能够在竞争性结合研究中取代ltb4(yokomizoetal.,2001)。人类blt2对ltb4的亲和力(kd23nm)比blt1对ltb4的亲和力低20倍,且通过结合较宽范围的类二十烷酸,包括12-epiltb4、20位羟基取代的ltb4、12(s)-和15(s)-hete以及12(s)-和15(s)-hpete来活化(yokomizoetal.,2001)。人类blt2与人类和小鼠blt1具有45.2%和44.6%氨基酸同一性,而人类和小鼠blt2具有92.7%同一性(yokomizoetal.,2000)。
虽然最近有报道称人类blt1也在内皮细胞和血管平滑肌细胞中表达,但是它主要在白细胞表面表达。人类blt2表达于较宽范围的组织和细胞类型中。已描述了blt1和blt2的多种特异性拮抗剂,其抑制人类嗜中性粒细胞的活化、外渗(extravasation)和凋亡(kimandluster,2007),并且减少炎症性关节炎(kimetal.,2006)和肾局部缺血再灌注(noirietal.,2000)的小鼠模型中由嗜中性粒细胞浸润引起的症状。越来越多的研究表明,blt1和blt2均可通过ltb4和羟基类二十烷酸介导病理效应(lundeenetal.,2006),当然,尽管blt1在一些病变例如小鼠中胶原蛋白诱发的关节炎中具有主导作用(shaoetal.,2006)。blt1-/-缺陷小鼠也已突出显示了blt1在炎症应答中引导嗜中性粒细胞迁移中的重要性。确切地说,用5lo缺陷小鼠品系显示了需要blt1对嗜中性粒细胞的自分泌活化以便将嗜中性粒细胞募集至关节炎关节中(chenetal.,2006)。
ltb4的氧化异构衍生物,如b4异白三烯也具有生物活性(harrisonetal.,1995)。羟基类二十烷酸也是这样,例如5(s)-hete为嗜酸性粒细胞的高效化学诱导剂(chemoattractant)(powellandrokach,2005)。衍生自lta4的半胱氨酰基lk与哮喘的病理生理学相关,包括:由呼吸道内衬的平滑肌的收缩引起的支气管收缩;由血管渗漏引起的粘膜水肿;粘液分泌增加;和富含嗜酸性粒细胞的炎症性细胞浸润的存在(bisgaardetal.,1985;drazenetal.,1988)。
有多种市售药物靶向类二十烷酸。这些药物包括调节磷脂酶a2(pla2)并由此抑制类二十烷酸前体aa释放的糖皮质激素(sebaldtetal.,1990)、非类固醇抗炎药(nsaid)和防止pg和txb合成的其它cox2抑制剂(curryetal.,2005)。还存在多种lk修饰剂,其抑制ltb4合成所需的5-lo酶(齐留通(zileuton);dubeetal.,1998),或拮抗介导半胱胺酰基白三烯作用的cyslt1受体(扎鲁司特(zafirlukast)和孟鲁司特(montelukast))(sharmaandmohammed,2006)。lk修饰剂为口服可用的且已由fda批准用于治疗例如哮喘。市面上还没有特定作用于ltb4或其受体的药物。
wo2004/106369描述了软蜱源性补体(c)抑制剂coversin,其通过直接结合至补体组分c5而抑制经典凝集素和旁路补体两条途径(nunnetal.,2005)。coversin衍生自吸血性节肢动物的唾液腺。已证明其治疗潜力(hepburnetal.,2007)。coversin在包括人类的大范围哺乳动物物种中防止补体(c)介导的c组分5(c5)活化(barratt-due,a.etal.(2011)j.immunol.187,4913-4919))。通过直接结合至cub、c5d和c5-c345cc5结构域,coversin防止通过c5补体转化酶的c5裂解,由此防止过敏毒素(anaphylatoxin)c5a的释放和c5b的形成,c5b使包含补体组分c5b-9复合物的攻膜复合物(mac)的形成成核(参见例如jore等人2016)。还显示coversin与类二十烷酸(尤其lk,尤其ltb4)结合,随后围封于其蛋白质主体内(roversi,p.etal.,(2013)j.biol.chem.2013,288:18789-18802)。已知coversin可同时结合ltb4和c5,且结合位点位于coversin的相对面上,且在c5-coversin复合物中ltb4结合袋是完全可进入的(joreetal.,2016)。
技术实现要素:
已发现coversin多肽可被修饰以减少或去除其c5结合活性(且因此减少或去除其补体抑制剂活性),同时保留白三烯/羟基类二十烷酸(lk/e)结合活性(例如ltb4结合活性)。确切地说,本发明人已展示在特定残基处修饰包含seqidno:3的coversin多肽可减少或去除c5结合。
因此,本发明涉及包含seqidno:3的coversin多肽的修饰的型式,其显示减少的c5结合或不显示c5结合,但其与lk/e结合,并且涉及编码此类修饰的coversin多肽的聚核苷酸。
此类修饰的coversin多肽或编码此类修饰的coversin多肽的聚核苷酸充当lk/e抑制剂,并且可用于预防和治疗由lk/e介导的疾病和病况。可以看出,这些修饰的分子将显示减少的c5结合或不显示c5结合,并且导致c5转化酶抑制的降低或没有c5转化酶抑制,以及减少的补体活性干扰或没有补体活性干扰。
本发明还涉及本发明所述的修饰的coversin多肽和编码核苷酸在治疗和预防疾病中的用途,其中白三烯(特别是ltb4)和羟基类二十烷酸与所述疾病的病理学有关。本发明所述的修饰的coversin多肽可结合至并囚禁lk和羟基类二十烷酸。这可以阻止配体与blt1和blt2两类受体相互作用且改善脂肪酸的促炎作用,已频繁显示所述促炎作用取决于通过这两种受体的信号传导。因此根据本发明的一个方面,提供本发明的修饰的coversin多肽和编码核苷酸,用于治疗由白三烯或羟基类二十烷酸介导的疾病或病况。
本发明的多肽或聚核苷酸可以用于治疗由白三烯或羟基类二十烷酸介导的疾病和病况。可根据本发明治疗的疾病和病症的实例包括接触性过敏反应、溃疡性结肠炎、食管腺癌、胰腺癌(pancreaticadenocarcinoma)、乳腺癌、痤疮、动脉瘤、牙周病、囊肿性纤维化、哮喘和细支气管炎。
其它实例包括:肺和呼吸道病况,优选地选自α-1抗胰蛋白酶病(aatd)、肺动脉高血压(pah)、慢性阻塞性肺病(copd)、闭塞性细支气管炎综合症(bos)、特发性肺病(ipd)、重度持续性哮喘、运动和阿司匹林诱发的哮喘、过敏性鼻炎和硅肺病(silicosis);皮肤病况,优选地选自自身免疫性水疱病、特应性皮炎、接触性皮炎、银屑病和丘-施二氏综合症(churg-strausssyndrome);癌症,优选地选自胰腺癌、卵巢癌、结肠癌、前列腺癌、肺癌、食道癌和癌转移;眼部病况,例如自身免疫葡萄膜炎、过敏性结膜炎和其他随后列于本申请中的眼部病况。其它所关注的一般全身性病况包括类风湿性关节炎、破骨细胞性关节炎、绝经后骨质疏松、系统性红斑狼疮(sle)、发炎性肠病、包括古德帕斯彻综合症(goodpasture'ssyndrome)和肾小球肾炎的血管炎、全身性硬化症、2型糖尿病、糖尿病性肾病、镰形细胞病(scd)、疟疾、创伤、心肌梗塞、阻塞性睡眠呼吸暂停综合症、动脉粥样硬化、冠状动脉成形术后再狭窄、多发性硬化症(ms)、痴呆、移植物抗宿主疾病(gvhd)和神经病。
最优选地,本发明用于治疗aatd、copd、pah、哮喘(例如重度持续性哮喘)、gvhd、水疱性皮肤病和银屑病。
在本发明的另一方面中,提供一种在有需要的受试者中治疗或预防由白三烯或羟基类二十烷酸介导的疾病或病况的方法,所述方法包含向受试者施用治疗有效量的根据本发明的修饰的coversin多肽或编码修饰的coversin多肽的聚核苷酸。
在本发明的另一方面中,提供包含修饰的coversin多肽和脂肪酸的组合物。脂肪酸优选地为治疗性脂肪酸且提供用于递送至个体。
在本发明的另一方面中,提供包含pas序列和本发明所述的修饰的coversin多肽的融合蛋白。
附图说明
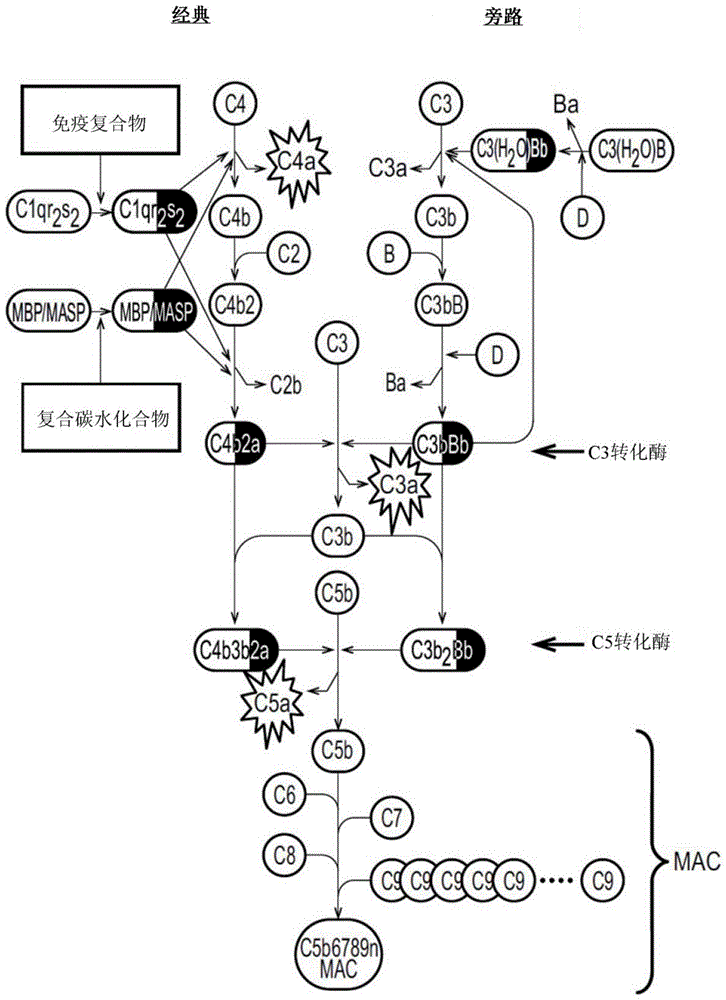
图1(a)显示补体活化的经典途径和旁路途径的示意图。酶组分,深灰色。星暴状图形(starburst)内是过敏毒素。(b)显示类二十烷酸途径的示意图。
图2显示(a)coversin的一级序列。加下划线的是信号序列。半胱氨酸残基呈粗体。核苷酸和氨基酸数目显示在右侧。(b)coversin变体的实例。
图3显示从大肠杆菌表达和纯化的coversin野生型(通道1)、coversin变体1(通道2)和coversin变体2(通道3)的还原sds-page凝胶。
图4显示结合至c5的野生型coversin和coversin变异体1和2(a)以及其pas化型式(b)的表面等离子体共振迹线。
图5显示结合至ltb4的各种浓度的野生型coversin和coversin变异体1和2(a)以及其pas化型式(b)的荧光滴定曲线。
图6显示如根据圆二色性光谱法测量的野生型coversin和coversin变体1和2的热变性曲线。还显示每种蛋白质的熔化温度值的表。
图7显示如根据ch50分析测量的野生型coversin和coversin变体1和2对c5介导的绵羊红血球裂解的作用。如图7中所示的此分析的结果用作野生型coversin和变体1和2抑制c5的能力的间接量度。
图8显示l-coversin对哮喘小鼠模型的支气管肺泡液体和肺中的嗜酸性粒细胞和嗜中性粒细胞计数的作用。在施用l-coversin之前,将哮喘小鼠暴露于屋尘螨(hdm)。在对照组中,用磷酸盐缓冲盐水代替hdm暴露。
图9显示长效l-coversin(pas-l-coversin)对eba小鼠模型的作用(a-实验1,b实验2)。
序列描述
seqidno:1为coversin非洲钝缘蜱(ornithodorosmoubata)的聚核苷酸序列。
seqidno:2为coversin非洲钝缘蜱的氨基酸序列(即氨基酸1-168)。序列在第132至142位氨基酸处在βh与α2之间形成环。
seqidno:3为seqidno:2中第19至168位氨基酸的氨基酸序列,并且是不具有seqidno:2蛋白质的前18个氨基酸序列(其为信号序列)的coversin非洲钝缘蜱的氨基酸序列。序列在第114至124位氨基酸处在βh与α2之间形成环。
seqidno:4为seqidno:3的聚核苷酸序列。
seqidno:5为根据本发明的修饰的coversin的氨基酸序列,其中seqidno:3已被修饰以使得met114变为gln、met116变为gln、leu117变为ser、asp118变为asn、ala119变为gly、gly120变为ser、gly121变为ala、leu122变为asp、glu123变为asp且val124变为lys。(coversin变体1)
seqidno:6为根据本发明的修饰的coversin的氨基酸序列,其中seqidno:3已被修饰以使得ala44变为asn、met116变为gln、leu117变为ser、gly121变为ala、leu122变为asp、glu123变为ala且asp149变为gly。(coversin变体2)
seqidno:7为根据本发明的修饰的coversin的氨基酸序列,其被修饰以使得ala44变为asn、met116变为gln、leu122变为asp且asp149变为gly。(coversin变体3)
seqidno:8为根据本发明的修饰的coversin的氨基酸序列,其被修饰以将ala44变为asn。(coversin变体4)
seqidno:9为在seqidno:3的第114至124位氨基酸(seqidno:2的第132-142位氨基酸)处在βh与α2之间的环的氨基酸序列。
seqidno:10为在coversin变体1(seqidno:5)中的seqidno:3的第114至124位氨基酸处在βh与α2之间的环的氨基酸序列。
seqidno:11为在coversin变体2(seqidno:6)中的seqidno:3的第114至124位氨基酸处在βh与α2之间的环的氨基酸序列。
seqidno:12为在coversin变体3(seqidno:7)中的seqidno:3的第114至124位氨基酸处在βh与α2之间的环的氨基酸序列。
seqidno:13至19为pas序列。
具体实施方式
在一个方面,本发明提供修饰的coversin多肽,其展现出白三烯或羟基类二十烷酸结合活性和减少或缺乏的c5结合,所述修饰的coversin多肽包含其中进行1至30个氨基酸取代的seqidno:3,其中
(i)在seqidno:3的第114至124位进行以下取代(a)-(j)中的一个或多个:
a.met114被gln、asp、asn、glu、arg、lys、gly、ala、pro、his或thr替换;
b.met116被gln、asp、asn、glu、arg、lys、gly、ala、pro、his或thr替换;
c.leu117被ser、asp、asn、glu、arg、lys、gly、ala或pro替换;
d.asp118被asn、gln、arg、lys、gly、ala、leu、ser、ile、phe、tyr、met、pro、his或thr替换;
e.ala119被gly、asp、asn、glu、arg、lys、leu、ile、phe、tyr、met、pro或his替换;
f.gly120被ser、asp、asn、glu、arg、lys、leu、ile、phe、tyr、met、pro或his替换;
g.gly121被ala、asp、asn、glu、arg、lys、leu、ile、phe、tyr、met、pro或his替换;
h.leu122被asp、glu、asn、ala、gln、arg、lys、pro或his替换;
i.glu123被asp、ala、gln、asn、arg、lys、gly、leu、ser、ile、phe、tyr、pro、his或thr替换;
j.val124被lys、gln、asn、arg、lys、gly、ala、pro、his或thr替换;或/且其中
(ii)seqidno:3中的ala44被asn、asp、gln、glu、arg、lys、leu、ile、phe、tyr、met、pro或his替换;
或其片段,所述片段中在所述修饰的coversin多肽的n末端缺失至多五个氨基酸。
本发明还提供包含根据本发明的修饰的coversin多肽或其片段的融合蛋白。
本发明还提供编码根据本发明的修饰的coversin多肽或其片段的核酸分子,以及包含根据本发明的核酸分子的载体,和包含根据本发明的核酸分子或根据本发明的载体的宿主细胞。
本发明还提供一种制备根据本发明的修饰的coversin多肽或其片段或根据本发明的融合蛋白的方法,所述方法包括在借以表达所述蛋白的条件下培养根据本发明的宿主细胞并回收因此产生的所述蛋白。
本发明还提供一种组合物,其包含根据本发明的修饰的coversin多肽、根据本发明的融合蛋白或根据本发明的核酸分子以及药学上可接受的载体。
本发明进一步提供用于治疗的根据本发明的修饰的coversin多肽、根据本发明的融合蛋白、根据本发明的核酸分子或根据本发明的组合物。
本发明还提供用于治疗由白三烯或羟基类二十烷酸介导的疾病或病况的根据本发明的修饰的coversin多肽、根据本发明的融合蛋白、根据本发明的核酸分子或根据本发明的组合物,以及在受试者中治疗或预防由白三烯或羟基类二十烷酸介导的疾病或病况的方法,所述方法包括向根据本发明的所述受试者施用根据本发明的融合蛋白、根据本发明的核酸分子或根据本发明的组合物。
在一个方面,本发明提供用于治疗由白三烯或羟基类二十烷酸介导的疾病或病况的修饰的coversin多肽或编码所述修饰的coversin多肽的多核苷酸。
修饰的coversin多肽
本发明的修饰的coversin多肽是基于从非洲钝缘蜱的唾液分离的蜱源性补体抑制剂。首先从蜱的唾液腺分离该蛋白质,已发现该蛋白质抑制经典和旁路补体途径以及白三烯和羟基类二十烷酸(尤其ltb4)。此蛋白质的氨基酸序列如seqidno:2所示。在一些实施方案中,根据本发明的修饰的coversin多肽可为seqidno:2所示的完整序列的修饰的型式。
在替代实施方案中,coversin多肽是以不包括蛋白质序列的前18个氨基酸(信号序列)的形式提供。因此,根据本发明的修饰的coversin多肽可为seqidno:3的修饰的型式,seqidno:3是seqidno:2的氨基酸序列的第19至168位氨基酸。
在整个本申请中,提及的“修饰的coversin多肽”应理解为是指seqidno:2或seqidno:3(即,在seqidno:2的n末端有或没有18个氨基酸的信号序列的coversin多肽)的修饰的型式。
当seqidno:3内的特定氨基酸由引用其于seqidno:3中的位置编号定义时,此氨基酸也可由引用其于seqidno:2中的位置编号定义且此编号将比seqidno:3的编号大18,因为seqidno:2的n末端处存在18个氨基酸的信号序列。
本发明的修饰的coversin多肽的氨基酸序列与seqidno:2或seqidno:3的氨基酸序列有1至30个氨基酸的差异,但在一定程度上保留了在未修饰的coversin多肽中的lk/e结合活性。与seqidno:2和seqidno:3中未修饰的coversin多肽相比,本发明的修饰的coversin多肽还展现出减少或缺乏的c5结合。如本文所用的lk/e结合活性是指结合至白三烯和羟基类二十烷酸(包括但不限于ltb4、b4异白三烯及其任何羟基化衍生物、hete、hpete和eet)的能力。ltb4结合尤其受关注。
本发明的修饰的coversin多肽可由seqidno:2或3组成,根据下文的描述被修饰,或可包含seqidno:2或3,根据下文的描述被修饰。
seqidno:2和seqidno:3的未修饰的coversin多肽在seqidno:3的第114至124位氨基酸(seqidno:2的第132-142位氨基酸)处在βh与α2之间形成环。此环具有以下所示的序列:
-met-trp-met-leu-asp-ala-gly-gly-leu-glu-val-(seqidno:9)
第一个met在seqidno:3的第114位,并且在seqidno:2的第132位。
在本发明的一个方面,seqidno:2或seqidno:3中的coversin多肽被修饰,使得在seqidno:3的第114至124位进行以下取代(a)-(j)中的一个或多个:
a.met114被gln、asp、asn、glu、arg、lys、gly、ala、pro、his或thr替换,优选地被gln或ala替换;
b.met116被gln、asp、asn、glu、arg、lys、gly、ala、pro、his或thr替换,优选地被gln或ala替换;
c.leu117被ser、asp、asn、glu、arg、lys、gly、ala或pro替换,优选地被ser或ala替换;
d.asp118被asn、gln、arg、lys、gly、ala、leu、ser、ile、phe、tyr、met、pro、his或thr替换,优选地被asn替换;
e.ala119被gly、asp、asn、glu、arg、lys、leu、ile、phe、tyr、met、pro或his替换,优选地被gly或asn替换;
f.gly120被ser、asp、asn、glu、arg、lys、leu、ile、phe、tyr、met、pro或his替换,优选地被ser或asn替换;
g.gly121被ala、asp、asn、glu、arg、lys、leu、ile、phe、tyr、met、pro或his替换,优选地被ala或asn替换;
h.leu122被asp、glu、asn、ala、gln、arg、lys、pro或his替换,优选地被asp或ala替换;
i.glu123被asp、ala、gln、asn、arg、lys、gly、leu、ser、ile、phe、tyr、pro、his或thr替换,优选地被asp、ala、gln或asn替换;
j.val124被lys、gln、asn、arg、lys、gly、ala、pro、his或thr替换,优选地被lys或ala替换。
在本发明的实施方案中,seqidno:2或seqidno:3中的coversin多肽被修饰,使得在seqidno:3的第114至124位进行以下取代(a)-(j)中的一个或多个:
a.met114被gln替换;
b.met116被gln替换;
c.leu117被ser替换;
d.asp118被asn替换;
e.ala119被gly替换;
f.gly120被ser替换;
g.gly121被ala替换;
h.leu122被asp替换;
i.glu123被asp或ala替换;
j.val124被lys替换。
在本发明的实施方案中,seqidno:2或seqidno:3中的coversin多肽被修饰,使得在seqidno:3的第114至124位进行以下取代(a)-(j)中的一个或多个:
a.met114被ala替换;
b.met116被ala替换;
c.leu117被ala替换;
d.asp118被asn替换;
e.ala119被asn替换;
f.gly120被asn替换;
g.gly121被asn替换;
h.leu122被ala替换;
i.glu123被gln或asn替换;
j.val124被ala替换。
在本发明的实施方案中,存在取代(a)-(j)中的二、三、四、五、六、七、八、九或十个。优选地,存在取代(a)-(j)中的两个或更多个、五个或更多个或八个或更多个。
在一些实施方案中,seqidno:2或seqidno:3中的coversin多肽被修饰,使得在seqidno:3的第114至124位存在以下取代:
a.met114被gln替换;
b.met116被gln替换;
c.leu117被ser替换;
d.asp118被asn替换;
e.ala119被gly替换;
f.gly120被ser替换;
g.gly121被ala替换;
h.leu122被asp替换;
i.glu123被asp替换;
j.val124被lys替换。
任选地,在上文提及的修饰的coversin多肽中,trp115未被取代。优选的修饰的coversin多肽在seqidno:3的第114至124位氨基酸处在βh与α2之间具有环,所述环具有序列gln-trp-gln-ser-asn-gly-ser-ala-asp-asp-lys(seqidno:10)。
在一些实施方案中,coversin多肽被修饰,使得在seqidno:3的第114至124位存在以下取代:
a.met114被gln、asp、asn、glu、arg、lys、gly、ala、pro、his或thr替换,优选地被gln替换;
b.leu117被ser、asp、asn、glu、arg、lys、gly、ala或pro替换,优选地被ser替换;
c.gly121被ala、asp、glu、arg、lys、leu、ile、phe、tyr、met、pro或his替换,优选地被ala替换;
d.leu122被asp、glu、asn、gln、arg、lys、pro或his替换,优选地被asp替换;
e.glu123被asp、ala、gln、asn、arg、lys、gly、leu、ser、ile、phe、tyr、pro、his或thr替换,优选地被asp或ala替换,更优选地被ala替换。
在更特定实施方案中;
a.met116被gln替换;
b.leu117被ser替换;
c.gly121被ala替换;
d.leu122被asp替换;
e.glu123被ala替换。
任选地,在上文提及的此修饰的coversin多肽中,trp115未被取代。任选地,在此实施方案中,met114、trp115、asp118、ala119、gly120和val124未被取代,或被本文中其它地方提及的保守取代取代。优选的修饰的coversin多肽在seqidno:3的第114至124位氨基酸处在βh与α2之间具有环,所述环具有序列met-trp-gln-ser-asp-ala-gly-ala-asp-ala-val(seqidno:11)。
在一些实施方案中,coversin多肽被修饰,使得在seqidno:3的第114至124位存在以下取代:
a.met116被gln、asp、asn、glu、arg、lys、gly、ala、pro、his或thr替换,优选地被gln替换;
b.leu122被asp、glu、asn、gln、arg、lys、pro或his替换,优选地被asp替换;
在更特定实施方案中;
a.met116被gln替换;
b.leu122被asp替换。
任选地,在上文提及的此修饰的coversin多肽中,trp115未被取代。任选地,在此实施方案中,met114、trp115、leu117、asp118、ala119、gly120、gly121、glu123和val124未被取代。优选的修饰的coversin多肽在seqidno:3的第114至124位氨基酸处在βh与α2之间具有环,所述环具有序列met-trp-gln-leu-asp-ala-gly-gly-asp-glu-val(seqidno:12)。
在本发明的另一个方面,coversin多肽被修饰,使得seqidno:3中的ala44(seqidno:2中的ala62)被asn、asp、gln、glu、arg、lys、leu、ile、phe、tyr、met、pro或his替换。
在优选实施方案中,seqidno:3中的ala44被asn替换。
seqidno:3的第44位(或seqidno:2的第62位)的此取代可与本文中提及的任何其它取代进行组合。
在本发明的另一个方面,coversin多肽被修饰,使得在seqidno:3的第114至124位存在以下取代(a)-(j)中的一个或多个:
a.met114被gln、asp、asn、glu、arg、lys、gly、ala、pro、his或thr替换,优选地被gln或ala替换,例如被gln替换;
b.met116被gln、asp、asn、glu、arg、lys、gly、ala、pro、his或thr替换,优选地被gln或ala替换,例如被gln替换;
c.leu117被ser、asp、asn、glu、arg、lys、gly、ala或pro替换,优选地被ser或ala替换,例如被ser替换;
d.asp118被asn、gln、arg、lys、gly、ala、leu、ser、ile、phe、tyr、met、pro、his或thr替换,优选地被asn替换;
e.ala119被gly、asp、glu、arg、lys、leu、ile、phe、tyr、met、pro或his替换,优选地被gly或asn替换,例如被gly替换;
f.gly120被ser、asp、glu、arg、lys、leu、ile、phe、tyr、met、pro或his替换,优选地被ser或asn替换,例如被ser替换;
g.gly121被ala、asp、glu、arg、lys、leu、ile、phe、tyr、met、pro或his替换,优选地被ala或asn替换,例如被ala替换;
h.leu122被asp、glu、asn、gln、arg、lys、pro或his替换,优选地被asp或ala替换,例如被asp替换;
i.glu123被asp、ala、gln、asn、arg、lys、gly、leu、ser、ile、phe、tyr、pro、his或thr替换,优选地被asp、ala、gln或asn替换,例如被asp或ala替换;
j.val124被lys、gln、asn、arg、lys、gly、ala、pro、his或thr替换,优选地被lys或ala替换,例如被lys替换;
且另外,seqidno:3中的ala44(seqidno:2中的ala62)被asn、asp、gln、glu、arg、lys、leu、ile、phe、tyr、met、pro或his替换,优选地被asn替换。
在一些实施方案中,coversin多肽被修饰,使得在seqidno:3的第114至124位存在以下取代:
a.met116被gln替换;
b.leu117被ser替换;
c.gly121被ala替换;
d.leu122被asp替换;
e.glu123被ala替换;
且seqidno:3中的ala44被asn替换。
在此实施方案的优选方面中,对应于seqidno:3的第114至124位的氨基酸残基如seqidno:11所示。
在一些实施方案中,coversin多肽被修饰,使得在seqidno:3的第114至124位存在以下取代:
a.met116被gln替换;
b.leu122被asp替换;
且seqidno:3中的ala44被asn替换。
在此实施方案的优选方面中,对应于seqidno:3的第114至124位的氨基酸残基如seqidno:12所示。
在一些实施方案中,coversin多肽被修饰,使得seqidno:3中的asp149被gly、gln、asn、ala、met、arg、lys、leu、ser、ile、phe、tyr、pro、his或thr替换。在一些实施方案中,coversin多肽被修饰,使得seqidno:3的asp149被gly替换。seqidno:3的第149位(seqidno:2的第167位)的此取代可与本文中提及的任何其它取代进行组合。
在一些实施方案中,coversin多肽被修饰,使得在seqidno:3的第114至124位存在以下取代:
a.met116被gln替换;
b.leu117被ser替换;
c.gly121被ala替换;
d.leu122被asp替换;
e.glu123被ala替换;
seqidno:3中的ala44被asn替换,并且seqidno:3中的asp149被gly149替换。
在此实施方案的优选方面中,对应于seqidno:3的第114至124位的氨基酸残基如seqidno:11所示。
在一些实施方案中,coversin多肽被修饰,使得在seqidno:3的第114至124位存在以下取代:
a.met116被gln替换;
b.leu122被asp替换;
seqidno:3中的ala44被asn替换,并且seqidno:3中的asp149被gly149替换。
在此实施方案的优选方面中,对应于seqidno:3的第114至124位的氨基酸残基如seqidno:12所示。
在本公开的各种方面和实施方案中,本发明的修饰的coversin多肽与seqidno:2和seqidno:3中的未修饰的coversin多肽存在1至30个氨基酸的差异。可对seqidno:2和seqidno:3中的coversin多肽进行任何修饰,前提是与未修饰的coversin多肽相比,所得的修饰的coversin多肽展现出lk/e结合活性和减少或缺乏的c5结合。
在本发明的一些实施方案中,seqidno:3的第6、38、100、128、129、150位的六个半胱氨酸氨基酸保留于本发明的修饰的coversin多肽中。
在一些实施方案中,seqidno:3中的asn60和asn84各自被gln替换。可通过定点突变进行此修饰,从而当在真核细胞(例如酵母、植物、哺乳动物)中表达多肽时,防止n-连接高糖基化。
在一些实施方案中,认为seqidno:3中的以下氨基酸中的一个或多个参与与ltb4的结合,因此可以未修饰形式保留:phe18、tyr25、arg36、leu39、gly41、pro43、leu52、val54、met56、phe58、thr67、trp69、phe71、gln87、arg89、his99、his101、asp103和trp115。在一些实施方案中,这些氨基酸中的至少五个、十个或十五个或全部以未修饰形式保留于本发明的修饰的coversin多肽中。在一些实施方案中,这些氨基酸中的一个或多个可被保守取代。在一些实施方案中,这些氨基酸中的至多五个、十个或十五个或全部在本发明的修饰的coversin多肽中被保守取代。
seqidno:3中的以下位置处的氨基酸在coversin与tsgp2和tsgp3之间高度保守:5、6、11、13-15、20-21、24-27、29-32、35-41、45、47-48、50、52-60、64、66、69-81、83、84、86、90-94、97-104、112-113、115、125-129、132-139、145、148和150。
认为seqidno:3中的以下位置处的氨基酸参与与ltb4的结合和/或在coversin与tsgp2和tsgp3之间高度保守:5、6、11、13-15、18、20-21、24-27、29-32、35-41、43、45、47-48、50、52-60、64、66、67、69-81、83、84、86、87、89、90-94、97-104、112-113、115、125-129、132-139、145、148和150。
认为seqidno:3中的以下位置处的氨基酸参与与ltb4的结合和/或在coversin与tsgp2和tsgp3之间高度保守:5、6、11、13-15、18、20-21、24-25、27、30-32、35-41、43、47-48、50、52-60、64、66、67、69-81、83、84、86、87、89、90-94、98、100、102-104、112-113、115、126、128-129、132-139、145、148和150。
因此,在一些实施方案中,以上氨基酸以未修饰形式保留。在一些实施方案中,这些氨基酸中的至少五个、十个或十五个或全部以未修饰形式保留于本发明的修饰的coversin多肽中。在一些实施方案中,这些氨基酸中的一个或多个可被保守取代。在一些实施方案中,这些氨基酸中的至多5、10或15、20、25、30、40、50个或全部在本发明的修饰的coversin多肽中被保守取代。
本发明的修饰的coversin多肽与seqidno:2或seqidno:3通常有1至30个、优选地2至25个、更优选地3至20个、甚至更优选地4至15个氨基酸的差异。通常,所述差异将为5至12个或6至10个氨基酸变化。举例来说,可在seqidno:2或seqidno:3中进行1至30个、或2至25个、3至30个、4至15个、5至12个或6至10个氨基酸取代。
与seqidno:3相比,在seqidno:3的第114至124位氨基酸(seqidno:2的第132-142位氨基酸)处在βh与α2之间具有如seqidno:10所示的环的修饰的coversin多肽由于存在此环而具有10个氨基酸取代。因此,在一些实施方案中,与seqidno:3相比,本发明的修饰的coversin多肽优选地具有除seqidno:5(例如在seqidno:10的环中)所示的取代以外的1-15、2-10、3-5或至多2、3、4或5个额外取代。
与seqidno:3相比,在seqidno:3的第114至124位氨基酸(seqidno:2的第132-142位氨基酸)处在βh与α2之间具有如seqidno:11所示的环的修饰的coversin多肽由于存在此环而具有5个氨基酸取代。因此,在一些实施方案中,与seqidno:3相比,本发明的修饰的coversin多肽优选地具有除seqidno:6(例如在seqidno:11的环中)所示的取代以外的1-20、2-15、3-10或至多2、3、4、5、6、7、8、9、10个额外取代。所述额外取代优选地包括如本文中其它地方描述的第44和149位的取代。
与seqidno:3相比,在seqidno:3的第114至124位氨基酸(seqidno:2的第132-142位氨基酸)处在βh与α2之间具有如seqidno:12所示的环的修饰的coversin多肽由于存在此环而具有2个氨基酸取代。因此,在一些实施方案中,与seqidno:3相比,本发明的修饰的coversin多肽优选地具有除seqidno:7所示的取代(例如在seqidno:12的环中的取代)以外的1-25、2-12、3-15或至多2、3、4、5、6、7、8、9、10、11、12、13、14、15个额外取代。所述额外取代优选地包括如本文中其它地方描述的第44和149位的取代。
与seqidno:3相比,如本文中其它地方描述的在seqidno:3的第44位具有取代的修饰的coversin多肽优选地具有1-25、2-12、3-15或至多2、3、4、5、6、7、8、9、10、11、12、13、14、15个额外取代。
除了上文明确提及的取代以外的取代优选为,例如根据下表的保守取代。第二列中的相同框和优选地第三列中的相同行中的氨基酸可彼此取代:
还可基于变体中发现的残基来选择取代,所述变体为例如获自非洲钝缘蜱的coversin蛋白质的同源物。此类同源物可包括seqidno:2或3所示的coversin序列的旁系同源物和直系同源物,包括例如来自包括以下的其它蜱物种的coversin蛋白质序列:附加扇头蜱(rhipicephalusappendiculatus)、血红扇头蜱(r.sanguineus)、囊形扇头蜱(r.bursa)、美洲钝眼蜱(a.americanum)、卡延钝眼蜱(a.cajennense)、希伯来钝眼蜱(a.hebraeum)、微小牛蜱(boophilusmicroplus)、具环牛蜱(b.annulatus)、消色牛蜱(b.decoloratus)、网纹革蜱(dermacentorreticulatus)、安氏革蜱(d.andersoni)、边缘革蜱(d.marginatus)、变异革蜱(d.variabilis)、铁角血蜱(haemaphysalisinermis)、蓝斑血蜱(ha.leachii)、点状血蜱(ha.punctata)、小亚璃眼蜱(hyalommaanatolicumanatolicum)、嗜驼璃眼蜱(hy.dromedarii)、边纹璃眼蜱(hy.marginatummarginatum)、羊硬蜱(ixodesricinus)、全沟硬蜱(i.persulcatus)、肩突硬蜱(i.scapularis)、六角硬蜱(i.hexagonus)、波斯隐喙蜱(argaspersicus)、卷边隐喙蜱(a.reflexus)、游走钝缘蜱(ornithodoroserraticus)、毛白钝缘蜱(o.moubatamoubata)、豚钝缘蜱(o.m.porcinus)和萨维尼钝缘蜱(o.savignyi)。
本发明还涵盖seqidno:3的修饰的coversin多肽的片段,其中所述修饰的coversin多肽的n末端缺失至多五个氨基酸。片段可对应于自修饰的coversin多肽的n末端的1、2、3、4或5个缺失。如果所得多肽保留修饰的coversin的lk/e结合活性(例如本文中关于修饰的多肽的描述)且具有减少或缺乏的补体抑制剂活性(例如本文中关于修饰的多肽的描述),则自seqidno:2或seqidno:3的氨基酸序列中的其它位置的缺失也被认为形成为本发明的一部分。
本发明的修饰的coversin多肽还可以以融合蛋白的形式提供,所述融合蛋白包含以基因方式或以化学方式融合至另一肽的修饰的coversin多肽。例如,可以通过将编码修饰的coversin多肽的聚核苷酸框内(in-frame)克隆至异源蛋白质序列的编码序列而获得融合蛋白。当用于本文中时,术语“异源”意指除本发明的修饰的coversin多肽以外的任何多肽。可在n末端或c末端被包含于可溶融合蛋白中的异源序列的实例如下:膜结合蛋白的胞外域、免疫球蛋白恒定区(fc区)、pas或xten或其它类似的非结构化多肽、多聚化域、胞外蛋白域、信号序列、输出序列或允许通过亲和色谱法纯化的序列。这些异源序列中的许多在表达质粒中可商购,因为这些序列通常被包含于融合蛋白中以在不显著损害与其融合的蛋白质的特定生物活性的情况下提供额外特性。此类额外特性的实例为体液中持续时间更长的半衰期(例如由于添加fc区或pas化而产生(schlapschym等人《蛋白质工程、设计与选择(proteinengdessel.)》2013年8月;26(8):489-501)、细胞外定位、或者如由例如组氨酸、gst、flag、抗生物素蛋白或ha标签等标签所允许的更容易的纯化程序。融合蛋白可另外含有连接子序列(例如长度为1-50、2-30、3-20、5-10个氨基酸),使得组分被此连接子序列隔开。
因此,融合蛋白为包含修饰的coversin多肽的蛋白质的实例,且以特定实例的方式包括包含pas序列和修饰的coversin多肽序列的蛋白质。pas序列描述于例如schlapschymetal.,proteinengdessel.august2013;26(8):489-501和ep08773567.6中,且pas化的coversin分子描述于kuhnetal.,bioconjugatechem.,2016,27(10),2359-2371中。pas化描述蛋白质与由氨基酸pro、ala和/或ser构成的构象上无序的多肽序列的基因融合。这是由xlprotein(http://xl-protein.com/)开发的技术,它以简单的方式将具有大流体动力学体积的溶剂化无规链(solvatedrandomchain)连接至其所融合的蛋白质。多肽序列采用大体积无规卷曲结构。因此,所得融合蛋白的尺寸比其所融合的蛋白质大得多。已显示这会降低在生物系统中的清除率。ep08773567.6以及上文的schlapschy参考文献中描述了合适的pas序列。任何合适的pas序列均可用于所述融合蛋白中。实例包括由至少约100个氨基酸残基组成的氨基酸序列,所述氨基酸残基形成无规卷曲构象且由丙氨酸、丝氨酸和脯氨酸残基组成(或由脯氨酸和丙氨酸残基组成)。这可包含多个氨基酸重复序列,其中所述重复序列由ala、ser和pro残基(或脯氨酸和丙氨酸残基)组成且其中不超过6个连续氨基酸残基是相同的。脯氨酸残基可占序列的氨基酸的4%以上且40%以下。所述序列可包含选自以下的氨基酸序列:
aspaapapaspaapapsapa(seqidno:13);
aapaspapaapsapapaaps(seqidno:14);
apsspspsapsspspaspss(seqidno:15),
sapsspspsapsspspasps(seqidno:16),
sspsapspsspaspspsspa(seqidno:17),
aaspaapsappaaaspaapsappa(seqidno:18),和
asaaapaaasaaasapsaaa(seqidno:19)
或作为这些序列的整体或一部分的这些序列的环形排列型式或多聚体。在pas序列中可存在这些重复序列中的一个重复序列(即seqidno13-19中的一个)的例如5-40个、10-30个、15-25个、18-20个,优选地20-30个或30个,优选地13个拷贝。优选地,pas序列包含30个拷贝的seqidno:13或由30个拷贝的seqidno:13组成。优选地,pas序列(直接或通过连接子序列)融合至coversin型蛋白质的n末端,且在某些优选实施方案中,coversin型蛋白质可包含seqidno:5或seqidno:6,或seqidno:7或seqidno:8或由其组成,例如融合蛋白包含(a)由30个拷贝的seqidno:13组成的pas序列,和(b)(i)seqidno:5,或(iii)seqidno:6,或(iii)seqidno:7,或(iv)seqidno:8,其中(a)直接或通过连接子序列融合至(b)的n末端。
在一些实施方案中,连接子序列包含一个或多个丙氨酸残基,例如1-5个丙氨酸残基,例如单个丙氨酸残基。
本发明的修饰的coversin多肽可被化学修饰,例如翻译后修饰。举例来说,其可被糖基化、聚乙二醇化、磷酸化或包含修饰的氨基酸残基。此类修饰的多肽落入本文所用的术语“多肽”的范围内。在其它实施方案中,本发明的修饰的coversin多肽未被化学修饰,例如未被翻译后修饰(例如未被糖基化、聚乙二醇化、磷酸化)。
本发明的修饰的coversin多肽可呈基本上分离的形式。在本发明的多肽已表达于宿主细胞中的情况下,这可以是其已与表达其的宿主细胞和/或生长培养基中的至少一种组分分离。应理解,修饰的coversin多肽可与不干扰多肽的预期目的的载体或稀释剂混合且仍被看作是基本上分离的形式。用于本发明的多肽还可呈基本上纯化的形式,在此情况下,其一般包含制剂(preparation)中的多肽,其中在所述制剂中按多肽的重量计大于50%,例如大于80%、90%、95%或99%为本发明的多肽。这可通过例如电泳或色谱来测定。
还可以通过合成方式或重组方式制得修饰的coversin多肽。举例来说,可通过如下步骤来产生重组coversin多肽:用表达载体转染培养物中的哺乳动物、真菌、细菌或昆虫细胞,所述表达载体包含编码可操作地连接于合适的控制序列的修饰的coversin多肽的核苷酸序列;培养细胞;提取和纯化由细胞产生的修饰的coversin多肽。还可在合成或重组生产后对多肽进行修饰。还可用d-氨基酸来产生用于本发明的多肽。在此类情况下,氨基酸将以c至n方向连接于反向序列中。这在产生此类多肽的领域中是常规操作。
本领域中已知多种侧链修饰,且可对修饰的coversin多肽的侧链进行多种侧链修饰,只要修饰的coversin多肽保留lk/e结合活性且展现出减少或缺乏的补体抑制剂活性(例如补体c5结合活性)。
聚核苷酸
根据本发明的一个方面,提供编码本发明的修饰的coversin多肽的聚核苷酸。编码根据本发明的修饰的coversin多肽或其片段的聚核苷酸可用于治疗或预防由白三烯或类二十烷酸介导的疾病或病况。
具体地,聚核苷酸可包含以下或由以下组成:(a)对应于seqidno:1(或其第55至507位核苷酸)的编码序列,其具有必要的改变以反映在本发明的修饰的coversin多肽中对seqidno:2或seqidno:3进行的修饰;(b)由于如(a)中所定义的序列的遗传密码子而简并的序列;或(c)如(a)或(b)中所定义的任一序列的片段,其编码具有lk/e结合活性(例如本文中关于修饰的多肽的描述)和减少或缺乏的补体抑制剂活性(例如本文中关于修饰的多肽的描述)的根据本发明的修饰的多肽。通常,聚核苷酸为dna,例如cdna。但是,聚核苷酸可为rna聚核苷酸。聚核苷酸可为单链或双链,且可在其内包括合成或修饰的核苷酸。
在一些实施方案中,编码序列对应于图2中的核苷酸序列(seqidno:1)的第55至507位核苷酸,而非对应于seqidno:1的编码序列。该核苷酸序列编码图2中的无信号序列的coversin蛋白质,即编码seqidno:3。图2中的核苷酸序列的前54个碱基编码信号序列,其对于补体抑制活性或ltb4结合活性来说是非必需的。因此,本发明的聚核苷酸可包含图2中的核苷酸序列(seqidno:1)的第55至507位核苷酸的修饰的型式或由其组成。
本发明的聚核苷酸通常可以显著高于背景的水平与具有必要改变的seqidno:1(或其第55至507位核苷酸)的编码序列或所述编码序列的互补序列杂交,所述必要改变是为了反映在本发明的修饰的coversin多肽中对seqidno:2或seqidno:3进行的修饰。例如,可由于存在于dna文库中的其它dna而发生背景杂交。由本发明的聚核苷酸与具有必要改变的seqidno:1(或其第55至507位核苷酸)的编码序列或所述编码序列的互补序列(所述必要改变是为了反映在本发明的修饰的coversin多肽中对seqidno:2或seqidno:3进行的修饰)之间的相互作用产生的信号水平的强度通常为其它聚核苷酸与seqidno:1(或其第55至507位核苷酸)的编码序列之间的相互作用的至少10倍,优选地至少100倍。例如,可通过例如用32p对探针进行放射性标记来测量相互作用的强度。通常可使用中至高严格度的条件来实现选择性杂交。但是,可在本领域中已知的任何合适的条件下进行此类杂交(参见sambrooketal.,molecularcloning:alaboratorymanual,1989)。举例来说,如果需要高严格度,则合适的条件包括在60℃至65℃的0.1至0.2×ssc。如果需要较低严格度,则合适的条件包括60℃的2×ssc。
上文提及的聚核苷酸可替代地或另外被修饰以包括编码在多肽的一端或两端或环区内部的延伸部的序列。还可包括额外序列,例如信号序列或编码另一肽或蛋白质的序列以帮助检测、表达、分离或纯化蛋白质,或编码肽,如fc肽、pas或如本文中其它地方提及的其它分子的序列以增加蛋白质的循环半衰期,如上文所提及。其它融合搭配物的实例包括β-半乳糖苷酶、谷胱甘肽-s-转移酶或荧光素酶。
修饰的聚核苷酸一般编码具有lk/e结合活性的多肽。可进行简并取代和/或可进行在翻译修饰的序列时引起保守氨基酸取代的取代,例如如上表中所示的保守取代。能够与具有必要改变的seqidno:1的dna编码序列的互补序列(所述必要改变是为了反映在本发明的修饰的coversin多肽中对seqidno:2或seqidno:3进行的修饰)选择性杂交的核苷酸序列一般在seqidno:1(具有为了反映在本发明的修饰的coversin多肽中对seqidno:2或seqidno:3进行的修饰的必要改变)的至少20、优选地至少30,例如至少40、至少60、至少100、至少200、至少420个核苷酸的区域上或最优选地在其全长上,或在根据本发明对这些序列进行了修饰的编码具有seqidno:2或3所示序列的多肽的seqidno:1(具有为了反映在本发明的修饰的coversin多肽中对seqidno:2或seqidno:3进行的修饰的必要改变)的长度上,与具有必要改变的seqidno:1(或其第55至507位核苷酸)(所述必要改变是为了反映在本发明的修饰的coversin多肽中对seqidno:2或seqidno:3进行的修饰)的编码序列具有至少60%、至少70%、至少80%、至少90%、至少95%、至少98%或至少99%序列同一性。可通过任何合适的方法测定序列同一性(如例如pearson,w.currprotocbioinformatics.june2013;03,doi:10.1002/0471250953.bi0301s42中所描述的方法)。
可以通过重组方式、合成方式或本领域技术人员可用的任何方法产生用于本发明的聚核苷酸。还可通过标准技术克隆用于本发明的聚核苷酸。通常以分离和/或纯化形式提供聚核苷酸。
如本文所述的聚核苷酸可用于生产用于本发明中的多肽,所述生产可在体外、体内或离体进行。聚核苷酸可凭其自身的性质用作治疗剂或可参与重组蛋白合成。用于本发明的聚核苷酸通常并入至重组可复制载体中。载体可用于在相容的宿主细胞中复制核酸。因此,可通过将coversin聚核苷酸引入至可复制载体中、将载体引入至相容的宿主细胞中且在引起载体复制的条件下使宿主细胞生长而制得用于本发明的聚核苷酸。宿主细胞可为,例如,大肠杆菌细胞。
载体
本发明还包括包含本发明的此方面的核酸分子的克隆和表达载体。此类表达载体可整合适当的转录和翻译控制序列,例如与本发明的核酸分子框内连接的增强子元件、启动子-操纵子区、终止序列、mrna稳定性序列、起始和终止密码子或核糖体结合位点。
优选地,载体为表达载体,其包含编码如本文中所定义的修饰的coversin多肽的核酸序列。还可以选择编码序列以提供适合于待使用的宿主生物体的优选的密码子用途。其它合适的载体对于本领域技术人员而言是显而易见的,参见sambrooketal.(1989)。优选地,载体中的用于本发明的聚核苷酸可操作地连接于控制序列,所述控制序列能够通过宿主细胞实现编码序列的表达,即载体为表达载体。术语“可操作地连接”是指一种并接(juxtaposition),其中所描述的组件处于允许其按预定方式发挥作用的关系。“可操作地连接”于编码序列的调节序列(例如启动子)的安置方式使得编码序列在与调节序列相容的条件下实现表达。
根据本发明的载体包括质粒和病毒(包括噬菌体和真核病毒二者),以及其它线性或环形dna载体,如采用转座元件或同源重组技术的那些载体。
许多此类载体和表达系统为已知的且记录在本领域中(fernandezandhoeffler,1998)。尤其合适的病毒载体包括基于杆状病毒、腺病毒和牛痘病毒的载体。
重组表达的合适宿主包括常用的原核物种,如大肠杆菌或真核酵母,它们可以表达高水平的重组蛋白,并且可容易地大量生长。优选地,宿主细胞为真核酵母细胞。体外生长的哺乳动物细胞系也是合适的,尤其在使用病毒驱动的表达系统时。另一合适的表达系统为涉及使用昆虫细胞作为宿主的杆状病毒表达系统。表达系统也可构成将dna并入其基因组中的宿主细胞。
蛋白质或蛋白质片段还可表达于体内,例如昆虫幼虫或哺乳动物组织中。
可使用多种技术将根据本发明的载体引入至原核或真核细胞中。文献中(sambrooketal.,1989;ausubeletal.,1991;spector、goldmanandleinwald,1998)已充分描述了合适的转化或转染技术。在真核细胞中,表达系统可根据系统需要而为瞬时的(例如游离型(episomal))或永久的(染色体整合)。
宿主细胞
本发明还包括经转化或转染的包含如上文所定义的核酸分子、反义核酸分子或载体的原核或真核宿主细胞。当宿主细胞为原核细胞时,其优选为大肠杆菌细胞。
优选的真核宿主细胞包括真核酵母细胞和哺乳动物细胞。
本发明还提供制备如上文所定义的修饰的coversin多肽的方法,其包括在借以表达蛋白的条件下培养根据本发明的含有核酸分子的宿主细胞和回收因此产生的蛋白。优选地,宿主细胞为酵母细胞或大肠杆菌细胞。
组合物
根据本发明的另一方面,提供一种组合物,其包含根据本发明的上述方面的修饰的coversin多肽、包含修饰的coversin多肽的融合蛋白或包含编码修饰的coversin多肽的核酸序列的核酸分子以及药学上可接受的载体。
如本文所用,术语“药学上可接受的载体”包括基因、多肽、抗体、脂质体、多糖、聚乳酸、聚乙醇酸和无活性病毒颗粒或实际上任何其它试剂,只要赋形剂本身不诱发毒性效应或不产生对接受药物组合物的个体有害的抗体。药学上可接受的载体可额外地含有液体,如水、生理盐水、甘油、乙醇或助剂物质,如湿润剂或乳化剂、ph缓冲物质等。举例来说,可使用水溶液或pbs溶液。
赋形剂可使得药物组合物能够被调配成片剂、丸剂(包括机械丸剂)、糖衣药丸、胶囊、液体、凝胶、糖浆、浆液、悬浮液、乳液、软膏、乳膏、气溶胶喷雾以有助于患者摄入。还可使用用于递送治疗物质的纳米粒子或离子电渗疗法(iontophoresis)。remington'spharmaceuticalsciences,mackpub.co.,n.j.1991中充分讨论了药学上可接受的载体。
根据另一方面,本发明提供用于治疗的根据本发明的上述方面的修饰的coversin多肽、包含修饰的coversin多肽的融合蛋白或包含编码修饰的coversin多肽的核酸序列的核酸分子。
本发明还提供治疗罹患lk/e(尤其ltb4)介导的疾病或病症的动物或预防动物产生lk/e(尤其ltb4)介导的疾病或病症的方法,所述方法包括以治疗或预防有效量向所述动物施用根据本发明的上述方面的修饰的coversin多肽、包含修饰的coversin多肽的融合蛋白或包含编码修饰的coversin多肽的核酸序列的核酸分子,或根据本发明的上述方面的药物组合物。
本发明还提供根据本发明的上述方面的修饰的coversin多肽、包含修饰的coversin多肽的融合蛋白或包含编码修饰的coversin多肽的核酸序列的核酸分子,用于治疗罹患lk/e(尤其ltb4)介导的疾病或病症的动物或预防动物产生lk/e(尤其ltb4)介导的疾病或病症的方法。
优选地,所述动物为哺乳动物,更优选为人类。
术语“治疗有效量”是指治疗或改善目标疾病或病况所需的化合物的量。本文所用的术语“预防有效量”是指预防目标疾病或病况所需的化合物的量。精确剂量一般取决于施用时患者的状态。在确定剂量时可考虑的因素包括患者的疾病状态的严重程度、患者的一般健康状况、年龄、体重、性别、饮食、施用时间和频率、药物组合、反应敏感性和患者对疗法的耐受性或应答。
可通过常规实验确定精确量,但可能最终取决于临床医师的判断。优选地,药剂的剂量足以在受试者中结合尽可能多可用的lk/e,例如ltb4,更优选地所有可用的lk/e,例如ltb4。
需要施用的剂量的频率取决于涉及的药剂的半衰期。修饰的coversin多肽可以连续输注形式、以大丸(bolus)剂量或每日一次、每日两次或每2、3、4、5、6、7、10、15或20天或更长时间一次地施用。修饰的coversin多肽的特定优势为其可相对简易且快速地施用,和不需要医疗专业人员施用蛋白质的事实。
可施用单一剂量或多个剂量。举例来说,可施用至少2、3、4、5、6、7或8个剂量。单一剂量为一个实施方案。精确剂量和剂量频率还可取决于施用时患者的状态。确定剂量时可考虑的因素包括治疗或预防的需要、患者的疾病状态的严重程度、患者的一般健康状况、年龄、体重、性别、饮食、施用时间和频率、药物组合、反应敏感性和患者对疗法的耐受性或应答。可通过常规实验确定精确量,但可能最终取决于临床医师的判断。
给药方案还可以采取初始“负荷剂量”后跟一个或多个后续“维持剂量”的形式。一般来说,负荷剂量大于维持剂量。负荷剂量比维持剂量大2、5、10倍或更多倍。负荷剂量可以单一剂量形式施用,或以特定时间范围内的一个或多个剂量形式施用。通常,负荷剂量为单一24小时时段内施用的1、2、3、4或5个剂量。维持剂量可为以规律时间间隔重复的较低剂量。维持剂量可以一定间隔,如每3、4、6、8、12、24或48小时重复。精确方案可通过常规实验确定,但可能最终取决于临床医师的判断。维持剂量可为初始负荷剂量的至少20、30、40、50、60、70、80、90或100%,或初始负荷剂量的至多20、30、40、50、60、70、80、90或100%。
在另一实施方案中,在整个疗程中(例如每日)使用相同剂量。
可通过任何已知施用途径递送所述修饰的coversin多肽、包含修饰的coversin多肽的融合蛋白或包含编码修饰的coversin多肽的核酸序列的核酸分子。其可局部或全身地递送。其可通过肠道外途径递送(例如通过皮下、腹膜内、静脉内或肌肉内注射或递送到组织的间隙空间)。也可将组合物施用至病灶中。其它施用模式包括经口和经肺施用、栓剂和透皮(transdermal)或经皮(transcutaneous)施用、针和无针注射器(hypospray)。局部(local)施用可包括体表(topical)施用。优选地,其经由皮下注射递送。
疾病和病况
本发明的发明人已发现如本申请和权利要求书中所定义的修饰的coversin多肽能够结合至e/lk,例如ltb4,但不显示c5结合或显示减少的c5结合。ltb4是已描述的具有最强趋化性和化学增活性的类二十烷酸,并且通过上调整合素来促进嗜中性粒细胞粘附至血管内皮。ltb4诱导嗜中性粒细胞聚集且通过多种过程在发炎中起作用。已显示ltb4在诱导和管理适应性免疫反应中有作用。因此,能够结合至并囚禁白三烯和羟基类二十烷酸的修饰的coversin多肽可阻止这些配体与blt1和blt2受体相互作用,并且可用于改善脂肪酸的促炎作用。
可使用本发明的修饰的coversin多肽治疗的疾病和病症的实例如下。
α-1抗胰蛋白酶病(aatd)、肺动脉高血压(pah)、慢性阻塞性肺病(copd)、闭塞性细支气管炎综合症(bos)、特发性肺病(ipd)、重度持续性哮喘、运动和阿司匹林诱发的哮喘、过敏性鼻炎、硅肺病(silicosis)。
自身免疫性水疱病、特应性皮炎、接触性皮炎、银屑病、丘-施二氏综合症(churg-strausssyndrome)。
类风湿性关节炎、破骨细胞性关节炎、绝经后骨质疏松、系统性红斑狼疮(sle)、发炎性肠病、包括古德帕斯彻综合症(goodpasture’ssyndrome)和肾小球肾炎的血管炎、系统性硬化症、2型糖尿病、糖尿病性肾病、镰形细胞病(scd)、疟疾、创伤、心肌梗塞、阻塞性睡眠呼吸暂停综合症、动脉粥样硬化、冠状动脉成形术后再狭窄、多发性硬化症(ms)、神经病。
胰腺癌、卵巢癌、结肠癌、前列腺癌、肺癌、食道癌、癌转移。
休格连氏干眼(sjogren'sdryeye)、移植物抗宿主综合症干眼、干燥性角膜结膜炎、特应性角膜结膜炎、粘膜性类天疱疮、春季角膜结膜炎、眼睑角膜结膜炎、常年性角膜结膜炎、眼部红斑狼疮、眼部红斑痤疮、砂眼、细菌、病毒或真菌角膜炎、眼部单纯疱疹或带状疱疹、圆锥形角膜,包括但不限于以下种类:遗传、创伤、色素性视网膜炎、早产视网膜炎、唐氏综合症(down'ssyndrome)、成骨不全症、爱迪生氏病(addison'sdisease)、莱伯氏先天性黑蒙(leber'scongenitalamaurosis)和埃勒斯-当洛斯综合症(ehlers-danlossyndrome)、地图-点状-指纹状角膜营养不良(map-dot-fingerprintcornealdystrophy)、富克氏角膜营养不良(fuch'scornealdystrophy)、格子状角膜营养不良(latticecornealdystrophy)、光性角膜炎、前葡萄膜炎、翼状胬肉(pterygium)、自身免疫性葡萄膜炎、过敏性结膜炎。
可根据本发明治疗的一些特定病症的实例包括葡萄膜炎、特应性皮炎、接触性过敏反应、溃疡性结肠炎、食管腺癌、胰腺癌(pancreaticadenocarcinoma)、乳腺癌、卵巢癌、结肠癌、肺癌、痤疮、阻塞性细支气管炎、动脉瘤、牙周病、囊肿性纤维化、前列腺癌、发炎后色素沉着、肌肉纤维疼痛、系统性红斑狼疮、肿瘤转移、硬皮病、多发性硬化症、类肉瘤病、辐射诱发的胃肠道发炎和痛风。
可根据本发明治疗的其它病况和病症包括哮喘、支气管炎、动脉粥样硬化、银屑病、银屑病性关节炎、发炎性肠病(包括克罗恩氏病(crohn'sdisease))、败血症、动脉炎、心肌梗塞、中风和冠心病、缺血性再灌注损伤、肾炎和关节炎,包括类风湿性关节炎、脊椎关节病、骨关节炎和幼年型关节炎。可根据本发明治疗的已知由ltb4介导的病况包括阻塞性细支气管炎、硬皮病、间质性肺病、牙周病、慢性b淋巴细胞性白血病、前列腺癌和动脉粥样硬化。
可根据本发明治疗的已知由ltb4和补体介导的病况包括肾炎、各种类型的关节炎、葡萄膜炎、癌症、败血症、缺血性再灌注损伤、中风和心肌梗塞。
最优选地,本发明用于治疗aatd、copd、pah、重度持续性哮喘、gvhd、水疱性皮肤病和银屑病。
补体和lk/e活性
本发明的修饰的coversin多肽展现出白三烯或羟基类二十烷酸结合活性。由于对seqidno:2或3中的氨基酸序列的修饰,修饰的coversin多肽还展现出减少或缺乏的补体c5结合活性(相对于seqidno:2或seqidno:3中的未修饰的coversin氨基酸序列)。
减少/缺乏的c5结合
可通过本领域中已知的标准体外分析测定本发明的修饰的多肽结合至补体c5蛋白质(包括来自具有c5多态性的受试者的c5)的能力,例如通过将蛋白质与标记的c5一起在凝胶上孵育后进行的蛋白质印迹法或表面等离子体共振来测定(参见例如实施例2)。
野生型coversin与c5结合且以约0.02mg/ml的ic50防止c5被大鼠、小鼠和人类血清中的c5转化酶裂解。已证明,coversin蛋白质以1nm的kd(使用表面等离子体共振(spr)测得)结合至c5(参见例如实施例2)。
优选地,修饰的coversin多肽展现出比未修饰的coversin多肽更弱的c5结合能力。在优选实施方案中,修饰的coversin多肽可不展现可检测的c5结合。
与seqidno:2或3中未修饰的coversin多肽展现的结合相比,本发明的一些实施方案中的c5结合例如减少了至少2、5、10、15、20、50、100倍,或消除了c5结合。
在一些实施方案中,与seqidno:2或3中未修饰的coversin多肽相比,c5结合减少了至少50%、60%、70%、80%、90%或95%。
在一些实施方案中,修饰的coversin多肽以大于1微摩尔的kd结合c5,如通过表面等离子体共振,根据roversietal.(2013)jbiolchem.288,18789-18802中描述的方法,或如实施例2中所示地测定。
在一些实施方案中,根据或类似于giclas1994来进行ch50裂解(lytic)分析,修饰的coversin多肽在以0.02mg/ml的浓度存在于收集的正常全血清中时抑制小于10%的绵羊红血球裂解(lysis)。
可通过测量试剂抑制血清中的补体活化的能力来测定本发明的修饰的多肽与c5的结合能力。举例来说,可通过本领域中已知的任何方法来测量血清中的补体活性。
不受影响的lk/e结合
本发明的修饰的coversin多肽可抑制lk/e(例如白三烯b4(ltb4))活性。具体地,本发明的修饰的coversin多肽可结合此类分子。可通过本领域中已知的标准体外分析测定试剂结合这些分子的能力,例如通过coversin与抗lk/e(例如抗ltb4)抗体竞争结合至标记的lk/e(例如ltb4)的竞争性elisa来测定。此类分析陈述于roversi等人2013中。
根据本发明的修饰的coversin多肽可以与野生型coversin相同或更大的亲和力结合lk/e。结合的一些降低也是可接受的。
还可根据如通过荧光滴定测定的kd来表示coversinltb4结合。使用荧光滴定获得的数据已显示野生型coversin以200-300pm之间的kd结合ltb4。根据本发明的修饰的coversin多肽与ltb4结合的kd优选地小于5nm、2nm或1nm,更适宜地小于0.9nm,最适宜地小于0.8nm,优选小于0.7nm,更优选小于0.6nm,优选小于0.5nm,甚至更优选小于0.4nm,且有利地小于0.3nm,其中使用荧光滴定来测定所述kd,例如根据实施例3中描述的方法测定。
在一些实施方案中,根据roversietal.(2013)jbiolchem.288,18789-18802中描述的elisa方法,修饰的coversin多肽与抗体竞争结合ltb4。
实施例
实施例1:coversin变体在大肠杆菌中的表达
将编码coversin变体1(seqidno:5)和2(seqidno:6)的基因构建体克隆至大肠杆菌表达载体中,其接着转化成大肠杆菌表达菌株。接着使用确立的发酵方案用复合培养基进行细菌培养物发酵。
将所得澄清细胞培养物在20mmbis-tris缓冲液,ph6.0中浓缩,施加至deae-琼脂糖ff柱(gehealthcare),然后在相同缓冲液中用nacl的阶梯梯度洗脱。然后使用20mmbis-tris缓冲液中(nh4)2so4的线性梯度使纯化馏分通过苯基琼脂糖hp柱。用sds-page分析色谱馏分且合并。coversin变体1进行另一纯化步骤,其中将合并的蛋白质馏分施加至superdex75凝胶过滤柱。coversin变体2进行另一纯化步骤,其中将合并的蛋白质馏分施加至q-琼脂糖离子交换柱。
然后,将变体1和2的纯化馏分与野生型coversin一起在sds-page凝胶上运行。结果显示于图3中,证明两种coversin变体均在大肠杆菌中充分表达。
实施例2:coversin变体1和2相对于野生型coversin失去c5结合活性
为了测量coversin变体1和2相对于野生型coversin与c5的结合活性,使用biacore仪器(gehealthcare)进行spr实验。将含0.05%tween20的hepes缓冲生理盐水用作运行缓冲液(流动速率为30μl/min),将人类c5固定于cm3传感器芯片上达到总共4800ru。
在25℃下在biacore2000系统(gehealthcare,munich,germany)上进行实时亲和力测量。使用胺偶联试剂盒(gehealthcare)将人类c5(complementtechnology,tyler,tx,usa)以25μg/ml的浓度初始固定于10mmph5.0的乙酸钠的cm3传感器芯片(gehealthcare)上,产生4200-4800共振单位(ru)的配体密度。在存在含有0.05%v/vtween20的hepes缓冲生理盐水(hbs;10mmhepes/naohph7.4,150mmnacl)(hbst-0.05)作为运行缓冲液的情况下,以系列稀释浓度(对于coversin为0-96nm)或以1μm(对于变体)注射纯化的coversin、变体2和变体1。在30μl/min的连续流动速率下,在240s内观测复合物形成。随后,在用8μlimmunopuregentleag/ab洗脱缓冲液(thermofisherscientific,waltham,ma,usa)再生之前解离900s,从而破坏coversin与c5之间的强静电相互作用,接着注射120μl含有1mmedta的hbst-0.05和120μlhbst-0.05来清洗流通池。通过针对在线控制空白通道测量的对应信号和如先前所述(myszkad.g.(1999)改进生物传感器分析(improvingbiosensoranalysis.)《分子识别杂志(jmolrecognit.)》12(5):279-284)的三次缓冲液空白注射测定的平均基线的双重减除来校正传感图。使用biaevaluation软件通过将数据全局拟合至用于双分子复合物形成的朗格缪尔(langmuir)结合模型来测定动力学参数。
如图4a所示,coversin以1.45nm的kd结合至固定的c5。相比之下,当在1μm的coversin变体1和2的单次测量下进行相同实验时,均不产生显著应答,表明变体1和变体2均不结合c5。还测试了pas化的coversin变体1和2,结果类似(图4b)。
实施例3:coversin/变体在皮摩尔范围内结合ltb4
对于野生型coversin和变体1和2以及其pas化型式进行coversin结合至ltb4的荧光滴定。
用ls50b分光荧光计(perkin-elmer,norwalk,ct,usa)定量磷酸盐缓冲盐水(pbs)中coversin和变体1和2以及其pas化型式针对ltb4(caymenchemicals,annarbor,mi,usa)的结合活性。将2mlpbs中的纯化蛋白质的100nm溶液施置于配有电磁搅拌器的石英比色杯(10mm路径长度;hellma,mühlheim,germany)中。将温度调节至20℃,且在达到平衡之后,在280nm(狭缝宽度:15nm)处激发蛋白质tyr/trp荧光。在对应于发射最大值的340nm(狭缝宽度:16nm)处测量荧光发射。逐步添加30μmltb4配体的pbs溶液,直至20μl的最大体积(总样品体积的1%),且在孵育30s之后测量培育稳态荧光。为计算kd值,将数据标准化至100%的初始荧光强度,使用3μmn-乙酰基-色氨酰胺溶液的滴定校正内滤效应,并且相对于对应配体浓度标绘数据。接着,关于双分子复合物形成的基于质量作用定律的非线性最小平方回归用于利用origin软件版本8.5(originlab,northampton,ma,usa)使用公开的公式来拟合数据(breustedtetal.,2006comparativeligand-bindinganalysisoftenhumanlipocalins.biochimbiophysacta1764(2):161-173)。
图5a和b显示两种coversin变体以及其pas化型式均保留ltb4结合活性,以皮摩尔范围内的kd结合ltb4。
实施例4:使用cd光谱法的热稳定性分析
圆二色性用于检测由热变性所致的蛋白质去折叠。使用此方法,获得野生型coversin和coversin变体1和2的熔化(melting)温度。
在配有peltier元件pt-423s的j-810分光偏振计(jasco,tokyo,japan)中测量热去折叠,两者均受spectramanager版本1.53.05仪器软件控制。经由使用slide-a-lyzertm微型透析装置(thermofisherscientific,waltham,ma,usa)在4℃下透析过夜将蛋白质溶液缓冲交换为20mmkpiph7.5,50mmk2so4,且在12.5μm的蛋白质浓度下在石英比色杯(1mm路径长度;hellma)中在20℃和94℃下从190nm至250nm记录光谱。以此方式,变性研究的最优信号变化被鉴别为位于217nm处。在以60k/h的梯度从20℃加热至94℃时用蛋白质溶液测定熔化温度(tm)。于217nm处记录数据且根据蛋白质折叠的双态模型(two-state-model)使用公开的公式(schlehuberandskerra,2002tuningligandaffinity,specificity,andfoldingstabilityofanengineeredlipocalinvariant--aso-called'anticalin'--usingamolecularrandomapproach.biophyschem.96(2-3):213-228)用kaleidagraph软件(synergysoftware,reading,pa,usa)评估。
相对于温度标绘未折叠蛋白质的分率以得到图6中的熔化曲线以及野生型coversin和变体1和2的熔化温度值。如图6所示,野生型coversin的熔化温度为61.06℃±0.03℃,变体2的熔化温度为57.83℃±0.04℃,变体1的熔化温度为50.16℃±0.06℃。
实施例5:coversin变体不展示c5抑制活性
为了评估coversin/coversin变体1和2对c5的抑制作用,使用下文详述的方案用纯化的coversin蛋白质进行ch50分析。
使用兔溶血素(sigma)根据giclasetal.1994的方法敏化绵羊红血球(srbc)。使用在补充有钙和镁的明胶佛罗那(veronal)缓冲生理盐水中1:80稀释的25μl收集的正常人血清(nhs)和25μl敏化的srbc以50μl的总体积进行分析。所有裂解分析均设置于冰上。coversin、coversin变体1和coversin变体2的连续稀释液在稀释的nhs中制成。在37℃下以350rpm振荡培育分析反应30分钟。通过在4000g下微量离心5秒停止反应且将上清液移出至平底96孔板。将100μlddh2o添加至每个孔且在蛋白质存在下的裂解百分比计算为通过添加25μl水代替稀释的nhs至反应物而诱发的总裂解的百分比。
通过在每种coversin蛋白质存在下细胞的裂解百分比来评估每种蛋白质对c5的抑制作用。405nm处的吸光度测量被视为沿着coversin蛋白质浓度的范围的细胞裂解的测量。
图7显示含有不同浓度的野生型coversin的样品中的细胞裂解百分比在各浓度下维持低于10%,表明野生型coversin对c5的已知抑制作用。相比之下,含有不同浓度的两种coversin变体的样品中的几乎所有细胞均被裂解,表明两种变体均不具有针对c5的任何可检测抑制活性。
实施例6:l-coversin降低hdm哮喘小鼠模型中的粒细胞浸润
为了测试coversin变体在体内的作用,将变体2引入至由屋尘螨(hdm)过敏原诱发的哮喘小鼠模型(参见gregory,l.g.etal.,2009)。如下文所概述地测试六组小鼠:
1.pbs(n=4)
2.l-coversin(n=4)
3.hdm(n=6)
4.hdm/l-coversin(n=6)
将25μghdm以50μlpbs气管内(i.t.)施用至4-6只小鼠的组,每周3次持续3周。每日以50μlpbs施用100μgl-coversin,持续3周。将pbs以相同给药方案施用至对照组(第1组)。
接着测试各组的支气管肺泡灌洗液(balf)中嗜酸性粒细胞和嗜中性粒细胞的含量。结果显示于图8中。图8中显示,相对于仅有hdm的对照组,l-coversin在支气管肺泡灌洗液中引起嗜中性粒细胞数目的显著减少和嗜酸性粒细胞数目的接近显著减少。
实施例7:eba转移模型中的pas化l-coversin
使用由sitaruetal.,2005描述的方案的修改版本来诱发抗体转移获得性大疱性表皮松懈症(eba)。简单来说,在第0、2和4天向小鼠皮下注射50μg亲和力纯化的抗col7igg。在第一次注射抗col7igg之前四天(第-2天)开始每天两次向小鼠皮下注射coversin或pas化l-coversin(pas化变体2)。在整个实验中继续此施用直至其最后一天(第11天)。在对照组中,小鼠仅通过皮下接受媒剂。
为了产生针对小鼠vii型胶原蛋白的抗体(“抗col7”),用200μg含有衍生自胶原蛋白vii的非胶原1(nc1)域的三种不同重组蛋白(“col7a、b和c”)以及不完全弗氏佐剂的蛋白混合物免疫新西兰白兔。通过使用蛋白g从经免疫兔的血清分离igg,且随后用his-col7对igg进行亲和力纯化以特定地获得兔抗col7igg。通过在冷冻切片分析中测定效价和效力来对抗体进行质量检查。
从第4天开始,每隔一天对每只单个小鼠进行皮肤损伤程度评分。经过训练的观察员将展现出红斑、水疱、糜烂、痂皮或秃发的皮肤区域分类为“受影响”或“不受影响”[sitaruetal.,2005]。计算受皮肤损伤影响的总身体表面(absa)的百分比。
实验结果显示于图9中。可以看出,用2.5mg/kg的coversin治疗的小鼠的absa百分比减少,且用10mg/kg的pas化l-coversin变体2治疗的小鼠的absa也减少。使用的pas-l-coversin序列为n末端融合有pas序列的变体2。因为pas-l-cov的分子量较高,所以10mg/kgpas-l-cov对应于2.5mg/kgcoversin。
参考文献
aya,i.(2006)blockadeofleukotrieneb4signallingpathwaydirectlyinhibitscellproliferationandinducesapoptosiscoloncancer,yokohamamedicaljournal57,43-52.
ausubel,f.m.,davis,k.r.,schott,e.j.,dong,x.,andmindrinos,m.(1991)identificationofsignaltransductionpathwaysleadingtotheexpressionofarabidopsisthalianadefensegenes,advancesinmoleculargeneticsofplant-microbeinteractions1:357-364.
barratt-due,a.,thorgersen,e.b.,lindstad,j.k.,pharo,a.,lissina,o.,lambris,j.d.,nunn,m.a.,mollnes,t.e.(2011)ornithodorosmoubatacomplementinhibitorisanequallyeffectivec5inhibitorinpigsandhumans.jimmunol.187(9):4913-9
bisgaardh.,groths.,andmadsenf.(1985).bronchialhyperreactivitytoleukotriened4andhistamineinexogenousasthma.brmedj.290,1468-1471.
chen,m.,lam,b.k.,kanaoka,y.,nigrovic,p.a.,audoly,l.p.,austen,k.f.andleed.m.(2006).neutrophilderivedleukotrieneb4isrequiredforinflammatoryarthritis.j.exp.med.203,837-842.
curry,s.l.,cogar,s.m.andcook,j.l.(2005).nonsteroidalantiinflammatorydrugs:areview.journaloftheamericananimalhospitalassociation41,298-309.
curtis-prior,p.(ed.)theeicosanoids.johnwiley&sons.isbn04711489840.
czarnetzki,b.(1983).increasedmonocytechemotaxistowardsleukotrieneb4andplateletactivatingfactorinpatientswithinflammatorydermatoses.clinexpimmunol.54,486-492.
delpretea.,shaow.h.,mitolas.,santorog.,sozzanis.,andharibabu,b.(2007)regulationofdendriticcellmigrationandadaptiveimmuneresponsebyleukotrieneb4receptors:aroleforltb4inup-regulationofccr7expressionandfunction.blood,109,626-631.
drazenj.m.(1988).comparativecontractileresponsestosulfidopeptideleukotrienesinnormalandasthmatichumansubjects.annnyacadsci.524,289-297.
dubel.m.,swansonl.j.,awniw.m.,bellr.l.,carterg.w.,ochsr.f.(1998).zileuton:thefirstleukotrieneinhibitorforuseinthemanagementofchronicasthma.in:drazenjm,dahlens,leeth,eds.five-lipoxygenaseproductsinasthma.newyork,ny:marceldekkar,inc.
fernandez,j.,andhoeffler,j.geneexpressionsystem:usingnaturefortheartofexpression,1998
ford-hutchinson,a.(1990).leukotrieneb4ininflammation.crit.rev.immunol.10,1-12.
giclas,p.c.(1994).classicalandalternativepathwayevaluation(sections13.1and13.2).incurrentprotocolsinimmunology,vol.3,complement.editors:j.e.coligan,a.m.kruisbeek,d.h.margulies,e.m.shevachandw.strober.serieseditor:r.coico.johnwileyandsons,inc.,usa.
gregory,l.g.,etal.,inhaledhousedustmiteinducespulmonarythelper2cytokineproduction.clinexpallergy,2009.39(10):p.1597-610.
haocm.andbreyerm.d.(2007).physiologicandpathophysiologicrolesoflipidmediatorsinthekidney.kidneyinternational71,1105-1115.
harrison,k.a.,murphy,r.c.(1995).isoleukotrienesarebiologicallyactivefreeradicalproductsoflipidperoxidation.j.biol.chem.270,17273-17276.
hepburn,n.j.,williams,a.s.,nunn,m.a.,chamberlain-banoub,j.c,hamer,j.,morgan,b.p.andharris,cl.(2007)invivocharacterisationandtherapeuticefficacyofc5-specificinhibitorfromthesofttickornithodorosmoubata.jbiolchem.282,8292-8299.
hoover,h.,karnovasky,m.,austen,k.,corey,e.andlewis,r.(1984).leukotrieneb4actiononendotheliummediatesaugmentedneutrophil/endothelialadhesion.proc.nat.acad.sci.u.s.a.81,2191-2193.
imig,j.d.(2000).eicosanoidregulationoftherenalvasculature.am.j.physiol.renalphysiol.279,f965-f981.
jore,m.m.etal(2016)structuralbasisfortherapeuticinhibitionofcomplementc5,naturestructural&molecularbiology23,378–386
klaaspj.m.vangisbergen,martasanchez-hernandez,teunisb.h.geijtenbeek,andyvettevankooyk(2005)neutrophilsmediateimmunemodulationofdendriticcellsthroughglycosylation-dependentinteractionsbetweenmac-1anddc-sign.j.exp.med.201,1281-1292.
kim,n.d.,chou,r.c.,seung,e.,tager,a.m.andluster,a.d.(2006).auniquerequirementfortheleukotrieneb4receptorbltlforneutrophilrecruitmentininflammatoryarthritis.j.exp.med.203,829-835.
kim,n.d.andluster,a.d.(2007)regulationofimmunecellsbyeicosanoidreceptors,thescientificworldjournal7,1307-1328.
lundeenk.a.,sunb.,karlssonl.,andfouriea.m.(2006)leukotrieneb4receptorsbltlandblt2:expressionandfunctioninhumanandmurinemastcells.j.immunol.177,3439-3447.
miyahara,n.,miyahara,s.,takeda,k.,andgelfandg.w.(2006).roleoftheltb4/blt1pathwayinallergen-inducedairwayhyperresponsivenessandinflammation.allergolint.55,91-7.
noiri,e.,yokomizo,t.,kakao,a.,izumi,t.,fujita,t.,kimura,s.,andshimizu,t.(2000).aninvivoapproachshowingthechemotacticactivityofleukotrieneb(4)inacuterenalischaemic-reperfusioninjury.procnatacadsciusa97,823-828.
nunn,m.a.,sharma,a.,paesen,g.c.,adamson,s.,lissina,o.,willis,a.c.,&nuttall,p.a.(2005)complementinhibitorofc5activationfromthesofttickornithodorosmoubataj.immunol.174,2084-2091.paesengc,adamspl,harlosk,nuttallpa,stuartdi.(1999)tickhistamine-bindingproteins:isolation,cloning,andthree-dimensionalstructure.moicell3,661-671.
peters-golden,m.&hendersonjr.,w.r.(2007).leukotrienes.n.eng.j.med.357,1841-1854.
powellw.s.,androkachj.(2005)biochemistry,biologyandchemistryofthe5-lipoxygenaseproduct5-oxo-ete.proglipidres.44,154-183.
remington,j.p.(1991)remington'spharmaceuticalsciences.mackpub.co.
roversi,p.r.,lissina,o.,johnson,s.,ahmat,n.,paesen,g.c.,ploss,k.,boland,w.,nunn,m.a.,andlea,s.r.(2007)thestructureofomcianovellipocalininhibitorofthecomplementsystem.j.moi.biol.369:784-93.
roversi,p.,ryffel,b.,togbe,d.,maillet,i.,teixeira,m.,ahmat,n.,paesen,g.,lissina,o.,boland,w.,ploss,k.,caesar,j.,leonhartsberger,s.,lea,s.,andnunn,m.(2013)bifunctionallipocalinamelioratesmurineimmunecomplex-inducedacutelunginjury.j.biol.chem288:18789-18802
sambrook,j.,fritsch,e.f.,maniatis,t.(1989)molecularcloning:alaboratorymanual
samuelsson,b.(1983).leukotrienes:mediatorsofimmediatehypersensitivityreactionsandinflammation.science220,569-575.
schlapschy,m.,binder,u.,
schwartz,g.k.,weitzman,a.,o'reilly,e.,brail,l.,dealwis,d.p.,cleverly,a.,barile-thiem,b.,vinciguerra,v.,andbudmand.r.(2005)phaseiandpharmacokineticstudyofly293111,anorallybioavailableltb4receptorantagonist,inpatientswithadvancedsolidtumors.journalofclinicaloncology,23,5365-5373.
sebaldt,r.j.,sheller,j.r.,oates,j.a.,roberts,l.j.andfitzgeraldg.a.(1990).inhibitionofeicosanoidbiosynthesisbyglucocorticoidsinhumans.procnatlacadsd.u.s.a.8,6974-6978.
shaow.h.,delpretea.,bockc.b.,haribabub.(2006)targeteddisruptionofleukotrieneb4receptorsbltlandblt2:acriticalroleforbltlincollagen-inducedarthritisinmice.j.immunol.176,6254-6261.
sharma,j.n.andmohammed,l.a.(2006).theroleofleukotrienesinthepathophysiologyofinflammatorydisorders:isthereacaseforrevisitingleukotrienesastherapeutictargets?immunopharmacology14,10-16.
showell,h.j.,pettipher,e.r.,cheng,j.b.,breslow,r.,conklyn,m.,farrell,ca,hingorani,g.p.,salter,e.d.,hackman,b.c.,wimberly,dj.etal(1995).theinvitroandinvivopharmacologicactivityofthepotentandselectiveleukotrieneb4receptorantagonistcp-105696.j.pharm.exp.ther.273,176-184.
sitaru,c.,etal.inductionofdermal-epidermalseparationinmicebypassivetransferofantibodiesspecifictotypeviicollagenjclininvest2005;115:870-8.
spector,d.l.,goldman,r.d.,leinwand,l.a.(1998)cells:alaboratorymanual.coldspringharborlaboratorypress.
tager,a.m.andluster,a.d.(2003).bltlandblt2:theleukotrieneb(4)receptors.prostaglandinsleukot.essent.fattyacids69,123-134.
taubec,miyaharan.,ottv.,swansonb.,takedak.,loaderj.,shultzl.d.,tagera.m.,lustera.d.,dakhamaa.,andgelfande.w.(2006)theleukotrieneb4receptorbltlisrequiredforeffectorcd8+tcell-mediated,mastcell-dependentairwayhyperresponsiveness.j.immunol.176,3157-3164.
yamaoka,ka.,claesson,h.e.,androsen,a.(1989)leukotrieneb4enhancesactivation,proliferation,anddifferentiationofhumanblymphocytes.j.immunol.143,1996-2000.
yokomizo,t.,kato,k.,higiya,h.,izumi,t.andshimizu,t.(1997).ag-proteincoupledreceptorforleukotrieneb4thatmediateschemotaxis.nature387,620-624.
yokomizo,t.,kato,k.,terwaki,k.,y.,izumi,t.andshimizu,t.(2000).asecondleukotrieneb(4)receptor,blt2.anewtherapeutictargetininflammationandimmunologicaldisorders.j.exp.med.192,421-432.
yokomizo,t.,isumi,t.,chang,k.,takuwa,y.,shimizu,t.(2001).hydroxyeicosanoidsbindtoandactivatethelowaffinityleukotrieneb4receptorblt2.j.biol.chem.276,12454-12459.
序列表
<110>沃卢申伊缪诺制药公司
<120>治疗方法
<130>p070475wo
<141>2018-04-20
<150>gb1706406.4
<151>2017-04-21
<160>19
<170>seqwin2010,version1.0
<210>1
<211>507
<212>dna
<213>非洲钝缘蜱
<400>1
atgctggttttggtgaccctgattttctccttttctgcgaacatcgcatatgctgacagc60
gaaagcgactgcactggaagcgaacctgttgacgccttccaagctttcagtgagggcaaa120
gaggcatatgtcctggtgaggtccacggatcccaaagcgagggactgcttgaaaggagaa180
ccagccggagaaaagcaggacaacacgttgccggtgatgatgacgtttaagaatggcaca240
gactgggcttcaaccgattggacgtttactttggacggcgcaaaggtaacggcaaccctt300
ggtaacctaacccaaaatagggaagtggtctacgactcgcaaagtcatcactgccacgtt360
gacaaggtcgagaaggaagttccagattatgagatgtggatgctcgatgcgggagggctt420
gaagtggaagtcgagtgctgccgtcaaaagcttgaagagttggcgtctggcaggaaccaa480
atgtatccccatctcaaggactgctag507
<210>2
<211>168
<212>prt
<213>非洲钝缘蜱
<400>2
metleuvalleuvalthrleuilepheserpheseralaasnileala
151015
tyralaaspsergluseraspcysthrglysergluprovalaspala
202530
pheglnalaphesergluglylysglualatyrvalleuvalargser
354045
thraspprolysalaargaspcysleulysglygluproalaglyglu
505560
lysglnaspasnthrleuprovalmetmetthrphelysasnglythr
65707580
asptrpalaserthrasptrpthrphethrleuaspglyalalysval
859095
thralathrleuglyasnleuthrglnasnarggluvalvaltyrasp
100105110
serglnserhishiscyshisvalasplysvalglulysgluvalpro
115120125
asptyrglumettrpmetleuaspalaglyglyleugluvalgluval
130135140
glucyscysargglnlysleuglugluleualaserglyargasngln
145150155160
mettyrprohisleulysaspcys
165
<210>3
<211>150
<212>prt
<213>非洲钝缘蜱
<400>3
aspsergluseraspcysthrglysergluprovalaspalaphegln
151015
alaphesergluglylysglualatyrvalleuvalargserthrasp
202530
prolysalaargaspcysleulysglygluproalaglyglulysgln
354045
aspasnthrleuprovalmetmetthrphelysasnglythrasptrp
505560
alaserthrasptrpthrphethrleuaspglyalalysvalthrala
65707580
thrleuglyasnleuthrglnasnarggluvalvaltyraspsergln
859095
serhishiscyshisvalasplysvalglulysgluvalproasptyr
100105110
glumettrpmetleuaspalaglyglyleugluvalgluvalglucys
115120125
cysargglnlysleuglugluleualaserglyargasnglnmettyr
130135140
prohisleulysaspcys
145150
<210>4
<211>453
<212>dna
<213>非洲钝缘蜱
<400>4
gacagcgaaagcgactgcactggaagcgaacctgttgacgccttccaagctttcagtgag60
ggcaaagaggcatatgtcctggtgaggtccacggatcccaaagcgagggactgcttgaaa120
ggagaaccagccggagaaaagcaggacaacacgttgccggtgatgatgacgtttaagaat180
ggcacagactgggcttcaaccgattggacgtttactttggacggcgcaaaggtaacggca240
acccttggtaacctaacccaaaatagggaagtggtctacgactcgcaaagtcatcactgc300
cacgttgacaaggtcgagaaggaagttccagattatgagatgtggatgctcgatgcggga360
gggcttgaagtggaagtcgagtgctgccgtcaaaagcttgaagagttggcgtctggcagg420
aaccaaatgtatccccatctcaaggactgctag453
<210>5
<211>150
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>5
aspsergluseraspcysthrglysergluprovalaspalaphegln
151015
alaphesergluglylysglualatyrvalleuvalargserthrasp
202530
prolysalaargaspcysleulysglygluproalaglyglulysgln
354045
aspasnthrleuprovalmetmetthrphelysasnglythrasptrp
505560
alaserthrasptrpthrphethrleuaspglyalalysvalthrala
65707580
thrleuglyasnleuthrglnasnarggluvalvaltyraspsergln
859095
serhishiscyshisvalasplysvalglulysgluvalproasptyr
100105110
gluglntrpglnserasnglyseralaaspasplysgluvalglucys
115120125
cysargglnlysleuglugluleualaserglyargasnglnmettyr
130135140
prohisleulysaspcys
145150
<210>6
<211>150
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>6
aspsergluseraspcysthrglysergluprovalaspalaphegln
151015
alaphesergluglylysglualatyrvalleuvalargserthrasp
202530
prolysalaargaspcysleulysglygluproasnglyglulysgln
354045
aspasnthrleuprovalmetmetthrphelysasnglythrasptrp
505560
alaserthrasptrpthrphethrleuaspglyalalysvalthrala
65707580
thrleuglyasnleuthrglnasnarggluvalvaltyraspsergln
859095
serhishiscyshisvalasplysvalglulysgluvalproasptyr
100105110
glumettrpglnseraspalaglyalaaspalavalgluvalglucys
115120125
cysargglnlysleuglugluleualaserglyargasnglnmettyr
130135140
prohisleulysglycys
145150
<210>7
<211>150
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>7
aspsergluseraspcysthrglysergluprovalaspalaphegln
151015
alaphesergluglylysglualatyrvalleuvalargserthrasp
202530
prolysalaargaspcysleulysglygluproasnglyglulysgln
354045
aspasnthrleuprovalmetmetthrphelysasnglythrasptrp
505560
alaserthrasptrpthrphethrleuaspglyalalysvalthrala
65707580
thrleuglyasnleuthrglnasnarggluvalvaltyraspsergln
859095
serhishiscyshisvalasplysvalglulysgluvalproasptyr
100105110
glumettrpglnleuaspalaglyglyaspgluvalgluvalglucys
115120125
cysargglnlysleuglugluleualaserglyargasnglnmettyr
130135140
prohisleulysglycys
145150
<210>8
<211>150
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>8
aspsergluseraspcysthrglysergluprovalaspalaphegln
151015
alaphesergluglylysglualatyrvalleuvalargserthrasp
202530
prolysalaargaspcysleulysglygluproasnglyglulysgln
354045
aspasnthrleuprovalmetmetthrphelysasnglythrasptrp
505560
alaserthrasptrpthrphethrleuaspglyalalysvalthrala
65707580
thrleuglyasnleuthrglnasnarggluvalvaltyraspsergln
859095
serhishiscyshisvalasplysvalglulysgluvalproasptyr
100105110
glumettrpmetleuaspalaglyglyleugluvalgluvalglucys
115120125
cysargglnlysleuglugluleualaserglyargasnglnmettyr
130135140
prohisleulysaspcys
145150
<210>9
<211>11
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>9
mettrpmetleuaspalaglyglyleugluval
1510
<210>10
<211>11
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>10
glntrpglnserasnglyseralaaspasplys
1510
<210>11
<211>11
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>11
mettrpglnseraspalaglyalaaspalaval
1510
<210>12
<211>11
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>12
mettrpglnleuaspalaglyglyaspgluval
1510
<210>13
<211>20
<212>prt
<213>人工序列
<220>
<223>pas序列
<400>13
alaserproalaalaproalaproalaserproalaalaproalapro
151015
seralaproala
20
<210>14
<211>20
<212>prt
<213>人工序列
<220>
<223>pas序列
<400>14
alaalaproalaserproalaproalaalaproseralaproalapro
151015
alaalaproser
20
<210>15
<211>20
<212>prt
<213>人工序列
<220>
<223>pas序列
<400>15
alaproserserproserproseralaproserserproserproala
151015
serproserser
20
<210>16
<211>20
<212>prt
<213>人工序列
<220>
<223>pas序列
<400>16
seralaproserserproserproseralaproserserproserpro
151015
alaserproser
20
<210>17
<211>20
<212>prt
<213>人工序列
<220>
<223>pas序列
<400>17
serserproseralaproserproserserproalaserproserpro
151015
serserproala
20
<210>18
<211>24
<212>prt
<213>人工序列
<220>
<223>pas序列
<400>18
alaalaserproalaalaproseralaproproalaalaalaserpro
151015
alaalaproseralaproproala
20
<210>19
<211>20
<212>prt
<213>人工序列
<220>
<223>pas序列
<400>19
alaseralaalaalaproalaalaalaseralaalaalaseralapro
151015
seralaalaala
20
- 还没有人留言评论。精彩留言会获得点赞!