用于治疗自体免疫神经疾病及/或神经退化性疾病的方法以及用于液体剂型与控制释放剂型的药物制剂与流程
相关申请的交叉引用
本申请要求2017年6月30日提交的美国临时申请no.62/527,300的优先权,将其整体在此引入作为参考。
技术领域系关于治疗自体免疫神经疾病及/或神经退化性疾病的方法以及液体剂型与控释剂型的药物制剂。
背景技术:
涉及中枢与周围神经系统的自体免疫性疾病也称为自体免疫神经疾病。
多发性硬化症(multiplesclerosis,ms)是一种引起脊髓神经和脑细胞脱髓鞘的疾病,且被认为是一种自体免疫神经疾病。患有多发性硬化症的患者可能会出现多种症状。由于多发性硬化症的本质,人与人之间的症状变化相当大。多发性硬化症的症状甚至可以在每天的严重程度上发生变化,而两种最常见的症状则是疲劳与行走困难。
尽管对于自体免疫神经疾病及/或神经退化性疾病,如多发性硬化症,存在多种治疗选择,但尚无治愈的方法。
因此,亟需一种针对自体免疫神经疾病及/或神经退化性疾病的新疗法。
技术实现要素:
本揭露提供一种治疗自体免疫神经疾病及/或神经退化性疾病的方法。此方法包括对需要的个体投予有效量的具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物(geometricisomer)、对映异构体(enantiomer)、非对映异构体(diastereomer)或药学上可接受的盐类:
其中
x为nch3或ch2,
y为不存在、o或n,
r1为h、oh,且
r2为不存在、h、c1-c8烷基、–(c=o)–烷基、–(c=o)–芳基、–(c=o)–烷基-芳基、–(c=o)–杂芳基、环烷基或杂环烷基,其任选被一或多个的–oh、–no2、–nh2、–nr3r4、羰基、烷氧基、烷基或–ocf3所取代,其中r3与r4独立地为h、烷基、–so2ch3、–(c=o)-ch3或–(c=o)-nh2。
本揭露也提供一种具有式(i)、式(ii)或式(iii)的至少一种化合物的液体剂型的药物制剂。此具有式(i)、式(ii)或式(iii)的至少一种化合物的液体剂型的药物制剂包括:
按重量计0.1-30%的具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类:
其中
x为nch3或ch2,
y为不存在、o或n,
r1为h、oh,且
r2为不存在、h、c1-c8烷基、–(c=o)–烷基、–(c=o)–芳基、–(c=o)–烷基-芳基、–(c=o)–杂芳基、环烷基或杂环烷基,其任选被一或多个的–oh、–no2、–nh2、–nr3r4、羰基、烷氧基、烷基或–ocf3所取代,其中r3与r4独立地为h、烷基、–so2ch3、–(c=o)-ch3或–(c=o)-nh2;以及
按重量计0.1-15%的聚环氧乙烷(poly(ethyleneoxide),peo)与聚环氧丙烷(poly(propyleneoxide),ppo)的共聚物;
按重量计0.1-60%的环糊精或其衍生物;以及
按重量计1-99%的溶剂。
本揭露更提供一种具有式(i)、式(ii)或式(iii)的至少一种化合物的控释剂型的药物制剂。此具有式(i)、式(ii)或式(iii)的至少一种化合物的控释剂型的药物制剂包括:
粒子载体的组合物;
包覆于该载体上的载药层的组合物,其包括:
具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类:
其中
x为nch3或ch2,
y为不存在,o或n,
r1为h、oh,且
r2为不存在、h、c1-c8烷基、–(c=o)–烷基、–(c=o)–芳基、–(c=o)–烷基-芳基、–(c=o)–杂芳基、环烷基或杂环烷基,其任选定被一或多个的–oh、–no2、–nh2、–nr3r4、羰基、烷氧基、烷基或–ocf3所取代,其中r3与r4独立地为h、烷基、–so2ch3、–(c=o)-ch3或–(c=o)-nh2;以及
至少一种粘合剂;以及
包覆于该载药层上的控释层的组合物,
其中,于该控释剂型的药物制剂中,该粒子载体的组合物按重量计占35-98%,该载药层的组合物按重量计占1-64%,而该控释层的组合物按重量计占0.5-50%,且
其中,该具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类按重量计占该载药层的组合物的1-99%。
详细说明提供于如下实施例中,并可参考所配合的图示。
附图说明
通过阅读如下详细描述和实施例,并配合参考附图,可更全面地理解本发明,其中:
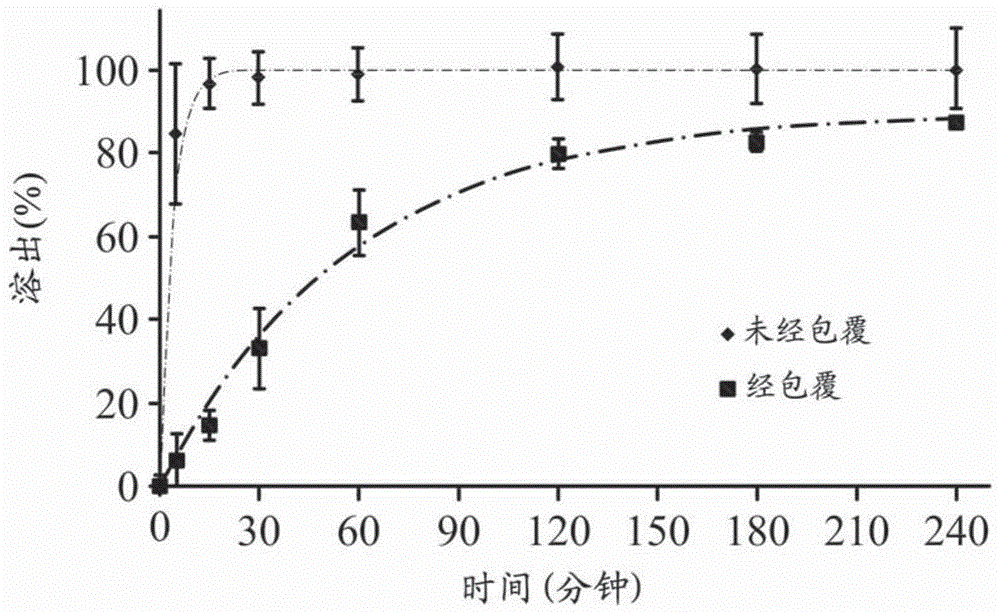
图1显示,具有17%(-)反式-索布瑞醇的控释颗粒(经包覆的药物携带颗粒(coated-drugcarryingparticle))与反式-索布瑞醇药物携带颗粒(未经包覆的药物携带颗粒(uncoated-drugcarryingparticle))的溶出试验的结果。
图2显示,具有20%(+)(-)反式-索布瑞醇的控释颗粒(经包覆的药物携带颗粒)与(+)(-)反式-索布瑞醇药物携带颗粒(未经包覆的药物携带颗粒)的溶出试验的结果。
图3显示,具有8%(+)(-)反式-索布瑞醇的控释颗粒(经包覆的药物携带颗粒)与(+)(-)反式-索布瑞醇药物携带颗粒(未经包覆的药物携带颗粒)的溶出试验的结果。
图4显示,具有32%(+)(-)反式-索布瑞醇的控释颗粒(经包覆的药物携带颗粒)与(+)(-)反式-索布瑞醇药物携带颗粒(未经包覆的药物携带颗粒)的溶出试验的结果。
图5a显示,在一治疗性给药试验中,每天一次被投予30mg/kg与100mg/kg剂量的(-)反式-索布瑞醇的小鼠与被投予载剂(vehicle)(dmso:crel:生理食盐水=10:10:80)的小鼠的分别的eae分数。平均值(mean)±平均值的标准差(standarderrorofthemean);n=10;*:p<0.05,**:p<0.01,相较于载剂处理组。学生t检定(student’st-test)。
图5b显示,在一治疗性给药试验中,每天两次被投予50mg/kg与100mg/kg剂量的(-)反式-索布瑞醇的小鼠与被投予载剂(dmso:crel:生理食盐水=10:10:80)的小鼠的分别的eae分数。bid(biindie):每天两次。平均值±平均值的标准差;n=10;*:p<0.05,**:p<0.01,***:p<0.001,相较于载剂处理组。学生t检定。
图5c显示,在一治疗性给药试验中,每天三次被投予10mg/kg、25mg/kg、50mg/kg与100mg/kg剂量的(-)反式-索布瑞醇的小鼠与被投予载剂(dmso:crel:生理食盐水=10:10:80)的小鼠,以及每天两次被投予100mg/kg剂量的富马酸二甲酯(dimethylfumarate)的小鼠的分别的eae分数
。bid(biindie):每天两次;tid(terindie):每天三次。平均值±平均值的标准差;n=10;*:p<0.05,**:p<0.01,***:p<0.001,相较于载剂处理组。学生t检定。
图6a显示,在一治疗性给药试验中,经每天三次100mg/kg剂量的(-)反式-索布瑞醇处理的小鼠的脊髓的苏木素与伊红染色(hematoxylinandeosinstain)的结果。
图6b显示,在一治疗性给药试验中,经每天三次载剂处理的小鼠的脊髓的苏木素与伊红染色的结果。以箭号指出脱髓鞘。
图6c显示,在一治疗性给药试验中,经每天三次100mg/kg剂量的(-)反式-索布瑞醇处理的小鼠的脊髓的luxolfastblue染色的结果。
图6d显示,在一治疗性给药试验中,经每天三次载剂处理的小鼠的脊髓的luxolfastblue染色的结果。以箭号指出脱髓鞘。
图7a显示,在一治疗性给药试验中,经每天三次100mg/kg剂量的(-)反式-索布瑞醇处理的小鼠、经每天三次载剂处理的小鼠与未经任何处理的小鼠的脊髓的脱髓鞘分数。tid(terindie):每天三次。平均值±平均值的标准差;n=10;***:p<0.001,相较于载剂处理组。学生t检定。
图7b显示,在一治疗性给药试验中,经每天三次100mg/kg剂量的(-)反式-索布瑞醇处理的小鼠、经每天三次载剂处理的小鼠与未经任何处理的小鼠的脊髓的轴突肿胀分数。tid(terindie):每天三次。平均值±平均值的标准差;n=10;**:p<0.01,***:p<0.001,相较于载剂处理组。学生t检定。
图7c显示,在一治疗性给药试验中,经每天三次100mg/kg剂量的(-)反式-索布瑞醇处理的小鼠、经每天三次载剂处理的小鼠与未经任何处理的小鼠的脊髓的发炎分数。tid(terindie):每天三次。平均值±平均值的标准差;n=10;**:p<0.01,***:p<0.001,相较于载剂处理组。学生t检定。
图7d显示,在一治疗性给药试验中,经每天三次100mg/kg剂量的(-)反式-索布瑞醇处理的小鼠、经每天三次载剂处理的小鼠与未经任何处理的小鼠的脊髓的神经胶质增生分数。tid(terindie):每天三次。平均值±平均值的标准差;n=10;***:p<0.001,相较于载剂处理组。学生t检定。
图8a显示,在一治疗性给药试验中,每天一次被投予100mg/kg剂量的(+)反式-索布瑞醇与(-)反式-索布瑞醇的混合物的小鼠与被投予载剂(dmso:crel:生理食盐水=10:10:80)的小鼠的分别的eae分数。平均值±平均值的标准差;n=10;*:p<0.05,**:p<0.01,相较于载剂处理组。学生t检定。
图8b显示,在一治疗性给药试验中,每天两次被投予15mg/kg、50mg/kg与100mg/kg剂量的(+)反式-索布瑞醇与(-)反式-索布瑞醇的混合物的小鼠与被投予载剂(dmso:crel:生理食盐水=10:10:80)的小鼠的分别的eae分数。bid(biindie):每天两次。平均值±平均值的标准差;n=10;*:p<0.05,**:p<0.01,相较于载剂处理组。学生t检定。
图9a显示,在一治疗性给药试验中,每天两次被投予150mg/kg剂量的所制备的(-)反式-索布瑞醇的液体剂型与每天一次被投予300mg/kg剂量的所制备的(-)反式-索布瑞醇的液体剂型的小鼠、每天三次被投予100mg/kg剂量的(-)反式-索布瑞醇与每天两次被投予载剂(6%peo-ppo-peo与40%2-羟丙基-β-环糊精(%:mg/100μl水))与每天三次被投予载剂(dmso:crel:生理食盐水=10:10:80)的小鼠的分别的eae分数。bid(biindie):每天两次;tid(terindie):每天三次;qd(quaquedie):每天一次。平均值±平均值的标准差;n=10;*:p<0.05,**:p<0.01,***:p<0.001,相较于载剂处理组。学生t检定。
图9b显示,在一治疗性给药试验中,每天两次被投予150mg/kg剂量的所制备的(-)反式-索布瑞醇的液体剂型与每天一次被投予300mg/kg剂量的所制备的(-)反式-索布瑞醇的液体剂型的小鼠、每天三次被投予100mg/kg剂量的(-)反式-索布瑞醇与每天两次被投予载剂(6%peo-ppo-peo与40%2-羟丙基-β-环糊精(%:mg/100μl水))与每天三次被投予载剂(dmso:crel:生理食盐水=10:10:80)的小鼠,在eae症状发作后的第15天的分别的eae分数。bid(biindie):每天两次;tid(terindie):每天三次;qd(quaquedie):每天一次。平均值±平均值的标准差;n=10;##:p<0.01,***:p<0.001,相较于载剂处理组。学生t检定。
图10显示,在一预防性给药试验中,每天一次被投予100mg/kg剂量的(-)反式-索布瑞醇的小鼠、被投予载剂(dmso:crel:生理食盐水=10:10:80)的小鼠与被投予50mg/kg剂量的富马酸二甲酯的小鼠的分别的eae分数。平均值±平均值的标准差;n=10;*:p<0.05,**:p<0.01,***:p<0.001,相较于载剂处理组。学生t检定。
实施方式
在以下详细描述中,出于解释的目的,阐述了许多具体细节以便提供对所揭示实施例的透彻理解。然而,清楚的是,可以在没有这些具体细节的情况下实施一个或多个实施例。在其他情况下,示意性地示出了公知的结构与装置以简化附图。
本揭露提供一种治疗自体免疫神经疾病及/或神经退化性疾病的方法。治疗自体免疫神经疾病及/或神经退化性疾病的方法可包括,但不限于,对一需要的个体投予一有效量的具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类:
其中
x可为nch3或ch2,
y可为不存在、o或n,
r1可为h、oh,且
r2可为不存在、h、c1-c8烷基、–(c=o)–烷基、–(c=o)–芳基、–(c=o)–烷基-芳基、–(c=o)–杂芳基、环烷基或杂环烷基,其任选被一或多个的–oh、–no2、–nh2、–nr3r4、羰基、烷氧基、烷基或–ocf3所取代,其中r3与r4独立地为h、烷基、–so2ch3、–(c=o)-ch3或–(c=o)-nh2。
在一实施例中,于上方的式(i)、式(ii)或式(iii)中,x可为nch3或ch2,y可为不存在、o或n,r1可为h、oh,而r2可为不存在、h、me、c2h5、c3h7、c4h9、c7h7、coch3、coc2h5、coc3h7、coc4h9、coc5h11、coc6h5、coch2c6h5、coc2h4c6h5、coc6h4no2或coc6h4oh,但不限于此。
上述自体免疫神经疾病可包括多发性硬化症(multiplesclerosis,ms)、视神经脊髓炎(neuromyelitisoptica)、兰伯特-伊顿肌无力综合征(lambert-eatonmyasthenicsyndrome)、自体免疫内耳疾病(autoimmuneinnereardisease)、嗜睡症(narcolepsy)、神经性肌强直(neuromyotonia)、格林-巴利综合征(guillain-barresyndrome)、重症肌无力(myastheniagravis)、全身性红斑狼疮(systemlupuserythematosus)、横贯性脊髓炎(transversemyelitis)或急性弥漫性脑脊髓炎(acutedisseminatedencephalomyelitis),但不限于此。又,上述神经退化性疾病的例子可包括,但不限于,阿兹海默症(alzheimer’sdisease)、亨廷顿氏症(huntington’sdisease)、帕金森氏症(parkinson’sdisease)、精神分裂症(schizophrenia)、抑郁症(depression)、肌肉萎缩性脊髓侧索硬化症(amyotrophiclateralsclerosis)、多发性梗塞痴呆(multi-infarctdementia)、运动神经性疾病(motorneurondisease)或神经纤维瘤病(neurofibromatosis),但不限于此。在一实施例中,上述自体免疫神经疾病及/或神经退化性疾病可为多发性硬化症(ms)。
于此所使用的用语“有效量”意指会具有治疗效果的化合物或药物的量,或足以达成所希望的临床改善的化合物或药物的量。
具有上方所示的式(i)的化合物的例子可包括具式(iv)至式(xvi)的任一个的化合物,但不限于此:
此外,具有上方所示的式(ii)的化合物的例子可包括具有式(xvii)的化合物,但不限于此:
再者,具有上方所示的式(iii)的化合物的例子可包括具有式(xviii)的化合物,但不限于此:
在一实施例中,对于治疗自体免疫神经疾病及/或神经退化性疾病的方法而言,上述具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类,可为具有式(iv)的至少一种化合物,并可为索布瑞醇(sobrerol)。索布瑞醇可包括,但不限于,(+)反式(trans)-索布瑞醇、(-)反式-索布瑞醇、(+)顺式(cis)-索布瑞醇、(-)顺式-索布瑞醇或其组合。
于前方所述实施例中,具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类,可为具有上方所示的式(iv)的至少一种化合物,并可为索布瑞醇,对于一特定实施例而言,索布瑞醇可为(+)反式-索布瑞醇,对于另一特定实施例而言,索布瑞醇可为(-)反式-索布瑞醇,而对于又另一实施例而言,索布瑞醇可为一(+)反式-索布瑞醇与(-)反式-索布瑞醇的混合物。
对于治疗自体免疫神经疾病及/或神经退化性疾病的方法而言,于前方所述实施例中,具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类,可为具有式(iv)的至少一种化合物,并可为索布瑞醇,而自体免疫神经疾病及/或神经退化性疾病可为多发性硬化症,但不限于此。
在另一实施例中,对于治疗自体免疫神经疾病及/或神经退化性疾病的方法而言,上述具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类可具有上方所示的式(v)至式(xviii)的任一个。在一特定实施例中,对于治疗自体免疫神经疾病及/或神经退化性疾病的方法而言,上述具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类可为具有式(i)的至少一种化合物,并具有上方所示的式(v)至式(xvi)的任一个。在另一特定实施例中,对于治疗自体免疫神经疾病及/或神经退化性疾病的方法而言,上述具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类可为具有式(ii)的至少一种化合物,并具有上方所示的式(xvii)。在又另一特定实施例中,对于治疗自体免疫神经疾病及/或神经退化性疾病的方法而言,上述具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类可为具有式(iii)的至少一种化合物,并具有上方所示的式(xviii)。
在任何前述治疗自体免疫神经疾病及/或神经退化性疾病的方法中,个体可包括,但不限于,脊椎动物。又,上述脊椎动物可包括鱼类、两栖类、爬虫类、鸟类或哺乳类,但不限于此。哺乳类的例子可包括,但不限于,人类、猩猩、猴子、马、驴、狗、猫、兔子、天竺鼠、大鼠与小鼠。在一实施例中,在任何前述本揭露的治疗自体免疫神经疾病及/或神经退化性疾病的方法中,个体为人类。
此外,本揭露也提供具有式(i)或式(ii)的至少一种化合物的液体剂型的新颖药物制剂:
其中
x可为nch3或ch2,
y可为不存在、o或n,
r1可为h、oh,且
r2可为不存在、h、c1-c8烷基、–(c=o)–烷基、–(c=o)–芳基、–(c=o)–烷基-芳基、–(c=o)–杂芳基、环烷基或杂环烷基,其任选被一或多个的–oh、–no2、–nh2、–nr3r4、羰基、烷氧基、烷基或–ocf3所取代,其中r3与r4独立地为h、烷基、–so2ch3、–(c=o)-ch3或–(c=o)-nh2。
在一实施例中,在上方的式(i),式(ii)或式(iii)中,x可为nch3或ch2,y可为不存在、o或n,r1可为h、oh,而r2可为不存在、h、me、c2h5、c3h7、c4h9、c7h7、coch3、coc2h5、coc3h7、coc4h9、coc5h11、coc6h5、coch2c6h5、coc2h4c6h5、coc6h4no2或coc6h4oh,但不限于此。
前述具有上方所示的式(i)、式(ii)或式(iii)的至少一种化合物的液体剂型的药物制剂可包括,但不限于,具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类、聚环氧乙烷(poly(ethyleneoxide),peo)与聚环氧丙烷(poly(propyleneoxide),ppo)的共聚物、环糊精(cyclodextrin)或其衍生物,与溶剂。
在上述本揭露的具有式(i)、式(ii)或式(iii)的至少一种化合物的液体剂型的药物制剂中,具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类按重量计可占约0.1-30%,例如,按重量计约0.1-10%、约5-25%、约10-20%或约20-30%,但不限于此。
具有式(i)的化合物的例子可如上方关于本揭露的治疗自体免疫神经疾病及/或神经退化性疾病的方法的段落中所记载者,而并不于此重复以避免赘述。
相似地,具有式(ii)的化合物的例子及具有式(iii)的化合物的例子可如上方关于本揭露的治疗自体免疫神经疾病及/或神经退化性疾病的方法的段落中所记载者,而并不于此重复以避免赘述。
又,在前述本揭露的具有式(i)或式(ii)的至少一种化合物的液体剂型的药物制剂中,聚环氧乙烷与聚环氧丙烷的共聚物按重量计可占约0.1-15%,例如,按重量计约0.1-5%、约0.5-12%、约5-10%或约10-15%,但不限于此。
聚环氧乙烷与聚环氧丙烷的共聚物的例子可包括,但不限于,(聚环氧乙烷)x-(聚环氧丙烷)y-(聚环氧乙烷)x(peo-ppo-peo)。对于(聚环氧乙烷)x-(聚环氧丙烷)y-(聚环氧乙烷)x而言,x可为约30-120的整数,例如,约30-60、约40-100、约60-120,而y可为约10-50的整数,例如,约10-25、约20-40、约25-50,但不限于此。
此外,在上述本揭露的具有式(i)、式(ii)或式(iii)的至少一种化合物的液体剂型的药物制剂中,环糊精或其衍生物按重量计可占约0.1-60%,例如,按重量计约0.1-20%、约1-50%、约5-40%、约20-40%或约40-60%,但不限于此。
环糊精的衍生物可包括2-羟丙基-β-环糊精(2-hydroxypropyl-betacyclodextrin)、2-羟丙基-γ-环糊精(2-hydroxypropyl-γ-cyclodextrin)、β-cd磺丁基醚钠盐(β-cdsulfobutylethersodiumsalt)或无规甲基化的β-环糊精(randomlymethylatedβ-cyclodextrin)等,但不限于此。
再者,在上述本揭露的具有式(i)、式(ii)或式(iii)的至少一种化合物的液体剂型的药物制剂中,溶剂按重量计可占约1-99%,例如,按重量计约1-30%、约10-85%、约20-70%、约30-60%或约60-99%,但不限于此。
适合本揭露的具有式(i)、式(ii)或式(iii)的至少一种化合物的液体剂型的药物制剂的溶剂可包括,但不限于,水、乙醇等。
在一实施例中,在上述本揭露的具有式(i)、式(ii)或式(iii)的至少一种化合物的液体剂型的药物制剂中,具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类按重量计可占约0.1-30%,聚环氧乙烷与聚环氧丙烷的共聚物按重量计可占约0.1-15%,环糊精或其衍生物按重量计可占约0.1-60%,而溶剂按重量计可占约1-99%。
又,在一实施例中,在上述本揭露的具有式(i)、式(ii)或式(iii)的至少一种化合物的液体剂型的药物制剂中,具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类按重量计可占约0.1-30%,聚环氧乙烷与聚环氧丙烷的共聚物按重量计可占约0.1-15%,环糊精或其衍生物按重量计可占约0.1-60%,而溶剂按重量计可占约1-99%,其中,聚环氧乙烷与聚环氧丙烷的共聚物可为(聚环氧乙烷)x-(聚环氧丙烷)y-(聚环氧乙烷)x,于其中,x为76的整数,而y为30的整数,且其中,环糊精或其衍生物可为2-羟丙基-β-环糊精。对于此实施例而言,具有式(i)、式(ii)或式(iii)的至少一种化合物可具有式(iv),并可为索布瑞醇,但不限于此。
此外,在上方所述的实施例中,前述索布瑞醇可包括(+)反式-索布瑞醇、(-)反式-索布瑞醇、(+)顺式-索布瑞醇、(-)顺式-索布瑞醇,或其组合,但不限于此。在一特定实施例中,索布瑞醇为(+)反式-索布瑞醇。在另一特定实施例中,索布瑞醇为(-)反式-索布瑞醇。在又另一实施例中,索布瑞醇为(+)反式-索布瑞醇与(-)反式-索布瑞醇的一混合物。
在另一实施例中,对于本揭露的具有式(i)、式(ii)或式(iii)的至少一种化合物的液体剂型的药物制剂而言,前述具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类可具有上方所示的式(v)至式(xviii)的任一个。在一特定实施例中,对于本揭露的具有式(i)、式(ii)或式(iii)的至少一种化合物的液体剂型的药物制剂而言,前述具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类可为具有式(i)的至少一种化合物,并具有上方所示的式(v)至式(xvi)的任一个。在另一特定实施例中,对于本揭露的具有式(i)、式(ii)或式(iii)的至少一种化合物的液体剂型的药物制剂而言,上述具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类可为具有式(ii)的至少一种化合物,并具有上方所示的式(xvii)。在又另一实施例中,对于本揭露的具有式(i)、式(ii)或式(iii)的至少一种化合物的液体剂型的药物制剂而言,上述具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类可为具有式(iii)的至少一种化合物,并具有上方所示的式(xviii)。
任何前述的本揭露的具有式(i)、式(ii)或式(iii)的至少一种化合物的液体剂型的药物制剂,能够降低对需要被投予具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类的一个体的剂量及/或投药频率。
需要被投予具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类的个体可包括,罹患可被具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类所治疗的疾病的个体,但不限于此。在一实施例中,上述疾病可包括,但不限于,自体免疫神经疾病及/或神经退化性疾病。在一特定实施例中,上述疾病可为多发性硬化症。
再者,前述个体可包括,但不限于,脊椎动物。又,上述脊椎动物可包括鱼类、两栖类、爬虫类、鸟类或哺乳类,但不限于此。哺乳类的例子可包括,但不限于,人类、猩猩、猴子、马、驴、狗、猫、兔子、天竺鼠、大鼠与小鼠。在一实施例中,个体为人类。
又,本揭露更提供一具有如下方所示的式(i)、式(ii)或式(iii)的至少一种化合物的控释剂型的新颖药物制剂。
其中
x可为nch3或ch2,
y可为不存在、o或n,
r1可为h、oh,且
r2可为不存在、h、c1-c8烷基、–(c=o)–烷基、–(c=o)–芳基、–(c=o)–烷基-芳基、–(c=o)–杂芳基、环烷基或杂环烷基,其任选定被一或多个的–oh、–no2、–nh2、–nr3r4、羰基、烷氧基、烷基或–ocf3所取代,其中r3与r4独立地为h、烷基、–so2ch3、–(c=o)-ch3或–(c=o)-nh2。
在一实施例中,在上方的式(i),式(ii)或式(iii)中,x可为nch3或ch2,y可为不存在、o或n,r1可为h、oh,而r2可为不存在、h、me、c2h5、c3h7、c4h9、c7h7、coch3、coc2h5、coc3h7、coc4h9、coc5h11、coc6h5、coch2c6h5、coc2h4c6h5、coc6h4no2或coc6h4oh,但不限于此。
前述具有上方所示的式(i)、式(ii)或式(iii)的至少一种化合物的控释剂型的药物制剂可包括,粒子载体的组合物、载药层(druglayer)的组合物,其包括具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类与至少一种粘合剂,与控释层(controlledreleaselayer)的组合物,但不限于此。对于上述具有式(i)、式(ii)或式(iii)的至少一种化合物的控释剂型而言,载药层系包覆于粒子载体上,而控释层系包覆于载药层上。
在上述本揭露的具有式(i)、式(ii)或式(iii)的至少一种化合物的控释剂型的药物制剂中,粒子载体的组合物按重量计可占约35-98%,例如,按重量计约30-60%、约40-90%、约35-95%、约50-85%,但不限于此。
上述粒子载体的组合物可包括微晶纤维素(microcrystallinecellulose)、乳糖(lactose)、玉米淀粉(cornstarch)、甘露醇(mannitol)、羧甲基纤维素钠(sodiumcarboxymethylcellulose)、食盐(commonsalt)、二氧化锗(germaniumdioxide)、或其组合等,但不限于此。粒子载体的粒径可为约100-1300μm,例如,约200-1000μm、约500-710μm,但不限于此。
又,在上述本揭露的具有式(i)、式(ii)或式(iii)的至少一种化合物的控释剂型的药物制剂中,载药层的组合物按重量计可占约1-64%,例如,按重量计约5-60%、约15-50%、约8-32%,但不限于此。此外,具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类按重量计可占前述载药层的组合物的约1-99%,例如,按重量计约5-50%、约20-80%、约40-90%。
具有式(i)的化合物的例子可如上方关于本揭露的治疗自体免疫神经疾病及/或神经退化性疾病的方法的段落中所记载者,而并不于此重复以避免赘述。
相似地,具有式(ii)的化合物的例子可如上方关于本揭露的治疗自体免疫神经疾病及/或神经退化性疾病的方法的段落中所记载者,而并不于此重复以避免赘述。
于上述载药层的组合物中的至少一种粘合剂,可包括羟丙基甲基纤维素(hydroxypropylmethylcellulose)、羟丙基纤维素(hydroxypropylcellulose)、聚乙烯(polyvinyl)、聚乙烯醇(polyvinylalcohol)或其组合,但不限于此。
在一实施例中,对于本揭露的具有式(i)、式(ii)或式(iii)的至少一种化合物的控释剂型的药物制剂而言,上述载药层的组合物可还包括,但不限于,抗粘剂(anti-adherent)、增塑剂(plasticizer)、其他赋形剂(excipient),或其组合。
适合上述载药层的组合物的抗粘剂的例子,可包括,但不限于,滑石粉(talcpowder)、硬脂酸(stearicacid)、硬脂酸盐(stearate)或胶体二氧化硅(colloidalsilicondioxid),但不限于此。
适合上述载药层的组合物的增塑剂,可包括柠檬酸三乙酯(triethylcitrate)、柠檬酸三丁酯(tributylcitrate)、聚乙二醇(polyethyleneglycol)等,但不限于此。
适合上述载药层的组合物的其他赋形剂,可包括,但不限于,乳糖、淀粉、甘露醇、色素(pigment)、微晶纤维素、蓖麻油(castoroil)等。
在上述载药层的组合物中,至少一种粘合剂的含量、抗粘剂的含量、增塑剂的含量及/或其他赋形剂的含量并不具有特别限制,且可依据具有式(i),式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类的含量进行调整,及/或可依需求进行调整。
此外,上述控释层的组合物可包括至少一种水不可溶性聚合物(water-insolublepolymer)或类蜡成分(wax-likeingredient),但不限于此。又,在上述本揭露的具有式(i)、式(ii)或式(iii)的至少一种化合物的控释剂型的药物制剂中,控释层的组合物按重量计可占约0.5-50%,例如,按重量计约1-50%、约0.5-20%、约5-40%,但不限于此。
上述至少一种水不可溶性聚合物或类蜡成分可包括,但不限于乙基纤维素(ethylcellulose)、羟丙基纤维素(hydroxypropylcellulose)、羟丙基甲基纤维素(hydroxypropylmethylcellulose)、丙烯酸乙酯-甲基丙烯酸甲酯-甲基丙烯酰氧乙基三甲基氯化铵共聚物(ethylacrylate-methylmethacrylate-trimethylammoniumchlorideethylmethacrylatecopolymer)、甲基丙烯酸甲酯-丙烯酸乙酯共聚物(methylmethacrylate-ethylacrylatecopolymer)、聚乙烯吡咯烷酮(polyvinylpyrrlidone)、聚乙烯醇(polyvinylalcohol)、氢化蓖麻油(hydrogenatedcastoroil)、氢化椰子油(hydrogenatedcoconutoil)、硬脂酸(stearicacid)、硬脂醇(stearylalcohol)或其组合。
在一实施例中,对于本揭露的具有式(i)、式(ii)或式(iii)的至少一种化合物的控释剂型的药物制剂而言,上述控释层的组合物可还包括抗粘剂、增塑剂、其他赋形剂或其组合,但不限于此。
适合上述控释层的组合物的抗粘剂,可包括,但不限于,滑石粉、硬脂酸、硬脂酸盐或胶体二氧化硅,但不限于此。
适合上述控释层的组合物的增塑剂,可包括柠檬酸三乙酯、柠檬酸三丁酯、聚乙二醇(polyethyleneglycol)等,但不限于此。
适合上述控释层的组合物的其他赋形剂,可包括,但不限于,乳糖、淀粉、甘露醇、色素、微晶纤维素、蓖麻油等。
在上述控释层的组合物中,抗粘剂的含量、增塑剂的含量及/或其他赋形剂的含量并不具有特别限制,且可依据至少一种水不可溶性聚合物的含量进行调整,及/或可依需求进行调整。
在一实施例中,对于本揭露的具有式(i)、式(ii)或式(iii)的至少一种化合物的控释剂型的药物制剂而言,粒子载体的组合物按重量计可占约35-98%、载药层的组合物按重量计可占约1-64%,而控释层的组合物按重量计可占约0.5-50%,其中具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类按重量计可占载药层的组合物的约1-99%。对于此实施例而言,具有式(i)、式(ii)或式(iii)的至少一种化合物可具有式(iv),并可为索布瑞醇,但不限于此。
又,在此实施例中,前述索布瑞醇可包括(+)反式-索布瑞醇、(-)反式-索布瑞醇、(+)顺式-索布瑞醇、(-)顺式-索布瑞醇,或其组合,但不限于此。在一特定实施例中,索布瑞醇为(+)反式-索布瑞醇。在另一特定实施例中,索布瑞醇为(-)反式-索布瑞醇。在又另一实施例中,索布瑞醇为(+)反式-索布瑞醇与(-)反式-索布瑞醇的混合物。
或者,于此实施例中,粒子载体的组合物可包括微晶纤维素,载药层的组合物可包括(-)反式-索布瑞醇、至少一种粘合剂,其包括羟丙基甲基纤维素,与抗粘剂,其包括滑石粉,而控释层的组合物可包括至少一种水不可溶性聚合物,其包括乙基纤维素与羟丙基甲基纤维素,与抗粘剂,其包括滑石粉。又,粒子载体的组合物按重量计可占约40-90%,载药层的组合物按重量计可占约15-50%,而控释层的组合物按重量计可占约1-15%,且(-)反式-索布瑞醇按重量计可占载药层的组合物的约40-90%。
或者,于此实施例中,粒子载体的组合物可包括微晶纤维素,载药层的组合物包括(-)反式-索布瑞醇与至少一种粘合剂,其包括聚乙烯吡咯烷酮,控释层的组合物包括至少一种水不可溶性聚合物,其包括乙基纤维素与羟丙基甲基纤维素。再者,粒子载体的组合物按重量计可占约5-60%,载药层的组合物按重量计可占约35-95%,而控释层的组合物按重量计可占约0.5-20%,其中(-)反式-索布瑞醇按重量计可占载药层的组合物的约40-90%。
或者,于此实施例中,粒子载体的组合物可包括微晶纤维素,载药层的组合物可包括(+)反式-索布瑞醇与(-)反式-索布瑞醇的混合物与至少一种粘合剂,其包括聚乙烯吡咯烷酮,控释层的组合物可包括至少一种水不可溶性聚合物,其包括乙基纤维素与羟丙基甲基纤维素。再者,颗粒载体的组合物按重量计可占约35-95%,载药层的组合物按重量计可占约5-60%,而控释层的组合物按重量计可占约0.5-20%,其中(+)反式-索布瑞醇与(-)反式-索布瑞醇的混合物按重量计可占载药层的组合物的约40-90%。
再者,在另一实施例中,对于本揭露的具有式(i)、式(ii)或式(iii)的至少一种化合物的控释剂型的药物制剂而言,前述具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类可具有上方所示的式(v)至式(xviii)的任一个。在一特定实施例中,对于具有式(i)、式(ii)或式(iii)的至少一种化合物的控释剂型的药物制剂而言,前述具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类可为具有式(i)的至少一种化合物,并具有上方所示的式(v)至式(xvi)的任一个。在另一特定实施例中,对于具有式(i)、式(ii)或式(iii)的至少一种化合物的控释剂型的药物制剂而言,上述具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类可为具有式(ii)的至少一种化合物,并具有上方所示的式(xvii)。在又另一实施例中,对于具有式(i)、式(ii)或式(iii)的至少一种化合物的控释剂型的药物制剂而言,上述具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类可为具有式(iii)的至少一种化合物,并具有上方所示的式(xviii)。
在一实施例中,具有式(i)、式(ii)或式(iii)的至少一种化合物的控释剂型的药物制剂可还包括包覆于控释层上的包衣层(coatinglayer)的组合物。包衣层的目的为避免控释层受到损害或侵蚀,而丧失其控制释放的能力。
包衣层的组合物可包括羟丙基甲基纤维素、聚乙二醇、乳糖,滑石粉、二氧化钛(titaniumdioxide)等,或其组合。或者,包衣层的组合物也可为市售的组合物,如欧巴代薄膜包衣(opadryfilmcoating)或巴斯夫薄膜包衣(kollicoatfilmcoating),但不限于此。
于本揭露的具有式(i)、式(ii)或式(iii)的至少一种化合物的控释剂型的药物制剂还包括包覆于控释层上的包衣层的组合物的实施例中,粒子载体的组合物按重量计可占约35-98%,载药层的组合物按重量计可占约1-64%,控释层的组合物按重量计可占约1-50%,而包衣层的组合物按重量计可占约1-35%,其中,具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类按重量计可占载药层的组合物的约1-99%。
任何前述的具有式(i)、式(ii)或式(iii)的至少一种化合物的控释剂型的药物制剂,能够降低对需要被投予具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类的个体的剂量及/或投药频率。
又,需要被投予具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类的个体可包括罹患可被具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类所治疗的疾病的个体,但不限于此。在一实施例中,上述疾病可包括,但不限于,自体免疫神经疾病及/或神经退化性疾病。在一特定实施例中,上述疾病可为多发性硬化症。
此外,需要被投予具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类的个体可包括罹患可被具有式(i)、式(ii)或式(iii)的至少一种化合物,或其几何异构物、对映异构体、非对映异构体或药学上可接受的盐类所治疗的疾病的个体,但不限于此。在一实施例中,上述疾病可包括,但不限于,自体免疫神经疾病及/或神经退化性疾病。在一特定实施例中,上述疾病可为多发性硬化症。
上述个体可包括,但不限于,脊椎动物。又,上述脊椎动物可包括鱼类、两栖类、爬虫类、鸟类或哺乳类,但不限于此。哺乳类的例子可包括,但不限于,人类、猩猩、猴子、马、驴、狗、猫、兔子、天竺鼠、大鼠与小鼠。在一实施例中,个体为人类。
实施例
实施例1
索布瑞醇与其衍生物在bv-2细胞中对于lps-诱导发炎的抑制影响
1.方法
将bv-2细胞(8×103细胞/ml)接种于一96孔培养盘并于37℃,5%co2下隔夜培养。将细胞分成未经处理组(
将孔洞中的上清液移除。其后,将不同浓度的测试化合物添加至细胞以与细胞反应1小时(控制组则以培养液添加至细胞),之后将lps(100ng/ml)添加至细胞。
在反应24小时之后,取出培养盘中的上清液,接着通过mouseil-6elisaready-set-go(invitrogen;cat.no.88-7064-88)并根据制造商所建议的程序来侦测il-6的表现量。
又,将50μl的含有mtt(0.5mg/ml)的培养液添加至培养盘中的细胞并于37℃与5%co2下培养90分钟,之后将150μldmso添加至培养盘并将培养盘震荡5-10分钟。最后,通过一连续波长微孔盘分析仪来读取od570,并使用以下公式来计算细胞存活率:
细胞存活率(%)=(实验组的od值/控制组的od值)×100。
根据在不同浓度的测试化合物的细胞存活率与在不同浓度的测试化合物的细胞的il-6表现量分别计算测试化合物对于细胞存活的cc50值与测试化合物对于il-6表现的ic50值。
2.结果
结果如表1所示。
表1:索布瑞醇与其衍生物对于细胞存活的cc50值与对于il-6表现的ic50值
根据上方表1所示的结果,可明确知道所测试的索布瑞醇的衍生物具有在bv-2细胞中抑制lps-诱导的il-6表现的能力。换言之,所测试的索布瑞醇的衍生物能够抑制lps-诱导的发炎。
实施例2
索布瑞醇的液体剂型的制备
在微量离心管中将30mg(-)反式-索布瑞醇的粉末、60mgpeo-ppo-peo((聚环氧乙烷)76-(聚环氧丙烷)30-(聚环氧乙烷)76;mw6800)(6%)与400mg2-羟丙基-β-环糊精的粉末(40%)溶解于1ml去离子水中(%:mg/100μl水)以形成一混合物。之后,于室温下将微量离心管震荡至其中的混合物变为透明以完成索布瑞醇的液体剂型的制备。
实施例3
a.17%(-)反式-索布瑞醇的控释剂型
1.17%反式-索布瑞醇的控释剂型的制备
将50g的(-)反式-索布瑞醇与20g的聚乙烯吡咯烷酮溶解于250g的乙醇以形成第一喷洒溶液(sprayingsolution)。将200g的微晶纤维素球体(粒径为约25-35筛号,约500-710μm)导入一流化床造粒机(fluid-bedgranulator)并以喷洒溶液对其进行喷洒包覆(喷液体积(sprayvolume):0.6-2.0g/分钟;喷布空气压力(sprayairpressure):0.4-0.6kg/cm2;排风温度(exhaustairtemperature):20-30℃;入风温度(inletairtemperature):25-40℃)以获得(-)反式-索布瑞醇药物携带颗粒(drugcarrying-particles)(未经包覆的药物携带颗粒)。
将18.6g的乙基纤维素与2.1g的羟丙基甲基纤维素溶解于185.6g的乙醇与20.7g的纯水(以约9:1的重量比)的混合溶液中并搅拌以均匀地分散于混合溶液中以形成第二喷洒溶液。
将270g的(-)反式-索布瑞醇药物携带颗粒导入一流化床造粒机并以第二喷洒溶液对其进行喷洒包覆(喷液体积:0.2-1.0g/分钟;喷布空气压力:0.4-0.6kg/cm2;排风温度:20-26℃;入风温度:23-30℃)以获得具有17%反式-索布瑞醇的控释颗粒(经包覆的药物携带颗粒)。
2.具有17%反式-索布瑞醇的控释颗粒的溶出试验(dissolutiontesting)
将上方所获得的未经包覆的药物携带颗粒(无控释效果)与经包覆的药物携带颗粒(具控释效果)进行溶出试验以比较两种颗粒的溶出速度(dissolutionrates)。
于溶出试验中采用篮式法(basketmethod),而溶出试验的步骤如下方所述。
将1000ml纯水添加至一测试容器中,之后将测试容器安装于一溶出机(dissolutiontester)中,并将水温设置为37℃。将一测试样本(191mg未经包覆的药物携带颗粒或200mg经包覆的药物携带颗粒)置于网篮中。当测试容器中的水温达到37.0±0.5℃时,将网篮降至测试容器中并伴随75rpm的搅拌速率以开始溶出(起始点(initialpoint))。分别于起始点后的5、15、30、60、120、180与240分钟进行取样,且取样体积为10ml。将样本分别以一0.45μm过滤器过滤,之后以高效液层析法(highperformanceliquidchromatography,hplc)来分析其成分含量。
具有17%反式-索布瑞醇的控释颗粒(经包覆的药物携带颗粒)与反式-索布瑞醇药物携带颗粒(未经包覆的药物携带颗粒)的溶出试验的结果显示于第1图中。
结果显示,在使用纯水为溶剂的溶出试验起始15分钟后,反式-索布瑞醇药物携带颗粒(未经包覆的药物携带颗粒)的溶出率为100%,而具有17%反式-索布瑞醇的控释颗粒(经包覆的药物携带颗粒)的溶出率小于20%。于溶出试验起始120分钟后,具有17%反式-索布瑞醇的控释颗粒(经包覆的药物携带颗粒)的溶出率为约80%。根据上述结果,可确认控释层对于反式-索布瑞醇的溶出速度具有控制释放的效果。
b.20%(+)(-)反式-索布瑞醇的控释剂型
1.20%(+)(-)反式-索布瑞醇的控释剂型的制备
将60g的(+)(-)反式-索布瑞醇与24g的聚乙烯吡咯烷酮溶解于300g的乙醇以形成第一喷洒溶液。将200g的微晶纤维素球体(粒径为约25-35筛号,约500-710μm)导入一流化床造粒机并以喷洒溶液对其进行喷洒包覆(喷液体积:0.6-2.0g/分钟;喷布空气压力:0.4-0.6kg/cm2;排风温度:20-30℃;入风温度:25-40℃)以获得(+)(-)反式-索布瑞醇药物携带颗粒(未经包覆的药物携带颗粒)。
将20.3g的乙基纤维素与2.3g的羟丙基甲基纤维素溶解于202.5g的乙醇与22.5g的纯水(以约9:1的重量比)的混合溶液中并搅拌以均匀地分散于混合溶液中以形成第二喷洒溶液。
将284g的(+)(-)反式-索布瑞醇药物携带颗粒导入一流化床造粒机并以第二喷洒溶液对其进行喷洒包覆(喷液体积:0.2-1.0g/分钟;喷布空气压力:0.4-0.6kg/cm2;排风温度:20-35℃;入风温度:25-40℃)以获得具有20%(+)(-)反式-索布瑞醇的控释颗粒(经包覆的药物携带颗粒)。具有20%(+)(-)反式-索布瑞醇的控释颗粒(经包覆的药物携带颗粒)以两批次被制造。
2.具有20%反式-索布瑞醇的控释颗粒的溶出试验
将上方所获得的未经包覆的药物携带颗粒(无控释效果)与经包覆的药物携带颗粒(具控释效果)进行溶出试验以比较两种颗粒的溶出速度。
于溶出试验中采用篮式法,而溶出试验的步骤如下方所述。
将1000ml纯水添加至一测试容器中,之后将测试容器安装于一溶出机中,并将水温设置为37℃。将一测试样本(193mg未经包覆的药物携带颗粒或208mg经包覆的药物携带颗粒)置于网篮中。当测试容器中的水温达到37.0±0.5℃时,将网篮降至测试容器中并伴随75rpm的搅拌速率以开始溶出(起始点)。分别于起始点后的5、15、30、60、120、180与240分钟进行取样,且取样体积为10ml。将样本分别以一0.45μm过滤器过滤,之后则以高效液层析法分析其成分含量。
具有20%反式-索布瑞醇的控释颗粒(经包覆的药物携带颗粒)与反式-索布瑞醇药物携带颗粒(未经包覆的药物携带颗粒)的溶出试验的结果显示于第2图中。
结果显示,在使用纯水为溶剂的溶出试验起始30分钟后,反式-索布瑞醇药物携带颗粒(未经包覆的药物携带颗粒)的溶出率为100%,而两批次的具有20%反式-索布瑞醇的控释颗粒(经包覆的药物携带颗粒)的溶出率皆小于40%。于溶出试验起始120分钟后,两批次的具有20%反式-索布瑞醇的控释颗粒(经包覆的药物携带颗粒)的溶出率为约80%。根据上述结果,可确认控释层对于反式-索布瑞醇的溶出速度具有控制释放的效果。
c.8%(+)(-)反式-索布瑞醇的控释剂型
1.8%(+)(-)反式-索布瑞醇的控释剂型的制备
将20g的(+)(-)反式-索布瑞醇与8g的聚乙烯吡咯烷酮溶解于100g的乙醇以形成第一喷洒溶液。将200g的微晶纤维素球体(粒径为约25-35筛号,约500-710μm)导入一流化床造粒机并以喷洒溶液对其进行喷洒包覆(喷液体积:0.6-1.4g/分钟;喷布空气压力:0.4-0.6kg/cm2;排风温度:20-26℃;入风温度:22-32℃)以获得(+)(-)反式-索布瑞醇药物携带颗粒(未经包覆的药物携带颗粒)。
将18.56g的乙基纤维素与2.07g的羟丙基甲基纤维素溶解于185.6g的乙醇与20.7g的纯水(以约9:1的重量比)的混合溶液中并搅拌以均匀地分散于混合溶液中以形成第二喷洒溶液。
将228g的(+)(-)反式-索布瑞醇药物携带颗粒导入一流化床造粒机并以第二喷洒溶液对其进行喷洒包覆(喷液体积:0.4-1.2g/分钟;喷布空气压力:0.4-0.6kg/cm2;排风温度:20-26℃;入风温度:23-30℃)以获得具有8%(+)(-)反式-索布瑞醇的控制释放颗粒(经包覆的药物携带颗粒)。
2.具有8%反式-索布瑞醇的控释颗粒的溶出试验
将上方所获得的未经包覆的药物携带颗粒(无控释效果)与经包覆的药物携带颗粒(具控释效果)进行溶出试验以比较两种颗粒的溶出速度。
于溶出试验中采用篮式法,且溶出试验的步骤如下方所述。
将1000ml纯水添加至一测试容器中,之后将测试容器安装于一溶出机中,并将水温设置为37℃。将一测试样本(190mg未经包覆的药物携带颗粒或204mg经包覆的药物携带颗粒)置于网篮中。当测试容器中的水温达到37.0±0.5℃时,将网篮降至测试容器中并伴随75rpm的搅拌速率以开始溶出(起始点)。分别于起始点后的5、15、30、60、120、180与240分钟进行取样,且取样体积为10ml。将样本分别以一0.45μm过滤器过滤,之后则以高效液层析法分析其成分含量。
具有8%反式-索布瑞醇的控释颗粒(经包覆的药物携带颗粒)与反式-索布瑞醇药物携带颗粒(未经包覆的药物携带颗粒)的溶出试验的结果显示于第3图中。
结果显示,使用纯水为溶剂的溶出试验于起始15分钟后,反式-索布瑞醇药物携带颗粒(未经包覆的药物携带颗粒)的溶出率为100%,而具有8%反式-索布瑞醇的控释颗粒(经包覆的药物携带颗粒)的溶出率小于20%。于溶出试验起始180分钟后,具有8%反式-索布瑞醇的控释颗粒(经包覆的药物携带颗粒)的溶出率为约80%。根据上述结果,可确认控释层对于反式-索布瑞醇的溶出速度具有控制释放的效果。
d.32%(+)(-)反式-索布瑞醇的控释剂型
1.32%(+)(-)反式-索布瑞醇的控释剂型的制备
将125g的(+)(-)反式-索布瑞醇与50g的聚乙烯吡咯烷酮溶解于625g的乙醇以形成第一喷洒溶液。将200g的微晶纤维素球体(粒径为约25-35筛号,约500-710μm)导入一流化床造粒机并以喷洒溶液对其进行喷洒包覆(喷液体积:0.6-2.8g/分钟;喷布空气压力:0.4-0.75kg/cm2;排风温度:20-26℃;入风温度:24-31℃)以获得(+)(-)反式-索布瑞醇药物携带颗粒(未经包覆的药物携带颗粒)。
将18.56g的乙基纤维素与2.07g的羟丙基甲基纤维素溶解于185.6g的乙醇与20.7g的纯水(以约9:1的重量比)的混合溶液中并搅拌以均匀地分散于混合溶液中以形成第二喷洒溶液。
将375g的(+)(-)反式-索布瑞醇药物携带颗粒导入一流化床造粒机并以第二喷洒溶液对其进行喷洒包覆(喷液体积:0.8-1.2g/分钟;喷布空气压力:0.8-0.9kg/cm2;排风温度:20-24℃;入风温度:22-29℃)以获得具有32%(+)(-)反式-索布瑞醇的控释颗粒(经包覆的药物携带颗粒)。
2.具有32%反式-索布瑞醇的控释颗粒的溶出试验
将上方所获得的未经包覆的药物携带颗粒(无控释效果)与经包覆的药物携带颗粒(具控释效果)进行溶出试验以比较两种颗粒的溶出速度。
于溶出试验中采用篮式法,而溶出试验的步骤如下方所述。
将1000ml纯水添加至一测试容器中,之后将测试容器安装于一溶出机中,并将水温设置为37℃。将一测试样本(190mg未经包覆的药物携带颗粒或198mg经包覆的药物携带颗粒)置于网篮中。当测试容器的水温达到37.0±0.5℃时,将网篮降至测试容器中并伴随75rpm的搅拌速率以开始溶出(起始点)。分别于起始点后的5、15、30、60、120、180与240分钟进行取样,且取样体积为10ml。将样本分别以一0.45μm过滤器过滤,之后则以高效液层析法分析其成分含量。
具有32%反式-索布瑞醇的控释颗粒(经包覆的药物携带颗粒)与反式-索布瑞醇药物携带颗粒(未经包覆的药物携带颗粒)的溶出试验的结果显示于第4图中。
结果显示,使用纯水为溶剂的溶出试验于起始15分钟后,反式-索布瑞醇药物携带颗粒(未经包覆的药物携带颗粒)的溶出率为100%,而具有32%反式-索布瑞醇的控释颗粒(经包覆的药物携带颗粒)的溶出率小于5%。于溶出试验起始240分钟后,具有32%反式-索布瑞醇的控释颗粒(经包覆的药物携带颗粒)的溶出率为约57%。根据上述结果,可确认控释层对于反式-索布瑞醇的溶出速度具有控制释放的效果。
实施例4
分离自实验性自体免疫性脑髓炎(experimentalautoimmuneencephalomyelitis,eae)模式的小鼠的脾细胞(splenocyte),以mog诱导的ifn-γ分泌与il-2分泌
于c57bl/6小鼠中诱导eae。于第0天以含有400μg热灭活结核分支杆菌(heat-killedmycobateriumtuberculosis)h37ra的弗氏不完全佐剂(incompletefreund'sadjuvant,ifa)中的200μg髓鞘少突胶质细胞糖蛋白(myelinoligodendrocyteglycoprotein,mog)经由皮下注射来免疫小鼠。以乳剂(emulsion)免疫小鼠后,于第0天与第2天腹腔注射百日咳毒素(pertussistoxin)(500ng)。于免疫后第30天,将小鼠牺牲。收取小鼠的脾脏且分离脾细胞并将其培养于存在或不存在20μg/mlmog肽的10%fbsrpmi1640培养基中。将测试化合物添加至培养物并维持于37℃,5%co2,48小时。通过elisa并根据其制造商的操作指南来测定ifn-γ与il-2于培养物的上清液中的浓度。
2.结果
结果显示于表2中。
表2:索布瑞醇与其衍生物的ifn-γ抑制与il-2抑制
实施例5动物实验
a.材料
a.动物
于此研究中,使用购自国家实验动物中心(nationallaboratoryanimalcenter,nlac,台湾)的雌性c57bl/6小鼠,8周大。动物的c57bl/6小鼠已被广泛使用且伴随丰富的参考文献与资料,并符合实验性自体免疫性脑髓炎(experimentalautoimmuneencephalomyelitis,eae)模式。在工业技术研究院(industrialtechnologyresearchinstitute,itri,台湾)的动物研究场所中,让小鼠以自由获取饮水与食物的方式处于维持在23±2℃,相对湿度40-70%与12:12小时光-暗循环的恒定环境下。
为了确保动物的健康,分别在检疫与实验期间由兽医与工研院的研究人员每天进行临床观察及记录。以下所列出的动物使用计画已经由工业技术研究院的机构动物照护和使用委员会(institutionalanimalcareandusecommittee,iacuc)审查及批准。
b.试剂
弗氏不完全佐剂(incompletefreund’sadjuvant,ifa)(sigma-aldrich,usa);髓鞘少突胶质细胞糖蛋白(myelinoligodendrocyteglycoprotein,mog35-55)肽(科罗耐国际科技有限公司,台湾);百日咳毒素(pertussistoxin)(listbiologicallaboratories,usa);结核分支杆菌(mycobateriumtuberculosis)h37ra(difcolaboratories,germany);(+)反式-索布瑞醇与(-)反式-索布瑞醇的混合物(mucofluxcapsules);(-)反式-索布瑞醇(sigma-aldrich)
b.方法
3.治疗性给药实验
3-1在实验性自体免疫性脑髓炎(eae)诱导后的测试药物投予与临床评估
为了诱导eae,将雌性c57bl/6小鼠皮下注射包括有200μgmog35-55肽与400μg结核分支杆菌h37ra的200μl乳剂,之后腹腔注射500ng百日咳毒素,且于48小时后再次以另外的500ng百日咳毒素对小鼠进行腹腔注射。
从诱导后的第7天,根据公认的运动失调(ataxia)评分(神经系统疾病分级)与eae评分作为评分标准(运动失调评分与eae评分的描述如下),每天记录小鼠的eae临床症状。当小鼠开始出现运动失调分数0++时,将小鼠以s型方式分组并开始测试药物((+)反式-索布瑞醇与(-)反式-索布瑞醇的混合物(mucofluxcapsules)、(-)反式-索布瑞醇(sigma-aldrich)或上述实施例2中所制备的(-)反式-索布瑞醇的液体剂型)的投予且持续14天。于测试药物的投予的第15天,将小鼠牺牲,并收集其血液或相关器官以进行后续分析。
改自mettenetal.(2004)的运动失调评分(ataxiascore)标准如下所示:0+:动物行进时后脚呈八字形,会左右摇摆且步态无法平衡;0++:当抓住动物后颈部,观察其尾巴是否可自行抬起,并以手指测试其尾巴张力强弱时,其尾巴出现无法自主抬起且张力减弱情况。
eae评分标准如下所示:0分:无eae症状;0.5分:尾巴短暂无力,有时可举起;1分:尾巴无力,无法正常举起;2分:尾巴瘫痪或轻微后肢无力;3分:中度至严重的后肢瘫痪或轻微的前肢无力;4分:完全的后肢瘫痪或中度至严重的前肢无力;5分:四肢瘫痪伴随失禁或呈现濒死状态;6分:死亡。
3-2.组织学(histology)与免疫组织化学(immunohistochemistry)
在eae发病后第15天对小鼠实施安乐死。取出脊髓并固定在10%磷酸盐缓冲的甲醛中。将石蜡(parafin)包埋的3μm厚的脊髓横切面以苏木素与伊红(hematoxylinandeosin)染色以确认组织病变(tissuelesion)。将另一玻片以luxolfastblue染色,用于检验脱髓鞘(demyelination)。依据表2所示标准来评分脱髓鞘、发炎、轴突肿胀(axonalswelling)和神经胶质增生(gliosis),并评估病变:
表2
4.预防性给药实验
在实验性自体免疫性脑髓炎(eae)诱导后与实验性自体免疫性脑髓炎(eae)症状(sign)发作之前的测试药物投予与临床评估
为了诱发eae,将雌性c57bl/6小鼠皮下注射包括有200μgmog35-55肽与400μg结核分支杆菌h37ra的200μl乳剂,之后腹腔注射500ng百日咳毒素,且于48小时后再次以另外的500ng百日咳毒素对小鼠进行腹腔注射。
从诱导后的第7天,依据重量将小鼠以s型方式分组并开始测试药物((-)反式-索布瑞醇(sigma-aldrich))的投予且持续14天。于mog35-55免疫后的第21天,将小鼠牺牲,并收集其血液或相关器官以进行后续分析。根据作为评分标准的eae评分(运动失调评分与eae评分的描述如下),每天记录小鼠的eae临床症状。
eae评分的标准如下所示:0分:无eae症状;0.5分:尾巴短暂无力,有时可举起;1分:尾巴无力,无法正常举起;2分:尾巴瘫痪或轻微后肢无力;3分:中度至严重的后肢瘫痪或轻微的前肢无力;4分:完全的后肢瘫痪或中度至严重的前肢无力;5分:四肢瘫痪伴随失禁或呈现濒死状态;6分:死亡。
c.结果
1.治疗性给药实验
1-1.在实验性自体免疫性脑髓炎(eae)诱导后(-)反式-索布瑞醇的投予
将(-)反式-索布瑞醇溶解于载剂(vehicle)(dmso:crel:生理食盐水(saline)=10:10:80)中以形成一(-)反式-索布瑞醇的溶液。
根据上方““b.方法”的“3.治疗性给药实验”的小节“3-1在实验性自体免疫性脑髓炎(eae)诱导后的测试药物投予与临床评估”中所描述的方法,对eae诱导小鼠以不同的给药频率投予不同剂量的(-)反式-索布瑞醇与载剂(dmso:crel:生理食盐水=10:10:80),且之后评估小鼠的eae分数。
结果显示于第5a、5b与5c图中。第5a图显示,每天一次被投予30mg/kg与100mg/kg剂量的(-)反式-索布瑞醇的小鼠与被投予载剂(dmso:crel:生理食盐水=10:10:80)的小鼠的分别的eae分数。第5b图显示,每天两次被投予50mg/kg与100mg/kg剂量的(-)反式-索布瑞醇的小鼠与被投予载剂(dmso:crel:生理食盐水=10:10:80)的小鼠的分别的eae分数。第5c图显示,每天三次被投予10mg/kg、25mg/kg、50mg/kg与100mg/kg剂量的(-)反式-索布瑞醇的小鼠与被投予载剂(dmso:crel:生理食盐水=10:10:80)的小鼠,以及每天两次被投予100mg/kg剂量的富马酸二甲酯(dimethylfumarate)的小鼠的分别的eae分数。
根据第5a、5b与5c图所显示的结果,可明确得知(-)反式-索布瑞醇可显著减轻eae诱导小鼠的eae的症状。
根据上方“b.方法”的“3.治疗性给药实验”的小节“3-2.组织学(histology)与免疫组织化学(immunohistochemistry)”中所描述的方法,依据脱髓鞘、发炎、轴突肿胀与神经胶质增生来评估小鼠的脊髓的病变。
结果显示于第6a-6d图与第7a-7d图。
第6a图显示,经每天三次100mg/kg剂量的(-)反式-索布瑞醇处理的小鼠的脊髓的苏木素与伊红染色的结果,第6b图显示,经每天三次载剂处理的小鼠的脊髓的苏木素与伊红染色的结果,第6c图显示,经每天三次100mg/kg剂量的(-)反式-索布瑞醇处理的小鼠的脊髓的luxolfastblue染色的结果,而第6d图显示,经每天三次载剂处理的小鼠的脊髓的luxolfastblue染色的结果。
第7a图显示,经每天三次100mg/kg剂量的(-)反式-索布瑞醇处理的小鼠、经每天三次载剂处理的小鼠与未经任何处理的小鼠的脊髓的脱髓鞘分数。第7b图显示,经每天三次100mg/kg剂量的(-)反式-索布瑞醇处理的小鼠、经每天三次载剂处理的小鼠与未经任何处理的小鼠的脊髓的轴突肿胀分数。第7c图显示,经每天三次100mg/kg剂量的(-)反式-索布瑞醇处理的小鼠、经每天三次载剂处理的小鼠与未经任何处理的小鼠的脊髓的发炎分数。第7d图显示,经每天三次100mg/kg剂量的(-)反式-索布瑞醇处理的小鼠、经每天三次载剂处理的小鼠与未经任何处理的小鼠的脊髓的神经胶质增生分数。
根据第6a-6d图与第7a-7d图所显示的结果,可明确得知索布瑞醇可有效减缓eae诱导小鼠的脊髓的脱髓鞘、发炎、轴突肿胀与神经胶质增生。
1-2.实验性自体免疫性脑髓炎(eae)诱导后(+)反式-索布瑞醇与(-)反式-索布瑞醇的混合物的投予
将含有(+)反式-索布瑞醇与(-)反式-索布瑞醇的混合物的mucoflux胶囊剥开并将粉末溶解于载剂(dmso:crel:生理食盐水=10:10:80)中以形成一(+)反式-索布瑞醇与(-)反式-索布瑞醇的混合物的溶液。
根据上方“b.方法”的“3.治疗性给药实验”的小节“3-1在实验性自体免疫性脑髓炎(eae)诱导后的测试药物投予与临床评估”中所描述的方法,对eae诱导小鼠以不同给药频率投予不同剂量的(+)反式-索布瑞醇与(-)反式-索布瑞醇的混合物与载剂(dmso:crel:生理食盐水=10:10:80),之后评估小鼠的eae分数。
结果如第8a与8b图所示。第8a图显示每天一次被投予100mg/kg剂量的(+)反式-索布瑞醇与(-)反式-索布瑞醇的混合物的小鼠与被投予载剂(dmso:crel:生理食盐水=10:10:80)的小鼠的分别的eae分数。第8b图显示每天两次被投予15mg/kg、50mg/kg与100mg/kg剂量的(+)反式-索布瑞醇与(-)反式-索布瑞醇的混合物的小鼠与被投予载剂(dmso:crel:生理食盐水=10:10:80)的小鼠的分别的eae分数。
根据第8a与8b图所显示的结果,可明确得知(+)反式-索布瑞醇与(-)反式-索布瑞醇的混合物可显著减轻eae诱导小鼠的eae的症状。
1-3.实验性自体免疫性脑髓炎(eae)诱导后(-)反式-索布瑞醇的液体剂型的投予
根据上方“b.方法”的“3.治疗性给药实验”的小节“3-1在实验性自体免疫性脑髓炎(eae)诱导后的测试药物投予与临床评估”中所描述的方法,对eae诱导小鼠以不同给药频率投予不同剂量的所制备的(-)反式-索布瑞醇的液体剂型、(-)反式-索布瑞醇与载剂(6%peo-ppo-peo与40%2-羟丙基-β-环糊精在水中(%:mg/100μl水)),之后评估小鼠的eae分数。
结果如第9a与9b图所示。第9a图显示,每天两次被投予150mg/kg剂量的所制备的(-)反式-索布瑞醇的液体剂型与每天一次被投予300mg/kg剂量的所制备的(-)反式-索布瑞醇的液体剂型的小鼠、每天三次被投予100mg/kg剂量的(-)反式-索布瑞醇的小鼠以及每天两次被投予载剂(6%peo-ppo-peo与40%2-羟丙基-β-环糊精(%:mg/100μl水))与每天三次被投予载剂(dmso:crel:生理食盐水=10:10:80)的小鼠的分别的eae分数。第9b图显示,每天两次被投予150mg/kg剂量的所制备的(-)反式-索布瑞醇的液体剂型与每天一次被投予300mg/kg剂量的所制备的(-)反式-索布瑞醇的液体剂型的小鼠、每天三次被投予100mg/kg剂量的(-)反式-索布瑞醇的小鼠以及被每天两次投予载剂(6%peo-ppo-peo与40%2-羟丙基-β-环糊精(%:mg/100μl水))与每天三次投予载剂(dmso:crel:生理食盐水=10:10:80)的小鼠在eae症状发作后的第15天的分别的eae分数。
根据第9a与9b图所显示的结果,可明确得知所制备的(-)反式-索布瑞醇的液体剂型以一天一次(300mg/kg)投予与所制备的(-)反式-索布瑞醇的液体剂型以一天两次(150mg/kg)投予所造成的影响相当于(-)反式-索布瑞醇以一天三次(100mg/kg)投予所造成影响。换言之,第9a与9b图清楚显示液体剂型可降低(-)反式-索布瑞醇所需的投药频率。
2.预防性给药实验
2-1.在实验性自体免疫性脑髓炎(eae)症状发作之前的(-)反式-索布瑞醇投予
将(-)反式-索布瑞醇溶解于载剂(dmso:crel:生理食盐水=10:10:80)中以形成一(-)反式-索布瑞醇的溶液。
根据上方“b.方法”的“4.预防性给药实验”中所描述的方法,在实验性自体免疫性脑髓炎(eae)诱导第7天后以不同投药频率开始不同剂量的(-)反式-索布瑞醇与载剂(dmso:crel:生理食盐水=10:10:80)的投予,之后评估小鼠的eae分数。
结果如第10图所示。第10图显示每天一次被投予100mg/kg剂量的(-)反式-索布瑞醇的小鼠、被投予载剂(dmso:crel:生理食盐水=10:10:80)的小鼠与被投予50mg/kg剂量的富马酸二甲酯的小鼠的分别的eae分数。
根据第10图所显示的结果,可明确得知(-)反式-索布瑞醇可显著减缓eae诱导小鼠中的eae症状。
对本发明所属技术领域中具有通常知识者明显的是,可对揭露的实施例进行各种修改或变动。说明书和实施例仅为示例,系由以下权利要求及与其均等者指出本揭露的真正范围。
- 还没有人留言评论。精彩留言会获得点赞!