包含槲皮素的粉末固体分散体、其制备方法及其配制物与流程
发明领域
本发明涉及包含磷脂和极易溶于水至易溶于水的载体的粉末固体分散体。本发明还涉及所述粉末固体分散体的制备方法和包含所述粉末固体分散体的药物组合物、营养组合物和美容化妆组合物。
发明背景
槲皮素(即,2-(3,4-二羟基苯基)-3,5,7-三羟基-4h-色烯-4-酮)具有式(i),属于黄酮醇(类黄酮的一个亚类)的化学家族。槲皮素是柠檬黄色的亲脂性粉末,基本不溶于水,但是溶于乙醇、甲醇、丙酮和其它亲脂性有机溶剂。槲皮素的熔点为316℃。
槲皮素主要作为槲皮素糖苷存在于多种水果和蔬菜、包括苹果、葡萄、洋葱、刺山柑蕾(capers)、浆果、萝卜中。
槲皮素对人类健康具有多种潜在益处,包括抗氧化、抗炎、抗过敏和抗哮喘作用。槲皮素的抗过敏和抗哮喘活性是通过对肥大细胞和嗜碱细胞释放的组胺的抑制作用来介导的。还已经研究了槲皮素的归因于不同作用机制的潜在抗癌作用。
由于对于人类健康的这些潜在益处,槲皮素作为营养和药物成分得到了越来越多的关注。然而,槲皮素的潜在功效由于其具有低的和变化的生物利用度(这主要归因于其水溶性非常差)而受到限制。由于低的和变化的口服生物利用度,需要高单位剂量的槲皮素以确保其药理活性。
多项动物研究证实了槲皮素体内吸收的高变化性,其已经证明不同的饮食因素可强烈影响槲皮素吸收(nishijima,t.等人,(2009).journalofagriculturalandfoodchemistry,57(6),2583-2587;tamura,m.等人,(2007).journaloffoodscience,72(9);azuma,k.等人,(2003)。已经应用不同的方法来提高槲皮素吸收,包括掺入微乳和纳米乳(gao,y.等人,(2009).colloidsandsurfacesb:biointerfaces,71(2),306-314)、固体脂质纳米颗粒(li,h.,等人,(2009).journalofcontrolledrelease,133(3),238-244)、环糊精包合物(aytac,z.,等人,(2016).foodchemistry,197,864-871)、聚合物纳米颗粒(patel,a.r.,等人,(2012).foodchemistry,133(2),423-429)中,但是这些方法中大多数具有多种缺陷,包括包封载量低、制备复杂、缺乏节约成本的工业规模的制备方法。而且,大多数这些方法仅以实验室规模应用,并且仅在体外或体内动物研究中证实了可能改善槲皮素口服生物利用度。
cn1813677a(四川大学[cn]),2006年8月9日公开)涉及槲皮素脂质体注射粉末及其制备方法。该脂质体粉末由槲皮素、聚乙二醇-磷脂酰乙醇胺、卵磷脂、胆固醇和赋形剂(例如山梨醇、甘露醇、葡萄糖、蔗糖或海藻糖)制成,并且通过包括如下的方法制备:将槲皮素、聚乙二醇-磷脂酰乙醇胺、卵磷脂和胆固醇溶于氯仿和甲醇中,蒸发溶剂得到干残余物,加入无菌汤(sterilebroth)和赋形剂,得到水溶液,将其进行超声处理和冷冻干燥,得到粉末。
cn102580111b(四川大学,2014年4月9日公开)公开了一种脂质体,其包含包埋在环糊精中的槲皮素。具体而言,该脂质体通过包括下述的方法制备:将槲皮素加入羟丙基-β-环糊精在溶剂中的溶液中,得到溶液,所述溶剂选自无水乙醇、正丁醇和醚中的一种或多种;向该溶液中加入蛋黄卵磷脂或大豆磷脂、胆固醇、聚乙二醇-二硬脂酸、磷脂酰乙醇胺,接着将所得溶液加入到蔗糖水溶液中,通过冷冻干燥除去溶剂。在该脂质体中,使用相对于槲皮素而言过量的卵磷脂或大豆磷脂;在更详细的内容中,槲皮素与卵磷脂或大豆磷脂之间的重量比为1:5至1:50。
cn101904821a(姜玲敏;高磊,2010年12月8日公开)涉及平均直径小于300nm、优选100至300nm的槲皮素纳米冻干粉末,由槲皮素、表面活性剂和冻干保护剂组成。所述表面活性剂可以特别为磷脂或大豆卵磷脂,所述冻干保护剂为多糖或多元醇。槲皮素粉末通过完全在水中进行的方法制备;具体而言,将表面活性剂分散在水中,然后加入槲皮素,将所得混悬液在压力下均化,并冻干。冻干保护剂可以在加入槲皮素之前或在冻干之前加入到表面活性剂分散液中。
cn1813677a、cn102580111b和cn101904821a均公开了其制备包括使用水的脂质体。
hong-boyang,等人,(2017)jointinternationalconferenceonmaterialsscienceandengineeringapplication,2017年4月,第1-7页)公开了通过下述方法制备槲皮素在磷脂中的固体分散体:将1:2重量比的槲皮素和磷脂溶于四氢呋喃中,搅拌,过滤,于50℃真空干燥。x-射线表明槲皮素本身是结晶固体,而该固体分散体的x-射线分析显示,在该固体分散体中,槲皮素以无定型形式存在。
sanghyunpark等人,massspectrometryletters第7卷,第3期,2016年9月30日,第79-83页)教导了通过下述方法制备槲皮素的固体分散体:将槲皮素、亲水性聚合物和载体溶于乙醇中,然后蒸发,得到残余物,将其溶于hpmg、peg8000、pvpk40和水中,得到澄清溶液,将其进行冻干,得到固体分散体。该文件声称槲皮素因此由结晶转变成无定型形式。
由于槲皮素的吸收差且可变,仍然需要开发能够促进其口服生物利用度和确保更恒定地吸收到体循环和因此确保其药理活性的递送系统。
附图说明
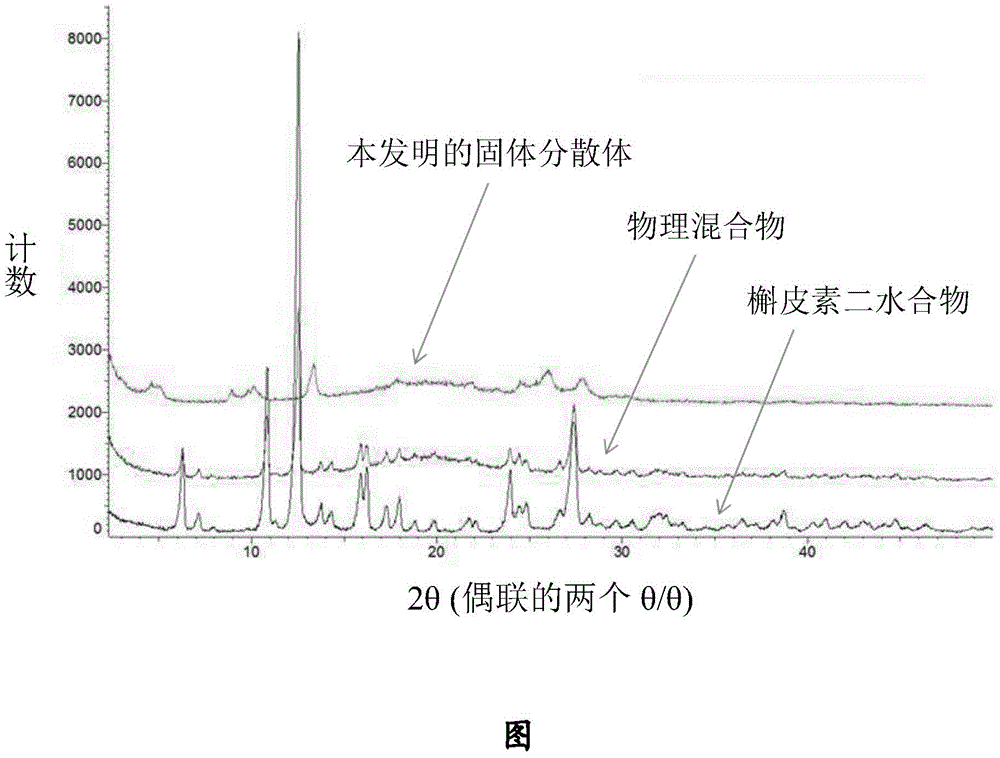
图:本发明的固体分散体(槲皮素:磷脂:载体的重量比=3:3:2)、槲皮素二水合物和槲皮素二水合物的物理混合物(槲皮素:磷脂:载体的重量比=3:3:2)的x-射线衍射图。
发明简述
本发明涉及包含槲皮素、磷脂和极易溶于水至易溶于水的载体的粉末固体分散体。
本发明还涉及制备粉末固体分散体的方法,该方法包括在加热下将槲皮素、磷脂和水溶性载体溶于或混悬于无水有机溶剂中,然后除去溶剂,得到粉末固体分散体。
本发明的进一步目的是包含所述粉末固体分散体和一种或多种药学和食品可接受的赋形剂的用于口服施用的配制物。
技术实现要素:
已经令人惊奇地发现:包含槲皮素、磷脂和极易溶于水至易溶于水的载体、优选由它们组成的粉末固体分散体的特征是具有改善的溶解度和槲皮素在人中的口服生物利用度。
根据优选的实施方案,槲皮素为槲皮素二水合物。
磷脂可选自来自大豆或向日葵或蛋的卵磷脂、磷脂酰胆碱、磷脂酰丝氨酸、磷脂酰乙醇胺或它们的混合物,其中酰基基团可以相同或不同并且主要衍生自棕榈酸、硬脂酸、油酸、亚油酸、亚麻酸。在优选的实施方案中,卵磷脂为大豆卵磷脂或向日葵卵磷脂;在更优选的实施方案中,卵磷脂为向日葵卵磷脂。
槲皮素与磷脂的重量比范围可以为5:1至1:1,优选2:1至1:1。
根据本发明,术语“极易溶”和术语“易溶”具有如欧洲药典5.0中定义的含义,记录在以下图表中:
图表
所用术语具有对15℃至25℃之间的温度而言的所定义的意思。
在下文中使用术语“载体”指“极易溶于水至易溶于水的载体”。所述载体可选自单糖和二糖(例如蔗糖、果糖、麦芽糖糊精);多元醇(例如甘露醇、山梨醇、木糖醇);可溶性寡糖和多糖(例如葡聚糖、普鲁兰)。在优选的实施方案中,载体为麦芽糖糊精。
槲皮素与载体的重量比范围可以为1:5至5:1,优选1:2至3:1。为了避免引起疑问,在本申请通篇中,当指示范围时,包括范围的端点。
优选地,本发明的固体分散体具有100μm至300μm的平均粒度分布。
优选地,本发明的固体分散体仅由槲皮素、磷脂和如上定义的载体组成。在优选的实施方案中,本发明的固体分散体由槲皮素、向日葵卵磷脂和麦芽糖糊精组成;在另一个优选的实施方案中,本发明的固体分散体由槲皮素、向日葵卵磷脂和果糖组成。
不受理论的束缚,据信所述载体对于粉末固体分散体的性能起基本作用,促进槲皮素的快速溶解速率和有助于促进其口服生物利用度。还据信所述可溶性载体在优化最终产物的物理性质方面起相关作用。
已经发现:在本发明的固体分散体中,槲皮素的理化性质得到显著改善,改善程度如此高以致于槲皮素的药理性能得到改善,即使槲皮素/磷脂的重量比是低的。已经出人意料地观察到:槲皮素、特别是槲皮素二水合物可以以高量掺入到磷脂中,并且在水中的溶解快速,尽管本发明的固体分散体的x-射线显示仍然存在显著量的结晶。确实,基于hong-boyang等人和sanghyunpark等人的前述出版物的教导,人们应当预期:快速溶解将归因于不存在结晶形式的槲皮素。
本发明的固体分散体可以采用如下工艺(或方法)来有利地制备:所述工艺(或方法)避免了使用氯化溶剂和不包括任何冷冻干燥步骤,并且所述工艺(或方法)可以容易地在中试(pilot)和工业设备上放大。
因此,本发明的另一个目的是制备本发明的粉末固体分散体的方法,该方法包括在加热下将槲皮素、磷脂和水溶性载体溶于或混悬于包含少于5%wt水的有机溶剂中,然后除去溶剂,得到粉末固体分散体。
在一个实施方案中,所述方法包括下述步骤:
a)制备槲皮素在有机溶剂中的溶液[溶液(s1)];
b)制备磷脂在与步骤a)中所用相同的溶剂中的溶液/混悬液[溶液或混悬液(s2)];
c)使步骤a)中得到的槲皮素溶液与步骤b)中得到的溶液/混悬液接触,得到进一步的溶液或混悬液[混悬液或溶液(s3)];
d)将极易溶于至易溶于水载体中的载体加入到步骤c)中得到的溶液或混悬液中,和
e)在真空下或在喷雾干燥下除去溶剂,形成粉末固体分散体。在另一个实施方案中,所述方法包括下述步骤:
a-1)制备槲皮素在包含少于5%wt水的有机溶剂中的溶液[溶液(s1)];
b-1)向溶液(s1)中加入磷脂和极易溶于至易溶于水载体的载体,得到槲皮素、磷脂和载体在所述溶剂中的溶液或混悬液[溶液或混悬液(s3)],和
c-1)在真空下或在喷雾干燥下除去溶剂,形成粉末固体分散体。
有机溶剂是在大气压下的沸点不高于80℃的食品级溶剂;优选地,溶剂为c1-c4直链或支链醇、乙酸乙酯或丙酮。更优选地,溶剂选自乙醇、异丙醇、正丙醇、正丁醇、乙酸乙酯、丙酮。甚至更优选地,溶剂选自乙醇和乙酸乙酯。
本发明的方法采用含有少于5%wt水的溶剂进行,其不包括任何在水中溶解的步骤。
槲皮素、磷脂和载体的溶解或混悬在加热下进行;特别地,优选实施方案的步骤a)至d)和a-1)和b-1)在加热下进行;通常,加热在30℃至溶剂沸点温度、优选从40℃至80℃、更优选从50℃至60℃的温度范围进行,直至部分或完全溶解或混悬槲皮素、磷脂和载体。本领域技术人员应当能够确定获得槲皮素、磷脂和载体的完全或部分溶解(即混悬)需要的时间。
为了避免引起疑问,在本申请内,术语“溶液”指当目测检查时在所选温度下澄清的液体组合物;术语“混悬液”指当目测检查时不透明、但是仍然是均相的液体组合物。
在步骤e)或c1)后,可以调整粉末固体分散体以得到在前述100μm至300μm范围内的期望粒度分布,并且可以最终与药学和食品可接受的赋形剂如二氧化硅、滑石粉、硬脂酸镁混合以进一步改善其物理和工艺性质。
极易溶于水至易溶于水的载体(槲皮素和磷脂负载在其上)的快速溶解有助于增加槲皮素润湿性和快速溶解。因此,在吸收部位产生了槲皮素的高浓度,决定了高浓度梯度,所述高浓度梯度是槲皮素被动扩散穿过胃肠道吸收膜的驱动力。
不受理论的束缚,据信在本发明的方法期间,槲皮素和磷脂在所选有机溶剂中完全或至少部分共溶有助于提高槲皮素的溶解度和口服生物利用度。
通过差示扫描量热法(dsc)进行热量分析,从而与完全结晶的未配制槲皮素相比、特别是与槲皮素二水合物相比,基于熔化焓(j/g)的减少确定粉末固体分散体中槲皮素的无定形化程度。还进行了x-射线分析。本发明的粉末固体分散体的x-射线衍射图显示出特征峰位于8.9±0.2、13.5±0.2、26.0±0.2和27.8±0.22θ角(cukα
因此,本发明的另一个目的是包含槲皮素、磷脂和极易溶于水至易溶于水的载体、优选由它们组成的粉末固体分散体,其中槲皮素与磷脂的重量比范围为5:1至1:1,并且特征在于x-射线衍射图特征峰位于8.9±0.2、13.5±0.2、26.0±0.2和27.8±0.22θ角(cukα
本发明的粉末固体分散体易于掺入到常规固体剂型如片剂和胶囊中以及在运动营养领域特别有用和有吸引力的即用或临时液体配制物中,运动营养领域代表了槲皮素的最重要应用领域之一。
本发明的另一个目的是含有本发明的粉末固体分散体和一种或多种药学和食品可接受的赋形剂的用于口服施用的配制物,所述赋形剂例如有崩解剂、润滑剂、粘合剂、涂层剂、着色剂、吸收促进剂、增溶剂、稳定剂、调味剂、甜味剂、杀菌剂、防腐剂、抗氧化剂等。
本发明的配制物或制剂可以根据如例如在remington'spharmaceuticalhandbook,mack出版公司,nyusa中描述的常规技术来制备。
本发明的配制物的剂型的实例包括包衣或未包衣的片剂、咀嚼片、胶囊、软明胶胶囊、硬明胶胶囊、胶囊形片剂、锭剂、可咀嚼锭剂、临时和即用液体配制物及其组合。
在模拟胃和肠液中评价了本发明的粉末固体分散体中所含的槲皮素的溶解度提高。
在人中评价了槲皮素的粉末固体分散体与(未进行配制的游离形式的)槲皮素相比的口服生物利用度。结果显示:与(未进行配制的游离形式的)槲皮素二水合物相比,本发明的粉末固体分散体中的槲皮素的口服生物利用度显著改善。
对人受试者进行的药物动力学研究证实:与槲皮素自身相比,本发明的粉末固体分散体的槲皮素的口服生物利用度改善约50倍。
如果与槲皮素自身相比,所得到的本发明的粉末固体分散体具有下述特征:槲皮素的含量高,槲皮素溶解度和溶解速率改善,槲皮素在人中的口服生物利用度(auc和cmax)改善。所有这些都是出人意料的;确实,本发明的粉末固体分散体的dsc分析显示表明了槲皮素的几乎定量的无定形化(其被认为是提高在体液中溶解和生物利用度所必需的),x-射线分析显示结晶形式的槲皮素的显著峰不同于二水合物形式。
下述实施例进一步描述了本发明。
实施例
实施例1:粉末固体分散体的制备
将375g槲皮素二水合物加入到13升乙醇中,然后于60℃加热,混合约15分钟直到完全溶解。
将375g向日葵卵磷脂和250g麦芽糖糊精加入到槲皮素溶液中。将所得混悬液于50℃搅拌约60分钟。在减压下除去溶剂,直到得到软物质。于50℃在真空下除去剩余溶剂约12小时,直到乙醇残留低于10000ppm。
实施例2:粉末固体分散体的制备
将350g槲皮素二水合物加入到12升乙酸乙酯中,然后于60℃加热,混合约15分钟直到完全溶解。
将300g向日葵卵磷脂和350g果糖细粉加入到槲皮素溶液中。将所得混悬液于50℃搅拌约60分钟。在减压下除去溶剂,直到得到软物质。于50℃在真空下除去剩余溶剂约16小时,直到乙酸乙酯残留低于5000ppm。
实施例3:通过dsc(差示扫描量热法)和x-射线分析表征粉末固体分散体
通过dsc、与(未进行配制的游离形式的)槲皮素二水合物相比分析了实施例1中得到的粉末固体分散体。使用mettlerdsc1system进行了分析。在50ml/min氮气流下,使用具有针孔的密闭铝坩埚(40ml容积),采用线性加热速率(10℃/min)记录了从30至300℃的热流。每次测定使用约5-10mg粉末。获得热曲线,通过专用软件进行详细分析。在固体分散体dsc曲线中的槲皮素的吸热峰消失显示表明了几乎定量的无定形化。相反地,与槲皮素二水合物相比和与具有与实施例1中得到的固体分散体相同的质性-定量(quali-quantitative)组成的物理混合物(物理混合物)相比,实施例1中得到的粉末固体分散体的xrdp(x-射线衍射图)(参见附图)显示本发明的固体分散体仍然含有显著量的结晶形式,然而,其不同于槲皮素二水合物自身或所述物理混合物中存在的槲皮素二水合物。
该实施例的槲皮素二水合物的xrdp的特征在于最强衍射峰位于12.52θ角,相对强度为100%(净强度为7096个计数)。在所述物理混合物中,位于12.52θ角的相同峰保持最强(相对强度为100%,净强度为2577个计数),而在所述固体分散体中,在12.52θ角处仅可检测到噪音基线。
相反,在该实施例的固体分散体的xrdp中,最强衍射峰位于13.52θ角,相对强度为100%(净强度为501个计数),然而在槲皮素二水合物和在物理混合物的xrdp中,在13.52θ处仅可检测到噪音基线。就结晶度而言,根据bruker软件diffracevav.3.1及其算法“结晶性”,由该实施例的三种材料的xrdp计算的结晶度为:槲皮素二水合物=85%;物理混合物=47%;固体分散体=37%。
实施例4:粉末固体分散体的表征—在模拟胃-肠液中的溶解度研究
使用下述模拟胃-肠液,在高过量分析物的存在下,使槲皮素二水合物、实施例1中得到的槲皮素粉末固体分散体和所述固体分散体的组分的机械(物理)混合物进行溶解性对比实验:
·禁食状态模拟胃液;
·禁食状态模拟肠液;
·进食状态模拟肠液。
在实验期间使用等量的槲皮素。将槲皮素二水合物、实施例1的槲皮素粉末固体分散体和机械(物理)混合物保持在磁力搅拌下2小时。过滤上清液,通过hplc分析计算槲皮素浓度。将这些溶解性研究的结果记录在下表1中:
表1
溶解性研究的结果显示:尽管存在显著量的结晶形式的槲皮素,但是本发明的粉末固体分散体的溶解性比槲皮素二水合物自身或与磷脂的机械混合物的溶解性大得多。
实施例5:对人进行的药物动力学研究
采用含500mg(未进行配制的)槲皮素二水合物、500mg槲皮素(40%)粉末固体分散体(相当于200mg槲皮素二水合物)和250mg槲皮素(40%)粉末固体分散体(相当于100mg槲皮素二水合物)的膜包衣片剂,在禁食状态下的健康志愿者中进行了单剂量随机、交叉药物动力学研究。平均药物动力学参数(auc0-∞;cmax)记录在下表2中。
表2
结果显示:尽管存在显著量的结晶形式的槲皮素,但是本发明的固体分散体具有比槲皮素二水合物自身高得多的auc和cmax。
实施例6:含有槲皮素粉末固体分散体的配制物(膜包衣片剂)
实施例7:含有槲皮素粉末固体分散体的配制物(软明胶胶囊)
实施例8:含有槲皮素粉末固体分散体的配制物(用于分散体的颗粒)
- 还没有人留言评论。精彩留言会获得点赞!