用于心内起搏器的电极的制作方法
相关申请的交叉引用
本申请要求于2017年9月15日提交的美国临时专利申请序列号62/559,106以及于2017年11月8日提交的美国申请序列号62/583,075的权益,其全部内容通过引用结合于此。
本公开大体上涉及植入式医疗设备并且具体地涉及心内起搏器。
背景技术:
心脏传导系统包括窦房(sa)节、房室(av)节、希氏束、束支以及浦肯野纤维。心跳在sa节中被发起,该sa节用作心脏天然的“起搏器”。由sa节引发的电脉冲使得心房心肌收缩。信号经由av节被传导至心室,av节固有地延迟传导以允许在心室开始收缩之前心房停止收缩,由此提供恰当的av同步。电脉冲经由希氏束、束支以及浦肯野纤维从av节被传导到至心室心肌。
存在传导系统异常(例如,av节传导较差或sa节功能较差)的患者可接收起搏器以用于恢复更为正常的心脏节律和房室同步。双腔起搏器是可用的,其包括经静脉心房引线以及经静脉心室引线,该经静脉心房引线携载被放置在右心房中的电极,,该经静脉心室引线携载经由右心房被放置在右心室中的电极。起搏器自身通常被植入在皮下袋中,其中经静脉引线隧穿至皮下袋。双腔起搏器感测心房电信号以及心室电信号,并且可按照需要提供心房起搏和心室起搏二者,以促进正常的心脏节律和av同步。
已引入或提议心内起搏器用于完全植入至患者心脏内,从而消除经静脉引线的需要,该经静脉引线可能是感染或其他并发症的来源。心内起搏器可提供患者心脏的单个腔室内的感测和起搏。一些患者的单腔室起搏和感测可能充分地解决患者需求,然而,单腔室起搏和感测可能无法完全解决所有患者的心脏传导疾病或异常。可能需要双腔感测和/或起搏功能来恢复更为正常的心脏节律。
技术实现要素:
一般而言,本公开涉及心内起搏器。心内起搏器包括耦合至起搏器壳体的绝缘远侧构件的多个电极。在一些示例中,至少一个非组织穿刺阴极电极被直接耦合至绝缘远侧构件,并且组织穿刺电极延伸远离绝缘远侧构件。非组织穿刺阴极电极可被用于感测来自相邻心脏组织的电信号,以及向相邻心脏组织递送电脉冲。组织穿刺电极可被用于感测来自与相邻心脏组织(即,与非组织穿刺阴极电极相邻的心脏组织)分隔开的心脏组织的电信号,以及向与相邻心脏组织分隔开的心脏组织递送电脉冲。
在一个示例中,本公开提供了起搏器,该起搏器包括壳体,该壳体具有近侧端、远侧端和从近侧端延伸至远侧端的纵向侧壁,该起搏器还包括治疗递送电路,该治疗递送电路由壳体封围用于生成用于向患者心脏递送的起搏脉冲。起搏器包括由壳体的导电部分限定的阳极电极以及耦合至壳体远侧端的电绝缘远侧构件。至少一个非组织穿刺阴极电极被直接耦合至绝缘远侧构件并且电耦合至治疗递送电路,以用于经由第一起搏电极向量递送生成的起搏脉冲的第一部分,该第一起搏电极向量包括至少一个非组织穿刺阴极电极以及阳极电极。组织穿刺电极延伸远离壳体远侧端,以用于递送生成的起搏脉冲的第二部分。
在另一示例中,本公开提供了包括起搏器的起搏器系统,该起搏器具有壳体,该壳体具有近侧端、远侧端以及从近侧端延伸至远侧端的纵向侧壁。治疗递送电路由壳体封围以用于生成用于递送至患者心脏的起搏脉冲。阳极电极是由壳体的导电部分限定的。电绝缘远侧构件被耦合至壳体远侧端。至少一个非组织穿刺阴极电极被直接耦合至绝缘远侧构件并且电耦合至治疗递送电路,以用于经由起搏电极向量递送生成的起搏脉冲的至少一部分,该起搏电极向量包括至少一个非组织穿刺阴极电极以及阳极电极。组织穿刺电极包括从远侧轴端延伸至近侧轴端的电绝缘轴以及在远侧轴端处的尖端电极,该近侧轴端被耦合至壳体远侧端。起搏器进一步包括从壳体近侧端延伸的用于接收递送工具的递送工具接口构件,该递送工具用于将尖端电极推进进入第一心脏腔室组织中以用于起搏第一心脏腔室,并且用于沿着第二心脏腔室组织推进至少一个非组织穿刺阴极以用于起搏第二心脏腔室。
在另一示例中,本公开提供了由起搏器执行的方法,该起搏器具有封围治疗递送电路的壳体,该治疗递送电路用于生成多个起搏脉冲。该方法包括:经由直接耦合至绝缘远侧构件(该绝缘远侧构件耦合至壳体的远侧端)的至少一个非组织穿刺阴极电极递送起搏脉冲的第一部分以用于起搏第一心脏腔室,以及经由具有延伸远离壳体远侧端的阴极尖端电极的组织穿刺远侧电极递送起搏脉冲的第二部分以用于与第一心脏腔室不同的第二心脏腔室。
本发明内容旨在提供对本公开中所描述的主题的概览。并不旨在提供对在下面的附图和描述内详细描述的装置和方法的排他的或穷尽的解释。一个或多个示例的进一步细节在以下的附图和描述中被阐述。
附图说明
图1是植入至患者心脏中的双腔心内起搏器的概念图。
图2是根据一个示例的双腔心内起搏器和患者心脏的解剖结构的放大概念图。
图3是具有包括实现为环形电极的远侧基于壳体的电极的远侧固定和电极组件的双腔心内起搏器的透视图。
图4是根据另一示例的双腔心内起搏器的透视图。
图5是根据另一示例的双腔心内起搏器的透视图。
图6是图5的双腔心内起搏器的远侧部分的截面图。
图7是根据又另一示例的心内起搏器的透视图。
图8是根据另一示例的具有由飞镖(dart)电极携载的第二电极的双腔心内起搏器的透视图。
图9是装载在递送工具中的图5的双腔心内起搏器的概念图。
图10是植入在目标植入部位处的心内起搏器的概念图。
图11是具有替代固定构件的双腔心内起搏器的透视图。
图12a-图12c是根据一个示例的心内起搏器的用于组装远侧固定构件和电极组件的部件的概念图。
图13是根据一个示例的被包括在远侧固定构件和电极组件中的歧管的俯视图。
图14是根据一个示例的可被封围在心内起搏器壳体内以用于提供双腔起搏和感测功能的电路系统的框图。
图15是用于使用图1的双腔心内起搏器的方法的流程图。
图16是具有不止一个远侧飞镖电极的心内起搏器的概念图。
图17是根据另一示例的具有不止一个远侧飞镖电极的心内起搏器的概念图。
图18是根据又另一示例的被配置为用于双腔心脏起搏的心内起搏器的三维透视图。
图19是包括可被包括在图18的起搏器中的携载多个非组织穿刺电极的连续环的整体构件的俯视示意图。
图20是图18的起搏器的远侧固定和电极组件的三维爆炸图。
图21是经由开关电路系统耦合至多个非组织穿刺阴极的心房感测通道和心房感测电路的概念图。
图22是根据另一示例的起搏器的三维图。
具体实施方式
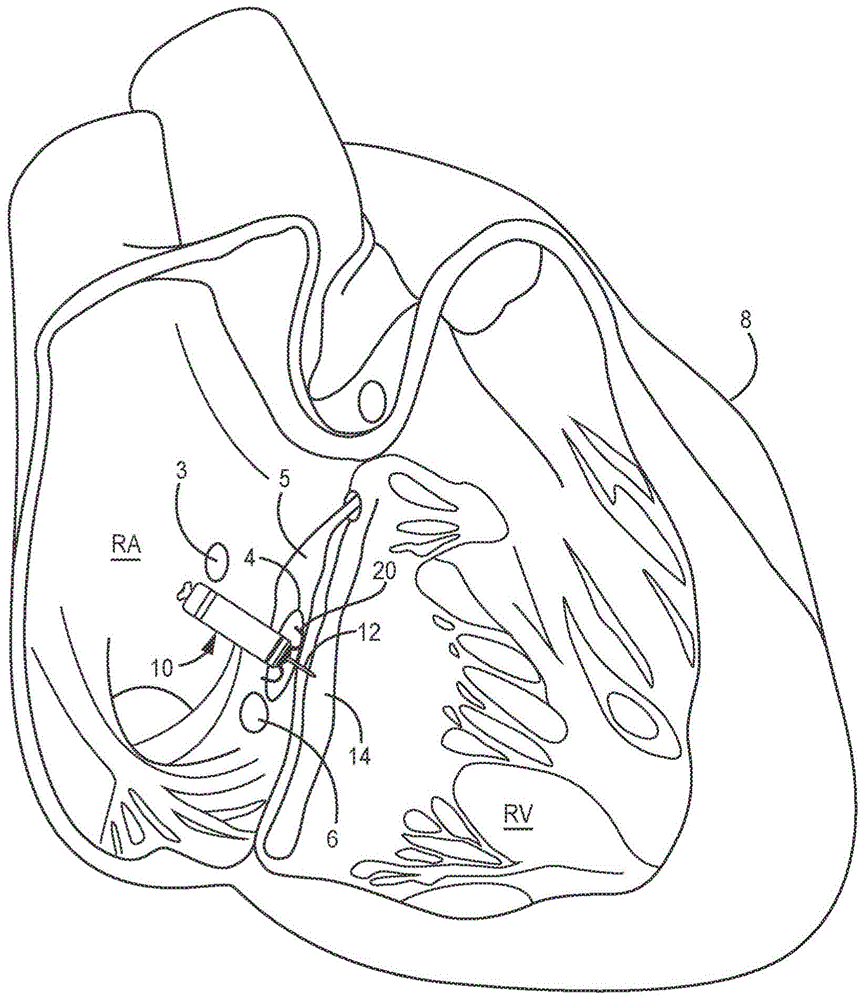
图1是植入至患者心脏8中的双腔心内起搏器10的概念图。起搏器10被示出被植入在患者心脏8的右心房(ra)中在目标植入区4中。起搏器10包括固定构件20,固定构件20将起搏器的远侧端锚定抵靠目标植入区4中的心房内膜。目标植入区4可位于希氏束5与冠状窦6之间,并且可与三尖瓣3相邻。起搏器10可以是无引线起搏器,其包括飞镖电极12,该飞镖电极12具有笔直轴,该笔直轴从起搏器10的远侧端延伸,穿过心房心肌和中心纤维体,并且进入心室心肌14或者沿着心室隔延伸,而不完全穿透心室心内膜或心外膜表面。飞镖电极12在轴的远侧端处携载电极,以将该电极定位在心室心肌内,以用于感测心室信号并且递送心室起搏脉冲。在一些示例中,轴的远侧端处的电极是阴极电极,该阴极电极被提供以在双极起搏和感测电极对中使用。虽然在图1中示出了特定植入区4以使得飞镖电极12的电极能够被定位在心室心肌内,但是应认识到的是,具有本文公开的方面的起搏器可被植入在用于双腔起搏、具有双腔感测的单腔起搏、单腔起搏和/或感测、或适合的其他临床应用的其他位置处。
图2是双腔心内起搏器10和患者心脏8的解剖结构的放大概念图。。心内起搏器10包括壳体30,该壳体30限定了气密密封内腔,起搏器10的内部部件驻留在该气密密封内腔中,该内部部件诸如感测电路、治疗递送电路、控制电路、存储器、遥测电路、其他可选传感器以及电源,如结合下方图所大体描述的。壳体30可由导电材料形成,包括钛或钛合金、不锈钢、mp35n(一种非磁性镍钴铬钼合金)、铂合金或其他生物相容性金属或金属合金。在其他示例中,壳体30由非导电材料形成,包括陶瓷、玻璃、蓝宝石、硅酮、聚氨酯、环氧树脂、乙酰基共聚合物塑料、聚醚醚酮(peek)、液晶聚合物或其他生物相容性聚合物。
壳体30在远侧端32与近侧端34之间延伸,并且在本文呈现的示例中大体为圆柱形,以促进导管递送,但是在其他示例中壳体30可以是棱形或其他形状。壳体30可包括例如在近侧端34处的递送工具接口构件26,用于在起搏器10的植入期间与递送工具接合。下文结合图9描述了可被用于向植入部位递送起搏器10的递送工具的一个示例。
在起搏和/或感测期间,壳体30的全部或一部分可用作电极。在所示的示例中,基于壳体的电极24被示出为围绕(circumscribe)壳体30的近侧部分。当壳体30是由导电材料(诸如,钛合金或上文列出的其他示例)形成时,壳体30的各个部分通过非导电材料进行电绝缘,该非导电材料诸如,聚对二甲苯、聚氨酯、硅酮、环氧树脂或其他生物相容性聚合物,留下导电材料的一个或多个离散区域被暴露以限定近侧基于壳体的电极24。当壳体30是由非导电材料(诸如,陶瓷、玻璃或聚合物材料)形成时,导电涂层或层(诸如钛、铂、不锈钢或其合金)可被应用至壳体30的一个或多个离散区域以形成近侧基于壳体的电极24。在其他示例中,近侧基于壳体的电极24可以是安装或组装在壳体30上的部件,诸如环形电极。近侧基于壳体的电极24可例如经由导电壳体30或当壳体30为非导电材料时经由电导体被电耦合至起搏器10的内部电路系统。在所示的示例中,近侧基于壳体的电极24被定位为更接近壳体近侧端34而不是远侧端32,并且因此被称为“近侧基于壳体的电极”24。然而,在其他示例中,基于壳体的电极24可被定位在沿着壳体30的其他位置处,例如,比所示的位置相对更远侧的位置。
在远侧端32,起搏器10包括远侧固定和电极组件36,远侧固定和电极组件36包括固定构件20和飞镖电极12,该飞镖电极12包括轴40,该轴40从壳体远侧端32向远侧延伸,并且在轴40的自由远侧端处或其附近携载尖端电极42。尖端电极42可具有尖端直径相对较窄(例如,小于1mm)的锥形或半球形远侧尖端,以用于穿透进入并且穿过组织层,而不需要尖锐尖端或具有尖锐或斜切边缘的针状尖端,否则该尖锐尖端或具有尖锐或斜切边缘的针状尖端可能产生可导致尖端电极42的侧向移位以及不期望的组织创伤的切割作用。
飞镖电极12的轴40通常是笔直构件,并且在一些示例中可以是刚性的。在其他示例中,轴40相对刚性,在侧向方向上具有有限的灵活性。轴40可以是非刚性的,以允许随心脏运动一起的一些侧向弯曲。然而,在放松状态下,当不受到任何外部力时,轴40维持如所示的笔直位置,以保持尖端电极42至少在轴40的高度47处与壳体远侧端32分隔开。飞镖电极12被配置为穿刺穿过一个或多个组织层以将尖端电极42定位在期望的组织层内,例如,心室心肌。由此,轴40具有与预期起搏部位深度对应的高度47,并且可具有沿着其纵向轴线的相对高的抗压强度,以在当尖端电极42被挤压抵靠植入部位时向尖端电极42施加纵向轴向力的情况下(例如,通过向壳体30的近侧端34施加纵向推力以将飞镖电极12推进进入目标植入区4内的组织中)在侧向或径向方向上抵抗弯折。轴40可以是纵向非压缩的。当受到侧向或径向的力时,轴40可以是在侧向或径向方向上可弹性地变形的,以允许暂时弯曲(例如,随着组织运动一起),但是当侧向力消失时,将返回至其通常的笔直位置。当轴40未暴露于任何外部力时,或仅暴露于沿着其纵向中心轴的力时,轴40保持如所示的笔直线性位置。
固定构件20可包括通常具有弯曲位置的一个或多个尖齿。固定构件20的尖齿可被保持为如图9中所示的递送工具内的远侧延伸位置。在从递送工具释放后在弹性地向近侧往回弯曲至通常的弯曲位置(所示出的)之前,固定构件的远侧尖端穿透心脏组织至有限的深度。固定构件20的各个方面可与美国2016/0059002a1(grubac等人)或美国专利第9,119,959号(rys等人)中大体公开的固定构件对应,该两者均通过引用以其整体并入本文。
在一些示例中,远侧固定和电极组件36包括远侧基于壳体的电极22。在使用起搏器10以用于双腔起搏和感测的情况下,尖端电极42可被用作与近侧基于壳体的电极24配对的阴极电极,该近侧基于壳体的电极24充当返回阳极电极。替代地,远侧基于壳体的电极22可充当与尖端电极42配对的返回阳极电极,以用于感测心室信号以及递送心室起搏脉冲。在其他示例中,远侧基于壳体的电极22可以是用于感测心房信号以及向目标植入区4中的心房心肌递送起搏脉冲的阴极电极。当远侧基于壳体的电极22充当心房阴极电极时,近侧基于壳体的电极24可充当与尖端电极42配对的返回阳极,以用于心室起搏和感测,并且可充当与远侧基于壳体的电极22配对的返回阳极,以用于心房起搏和感测。
也还如图2中所示的,一些起搏应用中目标植入区4是沿着心房心内膜18,通常在av节15和希氏束5下方。飞镖电极42设置有高度47的轴40,该轴40穿透通过目标植入区4中的心房心内膜18,穿过中心纤维体16并且进入心室心肌14,而没有穿透心室心内膜表面17。当飞镖电极12的完全高度47完全被推进进入目标植入区4中时,尖端电极42位于心室心肌14内,并且远侧基于壳体的电极22被定位与心房心内膜18密切接触或紧邻心房心内膜18。飞镖电极12可具有尖端电极42和轴40的总组合高度47,其在各种示例中大约为3mm到8mm。轴40的直径可以小于2mm,并且可以是1mm或更小,或甚至0.6mm或更小。
在一些示例中,不将飞镖电极12提供作为固定构件或具有任何固定特征,诸如钩、螺旋、倒钩或旨在阻止飞镖电极12从植入部位处的组织缩回的其他特征。在没有固定构件20的情况下,具有通常笔直线性轴的飞镖电极12可至少在植入之后的急性阶段期间容易地滑入和滑出心脏组织。例如,当没有受到外力时,飞镖电极12可具有通常笔直的位置或形状,并且飞镖电极12从其在壳体远侧端32处的固定附接点到尖端电极42的基部是等径的。尖端电极42可在其基部具有最大直径,其基部用与轴40等径的该最大直径与轴40接合(见例如图6)。尖端电极40的直径可从基部向着尖端电极42的远侧尖端减小,例如,根据尖端电极42的锥形或半球形形状。在其他示例中,尖端电极42可以是具有相对平坦钝化或圆形尖端的圆柱形。尖端电极42的远侧尖端可被钝化或呈圆形以避免尖锐切割点或边缘。
图3是根据一个示例的能够双腔起搏和感测的心内起搏器10的三维透视图。起搏器10具有远侧固定和电极组件36,远侧固定和电极组件36包括被实现为环形电极的远侧基于壳体的电极22。当固定构件20的固定构件尖齿20a、20b和20c与心房组织接合时,远侧基于壳体的电极22被定位为与心房组织紧密接触或可操作地邻近心房组织。如结合图9所描述的,在起搏器10向植入部位递送期间,可弹性地变形的尖齿20a、20b以及20c可向远侧延伸。例如,当起搏器10被推出递送工具之外并且弯曲回它们当不再被约束在递送工具内时的通常的弯曲位置(如所示的)时,尖齿20a、20b以及20c穿刺心房心内膜表面。当尖齿20a、20b以及20c弯曲返回至它们正常的位置时,固定构件20作用于将远侧固定构件和电极组件36拉向心房心内膜表面。当远侧固定构件和电极组件36被拉向心房心内膜时,尖端电极42被推进穿过心房心肌以及中心纤维体并且进入心室心肌。远侧基于壳体的电极22可随后被定位抵靠心房心内膜表面。
远侧基于壳体的电极22可以是由导电材料形成的环,诸如钛、铂、铱或其合金。远侧基于壳体的电极22可以是单个连续的环形电极。在其他示例中,环的各个部分可涂覆有电绝缘涂层,例如聚对二甲苯、聚氨酯、硅酮、环氧树脂或其他绝缘涂层,以减小环形电极的导电表面积。例如,环的一个或多个扇区可被涂覆为将远侧基于壳体的电极22的两个或更多个导电暴露表面积分开。减小远侧基于壳体的电极22的导电表面积(例如,通过使用绝缘涂层来覆盖导电环的各部分)可增加远侧基于壳体22的电阻抗,并且由此降低在起搏脉冲期间递送的夺获心肌(例如,心房心肌组织)的电流。较低的电流消耗节省起搏器10的电源,例如,一个或多个可充电或不可充电电池。
如上文描述的,远侧基于壳体的电极22可被配置为心室阴极电极,以用于与作为返回阳极的近侧基于壳体的电极24组合在植入部位处向心房组织递送起搏脉冲。电极22和24可被用于感测心房p波,以在控制心房起搏脉冲(在没有感知到的p波的情况下被递送的)中使用,以及用于控制心房同步心室起搏脉冲,该心房同步心室起搏脉冲是使用尖端电极42作为阴极以及近侧基于壳体的电极24作为返回阳极递送的。在其他示例中,远侧基于壳体的电极22可被用作返回阳极,其结合阴极尖端电极42以用于心室起搏和感测。
图4是根据另一示例的心内起搏器10的侧向透视图,其中起搏器10可被配置成用于双腔起搏和感测。在该示例中,远侧固定构件和电极组件36携载远侧基于壳体的电极52,该远侧基于壳体的电极52围绕组件36的外周沿着周向表面39周向地延伸。在其他示例中,远侧基于壳体的电极52可围绕壳体30周向地延伸,位于组件36的近侧但位于近侧基于壳体的电极24的远侧,并且与近侧基于壳体的电极24电隔离。例如,壳体30可由非导电材料(例如,玻璃或陶瓷)形成,使得两个或多个基于壳体的电极22和24可围绕壳体30周向地延伸,彼此电隔离并且单独地经由相应电馈通耦合至封围在壳体30内的电子电路,诸如,感测和/或起搏电路。
在另一示例中,远侧固定构件和电极组件36可包括多个远侧基于壳体的电极,例如,沿着其远侧表面38的一个或多个电极和/或沿着其周向表面39的一个或多个电极。例如,组件36可包括如图3中所示的沿着远侧表面38的环形电极,或如下文结合图5所描述的沿着远侧表面38的一个或多个纽扣电极,并且环形电极如图4中所示地围绕周向表面39。远侧基于壳体的电极可以是单独地可选择的,以用于电耦合至由壳体30封围的感测和/或起搏电路,以供单独地使用,或作为具有单极性的电极以任何组合的方式使用,或作为具有双极性的电极的组合。例如,单个远侧基于壳体的电极、或单极性远侧基于壳体的电极的组合可充当与尖端电极42配对的阳极,该尖端电极42充当阴极,以用于心室起搏。远侧基于壳体的电极、或单极性远侧基于壳体的电极的组合可充当与近侧基于壳体的电极24配对的心房阴极电极,该侧基于壳体的电极24充当阳极。在其他示例中,远侧基于壳体的电极的组合可被选择为阳极和阴极对,以用于心房起搏和感测。
图5是根据另一示例的双腔心内起搏器的三维透视图。在该示例中,飞镖电极12包括锥形尖端电极42,该锥形尖端电极42具有基部43,该基部43的直径大于轴40的外径45。尖端电极42的远侧尖端44可被钝化以避免尖锐尖端以及起搏部位处的高电流密度。
远侧基于壳体的电极62包括一个或多个纽扣电极,在本示例中三个纽扣电极62a、62b以及62c被统称为远侧基于壳体的电极62,该三个纽扣电极全部沿着远侧固定构件和电极组件36的远侧表面38被定位。三个纽扣电极62a、62b以及62c可被电耦合在一起以用作单个电极。分开的纽扣电极62a、62b以及62c可具有小于连续环形电极(诸如图3中所示的远侧基于壳体的电极22或图4中的远侧基于壳体的电极52)的总表面积。远侧基于壳体的电极62的较小的总表面积增加了起搏负载的电阻抗,从而减小了起搏电流以及起搏器10的电池消耗。在一个示例中,每一个纽扣电极62a、62b以及62c的表面积为1.2mm2或更小,其组合总表面为3.6mm2或更小。
在其他示例中,三个纽扣电极62a、62b以及62c可以是可由被包括在由壳体30封围的电子器件中的开关电路系统单独地选择的。每一个电极62a、62b以及62c可被单独地电耦合至封围在壳体30中的起搏电路和/或感测电路,使得电极62a、62b以及62c可被一次选择一个、一次选择两个或一次选择所有,例如,以充当心房阴极电极,以用于感测心房信号并且递送心房起搏脉冲。
分开的纽扣电极62a、62b以及62c可沿着远侧表面38以相等的距离分布在飞镖电极12外周,该飞镖电极12的中心与壳体30的纵向轴线31共轴。例如,将电极62a、62b以及62c的每一个相邻对分开的弧度可以是120度。在由固定构件20将远侧表面38拉向心房心内膜时,取决于植入部位处的解剖以及飞镖电极12和固定构件20在植入部位处的进入角度,电极62a、62b以及62c中的一个或两个与电极62a、62b以及62c中的其他一个或两个相比较可具有与心房心内膜的更佳接触。通过沿着远侧表面38将电极62a、62b以及62c分隔开,例如,在不同的径向位置处,至少一个电极62a、62b以及62c被期望具有与心内膜的良好接触,以实现可靠的心房感测和起搏。
在图5中,电极62a、62b以及62c被示出被分隔在固定构件20的相同数量的尖齿之间。每一个电极62a、62b以及62c大约位于固定构件20的两个相邻的尖齿的中心。在其他示例中,每一个电极62a、62b以及62c可与固定构件20的尖齿径向地对齐,以促进心内膜表面与电极62a、62b以及62c之间的紧密接触。虽然在图5中示出了三个纽扣电极62a、62b以及62c,但是应认识到的是,远侧基于壳体的电极62可包括少于三个、少至一个、或多于三个的纽扣电极沿着固定构件和电极组件36的远侧表面38以相等或不相等的间隔或弧度分布。此外,远侧固定构件和电极组件36不需要具有相等数量的限定远侧基于壳体的电极62的电极和被包括在固定构件20中的尖齿;可沿着远侧表面383提供比固定构件尖齿数量更少或更多的电极。
电极62a、62b以及62c可如图5中所示地升高,使得电极62a、62b以及62c的表面从远侧表面38突出,以用于在植入部位处于心房心内膜进行更佳的接触。在其他示例中,电极62a、62b以及62c可与远侧表面38齐平。远侧表面38被示出为凸表面。在其他示例中,远侧表面38可比此处示出的远侧表面更为凸起或更不凸起,并且可适用于匹配植入部位处的解剖,以促进远侧基于壳体的电极62与心房心内膜的接触。在另其他示例中,一个或多个纽扣电极62a、62b以及62c可被沿着组件36的周向表面39定位。
图6是能够双腔起搏和感测的心内起搏器10的远侧部分的截面图。在一些示例中,远侧固定构件和电极组件36包括内部主体70以及外部环72,用于支持并且保持固定构件20、飞镖电极12以及远侧基于壳体的电极62并且将这些部件耦合至壳体30(并且如有需要,则耦合至壳体30的内部部件)。在下文结合图12a-图12c描述用于组装这些各个部件的方法。固定构件20可包括从固定构件环224延伸的一个或多个弯曲尖齿,该固定构件环224被保持在内部主体70与外部环72的互锁面之间。内部主体70以及外部环72可以是模制部件,包括聚氨酯、硅酮、环氧树脂、peek或其他生物相容性聚合物材料,并且可包括各种管道、内腔、腔、凹槽或用于接收并且保持轴40、基于壳体的电极62、电导体以及所需的其他组件部件的其他特征。下文结合图12a-图12c描述远侧固定构件和电极组件36的其他方面。
在该示例中,轴40包括电耦合至尖端电极42并且从尖端电极42延伸至电馈通导线250的电导体46,该电馈通导线250经由电馈通50提供跨壳体30的电连接。电导体46在本示例中被示出为线圈导体,但在其他示例中可以是编织的、绞合的或其他多纤丝导体或单股导线。轴40进一步包括管状体48,该管状体48将电导体46电绝缘,并且结合电导体46为轴40提供沿着其纵向中心轴线31的高抗压强度的机械属性,并且在一些示例中,提供侧向弹性变形性。飞镖电极12具备高抗压强度,使得它可以穿透进入并且通过组织层,而具有少量或不具有由于针对尖端电极42的纵向力而引起的压缩或弯曲。当由于心脏运动而受到侧向力时,飞镖电极12可在侧向方向上具备一些柔性。管状体48可以是被应用在电导体46上以封围并且围绕导体46的涂层或包覆模制部件。在一些示例中,管状体48可在包覆模制过程期间变得被接合到电导体46。在其他示例中,管状体48可以是在组装过程期间接收电导体46的预形成、挤压或模制的管状部件。管状体48可以是电绝缘材料,并且可包括聚对二甲苯、聚氨酯、环氧树脂、peek、硅酮或其他生物相容性聚合物。在其他示例中,管状体48可以是导电材料,例如,不锈钢、钛或钛合金,其中其外部暴露表面涂覆有电绝缘材料。
尖端电极42包括柄部分42a以及在轴40的远侧端处暴露的主动(active)暴露电极部分42b。柄部分42a可以不暴露于周围组织/环境,并且被电耦合至电导体46并且机械地耦合至轴40。例如,柄部分42a可延伸穿过由管状体48和线圈电导体46限定的内腔60的至少一部分,并且可比所示的延伸得更远,例如,延伸至内部主体70的一半或甚至延伸内部主体70的全部。在其他示例中,柄部分42a是管状构件,其延伸进入管状体48并且在由柄部分42a限定的内腔内接收电导体46的一部分,以用于在导体46与尖端电极42之间的机械耦合以及电耦合两者。柄部分42a可对飞镖电极12的纵向无压缩以及至少在一些示例中的可侧向弹性地变形的机械属性作出贡献。
如需要的话,则中心构件61可在腔60内延伸以实现飞镖电极12纵向无压缩以及可侧向弹性地变形的期望的机械属性。中心构件61可以是固体支持构件、弹簧、线缆、管或棒,并且可包括提供高纵向抗压强度和/或侧向弹性变形性的金属或塑料材料。在其他示例中,中心构件61可以是类固醇浸渍的聚合物构件,其提供随着时间穿过暴露的尖端电极部分42b的类固醇洗脱(steroidelution)。例如,中心构件61可以是包括聚合物基质(例如,硅酮或聚氨酯基)以及在聚合物基质中合成的类固醇(例如,地塞米松磷酸钠)的单片式控制释放设备(mcrd)。
尖端电极42的主动电极部分42b被暴露在轴40的远侧端处,并且被示出为具有圆形或钝化尖端44的基本锥形,这与具有可能对周围组织造成损伤或在起搏期间创建高电流密度的点的尖锐尖端是相对的。暴露的电极部分42b具有基部43,该基部43与管状体48的外径45等径。以此方式,飞镖电极12在期望的植入部位处以最小的阻力滑入心脏组织中,并且如果起搏器10需要被移除,则可被轻松地从植入部位缩回。
暴露的电极分布42b可以是烧结的,例如,烧结铂铱。尖端电极42可以是类固醇洗脱电极,其具有烧结主动电极部分42b以及中空管状柄部分42a,该中空管状柄部分42a允许来自类固醇洗脱构件(例如,一些示例中的中心构件61)的类固醇洗脱,用于通过尖端电极42被释放进入周围组织,以减小起搏和感测部位处的异物反应。
轴40可包括基部49,该基部49围绕管状体48并且被保持在内部主体70内。基部49向电导体46与馈通导线250之间的焊接电连接提供机械支持。在一些示例中,馈通导线250被焊接至轴安装构件252的轴接收引脚254。轴安装构件252可以是导电构件,其通过将轴40安装在轴安装构件252的轴接收引脚254的上方而被电耦合至导体46。导电轴接收引脚254与电导体46的物理接触可提供电导体46与馈通导线250之间的电连接,该馈通导线250被焊接或以其它方式电耦合至轴安装构件252。轴40的基部49向这些连接提供电绝缘和机械支持。基部49可以是聚合物管状构件,其例如使用医疗粘合剂被密封并且接合至轴40的外部管状体48。基部49可抵靠内部主体70的内部停止表面78,以防止飞镖电极12从内部主体70被拉走。
轴安装构件252被安装在歧管240上,歧管240将馈通导线250引向飞镖电极12,并且将其他馈通导线(在图6中未示出)引向远侧基于壳体的导线62。歧管240包括中心腔244,中心腔244将馈通导线250从电馈通50传递至轴安装构件252。歧管240可被粘合地接合到壳体30的远侧端盖228以及馈通50上方。
远侧端盖228可包括一个或多个内部径向向外延伸的突片230。内部主体70可包括一个或多个径向向内延伸的突片73,该一个或多个径向向内延伸的突片73与相应的向外延伸的突片230接合并且配合。在组装期间,内部主体70可被粘合地接合到外部环72,其中固定构件环224被夹在(trap)内部主体70与外部环72之间以形成子组件。该子组件可与飞镖电极12组装在一起,并且随后通过将内部主体70放置在远侧端盖228上并且向内延伸的突片73定位在向外延伸的突片230之间、在由间隔开的向外延伸的突片230限定的空间(如图12a中最佳所见的)内,来附接至壳体远侧端盖228。一旦被放置抵靠远侧端盖228,整个固定构件和电极组件36可相对于壳体30(以及壳体远侧端盖228)旋转,使得内部主体70的径向向内延伸的突片73变得被内夹(entrap)在远侧端盖228的径向向外延伸的突片230的下方。可使用医疗粘合剂来填充并且密封任何间隙或空间,并且接合远侧固定构件和电极组件36与壳体30的各种接合表面。以此方式,远侧固定构件和电极组件36可被固定地耦合至壳体30。
图7是根据另一示例的起搏器10的侧向透视图。在该示例中,飞镖电极12包括圆形圆柱体尖端电极42,而不是如图6中所示的圆锥尖端电极。尖端电极42的远侧尖端44被制作得尽可能钝化,具有圆形边缘,以避免任何组织切割动作以及高电路密度的点。当基部43的直径增加(或轴40的直径45增加)时,尖端44处的直径可能需要减小或变得尖,例如,如图6中尖端电极42的圆锥形状所示的,以便于使用在外科手术植入期间可合理实现的力穿透心脏组织。例如,尖端44变得越大并且越钝化,将飞镖电极12推进进入并且穿过心房心肌以及中心纤维体以将尖端电极42定位在心室心肌中所需的力就越大。轴40的直径45以及尖端电极42的等径基部43越小,远侧尖端44可更呈圆形或钝化,同时仍使得能够刺穿并且推进穿过心脏组织。施加至飞镖电极12的纵向力可通过用户操纵递送工具和/或通过固定构件20在其从延伸位置弹性地弯曲返回至其正常弯曲位置时的拉力,来被施加在壳体近侧端34处。
图8是根据另一示例的双腔心内起搏器10的侧向透视图。在上文描述的示例中,飞镖电极12的轴40具有非导电的外部管状体48(见图6),并且该外部管状体48将电导体46绝缘,该电导体46将尖端电极42电耦合至由壳体30封围的电路系统。主动尖端电极部分42b是飞镖电极12暴露于周围组织/环境的唯一导电表面。在图8中所示的示例中,飞镖电极12包括由轴40携载的第二电极64。第二电极64可以是围绕轴40安装的或安装在轴40与固定构件和电极组件36的远侧表面38之间的环形电极。在一个示例中,飞镖电极12的尖端电极42以及第二(环形)电极64被耦合至相应的线圈、编织、绞合、编股导体或导线导体,并且导体用电绝缘镀层被包覆模制以形成管状体48,留下电极42和64的主动表面积被暴露。
在其他示例中,轴40的管状体可以是导电金属体,其具有绝缘涂层(例如,聚对二甲苯或本文给出的其他示例),该绝缘涂层覆盖该导电金属体的外表面(除电极64的暴露区域之外)并且将轴40从尖端电极42绝缘。绝缘涂层将电极42和64彼此绝缘,使得它们可充当互斥电极。
由轴40携载的第二电极64可充当与尖端电极42配对的阳极电极,该尖端电极42充当阴极,以用于递送心室起搏脉冲以及感测心室信号。例如,由轴40携载的第二电极64可经由从轴40延伸的绝缘导体通过固定构件和电极组件36被电耦合至壳体30或电接地。在其他示例中,第二电极64可以是阴极电极,并且尖端电极42可以是阳极电极。
在其他示例中,第二电极64可用作心房阴极电极,并且被电耦合至由壳体30封围的相应感测和起搏电路的心房感测通道以及心房起搏通道。在该情况下,尖端电极42可充当心室电极,例如,阴极电极,并且沿着轴40在尖端电极42近侧的作为第二电极被提供的环形电极64可充当心房电极,例如,心房阴极电极。在该示例中,每一个阴极电极(尖端电极42和环形电极64)可与相同或不同的阳极电极配对,该相同或不同的阳极电极可沿着固定构件和电极组件36的远侧表面38被携载,诸如,被提供作为纽扣电极的远侧基于壳体的电极62、围绕固定构件和电极组件36的环形电极(诸如,图4中示出的电极52)、或近侧基于壳体的电极24。
图9是装载在递送工具100中的双腔心内起搏器10的概念图。递送工具100包括外部导管102、推进工具104、系绳(tether)106并且可包括内部转向工具107。外部导管102具有用于接收以及保持起搏器10的远侧设备插座(receptacle)108。插座108具有远侧开口110,通过该远侧开口110起搏器10可被装载进入递送工具100并且在植入位置处从递送工具100被释放。推进工具104延伸穿过外部导管102的内腔,并且可包括远侧推动器圆锥或杯状物105,该远侧推动器圆锥或杯状物105被配置为与壳体30的近侧端34接合,以用于当推进工具104远侧地推进穿过外部导管102时将壳体30推出远侧开口110。系绳106,其可被提供作为细长体或缝合线,可延伸穿过推进工具104,并且可以可移除地附接或环过(loopthrough)起搏器10的递送工具接口26。系绳106可由临床医生使用以缩回起搏器10,以在向起搏部位推进递送工具100期间将起搏器10保持在插座108内。
内部转向工具107可以是细长管状体,其延伸穿过由推进工具104限定的腔。内部转向工具107可以是可转向体,其可被用于将远侧开口110转向目标植入区4(图1中示出)。在一些示例中,内部转向工具107可限定内腔,诸如引导线之类的转向构件延伸通过该内腔。在该情况下,内部转向工具107可以是被动管状体,其遵循内部转向构件或引导线的轮廓。
推进器杯状物105的大小被设计为与壳体近侧端34以及递送工具接口构件26配对并且可移除地接合。系绳106可被用于只要推进工具104在外部导管102内保持缩回位置(如所示的)就缩回起搏器10并将其保持在插座108中。当远侧开口110已被转向至期望的植入部位时,随着推进工具104在外部导管102中被向远侧推进,系绳106上的张力可减轻,使得推进器杯状物105被向远侧推进穿过插座108,从而将起搏器10推到远侧开口110之外。
固定构件20被示出以延伸位置被保持在插座108的范围内。当远侧开口110在目标植入区(例如,图1的区4)处被放置在心内膜组织附近或抵靠心内膜组织并且起搏器10由推进工具104推到远侧开口110之外时,固定构件20的每一个尖齿的远侧尖端21穿刺心房心内膜表面并且部分地推进进入心肌组织,直至固定构件20被推出插座108足够远以使得固定构件20的预形成的弯曲尖齿不再被限制并且开始弹性地弯曲或弯折回它们通常的松弛弯曲位置。在部署固定构件20之后,系绳106可被缩回以从递送工具接口构件26被释放,并且递送工具100可被缩回并且移除,使得起搏器10被主动地固定在植入部位处。递送工具100以及固定构件20的各个方面可与美国专利公开第2012/0172892号(grubac等人)中大体公开的医疗设备固定装置以及技术相对应,该专利公开通过引用以其整体并入本文。
图10是植入在目标植入部位处的起搏器10的概念图。如图10的植入位置中所示,固定构件20的每一个尖齿的远侧尖端21可回退到心房心内膜表面18之外,使得组织在固定构件20的每一个尖齿的弯曲部分内变得更为接合。当固定构件20变得与心房心肌19接合时,飞镖电极12在目标组织区处穿刺进入组织并且推进穿过心房心肌19以及中心纤维体16,以将尖端电极42定位在心室心肌14中,如图10中所示的。远侧基于壳体的电极22(在图10中示出为环形电极)可由固定构件20保持与心房心内膜表面18接触。固定构件20防止飞镖电极12从心室心肌14缩回。如上文所描述的,飞镖电极12可以是线性的并且从圆锥、圆柱形或半球形尖端电极42到其在固定构件和电极组件36的远侧表面上的附接点是等径的,使得不存在突起、钩、倒钩、螺旋或将阻止飞镖电极12缩回的其他特征。在一些示例中,固定构件20是起搏器10的唯一固定特征。
飞镖电极12的高度47被选择以确保尖端电极42在组织层中抵达足够的深度以抵达目标起搏和感测部位(在该情况中目标起搏和感测部位在心室心肌中),而不会一直穿刺进入相邻的心脏腔室。在各种示例中,高度47可至少为3mm,但小于20mm、小于15mm、小于10mm或至多8mm。
再次参考图9,尖端电极42以及处于延伸位置的固定构件20的每一个尖齿的远侧尖端21可从壳体远侧端32延伸大约等距。图10中示出的处于延伸位置的固定构件20的尖齿以及飞镖电极12可延伸至从轴40的连接点到组件36的相同高度47。在该情况下,尖端电极42以及固定构件20的尖齿远侧尖端21将在起搏器10被推出远侧开口110时在植入部位处穿刺组织。经由推进工具104施加至壳体近侧端34的手动压力提供了在植入部位处穿刺心脏组织所需的纵向力。
在其他示例中,当固定构件20在插座108内被保持在延伸位置中时,尖齿远侧尖端21可从轴42的近侧基部延伸大于飞镖电极12的高度47的高度。在该情况下,远侧尖齿尖端21在尖端电极42之前首先穿刺组织,并且在固定构件弹性地弯折或弯曲回至其通常弯曲位置时,可用于将起搏器10拉向心房心内膜表面18。由固定构件20产生的该拉力可贡献于驱动尖端电极42进入植入部位处的组织并且将尖端电极42推进进入心室起搏部位的纵向力。在一些示例中,由固定构件20产生的拉力可以是驱动飞镖电极12进入心脏组织到心室心肌中的期望的深度以实现双腔起搏和感测功能所需的唯一的力。
在另其他示例中,当尖齿远侧尖端21被保持在图9中所示的延伸位置中时,飞镖电极12的高度47可大于尖齿远侧尖端21延伸的距离。在该情况下,尖端电极42首先穿刺心房心内膜,并且在固定构件20的尖齿远侧尖端21进入心内膜组织之前部分地推进进入组织层。例如,尖端电极42可至少部分地推进穿过心房心肌,并且固定构件20可作用于增加纵向力,该纵向力通过在固定构件20的尖齿弹性地返回到它们通常的弯曲位置时将起搏器10拉向心房心内膜表面,来驱动尖端电极42穿过中心纤维体并且进入心室心肌。
图11是具有替代固定构件120的心内起搏器10的三维透视图。心内起搏器10可以是双腔起搏器,其具有用于在心室心肌中起搏以及感测的远侧飞镖电极12,可使用除上文给出的固定构件20的示例中示出的弹性可变形穿透组织的尖齿之外的其他固定构件将该远侧飞镖电极12锚定在心房腔室中。在图11的示例中,固定构件120包括从附接至固定构件和电极组件36的固定端122沿着外周螺旋路径延伸至组织穿刺远侧尖端124的两个组织接合部分。固定构件120可大体上与美国专利第8,948,883号(eggen等人)中公开的电极组件的组织接合部分相对应,该美国专利以其整体通过引用并入本文。
可通过使用推进工具(诸如,图9中示出的推进工具104)沿着壳体30和飞镖电极12的中心纵向轴线施加力来推进飞镖电极12进入组织(例如,心房心肌),来将起搏器10植入在组织部位处。在其他示例中,可施加沿着壳体30和飞镖电极12的纵向中心轴线的轴向力,同时也使用递送工具例如通过旋转推进工具104或整个递送工具100来施加旋转力,,以通过旋转力和轴向力二者推进飞镖电极12进入植入部位。当固定构件120的穿刺远侧尖端124抵达组织表面(例如,心房心内膜表面)时,起搏器10被旋转(针对示出的组织接合部分的取向的顺时针)以推进固定构件120进入组织部位,并且进一步推进飞镖电极12至心室感测和起搏部位。固定构件120与在植入部位处的组织的接合以及固定构件120到在植入部位处的组织的推进可贡献于推进飞镖电极12穿过组织层并且进入心室心肌的纵向力。固定构件120防止飞镖电极12从心室起搏部位缩回。
飞镖电极12被示出具有高度,与固定构件120的远侧穿刺尖端124相比较,该高度从远侧表面38延伸了更大的距离。在其他示例中,固定构件120的组织接合部分可具有比图11中示出的更大的长度,使得远侧穿刺尖端124和尖端电极42的尖端44距离远侧表面38是等距的,并且同时进入组织。替代地,远侧穿刺尖端124可从远侧表面38延伸至超过飞镖电极12的高度的高度。在该情况下,起搏器10的旋转推进固定构件120在植入部位处首先进入心脏组织,并且随后飞镖电极12被推进进入并且穿过组织层,直至尖端电极42抵达心室起搏部位。通过旋转起搏器10推进固定构件120进入组织可产生推进飞镖电极12穿过组织层进入心室心肌所需的唯一的纵向力。在其他情况下,可需要在壳体近侧端34处施加额外纵向力以将飞镖电极12完全推进至其最终位置。
图12a-图12c是组装远侧固定构件和电极组件36以及将组件36耦合至壳体30的方法和部件的概念图。图12a是根据一个示例的远侧固定构件和电极组件36的爆炸图。组件36可包括内部主体70以及外部环72,该组件36可以是在图12中被示出组装在一起的模制互锁部件。固定构件220包括从固定构件环224延伸的一个或多个尖齿220a、220b、220c以及220d,固定构件环224可被捕获并且保持在内部主体70与外部环72之间。
绝缘导电馈通导线232和250从壳体30内向外延伸穿过电馈通50,该电馈通50延伸穿过壳体30的远侧端盖228。馈通导线232提供壳体30内部电路系统到远侧基于壳体的电极262中的每一个的电连接,在该示例中,远侧基于壳体的电极262包括四个纽扣电极262a、262b、262c以及262d。馈通导线250提供从内部电路系统到尖端电极42的电连接。远侧端盖228包括间隔开的径向向外延伸的突片230,以用于与内部主体70的径向向内延伸的突片73互锁(如图6中最佳所见)。
歧管240可被提供为具有径向延伸的水平通道242,以用于引导多个馈通导线232中的每一个到相应的纽扣电极262a-d,并且具有中心腔244,以用于穿过用于电偶合到飞镖电极12的电导体46(如图6中所示)的馈通导线250。可提供轴安装构件252以用于机械地耦合以及支持飞镖电极12的轴40。在一些示例中,轴安装构件252可提供馈通导线250与电导体46(见图6)之间在轴40内的电耦合,并且提供电连接的机械支持。
飞镖电极12可被提供为子组件,该子组件具有尖端电极42,该尖端电极42被安装在轴40的远侧端处(如上文结合图6所描述的),并且被电耦合至延伸穿过轴40的电导体46,以促进尖端电极42到馈通导线250的电连接。轴40可包括预模制或包覆模制的刚性管状体或半刚性管状体以如上文描述的将电导体46封围在内。轴40可以是纵向非压缩的,以抵抗在飞镖电极12插入心脏组织期间以及推进尖端电极42至心室起搏部位期间的沿着飞镖电极12的纵向中心轴的压缩力。轴40可通过在侧向方向上弹性地可变形以具备侧向柔性。轴40可被提供具有近侧基部49,该近侧基部49被配置成密封并且加强轴40与轴安装构件252之间的连接。
图12b是部分组装的远侧固定构件和电极组件36的概念图。歧管240被安装在壳体30的远侧端盖228上,其中馈通导线232和250穿过歧管240。医疗粘合剂可被施加在电馈通50上以将歧管240固定地耦合并且密封在馈通50上方以及在远侧端盖228上的适当位置。轴安装构件252被安装在歧管240顶部。轴接收引脚254可与壳体30的中心纵向轴线对齐。轴接收引脚254被配置为与轴40的近侧端配对,并且可引导馈通导线250穿过引脚254的中心腔,以用于电耦合至轴40内延伸的电导体46(图6中所示)。在一些示例中,馈通导线250被电耦合至轴接收引脚254,并且轴接收引脚254被电耦合至电导体46。
在一些示例中,基部49是可滑动构件,其在飞镖电极12的组装期间可在轴40上方向远侧推进至轴接收引脚254上。基部49可在轴接收引脚254与轴40之间的接合处向下滑动,以密封、绝缘并且机械地加强轴接收引脚254、馈通导线250以及轴40内延伸的电导体46之间的连接。在各种示例中,可使用焊接、粘合剂接合、或适用于轴安装构件252和轴基部49的特定材料的其他接合方法来将飞镖电极12的基部49固定地耦合至轴安装构件252。
可使用医疗粘合剂将外部环72以及内部主体70密封在一起以形成子组件,该子组件包括保持在外部环72与内部主体70之间的固定构件220。组件36的内部主体70限定了用于在飞镖电极12已被组装到轴安装构件252上之后在飞镖电极12上方穿过的中心腔76。内部主体70进一步限定了电极腔74,以用于接收并且保持纽扣电极262a-d。与纽扣电极262a-262d中的每一个相对应的馈通导线232中的每一个可由歧管240引向相应的电极腔74,以促进电耦合到相应电极262a-d。在将内部主体70在飞镖电极12上方穿过之后,与远侧基于壳体的电极262a-d相对应的剩余馈通导线232中的每一个被穿过电极接收腔74,以使得每一个馈通导线232能够耦合至远侧基于壳体的纽扣电极262a-262d中的相应一个。
图12c是远侧固定构件和电极组件36的完全组装的概念图。内部主体70和外部环72可与壳体30对齐以在径向向外延伸的突片230上方穿过,随后被旋转以锁定在径向向外延伸的突片230下方的适当位置中的径向向内延伸的突片73(在图6中示出),其中内部主体70被密封在轴安装构件252上方。在其他示例中,内部主体70和/或外部环72可包括凹槽、螺纹、凸缘、或与被包括在远侧端盖228上的对应的特征配对的其他特征或特征的组合,以用于将远侧固定构件和组件36与壳体30对齐并且固定地耦合。
电极262可被压入配合并且密封或焊接进入相应腔74内的位置中。执行将馈通导线232修整(如需要的话)并且点焊至每一个相应电极262。医疗粘合剂(诸如,硅酮粘合剂)或其他接合以及密封材料可根据需要被应用在飞镖电极12、内部主体70、远侧基于壳体的电极262、外部环72与壳体30之间的接合点处,以固定地将远侧固定构件和电极组件36的部件与壳体30进行耦合并且促进导电部件与身体组织和流体(除故意暴露的电极表面之外)的气密密封和电绝缘。
图13是歧管240的俯视图。歧管240包括从歧管240的底部表面延伸至顶部表面的中心腔244,以用于传递被电耦合至飞镖电极12的馈通导线250。在第二电极由飞镖电极12的轴40携载的情况下(例如,如图8中所示),可提供不止一个中心腔或中心腔244可容纳不止一个绝缘馈通导线。
歧管240包括从歧管240的底部表面延伸至顶部表面的一个或多个外周腔243,以用于将馈通导线232传递至每一个相应的远侧基于壳体的电极262。每一个外周腔243与水平径向延伸的通道242连通,该水平径向延伸的通道242用于将相应馈通导线232引向与相应基于壳体的电极262的电连接点,例如,引向内部主体70的相应电极腔74。每一个通道242被示出具有宽度,该宽度随着向歧管240的外周246移动而变宽。通道242靠近腔243的宽度245小于靠近外周246的宽度247。向外周246移动而变宽的通道宽度允许(多个)馈通导线232在远侧固定构件和电极组件36内侧向地移位。
例如,在上文描述的组装过程期间,馈通导线232可穿过内部主体70的电极腔74。与外部环72以及固定构件220组装的内部主体70在飞镖电极12上方被推进,并且被安置在远侧端盖228上,随后被旋转以将远侧固定构件和电极组件36机械地锁定就位,如结合图6所描述的。在相对于歧管240以及壳体30旋转内部主体70和外部环72期间,通过增宽通道242来容纳馈通导线232的侧向移位。通道242向着外周246移动而逐渐增宽避免馈通导线232中的突然弯折或扭结,否则可能在旋转期间导致馈通导线232中的突然弯折或扭结。
图14是根据一个示例的可被封围在壳体30内以用于提供起搏器10的双腔起搏和感测功能的电路系统的框图。封围在壳体30内的电子电路系统包括软件、固件以及硬件,该软件、固件以及硬件合作地监测心房和心室电心脏信号、确定起搏治疗何时是必需的、以及按需根据编程的起搏模式和起搏脉冲控制参数向患者心脏递送电起搏脉冲。电子电路系统包括控制电路80、存储器82、治疗递送电路84、感测电路86以及遥测电路88。在一些示例中,起搏器10包括用于产生与患者的生理功能、状态或状况相关的信号的一个或多个传感器90,诸如患者活动传感器,以在确定起搏治疗的需要和/或控制起搏频率中使用。
电源98根据需要向起搏器10的电路系统(包括部件80、82、84、86、88和90中的每一个)提供电力。电源98可以包括一个或多个能量存储设备,诸如一个或多个可再充电或不可再充电的电池。电源98与其他部件80、82、84、86、88和90中的每一个之间的连接将从图14的总体框图来理解,但是为了清楚起见未被示出。例如,电源98被耦合至被包括在治疗递送电路84中的一个或多个充电电路,以用于向治疗递送电路84中所包括的电荷保持电容器提供所需的电力,该电荷保持电容器在控制电路80的控制下在适当时间处放电,以用于例如根据诸如ddi(r)之类的双腔起搏模式递送起搏脉冲。根据需要,电源98还被耦合到感测电路86的部件(诸如,感测放大器、模数转换器、开关电路系统等)、传感器90、遥测电路88、和存储器82以向各种电路提供电力。
图14中所示出的功能框表示被包括在起搏器10中的功能,并且可以包括实现能够产生归属于本文的双腔心内起搏器10的功能的模拟电路和/或数字电路的任何分立和/或集成电子电路部件。各种部件可以包括专用集成电路(asic)、电子电路、执行一个或多个软件或固件程序的处理器(共享的、专用的、或群组)和存储器、组合逻辑电路、状态机、或提供所描述的功能的其他合适的部件或部件的组合。被采用来实现本文公开的功能的软件、硬件和/或固件的特定形式将主要由起搏器中所采用的特定系统架构以及通过由起搏器所采用的特定检测和治疗递送方法来确定。鉴于本文的公开,在任何现代心脏医疗设备系统的背景下提供软件、硬件和/或固件以用于完成所描述的功能在本领域技术人员的能力范围内。
存储器82可以包括任何易失性、非易失性、磁性、或电的非瞬态计算机可读存储介质,诸如随机存取存储器(ram)、只读存储器(rom)、非易失性ram(nvram)、电可擦除可编程rom(eeprom)、闪存、或任何其他存储器设备。此外,存储器82可包括存储指令的非瞬态计算机可读介质,当被一个或多个处理电路执行时,这些指令使得控制电路80和/或其他电路执行归属于起搏器10的双腔起搏功能或其他感测和治疗递送功能。存储指令的非瞬态计算机可读介质可以包括上文所列出的介质中的任何介质。
控制电路80例如经由数据总线与治疗递送电路84以及感测电路86通信,以用于感测心脏电信号以及响应于感知到的心脏事件(例如,p波和r波、或缺少p波或r波)而控制心脏电刺激治疗的递送。尖端电极42、远侧基于壳体的电极22(或如图4、图5以及图12a-图12c分别示出的52、62或262)以及近侧基于壳体的电极24被电耦合至治疗递送电路84,以用于向患者心脏递送电刺激脉冲,并且被电耦合至感测电路86以用于感测心脏电信号。
感测电路86包括心房(a)感测通道87以及心室(v)感测通道89。远侧基于壳体的电极22以及近侧基于壳体的电极24可被耦合至心房感测通道87以用于感测心房信号,例如,伴随于心房心肌去极化的p波。在包括两个或更多个可选择的远侧基于壳体的电极(例如,图5中的电极62a-c或图12c中的电极262a-d)的示例中,感测电路86可包括开关电路系统,该开关电路系统用于选择性地将可用的远侧基于壳体的电极中的一个或多个耦合至被包括在心房感测通道87中的心脏事件检测电路系统。开关电路系统可以包括开关阵列、开关矩阵、多路复用器或适合用于选择性地将感测电路86的部件耦合到所选择的电极的任何其他类型的开关设备。尖端电极42以及近侧基于壳体的电极24可被耦合至心室感测通道89以用于感测心室信号,例如,伴随于心房心肌去极化的r波。
心房感测通道87以及心室感测通道89中的每一个包括用于分别从由相应感测通道接收的心脏电信号中检测p波和r波的心脏事件检测电路系统。被包括在每一个通道87和89中的心脏事件检测电路系统可被配置成放大、过滤、数字化以及整流从所选择的电极接收到的心脏电信号,以改善用于检测心脏电事件的信号质量。每一个通道87和89内的心脏事件检测电路系统可以包括一个或多个感测放大器、滤波器、整流器、阈值检测器、比较器、模数转换器(adc)、定时器或其他模拟或数字部件。可在控制电路80的控制下例如基于由控制电路80确定的、存储在存储器82中的、和/或由控制电路80和/或感测电路86的硬件、固件和/或软件控制的计时间期和感测阈值由每一个相应的感测通道87和89自动地调整心脏事件感测阈值,例如,p波感测阈值以及r波感测阈值。
在基于感测阈值越过而检测到心脏电事件时,感测电路86可以产生被传送至控制电路80的感知事件信号。例如,心房感测通道87可响应于p波感测阈值越过产生p波感知事件信号。心室感测通道89可响应于r波感测阈值越过而产生r波感知事件信号。感知事件信号由控制电路80使用以用于设置控制用于安排心脏起搏脉冲的基础时间间期的起搏逸搏间期定时器。取决于特定编程的起搏模式,感知事件信号可触发或抑制起搏脉冲。例如,从心房感测通道87接收到的p波感知事件信号可使得控制电路80抑制安排的心室起搏脉冲,并且以编程的房室(av)起搏间期安排心室起搏脉冲。如果在av起搏间期期满之前感知到r波,则抑制心室起搏脉冲。如果av起搏间期在控制电路80从心室起搏通道89接收r波感知事件信号之前期满,则控制电路80控制治疗递送电路84递送与感知到的p波同步的安排的心室起搏脉冲。
在一些示例中,起搏器10可被配置为递送各种起搏治疗,该各种起搏治疗包括心动过缓起搏、心脏再同步治疗、电击后起搏、和/或抗心动过速起搏。例如,起搏器10可被配置成检测非窦性心动过速并且递送atp。控制电路80可确定心脏事件时间间期,例如,从心房感测通道87接收到的连续p波感知事件信号之间的pp间期,从心室感测通道89接收到的连续r波感知事件信号之间的rr间期,以及p波感知事件信号与r波感知事件信号之间接收的p-r和/或r-p间期。可将这些间期与心动过速检测间期相比较以用于检测非窦性心动过速。可在给定心脏腔室中基于被检测到的心动过速检测间期的阈值数量来检测心动过速。
治疗递送电路84包括心房起搏电路83以及心室起搏电路85。每一个起搏电路83和85包括充电电路系统、一个或多个电荷存储设备(诸如一个或多个低电压保持电容器)、输出电容器、以及开关电路系统,该开关电路系统控制(多个)保持电容器何时被充电,以及何时跨输出电容器放电以向被耦合至相应起搏电路83或85的起搏电极向量递送起搏脉冲。尖端电极42以及近侧基于壳体的电极24可作为双极阴极和阳极对被耦合至心室起搏电路85,以用于例如在由控制电路80设置的av或vv起搏间期期满时递送心室起搏脉冲,以用于提供心房同步心室起搏以及基础较低心室起搏频率。
心房起搏电路83可被耦合至远侧基于壳体的电极22以及近侧基于壳体的电极24以用于递送心房起搏脉冲。控制电路80可根据编程的较低起搏频率设置心房起搏间期,或根据频率应答传感器指示的起搏频率而设置的临时较低频率来设置心房起搏间期。如果心房起搏间期在从心房感测通道87接收到p波感知事件信号之前期满,则心房起搏电路被控制以用于递送心房起搏脉冲。响应于递送的心房起搏脉冲,控制电路80开始av起搏间期,以提供同步的双腔起搏。
可由治疗递送电路84根据从控制电路80接收到的控制信号执行心房或心室起搏电路83或85的保持电容器充电至编程的起搏电压幅度以及电容器放电达编程的起搏脉冲宽度。例如,被包括在控制电路80中的起搏计时电路可包括由控制电路80的微处理器设置的可编程数字计数器,以用于控制与各种单腔室或双腔起搏模式或抗心动过速起搏序列相关联的基础起搏时间间期。控制电路80的微处理器还可以设置心脏起搏脉冲的幅度、脉冲宽度、极性或其他特性,这些参数可以基于存储在存储器82中的编程值。
起搏器10可包括用于从患者感测信号的其他传感器90,该信号用于在确定对于由治疗递送电路84递送的电刺激治疗的需要和/或控制由治疗递送电路84递送的电刺激治疗中使用。在一些示例中,指示对于增加的心脏输出的需要的传感器可包括患者活动传感器,诸如加速度计。可由控制电路80确定如由患者活动传感器指示的由于增加的活动引起的患者代谢需求的增加,以用于在确定传感器指示的起搏频率中使用。
由控制电路80用于感测心脏事件和控制起搏治疗递送的控制参数可以经由遥测电路88被编程到存储器82中。遥测电路88包括用于使用射频通信或其他通信协议与外部设备(诸如,编程器或家用监视器)通信的收发器和天线。在控制电路80的控制下,遥测电路88可以从外部设备接收下行链路遥测并向外部设备发送上行链路遥测。在一些情况下,遥测电路88可以用于向植入在患者体内的另一医疗设备传输通信信号以及从该另一医疗设备接收通信信号。
图15是用于使用双腔心内起搏器10的方法的流程图。在框402处,心室起搏器10被安装在递送工具(例如,图9中的递送工具100)的插座中。如图9中所示,固定构件20可在插座内被保持在延伸的位置中。在框404处,递送工具100的远侧开口110被推进至期望的植入部位,例如,图1中示出的目标植入区4。在期望的植入部位处,通过将起搏器10推到递送工具100的远侧开口110之外(例如,通过推进工具104)来部署固定构件。当固定构件在框406处被部署,飞镖电极12被推进进入心脏组织。如上文描述的,固定构件的(多个)远侧尖端以及飞镖电极的远侧尖端可同时地进入心脏组织,飞镖电极尖端可首先进入,固定构件随后进入,或固定构件可首先进入组织,飞镖电极12随后进入。如果飞镖电极12具有比延伸的固定构件更大的高度,则可通过由临床医生沿着起搏器10的纵向轴线施加的并且沿着轴40的中心纵向轴线传送的手动力将飞镖电极12推进进入组织。
当固定构件接合心脏组织时例如,当弹性可变形尖齿以非松弛延伸位置被推进进入组织并且弹性地弯折或弯曲回到通常的弯曲松弛位置时,在框406处的固定构件的部署产生拉力。拉力可贡献于导致飞镖电极的尖端推进进入心脏组织(例如,相邻心脏腔室的心肌,当壳体30被定位在心房腔室中时其可以是心室心肌)的纵向轴向力。如图1中所示,飞镖电极的尖端电极可被推进进入av节和希氏束下方的心室隔。在从插座释放起搏器10之后,在框408处将递送工具从患者中移除。起搏器壳体30完全保持在一个心脏腔室(例如,右心房)内,其中飞镖电极12延伸进入不同的心脏腔室的心肌组织(例如,心室隔)以用于在两个不同的部位处提供起搏和感测,例如,双腔心房同步心室起搏。
图16是具有不止一个飞镖电极的心内起搏器510的概念图。起搏器510包括壳体530,并且可包括至少一个基于壳体的电极524,如本文呈现的其他示例中描述的。远侧固定和电极组件536包括固定构件520,其可包括如上文描述的一个或多个弹性可变形的尖齿。在其他示例中,起搏器510的固定构件可包括如图11所示的沿着外周路径延伸的一个或多个螺旋组织接合部分。
远侧固定和电极组件536可包括多个飞镖电极。在图16的示例中示出了从内部主体570延伸的两个飞镖电极512a和512b。每一个飞镖电极512a和512b包括从内部主体70向远侧延伸的笔直轴540a或540b,笔直轴540a或540b各自具有相应的远侧尖端电极542a和542b。在一些示例中,远侧尖端电极542a和542b被电连结在一起,以用作双阴极极性,其中基于壳体的电极(例如,电极524)充当阳极,以用于起搏和/或感测。在其他示例中,尖端电极542a和542b被各自耦合至分开绝缘的导体,并且可一次选择一个作为单个阴极,或组合选择作为双阴极。在另其他示例中,电极524a或542b中的一个可以是阴极电极,并且电极542a和542b中的另一个可以是阳极,以用于在尖端电极542a和542b被植入的组织深度处提供双极起搏和/或感测。
每一个轴540a和540b可包括电导体,该电导体在管状体内从相应的尖端电极542a和542b延伸至对应的轴接收引脚和/或电馈通导线,该电馈通导线将尖端电极542a或542b电耦合至由壳体530封围的起搏和/或感测电路。如上文描述的,每一个飞镖电极512a和512b具备抗压强度,以在尖端电极542a和542b被推进进入心脏组织时抵抗弯折或屈伸。每一个轴540a和540b可具有侧向柔性,以允许响应于侧向力而随着心脏运动一起弯曲。虽然轴540a和540b被示出具有相同的长度,但是所设想的是,当两个或更多个飞镖电极从远侧固定和电极组件536延伸时,轴540a和540b的长度和/或直径和/或对应的尖端电极542和542b的大小和形状可以是相同或不同的。
起搏器510可以是双腔心内起搏器,其具有充当阴极和阳极对的尖端电极542a和542b,以用于在心室组织中感测和/或起搏,以及与近侧基于壳体的阳极524配对的远侧基于壳体的阴极552,以用于在心房腔室中起搏和感测。在该示例中,基于壳体的阴极552可包括由远侧固定和电极组件536携载的一个或多个纽扣电极或环形电极,如上文大体地描述的。
图17是根据另一示例的具有不止一个远侧飞镖电极612a和612b的心内起搏器610的概念图。在该示例中,两个飞镖电极612a和612b从分隔件644延伸,该分隔件644侧向地延伸,例如,大约与起搏器610的纵向轴线正交。分隔件644可提供尖端电极642a与642b之间的分隔距离,该分隔距离大于飞镖电极512a与512b之间的分隔距离,飞镖电极512a和512b从远侧固定和电极组件536的内部主体笔直延伸出去。当飞镖电极512a和512b各自从由组件536的内部主体570限定的开口笔直延伸出去时,由飞镖电极512a和512b携载的尖端电极542a和542b的分隔距离可由远侧固定和电极组件536的整体直径限制。分隔件644可从中心基部646向外延伸,该中心基部646将分隔件644(以及延伸穿过分隔件644延伸的相关联的电导体)耦合至壳体630。
轴640a和640b可各自是由距离650(对应于分隔件644的长度)分隔的笔直线性轴,该距离650可等于或大于内部主体670的直径,或甚至等于或大于起搏器壳体630的直径。在该示例中,轴640b被示出具有比轴640a具有更短的长度,尽管在其他示例中两个轴可能具有相同的长度。起搏器610可以是双腔心内起搏器,其具有充当阴极和阴极对的电极642a和642b,以用于在心室组织中感测和/或起搏,以及与近侧基于壳体的阳极624配对的远侧基于壳体的阴极652,该远侧基于壳体的阴极652被示出为围绕远侧固定和电极组件636的环形电极,以用于当固定构件620将壳体630锚定在心房腔室中时在心房腔室中进行起搏和感测。由此,在各种实施例中,心内起搏器可包括从起搏器的远侧端延伸的一个或多个飞镖电极,以提供被定位在心脏组织内的起搏或感测部位处的一个或多个尖端电极,例如,在与起搏器壳体被植入其中的心脏腔室相邻的心脏腔室的心肌中。
图18是根据又另一示例的被配置为用于双腔心脏起搏的无引线心内起搏器710的三维透视图。起搏器710包括壳体730,该壳体730具有外部侧壁735,被示出为圆柱形外部侧壁,其从壳体远侧端732延伸至壳体近侧端734。壳体760封围电子电路系统,该电子电路系统被配置成执行心房和心室心脏电信号感测以及用于根据需要向心房和心室腔室递送双腔起搏,例如,如上文结合图14所描述的。递送工具接口构件726被示出在壳体近侧端734上。
远侧固定和电极组件736被耦合至壳体远侧端732。远侧固定和电极组件736可包括被耦合至壳体远侧端732的电绝缘远侧构件772。延伸远离壳体远侧端732的组织穿刺电极712以及多个非组织穿刺电极722被直接耦合至绝缘远侧构件772。组织穿刺电极712以纵向方向延伸远离壳体远侧端732并且可与壳体730的纵向中心轴线731共轴。
组织穿刺远侧电极712包括电绝缘轴740和尖端电极742。在一些示例中,组织穿刺远侧电极712是主动固定构件,其包括螺旋轴740和远侧阴极尖端电极742。螺旋轴740从轴远侧端743延伸至轴近侧端741,该轴近侧端741被直接耦合至绝缘远侧构件772。螺旋轴740可被涂覆有电绝缘材料(例如,聚对二甲苯或本文列出的其他示例)以避免沿着轴长度的心脏组织感测或刺激。尖端电极742在轴远侧端743处,并且可充当阴极电极,以用于当尖端电极742被推进进入心室组织时使用作为返回阳极的近侧基于壳体的电极724来递送心室起搏脉冲以及感测心室电信号。近侧基于壳体的电极724可以是围绕壳体730的环形电极,并且可由纵向侧壁724的非绝缘部分限定。壳体730的不充当电极的其他部分可被涂覆有电绝缘材料,如上文结合图2所描述的。
多个非组织穿刺电极722沿着绝缘远侧构件772的外周被提供,位于组织穿刺电极712外周。绝缘远侧构件772限定起搏器710的面向远侧的表面738以及周向表面739,该周向表面739围绕起搏器710并且与壳体纵向侧壁735相邻。非组织穿刺电极722可由导电材料形成,诸如钛、铂、铱或其合金。在图18中,六个非组织穿刺电极722沿着绝缘远侧构件772的外周以相等的距离径向地分隔开,然而,可提供两个或更多个非组织穿刺电极722。
非组织穿刺电极722可以是分立部件,每一个被保持在绝缘构件772中的相应凹槽774内,该相应凹槽774的大小和形状被设计为与非组织穿刺电极722配对。在其他示例中,非组织穿刺电极722可各自是安装在绝缘远侧构件内或安装在绝缘远侧构件上的一体构件的非绝缘暴露部分。不用做电极的一体构件的中间部分可由绝缘远侧构件772绝缘,或如果暴露于周围环境,则用电绝缘涂层(例如,聚对二甲苯、聚氨酯、硅酮、环氧树脂或其他绝缘涂层)涂覆。
当组织穿刺电极712被推进进入心脏组织时,非组织穿刺电极722中的至少一个被定位成抵靠心脏组织表面、被定位成与心脏组织表面紧密接触或被定位成可操作地邻近心脏组织表面,以用于递送起搏脉冲和/或感测由患者心脏产生的心脏电信号。例如,非组织穿刺电极722可被定位成与右心房心内膜组织接触,以用于当组织穿刺电极712被推进进入心房组织并且穿过中心纤维体直至尖端电极742被定位成与心室组织(例如,心室心肌和/或心室传导系统的一部分)直接接触时在心房中进行起搏以及感测。
非组织穿刺电极722可被耦合至由壳体730封围的治疗递送电路84以及感测电路86,以共同用作阴极电极,其与作为返回阳极的近侧基于壳体的电极724组合,以用于递送心房起搏脉冲以及用于感测心房电信号,例如,p波。被包括在感测电路86中的开关电路系统可在控制电路80的控制下被激活,以将非组织穿刺电极中的一个或多个耦合至心房感测通道87。远侧非组织穿刺电极722可以彼此电隔离,使得电极722中的每一单个可由被包括在治疗递送电路84中的开关电路系统单独地选择,以独自充当或以电极722中的两个或更多个的组合充当心房阴极电极。被包括在治疗递送电路84中的开关电路系统可在控制电路80的控制下被激活,以将非组织穿刺电极722中的一个或多个耦合至心房起搏电路83。可一次选择非组织穿刺电极722中的两个或更多个以操作作为多点心房阴极电极。
被选择用于心房起搏和/或心房感测的非组织穿刺电极722中的特定一个可基于心房夺获阈值检测、电极阻抗、心脏电信号中的p波信号强度或其他因素被选择。例如,可以选择充当提供低起搏夺获阈值幅度和相对高的电极阻抗的最佳组合的阴极电极的两个或更多个单个非组织穿刺电极722中的一个或任何组合,以使用来自电源98的最小电流消耗来实现可靠的心房起搏。
在一些实例中,当组织穿刺电极712将壳体730锚定在植入部位处时,面向远侧的表面738可均匀地接触心房心内膜表面。在该情况下,电极722中的所有可被一同选择以用于形成心房阴极。替代地,电极722中的每隔一个可被一同选择以用于形成多点心房阴极,该多点心房阴极具有仍沿着面向远侧的表面738均匀地分布的较高的电阻抗。替代地,沿着绝缘远侧构件772的一侧的一个或多个电极722的子集可被选择以在期望的部位处提供起搏,其由于电极722对于被起搏的心房组织的相对位置而实现最低起搏夺获阈值。
在其他实例中,取决于组织穿刺电极712进入心脏组织的定位和取向,面向远侧的表面738可以以相对于相邻心内膜表面的角度取向。在该情况下,非组织穿刺电极722中的一个或多个可被定位成比其他非组织穿刺电极722与相邻心内膜组织更紧密地接触,该其他非组织穿刺电极722可与心内膜表面成角度。通过沿绝缘远侧构件772的外周提供多个非组织穿刺电极,组织穿刺电极712和壳体远侧端732相对于心脏表面(例如,右心室心内膜表面)的角度不需要是基本平行的。解剖和位置差异可导致面向远侧的表面738与心内膜表面成角度或倾斜,然而,沿着绝缘远侧构件772的外周分布的多个非组织穿刺电极722增加了一个或多个电极722与相邻心脏组织之间的良好接触的可能性,以促进使用多个电极722的至少子集的可接受的起搏阈值和可靠的心脏事件感测。不需要沿着绝缘整体构件772的整个外周的周向接触或固定。
非组织穿刺电极722被示出为各自包括沿着面向远侧的表面738延伸的第一部分722a以及沿着周向表面739延伸的第二部分722b。第一部分722a和第二部分722b可以是连续的暴露表面,使得主动电极表面缠绕在绝缘远侧构件772的外周边缘776周围,该外周边缘776与面向远侧的表面738以及周向表面739接合。非组织穿刺电极722可包括沿着面向远侧的表面738的电极772中的一个或多个、一个或多个沿着周向表面739的电极、各自沿着面向远侧的表面738和周向表面739二者延伸的一个或多个电极、或其任何组合。非组织穿刺电极722中的每一个的暴露表面可与相应的面向远侧的表面738和/或周向表面齐平。在其他示例中,非组织穿刺电极722中的每一个可具有从绝缘远侧构件772突出的升高的表面。无论是平滑或是圆形的,电极722的任何升高表面是非组织穿刺表面。
由于远侧固定和电极组件736密封壳体730的远侧端,并且提供电极722被安装其上的基础,因此电极722可被称为基于壳体的电极。这些电极722不由轴或将主动电极部分延伸远离壳体730的其他延伸件携载,类似驻留在螺旋轴740的远侧尖端处并且延伸远离壳体730的远侧尖端电极742。本文呈现的被耦合至绝缘远侧构件的面向远侧的表面和/或周向表面的非组织穿刺电极的其他示例包括远侧基于壳体的环形电极22(图3)、围绕组件36周向地延伸的远侧基于壳体的环形电极52(图4)、纽扣电极62a-c(图5)、纽扣电极262(图12c)、基于壳体的电极552(图16)、以及周向环形电极652(图17)。直接被耦合至远侧绝缘构件、位于中心组织穿刺电极外周的这些非组织穿刺电极中的任一个可被提供以单独地运作、一同地运作、或以任何组合运作作为阴极电极,以用于向相邻心脏组织递送起搏脉冲。当环形电极,诸如远侧环形电极22和/或周向环形电极52被提供时,环形电极的多个部分可由涂层电绝缘以沿着绝缘远侧构件的面向远侧的表面和/或周向表面提供多个分布式的非组织穿刺电极。
与沿着远侧固定和电极组件736提供的组织穿刺电极相比较,非组织穿刺电极722和上文列出的其他示例被预期提供更为可靠并且有效的心房起搏和感测。与心室腔室壁相比较,心房腔室壁相对较薄。组织穿刺心房阴极电极可在心房组织内延伸得过深,从而导致心室组织的意外持续或间歇夺获。由于在经由物理上更为接近心室组织的组织穿刺心房阴极电极所接收的心脏电信号中心室信号具有更大的信号强度,因此组织穿刺心房阴极电极可能导致与感测心房信号的干扰。组织穿刺电极712可被安全地锚定至心室组织中,稳定起搏器710的植入位置并且提供对如下的合理的确定性:尖端电极742正在心室组织中感测以及起搏,同时非组织穿刺电极722在心房中可靠地起搏以及感测。当起搏器710被植入在目标植入区4中时,例如,如图1中所示,尖端电极742可抵达左心室组织以用于对左心室的起搏,而非组织穿刺电极722在右心房中提供起搏和感测。组织穿刺电极712从面向远侧的表面738的长度可在4mm到8mm的范围中,以抵达左心室组织。在一些实例中,起搏器710可通过以下来实现四腔室起搏:经由非组织穿刺电极722在目标植入区4中递送来自心房起搏电路83的心房起搏脉冲以实现双心房(右心房和左心房)夺获,以及经由从目标植入区4被推进进入心室组织的尖端电极742递送来自心室起搏电路85的心室起搏脉冲以实现双心室(右心室和左心室)夺获。
图19是包括电极722被沿着其被安装的连续环728的一体构件720的俯视示意图。一体构件720可以是由导电金属形成的加工部件。在其他示例中,一体构件720可以是多个零件的组件,其中电极722例如通过焊接或粘合耦合被机械地耦合至环728。环728可限定孔729,一个或多个导电馈通导线可延伸穿过该孔729以用于将一体构件(并且由此电极722中的所有)耦合至起搏器710内的电路系统。孔729被示出为细长孔,以用于允许当导电馈通导线延伸穿过孔729时,一体构件720和绝缘远侧构件772可旋转地耦合至壳体730。
图20是起搏器710的远侧固定和电极组件736的三维爆炸图。绝缘远侧构件772可被包覆模制到一体构件720上,使得非组织穿刺电极722被暴露在每一个凹槽774处。绝缘远侧构件772可包括径向延伸的突片780,用于与壳体730的远侧端盖782的保持突片784互锁。径向延伸的突片780可与远侧端盖782的沟槽786对齐,以抵靠远侧端盖782放置绝缘远侧构件772。绝缘远侧构件772可被旋转,使得径向延伸的突片780被捕获在远侧端盖782的保持突片784下方。
中心馈通导线790延伸穿过远侧端盖782以及绝缘远侧构件772以例如经由导电耦合器794被电耦合至组织穿刺电极712。组织穿刺电极712可被安装在耦合器794上,使得柄740经由耦合器794被电耦合至馈通导线790。一个或多个外周馈通导线792延伸穿过远侧端盖782和孔729(图19),以用于到非组织穿刺电极722的电连接。单个外周馈通导线792可被电耦合至一体构件(例如,图19的构件720),该一体构件携载电极722中的所有并且被电耦合至电极722。在包括可单独选择的电极的示例中,延伸穿过单个孔或多个孔的多个外周馈通导线可被电耦合至相应的电极722。在远侧固定和电极组件736被组装至远侧端盖782之上并且已经完成了必要的电连接之后,可应用医疗粘合剂来气密地密封并且保护电连接。图20的示例表示用于将中心组织穿刺电极外周的多个非组织穿刺电极组装在起搏器壳体730的远侧端处的一个方法。所认识到的是,其他组装方法可被用于沿着面向远侧的表面738和/或周向表面739提供多个非组织穿刺电极。
图21是经由开关电路系统750和752被耦合至多个电极722的感测电路86的心房感测通道87和治疗递送电路84(图14中示出)的心房起搏电路83的概念图。感测电路86可包括多个开关750a-n,统称为750,其可以由感测电路86响应于从控制电路80接收到的控制信号而控制。感测电路86在适当的时间处打开以及关闭开关750a-n,以用于将相应的电极722a-n一次一个或多个地电耦合至心房感测通道87。一次可将一个、两个、三个或更多个、至多所有n个电极722a-n可切换地耦合至心房感测通道87,以用作单个或多点阴极电极,以用于与基于壳体的阳极电极724组合地感测心房信号。
治疗递送电路84包括多个开关752a-n,统称为开关752,以用于选择性地将电极722a-n以任何期望的组合耦合至心房起搏电路83。可经由开关752a-n将一个、两个、三个或更多个、至多所有n个电极722a-n电耦合至心房起搏电路83,以用作单个或多点阴极电极,以用于递送心房起搏脉冲。控制电路80可被配置成控制治疗递送电路84以选择两个或更多个电极722a-n中的一个或组合以充当心房起搏阴极。
电极722a-n可包括组织穿刺电极712外周的六个非组织穿刺电极,如图18中所示,但是在其他示例中可包括少于六个电极或多于六个电极。在本文呈现的包括沿着远侧固定和电极组件的面向远侧的表面和/或周向表面的多个非组织穿刺电极的示例中的任一个中,非组织穿刺电极中的每一个彼此电隔离并且被耦合至电隔离的导体,该电隔离的导体经由相应的开关750a-n和752a-n将每一个非组织穿刺电极耦合至心房感测通道87和/或心房起搏电路83。
图22是根据另一示例的起搏器810的三维图。起搏器810包括壳体830,壳体830具有从壳体近侧端834延伸至壳体远侧端832的圆柱纵向侧壁835。递送工具接口构件826可从壳体近侧端834延伸,如本文先前描述的。远侧固定和电极组件836被直接耦合至壳体远侧端832。
远侧固定和电极组件836包括绝缘构件872,该绝缘构件872具有面向远侧的表面838、组织穿刺远侧电极812、以及非组织穿刺远侧电极822。组织穿刺远侧电极812以纵向方向延伸远离壳体远侧端832并且可与壳体831的纵向中心轴线830共轴。组织穿刺远侧电极812包括电绝缘轴840和尖端电极842。在该示例中,组织穿刺远侧电极812是主动固定构件,其包括螺旋轴840和远侧尖端电极842,该远侧尖端电极842可用作阴极电极,以用于在与起搏器810被植入其中的腔室相邻的心脏腔室中进行起搏和感测。例如,当尖端电极842被推进进入心室组织,并且壳体830被植入在右心房中时,尖端电极842可充当阴极电极,以用于使用近侧基于壳体的电极824作为返回阳极来递送心室起搏脉冲并且感测心室电信号。
组织穿刺远侧电极812位于面向远侧的表面838上的非组织穿刺电极822外周。非组织穿刺电极822可以是例如纽扣电极或半球形电极,其从面向远侧的表面838的中心部分突出,并且由组织穿刺远侧电极812的螺旋轴840围绕或包围,但是与该螺旋轴840分隔开并且电隔离。在一些示例中,非组织穿刺电极822包括涂层或是类固醇洗脱电极。例如,非组织穿刺电极822可以是环形电极,其限定了中心开口,或可包括凹槽或凹部以用于保持mcrd,该mcrd包括聚合物基质(例如,硅酮或聚氨酯基)以及在聚合物基质中合成的类固醇(例如,地塞米松磷酸钠),以用于随着时间洗脱以减少植入部位处的异物反应。在一些示例中,非组织穿刺远侧电极822和螺旋轴840二者可沿着壳体830的纵向中心轴线为中心,其中螺旋轴840围绕非组织穿刺远侧电极822缠绕并且以非组织穿刺远侧电极822为中心。
当组织穿刺远侧电极812从右心房被完全推进与心室心肌或传导组织直接接触时,非组织穿刺远侧电极822被锚定抵靠心房组织或可操作地邻近心房组织。通过组织穿刺远侧电极812实现的壳体830在心房腔室中的主动固定维持尖端电极842的位置,以用于心室感测和起搏,并且维持非组织穿刺远侧电极822的位置,以用于心房起搏和感测,以此来提供双腔起搏。非组织穿刺远侧电极822可用作心房阴极电极,以用于与充当阳极的近侧基于壳体的电极824组合地起搏右心房以及感测心房信号。
因此,已参考特定实施例在前述说明书中呈现了起搏器。将理解的是,本文所公开的各种方面可以以与附图中呈现的特定组合不同的组合来组合。应当理解的是,可以在不脱离本公开和所附权利要求书的范围的情况下对参考实施例做出各种修改。
- 还没有人留言评论。精彩留言会获得点赞!