氟维司群制剂及其使用方法与流程
相关申请的交叉引用本申请要求2017年11月8日提交的美国临时申请第62/583,403号的权益,其通过引用全文结合于此。本公开涉及含氟维司群的制剂及其在治疗疾病中的使用方法。
背景技术:
:氟维司群或7-(9-(4,4,5,5,5-五氟戊基亚磺酰基)壬基)雌-1,3,5(10)-三烯-3,17-二醇,具有式(1)结构:氟维司群是一种选择性雌激素受体降解剂(serd),可用于治疗在抗雌激素疗法后疾病进展的绝经后女性的激素受体阳性转移性乳腺癌。与其他类固醇类化合物一样,氟维司群的物理性质使制备水性悬浮液变得困难。即使与其他甾族化合物相比,氟维司群仍是特别亲脂的分子,其水溶性极低。由于氟维司群的溶解性和口服生物利用度差,目前所述药物是通过肌内注射油基氟维司群制剂来施用。当前市售的氟维司群制剂的剂量为500mg,并且需要肌内施用两次5ml的50mg/ml氟维司群制剂注射。每次5ml注射含有10%w/v乙醇、10%w/v苯甲醇和15%w/v苯甲酸苯甲酯作为助溶剂,并以蓖麻油作为另外的助溶剂和释放速率调节剂补足到100%w/v。由于用于溶解氟维司群的粘性油基媒剂,所述制剂的施用缓慢(每次注射1-2分钟)且痛苦。标签上已增加了有关注射疼痛、坐骨神经痛、神经性疼痛和周围神经病变的警告。先前已经报道(阿斯利康(astrazeneca)的us6,774,122),肌内注射水性悬浮液形式的氟维司群不适合使用。这些悬浮液导致注射部位有广泛的局部组织刺激,并且由于存在固体粒子形式的氟维司群而导致不良的释放特征。此外,据报道氟维司群的释放速率不是临床上显著的。需要给药特性改良的氟维司群制剂。本公开针对这些和其他重要需求。技术实现要素:本公开提供了水性悬浮液,包含溶解的氟维司群,不溶解的氟维司群粒子,所述不溶解的氟维司群粒子具有约1.5至约2.1微米的lddv(10)、约5.5至约9.0微米的lddv(50)和约15至约35微米的lddv(90)中的一种或多种,所述水性悬浮液进一步包含表面活性剂、聚乙烯吡咯烷酮和糖醇,以及水溶性赋形剂。所述水溶性赋形剂可以是芳基-c1-6烷基-oh、c1-6烷基-oh、缓冲盐、聚山梨酸酯、聚亚烷基二醇、c1-12亚基烷二醇、磷脂酰胆碱或其组合。本公开提供了治疗受试者的乳腺癌的方法,包括向所述受试者施用本公开的水性悬浮液。所述乳腺癌可以是激素受体(hr)阳性乳腺癌。还描述了制备和使用本文所述产品的方法。附图说明当结合附图阅读时,将进一步理解本
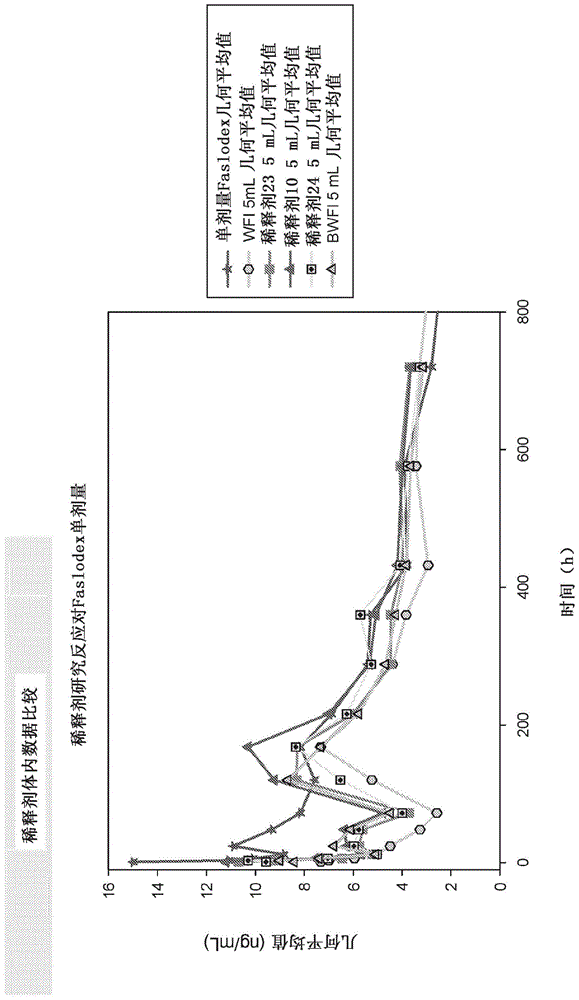
发明内容以及以下详细描述。为了说明本公开,在附图中示出了本公开的示例性实施方案;然而,本公开不限于所公开的特定方法、组合物和装置。在图中:图1描绘了向大鼠施用市售氟维司群制剂和本发明的一些示例性水性悬浮液的药代动力学数据。图2描绘了向人施用市售氟维司群制剂和本发明的示例性水性悬浮液的药代动力学数据。图3描绘了向人施用市售氟维司群制剂和本发明的示例性水性悬浮液的药代动力学数据。图4描绘了向人施用市售氟维司群制剂和本发明的示例性水性悬浮液的药代动力学数据。图5描绘了向人施用市售氟维司群制剂和本发明的示例性水性悬浮液的药代动力学数据。图6描绘了用于向人施用市售氟维司群制剂和本发明的示例性水性悬浮液的药代动力学数据。图7描绘了向人施用市售氟维司群制剂和本发明的示例性水性悬浮液的药代动力学数据。因此,附图中的所有标注和注释都被结合到本说明书中,就如同在这里完全阐述了一样。具体实施方式通过参考以下结合附图和实施例的详细描述,可以更容易地理解本公开,附图和实施例构成了本公开的一部分。应理解,本公开不限于本文描述和/或示出的特定装置、方法、应用、条件或参数,并且本文所用的术语只是出于通过举例来描述特定实施方案的目的,并不旨在限制要求保护的公开。如说明书(包括权利要求)中所使用,单数形式“一个”、“一种”和“所述”包括复数,并且除非上下文另有明确指示,否则提到特定数值至少包括所述特定值。当表达值的范围时,另一个实施方案包括从一个特定值和/或至另一特定值。所有范围都是包含性的并可组合的。此外,提到用范围陈述的值包括所述范围内的每个值。当通过使用先行词“约”将值表示为近似值时,应理解特定值形成另一个实施方案。如本文所用,术语“约”在涉及诸如量、时间持续时间等的可测量值时,意在涵盖所述值的合理变化,例如相对于指定值的±10%。例如,短语“约50%”可以包括50的±10%,或45%至55%。应理解,为清楚起见,本文在单独的实施方案的上下文中描述的本公开的某些特征也可以在单个实施方案中组合提供。相反,为简洁起见,在单个实施方案的上下文中描述的本公开的各种特征也可以单独地或以任意子组合来提供。术语如本文所用,无论是单独使用还是与另一个或多个术语结合使用,都应理解,短语特定疾病的“治疗方法”可以与短语“用于治疗”特定疾病互换使用。如本文所用,无论是单独使用还是与另一个或多个术语结合使用,“药学上可接受的”表示所指定的实体,例如药学上可接受的赋形剂,通常与制剂中的其他成分在化学和/或物理上相容,和/或通常与其接受者在生理上相容。如本文所用,无论是单独使用还是与另一个或多个术语结合使用,“受试者”、“个体”和“患者”是指哺乳动物,包括人。术语人是指并包括人类儿童、青少年或成人。如本文所用,无论是单独使用还是与另一个或多个术语结合使用,“治疗”是指并包括改善性、姑息性和/或治愈性使用和结果,或其任意组合。在其他实施方案中,本文所述的方法可以预防性使用。应当理解,“预防”或预防性使用或结果不是指也不要求绝对或全面预防(即100%的预防性或保护性使用或结果)。如本文所用,预防或预防性使用或结果是指以下使用和结果:施用化合物或制剂减少或减轻本文所述的特定病状、症状、病症或疾病的严重性;减少或减轻经历本文所述的特定病状、症状、病症或疾病的可能性;或延迟本文所述的特定病状、症状、病症或疾病的发作或复发(再出现);或上述的任意组合。如本文所用,无论是单独使用还是与另一个或多个术语结合使用,“治疗”和“治疗有效量”是指化合物或制剂达成以下效果的量:(a)治疗本文所述的特定病状、症状、病症或疾病;(b)减轻、改善或消除本文所述的特定病状、病症或疾病的一种或多种症状;(c)延迟本文所述的特定病状、症状、病症或疾病的发作或复发(再出现)。应理解,术语“治疗”和“治疗有效”涵盖上述效果(a)-(c)中的任一种,单独或与其他(a)-(c)中的任一种组合。如本文所用,无论是单独使用还是与另一个或多个术语结合使用,“治疗剂”是指制剂中包含的可用于治疗疾病、病状或病症或合并症(即与乳腺癌同时存在的疾病、病状或病症)且并非氟维司群的任何物质。如本文所用,无论是单独使用还是与另一个或多个术语结合使用,“悬浮液”是指分散在液体媒剂中的固体粒子。如本文所用,无论是单独使用还是与另一个或多个术语结合使用,“水性悬浮液”是指其中液体媒剂包含至少约50%w/w水的悬浮液。如本文所用,无论是单独使用还是与另一个或多个术语结合使用,“媒剂”是悬浮介质,优选是药学上可接受的悬浮介质。如本文所用,无论是单独使用还是与另一个或多个术语结合使用,“剂量”是指水性悬浮液中氟维司群的量。如本文所用,无论是单独使用还是与另一个或多个术语结合使用,“芳基”在单独使用或作为取代基的一部分使用时,是指在环中具有6至10个碳原子的单环或双环芳烃环结构。优选的芳基部分包括苯基和萘基。如本文所用,无论是单独使用还是与另一个或多个术语结合使用,“c1-c6烷基”在单独使用或作为取代基的一部分使用时,是指具有1、2、3、4、5或6个碳原子的脂族连接基并且包括例如-ch2-、-ch(ch3)-、-ch(ch3)-ch2-和-c(ch3)2-。术语“-c0烷基-”是指键。如本文所用,无论是单独使用还是与另一个或多个术语结合使用,“烷基”在单独使用或作为取代基的一部分时,是指具有1至12个碳原子的直链或分支链烃基(“c1-c12”),优选具有1至6个碳原子的直链或分支链烃基(“c1-c6”)。烷基的实例包括甲基(me,c1烷基)、乙基(et,c2烷基)、正丙基(c3烷基)、异丙基(c3烷基)、丁基(c4烷基)、异丁基(c4烷基)、仲丁基(c4烷基)、叔丁基(c4烷基)、戊基(c5烷基)、异戊基(c5烷基)、叔戊基(c5烷基)、己基(c6烷基)、异己基(c6烷基)等。当本文中使用一定范围的碳原子时,例如c1-c6,涵盖所有范围以及单独数字的碳原子。例如,“c1-c3”包括c1-c3、c1-c2、c2-c3、c1、c2和c3。如本文所用,“dv(10)”、“dv(50)”和“dv(90)”定义为体积加权的粒径,其中在测量时,相应累积的10%、50%或90%v/v的粒子具有相等或较小直径。例如,如果粒子群的dv(50)为约25微米,那么50%体积的粒子的直径小于或等于约25微米。如本文所用,dn(10)”、“dn(50)”和“dn(90)”定义为数量加权的粒径,其中在测量时,相应累积的10%、50%或90%的粒子具有相等或较小直径。例如,如果粒子群的dn(50)为约25微米,那么50%数量的粒子的直径小于或等于约25微米。粒度和粒度分布可以通过激光衍射测量来确定。通过激光衍射法进行的粒度分析在本领域中是已知的,并且通过国际标准化组织的iso13320:2009(e)“粒度分析-激光衍射法”进行更全面说明,所述文献出于所有目的通过引用全文结合于此。通过激光衍射确定的粒度表示为体积与通过米氏(mie)光散射理论确定的粒子体积相等的的球体的直径。通过激光衍射的测量可以“原样”或“超声处理”获得。通过激光衍射“原样”测量的值在表中如此表示,或者在本文中称为“激光衍射dv(##)”、“lddv(##)”、“激光衍射直径”或“ld直径”。“超声处理”样品的数据表明,测量样品在临分析之前进行了超声处理以分散聚结物,如iso13320:2009(e)中更全面描述。对于经过超声处理的样品,通过激光衍射测量的值在本文中称为“超声处理的激光衍射dv(##)”、超声处理的“lddv(##)”、“超声处理的激光衍射直径”或“超声处理的ld直径”。表3-6提供了本发明的一些示例性实施方案的激光衍射粒度和粒度分布(“psd”)数据。粒度和粒度分布也可以通过显微镜图像捕获和分析来确定。显微镜图像捕获和分析捕获3d粒子的二维(2d)图像,并从2d图像计算各种尺寸和形状参数。通过显微镜图像捕获和分析确定的粒度表示为面积与粒子的2d图像相等的圆的直径,在本文中称为圆当量或“ce”直径。通过显微镜图像捕获和分析进行粒度分析是本领域已知的,并由国际标准化组织的iso13322-1:2014“粒度分析-图像分析方法-第1部分:静态图像分析方法”进行更全面说明,所述文献出于所有目的通过引用全文结合于此。通过显微镜图像捕获和分析测量的值在本文中称为“圆当量直径”、“ce直径”,“圆当量dv(##)”、“cedv(##)”或“cedn(##)”。表6提供了本发明的一些示例性实施方案的显微镜图像捕获和分析粒度和粒度分布数据。水性悬浮液在特定的实施方案中,本公开涉及包含溶解的氟维司群和不溶解的氟维司群粒子的水性悬浮液。如本文中其他地方更全面描述,不溶解的氟维司群粒子可以具有不同的粒度分布。在一些实施方案中,本公开的水性悬浮液中来自溶解的氟维司群和不溶解的氟维司群的氟维司群总浓度可以是约80mg/ml至约170mg/ml,包括其间的所有范围和子范围。在其他实施方案中,氟维司群总浓度为约75mg/ml至约125mg/ml。在特定实施方案中,氟维司群总浓度为约75mg/ml、约80mg/ml、约85mg/ml、约90mg/ml、约95mg/ml、约100mg/ml、约105mg/ml、约110mg/ml、约115mg/ml、约120mg/ml、约125mg/ml、约130mg/ml、约135mg/ml、约140mg/ml、约145mg/ml、约150mg/ml、约155mg/ml、约160mg/ml、约165mg/ml或约170mg/ml。在其他实施方案中,氟维司群总浓度为约100mg/ml。本公开的水性悬浮液包含溶解的氟维司群,即以非粒子形式存在并且可以溶解在悬浮液的水性介质中的氟维司群。在本发明的一些实施方案中,水性悬浮液可以具有约0.01mg/ml至约0.10mg/ml、约0.05mg/ml至约0.10mg/ml、约0.05mg/ml至约0.08mg/ml或约0.06mg/ml的溶解的氟维司群。例如,水性悬浮液可以具有0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09或0.1mg/ml的溶解的氟维司群。在本发明的某些实施方案中,包含溶解的氟维司群和不溶解的氟维司群粒子的水性悬浮液还包含表面活性剂、聚乙烯吡咯烷酮、糖醇和水溶性赋形剂。在本发明的一些实施方案中,表面活性剂可以是但不限于聚环氧乙烷(peo)、peo衍生物、聚山梨酸酯80、聚山梨酸酯20、泊洛沙姆188(包括但不限于由巴斯夫公司(美国密歇根州怀恩多特)出售的泊洛沙姆)、泊洛沙姆124(包括但不限于巴斯夫公司(美国密歇根州怀恩多特)出售的泊洛沙姆))、泊洛沙姆407(包括但不限于巴斯夫公司(美国密西根州怀恩多特)出售的泊洛沙姆)、聚乙氧基化植物油、聚乙氧基化蓖麻油(包括但不限于巴斯夫公司(美国密西根州怀恩多特)出售的以前称为)、脱水山梨糖醇棕榈酸酯(包括但不限于禾大国际(crodainternationalplc)出售的spantm40)、卵磷脂、聚乙烯醇(“pva”)、人血清白蛋白及其混合物。在本发明的一些实施方案中,聚乙烯吡咯烷酮可以是但不限于聚维酮k12、聚维酮k17、plasdonetmc-12聚维酮(美国肯塔基州卡温顿的亚什兰公司)、plasdonetmc-17聚维酮(美国肯塔基州卡温顿的亚什兰公司)、plasdonetmc-30聚维酮(美国肯塔基州卡温顿的亚什兰公司)及其混合物。在本发明的某些实施方案中,聚乙烯吡咯烷酮是plasdonetmc-12聚维酮,其k值为10.2-13.8,标称分子量为4,000道尔顿。在本发明的一些实施方案中,糖醇可以是但不限于葡萄糖、甘油、甘露醇、赤藓糖醇、苏糖醇、阿拉伯糖醇、木糖醇、核糖醇、山梨糖醇、半乳糖醇、果糖醇、艾杜醇、肌醇、伏美糖醇、异麦芽糖醇、麦芽糖醇、乳糖醇、麦芽三糖醇、麦芽四糖醇、聚糖醇及其混合物。在本发明的其他实施方案中,糖醇为甘露醇、木糖醇、麦芽糖醇、乳糖醇、麦芽三糖醇、山梨糖醇、甘油或其混合物。在本发明的其他实施方案中,糖醇是甘露醇。根据本公开,水性悬浮液包含水溶性赋形剂,其可以是芳基-c1-6烷基-oh、c1-6烷基-oh、缓冲盐、聚山梨酸酯、聚亚烷基二醇、c1-12亚基烷二醇、磷脂酰胆碱或其组合。在本发明的某些实施方案中,本公开的水性悬浮液包含约0.1%至约5%(w/w)、约0.5%至约5%(w/w)、约0.5%至约2.5%(w/w)、约0.9%至约1.5%(w/w)、约4%(w/w)或约1%(w/w)的芳基-c1-6烷基-oh。例如,水性悬浮液可以包含0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9或5%(w/w)的芳基-c1-6烷基-oh。芳基-c1-6烷基-oh优选为苯基-c1-6烷基-oh,例如苯基-c1-2-oh。在其他实施方案中,芳基-c1-6烷基-oh是苯甲醇(苯基-ch2-oh)。在本发明的某些实施方案中,水性悬浮液包含约1%至约10%(w/w)、约5%至约10%(w/w)、约2%至约4%(w/w)、约2%(w/w)、约4%(w/w)、约5%(w/w)或约8%(w/w)的c1-6烷基-oh。例如,水性悬浮液可以包含约1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5或10%(w/w)的c1-6烷基-oh。优选的c1-6烷基-oh包括甲醇、乙醇、丙醇、异丙醇、丁醇、仲丁醇、叔丁醇及其组合。在其他实施方案中,c1-6烷基-oh是乙醇。在本发明的某些实施方案中,本公开的水性悬浮液包含一种或多种缓冲盐,其可以是当添加到水性悬浮液中时使得水性悬浮液抗ph变化或引起ph变化的试剂。根据本公开,ph是使用常规仪器在环境温度,例如20℃至25℃,优选23℃下提及。缓冲盐可以是例如磷酸钠盐(例如,nah2po4·h2o、nah2po4·2h2o、无水nah2po4),磷酸钾盐(例如,磷酸氢二钾(k2hpo4)、磷酸二氢钾(kh2po4)),柠檬酸或其盐(例如柠檬酸钠),三羟甲氨甲烷(三(羟甲基)氨基甲烷,“tris”)或其混合物。在本发明的某些实施方案中,水性悬浮液包含约1mm至20mm的缓冲盐,以及其间的所有范围和子范围。在本发明的特定实施方案中,水性悬浮液包含约1至2mm、1至3mm、1至5mm、2至8mm、5至6mm、5至10mm、8至12mm、10至15mm或15至20mm的一种或多种缓冲盐,以及其间的所有范围和子范围。在本发明的其他实施方案中,水性悬浮液包含约1mm、2mm、3mm、4mm、5mm、6mm、7mm、8mm、9mm、10mm、11mm、12mm、13mm、14mm、15mm、16mm、17mm、18mm、19mm或20mm的一种或多种缓冲盐。在本发明的某些实施方案中,水性悬浮液可以包含约0.1%至约2%(w/w)、约0.25%至约1.80%(w/w),或约0.75%(w/w)的聚山梨酸酯。例如,本公开的水性悬浮液可以包含约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.75、0.8、0.9、1、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9或约2%(w/w)的聚山梨酸酯。聚山梨酸酯在本领域中已知是一类衍生自被脂肪酸酯化的乙氧基化脱水山梨糖醇的化合物。在一些实施方案中,聚山梨酸酯可以是聚山梨酸酯20、聚山梨酸酯40、聚山梨酸酯60、聚山梨酸酯80,或其组合。在本发明的某些实施方案中,水性悬浮液可以包含约1%至约10%(w/w)、约0.5%至约8%(w/w)或约5%(w/w)的聚亚烷基二醇。例如,水性悬浮液可以包含约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5或约10%(w/w)的聚亚烷基二醇。聚亚烷基二醇是本领域已知的。优选的聚亚烷基二醇包括聚乙二醇。可用于本公开的聚乙二醇将具有约300g/mol至约10,000g/mol的分子量,包括但不限于peg200、peg300、peg400、peg540、peg600、peg1000、peg1450、peg1540、peg3350、peg3500、peg4000、peg6000、peg8000或其组合。在本发明的某些实施方案中,本公开的水性悬浮液可以包含约0.1%至约5%(w/w)、约0.5%至约4%(w/w)或约2.5%(w/w)的c1-12亚基烷二醇。例如,水性悬浮液可以包含约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9或约5%(w/w)的c1-12亚基烷二醇。如本文所用,“c1-12亚基烷二醇”是指具有1、2、3、4、5、6、7、8、9、10、11或12个碳原子的脂族二醇。示例性的c1-12亚基烷二醇包括例如丙二醇和乙二醇。在本发明的一些实施方案中,c1-12亚基烷二醇是丙二醇。在本发明的某些实施方案中,本公开的水性悬浮液包含约0.1%至约5%(w/w)、约0.1%至约2%(w/w)或约0.3%(w/w)的磷脂酰胆碱。例如,水性悬浮液可以包含约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9或约5%(w/w)的磷脂酰胆碱。磷脂酰胆碱在本领域中已知是一类包含胆碱首基的磷脂。在本发明的一些实施方案中,磷脂酰胆碱是卵磷脂。在本发明的某些实施方案中,水性悬浮液可以包含一种或多种其他药学上可接受的赋形剂。如本文所用,药学上可接受的赋形剂通常与水性悬浮液中的其他成分在化学和/或物理上相容,和/或通常与其受治疗者在生理上相容。在一些实施方案中,一种或多种其他药学上可接受的赋形剂选自防腐剂、抗氧化剂、消泡剂或其混合物。在本发明的其他实施方案中,另外的药学上可接受的赋形剂是防腐剂,例如但不限于苯酚、甲酚、对羟基苯甲酸酯、氯丁醇或其混合物。在本发明的其他实施方案中,另外的药学上可接受的赋形剂是抗氧化剂,例如但不限于抗坏血酸、焦亚硫酸钠、棕榈酸、丁基化羟基茴香醚、丁基化羟基甲苯、生育酚或其混合物。在本发明的其他实施方案中,另外的药学上可接受的赋形剂是消泡剂,例如但不限于二甲聚硅氧烷、二甲硅油或其混合物。在本发明的一些实施方案中,水性悬浮液可以包含水溶性赋形剂,即芳基-c1-6烷基-oh、c1-6烷基-oh、聚山梨酸酯或缓冲盐,或其组合。在本发明的某些实施方案中,水溶性赋形剂是芳基-c1-6烷基-oh(例如苯甲醇)、c1-6烷基-oh(例如乙醇)和聚山梨酸酯。在本发明的其他实施方案中,水溶性赋形剂是c1-6烷基-oh(例如乙醇)和聚山梨酸酯。在本发明的其他实施方案中,水溶性赋形剂是芳基-c1-6烷基-oh(例如苯甲醇)。在本发明的其他实施方案中,水溶性赋形剂是芳基-c1-6烷基-oh(例如苯甲醇)和聚山梨酸酯。在本发明的一些实施方案中,水溶性赋形剂是芳基-c1-6烷基-oh(例如苯甲醇)、聚山梨酸酯和一种或多种缓冲盐。在本发明的一些实施方案中,水溶性赋形剂是c1-6烷基-oh(例如,乙醇)、聚山梨酸酯和一种或多种缓冲盐。在本发明的某些实施方案中,水性悬浮液包含约100mg/ml的氟维司群、约0.5%(w/w)的聚山梨酸酯80、约5.0%(w/w)的甘露醇、约0.16%(w/w)的plasdonetmc-12、约1.2%(w/w)的苯甲醇、约0.75%(w/w)的聚山梨酸酯20和5mm的缓冲盐。在本发明的某些实施方案中,水性悬浮液包含氟维司群(约)100mg/ml、聚山梨酸酯80(约0.5%(w/w))、甘露醇(约5.0%(w/w))、plasdonetmc-12(约0.16%(w/w))、乙醇(约4%(w/w))和聚山梨酸酯20(约0.75%(w/w))。在本发明的某些实施方案中,水性悬浮液包含氟维司群(约100mg/ml)、聚山梨酸酯80(约0.5%(w/w))、甘露醇(约5.0%(w/w))、plasdonetmc-12(约0.16%(w/w))、乙醇(约2%(w/w))、聚山梨酸酯20(约0.25%(w/w))和5mm缓冲盐。在本发明的某些实施方案中,水性悬浮液包含氟维司群(约100mg/ml)、聚山梨酸酯80(约0.5%(w/w))、甘露醇(约5.0%(w/w))、plasdonetmc-12(约0.16%(w/w))、苯甲醇(约2%(w/w))、聚山梨酸酯20(约1.5%(w/w))和10mm缓冲盐。在本发明的其他实施方案中,缓冲盐包含磷酸二氢钾(kh2po4))(约0.24%(w/w))。在本发明的某些实施方案中,水性悬浮液包含氟维司群(约100mg/ml)、聚山梨酸酯80(约0.5%(w/w))、甘露醇(约5.0%(w/w))、plasdonetmc-12(约0.16%(w/w))、苯甲醇(约1.2%(w/w))、聚山梨酸酯20(约0.75%(w/w))和15mm缓冲盐。在本发明的其他实施方案中,缓冲盐包含磷酸二氢钾(kh2po4))(约0.36%(w/w))。在本发明的某些实施方案中,水性悬浮液包含氟维司群(约100mg/ml)、聚山梨酸酯80(约0.5%(w/w))、甘露醇(约5.0%(w/w))、plasdonetmc-12(约0.16%(w/w))、苯甲醇(约2%(w/w))、聚山梨酸酯20(约1.5%(w/w))和10mm缓冲盐。在本发明的其他实施方案中,缓冲盐包含磷酸二氢钾(kh2po4))(约0.24%(w/w))。在本发明的某些实施方案中,水性悬浮液包含氟维司群(约100mg/ml)、聚山梨酸酯80(约0.5%(w/w))、甘露醇(约5.0%(w/w))、plasdonetmc-12(约0.16%(w/w))、苯甲醇(约1.6%(w/w))、聚山梨酸酯20(约1.2%(w/w))和5mm缓冲盐。在本发明的其他实施方案中,缓冲盐包含磷酸二氢钾(kh2po4))(约0.12%(w/w))。在本发明的其他实施方案中,水性悬浮液可以进一步包含氯化钠(约0.9%(w/w))。在本发明的某些实施方案中,水性悬浮液包含氟维司群(约100mg/ml)、聚山梨酸酯80(约0.5%(w/w))、甘露醇(约5.0%(w/w))、plasdonetmc-12(约0.16%(w/w))、苯甲醇(约1.2%(w/w))、聚山梨酸酯20(约1.5%(w/w))和5mm缓冲盐。在本发明的其他实施方案中,缓冲盐包含磷酸二氢钾(kh2po4))(约0.12%(w/w))。在本发明的某些实施方案中,水性悬浮液的ph为约3-10,例如约3、4、5、6、7、8、9或约10。根据本公开,ph使用常规仪器在环境温度,例如20℃至25℃,优选23℃下提及。在本发明的其他实施方案中,水性悬浮液的ph为约5-8。在本发明的其他实施方案中,水性悬浮液的ph为约6-8。在本发明的其他实施方案中,水性悬浮液的ph为约3-7。在本发明的某些实施方案中,水性悬浮液的ph为约6.0至8.0。在本发明的特定实施方案中,水性悬浮液的ph为约6.0至7.0、6.5至7.0、6.5至7.5、6.7至7.2、7.0至7.2、7.0至7.5或7.0至8.0。在本发明的其他实施方案中,水性悬浮液的ph为约7.0。形成水性悬浮液的方法在本发明的一些实施方案中,形成水性悬浮液的方法包括将水性介质与表面活性剂、聚乙烯吡咯烷酮、糖醇和水溶性赋形剂中的至少一种混合以形成悬浮媒剂,向悬浮媒剂中加入一定量的氟维司群,并使氟维司群分散在悬浮媒剂中以形成水性悬浮液。在其他实施方案中,这些方法可以包括使水性悬浮液均质化。在其他实施方案中,具有或不具有均质化步骤的方法可以进一步包括通过相分离水性悬浮液并除去一部分上清液来浓缩含水性悬浮液。在特定的其他实施方案中,在浓缩步骤之后,所述方法可以进一步包括将一种或多种表面活性剂、聚乙烯基吡咯烷酮、糖醇和水溶性赋形剂添加至均质化的氟维司群水性悬浮液中,并使一种或多种表面活性剂、聚乙烯基吡咯烷酮、糖醇和水溶性赋形剂混入悬浮液中。在本发明的一些实施方案中,所述方法包括使用高剪切混合进行的分散步骤,使用高压均质化进行的均质化步骤,或使用高剪切混合进行的分散步骤和使用高压均质化进行的均质化步骤两者。在包含一种或多种表面活性剂、聚乙烯基吡咯烷酮、糖醇和水溶性赋形剂的本发明的其他实施方案中,可以在形成水性悬浮液的方法的一个或多个阶段将一种或多种表面活性剂、聚乙烯基吡咯烷酮、糖醇和水溶性赋形剂并入制剂中。在一些实施方案中,在任何混合、均质化或去除上清液步骤中的一些或全部之前将水性悬浮液的表面活性剂、聚乙烯吡咯烷酮、糖醇和水溶性赋形剂中的至少一部分或全部与一定量的氟维司群一起添加到水性介质中。在其他实施方案中,在任何混合、均质化或去除上清液步骤中的一些或全部已完成之后,将水性悬浮液的一种或多种表面活性剂、聚乙烯吡咯烷酮、糖醇和水溶性赋形剂中的至少一部分或全部加入到水性悬浮液中。在其他实施方案中,在任何混合、均质化或去除上清液步骤中的一些或全部之前,将水性悬浮液的表面活性剂、聚乙烯吡咯烷酮和水溶性赋形剂的至少一部分或全部与水性介质和氟维司群组合,且在任何混合、均质化或上清液去除步骤中的一些或全部之后,将糖醇和水溶性赋形剂的至少一部分或全部加入到水性悬浮液中。本文所述的氟维司群粒子可以通过包括以下步骤的方法制备:将氟维司群粒子分散在液体悬浮介质中,并在研磨介质存在下应用机械手段以减小不溶解的氟维司粒子的尺寸达到所需尺寸。在本发明的其他实施方案中,可以通过本领域已知的适当技术,例如冻干或喷雾干燥,部分或完全除去水性悬浮液中存在的一种或多种溶剂,例如水或醇或其组合,以形成干燥的药物组合物。在本发明的某些实施方案中,干燥的药物组合物可以包含最多约1%、约2%、约5%或约10%的一种或多种溶剂。通过冻干形成的干燥的药物组合物可以呈冻干饼的形式。在本发明的某些实施方案中,可以通过复溶干燥的药物组合物(例如冻干饼)来形成水性悬浮液。可以用适当的稀释剂进行复溶。在一些实施方案中,稀释剂可以是注射用水(wfi)。在其他实施方案中,稀释剂可以是氯化钠量为约0.01%至约1.8%w/w的wfi,例如但不限于含0.9%w/w氯化钠的生理盐水。在本发明的一些实施方案中,除氟维司群以外的至少一部分赋形剂可以从水性悬浮液中省略,并作为稀释剂的一部分掺入,并在用稀释剂复溶干燥的药物组合物时引入到水性悬浮液中,得到最终的制剂。在其他实施方案中,稀释剂可以是wfi和本文其他地方所述的一种或多种水溶性赋形剂。在其他实施方案中,稀释剂可以是wfi,本文其他地方所述的一种或多种水溶性赋形剂,以及本文其他地方所述的一种或多种表面活性剂、聚乙烯基吡咯烷酮和糖醇。在其他实施方案中,可以制备具有比用于施用的水性悬浮液中所期望的浓度更高或更低的组成成分的水性悬浮液,形成为干燥的药物组合物并以适当量的干燥的药物组合物放入小瓶中以达到每瓶目标剂量的氟维司,以后用适当的稀释剂复溶以形成所需的水性悬浮液供施用。药代动力学在本发明的某些实施方案中,水性悬浮液与市售药物组合物生物等效。据报道,绝经后晚期乳腺癌患者肌内施用500mg且在第15天再施用一剂的单剂量pk参数(以几何平均值和变异系数(%))为cmax25.1(35.3)ng/ml、cmin16.3(25.9)ng/ml和auc11,400(33.4)ng·h/ml。在本发明的其他实施方案中,本发明的水性悬浮液的相对平均cmax、auc(0-t)和auc(0-∞)的90%置信区间(ci)分别在的相对平均cmax、auc(0-t)和auc(0-∞)的80%至125%之内。在本发明的其他实施方案中,本发明的水性悬浮液的相对平均cmax、auc(0-t)和auc(0-∞)的90%置信区间(ci)分别在空腹状态下的相对平均cmax、auc(0-t)和auc(0-∞)的80%至125%之内。在本发明的其他实施方案中,本发明的水性悬浮液的相对平均cmax、auc(0-t)和auc(0-∞)的90%置信区间(ci)分别在进食状态下的相对平均cmax、auc(0-t)和auc(0-∞)的80%至125%之内。在本发明的其他实施方案中,本发明的氟维司群浓度为100mg/ml的水性悬浮液的相对平均cmax、auc(0-t)和auc(0-∞)的90%置信区间(ci)分别在的相对平均cmax、auc(0-t)和auc(0-∞)的80%至125%之内。在本发明的其他实施方案中,本发明的氟维司群浓度为100mg/ml的水性悬浮液的相对平均cmax、auc(0-t)和auc(0-∞)的90%置信区间(ci)分别在空腹状态下的相对平均cmax、auc(0-t)和auc(0-∞)的80%至125%之内。在本发明的其他实施方案中,本发明的氟维司群浓度为100mg/ml的水性悬浮液的相对平均cmax、auc(0-t)和auc(0-∞)的90%置信区间(ci)分别在进食状态下的相对平均cmax、auc(0-t)和auc(0-∞)的80%至125%之内。在本发明的特定实施方案中,水性悬浮液具有表1和表2所示的单剂量和多剂量药代动力学参数。表1示出了500mg剂量的本公开的水性悬浮液的药代动力学参数。对于表1中标记为“单剂量”的数据,示出了500mg初始剂量且在第15天再给予500mg剂量的氟维司群血浆浓度数据。对于表1中标记为“多剂量稳态”的数据,示出了在第1天、第15天、第20天以及此后每月一次给予500mg剂量后在第3个月测量的氟维司群血浆浓度数据。表2示出了本公开的单个250mg剂量的水性悬浮液的药代动力学参数。在表2中,除tmax外,数据表示为几何平均值(cv%),tmax表示为中值,括号中指示范围。表1表2在特定的实施方案中,在本发明的水性悬浮液中约500mg氟维司群的剂量与500mg的市售药物组合物生物等效。在某些实施方案中,在本发明的水性悬浮液中小于500mg氟维司群的剂量与500mg的市售药物组合物生物等效。在其他实施方案中,本发明的水性悬浮液中约400至450mg氟维司群的剂量与500mg的市售药物组合物生物等效。在其他实施方案中,在本发明的水性悬浮液中约350至400mg氟维司群的剂量与500mg的市售药物组合物生物等效。在其他实施方案中,本发明的水性悬浮液中约300至350mg氟维司群的剂量与500mg的市售药物组合物生物等效。在其他实施方案中,在本发明的水性悬浮液中约250至300mg氟维司群的剂量与500mg的市售药物组合物生物等效。在本发明的其他实施方案中,在本发明的水性悬浮液中500mg剂量的氟维司群提供的相对平均cmax、auc(0-t)和auc(0-∞)的90%置信区间(ci)分别在500mg剂量的的相对平均cmax、auc(0-t)和auc(0-∞)的80%至125%之内。在本发明的其他实施方案中,在本发明的水性悬浮液中小于500mg氟维司群的剂量提供的相对平均cmax、auc(0-t)和auc(0-∞)的90%置信区间(ci)分别在500mg剂量的的相对平均cmax、auc(0-t)和auc(0-∞)的80%至125%之间。在本发明的一些实施方案中,本发明的水性悬浮液可以作为单次肌内注射施用,氟维司群的相对平均cmax、auc(0-t)和auc(0-∞)的90%置信区间(ci)分别在以两次5ml注射被肌内施用的500mg形式的氟维司群之后氟维司群的相对平均cmax、auc(0-t)和auc(0-∞)的80%至125%之内。在其他实施方案中,作为单次肌内注射施用的这种水性悬浮液包含约500mg剂量的氟维司群。在其他实施方案中,作为单次肌内注射施用的这种水性悬浮液包含约500mg剂量的氟维司群,其注射体积为约3.0ml至约6.0ml、约3.0ml至约5.0ml、约4.5ml至约5.5ml、约3.5ml至约4.5ml、约3.0ml、约3.5ml、约4.0ml、约4.5ml或约5.0ml。在本发明的一些实施方案中,本发明的水性悬浮液可以作为单次皮下注射施用,氟维司群的相对平均cmax、auc(0-t)和auc(0-∞)的90%置信区间(ci)分别在以两次5ml注射被肌内施用的500mg形式的氟维司群之后氟维司群的相对平均cmax、auc(0-t)和auc(0-∞)的80%至125%之内。在其他实施方案中,作为单次皮下注射施用的这种水性悬浮液包含约500mg剂量的氟维司群。在其他实施方案中,作为单次皮下注射施用的这种水性悬浮液包含约500mg剂量的氟维司群,其注射体积为约3.0ml至约6.0ml、约3.0ml至约5.0ml、约4.5ml至约5.5ml、约3.5ml至约4.5ml、约3.0ml、约3.5ml、约4.0ml、约4.5ml或约5.0ml。在本发明的某些实施方案中,本发明的水性悬浮液的相对平均auc(0-t)、相对平均auc(0-∞)或两者的90%置信区间(ci)分别在的相对平均auc(0-t)和相对平均auc(0-∞)的80%至125%之内,并且本发明水性悬浮液的相对平均cmax小于的相对平均cmax的80%。相信这样的实施方案可以通过向受试者提供治疗有效量的氟维司群暴露同时与从一剂或多剂接受治疗有效量的氟维司群暴露的受试者遭受的副作用或毒性的程度相比降低一种或多种cmax驱动的副作用或毒性的程度而提供益处。在本发明的一些实施方案中,本发明的水性悬浮液的相对平均auc(0-t)、相对平均auc(0-∞)或两者的90%置信区间(ci)分别在的相对平均auc(0-t)和相对平均auc(0-∞)的80%至125%之内,并且本发明的水性悬浮液的相对平均cmax小于的相对平均cmax的80%、小于75%、小于70%、小于65%、小于60%、小于55%、小于50%、小于45%或小于40%。在其他实施方案中,这种水性悬浮液作为单次肌内注射施用,并且包含约500mg剂量的氟维司群,其浓度为约80mg/ml至约170mg/ml或约100mg/ml。在本发明的其他实施方案中,本发明的水性悬浮液的相对平均auc(0-t)、相对平均auc(0-∞)或两者的90%置信区间(ci)分别在的相对平均auc(0-t)和相对平均auc(0-∞)的80%至125%之内,并且本发明的水性悬浮液的相对平均cmax小于空腹状态下的相对平均cmax的80%、小于75%、小于70%、小于65%、小于60%、小于55%、小于50%、小于45%或小于40%。在其他实施方案中,这种水性悬浮液作为单次肌内注射施用,并且包含约500mg剂量的氟维司群,其浓度为约80mg/ml至约170mg/ml或约100mg/ml。在本发明的其他实施方案中,本发明的水性悬浮液的相对平均auc(0-t)、相对平均auc(0-∞)或两者的90%置信区间(ci)分别在的相对平均auc(0-t)和相对平均auc(0-∞)的80%至125%之内,并且本发明的水性悬浮液的相对平均cmax小于进食状态下的相对平均cmax的80%、小于75%、小于70%、小于65%、小于60%、小于55%、小于50%、小于45%或小于40%。在其他实施方案中,这种水性悬浮液作为单次肌内注射施用,并且包含约500mg剂量的氟维司群,其浓度为约80mg/ml至约170mg/ml或约100mg/ml。在本发明的一些实施方案中,本发明的水性悬浮液的相对平均auc(0-t)、相对平均auc(0-∞)或两者的90%置信区间(ci)分别在的相对平均auc(0-t)和相对平均auc(0-∞)的80%至125%之内,并且本发明的水性悬浮液的相对平均cmax为的相对平均cmax的约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约45%至约55%之内、约55%至约65%之内、约65%至约75%之内、约50%至约60%之内、约60%至约70%之内或约70%至约80%之内。在其他实施方案中,这种水性悬浮液作为单次肌内注射施用,并且包含约500mg剂量的氟维司群,其浓度为约80mg/ml至约170mg/ml或约100mg/ml。在其他实施方案中,这种水性悬浮液作为单次皮下注射施用,并且包含约500mg剂量的氟维司群,其浓度为约80mg/ml至约170mg/ml或约100mg/ml。在本发明的其他实施方案中,本发明的水性悬浮液的相对平均auc(0-t)、相对平均auc(0-∞)或两者的90%置信区间(ci)分别在的相对平均auc(0-t)和相对平均auc(0-∞)的80%至125%之内,本发明的水性悬浮液的相对平均cmax为空腹状态下的相对平均cmax的约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约45%至约55%之内、约55%至约65%之内、约65%至约75%之内、约50%至约60%之内、约60%至约70%之内或约70%至约80%之内。在其他实施方案中,这种水性悬浮液作为单次肌内注射施用,并且包含约500mg剂量的氟维司群,其浓度为约80mg/ml至约170mg/ml或约100mg/ml。在其他实施方案中,这种水性悬浮液作为单次皮下注射施用,并且包含约500mg剂量的氟维司群,其浓度为约80mg/ml至约170mg/ml或约100mg/ml。在本发明的其他实施方案中,本发明的水性悬浮液的相对平均auc(0-t)、相对平均auc(0-∞)或两者的90%置信区间(ci)分别在的相对平均auc(0-t)和相对平均auc(0-∞)的80%至125%之内,并且本发明的水性悬浮液的相对平均cmax为进食状态下的相对平均cmax的约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约45%至约55%之内、约55%至约65%之内、约65%至约75%之内、约50%至约60%之内、约60%至约70%之内或约70%至约80%之内。在其他实施方案中,这种水性悬浮液作为单次肌内注射施用,并且包含约500mg剂量的氟维司群,其浓度为约80mg/ml至约170mg/ml或约100mg/ml。在其他实施方案中,这种水性悬浮液作为单次皮下注射施用,并且包含约500mg剂量的氟维司群,其浓度为约80mg/ml至约170mg/ml或约100mg/ml。在特定的实施方案中,本发明的水性悬浮液中大于500mg(例如最多约3000mg)的氟维司群的剂量与500mg的市售药物组合物生物等效。在一些实施方案中,本发明的水性悬浮液中约550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群的剂量与500mg的市售药物组合物生物等效。在其他实施方案中,本发明的水性悬浮液中约500至1000mg氟维司群的剂量与500mg的市售药物组合物生物等效。在其他实施方案中,本发明的水性悬浮液中约1000至2000mg氟维司群的剂量与500mg的市售药物组合物生物等效。在其他实施方案中,本发明的水性悬浮液中约2000至3000mg氟维司群的剂量与500mg的市售药物组合物生物等效。在其他实施方案中,本发明的水性悬浮液中约750至1000mg氟维司群的剂量与500mg的市售药物组合物生物等效。在本发明的其他实施方案中,本发明的水性悬浮液中大于500mg氟维司群的剂量(例如最多约3000mg)提供的相对平均cmax、auc(0-t)和auc(0-∞)90%置信区间(ci)分别在500mg剂量的的相对平均cmax、auc(0-t)和auc(0-∞)的80%至125%之内。例如,本发明的水性悬浮液中约550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200,2300、2400、2500、2600、2700、2800、2900或约3000mg剂量的氟维司群提供的相对平均cmax、auc(0-t)和auc(0-∞)的90%置信区间(ci)分别在500mg剂量的的相对平均cmax、auc(0-t)和auc(0-∞)的80%至125%之内。在本发明的一些实施方案中,包含大于500mg氟维司群(例如,最多约3000mg)的本发明的水性悬浮液可以作为单次肌内注射施用,氟维司群的相对平均cmax、auc(0-t)和auc(0-∞)的90%置信区间(ci)分别在以两次5ml注射被肌内施用的500mg形式的氟维司群之后氟维司群的相对平均cmax、auc(0-t)和auc(0-∞)的80%至125%之内。例如,包含约550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群的本发明的水性悬浮液可以作为单次肌内注射施用,氟维司群的相对平均cmax、auc(0-t)和auc(0-∞)的90%置信区间(ci)分别在以两次5ml注射被肌内施用的500mg形式的氟维司群之后氟维司群的相对平均cmax、auc(0-t)和auc(0-∞)的80%至125%之内。在其他实施方案中,作为单次肌内注射施用的这种水性悬浮液包含大于500mg剂量的氟维司群,例如最多约3000mg氟维司群,其注射体积为约3.0ml至约6.0ml、约3.0ml至约5.0ml、约4.5ml至约5.5ml、约3.5ml至约4.5ml、约3.0ml、约3.5ml、约4.0ml、约4.5ml或约5.0ml。例如,作为单次肌内注射施用的本发明的水性悬浮液包含约550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群,其注射体积为约3.0ml至约6.0ml、约3.0ml至约5.0ml、约4.5ml至约5.5ml、约3.5ml至约4.5ml、约3.0ml、约3.5ml、约4.0ml、约4.5ml或约5.0ml。在本发明的一些实施方案中,包含大于500mg氟维司群(例如最多约3000mg)的本发明的水性悬浮液可以作为单次皮下注射施用,氟维司群的相对平均cmax、auc(0-t)和auc(0-∞)的90%置信区间(ci)分别在以两次5ml注射被肌内施用的500mg形式的氟维司群之后氟维司群的相对平均cmax、auc(0-t)和auc(0-∞)的80%至125%之内。在其他实施方案中,作为单次皮下注射施用的这种水性悬浮液包含550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg剂量的氟维司群。在其他实施方案中,作为单次皮下注射施用的这种水性悬浮液包含大于500mg剂量的氟维司群,例如最多约3000mg,其注射体积为约3.0ml至约6.0ml、约3.0ml至约5.0ml、约4.5ml至约5.5ml、约3.5ml至约4.5ml、约3.0ml、约3.5ml、约4.0ml、约4.5ml或约5.0ml。在本发明的一些实施方案中,水性悬浮液作为单次肌内注射施用,并包含大于500mg剂量的氟维司群,例如最多约3000mg(例如550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群),浓度为约80mg/ml至约170mg/ml或约100mg/ml,本发明的水性悬浮液的相对平均auc(0-t)、相对平均auc(0-∞)或两者的90%置信区间(ci)分别在的相对平均auc(0-t)和相对平均auc(0-∞)的80%至125%之内,并且本发明的水性悬浮液的相对平均cmax小于相对平均cmax的80%、小于75%、小于70%、小于65%、小于60%、小于55%、小于50%、小于45%或小于40%。在本发明的其他实施方案中,水性悬浮液作为单次肌内注射施用,并包含大于500mg剂量的氟维司群,例如最多约3000mg(例如550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群),浓度为约80mg/ml至约170mg/ml或约100mg/ml,本发明的水性悬浮液的相对平均auc(0-t)、相对平均auc(0-∞)或两者的90%置信区间(ci)分别在的相对平均auc(0-t)和相对平均auc(0-∞)的80%至125%之内,并且本发明的水性悬浮液的相对平均cmax小于空腹状态下相对平均cmax的80%、小于75%、小于70%、小于65%、小于60%、小于55%、小于50%、小于45%或小于40%。在本发明的其他实施方案中,水性悬浮液作为单次肌内注射施用,并包含大于500mg剂量的氟维司群,例如最多约3000mg(例如550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群),浓度为约80mg/ml至约170mg/ml或约100mg/ml,本发明的水性悬浮液的相对平均auc(0-t)、相对平均auc(0-∞)或两者的90%置信区间(ci)分别在的相对平均auc(0-t)和相对平均auc(0-∞)的80%至125%之内,并且本发明的水性悬浮液的相对平均cmax小于进食状态下相对平均cmax的80%、小于75%、小于70%、小于65%、小于60%、小于55%、小于50%、小于45%或小于40%。在本发明的一些实施方案中,水性悬浮液作为单次肌内注射施用,并包含大于500mg剂量的氟维司群,例如最多约3000mg(例如550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群),浓度为约80mg/ml至约170mg/ml或约100mg/ml,本发明的水性悬浮液的相对平均auc(0-t)、相对平均auc(0-∞)或两者的90%置信区间(ci)分别在的相对平均auc(0-t)和相对平均auc(0-∞)的80%至125%之内,并且本发明的水性悬浮液的相对平均cmax为相对平均cmax的约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约45%至约55%之内、约55%至约65%之内、约65%至约75%之内、约50%至约60%之内、约60%至约70%之内或约70%至约80%之内。在本发明的其他实施方案中,水性悬浮液作为单次肌内注射施用,并包含大于500mg剂量的氟维司群,例如最多约3000mg(例如550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群),浓度为约80mg/ml至约170mg/ml或约100mg/ml,本发明的水性悬浮液的相对平均auc(0-t)、相对平均auc(0-∞)或两者的90%置信区间(ci)分别在的相对平均auc(0-t)和相对平均auc(0-∞)的80%至125%之内,并且本发明的水性悬浮液的相对平均cmax为空腹状态下相对平均cmax的约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约45%至约55%之内、约55%至约65%之内、约65%至约75%之内、约50%至约60%之内、约60%至约70%之内或约70%至约80%之内。在本发明的其他实施方案中,水性悬浮液作为单次肌内注射施用,并包含大于500mg剂量的氟维司群,例如最多约3000mg(例如550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群),浓度为约80mg/ml至约170mg/ml或约100mg/ml,本发明的水性悬浮液的相对平均auc(0-t)、相对平均auc(0-∞)或两者的90%置信区间(ci)分别在的相对平均auc(0-t)和相对平均auc(0-∞)的80%至125%之内,并且本发明的水性悬浮液的相对平均cmax为进食状态下相对平均cmax的约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约45%至约55%之内、约55%至约65%之内、约65%至约75%之内、约50%至约60%之内、约60%至约70%之内或约70%至约80%之内。在本发明的一些实施方案中,包含大于500mg氟维司群(例如最多约3000mg)的本发明的水性悬浮液可以作为两次肌内注射施用,氟维司群的相对平均cmax、auc(0-t)和auc(0-∞)的90%置信区间(ci)分别在以两次5ml注射被肌内施用的500mg形式的氟维司群之后氟维司群的相对平均cmax、auc(0-t)和auc(0-∞)的80%至125%之内。例如,包含550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群的本发明的水性悬浮液可以作为两次肌内注射施用,氟维司群的相对平均cmax、auc(0-t)和auc(0-∞)的90%置信区间(ci)分别在以两次5ml注射被肌内施用的500mg形式的氟维司群之后氟维司群的相对平均cmax、auc(0-t)和auc(0-∞)的80%至125%之内。在其他实施方案中,作为两次肌内注射施用的这种水性悬浮液包含大于500mg剂量的氟维司群,例如最多约3000mg氟维司群,其每次注射的注射体积为约3.0ml至约6.0ml、约3.0ml至约5.0ml、约4.5ml至约5.5ml、约3.5ml至约4.5ml、约3.0ml、约3.5ml、约4.0ml、约4.5ml或约5.0ml。例如,作为两次肌内注射施用的本发明的水性悬浮液包含约550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群,其每次注射的注射体积为约3.0ml至约6.0ml、约3.0ml至约5.0ml、约4.5ml至约5.5ml、约3.5ml至约4.5ml、约3.0ml、约3.5ml、约4.0ml、约4.5ml或约5.0ml。在本发明的一些实施方案中,包含大于500mg氟维司群(例如最多约3000mg)的本发明的水性悬浮液可以作为两次皮下注射施用,氟维司群的相对平均cmax、auc(0-t)和auc(0-∞)的90%置信区间(ci)分别在以两次5ml注射被肌内施用的500mg形式的氟维司群之后氟维司群的相对平均cmax、auc(0-t)和auc(0-∞)的80%至125%之内。在其他实施方案中,作为两次皮下注射施用的这种水性悬浮液包含550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg剂量的氟维司群。在其他实施方案中,作为两次皮下注射施用的这种水性悬浮液包含大于500mg剂量的氟维司群,例如最多约3000mg,其每次注射的注射体积为约3.0ml至约6.0ml、约3.0ml至约5.0ml、约4.5ml至约5.5ml、约3.5ml至约4.5ml、约3.0ml、约3.5ml、约4.0ml、约4.5ml或约5.0ml。在本发明的一些实施方案中,水性悬浮液作为两次肌内注射施用,并包含大于500mg剂量的氟维司群,例如最多约3000mg(例如550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群),浓度为约80mg/ml至约170mg/ml或约100mg/ml,本发明的水性悬浮液的相对平均auc(0-t)、相对平均auc(0-∞)或两者的90%置信区间(ci)分别在相对平均auc(0-t)和相对平均auc(0-∞)的80%至125%之内,并且本发明的水性悬浮液的相对平均cmax小于相对平均cmax的80%、小于75%、小于70%、小于65%、小于60%、小于55%、小于50%、小于45%或小于40%。在本发明的其他实施方案中,水性悬浮液作为两次肌内注射施用,并包含大于500mg剂量的氟维司群,例如最多约3000mg(例如550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群),浓度为约80mg/ml至约170mg/ml或约100mg/ml,本发明的水性悬浮液的相对平均auc(0-t)、相对平均auc(0-∞)或两者的90%置信区间(ci)分别在相对平均auc(0-t)和相对平均auc(0-∞)的80%至125%之内,并且本发明的水性悬浮液的相对平均cmax小于空腹状态下相对平均cmax的80%、小于75%、小于70%、小于65%、小于60%、小于55%、小于50%、小于45%或小于40%。在本发明的其他实施方案中,水性悬浮液作为两次肌内注射施用,并包含大于500mg剂量的氟维司群,例如最多约3000mg(例如550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群),浓度为约80mg/ml至约170mg/ml或约100mg/ml,本发明的水性悬浮液的相对平均auc(0-t)、相对平均auc(0-∞)或两者的90%置信区间(ci)分别在的相对平均auc(0-t)和相对平均auc(0-∞)的80%至125%之内,并且本发明的水性悬浮液的相对平均cmax小于进食状态下相对平均cmax的80%、小于75%、小于70%、小于65%、小于60%、小于55%、小于50%、小于45%或小于40%。在本发明的一些实施方案中,水性悬浮液作为两次肌内注射施用,并包含大于500mg剂量的氟维司群,例如最多约3000mg(例如550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群),浓度为约80mg/ml至约170mg/ml或约100mg/ml,本发明的水性悬浮液的相对平均auc(0-t)、相对平均auc(0-∞)或两者的90%置信区间(ci)分别在的相对平均auc(0-t)和相对平均auc(0-∞)的80%至125%之内,并且本发明的水性悬浮液的相对平均cmax为相对平均cmax的约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约45%至约55%之内、约55%至约65%之内、约65%至约75%之内、约50%至约60%之内、约60%至约70%之内或约70%至约80%之内。在本发明的其他实施方案中,水性悬浮液作为两次肌内注射施用,并包含大于500mg剂量的氟维司群,例如最多约3000mg(例如550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群),浓度为约80mg/ml至约170mg/ml或约100mg/ml,本发明的水性悬浮液的相对平均auc(0-t)、相对平均auc(0-∞)或两者的90%置信区间(ci)分别在的相对平均auc(0-t)和相对平均auc(0-∞)的80%至125%之内,并且本发明的水性悬浮液的相对平均cmax为空腹状态下相对平均cmax的约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约45%至约55%之内、约55%至约65%之内、约65%至约75%之内、约50%至约60%之内、约60%至约70%之内或约70%至约80%之内。在本发明的其他实施方案中,水性悬浮液作为两次肌内注射施用,并包含大于500mg剂量的氟维司群,例如最多约3000mg(例如550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群),浓度为约80mg/ml至约170mg/ml或约100mg/ml,本发明的水性悬浮液的相对平均auc(0-t)、相对平均auc(0-∞)或两者的90%置信区间(ci)分别在的相对平均auc(0-t)和相对平均auc(0-∞)的80%至125%之内,并且本发明的水性悬浮液的相对平均cmax为进食状态下相对平均cmax的约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约45%至约55%之内、约55%至约65%之内、约65%至约75%之内、约50%至约60%之内、约60%至约70%之内或约70%至约80%之内。在本发明的一些实施方案中,包含大于500mg氟维司群(例如,最多约3000mg)的本发明的水性悬浮液可以作为3次或更多次肌内注射施用,氟维司群的相对平均cmax、auc(0-t)和auc(0-∞)的90%置信区间(ci)分别在以两次5ml注射被肌内施用的500mg形式的氟维司群之后氟维司群的相对平均cmax、auc(0-t)和auc(0-∞)的80%至125%之内。例如,包含约550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群的本发明的水性悬浮液可以作为3次或更多次肌内注射施用,氟维司群的相对平均cmax、auc(0-t)和auc(0-∞)的90%置信区间(ci)分别在以两次5ml注射被肌内施用的500mg形式的氟维司群之后氟维司群的相对平均cmax、auc(0-t)和auc(0-∞)的80%至125%之内。在其他实施方案中,作为3次或更多次肌内注射施用的这种水性悬浮液包含大于500mg剂量的氟维司群,例如最多约3000mg氟维司群,其每次注射的注射体积为约3.0ml至约6.0ml、约3.0ml至约5.0ml、约4.5ml至约5.5ml、约3.5ml至约4.5ml、约3.0ml、约3.5ml、约4.0ml、约4.5ml或约5.0ml。例如,作为3次或更多次肌内注射施用的本发明的水性悬浮液包含约550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群,其每次注射的注射体积为约3.0ml至约6.0ml、约3.0ml至约5.0ml、约4.5ml至约5.5ml、约3.5ml至约4.5ml、约3.0ml、约3.5ml、约4.0ml、约4.5ml或约5.0ml。在本发明的一些实施方案中,包含大于500mg氟维司群(例如最多约3000mg)的本发明的水性悬浮液可以作为3次或更多次皮下注射施用,氟维司群的相对平均cmax、auc(0-t)和auc(0-∞)的90%置信区间(ci)分别在以两次5ml注射被肌内施用的500mg形式的氟维司群之后氟维司群的相对平均cmax、auc(0-t)和auc(0-∞)的80%至125%之内。在其他实施方案中,作为3次或更多次皮下注射施用的这种水性悬浮液包含550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg剂量的氟维司群。在其他实施方案中,作为3次或更多次皮下注射施用的这种水性悬浮液包含大于500mg剂量的氟维司群,例如最多约3000mg,其每次注射的注射体积为约3.0ml至约6.0ml、约3.0ml至约5.0ml、约4.5ml至约5.5ml、约3.5ml至约4.5ml、约3.0ml、约3.5ml、约4.0ml、约4.5ml或约5.0ml。在本发明的一些实施方案中,水性悬浮液作为3次或更多次肌内注射施用,并包含大于500mg剂量的氟维司群,例如最多约3000mg(例如550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群),浓度为约80mg/ml至约170mg/ml或约100mg/ml,本发明的水性悬浮液的相对平均auc(0-t)、相对平均auc(0-∞)或两者的90%置信区间(ci)分别在相对平均auc(0-t)和相对平均auc(0-∞)的80%至125%之内,并且本发明的水性悬浮液的相对平均cmax小于相对平均cmax的80%、小于75%、小于70%、小于65%、小于60%、小于55%、小于50%、小于45%或小于40%。在本发明的其他实施方案中,水性悬浮液作为3次或更多次肌内注射施用,并包含大于500mg剂量的氟维司群,例如最多约3000mg(例如550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群),浓度为约80mg/ml至约170mg/ml或约100mg/ml,本发明的水性悬浮液的相对平均auc(0-t)、相对平均auc(0-∞)或两者的90%置信区间(ci)分别在相对平均auc(0-t)和相对平均auc(0-∞)的80%至125%之内,并且本发明的水性悬浮液的相对平均cmax小于空腹状态下相对平均cmax的80%、小于75%、小于70%、小于65%、小于60%、小于55%、小于50%、小于45%或小于40%。在本发明的其他实施方案中,水性悬浮液作为3次或更多次肌内注射施用,并包含大于500mg剂量的氟维司群,例如最多约3000mg(例如550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群),浓度为约80mg/ml至约170mg/ml或约100mg/ml,本发明的水性悬浮液的相对平均auc(0-t)、相对平均auc(0-∞)或两者的90%置信区间(ci)分别在的相对平均auc(0-t)和相对平均auc(0-∞)的80%至125%之内,并且本发明的水性悬浮液的相对平均cmax小于进食状态下相对平均cmax的80%、小于75%、小于70%、小于65%、小于60%、小于55%、小于50%、小于45%或小于40%。在本发明的一些实施方案中,水性悬浮液作为3次或更多次肌内注射施用,并包含大于500mg剂量的氟维司群,例如最多约3000mg(例如550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群),浓度为约80mg/ml至约170mg/ml或约100mg/ml,本发明的水性悬浮液的相对平均auc(0-t)、相对平均auc(0-∞)或两者的90%置信区间(ci)分别在的相对平均auc(0-t)和相对平均auc(0-∞)的80%至125%之内,并且本发明的水性悬浮液的相对平均cmax为相对平均cmax的约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约45%至约55%之内、约55%至约65%之内、约65%至约75%之内、约50%至约60%之内、约60%至约70%之内或约70%至约80%之内。在本发明的其他实施方案中,水性悬浮液作为3次或更多次肌内注射施用,并包含大于500mg剂量的氟维司群,例如最多约3000mg(例如550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群),浓度为约80mg/ml至约170mg/ml或约100mg/ml,本发明的水性悬浮液的相对平均auc(0-t)、相对平均auc(0-∞)或两者的90%置信区间(ci)分别在的相对平均auc(0-t)和相对平均auc(0-∞)的80%至125%之内,并且本发明的水性悬浮液的相对平均cmax为空腹状态下相对平均cmax的约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约45%至约55%之内、约55%至约65%之内、约65%至约75%之内、约50%至约60%之内、约60%至约70%之内或约70%至约80%之内。在本发明的其他实施方案中,水性悬浮液作为3次或更多次肌内注射施用,并包含大于500mg剂量的氟维司群,例如最多约3000mg(例如550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群),浓度为约80mg/ml至约170mg/ml或约100mg/ml,本发明的水性悬浮液的相对平均auc(0-t)、相对平均auc(0-∞)或两者的90%置信区间(ci)分别在的相对平均auc(0-t)和相对平均auc(0-∞)的80%至125%之内,并且本发明的水性悬浮液的相对平均cmax为进食状态下相对平均cmax的约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约45%至约55%之内、约55%至约65%之内、约65%至约75%之内、约50%至约60%之内、约60%至约70%之内或约70%至约80%之内。治疗方法在其他实施方案中,本发明涉及治疗方法,包括将药学有效量的本文所述的任何水性悬浮液施用给有需要的患者。在特定实施方案中,本发明涉及一种治疗乳腺癌的方法,包括施用药学上可接受量的本文所述的任何水性悬浮液。在某些实施方案中,乳腺癌是转移性乳腺癌。在本发明的其他实施方案中,乳腺癌是激素受体(hr)阳性乳腺癌。在本发明的其他实施方案中,本发明涉及一种治疗绝经后女性激素受体(hr)阳性乳腺癌的方法,包括施用药学有效量的本文所述的任何水性悬浮液。在其他实施方案中,本发明涉及一种治疗绝经后女性在抗雌激素疗法后疾病进展的激素受体(hr)阳性乳腺癌的方法,包括施用药学有效量的本文所述的任何水性悬浮液。在其他实施方案中,本发明涉及一种治疗女性在内分泌治疗后疾病进展的hr阳性,人表皮生长因子受体2(her2)阴性的晚期或转移性乳腺癌的方法。在其他实施方案中,本发明涉及治疗方法,包括通过向侧臀肌部位或臀大肌部位肌内注射来施用。在其他实施方案中,本发明涉及治疗方法,包括通过皮下注射施用本文所述的水性悬浮液。在本发明的特定实施方案中,在第1天、第15天、第29天以及此后每月一次施用如本文所述的水性悬浮液。在本发明的其他实施方案中,在第1天、第15天、第29天以及此后每月一次施用500mg剂量的如本文所述的任何水性悬浮液。在本发明的其他实施方案中,在第1天、第15天、第29天以及此后每月一次施用250mg剂量的如本文所述的任何水性悬浮液。在本发明的某些实施方案中,如本文所述的水性悬浮液作为单次注射施用。在本发明的其他实施方案中,500mg剂量的本文所述的任何水性悬浮液作为单次注射施用。在本发明的其他实施方案中,500mg剂量的本文所述的任何水性悬浮液作为单次5ml注射施用。在本发明的其他实施方案中,500mg剂量的本文所述的任何水性悬浮液作为单次4ml注射施用。在其他实施方案中,500mg剂量的本文所述的任何水性悬浮液作为单次3ml注射施用。在本发明的其他实施方案中,施用大于500mg,例如最多约3000mg氟维司群量总剂量的如本文所述的任何水性悬浮液。例如,施用约525、550、575、600、625、650、675、700、725、750、775、800、825、850、875、900、925、950、975、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群量总剂量的如本文所述的任何水性悬浮液。在本发明的一些实施方案中,如本文所述的任何水性悬浮液作为单次注射施用。在本发明的其他实施方案中,大于500mg,例如最多约3000mg氟维司群量剂量的如本文所述的任何水性悬浮液作为单次注射施用。在本发明的其他实施方案中,大于500mg,例如最多约3000mg氟维司群量剂量的如本文所述的任何水性悬浮液作为单次5ml注射施用。在本发明的其他实施方案中,500mg,例如最多约3000mg剂量的如本文所述的任何水性悬浮液作为单次4ml注射施用。在其他实施方案中,大于500mg,例如最多约3000mg氟维司群量剂量的如本文所述的任何水性悬浮液作为单次3ml注射施用。在其他实施方案中,大于500mg,例如最多约3000mg氟维司群量剂量的如本文所述的任何水性悬浮液作为单次6ml注射施用。在其他实施方案中,大于500mg,例如最多约3000mg氟维司群量剂量的如本文所述的任何水性悬浮液作为约5.5ml、约6.0ml、约6.5ml、约7.0ml或约7.5ml的单次注射施用。在本发明的特定实施方案中,如本文所述的水性悬浮液作为两次注射施用。在本发明的其他实施方案中,500mg剂量的如本文所述的任何水性悬浮液作为两次注射施用。在本发明的其他实施方案中,500mg剂量的如本文所述的任何水性悬浮液作为两次5ml注射施用。在本发明的其他实施方案中,500mg剂量的如本文所述的任何水性悬浮液作为两次1.5ml注射、两次2ml注射、两次2.5ml注射、两次3ml注射、两次3.5ml注射或两次4ml注射施用。在本发明的其他实施方案中,大于500mg,例如最多约3000mg氟维司群量剂量的如本文所述的任何水性悬浮液作为两次注射施用。例如,约525、550、575、600、625、650、675、700、725、750、775、800、825、850、875、900、925、950、975、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群量总剂量的如本文所述的任何水性悬浮液作为两次注射施用。在本发明的其他实施方案中,大于约500mg,例如最多约3000mg氟维司群量剂量的如本文所述的任何水性悬浮液作为约4.5ml、约5.0ml、约5.5ml、约6.0ml、约6.5ml、约7.0ml或约7.5ml的两次注射施用。在本发明的其他实施方案中,大于500mg,例如最多约3000mg氟维司群量剂量的如本文所述的任何水性悬浮液作为两次5ml注射施用。在本发明的其他实施方案中,大于500mg,例如最多约3000mg氟维司群量剂量的如本文所述的任何水性悬浮液作为两次1.5ml注射、两次2ml注射、两次2.5ml注射、两次3ml注射、两次3.5ml注射或两次4ml注射施用。在本发明的某些实施方案中,水性悬浮液作为两次注射施用,每次注射剂量为约500mg氟维司群,总剂量为约1000mg。在一些实施方案中,每次约500mg氟维司群剂量的两次注射各自为约5.0ml。在本发明的某些实施方案中,水性悬浮液作为两次注射施用,每次注射剂量为约550mg氟维司群,总剂量为约1100mg。在本发明的某些实施方案中,水性悬浮液作为两次注射施用,每次注射剂量为约600mg氟维司群,总剂量为约1200mg。在本发明的某些实施方案中,水性悬浮液作为两次注射施用,每次注射剂量为约650mg氟维司群,总剂量为约1300mg。在本发明的某些实施方案中,水性悬浮液作为两次注射施用,每次注射剂量为约700mg氟维司群,总剂量为约1400mg。在本发明的某些实施方案中,水性悬浮液作为两次注射施用,每次注射剂量为约750mg氟维司群,总剂量为约1500mg。在本发明的某些实施方案中,水性悬浮液作为两次注射施用,每次注射剂量为约800mg氟维司群,总剂量为约1600mg。在本发明的某些实施方案中,水性悬浮液作为两次注射施用,每次注射剂量为约850mg氟维司群,总剂量为约1700mg。在本发明的某些实施方案中,水性悬浮液作为两次注射施用,每次注射剂量为约900mg氟维司群,总剂量为约1800mg。在本发明的某些实施方案中,水性悬浮液作为两次注射施用,每次注射剂量为约950mg氟维司群,总剂量为约1900mg。在本发明的某些实施方案中,水性悬浮液作为两次注射施用,每次注射剂量为约1000mg氟维司群,总剂量为约2000mg。在本发明的某些实施方案中,水性悬浮液作为两次注射施用,每次注射剂量为约1100mg氟维司群,总剂量为约2200mg。在本发明的某些实施方案中,水性悬浮液作为两次注射施用,每次注射剂量为约1200mg氟维司群,总剂量为约2400mg。在本发明的某些实施方案中,水性悬浮液作为两次注射施用,每次注射剂量为约1300mg氟维司群,总剂量为约2600mg。在本发明的某些实施方案中,水性悬浮液作为两次注射施用,每次注射剂量为约1400mg氟维司群,总剂量为约2800mg。在本发明的某些实施方案中,水性悬浮液作为两次注射施用,每次注射剂量为约1500mg氟维司群,总剂量为约3000mg。在本发明的特定实施方案中,如本文所述的水性悬浮液作为三次或更多次注射施用。在本发明的其他实施方案中,500mg剂量的如本文所述的任何水性悬浮液作为三次或更多次注射施用。在本发明的其他实施方案中,500mg剂量的如本文所述的任何水性悬浮液作为三次或更多次5ml注射施用。在本发明的其他实施方案中,500mg剂量的如本文所述的任何水性悬浮液作为三次或更多次1.5ml注射、三次或更多次2ml注射、三次或更多次2.5ml注射、三次或更多次3ml注射、三次或更多次3.5ml注射或三次或更多次4ml注射施用。在本发明的其他实施方案中,大于500mg,例如最多约3000mg氟维司群量剂量的如本文所述的任何水性悬浮液作为三次或更多次注射施用,每次注射的氟维司群量相等。例如,约525、550、575、600、625、650、675、700、725、750、775、800、825、850、875、900、925、950、975、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900或约3000mg氟维司群量总剂量的如本文所述的任何水性悬浮液作为三次或更多次注射施用。在本发明的其他实施方案中,大于500mg,例如最多约3000mg氟维司群量剂量的如本文所述的任何水性悬浮液作为三次或更多次约4.5ml、约5.0ml、约5.5ml、约6.0ml、约6.5ml、约7.0ml或约7.5ml注射施用。在本发明的其他实施方案中,大于500mg,例如最多约3000mg氟维司群量剂量的如本文所述的任何水性悬浮液作为三次或更多次5ml注射施用。在本发明的其他实施方案中,大于500mg,例如最多约3000mg氟维司群量剂量的如本文所述的任何水性悬浮液作为三次或更多次1.5ml注射、三次或更多次2ml注射、三次或更多次2.5ml注射、三次或更多次3ml注射、三次或更多次3.5ml注射或三次或更多次4ml注射施用。在本发明的某些实施方案中,水性悬浮液作为三次或更多次注射施用,每次注射的氟维司群量相等,总剂量为约1000mg。在一些实施方案中,每次约500mg氟维司群剂量的两次注射各自为约5.0ml。在本发明的某些实施方案中,水性悬浮液作为三次或更多次注射施用,每次注射的氟维司群量相等,总剂量为约1100mg。在本发明的某些实施方案中,水性悬浮液作为三次或更多次注射施用,每次注射的氟维司群量相等,总剂量为约1200mg。在本发明的某些实施方案中,水性悬浮液作为三次或更多次注射施用,每次注射的氟维司群量相等,总剂量为约1300mg。在本发明的某些实施方案中,水性悬浮液作为三次或更多次注射施用,每次注射的氟维司群量相等,总剂量为约1400mg。在本发明的某些实施方案中,水性悬浮液作为三次或更多次注射施用,每次注射的氟维司群量相等,总剂量为约1500mg。在本发明的某些实施方案中,水性悬浮液作为三次或更多次注射施用,每次注射的氟维司群量相等,总剂量为约1600mg。在本发明的某些实施方案中,水性悬浮液作为三次或更多次注射施用,每次注射的氟维司群量相等,总剂量为约1700mg。在本发明的某些实施方案中,水性悬浮液作为三次或更多次注射施用,每次注射的氟维司群量相等,总剂量为约1800mg。在本发明的某些实施方案中,水性悬浮液作为三次或更多次注射施用,每次注射的氟维司群量相等,总剂量为约1900mg。在本发明的某些实施方案中,水性悬浮液作为三次或更多次注射施用,每次注射的氟维司群量相等,总剂量为约2000mg。在本发明的某些实施方案中,水性悬浮液作为三次或更多次注射施用,每次注射的氟维司群量相等,总剂量为约2200mg。在本发明的某些实施方案中,水性悬浮液作为三次或更多次注射施用,每次注射的氟维司群量相等,总剂量为约2400mg。在本发明的某些实施方案中,水性悬浮液作为三次或更多次注射施用,每次注射的氟维司群量相等,总剂量为约2600mg。在本发明的某些实施方案中,水性悬浮液作为三次或更多次注射施用,每次注射的氟维司群量相等,总剂量为约2800mg。在本发明的某些实施方案中,水性悬浮液作为三次或更多次注射施用,每次注射的氟维司群量相等,总剂量为约3000mg。本文所述的水性悬浮液可以单独施用,或与本文所定义的一种或多种另外的治疗剂组合施用。可以使用另外的治疗剂来治疗与总体上的癌症或特别是乳腺癌相关的一种或多种核心症状和/或合并症。一方面,氟维司群与至少一种治疗剂一起以固定剂量配制(和施用)。在另一方面,氟维司群与治疗剂分开配制(和施用)。可以与水性悬浮液组合使用的治疗剂的一些实例包括但不限于例如egfr激酶抑制剂、pdgfr激酶抑制剂、fgfr激酶抑制剂或任何其他细胞毒性、化学治疗、抗激素、抗血管生成、抗增殖、促凋亡、抗her2、放射或放射性药物、信号转导抑制剂或其他抗癌药或治疗。可以与本公开的水性悬浮液组合使用的特定药剂的实例包括帕博西尼、来曲唑、阿那曲唑、阿霉素、紫杉醇、多西他赛、长春瑞滨和5-氟尿嘧啶。在其他实施方案中,可以与水性悬浮液组合使用的治疗剂包括但不限于针对疼痛、恶心、呕吐、潮热、便秘和头晕中的一种或多种的药剂或治疗。剂量施用方法在本发明的某些实施方案中,本文所述的水性悬浮液可以分多剂施用。在本发明的一些实施方案中,可以在第1天施用第一剂氟维司群量的第一剂。在本发明的其他实施方案中,可以在第一剂之后的第一时间段之后施用第二剂氟维司群量的第二剂。在本发明的其他实施方案中,可以在第二剂之后的第二时间段之后施用第三剂氟维司群量的另外一剂或多剂并以每第三时间段一剂的频率重复。在本发明的一些实施方案中,本文所述的多剂施用可以用于本发明的治疗乳腺癌的方法。在本发明的一些实施方案中,第一剂氟维司群量可以是约500mg至约3000mg、约500mg至约1500mg、约750mg至约1500mg、约750mg至约1250mg、约750mg至约1000mg、约800mg至约1200mg、约850mg至约1150mg、约900mg至约1100mg或约950mg至约1050mg。在本发明的其他实施方案中,第一剂氟维司群量可以是约500mg、约550mg、约600mg、约650mg、约700mg、约750mg、约800mg、约850mg、约900mg、约950mg、约1000mg、约1050mg、约1100mg、约1150mg、约1200mg、约1250mg、约1300mg、约1350mg、约1400mg、约1450mg、约1500mg、约1550mg、约1600mg、约1650mg、约1700mg、约1750mg、约1800mg、约1850mg、约1900mg、约1950mg、约2000mg、约2050mg、约2100mg、约2150mg、约2200mg、约2250mg、约2300mg、约2350mg、约2400mg、约2450mg、约2500mg、约2550mg、约2600mg、约2650mg、约2700mg、约2750mg、约2800mg、约2850mg、约2900mg、约2950mg或约3000mg。在本发明的一些实施方案中,第二剂氟维司群量可以是约500mg至约3000mg、约500mg至约1500mg、约750mg至约1500mg、约750mg至约1250mg、约750mg至约1000mg、约800mg至约1200mg、约850mg至约1150mg、约900mg至约1100mg或约950mg至约1050mg。在本发明的其他实施方案中,第二剂氟维司群量可以是约500mg、约550mg、约600mg、约650mg、约700mg、约750mg、约800mg、约850mg、约900mg、约950mg、约1000mg、约1050mg、约1100mg、约1150mg、约1200mg、约1250mg、约1300mg、约1350mg、约1400mg、约1450mg、约1500mg、约1550mg、约1600mg、约1650mg、约1700mg、约1750mg、约1800mg、约1850mg、约1900mg、约1950mg、约2000mg、约2050mg、约2100mg、约2150mg、约2200mg、约2250mg、约2300mg、约2350mg、约2400mg、约2450mg、约2500mg、约2550mg、约2600mg、约2650mg、约2700mg、约2750mg、约2800mg、约2850mg、约2900mg、约2950mg或约3000mg。在本发明的一些实施方案中,第三剂氟维司群量可以是约500mg至约3000mg、约500mg至约1500mg、约750mg至约1500mg、约750mg至约1250mg、约750mg至约1000mg、约800mg至约1200mg、约850mg至约1150mg、约900mg至约1100mg或约950mg至约1050mg。在本发明的其他实施方案中,第三剂氟维司群量可以是约500mg、约550mg、约600mg、约650mg、约700mg、约750mg、约800mg、约850mg、约900mg、约950mg、约1000mg、约1050mg、约1100mg、约1150mg、约1200mg、约1250mg、约1300mg、约1350mg、约1400mg、约1450mg、约1500mg、约1550mg、约1600mg、约1650mg、约1700mg、约1750mg、约1800mg、约1850mg、约1900mg、约1950mg、约2000mg、约2050mg、约2100mg、约2150mg、约2200mg、约2250mg、约2300mg、约2350mg、约2400mg、约2450mg、约2500mg、约2550mg、约2600mg、约2650mg、约2700mg、约2750mg、约2800mg、约2850mg、约2900mg、约2950mg或约3000mg。在本发明的某些实施方案中,第一剂之后到可以施用第二剂时的第一时间段可以是约1天至约30天、约5天至约25天、约10天至约20天、约10天至约15天、约12天至约16天或约13天至约15天。在本发明的某些实施方案中,第一剂之后到可以施用第二剂时的第一时间段可以是约1天、约2天、约3天、约4天、约5天、约6天、约7天、约8天、约9天、约10天、约11天、约12天、约13天、约14天、约15天、约16天、约17天、约18天、约19天、约20天、约21天、约22天、约23天、约24天、约25天、约26天、约27天、约28天、约29天或约30天。在本发明的某些实施方案中,第二剂之后到可以施用另外一剂或多剂中的第一个时的第二时间段可以是约1天至约30天、约5天至约25天、约10天至约20天、约10天至约15天、约12天至约16天或约13天至约15天。在本发明的其他实施方案中,第二剂之后到可以施用另外一剂或多剂中的第一个时的第二时间段可以是约1天、约2天、约3天、约4天、约5天、约6天、约7天、约8天、约9天、约10天、约11天、约12天、约13天、约14天、约15天、约16天、约17天、约18天、约19天、约20天、约21天、约22天、约23天、约24天、约25天、约26天、约27天、约28天、约29天或约30天。在本发明的一些实施方案中,所述另外一剂或多剂可以以每第三时间段一剂的频率重复施用,所述第三时间段可以是约1天至约180天、约1天至约150天、约1天至约120天、约1天至约90天、约60天至约90天、约75天至约90天、约30天至约60天、约45天至约60天、约45天至约75天、约50天至约70天、约55天至约65天、约10天至约50天、约15天至约45天、约20天至约40天、约25天至约35天、约5天至约35天、约10天至约30天、约15天至约25天、约1周至约12周、约6周至约12周、约7周至约12周、约8周至约12周、约9周至约12周、约10周至约12周、约11周至约12周、约4周至约10周、约5周至约10周、约6周至约10周、约7周至约10周、约8周至约10周、约9周至约10周、约2周至约8周、约3周至约8周、约4周至约8周、约5周至约8周、约6周至约8周、约7周至约8周、约1周至约6周、约2周至约6周、约3周至约6周、约4周至约6周、约5周至约6周、约1周至约4周、约2周至约4周、约3周至约4周、约1周至约3周、约2周至约3周、约1个月至约3个月、约2个月至约3个月、约1.5个月至2.5个月、约1.5个月至3.5个月、约2.0个月至约3.5个月或约2.0个月至约2.5个月。在本发明的其他实施方案中,所述另外一剂或多剂可以以每第三时间段一剂的频率重复施用,所述第三时间段可以是约1天、约2天、约3天、约4天、约5天、约6天、约7天、约8天、约9天、约10天、约11天、约12天、约13天、约14天、约15天、约16天、约17天、约18天、约19天、约20天、约21天、约22天、约23天、约24天、约25天、约26天、约27天、约28天、约29天、约30天、约31天、约32天、约33天、约34天、约35天、约36天、约37天、约38天、约39天、约40天、约41天、约42天、约43天、约44天、约45天、约46天、约47天、约48天、约49天、约50天、约51天、约52天、约53天、约54天、约55天、约56天、约57天、约58天、约59天、约60天、约61天、约62天、约63天、约64天、约65天、约66天、约67天、约68天、约69天、约70天、约71天、约72天、约73天、约74天、约75天、约76天、约77天、约78天、约79天、约80天、约81天、约82天、约83天、约84天、约85天、约86天、约87天、约88天、约89天、约90天、约1个月、约1.5个月、约2个月、约2.5个月、约3个月或约3.5个月。在本发明的一些实施方案中,可以在第1天施用第一剂氟维司群量的第一剂。在本发明的其他实施方案中,可以在第一剂之后的第一时间段之后施用第二剂氟维司群量的第二剂。在本发明的其他实施方案中,可以在第二剂之后的第二时间段之后施用第三剂氟维司群量的另外一剂或多剂并以每第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约550mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约550mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约2个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约600mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约600mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约2个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约650mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约650mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约2个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约700mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约700mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约2个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约750mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约750mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约2个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约800mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约800mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约2个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约850mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约850mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约2个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约900mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约900mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约2个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约950mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约950mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约2个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1000mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1000mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约2个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1050mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1050mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约2个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1100mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1100mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约2个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1150mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1150mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约2个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1200mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1200mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约2个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1250mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1250mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约2个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约550mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约550mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约1个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约600mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约600mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约1个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约650mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约650mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约1个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约700mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约700mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约1个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约750mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约750mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约1个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约800mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约800mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约1个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约850mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约850mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约1个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约900mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约900mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约1个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约950mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约950mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约1个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1000mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1000mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约1个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1050mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1050mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约1个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1100mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1100mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约1个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1150mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1150mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约1个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1200mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1200mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约1个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1250mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1250mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约1个月的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约550mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约550mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约4周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约600mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约600mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约4周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约650mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约650mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约4周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约700mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约700mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约4周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约750mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约750mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约4周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约800mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约800mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约4周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约850mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约850mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约4周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约900mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约900mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约4周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约950mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约950mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约4周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1000mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1000mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约4周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1050mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1050mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约4周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1100mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1100mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约4周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1150mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1150mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约4周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1200mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1200mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约4周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1250mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1250mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约4周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约550mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约550mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约6周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约600mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约600mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约6周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约650mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约650mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约6周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约700mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约700mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约6周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约750mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约750mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约6周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约800mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约800mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约6周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约850mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约850mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约6周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约900mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约900mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约6周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约950mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约950mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约6周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1000mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1000mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约6周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1050mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1050mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约6周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1100mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1100mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约6周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1150mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1150mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约6周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1200mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1200mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约6周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1250mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1250mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约6周的第三时间段一剂的频率重复。在本发明的一些实施方案中,在本发明的一些实施方案中,可以在第1天施用约550mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约550mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约8周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约600mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约600mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约8周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约650mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约650mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约8周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约700mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约700mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约8周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约750mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约750mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约8周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约800mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约800mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约8周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约850mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约850mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约8周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约900mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约900mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约8周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约950mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约950mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约8周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1000mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1000mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约8周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1050mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1050mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约8周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1100mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1100mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约8周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1150mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1150mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约8周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1200mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1200mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约8周的第三时间段一剂的频率重复。在本发明的一些实施方案中,可以在第1天施用约1250mg第一剂氟维司群量的第一剂,可以在第一剂之后约14天的第一时间段之后施用约1250mg第二剂氟维司群量的第二剂,可以在第二剂之后约14天的第二时间段之后施用约500mg第三剂氟维司群量的另外一剂或多剂并以每约8周的第三时间段一剂的频率重复。不溶解的氟维司群粒子在本发明的某些实施方案中,不溶解的氟维司群粒子具有通过激光衍射测量的大于或等于约1微米的直径。在本发明的又一个实施方案中,至少一部分不溶解的氟维司群粒子的激光衍射直径小于约1微米。在本发明的其他实施方案中,不溶解的氟维司群粒子具有大于或等于约2微米的激光衍射直径。在本发明的其他实施方案中,至少一部分不溶解的氟维司群粒子的激光衍射直径小于约2微米。在本发明的某些实施方案中,不溶解的氟维司群粒子具有大于或等于约0.5微米的激光衍射直径。在本发明的其他实施方案中,至少一部分不溶解的氟维司群粒子的激光衍射直径小于约0.5微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的激光衍射直径大于或等于约1微米。在本发明的其他实施方案中,至少一部分不溶解的氟维司群粒子的激光衍射直径小于约1微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的激光衍射直径大于或等于约1.5微米。在本发明的其他实施方案中,至少一部分不溶解的氟维司群粒子的激光衍射直径小于约1.5微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的激光衍射直径大于或等于约2微米。在本发明的其他实施方案中,至少一部分不溶解的氟维司群粒子的激光衍射直径小于约2微米。在本发明的其他实施方案中,约98%的不溶解的氟维司群粒子具有大于或等于约0.5微米的激光衍射直径。在本发明的其他实施方案中,约98%的不溶解的氟维司群粒子具有大于或等于约1微米的激光衍射直径。在本发明的其他实施方案中,约98%的不溶解的氟维司群粒子具有大于或等于约1.5微米的激光衍射直径。在本发明的其他实施方案中,约98%的不溶解的氟维司群粒子具有大于或等于约2微米的激光衍射直径。在本发明的某些实施方案中,不溶解的氟维司群粒子的lddv(90)为约4微米至约120微米、约4微米至约100微米、约4微米至约75微米、约4微米至约60微米、约4微米至约50微米、约4微米至约40微米、约4微米至约30微米、约4微米至约20微米、约4微米至约15微米、约4微米至约10微米、约15微米至约35微米、约20微米至约60微米、约20微米至约45微米、约20微米至约30微米、约30微米至约50微米或约4微米至约9微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的lddv(90)等于约4微米、约5微米、约6微米、约7微米、约8微米、约9微米、约10微米、约11微米、约12微米、约13微米、约14微米、约15微米、约16微米、约17微米、约18微米、约19微米、约20微米、约25微米、约30微米、约35微米、约40微米、约45微米、约50微米、约55微米、约60微米、约65微米、约70微米、约75微米、约80微米、约85微米、约90微米、约95微米、约100微米、约105微米、约110微米、约115微米或约120微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的lddv(90)小于或等于约120微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的lddv(90)小于或等于约100微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的lddv(90)小于或等于约80微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的lddv(90)小于或等于约60微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的lddv(90)小于或等于约50微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的lddv(90)小于或等于约40微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的lddv(90)小于或等于约30微米。在本发明的其他实施方案中,粒子的lddv(90)小于或等于约25微米。在本发明的其他实施方案中,粒子的lddv(90)小于或等于约18微米。在本发明的其他实施方案中,粒子的lddv(90)小于或等于约16微米。在本发明的其他实施方案中,粒子的lddv(90)小于或等于约14微米。在本发明的其他实施方案中,粒子的lddv(90)小于或等于约11微米。在本发明的其他实施方案中,粒子的lddv(90)小于或等于约9微米。在本发明的其他实施方案中,粒子的lddv(90)小于或等于约7微米。在本发明的其他实施方案中,粒子的lddv(90)小于或等于约5微米。在本发明的特定实施方案中,粒子的lddv(90)为约9-14微米。在本发明的其他实施方案中,粒子的lddv(90)为约12-14微米。在本发明的其他实施方案中,粒子的lddv(90)为约9-11微米。在本发明的其他实施方案中,粒子的lddv(90)为约7-9微米。在本发明的其他实施方案中,粒子的lddv(90)为约6-8微米。在本发明的其他实施方案中,粒子的lddv(90)为约6-7微米。在本发明的其他实施方案中,粒子的lddv(90)为约3-6微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的lddv(50)为约2微米至约35微米、约2微米至约25微米、约2微米至约20微米、约2微米至约15微米、约2微米至约10微米、约2微米至约8微米、约2微米至约7微米、约2微米至约6微米、约2微米至约5微米、约2微米至约4微米、约5微米至约10微米、约5.5微米至约9.0微米、约5微米至约15微米、约7微米至约10微米、约8微米至约10微米,或为约9微米至约16微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的lddv(50)等于约2微米、3微米、4微米、约5微米、约6微米、约7微米、约8微米、约9微米、约10微米、约11微米、约12微米、约13微米、约14微米、约15微米、约16微米、约17微米、约18微米、约19微米、约20微米、约25微米、约30微米或约35微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的lddv(50)小于或等于约9微米。在本发明的其他实施方案中,粒子的lddv(50)小于或等于约7微米。在本发明的其他实施方案中,粒子的lddv(50)小于或等于约6微米。在本发明的其他实施方案中,粒子的lddv(50)小于或等于约5微米。在本发明的特定实施方案中,粒子的lddv(50)小于或等于约4微米。在本发明的其他实施方案中,粒子的lddv(50)小于或等于约3微米。在本发明的其他实施方案中,粒子的lddv(50)为约4-6微米。在本发明的其他实施方案中,粒子的lddv(50)为约3-5微米。在本发明的其他实施方案中,粒子的lddv(50)为约3-4微米。在本发明的其他实施方案中,粒子的lddv(50)为约2-3微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的lddv(10)不超过约3微米、约2微米或约1微米。在本发明的其他实施方案中,粒子的lddv(10)为约1微米至约3微米。在本发明的其他实施方案中,粒子的lddv(10)大于或等于约2微米。在本发明的其他实施方案中,粒子的lddv(10)为约1.5微米至约2.5微米。在其他实施方案中,粒子的lddv(10)为约1.5微米至约2.1微米。在本发明的其他实施方案中,粒子的lddv(10)为约1微米至约2微米。在本发明的其他实施方案中,粒子的lddv(10)为约1.0微米至约1.5微米。在本发明的某些实施方案中,粒子的lddv(10)为约2微米。在本发明的某些实施方案中,粒子的lddv(10)为约1.5微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的lddv(90)小于或等于约25微米,lddv(50)小于或等于约9微米。在本发明的特定实施方案中,粒子的lddv(90)小于或等于约16微米,lddv(50)小于或等于约6微米。在本发明的其他实施方案中,粒子的lddv(90)小于或等于约11微米,lddv(50)小于或等于约5微米。在本发明的其他实施方案中,粒子的lddv(90)小于或等于约9微米,lddv(50)小于或等于约4微米。在本发明的其他实施方案中,粒子的lddv(90)小于或等于约8微米,lddv(50)小于或等于约4微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的lddv(90)为约9-14微米,lddv(50)为约4-6微米。在本发明的某些实施方案中,粒子的lddv(90)为约9-11微米,lddv(50)为约4-6微米。在本发明的特定实施方案中,粒子的lddv(90)为约12-14微米,lddv(50)为约4-6微米。在本发明的其他实施方案中,粒子的lddv(90)为约6-8微米,lddv(50)为约2-4微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的激光衍射直径大于或等于约1微米。在本发明的其他实施方案中,至少一部分不溶解的氟维司群粒子的激光衍射直径小于约1微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的激光衍射直径大于或等于约2微米。在本发明的某些实施方案中,至少一部分不溶解的氟维司群粒子的激光衍射直径小于约2微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的lddv(90)为约9-14微米,lddv(50)为约4-6微米,lddv(10)为约2-3微米。在本发明的其他实施方案中,粒子的lddv(90)为约9-11微米,lddv(50)为约4-6微米,lddv(10)为约2-3微米。在本发明的其他实施方案中,粒子的lddv(90)为约12-14微米,lddv(50)为约4-6微米,lddv(10)为约2-3微米。在本发明的其他实施方案中,粒子的lddv(90)为约6-9微米,lddv(50)为约2-4微米,lddv(10)为约1-2微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的激光衍射直径大于或等于约1微米。在本发明的其他实施方案中,至少一部分不溶解的氟维司群粒子的激光衍射直径小于约1微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的激光衍射直径大于或等于约2微米。在本发明的某些实施方案中,至少一部分不溶解的氟维司群粒子的激光衍射直径小于约2微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的lddv(90)为约9-14微米,lddv(50)为约4-6微米,lddv(10)为约2-3微米,不溶解的氟维司群粒子的激光衍射直径大于或等于约1微米。在本发明的其他实施方案中,粒子的lddv(90)为约9-14微米,lddv(50)为约4-6微米,lddv(10)为约2-3微米,至少一部分不溶解的氟维司群粒子的激光衍射直径小于约1微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的lddv(90)为约30微米至约110微米,lddv(50)为约5微米至约30微米,lddv(10)为约1.5微米至约3微米。在本发明的其他实施方案中,粒子的lddv(90)为约9-14微米,lddv(50)为约4-6微米,lddv(10)为约2-3微米,不溶解的氟维司群粒子的激光衍射直径大于或等于约2微米。在本发明的某些实施方案中,粒子的lddv(90)为约9-14微米,lddv(50)为约4-6微米,lddv(10)为约2-3微米,至少一部分不溶解的氟维司群粒子的激光衍射直径小于约2微米。在本发明的其他实施方案中,粒子的lddv(90)为约6-9微米,lddv(50)为约2-4微米,lddv(10)为约1-2微米,不溶解的氟维司群粒子的激光衍射直径大于或等于约0.5微米。在本发明的其他实施方案中,粒子的lddv(90)为约6-9微米,lddv(50)为约2-4微米,lddv(10)为约1-2微米,至少一部分不溶解的氟维司群粒子的激光衍射直径小于约0.5微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的激光衍射直径大于或等于约1微米。在本发明的其他实施方案中,至少一部分不溶解的氟维司群粒子的激光衍射直径小于约1微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的激光衍射直径大于或等于约2微米。在本发明的某些实施方案中,至少一部分不溶解的氟维司群粒子的激光衍射直径小于约2微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的lddv(90)为约15微米至约35微米,lddv(50)为约5.5微米至约9.0微米,lddv(10)为约1.5微米至约2.1微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的超声处理的lddv(10)为约0.9微米至约1.5微米、约1.0微米至约1.2微米或约1.0微米至约1.3微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的超声处理的lddv(10)等于约0.9微米、1.0微米、1.1微米、约1.2微米、约1.3微米、约1.4微米或约1.5微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的超声处理的lddv(50)为约2.5微米至约5.0微米、约2.5微米至约4.5微米、约2.5微米至约3.5微米、约3.0微米至约4.0微米或约3.0微米至约3.5微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的超声处理的lddv(50)等于约2.5微米、2.6微米、2.7微米、约2.8微米、约2.9微米、约3.0微米、约3.1微米、约3.2微米、约3.3微米、约3.4微米、约3.5微米、约3.6微米、约3.7微米、约3.8微米、约3.9微米、约4.0微米、约4.1微米、约4.2微米、约4.3微米、约4.4微米、约4.5微米或约5.0微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的超声处理的lddv(90)为约6.0微米至约10.0微米、约6.5微米至约9.0微米、约6.0微米至约9.0微米、约6.5微米至约7.5微米或约6.5微米至约8.5微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的超声处理的lddv(90)等于约6.0微米、6.5微米、7.0微米、约7.5微米、约8.0微米、约8.5微米、约9.0微米、约9.5微米或约10.0微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的超声处理的lddv(90)等于约6.1、6.2、6.3、6.4、6.6、6.7、6.8、6.9、7.1、7.2、7.3、7.4、7.6、7.7、7.8、7.9、8.1、8.2、8.3或约8.4微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的超声处理的lddv(10)为约1.0至约1.2微米,超声处理的lddv(50)为约3.0至约4.0微米,超声处理的lddv(90)为约6微米至约9微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的cedv(10)为约1微米至约25微米、约2微米至约25微米、约3微米至约7微米、约4微米至约15微米、约4微米至约10微米、约4微米至约8微米、约6微米至约8微米、约6微米至约7微米、约1微米至约10微米、约3微米至约6微米或约3.5微米至约5.2微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的cedv(10)等于约1微米、约2微米、约3微米、约4微米、约5微米、约6微米、约7微米、约8微米、约9微米、约10微米、约11微米、约12微米、约13微米、约14微米、约15微米、约16微米、约17微米、约18微米、约19微米、约20微米、约21微米、约22微米、约23微米、约24微米或约25微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的cedv(50)为约5微米至约60微米、约5微米至约50微米、约9微米至约20微米、约9微米至约15微米、约10微米至约50微米、约10微米至约40微米、约10微米至约30微米、约10微米至约20微米、约15微米至约30微米、约15微米至约25微米、约15微米至约20微米、约10微米至约15微米、约8微米至约15微米、约7.0微米至约16.0微米或约7.8微米至约14.9微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的cedv(50)等于约5微米、约6微米、约7微米、约8微米、约9微米、约10微米、约11微米、约12微米、约13微米、约14微米、约15微米、约16微米、约17微米、约18微米、约19微米、约20微米、约21微米、约22微米、约23微米、约24微米、约25微米、约30微米、约35微米、约40微米、约45微米、约50微米、约55微米或约60微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的cedv(90)为约10微米至约200微米、约25微米至约150微米、约25微米至约125微米、约25微米至约100微米、约20微米至约90微米、约23.3至约85.3微米、约25微米至约75微米、约25微米至约50微米、约25微米至约40微米、约25微米至约35微米、约35微米至约90微米、约35微米至约75微米、约35微米至约50微米、约35微米至约45微米、约50微米至约100微米、约50微米至约75微米或约20微米至约40微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的cedv(90)等于约10微米、约15微米、约20微米、约25微米、约30微米、约35微米、约40微米、约45微米、约50微米、约55微米、约60微米、约65微米、约70微米、约75微米、约80微米、约85微米、约90微米、约95微米、约100微米、约105微米、约110微米、约115微米、约120微米、约125微米、约130微米、约135微米、约140微米、约145微米、约150微米、约155微米、约160微米、约165微米、约170微米、约175微米或约200微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的cedv(90)为约35微米至约90微米,cedv(50)为约10微米至约35微米,cedv(10)为约4微米至约10微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的cedv(90)为约25微米至约60微米,cedv(50)为约10微米至约25微米,cedv(10)为约4微米至约8微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的cedv(90)为约20微米至约35微米,cedv(50)为约10微米至约20微米,cedv(10)为约4微米至约8微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的cedv(90)为约30微米至约100微米,cedv(50)为约10微米至约50微米,cedv(10)为约4微米至约10微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的cedv(90)为约50微米至约100微米,cedv(50)为约20微米至约50微米,cedv(10)为约6微米至约8微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的cedv(90)为约50微米至约75微米,cedv(50)为约30微米至约40微米,cedv(10)为约8微米至约10微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的cedv(90)为约20微米至约60微米,cedv(50)为约9微米至约20微米,cedv(10)为约3微米至约7微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的cedv(90)为约20微米至约50微米,cedv(50)为约9微米至约20微米,cedv(10)为约3微米至约7微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的cedv(90)为约20微米至约45微米,cedv(50)为约9微米至约20微米,cedv(10)为约3微米至约7微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的cedv(90)为约20微米至约40微米,cedv(50)为约9微米至约15微米,cedv(10)为约3微米至约7微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的cedv(90)为约20微米至约35微米,cedv(50)为约9微米至约15微米,cedv(10)为约3微米至约7微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的cedv(90)为约20微米至约45微米,cedv(50)为约9微米至约15微米,cedv(10)为约3微米至约7微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的cedv(10)为约3.0微米至约6.0微米,cedv(50)为约7.0微米至约16.0微米,cedv(90)为约20微米至约90微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的cedv(10)为约3.5微米至约5.2微米,cedv(50)为约7.8微米至约14.9微米,cedv(90)为约23.3至约85.3微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的cedn(90)为约4微米至约20微米、约6微米至约15微米、约6微米至约12微米、约8微米至约12微米、约8微米至约11微米、约4微米至约10微米、约4微米至约8微米、约4微米至约7微米或为约4微米至约6微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的cedn(90)等于约4微米、约5微米、约6微米、约7微米、约8微米、约9微米、约10微米、约11微米、约12微米、约13微米、约14微米、约15微米、约16微米、约17微米、约18微米、约19微米或约20微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的cedn(50)为约2.0微米至约10.0微米、约2.0微米至约8.0微米、约2.0微米至约6.0微米、约2.0微米至约5.0微米、约3.0微米至约5.0微米、约3.5微米至约4.5微米、约2.0微米至约4.0微米、约2.5微米至约4.5微米或约2.5微米至约3.5微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的cedn(50)等于约2.0微米、约2.5微米、约3.0微米、约3.5微米、约4.0微米、约4.5微米、约5.0微米、约5.5微米、约6.0微米、约6.5微米、约7.0微米、约7.5微米、约8.0微米、约8.5微米、约9.0微米、约9.5微米或约10.0微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的cedn(10)为约0.5微米至约2.0微米、约0.5微米至约1.5微米、约1.0微米至约1.5微米、约0.8微米至约1.2微米、约0.9微米至约1.1微米或约0.5微米至约1.0微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的cedn(10)等于约0.5、约0.6、约0.7、约0.8、约0.9、约1.0、约1.1、约1.2、约1.3、约1.4、约1.5、约1.6、约1.7、约1.8、约1.9或约2.0微米。在本发明的某些实施方案中,不溶解的氟维司群粒子的cedn(90)为约4微米至约20微米,cedn(50)为约2.0微米至约10.0微米,cedn(10)为约0.5微米至约2.0微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的cedn(90)为约6微米至约12微米,cedn(50)为约2.0微米至约6.0微米,cedn(10)为约0.5微米至约1.5微米。在本发明的其他实施方案中,不溶解的氟维司群粒子的cedn(90)为约8微米至约1微米,cedn(50)为约3.0微米至约5.0微米,cedn(10)为约0.8微米至约1.2微米。本领域技术人员将理解,可以对本公开的优选实施方案进行多种改变和修改,并且可以在不脱离本公开的精神的情况下进行这样的改变和修改。因此,预期以下实施例和权利要求覆盖落入本公开的真实精神和范围内的所有此类等同变化。本文件中引用或描述的每个专利、专利申请和出版物的公开内容均通过引用全文结合于此。实施例实施例1:分析方法在一些方面,通过hplc分析测量水性悬浮液中溶解的氟维司群的量。使用0.2微米pvdf25mm针筒式过滤器过滤水性悬浮液以去除微粒,并将过滤后的样品直接注入hplc设备进行分析。用安捷伦科技公司(agilenttechnologies)的安捷伦1260infinity四元液相色谱模块g1311b(加利福尼亚州圣克拉拉的安捷伦科技公司)进行hplc。其他hplc仪器也可以用于分析溶解的氟维司群浓度。在一些方面,使用马尔文mastersizer3000(英国伍斯特郡马尔文的马尔文仪器有限公司(malverninstrumentsltd.,malvern,worcestershire,uk)),通过激光衍射分析粒度和粒度分布。复溶的悬浮液按原样进行分析,或先使用附带的样品分散单元和在线超声探头进行超声处理,再通过激光衍射进行分析。在一些方面,使用马尔文morphologig3(英国伍斯特郡马尔文的马尔文仪器有限公司),通过显微镜图像捕获和分析确定圆当量(ce)直径来分析粒度和粒度分布。测量ce直径,并确定体积加权的粒度分布参数。实施例2:氟维司群水性悬浮液的体外分析制备冻干的氟维司群药物制剂的测试瓶,其由以下组成:氟维司群,500mg;聚山梨酸酯80,25mg;甘露醇,250mg;和plasdonetmc-12聚维酮,8.0mg,从包含以下的悬浮液冻干:氟维司群(usp):100mg/ml;聚山梨酸酯80(nf):0.5%(w/w);甘露醇(usp):5.0%(w/w);plsdonetmc-12(nf)(平均mw=4000):0.16%(w/w)。对用不同的水性稀释剂制备的水性悬浮液进行了体外分析。通过将水性稀释剂缓慢注入测试瓶中并用手轻轻摇动小瓶五分钟以混合悬浮液来制备水性悬浮液。如以下表3-8所示,分析了粒度、粒度分布和氟维司群溶解度。实施例3:对大鼠肌内施用的药代动力学研究用新型复溶氟维司群悬浮液在大鼠中进行了单剂量肌内药代动力学研究。每组十只雌性sprague-dawley[crl:(sd)]大鼠每只大鼠接受到左后肢大肌中的15mg/kg新颖复溶氟维司群悬浮液或(参照剂)的单次肌内(im)快速推注给药。新颖复溶悬浮液的剂量体积为0.15ml/kg。的剂量体积为0.3ml/kg。基于体表面积,15mg/kg约为人推荐剂量500mg/人/月的三分之一。在研究第1天(给药日),大鼠为至少10-13周龄,体重为233-282g。新颖复溶氟维司群悬浮液是从由以下组成的冻干药品制成:氟维司群,500mg;聚山梨酸酯80,25mg;甘露醇,250mg和plasdonetmc-12聚维酮,8.0mg,从包含以下的悬浮液冻干:氟维司群(usp):100mg/ml;聚山梨酸酯80(nf):0.5%(w/w);甘露醇(usp):5.0%(w/w);plasdonetmc-12(nf)(平均mw=4000):0.16%(w/w),在表9中称为“测试产品”。施用之前,冻干药品瓶用下表9中所示的稀释剂复溶。市售制剂按原样使用,据报道其含有10%w/v乙醇(usp);10%w/v苯甲醇(nf);和15%w/v苯甲酸苯甲酯(usp),以及补足至100%w/v的蓖麻油(usp)。所有大鼠的采血时间点是给药前和给药后1小时、3小时、6小时、12小时、24小时、48小时、72小时、120小时、168小时、216小时、288小时、360小时、432小时、576小时、720小时、888小时、1056小时和1224小时。从血液样本中获取血浆,并使用合格的测定法分析氟维司群浓度。制剂的选择是基于给药后720小时(30天)的药代动力学数据,基于已捕获到终末消除阶段的足够部分。使用模型无关方法对每只动物和每组计算药代动力学参数,包括最大观测血浆浓度(cmax)、最大观测血浆浓度时间(tmax)、从给药时推算到无穷大的平均停留时间(mrtinf)、调整后的rsq(r2)以及血浆浓度-时间曲线下面积(auc)。对于具有至少三个连续可定量浓度的所有动物使用线性梯形法。报告了每个血浆浓度-时间曲线的半衰期值(t1/2),这些曲线在终末消除阶段具有足够的血浆浓度(至少三个样品不包括tmax)。其他评估包括每日临床观察和每周体重。下表10中示出了第6组稀释剂10(5ml体积)和的平均药代动力学参数。下表11中示出了第5-13组的auc参数。第1组、第2组、第3组、第5组、第6组、第7组和第8组的血浆浓度在图1中以图形示出。实施例4:人肌内施用的药代动力学研究用新颖复溶氟维司群悬浮液在人受试者中进行了单剂量肌内药代动力学研究。600名健康女性受试者接受了到左或右臀大肌区域的复溶氟维司群悬浮液或(参照剂)的单次肌内(im)给药,以1:1的比例随机分配到治疗组中。所述研究是在40至75岁的围绝经期和绝经后健康女性受试者中进行的,其体重指数为18kg/m2至32kg/m2,筛选时体重至少为50kg。大约一半的受试者是围绝经期的,另一半是绝经后的。随机绝经后受试者中至少有20%≥65岁。在接受测试产品的受试者中,在第1天,将含有500mg(100mg/ml)氟维司群的复溶悬浮液,1×5ml(500mg)在1分钟内注射到右或左臀大肌区域1。其他受试者在第一天接受在每个装有2个预装注射器的纸盒供应的市售的(250mg/5ml),在1到2分钟内将其缓慢注射到左右臀大肌区域,作为2次5ml(500mg)注射。在给药前(给药前60分钟[min]内)以及第1天给药后第3小时、第6小时、12小时,以及第2天、第3天、第4天、第5天、第6天、第7天、第8天、第9天、第10天、第12天、第15天、第18天、第21天、第28天、第35天、第42天、第49天、第56天、第63天、第70天、第77天、第84天、第98天、第112天、第126天和第140天收集血样进行氟维司群的pk分析。从第2天至第10天收集的所有pk样本在第1天给药时间的1小时内,第12天至第21天在给药时间的3小时内,第28天至84天在给药时间的4小时内,以及第98天至第140天±1天但在给药时间的6小时内获得。收获血浆,并使用经验证的液相色谱-串联质谱法分析氟维司群浓度。1在其他方面,在接受测试产品的受试者中,在第1天将含有大于500mg,例如至多约3000mg氟维司群的复溶悬浮液注射到右或左大臀肌区域。研究中的测试产品以小瓶提供,需要用稀释剂复溶。用5ml所提供的稀释剂复溶以在水性悬浮液中获得100mg/ml的氟维司群浓度之后,在第1天,用23号针头(1.5英寸长)将单次5ml(500mg)剂量肌内施用到右或左臀大肌区域(由研究者选择)2。在制备后的2小时内注射复溶产品。将测试产品冷藏(2-8℃)。2在其他方面,在用所提供的稀释剂复溶以在水性悬浮液中获得100mg/ml的氟维司群浓度之后,在第1天,用23号针头(1.5英寸长)将含有大于500mg氟维司群,例如至多3000mg氟维司群的单次剂量肌内施用到右或左臀大肌区域(由研究者选择)。由表12所示组成的冻干药品形成复溶氟维司群悬浮液,其在玻璃瓶中呈白色至灰白色冻干粉形式提供。表12成分质量标准mg/瓶氟维司群usp/nf568聚山梨酸酯80usp/nf28.4甘露醇usp/nf284聚维酮usp/nf9.1注射用水usp/nf0.6冻干药品瓶在施用前用5.0ml体积的表13中所示的稀释剂复溶。通过用手轻轻摇动并轻轻倒转玻璃瓶进行混合来复溶。表13成分质量标准mg/评mg/ml苯甲醇usp/nf6612聚山梨酸酯20usp/nf41.37.5磷酸二氢钾usp/nf0.670.12磷酸氢二钾usp/nf3.880.71注射用水usp/nf补足补足复溶悬浮液的组成如表14所示。复溶悬浮液的ph为约7.6。复溶悬浮液外观呈乳白色。表14成分mg/ml氟维司群100聚山梨酸酯805甘露醇50聚维酮1.6苯甲醇10.6聚山梨酸酯206.6磷酸二氢钾0.11磷酸氢二钾0.62注射用水(usp)补足至1ml市售制剂在使用前在其原始纸盒中保存在冰箱中2℃至8℃(36℉至46℉)下,并按原样使用。据报道,制剂含有10%w/v乙醇(usp);10%w/v苯甲醇(nf);和15%w/v苯甲酸苯甲酯(usp),以及补足至100%w/v的蓖麻油(usp)。通过将血样在1800g下离心10分钟分离出血浆并将血浆上清液1ml转移到储存在-20℃下的2ml冷冻管中,直到送到生物分析实验室测定氟维司群水平。所有接受研究药物并具有足够的血液采样以确定至少一个pk参数的受试者都被包括在pk分析中。为了符合pk人群的资格,在给药后的前15天内漏掉的血液样本不超过一个,从第18天到第140天不超过两个连续样本。将浓度数据根据标称(协议规定)采样时间汇总。使用非房室方法计算pk参数,并使用给药后实际经过的时间估算各个血浆pk参数。使用方差分析模型比较了两种治疗之间氟维司群的总暴露量(auc最后)。使用通用线性模型方法进行方差分析,对数转换后的auc最后作为因变量,治疗组(测试或参照)和给药组作为固定效应。通过描述性统计评估次级pk参数cmax。通过线性梯形法计算从时间零到最后可测量浓度的曲线下面积(auc最后)。漏掉的样品值没有估算浓度。任何漏掉值的样品都被视为所述样品未被计划收集。如果受试者的临给药前(0小时样品)水平大于其测得的cmax值的5%,那么将所述受试者排除在统计分析之外。在分析之前,将auc最后进行对数转换。使用sas的通用线性模型(glm)程序进行方差分析(anova),并以α=0.05假设检验治疗效应。统计模型包含治疗和给药组的主要效应。针对anova中的均方误差项测试了所有效应。使用sasestimate语句获得治疗的最小均方(lsmeans语句)、这些均值之间的差、与所述差相关的标准误差以及所述差的90%置信区间。通过取所述差和所述差的90%置信区间的对数来获得测试与参照几何最小均方的比值以及所述比值的90%置信区间。以对auc最后所述的相同方式,对经过对数转换的数据进行cmax的比较。结果示于表15中。表15示出了“参照lsm”的计算值,是指所有经治疗的受试者的对数转换后的测量值的最小均方,“参照geolsm”,是指经治疗的所有受试者的测量值的几何最小均方,“测试lsm”,是指经复溶的氟维司群悬浮液测试产品治疗的所有受试者的对数转换后的测量值的最小均方,“测试geolsm”,是指用复溶的氟维司群悬浮液测试产品治疗的所有受试者的测量值的几何最小均方。标记为“ln(cmax)”的行表示以ng/ml为单位的cmax值,对表示的列进行了对数转换。标记为“ln(auc最后)”的行表示以天*ng/ml为单位的auc最后值,对表示的列进行了对数转换。计算用测试产品治疗的受试者的cmax和auc最后的算术平均值和标准偏差(包括n=291名受试者的数据),平均cmax=6.00ng/ml(sd为7.47ng/ml),平均auc最后=286天*ng/ml(sd为101天*ng/ml)。表15图2-7示出了测试产品和的氟维司群平均血浆浓度的线性和半对数图。表16中示出了图2-7中使用的平均血浆浓度的数据点。表16当本文对化学或物理性质,例如粒度或粒度分布、制剂组分浓度或药代动力学性质使用范围时,旨在包括其中特定实施方案的范围的所有组合和子组合。本文件中引用或描述的每个专利、专利申请和出版物的公开内容均通过引用全文结合于此。本领域技术人员将认识到,可以对本发明的优选实施方案进行多种改变和修改,并且可以在不脱离本发明的精神的情况下进行这种改变和修改。因此,预期权利要求覆盖落入本发明的真实精神和范围内的所有这样的等同变化。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1