青蒿琥酯在制备抑制肿瘤细胞耐药性药物中的应用的制作方法
本发明属于生物医药技术领域,具体涉及青蒿琥酯在制备抑制肿瘤细胞耐药性药物中的应用。
背景技术:
恶性肿瘤是严重威胁人类健康的重大疾病,对肿瘤的治疗研究刻不容缓,其防治已经成为我国医疗领域工作的重中之重。恶性肿瘤的发展包括多个步骤,主要特点为局部浸润和向远处转移,这是临床上导致肿瘤患者死亡的主要原因。化疗是治疗恶性肿瘤的有效手段之一,对部分肿瘤起到了很好的治疗作用,一些晚期肿瘤患者在进行联合化疗后总生存期得到了有效延长。但对于大部分实体瘤,化疗的客观有效率仍较低。肿瘤细胞多药耐药性(multidrugresistance,mdr)的产生是导致肿瘤化疗失败的主要原因之一,mdr的产生机制非常复杂,主要包括:膜糖蛋白、酶、凋亡调控相关基因的表达以及dna异常修复等,此外有研究表明,溶酶体对药物的封存会导致肿瘤细胞对疏水性弱碱性药物耐药性的产生。虽有大量关于逆转肿瘤多药耐药性和辅助增效方面的研究,但很少能有效用于临床治疗。
青蒿琥酯(artesunate,art)是青蒿素的半合成衍生物,具有独特的过氧桥结构,可以产生氧自由基,是更有效的抗疟疾药,被列入世界卫生组织基本药物清单。近年来研究表明,青蒿琥酯具有广泛的抗肿瘤活性,对多种癌细胞有细胞毒作用,但机制不清,可能与dna损伤等相关。因此研究青蒿琥酯抗肿瘤活性的作用机制,使用青蒿琥酯制备针对肿瘤耐药性的作用,对提高青蒿琥酯的药用价值具有重要的作用。
技术实现要素:
为解决上述问题,本发明的目的在于提供青蒿琥酯在制备抑制肿瘤细胞耐药性药物中的应用。
为了实现上述目的,本发明提供以下技术方案:
青蒿琥酯在制备抑制肿瘤细胞耐药性药物中的应用。
进一步的,所述的肿瘤细胞为人乳腺癌细胞、人宫颈癌细胞、人结肠癌细胞、人肝癌细胞和人肺癌细胞。
进一步的,所述的肿瘤细胞耐药性为由溶酶体功能引起的肿瘤细胞耐药性。
一种抑制肿瘤细胞耐药性的药物制剂,所述的药物制剂包括活性成分青蒿琥酯和/或医学上可接受的药用辅料。
进一步的,所述的药物制剂中的青蒿琥酯的含量质量计为1~100%。
进一步的,所述药物制剂为针剂、片剂、颗粒剂或胶囊剂。
一种抑制体外肿瘤细胞耐药性的方法,将青蒿琥酯加入肿瘤细胞的培养液中。
有益效果:本发明公开了青蒿琥酯在制备抑制肿瘤细胞耐药性药物中的应用,通过试验证明,溶酶体功能与肿瘤细胞耐药性有一定关系,是肿瘤细胞耐药的一个机制。青蒿琥酯可以抑制溶酶体功能,升高溶酶体ph,降低溶酶体酶活性,使得失能线粒体的清除减少,进而诱导细胞凋亡。因此,青蒿琥酯对溶酶体功能较高的耐药细胞具有更好的细胞毒作用,青蒿琥酯可以作为一种抑制肿瘤细胞耐药性药物,用于肿瘤细胞的辅助治疗。
附图说明
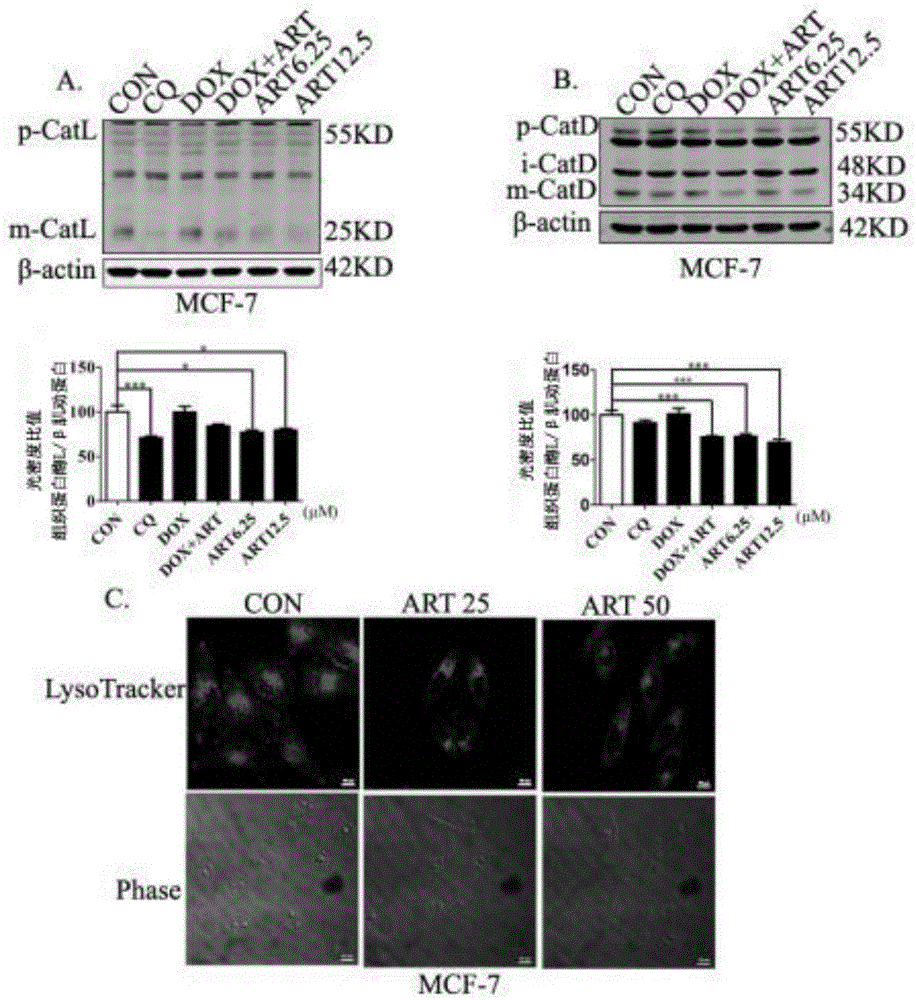
图1为青蒿琥酯抑制组织蛋白酶活性的结果分析图。(a)青蒿琥酯处理mcf-7细胞24h后,溶酶体组织蛋白酶cathepsinl的蛋白印迹检测图;(b)青蒿琥酯处理mcf-7细胞24h后,溶酶体组织蛋白酶cathepsind的蛋白印迹检测图;(c)青蒿琥酯处理24h后,溶酶体指示剂lysotrackerred荧光强度图。
图2为青蒿琥酯抑制自噬流的结果分析图。(a)青蒿琥酯处理mcf-7细胞24小时后自噬结果的电镜检测图,黑色箭头表示自噬体,红色箭头表示自噬溶酶体;(b)lc3检测的荧光图以及自噬体、自噬溶酶体的统计图;(c)以肌动蛋白作为对照,用青蒿琥酯处理mcf-7细胞24h后,经自噬抑制剂巴弗洛霉素a1(baf)处理前后p62和lc3的蛋白印迹检测图。
图3为转录因子tfeb过表达稳转株的构建结果图。(a)tfeb过表达前后的荧光染色图;(b)以肌动蛋白作为对照,tfeb检测的蛋白印迹图。
图4为tfeb过表达后降低mcf-7细胞对药物敏感性的结果分析图。(a)tfeb过表达的mcf-7细胞中的cathepsinl的蛋白印迹检测图;(b)过表达tfeb的mcf-7细胞中的cathepsind的蛋白印迹检测图;(c)青蒿琥酯处理过表达和非过表达tfeb的mcf-7细胞的生存活力图;(d)阿霉素处理过表达和非过表达tfeb的mcf-7细胞的生存活力图。
图5为tfeb敲减后mcf-7细胞对药物敏感性升高的结果分析图。(a)tfeb敲减后其蛋白水平的蛋白印迹检测图;(b)tfeb敲减cathepsinl水平的蛋白印迹检测图;(c)青蒿琥酯处理si-n细胞以及si-tfeb细胞后的生存活力图;(d)阿霉素处理si-n细胞以及si-tfeb后的生存活力图。
图6为三种耐药细胞株的验证结果图。(a)乳腺癌耐阿霉素细胞mcf-7/adr;(b)人肺癌耐紫杉醇细胞a549/tax;(c)人肺癌耐顺铂细胞a549/ddp。
图7为三种耐药细胞中溶酶体相关蛋白水平的分析图。(a)mcf-7和mcf-7/adr细胞中lamp1、p62以及cathepsinl的蛋白印迹检测图;(b)a549和a549/ddp细胞中lamp1和cathepsinl的蛋白印迹检测图;(c)a549和a549/tax细胞中lamp1以及cathepsinl的蛋白印迹检测图;(d)a549和a549/tax细胞中cathepsinb的蛋白印迹检测图;(e)a549和a549/tax细胞中cathepsind的蛋白印迹检测图;(f)a549和a549/tax细胞中溶酶体酶活的dq-bsa检测图。
图8为青蒿琥酯抑制a549/tax细胞增殖的结果分析图。(a)青蒿琥酯处理mcf-7/adr后的细胞生存活力图;(b)青蒿琥酯处理a549/tax后的细胞生存活力图;(c)青蒿琥酯处理a549/ddp后的细胞生存活力图。
图9为青蒿琥酯对a549/tax细胞线粒体和溶酶体的损伤分析图。(a)不同浓度青蒿琥酯处理a549/tax细胞24h后电镜图;(b)不同浓度青蒿琥酯处理a549/tax细胞24h后的lamp1、p62水平的蛋白印迹检测图;(c)不同浓度青蒿琥酯处理a549/tax细胞24h后的lysotracker荧光图。
图10为青蒿琥酯抑制a549/tax细胞溶酶体酶活的结果分析图。(a)青蒿琥酯处理a549/tax细胞24h后细胞内成熟型cathepsind的蛋白印迹检测图;(b)青蒿琥酯处理a549/tax细胞24h后细胞内成熟型cathepsinb的蛋白印迹检测图;(c)青蒿琥酯处理a549/tax细胞24h后细胞内成熟型cathepsinl的蛋白印迹检测图;(d)青蒿琥酯处理a549/tax细胞24h后细胞内溶酶体酶活的dq-bsa检测图。
图11为青蒿琥酯部分通过ros抑制溶酶体酶活的结果分析图。(a)青蒿琥酯处理a549/tax细胞24h后细胞内的ros水平的结果图;(b)青蒿琥酯处理a549/tax细胞24h后,ros清除剂nac对细胞处理前后的lysosensorgreen荧光变化图;(c)青蒿琥酯处理a549/tax细胞24h后,抗氧化剂tx对细胞处理前后细胞内成熟型cathepsinl的蛋白印迹检测图;(d)青蒿琥酯处理a549/tax细胞72h后,抗氧化剂tx对细胞处理前后的细胞活力图。
图中青蒿琥酯的浓度单位为μm。
具体实施方式
下面结合具体实施例来进一步描述本发明,但实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
以下通过实验对青蒿琥酯的抑制肿瘤细胞耐药性的效果进行验证。
实施例1青蒿琥酯对肿瘤细胞溶酶体功能的影响
1.1材料与方法
1)实验材料
2)实验细胞
人乳腺癌mcf-7细胞,购自中国科学院细胞生物研究所细胞库,本实验室保存;人宫颈癌hela细胞,购自中国科学院细胞生物研究所细胞库,本实验室保存;人结肠癌hct116细胞,购自中国科学院细胞生物研究所细胞库,本实验室保存;人肝癌hepg2细胞,购自中国科学院细胞生物研究所细胞库,本实验室保存;人肺癌a549细胞,购自中国科学院细胞生物研究所细胞库,本实验室保存。培养环境如下:细胞培养箱37℃恒温培养,5%co2,95%湿度。
3)青蒿琥酯母液配置:称取青蒿琥酯粉末7.6884mg,加入2mldmso配制成10mm母液,分装后保存在-20℃。
1.2方法与步骤
1)溶酶体红色荧光探针(lysotrackerred)染色
将小圆玻片铺于24孔板底部,经紫外照射30min,然后加0.01%-pbs多聚赖氨酸溶液0.5ml于培养箱中过夜,次日取出24孔板,吸出多聚赖氨酸,用灭菌水冲洗两遍,晾干待用。将生长到90%左右铺满的细胞用0.25%胰蛋白酶消化后,均匀铺在24孔板内,每孔2×104个细胞,待贴壁后加入不同浓度的青蒿琥酯处理24h,处理结束后,取lysotrackerred染料用培养基按照1:10000稀释,于培养箱中孵育20min,然后用pbs洗干净,将小圆玻片倒扣在加有荧光抗淬灭剂的载玻片上,立刻用共聚焦荧光显微镜观察。
2)统计学分析
采用imagej软件对westernblot结果图像进行灰度分析,采用graphpadprism5软件作图分析。实验数据采用spss16.0统计软件进行单因素方差分析(one-wayanova)student-newman-keulsposthoc检验来进行组间比较,p<0.05视为具有统计学意义。
1.3实验结果
1)青蒿琥酯抑制溶酶体功能
实验结果显示,在青蒿琥酯处理24h后,mcf-7细胞成熟型cathepsinl和cathepsind的水平明显降低(图1a、b),并且可以看到,在青蒿琥酯处理24h后,lysotrackerred荧光强度减弱(图1c)。
2)青蒿琥酯抑制自噬流
作为自噬功能的实现者,溶酶体具有重要的意义。溶酶体功能受到抑制,势必会对自噬产生一定的影响,所以,接下来我们检测自噬的变化。由电镜结果我们可以看到,在mcf-7细胞中,相较于未加药组,青蒿琥酯处理24h后,细胞内可以观察到数量较多的自噬体,而自噬溶酶体数量较少(图2a)。同时研究表明,尽管青蒿琥酯增加了lc3ii的水平,并且自噬体数量呈剂量依赖性增加,但是自噬溶酶体数量下降(图2b)。westernblot结果也显示,青蒿琥酯使mcf-7细胞的p62堆积(图2c),使mcf-7细胞的p62和lc3ii的水平增加,并且在自噬抑制剂巴弗洛霉素a1(baf)处理后,p62和lc3的堆积进一步加剧(图2c)。
从以上结果得出,青蒿琥酯抑制乳腺癌mcf-7细胞溶酶体酶的活性,抑制了溶酶体功能,阻断了自噬流。
实施例2溶酶体功能与耐药性的关系
2.1溶酶体合成相关转录因子tfeb对细胞毒性药物药效的影响
tfeb是调节溶酶体生物合成的主要基因,能够通过调控自噬/溶酶体合成相关基因的表达,从而提升自噬/溶酶体功能。所以,我们通过上调或者下调tfeb的水平来增强或者减弱溶酶体的功能,进一步探究青蒿琥酯对细胞的影响。
2.1.1材料与方法
1)实验材料
2)慢病毒
tfeb过表达慢病毒和突变体慢病毒由吉凯公司构建:lv-tfeb(6778-1),(滴度为1e+8tu/ml);阴性对照病毒con195(ubi-mcs-3flag-sv40-puromysin),(滴度为1e+9tu/ml)。
3)sirna
tfebsirnasense:5'-gagacgaaggttcaacatcaa-3'。
2.1.2.方法与步骤
1)建立tfeb细胞稳转株
配制tfeb过表达慢病毒(lv-tfeb),工作液(病毒滴度1×108/ml,moi=20),和阴性对照慢病毒空载体(con)工作液,加入到培养mcf-7细胞的培养皿中,孵育24h后换新鲜培养基。再培养48h后,用培养基配制2μg/ml嘌呤霉素对病毒感染后的mcf-7细胞进行筛选。中间视细胞生长情况逐步增加嘌呤霉素浓度。筛选2周后,挑选单克隆进行培养。
2)sirna转染步骤
将细胞均匀铺在6孔板中,待细胞贴壁后,按说明书将0.5od的sirna用62.5μldepc水重悬,配制成20μmsi-tfeb母液,分装后放置在-20°c保存。然后每孔用200μl的opti-mem培养基稀释lipofectamine2000(2μl/孔),混匀后室温下孵育5min。每孔用200μl的opti-mem培养基稀释si-n和si-tfeb,混匀后在室温下孵育5min(最终浓度为80nm)。然后将两种稀释液混合均匀,再于室温下静置20min以提高转染效率,在上述6孔板中加入1.6mldmem基础培养基,将静置后的混合液加入6孔板的孔中(400μl/孔),放在培养箱继续培养,6h后加入新鲜培养基继续转染,第二天换液,转染72h后收集细胞,进行后续实验。
3)统计学分析
采用imagej软件对westernblot结果图像进行灰度分析,graphpadprism5软件作图分析。数据采用spss16.0统计软件进行单因素方差分析(one-wayanova)student-newman-keulsposthoc检验进行组间比较,p<0.05为具有统计学意义。
2.1.3实验结果
1)tfeb过表达稳转株构建
在挑选出来的mcf-7单克隆稳转细胞株长起来后,鉴定过表达效果。首先,免疫荧光检测过表达tfeb细胞株和阴性对照细胞株的荧光强度,可以看到,过表达tfeb细胞株的荧光强度明显增加(图3a),westernblot结果也可以看出,过表达tfeb细胞株的tfeb蛋白水平明显增加(图3b)。
2)tfeb过表达后对药物的敏感性降低
检测lv-tfeb稳转mcf-7细胞株的溶酶体酶的活性,可以看到,相较于阴性对照病毒组,在过表达tfeb后,细胞内成熟型cathepsinl、cathepsind水平明显升高(图4a-b)。接下来用青蒿琥酯处理两种细胞,在lv-n细胞以及lv-tfeb细胞上其ic50值分别为12.5μm和50μm(图4c);用阿霉素处理两种细胞,在lv-n细胞以及lv-tfeb细胞上其ic50值分别为0.17μm和0.25μm(图4d)。相较于lv-n组,过表达tfeb后,细胞对青蒿琥酯和阿霉素(doxorubicin,dox)的敏感性均降低。
3)tfeb敲减后细胞对药物的敏感性升高
接下来为进一步验证tfeb过表达对溶酶体活性以及对细胞耐药性的结果,我们又进行了tfeb敲减的实验。首先验证sirna的可靠性。westernblot结果看出,tfeb敲减后其蛋白水平明显降低(图5a),并且可以看到成熟型cathepsinl水平也明显降低(图5b)。接下来用青蒿琥酯处理两种细胞,在si-n细胞以及si-tfeb细胞上其ic50值分别为37.5μm和25μm(图5c);用阿霉素处理两种细胞,在si-n细胞以及si-tfeb细胞上其ic50值分别为0.375μm和0.25μm(图5d)。相较于si-n组,敲减tfeb后,细胞对青蒿琥酯和阿霉素的敏感性均升高。
实施例3几种耐药细胞溶酶体功能的比较
3.1材料
人乳腺癌耐阿霉素细胞mcf-7/adr,购自中国科学院细胞生物研究所细胞库,本实验室保存;人肺癌耐紫杉醇细胞a549/tax,由苏州大学梁中琴老师实验室馈赠;人肺癌耐顺铂细胞a549/ddp,由苏州大学梁中琴老师实验室馈赠。
3.2方法与步骤
1)mcf-7/adr耐药性维持
细胞培养过程中,加阿霉素维持,每传一代阿霉素浓度增加0.01μg/ml,中间视细胞状态而定,最终加至2μg/ml。
2)a549/ddp耐药性维持
细胞培养过程中,加顺铂维持,每传一代顺铂浓度增加0.1μg/ml,中间视细胞状态而定,最终加至2μg/ml。
3)a549/tax耐药性维持
细胞培养过程中,加紫杉醇维持,每传一代紫杉醇浓度增加0.01μg/ml,中间视细胞状态而定,最终加至2μg/ml。
3.3实验结果
1)a549/tax细胞中溶酶体活性较高
首先对耐药细胞株进行验证,从图中结果我们可以看到,乳腺癌耐阿霉素细胞mcf-7/adr(图6a)、人肺癌耐紫杉醇细胞a549/tax(图6b)、人肺癌耐顺铂细胞a549/ddp(图6c)的建立是有效的。接下来,我们分别检测了三种耐药细胞中溶酶体相关蛋白的水平。我们可以看到,mcf-7和mcf-7/adr细胞中lamp1、p62以及cathepsinl的水平相差无几(图7a);a549和a549/ddp细胞中lamp1水平无明显变化,a549/ddp细胞中cathepsinl水平高于a549细胞(图7b);a549/tax细胞中lamp1以及cathepsinl水平明显高于a549细胞(图7c),且cathepsinb以及/cathepsind水平也明显高于a549细胞(图7d、e);并且可以看到,a549/tax细胞中自噬底物p62的水平低于a549细胞(图7d);dq-bsa结果可以看到,a549/tax细胞的溶酶体酶活明显高于a549细胞(图7f)。
结合实施例2和实施例3得出,过表达tfeb引起溶酶体酶的活性显著升高,细胞对药物的敏感性也降低;在敲减tfeb后,溶酶体酶的活性显著降低,细胞药敏性增加。不同的耐药株,其溶酶体活性不同。
实施例4青蒿琥酯对a549/tax细胞的影响
4.1.材料与方法
材料均与以上相同。
4.2.方法与步骤
1)dqgreenbsa染色
将小圆玻片铺于24孔板底部,经紫外照射30min,然后加0.01%pbs多聚赖氨酸溶液0.5ml于培养箱中过夜,次日取出24孔板,吸出多聚赖氨酸,用灭菌水冲洗两遍,晾干待用。将生长到90%左右铺满的细胞用0.25%胰蛋白酶消化后,均匀铺在24孔板内,每孔2×104个细胞,待贴壁后加入不同浓度的药物处理24h,处理结束后,取dqgreenbsa染料用培养基按照1:200稀释,于培养箱中孵育20min,然后用pbs洗干净,将小圆玻片倒扣在加有荧光抗淬灭剂的载玻片上,立刻用共聚焦荧光显微镜观察。
2)统计学分析
采用imagej软件对westernblot结果图像进行灰度分析,采用graphpadprism5软件作图分析。实验数据采用spss16.0统计软件进行单因素方差分析(one-wayanova)student-newman-keulsposthoc检验来进行组间比较,p<0.05视为具有统计学意义。
4.3实验结果
1)青蒿琥酯明显抑制a549/tax细胞增殖
分别用青蒿琥酯处理三种耐药细胞,由结果图中我们可以看到,青蒿琥酯对mcf-7/adr(图8a)、a549/tax(图8b)以及a549/ddp(图8c)的ic50分别为12.5μm、0.5μm和50μm,显示出青蒿琥酯对a549/tax细胞具有较强的杀伤力。
2)青蒿琥酯损伤了a549/tax细胞的线粒体和溶酶体
用不同浓度青蒿琥酯处理a549/tax细胞24h,电镜观察,从结果图中可以看到,青蒿琥酯处理后溶酶体数量明显减少,线粒体损伤较为明显,线粒体空泡化积聚(图9a);且lamp1蛋白水平降低,p62水平升高(图9b);lysotracker结果也看以看到,随着青蒿琥酯浓度增加,荧光强度逐渐减弱(图9c)。
3)青蒿琥酯抑制了a549/tax细胞溶酶体酶活
不同浓度青蒿琥酯处理a549/tax细胞24h后,结果显示,随着青蒿琥酯浓度的增加,细胞内成熟型cathepsind(图10a)、cathepsinb(图10b)以及cathepsinl(图10c)蛋白水平明显降低;且dq-bsa结果显示随着青蒿琥酯浓度的增加,荧光强度逐渐减弱(图10d)。
4)青蒿琥酯部分通过ros降低溶酶体ph,抑制溶酶体酶活
实验结果显示,在加入青蒿琥酯后,a549/tax细胞内的ros水平明显增加,并且可以看到,a549/tax细胞内的ros水平明显增加,并且这种增加可以被ros清除剂nac部分抑制(图11a)。a549/tax细胞的lysosensorgreen荧光强度减弱,说明青蒿琥酯降低了溶酶体的ph值,并且这种减弱可以被ros清除剂nac部分逆转(图11b),并且art引起的a549/tax细胞内成熟型cathepsinl的降低可以被抗氧化剂tx逆转(图11c)。同时,相较于单用art组,tx与青蒿琥酯联合应用处理后,细胞存活有所上升。表明在青蒿琥酯所引起的溶酶体ph的增加以及酶活性的降低作用中,ros起到了一定作用。
因此,青蒿琥酯可以损伤a549/tax细胞的线粒体,并且使溶酶体水平以及溶酶体酶活性降低,而溶酶体功能的抑制又进一步导致了失能线粒体的积聚。
综上所述,本研究表明,溶酶体功能与肿瘤细胞耐药性有一定关系,是肿瘤细胞耐药的一个机制。青蒿琥酯可以抑制溶酶体功能,升高溶酶体ph,降低溶酶体酶活性,使得失能线粒体的清除减少,进而诱导细胞凋亡。因此,青蒿琥酯对溶酶体功能较高的耐药细胞具有更好的细胞毒作用。
- 还没有人留言评论。精彩留言会获得点赞!