一种微孔再生组织基质及其制备和应用的制作方法
本发明属于生物医用材料领域,具体涉及一种微孔再生组织基质,及其制备方法和应用。
背景技术:
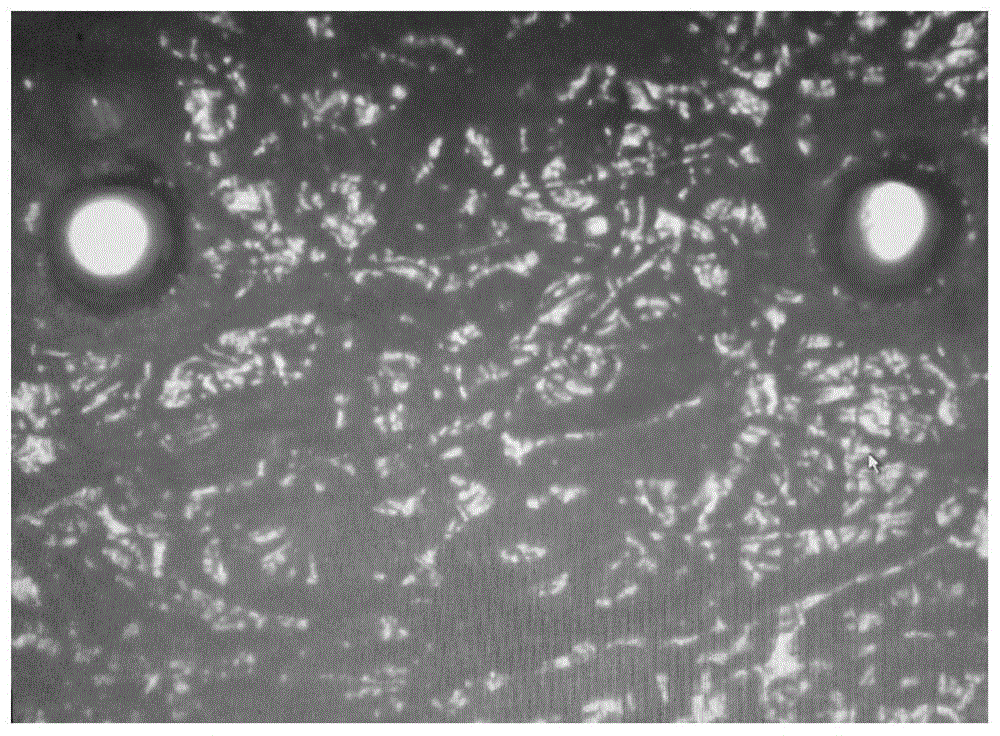
:再生组织基质(regenerativetissuematrix,rtm)是将人体皮肤经系列物理、化学方法去除表皮和真皮层中的细胞成分,清除了异体带来的免疫原性,保留了真皮的胶原纤维、网状纤维、弹性纤维及其组成的三维空间结构。1995年美国生命细胞公司首先报道了脱细胞真皮基质的制备方法,同时开展了其在烧伤、创伤引起的真皮缺损替代修复中的临床应用研究。后来的研究发现脱细胞真皮基质,除可用于烧、创伤等创面修复外,又可作为粘膜及软组织的替代物,广泛应用于整形外科、口腔、神经外科、眼科、耳鼻喉科等学科领域。一种理想的再生组织基质(rtm)应尽可能去除具有抗原性的细胞成分,保留较为完整的胶原纤维成分和组织的基本结构,使真皮基质具有较好组织相容性,高度的稳定性和适度的柔韧性等特点。而再生组织基质(rtm)的这些特性主要决定于其组成成分和结构,这与其制备方法直接有关。虽然现有的异种脱细胞真皮基质的制备已经比较成熟,但是在其制备和应用中还存在一些问题,如:胰酶法和nacl-sds法,其缺点为脱细胞程度不彻底,出现不同程度免疫反应,组织相容相差导致移植存活率较低;dispaseⅱ-triton和naoh消蚀法,其缺点为制备过程复杂,所用的方法对天然真皮超微结构破化性较大,细胞外基质成分保留较差,对真皮基底膜有一定的损伤作用。而且在制备方法中为防止胶原胶原纤维过度降解和减缓移植后被蛋白酶分解的速度,采用戊二醛进行交联,因戊二醛具有一定的细胞毒性,会引起机体创伤修复迟缓,延长修复时间。在牙齿种植和巨痣去除皮肤修复过程中,真皮基质上存有大小合适的微孔可促进血浆、游离细胞、成纤维细胞等活性成分渗透到无细胞真皮基质中,维持真皮基质早期的营养供应。在牙齿种植过程中,采用微孔脱细胞异体真皮包裹牙根,微孔可促进牙齿根部成纤维细胞的迁入、附着及扩增,加速与机体组织的融合,从而促进牙齿种植的成活率及缩短修复时间。在巨痣去除后,使用微孔脱细胞异体真皮作为补片进行皮肤修复的过程中,真皮基质上的微孔可防止皮下积液、积气及血肿的形成,促进血浆及游离细胞渗透到真皮基质表面,促进植皮的成活率。目前对真皮基质上打孔和孔间隙大小尚无统一认识,但孔径较大时会形成点状或网状瘢痕,而孔径较小时,组织细胞难以迁入,血管化速度缓慢。因此选择合适的微孔孔径及在孔径周围提供更多的细胞附着位点对真皮基质的血管化极为重要。激光打孔是最早达到实用化的激光加工技术,已广泛用于金属、皮革、玻璃、木材等材料的加工。激光打孔技术有打孔速度快、效率高,孔径微小、微孔分布均匀等优点。将激光打孔技术引入异体真皮基质微孔的加工,可在真皮基质上制作出均匀密布的微孔,减少移植皮表面瘢痕的出现,有利于促进微血管的均匀分布,从而达到提高真皮基质移植成活率和改善愈合质量的目的。现有的异体真皮的制备方法及打孔技术中,为避免免疫原性物质的存在,多数采用较为剧烈的制备条件,其结果造成真皮基质网状纤维和弹力纤维大量降解,使得胶原纤维的三维结构破化极大,降低了真皮基质的移植成活率;在真皮基质打孔技术中,较多采用复水后的真皮基质或湿的真皮基质进行打孔,且打孔工艺多数在脱细胞真皮基质制备完成后进行的,其孔径多数控制在80-140um,但孔径内表面细胞附着位点较少。中国专利cn105688286a公布了一种激光微孔脱细胞真皮基质及其制备方法,专利中采用脉冲激光器,对真皮基质进行打孔,其原料采用制备好的湿的脱细胞真皮基质,虽然其孔径分布均匀,但其孔径中细胞附着位点较少。中国专利cn200510126108.6公开了一种脱细胞真皮基质及其制备方法,专利中采用高浓度氢氧化钠反复清洗哺乳动物真皮获得脱细胞真皮基质,其碱处理条件剧烈造成部分胶原变性、蛋白裂解影响了真皮基质中原有蛋白结构。技术实现要素:为解决上述现有技术的问题,本发明提供了一种微孔再生组织基质。该微孔再生组织基质脱细胞完全,无免疫原性,无细胞毒性因素的存在,且组织基质的胶原纤维、网状纤维、弹力纤维及其组成的三维结构破坏较小,与创面贴合度较好,其微孔内表面有许多伸入孔内的胶原纤维,可提供更多的迁入细胞附着位点。本发明的第二个目的是提出所述微孔再生组织基质的制备方法。通过对冷冻干燥后的真皮层基质进行激光打孔,再采用复水、碱液膨胀脱细胞处理、振荡清洗和氨基酸溶液浸泡处理得到微孔异体真皮。本发明的第三个目的是提出所述微孔再生组织基质的应用。实现本发明上述目的的技术方案为:一种微孔再生组织基质,所述的微孔再生组织基质为多孔结构的片状材料,材料上有均匀分布的微孔,微孔的孔径为0.15~0.20mm,孔间距为0.8~1.2mm,微孔内表面有向孔内伸入的胶原纤维。一种微孔再生组织基质的制备方法,包括以下步骤:1)异体皮肤预处理:将刮去皮下组织的异体皮肤在生理盐水中清洗,然后在氯化钠溶液中浸泡,去除皮肤表皮层,再在生理盐水中清洗,获得异体真皮;2)冷冻干燥处理:将异体真皮放入冻干保护剂中浸泡,整形后放入液氮中速冻,然后真空冷冻干燥;3)打孔处理:采用激光加工系统对冷冻干燥后的异体真皮进行打孔;4)碱液膨胀脱细胞处理:将打孔后的异体真皮放入到生理盐水和/或冻干保护剂中复水,然后采用碱液膨胀处理去除真皮层内细胞,再用生理盐水中振荡清洗至流出液为中性。进一步地,步骤1)中,所述的氯化钠溶液的浓度为0.8~1.2mol/l,单位面积皮片与液体的料液比为1cm2:(0.5~2)ml,浸泡时间为18~30h,浸泡温度为24~32℃。其中,步骤2)所述的冻干保护剂为海藻糖稀盐水溶液,其海藻糖的浓度为200~600mmol/l,其中的稀盐水溶液是由1份生理盐水和两份注射用水组成,单位面积皮片与液体的料液比为1cm2:(0.5~2)ml,浸泡时间为4~6h,浸泡温度为30~40℃。优选地,步骤2)冻干保护剂浸泡后,将所述异体真皮用硬质边框(该硬质边框的材质主要是能承受液氮的低温就行,例如聚酰亚胺、聚三氟氯乙烯)固定整形,保持固定状态进行所述的冷冻干燥处理和打孔处理。打完孔就可以去掉边框了。本发明的一种优选技术方案为,步骤2)中所述液氮速冻的操作为:-6~-2℃预冷,然后用线绳吊入液氮中速冻20~60s;所述真空冷冻干燥的操作为:设置真空冷冻干燥机的预冷温度为-30~-40℃,放入异体真皮后进行抽真空冻干处理。更进一步地,所述的抽真空冻干处理分为两个阶段,阶段1:在温度低于-30℃、真空度小于3pa的条件下维持14h;阶段2:升温到20℃,在真空度小于3pa的条件下维持4h;整个真空冷冻干燥过程中,真空度不高于30pa。其中,步骤3)所述的激光加工系统为多功能紫外加工系统,其采用二极管泵浦固体激光,波长为355nm;所述的激光打孔参数为:孔径为0.15~0.20mm,孔间距为0.8~1.2mm。其中,所述步骤4)中所述的碱液脱细胞膨胀处理,其处理方式为:采用含有0.1~0.5mol/l的na2co3和质量分数为0.1~0.4%sds的溶液进行处理;或,先采用0.1~0.5mol/l的na2co3碱液处理,然后再采用质量分数为0.1~0.4%sds处理;优选地,皮片表面积和处理的溶液的料液比为(1~3)cm2:1ml,振荡1~3h,静置浸泡2~6h,重复振荡和浸泡处理2-5次;更优选地,将碱液膨胀处理后的物料放入氨基酸或表面活性剂的溶液中浸泡处理,再经生理盐水振荡清洗处理,辐照杀菌,分装;所述浸泡处理的氨基酸溶液为:每升溶液中含有2g苏氨酸,2g丝氨酸,1g谷氨酸和1g天门冬氨酸。本发明所述微孔再生组织基质作为牙齿种植填充材料及巨痣补片的应用。本发明的有益效果在于:本发明提出的微孔再生组织基质脱细胞完全,无免疫原性,无细胞毒性因素的存在,且基质中的胶原纤维、网状纤维、弹力纤维及其组成的三维结构破坏较小,与创面贴合度较好,其微孔内表面有许多伸入孔内的胶原纤维,可提供更多的迁入细胞附着位点。本发明微孔再生组织基质的制备方法,采用干燥的异体真皮进行激光打孔,微孔经复水、碱液膨胀处理后,微孔内存在许多伸入孔内的胶原纤维,有利于迁入细胞的附着及增殖,提高再生组织基质移植的存活率。本方法在碱液膨胀去除细胞工艺前,采用冷冻复水工艺过程,可有助于细胞脱落,缩短碱液处理强度,有利于减轻再生组织基质胶原纤维、网状纤维、弹力纤维组成的三维结构的破坏。本方法采用激光打孔方式,其精度高、速度快,微孔均匀分布,可减少移植皮表面瘢痕的出现,改善创面愈合质量。与现有的制备方法相比,本发明减少了戊二醛对再生组织基质的交联过程,避免了细胞毒性因素的引入。附图说明图1为实施例1微孔再生组织基质光学显微镜下的照片(光显×10)。图2为实施例1微孔再生组织基质微孔内表面的电镜照片。图3为实施例2微孔再生组织基质光学显微镜下的照片(光显×10)。图4为实施例2微孔再生组织基质微孔内表面的电镜照片。具体实施方式以下实施例用于说明本发明,但不用来限制本发明的范围。实施例中,若无特别说明,所使用的方法均为本领域常规的方法。本发明涉及到的原料或试剂均可市购获得。以下通过具体的实施例说明本发明的技术方案。实施例1本发明所述的微孔再生组织基质制备方法包括以下步骤:1.水洗:将异体皮肤从贮存保护液中取出,刮去皮下组织后,放入生理盐水中振荡清洗,皮片的面积与生理盐水的料液比(cm2:ml)为1:1,料液总体积不超过振荡容器容量的50%,振荡频率为30rpm,振荡清洗时间为1.5h,每振荡0.5h,更换一次生理盐水,共振荡清洗3次。2.去除表皮层:将振荡清洗过的异体皮肤,放入盛有1mol/lnacl溶液中浸泡,料液比(cm2:ml)为1:1,在28℃条件下,浸泡24h。浸泡完成后,取出异体皮肤,撕去表皮层。将去除了表皮层的皮肤,再按照步骤1振荡清洗获得异体真皮层。3.液氮冷冻:将异体真皮层放入含400mmol/l海藻糖低浓度盐水(由1份生理盐水和2份注射用水组成)中,在37℃条件下,孵育5h。将孵育后的皮片整形,用硬质的边框夹住四边,使皮片保持平整,防止在冷冻干燥的过程中真皮基质蜷缩便于后续激光打孔。将整形后的皮片在-4℃条件下预冷后,吊入液氮中速冻30s。4.冷冻干燥:将速冻后的异体真皮,迅速放入预冷到-30~-40℃的真空冷冻干燥机中,开启真空泵进行抽真空干燥处理,将干燥箱真空度抽到10pa以下。在温度低于-30℃、真空度小于3pa的条件下维持14h;然后升温到20℃,在真空度小于3pa的条件下维持4h,整个真空干燥过程中,真空度不高于30pa。5.激光制孔:设定多功能紫外激光加工系统(德中dl500u)的参数,选择355nm的紫外光,将冷冻干燥的异体真皮悬空置于框架内,使皮片距离底板留有大于5mm距离,防止底部余热造成皮片损失;激光打孔参数为:打孔间距1.0mm,孔径0.2mm,进行矩阵式打孔,获得干燥的微孔异体真皮。6.复水:将干燥的微孔异体真皮放入到生理盐水中,料液比(cm2:ml)为1:1,振荡浸泡20min,获得微孔异体真皮。7.碱液膨胀脱细胞处理:将微孔异体真皮加入到含0.2mol/l的na2co3和0.2%sds的溶液中进行浸泡处理,料液比(cm2:ml)1:1,料液总体积不超过振荡器容量的50%,振荡频率为30rpm,振荡2h,静置浸泡4h,重复振荡清洗和浸泡处理4次。再将真皮基质按照步骤1振荡清洗至流出的清洗液为中性(ph6-8),获得微孔脱细胞真皮基质。8.氨基酸溶液浸泡处理:将脱细胞异体真皮基质加入到氨基酸溶液(每l溶液中含有2g苏氨酸,2g丝氨酸,1g谷氨酸和1g天门冬氨酸)中,振荡浸泡处理1h,然后静置浸泡0.5h。再将真皮基质按照步骤1振荡清洗获得微孔再生组织基质。9.杀菌:使用co60辐照杀菌,辐照剂量为25kgy。10.封装:将杀菌过的微孔再生组织基质浸泡在pbs缓冲液中,并用塑料袋密封包装。得到的产物照片见图1,本实施例制得的微孔再生组织基质为多孔结构的片状材料,材料上有均匀分布的微孔,孔径为0.15~0.20mm,孔间距为0.8~1.2mm,微孔内表面有向孔内伸入的胶原纤维,参见图2的电镜照片。实施例2本实施例的微孔再生组织基质制备方法包括以下步骤:步骤1-5与实施例1相同;6.复水处理:采用梯度递减复水方式,即将冻干的微孔异体真皮置于400mmol/l的海藻糖低浓度盐水溶液中,料液比(cm2:ml)为1:1,振荡浸泡15min;然后取出加入到200mmol/l海藻糖低浓度盐水中,料液比(cm2:ml)为:1:1,振荡浸泡15min;然后再置入无海藻糖的生理盐水中,料液比(cm2:ml)为:1:1,振荡浸泡15min,即获得微孔异体真皮。7.碱液膨胀脱细胞处理:将微孔异体真皮加入到0.2mol/l的na2co3中进行浸泡处理,料液比(cm2:ml)1:1,料液总体积不超过振荡器容量的50%,振荡频率为30rpm,振荡2h,静置浸泡4h,重复振荡清洗浸泡处理4次。再将真皮基质按照步骤1振荡清洗获得脱细胞异体真皮基质。8.表面活性剂处理:将脱细胞异体真皮基质,加入到0.2%sds溶液中振荡处理,料液比(cm2:ml)1:1,处理时间为1h,用来脱去真皮基质残余的细胞碎片,降低免疫原性。将表面活性剂脱细胞的真皮基质,按照步骤1振荡清洗获得脱细胞异体真皮基质。9.氨基酸溶液浸泡处理:将脱细胞异体真皮基质加入到氨基酸溶液(每l溶液中含有2g苏氨酸,2g丝氨酸,1g谷氨酸和1g天门冬氨酸)中,振荡浸泡处理1h,然后静置浸泡0.5h。再将真皮基质按照步骤1振荡清洗获得微孔再生组织基质。10.杀菌:使用co60辐照杀菌,辐照剂量为25kgy。11.封装:将杀菌过的微孔再生组织基质浸泡在pbs缓冲液中,并用塑料袋密封包装。得到的产物照片见图3,本实施例制得的微孔再生组织基质为多孔结构的片状材料,材料上有均匀分布的微孔,孔径为0.15~0.20mm,孔间距为0.8~1.2mm,微孔内表面有向孔内伸入的胶原纤维,参见图4。对比例1本对比例的微孔再生组织基质制备方法包括以下步骤:步骤1、2与实施例1相同。3.碱液处理:将异体真皮加入到0.6%的naoh溶液中浸泡,料液比(cm2:ml)1:1,料液总体积不超过振荡器容量的50%,振荡频率为30rpm,振荡1h,静置浸泡5h,共处理18h。再将真皮基质按照步骤1振荡清洗处理。4.表面活性剂处理:将异体真皮基质加入到0.2%sds溶液中进行浸泡处理,料液比(cm2:ml)1:1,料液总体积不超过振荡器容量的50%,振荡频率为30rpm,振荡处理0.5h。再将真皮基质按照步骤1振荡清洗处理。5.戊二醛交联处理:将异体真皮基质加入到0.2%的戊二醛溶液浸泡处理,料液比(cm2:ml)1:1,浸泡处理20min。再将真皮基质按照步骤1振荡清洗处理。6.激光制孔:设定多功能紫外激光加工系统的参数,选择355nm的紫外光,将异体真皮基质悬空置于框架内,真皮基质距离底板留有一定距离,激光打孔参数为,打孔间距1.0mm,孔径0.15mm,进行矩阵式打孔。再将微孔异体真皮基质按照步骤1振荡清洗处理。7.杀菌:使用co60辐照杀菌,辐照剂量为25kgy。8.封装:将杀菌过的微孔再生组织基质,用pbs缓冲液浸泡,亦用塑料袋密封包装。实验例1:再生组织基质的性能检测对实施例1、2和对比例1制备获得的再生组织基质的机械特性等生物学性能进行测试,性能指标包括拉伸强度、缝合强度、拉伸延长率。具体检测结果如表1所示。结果显示,实施例1、2产品与皮肤更好的贴合度较好,且韧性和弹性良好,且能满足巨痣清除后补片缝合强度的要求。表1微孔再生组织基质检测结果项目拉伸强度(mpa)缝合强度(n)拉伸延长率(%)实施例16.219.514.0实施例26.419.814.1对比例14.718.211.2实验例2动物模型试验实验对象:取健康sd大鼠48只,雌雄不限,大鼠体重为250±10g。实验步骤:1.采用3%的戊巴比妥钠(50mg/kg)对大鼠进行腹腔麻醉。2.将sd大鼠固定在手术台上,背部去毛,碘酒消毒,铺无菌巾。3.采用鼓式取皮机进行去皮,调整鼓式取皮机取皮厚度至合适位置,拉动手柄,完成全层皮肤的取皮,获得自体刃厚皮片,皮片大小为2.5cm×2.5cm。4.然后将大鼠随机分为3组,每组16只。实施例1组:创面移植采用实施例1的制备方法获得的微孔再生组织基质;实施例2组:创面移植采用实施例2的制备方法获得的微孔再生组织基质;对照组:移植自体刃厚皮片。5.微孔再生组织基质和皮片移植后,用凡士林纱布及无菌敷料覆盖,并固定,手术后单笼饲养,并固定,2周后换药。实验结果:皮片和微孔再生组织基质移植手术后两周,实施例1组和实施例2组再生组织基质大部分成活,两组现象无明显区别,有零星斑点散在创面,深层的微孔再生组织基质已于皮下组织连接紧密,对照组创面大部分刃厚皮片成活良好。移植手术后4周,实施例1组和实施例2组已接近愈合,血运良好,移植部位有脱屑,对照组创面接近愈合。移植手术后6周,实施例1组和实施例2组,创面已基本愈合,两组外观无明显差别,创面较为平整;对照组创面基本愈合。各组创面移植皮片成活率如表2所示。表2术后各组移植皮片成活率比较(%,±s)注:与对照组相比,*p<0.05术后2周和4周,实施例1组和实施例2组移植成活率低于对照组(p<0.05);术后6周,实施例1组和实施例2组与对照组相比无统计学意义(p>0.05)。实验例3牙齿种植试验病例选择:3个月牙中科接纳的需牙齿种植的患者23例,男13例,女10例,患者口腔卫生良好。材料:实施例1微孔再生组织基质。手术方法:术前检查,对所有种植病例进行口腔检查,使用卡尺测量牙槽嵴的宽度,槽嵴的高度。种植体植入和微孔再生组织基质植入,剪取合适大小的微孔再生组织基质,根据唇侧凹陷的程度,将组织基质折叠植入,结缔组织面朝外。术后常规给予抗生素抗炎治疗。观察方法:追踪观察患者术后1周、3周、3个月、6个月移植再生组织基质伤口愈合情况。并采用拍摄x光片评估种植体育邻牙及周围组织的关系。结果:观察手术去无明显肿胀,未出现皮疹、发热、局部麻木、疼痛、出血等症状。术后3个月x光片显示种植体周瑜组织紧密贴合无透射间隙,无明显横行骨吸收发生。术后6个月观察种植体成活率100%。虽然,以上通过实施例对本发明进行了说明,但本领域技术人员应了解,在不偏离本发明精神和实质的前提下,对本发明所做的改进和变型,均应属于本发明的保护范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1