一种巨噬细胞载药微颗粒制剂及其制备方法与流程
本发明属于药物靶向载体技术领域,更具体地,涉及一种巨噬细胞载药微颗粒制剂及其制备方法,尤其是一种提高小分子药物的肿瘤富集与被m2型肿瘤相关巨噬细胞靶向摄取与逆极化的纳米载药系统的制备与用途。
背景技术:
肿瘤相关巨噬细胞(tumor-associatedmacrophages,tam)占实体肿瘤质量的50%左右,是肿瘤微环境的重要组成部分,是引起肿瘤微环境免疫抑制的重要原因之一。大量研究表明,m2型肿瘤相关巨噬细胞能够促进肿瘤生长、血管生成、转移、耐药和免疫抑制,发挥促肿瘤作用。与此相反,m1型肿瘤相关巨噬细胞具有更强的肿瘤细胞吞噬能力,能够分泌il-12和tnf-α等促炎细胞因子、释放活性氧,有效杀伤肿瘤细胞,在抗肿瘤免疫反应中发挥重要作用。因此,将m2型肿瘤相关巨噬细胞逆极化成m1型,恢复其抗肿瘤能力,是肿瘤免疫治疗的一个重要途径。
纳米材料因其独特的理化特性和靶向修饰性等,在靶向药物输送方面具有明显优势。相对于人工合成的纳米药物载体可能具有的生物相容性差等问题,利用细胞或细胞来源的囊泡用作药物载体引起广泛关注。巨噬细胞在体内受到肿瘤微环境中细胞因子、趋化因子等多种信号的诱导,能够被招募至肿瘤组织。因此,巨噬细胞作为药物载体具有天然的肿瘤组织靶向性和深部穿透能力。但是,巨噬细胞负载的药物会影响巨噬细胞活性从而导致其药物传递效率下降。而且,被招募至肿瘤组织的巨噬细胞在肿瘤微环境的诱导下有可能会转变为m2型肿瘤相关巨噬细胞,有促进肿瘤生长的风险。因此,十分有必要寻找替代巨噬细胞的药物载体。
目前,细胞来源的胞外囊泡作为药物载体已引起关注。这种天然生物来源的囊泡具有低免疫原性、优良的体内长循环特性及较高细胞靶向性等特点。作为一类重要的胞外囊泡,微颗粒(microparticles,mps)是细胞在相关信号的刺激下触发细胞膜下的骨架变化,导致细胞膜在局部向外膨出,包裹细胞内容物,并以囊泡的形式释放到细胞外所产生的,其粒径在100-1000nm。巨噬细胞来源载药微颗粒能够被巨噬细胞摄取,有效递送小分子药物,逆转巨噬细胞极性。但是,这种巨噬细胞载药微颗粒不能够有效靶向并逆极化m2型巨噬细胞,影响了其对肿瘤的免疫治疗效果。
技术实现要素:
本发明的目的在于解决现有技术中存在的药物小分子无法在肿瘤部位有效富集和靶向并逆极化m2型肿瘤相关巨噬细胞的问题,提供一种巨噬细胞载药微颗粒制剂及其制备方法。
本发明采用如下技术方案:
一种巨噬细胞载药微颗粒制剂,包括细胞囊泡和包裹在所述细胞囊泡内的药物小分子有效成分,所述细胞囊泡源自于甘露糖修饰的巨噬细胞凋亡所释放。
大量研究表明,巨噬细胞能够有效吞噬肿瘤细胞来源微颗粒;但是,肿瘤细胞来源微颗粒会诱导巨噬细胞m2极化,增加肿瘤生长的风险。m2型肿瘤相关巨噬细胞高表达甘露糖受体。经甘露糖修饰的巨噬细胞微颗粒,表面修饰有甘露糖,可更加高效靶向至m2型肿瘤相关巨噬细胞,将小分子药物更多地递送至m2型肿瘤相关巨噬细胞中,从而增强对m2型肿瘤相关巨噬细胞的逆极化作用,恢复巨噬细胞对肿瘤细胞的杀伤能力,改善肿瘤微环境,提高抗肿瘤效果。
在上述技术方案中,所述巨噬细胞载药微颗粒为磷脂-聚乙二醇-甘露糖(dspe-peg-mannose)与巨噬细胞于培养基中混合培养后分泌获得,或分泌的巨噬细胞微颗粒与磷脂-聚乙二醇-甘露糖孵育获得。
dspe-peg-mannose修饰的巨噬细胞形态不变,且增殖良好;dspe-peg-mannose修饰的微颗粒粒径、zeta点位和形貌不变。
进一步地,在上述技术方案中,所述巨噬细胞与所述磷脂-聚乙二醇-甘露糖的含量比为106个:25μg,或所述巨噬细胞微颗粒与所述磷脂-聚乙二醇-甘露糖的含量比为1mg蛋白量:1μg。
在上述技术方案中,所述巨噬细胞为源自于人体外周血中的循环单核细胞、人源单核细胞系、小鼠骨髓来源巨噬细胞和小鼠单核/巨噬细胞系中的一种。
在上述技术方案中,所述药物小分子有效成分为可逆极化m2型肿瘤相关巨噬细胞至m1型的小分子药物中的一种或多种,优选为酪氨酸激酶抑制剂、集落刺激因子1受体抑制剂、t样受体激动剂和ampk激动剂中的一种或多种。
具体地,所述肿瘤包括急性白血病、淋巴瘤、前列腺癌、甲状腺癌、食道癌、骨癌、胃癌、乳腺癌、肺癌、卵巢癌、绒毛膜上皮癌、子宫颈癌、子宫体癌、肝癌、膀胱癌、皮肤癌、结肠癌或直肠癌。
在上述技术方案中,所述巨噬细胞载药微颗粒的粒径为400-600nm。
所述载药微颗粒制剂为纳米尺寸,更有利于载药微颗粒制剂在肿瘤部位富集、更有效靶向并逆极化m2型肿瘤相关巨噬细胞、恢复巨噬细胞对肿瘤的杀伤、改善肿瘤抑制性免疫微环境、有效杀伤肿瘤细胞和肿瘤干细胞,对正常组织不会产生任何损伤,避免使用外源性材料作为载体而对机体产生的毒副作用。
本发明另一方面还提供了一种巨噬细胞载药微颗粒制剂的制备方法,包括:
s1、用含磷脂-聚乙二醇-甘露糖的培养基培养巨噬细胞,得到甘露糖修饰的巨噬细胞;
s2、使用紫外线照射所述巨噬细胞使其凋亡,将高浓度药物小分子和所述巨噬细胞进行孵育,使药物小分子被所述巨噬细胞摄取,然后收集所释放的载药细胞囊泡,收集载药微颗粒,即得;
或,使用紫外线照射所述巨噬细胞使其凋亡,收集凋亡细胞所释放的细胞囊泡,然后将所述细胞囊泡与磷脂-聚乙二醇-甘露糖及药物小分子进行孵育,使细胞囊泡被甘露糖修饰、药物小分子被甘露糖修饰的细胞囊泡包裹,收集载药微颗粒,即得。
在上述技术方案中,所述步骤s1的具体操作为:在所述巨噬细胞培养过程中,加入磷脂-聚乙二醇-甘露糖进行膜磷脂交换,使甘露糖交换至所述巨噬细胞膜表面,即可得到甘露糖修饰的巨噬细胞。
进一步地,在上述技术方案中,用所述含有磷脂-聚乙二醇-甘露糖的培养基培养所述巨噬细胞的培养时间至少为3天。
在上述技术方案中,步骤s2中,所述载药微颗粒的收集条件为:4-6℃的低温下,以400-20000g的离心力收集。
本发明的优点:
(1)本发明将源自甘露糖修饰的巨噬细胞来源的微颗粒作为本发明的药物制剂载体,解决了外源载体的免疫原性,同时可使作为有效成分的小分子药物在肿瘤部位富集、肿瘤深部穿透及被m2型肿瘤相关巨噬细胞摄取,使本发明的载药微颗粒在降低小分子药物对机体毒副作用的同时,提高对m2型肿瘤相关巨噬细胞的逆极化效果,增强对肿瘤细胞的杀伤效果;
(2)本发明的dspe-peg-mannose修饰的巨噬细胞,其凋亡释放得到的微颗粒作为载体,相较于未经甘露糖修饰的巨噬细胞来源的微颗粒,具有更好的m2型肿瘤相关巨噬细胞逆极化效果,有效缓解肿瘤免疫抑制性微环境,增强对肿瘤干细胞的杀伤效果;
(3)本发明使用dspe-peg-mannose进行膜磷脂交换以修饰巨噬细胞,根据本发明记载的方案可从得到大量甘露糖修饰的巨噬细胞微颗粒用于制备本发明的药物制剂,成本小,操作简单。
附图说明
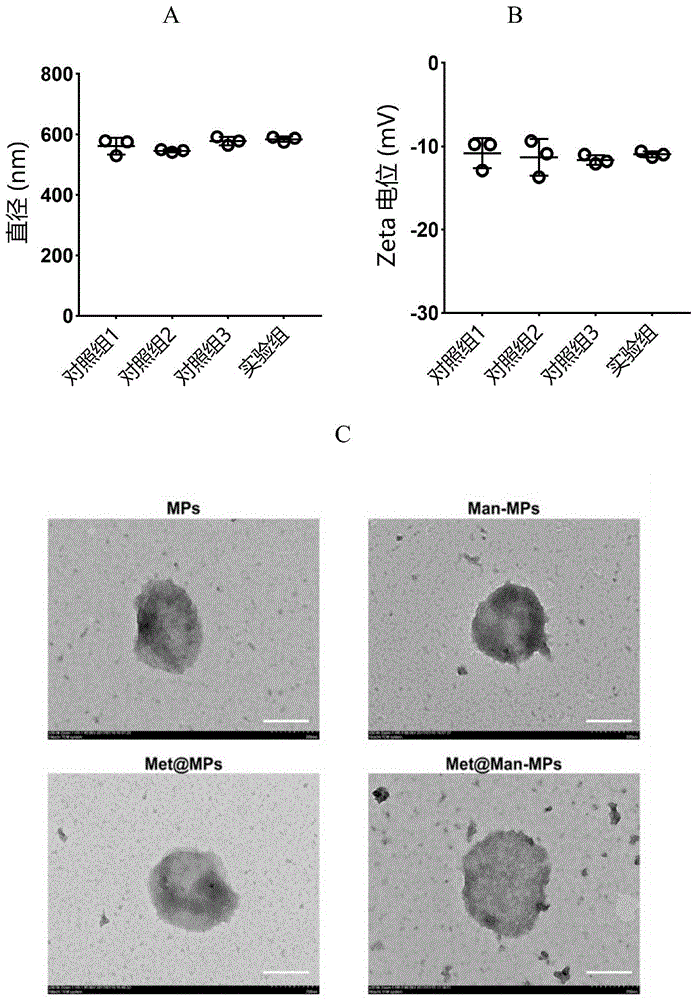
图1是本发明实施例1的巨噬细胞经过甘露糖修饰后产生的载药微颗粒的检测结果(a为颗粒粒径,b为颗粒zeta电位,c为颗粒tem照片);
图2是本发明实施例2的经甘露糖修饰后的载药微颗粒的检测结果(a为颗粒粒径,b为颗粒zeta电位);
图3是本发明实施例3的微颗粒摄取结果(a为肿瘤细胞、树突状细胞和不同极性巨噬细胞对pkh26标记的微颗粒的摄取结果,b为肿瘤细胞和不同极性巨噬细胞对载药微颗粒的摄取结果);
图4是本发明实施例4的微颗粒摄取结果(a为不同组织中的肿瘤细胞对pkh26标记的微颗粒的摄取结果,b为肿瘤组织中不同细胞对pkh26标记的微颗粒的摄取结果);
图5是本发明实施例5的载药微颗粒在荷瘤小鼠的不同组织中的分布结果;
图6是本发明实施例6的载药微颗粒的表达变化结果(a为载药微颗粒在荷瘤小鼠不同组织中的分布arg1表达变化,b和c分别为载二甲双胍微颗粒逆极化m2型肿瘤相关巨噬细胞后m2相关基因mgl1和mrc1表达变化,d为载二甲双胍微颗粒逆极化m2型肿瘤相关巨噬细胞后m1相关基因tnf-α表达变化);
图7是本发明实施例7的载r848微颗粒逆极化m2型肿瘤相关巨噬细胞后m2不同相关基因表达变化(a为arg1基因,b为mrc1基因);
图8是本发明实施例8的逆极化后的巨噬细胞对肿瘤细胞和肿瘤干细胞的体外杀伤测试结果(a为载药微颗粒逆极化后的巨噬细胞上清对小鼠肝癌细胞h22的杀伤效果,b和c分别为载药微颗粒逆极化后的巨噬细胞上清对3d软纤维蛋白胶中培养的h22肿瘤克隆球数目和大小的影响);
图9是本发明实施例9的载药微颗粒逆极化后的巨噬细胞上清对不同肿瘤细胞的杀伤效果(a为人肝癌细胞hepg2,b为小鼠乳腺癌细胞4t1);
图10是本发明实施例10的载药微颗粒逆极化后的巨噬细胞和h22肿瘤细胞共接种至小鼠皮下后对小鼠的杀伤效果(a为小鼠的成瘤比例,b为小鼠的皮下瘤的生长曲线,c为小鼠的肿瘤组织的重量);
图11是本发明实施例11的载药微颗粒通过尾静脉给药h22肝癌皮下瘤小鼠后的抑制效果(a为小鼠的肿瘤生长曲线,b为小鼠的肿瘤组织的重量,c为小鼠的生存期);
图12是本发明实施例12的载药微颗粒通过尾静脉给药h22肝癌皮下瘤小鼠后对小鼠的杀伤效果(a为小鼠肿瘤组织中侧群细胞比例,b和c分别为分散小鼠肿瘤组织得到的单分散细胞在3d软纤维蛋白胶中形成的克隆球数目和大小);
图13是本发明实施例13的载药微颗粒通过尾静脉给药h22肝癌皮下瘤小鼠后的逆极化作用效果(a和b分别为小鼠肿瘤组织中m2和m1型肿瘤相关巨噬细胞的比例);
图14是本发明实施例14的载药微颗粒通过尾静脉给药h22肝癌皮下瘤小鼠后小鼠肿瘤组织中不同细胞的比例(a为cd8+t细胞,b为激活的cd8+t细胞,c为mdsc细胞,d为treg细胞);
图15是本发明实施例15的载药微颗粒通过尾静脉给药h22肝癌皮下瘤小鼠后对小鼠安全性的测试结果(a为小鼠血清中肌酐含量,b为小鼠血清中血尿氮素含量,c为小鼠体重)。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚明白,下面结合附图和实施例,对本发明实施例中的技术方案进行清楚地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。
基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
若未特别指明,实施例中所用技术手段为本领域技术人员所熟知的常规手段。
下述实施例中使用的各种肿瘤细胞、药物及实验动物:
h22小鼠肝癌细胞、人肝癌细胞系hepg2和小鼠巨噬细胞系raw264.7,均可从美国atcc公司或中国典型物保藏中心cctcc购买;
balb/c小鼠,购自武汉大学医学实验动物中心,体重18-20克;
二甲双胍盐酸盐购自百灵威科技有限公司;
r848购自invivogen公司。
实施例1甘露糖修饰的巨噬细胞来源载药微颗粒的制备及表征
1、实验材料和试剂
小鼠巨噬细胞系raw264.7、二甲双胍盐酸盐、dspe-peg-mannose,紫外线装置为常规细胞超净工作台所有。
2、实验步骤
1)在直径10cm的无菌培养皿中,使用dmem高糖全培养基(含有25μg/mldspe-peg-mannose)培养raw264.7小鼠巨噬细胞3d,使dspe-peg-mannose能够和巨噬细胞进行膜磷脂交换。
2)当细胞量达到5×107时,弃去培养基,用磷酸盐缓冲液(pbs)清洗后,加入4ml无血清dmem培养基,用紫外照射60min后,加入1ml二甲双胍,使二甲双胍终浓度为4mg/ml。
3)在施用二甲双胍后的24h,对凋亡巨噬细胞实施分离。取上清进行逐步离心,以200g、600g的转速各离心10min后,以14000g的离心力离心1min,以除去细胞及碎片,取离心后的上清进一步以20000g的离心力离心1h,得到甘露糖修饰的巨噬细胞凋亡所产生的载药微颗粒(met@man-mps),作为实验组。类似的处理方式,不添加dspe-peg-mannose不加二甲双胍的细胞上清收集到的为巨噬细胞微颗粒(mps),作为对照组1;添加dspe-peg-mannose不加二甲双胍的细胞上清收集到的为甘露糖修饰的微颗粒(man-mps),作为对照组2;不添加dspe-peg-mannose而加二甲双胍的细胞上清收集到的为未经甘露糖修饰的载药微颗粒(met@mps),作为对照组3。
4)将得到的微颗粒溶解于pbs中,使用带633nmhe-ne激光器的纳米粒度及zeta电位仪检测其粒径以及zeta电位分布。具体设定条件为:温度为25℃,平衡时间为120s。同时,将铜网有碳膜一面朝上置于一次性pe手套上,将一定浓度的微颗粒滴加在铜网表面,平衡5min,依次使用4%多聚甲醛固定10min,磷钨酸染色5min,pbs清洗后用滤纸吸干铜网表面液体,将铜网置于滤纸上静置过夜,使用tem观察样品形貌。
3、实验结果
实验结果发现,得到的微颗粒的平均粒径分布为500-600nm(图1a),zeta电位为-12mv左右(图1b),表明微颗粒在经过dspe-peg-mannose修饰及负载二甲双胍后基本不改变微颗粒的粒径和zeta电位。tem图片显示(图1c),微颗粒形貌为球形或者椭球形。
实施例2使用紫外线诱导巨噬细胞凋亡产生的微颗粒经甘露糖修饰、与小分子药物孵育获得载药微颗粒
1、实验材料和试剂
使用的小鼠巨噬细胞系raw264.7、二甲双胍盐酸盐、dspe-peg-mannose同实施例1,紫外线装置为常规细胞超净工作台所有。
2、实验步骤
1)使用dmem高糖全培养基,在直径10cm的无菌培养皿中培养raw264.7小鼠巨噬细胞,使细胞量达到5×107。
2)对raw264.7小鼠巨噬细胞(带细胞培养基)进行紫外照射60min。
3)在紫外线照射24h后,对凋亡的raw264.7巨噬细胞培养基的上清进行逐步分离,同实施例1,得到巨噬细胞的微颗粒。
4)将所获得的微颗粒用1mlpbs重悬后,加入dspe-peg-mannose,使dspe-peg-mannose终浓度为1μg/ml,4℃孵育过夜,之后以20000g离心力离心1h,获得甘露糖修饰的微颗粒。
5)将所获得的甘露糖修饰的微颗粒用1mlpbs重悬后,加入二甲双胍,使二甲双胍终浓度为4mg/ml,室温孵育2h后,以20000g的离心力离心1h,再用pbs清洗2次并以20000g离心1h,获得甘露糖修饰的载药微颗粒。
6)将得到的微颗粒溶解于pbs中,放于37℃下不同时间后,使用带633nmhe-ne激光器的纳米粒度及zeta电位仪检测其粒径以及zeta电位分布。具体设定条件为:温度为25℃,平衡时间为120s。甘露糖修饰的载药微颗粒作为实验组,未经甘露糖修饰的未载药微颗粒作为对照组1,经甘露糖修饰的未载药微颗粒作为对照组2,未经甘露糖修饰的载药微颗粒作为对照组3。
3、实验结果
实验结果发现,紫外线照射后得到的微颗粒,经甘露糖修饰和负载二甲双胍后,其平均粒径依旧为500-600nm(图2a),zeta电位为-11mv左右(图2b),而且在37℃下放置一定时间后,其平均粒径和zeta电位仍能够基本维持不变,表明微颗粒在经过dspe-peg-mannose修饰及负载二甲双胍后仍然具有比较好的稳定性。
实施例3微颗粒在体外对m2巨噬细胞的靶向性
1、实验材料和试剂
h22小鼠肝癌细胞,dc2.4小鼠树突状细胞,使用的小鼠巨噬细胞系raw264.7同实施例1,il-4,lps,ifn-γ,二甲双胍、dspe-peg-mannose同实施例1。
2、实验步骤
1)收集甘露糖修饰的载药微颗粒,收集方法同实施例1。
2)于raw264.7中加入20ng/mlil-4或者20ng/mlifn-γ及100ng/mllps刺激诱导24h得到m1或者m2型巨噬细胞。分别将2×105个m0、m1、m2巨噬细胞、dc2.4、h22培养在细胞培养板中,12h后去掉培养基。
3)使用细胞膜红色荧光染料pkh26对微颗粒进行染色。
4)细胞培养板中的细胞在去掉培养基后,分别加入含有50μg(蛋白量)pkh26标记的mps、man-mps的无血清培养基,37℃、5%co2下孵育2h,收集细胞,pbs清洗3次,250g离心3min。收集到的细胞沉淀中加入400μlpbs重悬,使用fc500流式细胞仪检测细胞pkh26荧光强度。检测参数:ex=488nm,检测通道fl2。mps为对照组,man-mps为实验组。
5)另外,分别将5×105个m0、m1、m2巨噬细胞、h22培养在细胞培养板中,12h后去掉培养基。分别加入药物浓度为40μg/ml的二甲双胍、met@mps、met@man-mps,37℃、5%co2下孵育2h,收集细胞,pbs清洗3次,250g离心3min。收集到的细胞沉淀中加入500μlpbs重悬,超声破碎仪破碎细胞后,12000g离心10min,取上清进hplc检测细胞中二甲双胍的含量。检测参数:c18柱(5×250mm,颗粒5μm),流动相为甲醇:15mmnahco3=60:40(v:v),流速1.0ml/min,检测波长233nm。游离met为对照组1,met@mps为对照组2,met@man-mps为实验组。
3、实验结果
将mps、man-mps和不同细胞,包括m0(raw264.7)、m1(经inf-γ和lps处理的raw264.7细胞)、m2(经il-4处理的raw264.7细胞)、dc和肿瘤h22细胞共孵育,流式细胞分析结果表明,同mps相比,在m2型巨噬细胞中man-mps的荧光强度更强;同其他细胞相比,m2型巨噬细胞能够摄取更多man-mps(图3a)。将负载二甲双胍的载药微颗粒与上述细胞共孵育,hplc检测二甲双胍的含量,结果与上述流式结果相类似(图3b),表明了man-mps能够更加有效地靶向到m2型巨噬细胞。
实施例4微颗粒在m2型肿瘤相关巨噬细胞的蓄积
1、实验材料和试剂
h22-gfp小鼠肝癌细胞为实验室构建所得,二甲双胍和流式抗体商购获得,balb/c小鼠购自武汉大学医学动物中心。
2、实验步骤
1)小鼠肝癌h22皮下瘤模型的建立:在balb/c小鼠背部右下侧近右下肢处皮下接种肝癌h22-gfp细胞悬液100μl(细胞数为1×106),建立小鼠肝癌h22皮下瘤模型。
2)当小鼠肝癌h22-gfp皮下瘤长到体积为0.09-0.12cm3时,随机将荷瘤小鼠(18-22g)分为3组,每组4只。将所制备的pkh26标记的甘露糖修饰的巨噬细胞来源的微颗粒以100mg(蛋白量)/kg的给药量、200μl的剂量分别经尾静脉注射4只balb/c小鼠作为实验组,对4只balb/c小鼠注射相同剂量的游离pkh26,作为对照组1,将所制备的pkh26标记的未经甘露糖修饰的巨噬细胞来源的载药微颗粒以100mg(蛋白量)/kg的给药量、200μl的剂量分别经尾静脉注射4只balb/c小鼠作为对照组2。
3)尾静脉注射24h后各组处死小鼠,分别取肝、脾、肺、肿瘤。肺及肿瘤剪成2mm3左右的小块,使用0.8mg/ml胶原酶在37℃下消化40min后,过1次200目不锈钢筛网和2次200目尼龙网,经红细胞裂解液裂红、pbs清洗后得到单细胞悬液。肿瘤单细胞悬液经淋巴细胞分离液提纯得到肿瘤组织淋巴细胞悬液。肝、脾碾碎后,过1次200目不锈钢筛网和2次200目尼龙网,经裂红、pbs清洗后得到单细胞悬液。
4)得到的单细胞悬液,取1×106个细胞加入荧光染料标记的抗体,使用cytoflexs流式细胞仪检测不同细胞中pkh26的荧光强度。cd11b+f4/80+为总巨噬细胞,cd11b+f4/80+cd11c+cd206-为m1型巨噬细胞,cd11b+f4/80+cd11c-cd206+为m2型巨噬细胞,cd45+f4/80-cd11c+为树突状细胞,cd45+cd3+cd4+为cd4t细胞,cd45+cd3+cd8+为cd8t细胞,cd45+cd11b+gr1+为髓源抑制性细胞(mdsc),cd3+cd4+cd25+foxp3+为调节性t细胞(treg),gfp+为肿瘤细胞。
3、实验结果
由图4a所示,相对于肝枯否细胞、脾巨噬细胞、脾树突状细胞和肺巨噬细胞,肿瘤相关巨噬细胞中能够摄取更多甘露糖修饰的微颗粒;而在肿瘤组织中(图4b),相对于未经甘露糖修饰的微颗粒和有利pkh26,甘露糖修饰的微颗粒在m2巨噬细胞中的摄取量更多。进一步表明甘露糖修饰的微颗粒在肿瘤部位能够有效蓄积,而且对于m2型肿瘤相关巨噬细胞具有良好靶向能力。
实施例5载药微颗粒在肿瘤组织中的蓄积
1、实验材料和试剂
使用的h22小鼠肝癌细胞同实施例2,二甲双胍商购获得,balb/c小鼠购自武汉大学医学动物中心。
2、实验步骤
1)按照实例1收集met@mps、met@man-mps。
2)小鼠肝癌h22皮下瘤模型构建同实施例3。
3)当小鼠肝癌h22皮下瘤长到体积为0.09-0.12cm3时,将荷瘤小鼠(18-22g)随机分为4组,每组3只。将所制备的甘露糖修饰的巨噬细胞来源的载药微颗粒以10mg(二甲双胍当量)/kg的给药量、200μl的剂量分别经尾静脉注射3只balb/c小鼠作为实验组,对3只balb/c小鼠注射相同剂量的游离二甲双胍,作为对照组1,将所制备的未经甘露糖修饰的巨噬细胞来源的载药微颗粒以10mg(二甲双胍当量)/kg的给药量、200μl的剂量分别经尾静脉注射3只balb/c小鼠作为对照组2,同时对另外3只balb/c小鼠注射100mg/kg的游离二甲双胍,作为对照组3。
4)尾静脉注射24h后各组处死小鼠,取出心、肝、脾、肺、肾、肿瘤并制备成组织匀浆,加入等体积甲醇萃取,12000g离心10min,取上清通过hplc检测其中的药物含量。
3、实验结果
从图5的组织分布图可知,尾静脉注射载药微颗粒24h后肿瘤中的二甲双胍的浓度要远高于注射游离二甲双胍组;注射甘露糖修饰的载药微颗粒的实验组中,二甲双胍在肿瘤部位的浓度显著高于注射未经甘露糖修饰的载药微颗粒对照组,表明甘露糖修饰的载药微颗粒能在肿瘤部位更多地富集。
实施例6载二甲双胍微颗粒逆极化m2巨噬细胞
1、实验材料和试剂
使用的raw264.7小鼠巨噬细胞同实施例1,il-4、trizol、逆转录试剂盒和sybrgreen染料均为商购获得。
2、实验步骤
1)载药微颗粒收集同实施例1。
2)将5×105个raw264.7细胞接种于细胞六孔板中,加入20ng/mlil-4刺激24h得到m2巨噬细胞。
3)在m2巨噬细胞中,加入载药微颗粒共孵育,24h后收集细胞,提取总rna,逆转录成cdna,使用荧光定量pcr法检测m1、m2相关基因的表达。按20μg/ml(二甲双胍当量)加入甘露糖修饰的载药微颗粒(met@man-mps)的m2巨噬细胞作为实验组,不做处理的m2巨噬细胞作为对照组1,按60μg/ml(蛋白量)加入未经甘露糖修饰的微颗粒(mps)的m2巨噬细胞作为对照组2,按60μg/ml(蛋白量)加入经甘露糖修饰的微颗粒(man-mps)的m2巨噬细胞作为对照组3,加入20μg/ml二甲双胍(met)m2巨噬细胞作为对照组4,按20μg/ml(二甲双胍当量)加入未经甘露糖修饰的载药微颗粒(met@mps)的m2巨噬细胞作为对照组5,加入200μg/ml二甲双胍(highmet)m2巨噬细胞作为对照组6。
3、实验结果
如图6a-d所示,相比于未载药微颗粒、未经甘露糖修饰的载药微颗粒和游离二甲双胍,经甘露糖修饰的载药微颗粒能够显著升高m1相关基因tnf-a和inos的表达量,显著下调m2相关基因arg1和mrc1的表达量。表明本发明提供的经甘露糖修饰的载二甲双胍微颗粒能够有效逆极化m2型巨噬细胞。
实施例7载r848微颗粒逆极化m2巨噬细胞
1、实验材料和试剂
使用的raw264.7小鼠巨噬细胞同实施例1,r848、il-4、trizol、逆转录试剂盒和sybrgreen染料均为商购获得。
2、实验步骤
1)载药微颗粒收集同实施例1,其中r848孵育浓度为10μg/ml。
2)m2巨噬细胞逆极化处理及检测方法同实施例6。按10ng/ml(r848当量)加入甘露糖修饰的载r848微颗粒(r848@man-mps)处理的m2巨噬细胞作为实验组,不做处理的m2巨噬细胞作为对照组1,按10μg/ml(蛋白量)加入未经甘露糖修饰的未载药微颗粒(mps)处理的m2巨噬细胞作为对照组2,按10μg/ml(蛋白量)加入经甘露糖修饰的未载药微颗粒(man-mps)处理的m2巨噬细胞作为对照组3,加入10ng/mlr848处理的m2巨噬细胞作为对照组4,按10ng/ml(r848当量)加入未经甘露糖修饰的载r848微颗粒(r848@mps)的m2巨噬细胞作为对照组5,加入100ng/mlr844处理的m2巨噬细胞作为对照组6。
3、实验结果
如图7a-b所示,相比于未载药微颗粒、未经甘露糖修饰的载药微颗粒和游离r848,经甘露糖修饰的载r848微颗粒能够显著显著下调m2相关基因arg1和mrc1的表达量,逆极化m2巨噬细胞至m1表型。表明本发明提供的经甘露糖修饰的载药微颗粒能够有效逆极化m2型巨噬细胞。
实施例8逆极化后的巨噬细胞对肿瘤细胞和肿瘤干细胞的体外杀伤
1、实验材料和试剂
使用的raw264.7小鼠巨噬细胞同实施例1,h22小鼠肝癌细胞同实施例2,二甲双胍和3d软纤维蛋白胶为商购获得。
2、实验步骤
1)载药微颗粒收集同实施例1。
2)m2巨噬细胞逆极化处理方法同实施例5。
3)m2巨噬细胞加入载药微颗粒处理24h,将含有载药微颗粒的细胞上清吸去,pbs清洗细胞2次后,加入新鲜的dmem培养基(含10%fbs)继续培养,12h后收集细胞上清,12000g、10min离心去除细胞碎片,得到巨噬细胞条件培养基(conditionalmedium,cm)。按20μg/ml(二甲双胍当量)加入met@man-mps的m2巨噬细胞的cm作为实验组,m0巨噬细胞所得的cm作为对照组1,m2巨噬细胞所得的cm作为对照组2,按60μg/ml(蛋白量)加入mps的m2巨噬细胞的cm作为对照组3,按60μg/ml(蛋白量)加入man-mps的m2巨噬细胞的cm作为对照组4,加入20μg/ml二甲双胍m2巨噬细胞的cm作为对照组5,按20μg/ml(二甲双胍当量)加入met@mps的m2巨噬细胞的cm作为对照组6,加入200μg/ml二甲双胍m2巨噬细胞的cm作为对照组7。
4)h22细胞以1×104的细胞密度接种于96孔板内,过夜孵育后去掉培养基,加入100μl巨噬细胞条件培养基,37℃、5%co2条件下孵育24h后每孔加入10μlcck8溶液孵育4h,使用318c酶标仪检测每孔在450nm处吸光度,观察肿瘤细胞的死亡情况。
5)400个/孔h22细胞接种在铺有1mg/ml3d软纤维蛋白胶的96孔板中,37℃、5%co2条件下培养5天。去掉培养基,加入100μl巨噬细胞条件培养基继续孵育24h后,显微镜下观察并拍照,统计肿瘤细胞球的数目与大小。
3、实验结果
如图8a所示,m2巨噬细胞条件培养基能够促进h22小鼠肝癌细胞的生长;但是,经met@man-mps逆极化后的m2巨噬细胞条件培养基恢复了对h22肿瘤细胞的杀伤能力,能够有效抑制h22细胞的增殖,其细胞杀伤效果优于met@mps和高浓度的met。体外肿瘤干细胞毒性试验结果发现,用met@man-mps逆极化后的巨噬细胞的条件培养基孵育h22肿瘤克隆球后,存活的肿瘤克隆球的数量(图8b)和大小(图8c)均显著降低,说明met@man-mps处理后的m2巨噬细胞对于肿瘤干细胞也具有杀伤能力。
实施例9更多肿瘤细胞的应用
1、实验材料和试剂
不同肿瘤细胞系包括人肝癌细胞系hepg2和小鼠乳腺癌细胞系4t1;化疗药阿霉素为商购获得。
2、实验步骤
1)微颗粒收集方法同实施例1。
2)m2巨噬细胞逆极化处理同实施例6。
3)实验方法同实施例8。
3、实验结果
如图9a和b所示,met@man-mps逆极化后的巨噬细胞对不同肿瘤细胞均有高的杀伤率,而且效果均要显著好于met@mps和高剂量met,表明本发明提供的制剂适用多种肿瘤细胞,且可获得良好的治疗效果。
实施例10逆极化后的巨噬细胞对肿瘤细胞的体内杀伤
1、实验材料和试剂
raw264.7小鼠巨噬细胞同实施例1,h22小鼠肝癌细胞同实施例2,二甲双胍商购获得,balb/c小鼠购自武汉大学医学动物中心。
2、实验步骤
1)载药微颗粒收集同实施例1。
2)m2巨噬细胞逆极化处理方法同实施例6。
3)收集逆极化后的m2巨噬细胞,按照巨噬细胞:h22小鼠肝癌细胞=1:1的比例制成细胞混悬液,在balb/c小鼠背部右下侧近右下肢处皮下接种细胞混悬液100μl(巨噬细胞和h22细胞数均为1×106),建立小鼠肝癌h22皮下瘤模型。检测小鼠的成瘤率、肿瘤体积。23天后颈椎脱臼法处死小鼠,取出肿瘤组织,洗净、晾干后称重并拍照。按20μg/ml(二甲双胍当量)加入met@man-mps逆极化的巨噬细胞和h22细胞共接种的balb/c小鼠作为实验组,接种h22细胞的balb/c小鼠作为对照组1,不做处理的m2巨噬细胞和h22细胞共接种的balb/c小鼠作为对照组2,按60μg/ml(蛋白量)加入mps处理的m2巨噬细胞和h22细胞共接种的balb/c小鼠作为对照组3,按60μg/ml(蛋白量)加入man-mps处理的m2巨噬细胞和h22细胞共接种的balb/c小鼠作为对照组4,加入20μg/ml二甲双胍处理的m2巨噬细胞和h22细胞共接种的balb/c小鼠作为对照组5,按20μg/ml(二甲双胍当量)加入met@mps处理的m2巨噬细胞和h22细胞共接种的balb/c小鼠作为对照组6,加入200μg/ml二甲双胍处理的m2巨噬细胞和h22细胞共接种的balb/c小鼠作为对照组7。
3、实验结果
m2巨噬细胞和h22肿瘤细胞共接种,能够促进balb/c小鼠h22皮下瘤的成瘤率(图10a)和生长速度(图10b);经met@man-mps逆极化后的m2巨噬细胞,显著抑制了balb/c小鼠h22皮下瘤的成瘤率,延缓了肿瘤生长速度。23天后取出的肿瘤组织重量结果也表明,met@man-mps逆极化后的巨噬细胞在体内对肿瘤细胞杀伤效果显著优于met@mps和高浓度的met(图10c)。
实施例11载药微颗粒对小鼠肝癌皮下瘤模型的抑制效果
1、实验材料和试剂
使用的h22小鼠肝癌细胞同实施例2,二甲双胍商购获得,balb/c小鼠购自武汉大学医学动物中心。
2、实验步骤
1)微颗粒收集同实施例1。
2)小鼠肝癌h22皮下瘤模型构建同实施例3。
3)当肿瘤大小达到50mm3时,将荷瘤小鼠平均分为7组,每组12只,尾静脉注射pbs、mps、man-mps、met、met@mps、met@man-mps(met终浓度为10mg/kg)或者100mg/kg的高剂量游离met,每隔2天给药一次,总共6次,每天固定时间测量肿瘤大小。给药结束后,每组随机抽取7只继续进行生存期实验。引颈法处死小鼠,取出肿瘤组织,清洗、擦干后称重并拍照。met@man-mps处理的balb/c小鼠为实验组,pbs处理的balb/c小鼠为对照组1,mps处理的balb/c小鼠为对照组2,man-mps处理的balb/c小鼠为对照组3,10mg/kg游离met处理的balb/c小鼠为对照组4,met@mps处理的balb/c小鼠为对照组5,100mg/kg高剂量游离met处理的balb/c小鼠为对照组6。
3、实验结果
如图11a肿瘤生长曲线所示,met@man-mps显著抑制了肿瘤生长,其肿瘤抑制效果明显优于met@mps组和高剂量met组。给药结束后,取出的肿瘤组织的称重结果也表明,met@man-mps显著抑制了肿瘤生长(图11b)。生存期结果也发现(图11c),met@man-mps给药之后,延长了荷瘤小鼠的生存期,显著优于其他对照组。
实施例12载药微颗粒对体内肿瘤干细胞的杀伤作用
1、实验材料和试剂
使用的h22小鼠肝癌细胞同实施例2,二甲双胍商购获得,balb/c小鼠购自武汉大学医学动物中心。
2、实验步骤
1)按照实施例11的方法对小鼠肝癌皮下瘤模型进行给药处理。
2)给药结束后,引颈法处理小鼠,取出肿瘤组织,洗净并按实施例3将其分散为单细胞,使用cytoflexs流式细胞仪进行侧群分析,检测不同给药处理后肿瘤组织中侧群细胞比例。同时,取单分散的肿瘤细胞计数,以1000个/孔的细胞密度接种在铺有1mg/ml3d软纤维蛋白胶的96孔板内,37℃、5%co2条件下培养5天后,观察并统计肿瘤细胞球的数目和大小。met@man-mps处理的balb/c小鼠为实验组,pbs处理的balb/c小鼠为对照组1,mps处理的balb/c小鼠为对照组2,man-mps处理的balb/c小鼠为对照组3,10mg/kg游离met处理的balb/c小鼠为对照组4,met@mps处理的balb/c小鼠为对照组5,100mg/kg高剂量游离met处理的balb/c小鼠为对照组6。
3、实验结果
如图12a所示,经药物治疗后,met@man-mps组侧群细胞比例最小,说明其能够有效杀伤侧群细胞,且效果均显著好于met@mps和高剂量游离met。将分散的单个细胞接种3d软纤维蛋白胶中培养一段时间,结果发现met@man-mps组肿瘤细胞在3d软纤维蛋白胶中形成的肿瘤克隆球的数目(图12b)和大小(图12c)均显著降低,说明met@man-mps能够极大地抑制肿瘤细胞干性。
实施例13载药微颗粒对体内肿瘤相关巨噬细胞的逆极化作用
1、实验材料和试剂
使用的h22小鼠肝癌细胞同实施例2,二甲双胍商购获得,balb/c小鼠购自武汉大学医学动物中心。
2、实验步骤
1)按照实施例11的方法对小鼠肝癌皮下瘤模型进行给药处理。
2)给药结束后,引颈法处死小鼠,取出肿瘤组织,洗净并按实施例3将其分散为单细胞。取106个细胞,加入不同荧光染料标记的抗体,4℃、避光孵育30min。离心收集细胞,用500μlpbs重悬,使用cytoflexs流式细胞仪检测各组肿瘤组织中m1、m2巨噬细胞的比例。cd11b+f4/80+cd11c+cd206-为m1型巨噬细胞,cd11b+f4/80+cd11c-cd206+为m2型巨噬细胞。met@man-mps处理的balb/c小鼠为实验组,pbs处理的balb/c小鼠为对照组1,mps处理的balb/c小鼠为对照组2,man-mps处理的balb/c小鼠为对照组3,10mg/kg游离met处理的balb/c小鼠为对照组4,met@mps处理的balb/c小鼠为对照组5,100mg/kg高剂量游离met处理的balb/c小鼠为对照组6。
3、实验结果
经药物治疗后,met@man-mps组m2型肿瘤相关巨噬细胞比例最小(图13a),而m1型肿瘤相关巨噬细胞比例明显上升(图13b),说明其能够在体内有效逆极化m2型肿瘤相关巨噬细胞成m1型,且效果均显著好于met@mps和高剂量游离met。
实施例14载药微颗粒对肿瘤微环境的改善
1、实验材料和试剂
使用的h22小鼠肝癌细胞同实施例2,二甲双胍商购获得,balb/c小鼠购自武汉大学医学动物中心。
2、实验步骤
1)按照实施例8的方法对小鼠肝癌皮下瘤模型进行给药处理。
2)给药结束后,引颈法处死小鼠,取出肿瘤组织,洗净并按实施例3分离提纯得到肿瘤组织中的淋巴细胞。取106个细胞,加入不同荧光染料标记的抗体,4℃、避光孵育30min。离心收集细胞,用500μlpbs重悬,使用cytoflexs流式细胞仪检测肿瘤组织中cd8t细胞、激活的cd8t细胞、mdscs和tregs的比例。cd45+cd3+cd8+为cd8t细胞,cd45+cd3+cd8+cd69+为激活的cd8t细胞,cd45+cd11b+gr1+为髓源抑制性细胞(mdsc),cd3+cd4+cd25+foxp3+为调节性t细胞(treg)。met@man-mps处理的balb/c小鼠为实验组,pbs处理的balb/c小鼠为对照组1,mps处理的balb/c小鼠为对照组2,man-mps处理的balb/c小鼠为对照组3,10mg/kg游离met处理的balb/c小鼠为对照组4,met@mps处理的balb/c小鼠为对照组5、100mg/kg高剂量游离met处理的balb/c小鼠为对照组6。
3、实验结果
如图14a所示,荷瘤小鼠经药物治疗后,met@man-mps组肿瘤组织中cd8t细胞比例显著升高,同时处于激活状态的cd8t细胞比例也显著升高(图14b),且效果均显著好于met@mps和高剂量游离met;同时肿瘤组织中具有免疫抑制作用的mdsc和treg在met@man-mps治疗后的小鼠肿瘤中比例也是最低的(图14c-d),说明met@man-mps能够显著增加肿瘤组织中细胞毒性t细胞的比例,改善肿瘤免疫抑制性微环境,增强对肿瘤细胞的杀伤,抑制肿瘤组织的生长,具有良好的肿瘤免疫治疗效果。
实施例15载药微颗粒的生物安全性
1、实验材料和试剂
使用的h22小鼠肝癌细胞同实施例3,二甲双胍商购获得,balb/c小鼠购自武汉大学医学动物中心。
2、实验步骤
1)按照实施例11的方法对小鼠肝癌皮下瘤模型进行给药处理。
2)每天固定时间称量小鼠体重。第13天,对荷瘤小鼠取静脉血,检测血清中肌酐和血尿素氮含量。met@man-mps处理的balb/c小鼠为实验组,pbs处理的balb/c小鼠为对照组1,mps处理的balb/c小鼠为对照组2,man-mps处理的balb/c小鼠为对照组3,10mg/kg游离met处理的balb/c小鼠为对照组4,met@mps处理的balb/c小鼠为对照组5,100mg/kg高剂量游离met处理的balb/c小鼠为对照组6。
3、实验结果
结果表明,相比于注射pbs的对照组小鼠,注射met@man-mps组小鼠的肌酐和血尿素氮没有明显变化,(如图15a-b所示),体重也无明显变化(如图15c所示),说明其肾脏毒性很低。可见,用巨噬细胞来源的载药微颗粒制剂对机体基本没有毒副作用。
综上,本发明提供的载药微颗粒更有利于在肿瘤组织高度富集、及更易被m2型肿瘤相关巨噬细胞摄取,提高小分子药物对m2型肿瘤相关巨噬细胞的逆极化效果,改善肿瘤微环境,增强对肿瘤细胞的杀伤,能够解决小分子药物无法在肿瘤部位有效富集和靶向并逆极化m2型肿瘤相关巨噬细胞的问题,同时降低了小分子药物对机体的毒副作用。
最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!