一种气体驱动的靶向纳米材料、制备方法及其应用与流程
本发明涉及纳米材料领域,具体涉及一种气体驱动的靶向纳米材料、制备方法及其应用。
背景技术:
随着纳米医药及纳米生物技术的迅速发展,通过物理吸附、化学偶联等方式,将药物分子装载于纳米载体的内部或外表面,形成纳米载药系统,由于纳米载体具有靶向性,能够改善药代动力学和体内分布,使药物直达病灶部位,提高药物的生物利用率;同时,纳米载体还能够控制药物分子的释放速度,能够减轻甚至避免药物的毒副作用,进而提高药物的生物安全性,因此,纳米载药系统作为给药工具具有较好的应用前景,得到了广泛关注。
而纳米载药系统的给药效果与那载体的性能有直接关系,稳定的那么载体能够表现出刺激反应特性,主动触发使药物释放,从而将药物集中在可控的治疗窗口内。目前触发药物释放的方式包括内源性刺激和外源性刺激,常见的外源性刺激是通过ph值和生物分子的方式实现的,而外源性刺激则是通过温度、光线、超声波、磁场等,外源刺激通过破坏载体系统的稳定性来促进药物的释放。
hsing-wensung等人首先报道了含有co2气泡的药物载体,在这种药物载体中含有诱发性药物,药物在到达靶点前是稳定的,到达病灶后能够诱发二氧化碳气泡产生,进而快速触发药物释放,这种药物载体能够实现病变组织局部积累药物,同时减少对正常组织的副作用,提高其治疗效果的有效性,但是,目前含有co2气泡的药物载体稳定性较差,且药物负载效率较低。
技术实现要素:
针对现有技术中存在的缺陷,本发明的目的在于提供一种气体驱动的靶向纳米材料、制备方法及其应用,不仅稳定性较好,而且药物负载效率较高。
为达到以上目的,本发明采取的技术方案是:
一种气体驱动的靶向纳米材料,包括响应膜,所述响应膜的内部设置有反应核,所述反应核内包覆有药物分子和气体前驱分子,所述响应膜能够与外部细菌/病毒/蛋白特异性结合,并在结合时被破坏,同时,反应核被破坏,气体前驱分子释放气体,所述药物分子能够随气体释放到响应膜外部,与细菌/病毒/蛋白作用。
在上述技术方案的基础上,所述响应膜上设置有响应分子,所述响应分子用于特异性识别细菌/病毒/蛋白。
在上述技术方案的基础上,所述响应膜为磷脂类构成。
在上述技术方案的基础上,所述反应核为封闭结构,且为脂溶性材料,可以为圆形、矩形或者异形结构。
在上述技术方案的基础上,所述反应核为相变结构:当外部的ph值或/和渗透压或/和温度等条件改变时,反应核的封闭结构变为开放结构,外部的成分能够进入反应核的内部,反应核内部的成分能够释放到外部。
在上述技术方案的基础上,所述气体前驱分子为cao2、h2o2、na2co3nahco3或nh4hco3。
在上述技术方案的基础上,所述药物分子为抗菌药/抗病毒药/抗肿瘤药。
一种气体驱动的靶向纳米材料的制备方法,包括以下步骤:
配置相变材料,将相变材料与相应的气体前驱分子和药物分子混合,得到反应核前体;配置磷脂溶液,将反应核前体加入磷脂溶液并搅拌,使包裹有气体前驱分子和药物分子的反应核前体均匀分散且被磷脂溶液包裹。
在上述技术方案的基础上,将反应核前体加入磷脂溶液并搅拌后还包括以下步骤:将反应所得物进行离心、过滤,得到靶向纳米材料。
一种气体驱动的靶向纳米材料的应用,所述靶向纳米材料用于细菌、病毒或/和肿瘤治疗。
与现有技术相比,本发明的优点在于:
(1)本发明的一种气体驱动的靶向纳米材料,包括响应膜,响应膜的内部设置有反应核,反应核内包覆有药物分子和气体前驱分子,药物负载效率为5.59%,气体前驱分子的负载效率为19.14%,在进入生物体后稳定性较好,直至遇到导致病因的细菌/病毒/蛋白时,响应膜会与致病因子中的成分作用,导致相应膜被破坏(打孔、破裂等),此时,反应核的外部条件发生变化,反应核变为开放结构,生物体内的水分子等成分能够与气体前驱分子作用产生相应的气体,气体产生后向外部扩散,从而促进药物分子释放,同时,相应的气体不仅能够引发并促进药物的释放,还能够对哺乳动物体内的各种生理功能进行调节,促进疾病痊愈。
(2)本发明的一种气体驱动的靶向纳米材料且响应膜和反应核均为脂质体纳米材料,不仅成本较低,而且具有良好的生物相容性和体内可降解特性,给药的安全性较高,同时能够稳定且均匀的的分散在水中,具有良好的应用前景。
(3)本发明的一种气体驱动的靶向纳米材料,在体内直接作用于病灶部位,能够避免常规给药导致的耐药性和对正常组织毒副作用,提高给药的安全性和药效。
附图说明
图1为本发明实施例中气体驱动的靶向纳米材料的结构示意图;
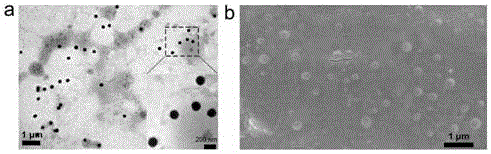
图2为本发明实施例1中靶向纳米材料的透射和扫描电子显微镜图;
图3为本发明实施例1中靶向纳米材料负载药物和气体前驱分子的元素mapping照片;
图4为本发明实施例1中靶向纳米材料遇到外源性刺激毒素时,毒素在脂质体表面打孔的电镜照片;
图5为本发明实施例1中靶向纳米材料产生h2o2和o2图;
图6为本发明实施例1中靶向纳米材料释放药物图;
图7为本发明实施例1中靶向纳米材料体外抗菌效果图;
图8为本发明实施例1中靶向纳米材料小动物活体抗菌效果图。
图中:1-响应膜,2-反应核,3-药物分子,4-气体前驱分子,5-响应分子。
具体实施方式
以下结合附图及实施例对本发明作进一步详细说明。
参见图1所示,本发明实施例提供一种气体驱动的靶向纳米材料,包括响应膜1,响应膜1的内部设置有反应核2,反应核2内包覆有药物分子3和气体前驱分子4,响应膜1能够与外部细菌/病毒/蛋白特异性结合,并在结合时被破坏,同时,反应核2被破坏,气体前驱分子4释放气体,药物分子3能够随气体释放到响应膜1外部,与细菌/病毒/蛋白作用,响应膜1上设置有响应分子5,响应分子5用于特异性识别细菌/病毒/蛋白。
本发明中,靶向纳米材料的药物负载效率大于等于5.59%,气体前驱分子的负载效率大于等于19.14%,且响应膜1和反应核2均为脂质体纳米材料,具有良好的生物相容性和体内可降解特性,给药的安全性较高,同时能够稳定且均匀的的分散在水中,具有良好的应用前景。
本发明中,响应膜1为磷脂类构成,其具有较好的生物相容性,能够无障碍进入生物体内且稳定存在,进一步的,响应膜1到达生物体内病灶部位时,导致病变的细菌/病毒/蛋白能够与响应膜1相互作用,如打孔、破裂等,使得响应膜1被破坏。
反应核2为封闭结构,且为脂溶性材料,可以为圆形、矩形或者异形结构,具有较好的生物相容性,同时,反应核2为相变结构:当外部的ph值或/和渗透压或/和温度等条件改变时,反应核2的封闭结构变为开放结构,外部的成分能够进入反应核2的内部,反应核2内部的成分也能够释放到外部。
气体前驱分子4是能够与生物体内的水或者其他成分作用产生气体的成分,这些气体包括但不限于co2、一氧化氮(no)、一氧化碳(co)、氧气(o2)和硫化氢(h2s),相对应的气体前驱分子4为过氧化钙(cao2)、过氧化氢(h2o2)、碳酸盐(na2co3nahco3,nh4hco3)等。
药物分子3可以为抗菌药/抗病毒药/抗肿瘤药,其中,抗菌药包括但不限于β—内酰胺类、氨基糖苷类、四环素类、氟喹诺酮类、叶酸途径抑制剂类、霉素、糖肽类和大环内酯类,具有抗菌性能的纳米材料但不限于(如纳米银,纳米氧化锌,纳米氧化铜等);抗病毒药包括但不限于抗呼吸道病毒感染药物(金刚烷胺、金刚乙胺、利巴韦林等)、抗免疫缺陷病毒药物(齐多夫定、扎西他滨、阿巴卡韦等)、抗肝炎病毒药物(α干扰素、拉米夫定等)、抗疱疹病毒药物(碘苷、阿昔洛韦、酞丁胺、咪喹莫特等);抗肿瘤药物包括但不限于细胞毒类药物氮芥类、亚硝尿类、甲基磺酸酯类铂类化合物如顺铂、卡铂和草酸铂等,抑制rna合成的药物如:放线菌素d、柔红霉素、阿霉素、表阿霉素、阿克拉霉素、光辉霉素等
本发明的气体驱动的靶向纳米材料在遇到导致病因的细菌/病毒/蛋白时,响应膜1会与致病因子中的成分作用,导致相应膜1被破坏(打孔、破裂等),此时,反应核2的外部条件发生变化,反应核2变为开放结构,生物体内的水分子等成分能够与气体前驱分子4作用产生相应的气体,气体产生后向外部扩散,从而促进药物分子3释放,同时,有些气体不仅能够引发并促进药物的释放,还能够对哺乳动物体内的各种生理功能进行调节,如:no能够调节许多生物事件的细胞信号分子,包括血管扩张、血管生成和平滑肌收缩;co是具有抗炎和抗凋亡作用的信使,h2s参与免疫反应、心血管保护和抗氧化,因此,这些气体不仅能够作为药物载体的释放剂,还能够作为治疗介质,参与疾病治疗,促进疾病的痊愈。
本发明还提供一种气体驱动的靶向纳米材料的制备方法,包括以下步骤:
s1、配置相变材料,将相变材料与相应的气体前驱分子和药物分子混合,得到反应核前体。
s2、配置磷脂溶液并加热至40~60℃,将反应核前体加入磷脂溶液并搅拌,使包裹有气体前驱分子和药物分子的反应核前体均匀分散且被磷脂溶液包裹,形成以磷脂为响应膜1,相变材料为反应核2的靶向纳米材料粗品,将靶向纳米材料粗品离心、过滤纯化,得到靶向纳米材料。
其中,相变材料的配置可以为:两种或多种脂肪酸或者醇类按照不同的比列形成的低共熔混合物。其中脂肪酸可以为月桂酸、硬脂酸、肉豆蔻酸或/和1-十四烷醇。
磷脂溶液的配置可以使用磷脂和直链单官能团聚乙二醇衍生物,配置比例根据实际需要确定,其中,磷脂可以为甘油磷脂或鞘磷脂,如卵磷脂、脑磷脂、磷脂酰丝氨酸、d-鞘氨醇或二氢鞘氨醇;直链单官能团聚乙二醇衍生物可以为dspe-peg3400、dspe-peg2000、mpeg2000-dspe、m-peg-cooh或m-peg-sha。
本发明还提供一种气体驱动的靶向纳米材料的应用,其能够用于细菌、病毒、肿瘤治疗。
下面,通过3实施例对本发明进行详细说明。
实施例1
将月桂酸和硬脂酸按照质量比为4:1、以4mg/ml浓度溶解在甲醇溶液中,得到相变材料,将3ml相变材料与相应的气体前驱分子和药物分子混合,得到反应核2,本实施例中,气体前驱分子为5mg/mlcao2的dmso(二甲基亚砜)溶液,药物分子为500μl,5mg/ml利福平的dmso溶液。
将卵磷脂和dspe-peg3400(平均分子量为3400的磷脂聚乙二醇活性酯)按质量比3:1、以1mg/ml的浓度溶解在4%乙醇水溶液中,得到磷脂溶液,将15ml磷脂溶液加热至50℃。
将反应核2加入加热后的磷脂溶液中进行剧烈涡旋2分钟,冷却后离心,通过0.22微米过滤器过滤并洗涤,得到靶向纳米材料,保存于温度为4℃的水中并表征。
参见图2a和2b所示,本实施例合成的靶向纳米材料中,明显为一壳多核的结构,参见图3所示,靶向纳米材料中特征元素碳、氮、氧、磷、钙均表征成功,说明靶向材料成功合成。
下面,通过5个验证实验对靶向纳米材料的性能进行验证
验证实验1免疫金染色实验确认毒素进入靶向纳米材料
将靶向纳米材料与毒素在37℃的温度下共孵育2h,用1%的bsa(牛血清白蛋白)溶液洗涤,依次加入一抗(polyclonalrabbitanti-staphylococcalα-toxin(α-hemolysin)antibody)、二抗(goldanti-rabbitlggh&l(40nmgold)preadsorbed)各染色30min后,将所得溶液用tem(透射电子显微镜)和sem(扫描电子显微镜)进行表征,并以没有处理的靶向纳米材料作为对照实验。
参见图4所示,图4a中没有经过表面处理的靶向纳米材料表面没有吸附纳米金,证明本实施例制备的靶向纳米材料可以吸附毒素;图3b中处理后的靶向纳米材料表面分布有小孔洞,说明靶向纳米材料可以被毒素穿孔。
验证实验2纳米载体在有无毒素的条件下产生过氧化氢和氧气
将负载有过氧化钙(cao2)的靶向纳米材料分别与毒素、去离子水混合成溶液后在37℃下孵育,孵育过程中用过氧化氢检测试剂盒检测不同孵育时间对应的溶液中(30、60、90、120、150min)过氧化氢的浓度,与理论产生过氧化氢的总量相比,得到过氧化氢的相对产量,同时使用便携式溶解氧分析仪检测不同时间点(30、60、90、120、150min)对应的溶液中氧气的浓度,并据此得到过氧化钙的负载率为19.14%。
参见图5a可知,随着时间的增加,与毒素孵育的靶向纳米材料混合溶液中过氧化氢的产量持续增多,而与去离子水孵育的靶向纳米材料混合溶液中没有过氧化氢。
参见图5b可知,与毒素孵育的靶向纳米材料混合溶液中产生了氧气,而与去离子水孵育的靶向纳米材料混合溶液中没有产生氧气。
进一步的,将图2与图4对比:图4中靶向纳米材料的尺寸大于图2,由此可知,产生的氧气可以使靶向纳米材料膨胀变大。
验证试验3不同的纳米载体在不同温度下的相对释放量
将负载有过氧化钙靶向纳米材料和毒素、去离子水在不同温度下(28、30、33、35、37℃)相互作用,且作用时间为30、60、90、120、150min,采用紫外分光光度计检测不同温度、时间下作用体系中利福平的释放浓度,与理论释放出利福平的最大浓度相比,得出利福平的相对释放量,并据此得到利福平的负载率为5.59%。
同时将没有负载过氧化钙的靶向纳米材料与毒素或去离子水在37℃下作用不同的时间(30、60、90、120、150min)、用紫外分光光度计检测出不同温度、时间下作用体系中利福平的释放浓度,与理论释放出利福平的最大浓度相比,得出利福平的相对释放量。
参见图6a可知:负载有过氧化钙靶向纳米材料和毒素作用时,随着温度和时间的增加,利福平的释放量逐渐增加;参见图6b可知:没有负载过氧化钙靶向纳米材料和毒素作用时,均只释放少量利福平;有负载过氧化钙靶向纳米材料和去离子水作用时,只释放少量利福平,由此可知:在过氧化钙的存在可以有效促进利福平的释放。
验证试验4不同的纳米载体对细菌的抗菌评价
分别将200ul浓度为100ug/ml、纳米载体不同(仅负载过氧化钙、仅负载利福平、二者均负载、二者均不负载)的靶向纳米材料与浓度为108cfu/ml细菌在37℃的条件下作用两个小时,通过涂布稀释平板法统计细菌的菌量,与对照的细菌量(仅添加等量的去离子水)相比,计算出不同纳米载体的抗菌效果。
结果表明:负载有利福平和过氧化钙纳米载体的靶向纳米材料表现出良好的抗菌活性,接近于100%。只负载一个纳米载体和未负载纳米载体的抗菌效果均较差。
验证试验5不同的纳米载体促进伤口愈合
用打孔器在小鼠背部建立伤口,然后用皮下注射的方式,将100ul106cfu/ml的细菌注射到伤口处,建立伤口感染模型。
然后分别将100ul浓度为100ug/ml纳米载体不同(仅负载过氧化钙、仅负载利福平、二者均负载、二者均不负载)的靶向纳米材料涂抹在不同小鼠的伤口处,两天治疗一次,连续治疗10天。同时,分别在第4、6、8、10天收集伤口处的细菌通过涂布稀释平板法统计伤口的菌量,计算出纳米载体不同的靶向纳米材料对伤口处细菌的抑制率。
参见图7所示,被负载有利福平和过氧化钙的靶向纳米材料治疗后的伤口菌量抑制率较高,只负载一个纳米载体和未负载纳米载体伤口菌量的抑制率较低,说明本实施例的靶向纳米材料对伤口具有良好的治疗效果。
综上所述,本实施例提供的靶向纳米材料利用磷脂双分子层包裹相转换材料并负载抗菌药物,来靶向治疗有害细菌,具有较好的抑菌效果,且副作用较小。
实施例2
以质量比为1:2的肉豆蔻酸和1-十四烷醇按浓度为7mg/ml溶解在甲醇溶液中,得到相变材料;以肌醇磷脂和mpeg2000-dspe(培化磷脂酰乙醇胺)按质量比6:1、以2mg/ml的浓度溶解在6%的乙醇水溶液中,得到磷脂溶液,以乙型肝炎病毒作为实验病毒,恩替卡韦作为药物分子na2co3nahco作为气体前驱分子。
除药物分子使用恩替卡韦、na2co3nahco作为气体前驱分子外,靶向纳米材料的合成步骤与实施例1基本一致,得到的靶向纳米材料为一壳多核的结构,特征元素碳、氮、氧、磷、钙均表征成功。
验证试验除实验病毒为乙型肝炎、感染乙型肝炎的方法外,其他验证步骤与实施例1中的验证步骤基本一致。
且验证结果表明本实施例的靶向纳米材料可以吸附毒素,也可以被毒素穿孔,与毒素孵育过程中可以产生了二氧化碳,且能够释放出恩替卡韦,对病毒的清除效果优于直接喂食恩替卡韦,本实施例中,恩替卡韦的负载效率为6.1%,na2co3nahco的负载效率为22.4%。
实施例3
将肉豆蔻酸溶解在甲醇溶液中,得到相变材料,将d-鞘氨醇和m-peg-cooh按质量比3:1、以5mg/ml的浓度溶解在8%的乙醇水溶液中,得到磷脂溶液。
本实施例以乳腺肿瘤细胞作为实验肿瘤细胞,以赫赛汀作为药物分子,h2o2作为气体前驱分子进行试验。
除药物分子使用赫赛汀、h2o2作为气体前驱分子外,靶向纳米材料的合成步骤与实施例1基本一致,得到的靶向纳米材料为一壳多核的结构,特征元素碳、氮、氧、磷、钙均表征成功。
验证试验除实验病毒为乳腺肿瘤细胞,接种肿瘤细胞方法外,其他验证步骤与实施例1中的验证步骤基本一致。
且验证结果表明本实施例的靶向纳米材料与乳腺肿瘤细胞孵育过程中可以产生了氧气,且能够释放出赫赛汀,能够抑制乳腺肿瘤细胞的增值,其效果好与直接喂食赫赛汀,本实施例中,赫赛汀的负载效率为6%,h2o2的负载效率为23%。
本发明不局限于上述实施方式,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明的保护范围之内。本说明书中未作详细描述的内容属于本领域专业技术人员公知的现有技术。
- 还没有人留言评论。精彩留言会获得点赞!