一种生长抑素或其类似物的口服药物组合物的制作方法
本发明属于生物医药技术领域,具体涉及一种生长抑素或其类似物的口服药物组合物。
背景技术:
生长抑素(生长素释放抑制素,growthhormonerelease-inlease-inhibitinghormone,ghrih,或somatostatin)是由116个氨基酸的大分子肽裂解而来的十四肽,其分了结构呈环状,在第3位和第14位半胱氨酸之间有一个二硫键;生长抑素是作用比较广泛的一种神经激素,它的主要作用是抑制垂体生长激素(gh)的基础分泌,也抑制腺垂体对多种刺激所引起的gh分泌反应,包括运动、进餐、应激、低血糖等。另外,生长抑素还可抑制lh、fsh、tsh、prl及acth的分泌。生长抑素与腺垂体生长素细胞的膜受体结合后,通过减少细胞内camp和ca2而发挥作用。除下丘脑外,其他部位如大脑皮层、纹状体、杏仁核、海马,以及脊髓、交感神经、胃肠、胰岛、肾、甲状腺与甲状旁腺等组织广泛存在生长抑素。在脑与胃肠又纯化出28个氨基酸组成的ghrih28,它是ghrih14n端向外延伸而成。生长抑素的垂体外作用比较复杂,它在神经系统可能起递质或调质的作用;生长抑素对胃肠运动与消化道激素的分泌均有一定的抑制作用;它还抑制胰岛素、胰高血糖素、肾素、甲状旁腺激素以及降钙素的分泌。
生长抑素及其类似物均不能口服,这造成患者依从性较差,因此,改变生长抑素及其类似物给药途径具有重要意义。
技术实现要素:
基于上述原因,申请人经过多次创造性研究,得到一种新的促进小肠吸收药物组合物,该组合物是由十二烷基硫酸钠、卡波姆、壳聚糖、枸橼酸钠组成,研究表明,本发明所述的促进小肠吸收药物组合物具有制备成一种复合辅料,该辅料与生长抑素和/或生长抑素类似物组合物后,可以提高该有效成分在小肠内的吸收等作用。
本发明是通过下述技术方案实现的。
一种药物组合物,该药物组合物含有:生长抑素和/或生长抑素类似物、促小肠吸收药物组合物制备而成,其中促小肠吸收药物组合物由十二烷基硫酸钠、卡波姆、壳聚糖、枸橼酸钠组成。
所述的药物组合物制备成口服制剂。
生长抑素类似物包括:奥曲肽。
本发明所述促小肠吸收药物组合物用于保障生长抑素和/或生长抑素类似物在小肠吸收。
本发明所述促小肠吸收药物组合物用于促进生长抑素和/或生长抑素类似物在小肠内吸收。
其中十二烷基硫酸钠、卡波姆、壳聚糖、枸橼酸钠的重量比为15-25:5-8:5-8:50-80。
其中生长抑素和/或生长抑素类似物与促小肠吸收药物组合物的重量比为:1:5-860。
一种口服制剂,该口服制剂是由生长抑素和/或生长抑素类似物、十二烷基硫酸钠、卡波姆、壳聚糖、枸橼酸钠制备而成。
其中十二烷基硫酸钠、卡波姆、壳聚糖、枸橼酸钠的重量比为15-25:5-8:5-8:50-80。
其中生长抑素和/或生长抑素类似物与促小肠吸收药物组合物的重量比为:1:5-860。
本发明的促小肠吸收药物组合物,获得一种新型辅料,该辅料可以用于:不能口服只能注射的药物(有效成分或活性成分)可以通过口服给药,从而改变药物(有效成分或活性成分)的给药方式。
本发明的促小肠吸收药物组合物能够促进在胃肠道内易于分解的药物(有效成分或活性成分)在肠内的吸收。
本发明的促小肠吸收药物组合物能够促进在胃肠道不易于吸收的药物(有效成分或活性成分)在肠内的吸收。
由于本发明促小肠吸收药物组合物是促进药物(有效成分或活性成分)在小肠吸收,要求在小肠内释放才能发挥其功效,因此在进行药效试验和药代试验时,啮齿类动物采用小肠导管给药,哺乳动物采用肠溶胶囊口服给药。
本发明将促小肠吸收药物组合物和药物(有效成分或活性成分)逐一搭配在啮齿类动物上进行生物利用度检测,同时会选择部分多肽在不同动物上进行药效和药代动力学的检测。
附图说明
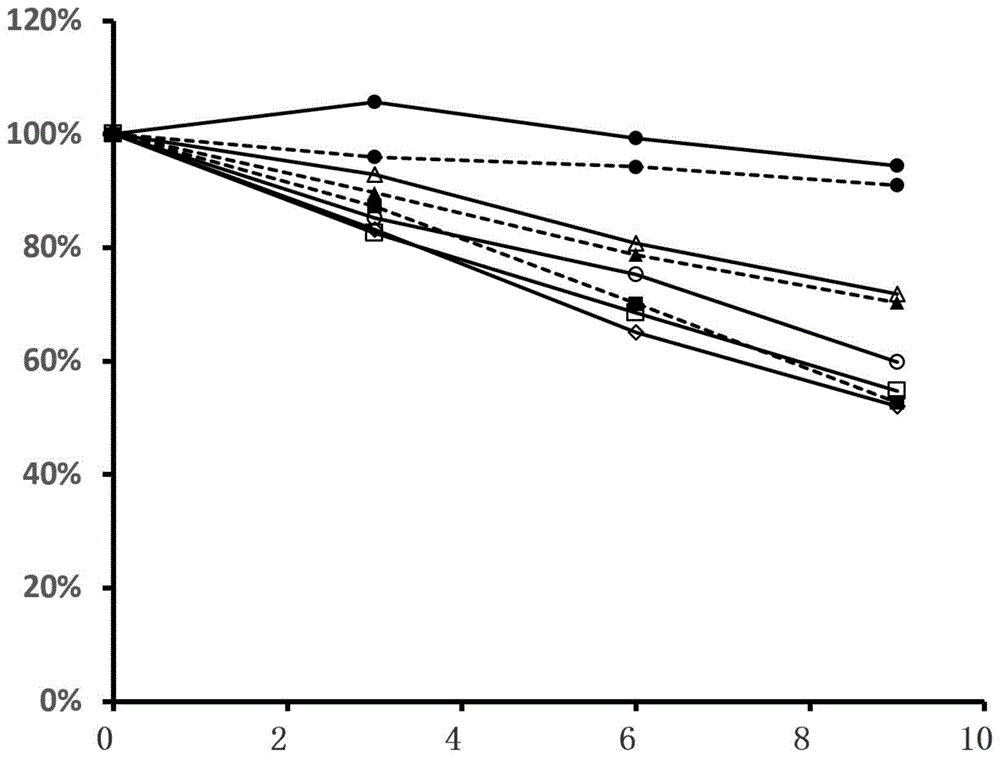
1、图1为exenatide在stz大鼠上的pd试验
其中:横坐标为时间(h),纵坐标为降低血糖效率(%)。
其中:实心圆形实线为小肠注射生理盐水2ml/kg,实心方形虚线为皮下注射exenatide1μg/kg,实心圆形虚线为皮下注射exenatide250μg/kg,实心三角形虚线为皮下注射exenatide1mg/kg,空心三角形实线为小肠给予试验1药物组合物+exenatide(给药量exenatide30μg/kg),空心圆形实线为小肠给予试验1药物组合物+exenatide(给药量exenatide40μg/kg),空心方形实线为小肠给予试验1药物组合物+exenatide(给药量exenatide50μg/kg),空心菱形实线为小肠给予试验1药物组合物+exenatide(给药量exenatide60μg/kg)。
2、图2为exenatide在大鼠上的ivpk试验
其中:横坐标为时间(min),纵坐标为大鼠血浆中exenatide浓度(ng/ml)。
3、图3为exenatide/试验1药物组合物在大鼠上的eipk试验
其中:横坐标为时间(min),纵坐标为大鼠血浆中exenatide浓度(ng/ml)。
4、图4为exenatide在比格犬上的ivpk试验
其中:横坐标为时间(min),纵坐标为比格犬血浆中exenatide浓度(ng/ml)。
5、图5为exenatide/试验1药物组合物在比格犬上的popk试验
其中:横坐标为时间(min),纵坐标为比格犬血浆中exenatide浓度(ng/ml)。
6、图6为exenatide在alloxan比格犬上的pd试验
其中:横坐标为时间(h),纵坐标为比格犬血糖(mm)。
其中:实心圆形实线为alloxan比格犬餐后血糖情况,实心方形实线为alloxan比格犬吞服exenatide/试验1药物组合物后餐后血糖情况,实心菱形实线为正常比格犬餐后血清情况。
具体试验例
以下以具体试验例来说明本发明的技术方案,但本发明的保护范围不限于此。
本说明书试验例所述的内容仅仅是对发明构思的实现形式的列举,本发明的保护范围不应当被视为仅限于试验例所陈述的具体形式,本发明的保护范围也及于本领域技术人员根据本发明构思所能够想到的等同技术手段。尽管以下本发明的实施方案进行了描述,但本发明并不局限于上述的具体实施方案和应用领域,下述的具体实施方案仅仅是示意性的、指导性的,而不是限制性的。本领域的普通技术人员在本说明书的启示下和在不脱离本发明权利要求所保护的范围的情况下,还可以做出很多种的形式,这些均属于本发明保护之列。
本发明下述试验,是在多次创造性试验的基础上,以本发明所要保护的技术方案为基础,总结的研发人员的结论性试验。以下试验例中的定量试验,均设置三次重复实验,数据为三次重复实验的平均值或平均值±标准差。
试验1显著提高小肠给入exenatide(exendin4,exe4)的药效
促小肠吸收药物组合物为:十二烷基硫酸钠,卡波姆,壳聚糖,枸橼酸钠,重量比为:20:6.5:6.5:65。
将exenatide与上述药物组合物按照重量比1:5充分混匀,待用;
试验动物:sd雄性大鼠,腹腔注射45mg/kgstz构建高血糖模型;
小肠药效试验:皮下注射(sc)或经小肠导管(ei)给药,于0h,3h,6h和9h采集血样检测血糖情况。
结果显示,小肠给入的exenatide在没有添加上述药物组合物的情况下,其降糖效果很微弱,剂量达到1mg/kg时,其9h后的降糖效率也只有70%左右,远低于其皮下1μg/kg的剂量所能达到的50%左右。而添加本发明药物组合物后,给药剂量50μg/kg即可达到皮下1μg/kg的降糖效果。见附图1。
试验2显著提高小肠给入exenatide的生物利用度
将exenatide与试验1促小肠吸收药物组合物按照重量比1:5充分混匀,待用;
试验动物:成年雄性sd大鼠;
小肠pk试验:在空腹状态的成年sd大鼠上,按1ml/kg给药体积经小肠导管给药,使exenatide剂量为200μg/kg,另分一组,小肠导管注射(ei)200μg/kg的exenatide或添加本发明药物组合物的exenatide,给药后0h,0.5h,1h,1.5h,2h,2.5h和3h,尾部采血,血样经10mmedta抗凝,4℃3000rpm离心5min,收集血浆速冻。
为避免动物出现低血糖,在给药前,先给入1g/kg的葡萄糖。
elisa检测方法:用抗目标多肽的小鼠单抗包被,1%bsa封闭,再加入血样或0.1%bsa稀释的标准品孵育,biotin标记的抗目标多肽的兔多抗捕获,hrp偶联的strepavidin孵育,最后tmb显色,hcl终止,450nm读数。根据标准品得到的标准曲线,计算血浆内目标多肽的浓度。
根据pk曲线计算auc,以静脉注射(iv)的生物利用度为100%,计算小肠给药的生物利用度。
结果显示,exenatide经iv注射1μg/kg后的pk曲线的auc为0.93ng/ml.h,经小肠注射200μg/kg,血内浓度已低于elisa检测下限。而添加试验1药物组合物后,pk曲线的auc可以达到1.47ng/ml.h,小肠给入的生物利用度约为0.79%。试验结果见图2和图3。
试验3显著提高口服exenatide的生物利用度
将exenatide0.7mg与试验1促小肠吸收药物组合物200mg充分混匀,并冻干,装入3号肠溶胶囊,备用;
将exenatide0.7mg与试验1促小肠吸收药物组合物400mg充分混匀,并冻干,装入0号肠溶胶囊,备用;
将exenatide0.7mg与试验1促小肠吸收药物组合物600mg充分混匀,并冻干,装入00号肠溶胶囊,备用;
将exenatide0.7mg与试验1促小肠吸收药物组合物200mg充分混匀,并冻干,装入3号普通胶囊,备用;
将exenatide0.7mg与甘露醇200mg充分混匀,并冻干,装入3号肠溶胶囊,备用;
试验动物:成年雄性比格犬
口服pk试验:动物空腹状态,口服肠溶胶囊后,于0.5,1,1.5,2,2.5,3h采集血样。血样经10mmedta抗凝,4℃、3000rpm离心5min,收集血浆速冻。
静脉pk试验:动物空腹状态,静脉注射0.3μg/kgexenatide,于5,15,30,60,90,120min采集血样。血样经10mmedta抗凝,4℃、3000rpm离心5min,收集血浆速冻。见图4和图5.
为避免动物出现低血糖,在给药前,先给入1g/kg的葡萄糖。
elisa检测方法:用抗目标多肽的小鼠单抗包被,1%bsa封闭,再加入血样或0.1%bsa稀释的标准品孵育,biotin标记的抗目标多肽的兔多抗捕获,hrp偶联的strepavidin孵育,最后tmb显色,hcl终止,450nm读数。根据标准品得到的标准曲线,计算血浆内目标多肽的浓度。
根据pk曲线计算auc,以静脉注射(iv)的生物利用度为100%,计算小肠给药的生物利用度。
比格犬的pk数据显示,静脉注射0.3μg/kg的exenatide的auc约为0.82ng/ml.hour,口服exenatide/试验1药物组合物0.7mg的auc约为1.36ng/ml.hour。口服exenatide/试验1药物组合物的生物利用度约为0.83%。
exenatide在没有本发明药物组合物的协助下,无法成功进入血液内,而加入本发明药物组合物后,入血效率得到显著改善。虽然exenatide的入血效率随着试验1药物组合物重量的增加而略有增加,但增加的幅度有限。综合口服的便利性和药物有效性两方面的考虑,3号胶囊量比较合适。
表1exenatide/试验1促小肠吸收药物组合物在比格犬上的popd试验
试验4exenatide/试验1促小肠吸收药物组合物可以明显抑制alloxan比格犬餐后血糖的升高
将exenatide0.7mg与试验1促小肠吸收药物组合物200mg充分混匀,并冻干,装入3号肠溶胶囊,备用;
试验动物:成年雄性比格犬;
动物体检与适应:采集动物空腹血样检测血生化指标,确定一切正常后,将动物放在较安静的房间适应1周,要求每天喂食时间和喂食量保持一致;
造模前数据采集:每天采集4个时间点血样(喂食前、喂食后2h、4h、6h),连续采集5天;
造模试验:空腹状态,静脉推注60mg/kgalloxan溶液,一周后,每天采集4个时间点血样(喂食前、喂食后2h、4h、6h),连续采集5天;根据采集的数据,判断模型是否合格。若合格开始药效试验;
药效试验:喂食前吞服测试胶囊,采集4个时间点血样(喂食前、喂食后2h、4h、6h)。
结果显示,exenatide/试验1促小肠吸收药物组合物在alloxan造模的比格犬上可以明显抑制餐后血糖的上升。见图6。
试验结论:通过上述试验表明,本发明促小肠吸收药物组合物具有很好的促进不能口服的有效成分在肠内的吸收,可以作为新型药用辅料使用。
试验例5本发明药物组合物可以显著提高小肠给入奥曲肽(octreotide)的生物利用度
本发明药物组合物:十二烷基硫酸钠、卡波姆、壳聚糖、枸橼酸钠重量比为:21:7:6:69。
将奥曲肽与本发明药物组合物按照重量比1:5充分混匀,待用;
试验动物:成年雄性sd大鼠;
小肠pk试验:在空腹状态的成年sd大鼠上,按1ml/kg给药体积经小肠导管给药,使奥曲肽剂量为200μg/kg,另分一组,小肠导管注射(ei)添加本发明药物组合物的奥曲肽200μg/kg,给药后0h,0.5h,1h,1.5h,2h,2.5h和3h,尾部采血,血样经10mmedta抗凝,4℃、3000rpm离心5min,收集血浆速冻。
静脉pk试验:动物空腹状态,静脉注射1μg/kg奥曲肽,于5,15,30,60,90,120min采集血样。血样经10mmedta抗凝,4℃、3000rpm离心5min,收集血浆速冻。
elisa检测方法为用抗目标多肽的小鼠单抗包被,1%bsa封闭,再加入血样或0.1%bsa稀释的标准品孵育,biotin标记的抗目标多肽的兔多抗捕获,hrp偶联的strepavidin孵育,最后tmb显色,hcl终止,450nm读数。根据标准品得到的标准曲线,计算血浆内目标多肽的浓度。
根据pk曲线计算auc,以静脉注射(iv)的生物利用度为100%,计算小肠给药的生物利用度。
结果显示,奥曲肽经小肠给药200μg/kg,血内浓度低于elisa检测下限。而添加本发明药物组合物后,小肠给入的生物利用度可以达到1.71%。
试验6本发明促小肠吸收药物组合物可以显著提高小肠给入生长抑素-14的生物利用度
促小肠吸收药物组合物:十二烷基硫酸钠、卡波姆、壳聚糖、枸橼酸钠重量比为:20:6.5:6.5:68。
将生长抑素-14与本发明药物组合物按照重量比1:5充分混匀,待用;
试验动物:成年雄性sd大鼠;
小肠pk试验:在空腹状态的成年sd大鼠上,按1ml/kg给药体积经小肠导管给药,使生长抑素-14剂量为200μg/kg,另分一组,小肠导管注射(ei)200μg/kg的生长抑素-14或添加本发明促小肠吸收的药物组合物的生长抑素-14(生长抑素-14为200μg/kg),给药后0h,0.5h,1h,1.5h,2h,2.5h和3h,尾部采血,血样经10mmedta抗凝,4℃、3000rpm离心5min,收集血浆速冻。
静脉pk试验:动物空腹状态,静脉注射1μg/kg生长抑素-14,于5,15,30,60,90,120min采集血样。血样经10mmedta抗凝,4℃、3000rpm离心5min,收集血浆速冻。
elisa检测方法为用抗目标多肽的小鼠单抗包被,1%bsa封闭,再加入血样或0.1%bsa稀释的标准品孵育,biotin标记的抗目标多肽的兔多抗捕获,hrp偶联的strepavidin孵育,最后tmb显色,hcl终止,450nm读数。根据标准品得到的标准曲线,计算血浆内目标多肽的浓度。
根据pk曲线计算auc,以静脉注射(iv)的生物利用度为100%,计算小肠给药的生物利用度。
结果显示,生长抑素-14经小肠注射200μg/kg,血内浓度低于elisa检测下限。而添加本发明促小肠吸收药物组合物后,生长抑素-14小肠给入的生物利用度可以达到0.70%。
试验7本发明促小肠吸收药物组合物可以显著提高生长抑素-28的生物利用度
本发明促小肠吸收药物组合物:十二烷基硫酸钠、卡波姆、壳聚糖、枸橼酸钠重量比为:3:1:1:10。
将生长抑素-28与本发明促小肠吸收药物组合物按照重量比1:5充分混匀,待用;
试验动物:成年雄性sd大鼠;
小肠pk试验:在空腹状态的成年sd大鼠上,按1ml/kg给药体积经小肠导管给药,使生长抑素-28剂量为200μg/kg,另分一组,小肠导管注射(ei)200μg/kg的生长抑素-28或添加本发明促小肠吸收药物组合物的生长抑素-28,给药后0h,0.5h,1h,1.5h,2h,2.5h和3h,尾部采血,血样经10mmedta抗凝,4℃、3000rpm离心5min,收集血浆速冻。
静脉pk试验:动物空腹状态,静脉注射1μg/kg生长抑素-28,于5,15,30,60,90,120min采集血样。血样经10mmedta抗凝,4℃、3000rpm离心5min,收集血浆速冻。
elisa检测方法为用抗目标多肽的小鼠单抗包被,1%bsa封闭,再加入血样或0.1%bsa稀释的标准品孵育,biotin标记的抗目标多肽的兔多抗捕获,hrp偶联的strepavidin孵育,最后tmb显色,hcl终止,450nm读数。根据标准品得到的标准曲线,计算血浆内目标多肽的浓度。
根据pk曲线计算auc,以静脉注射(iv)的生物利用度为100%,计算小肠给药的生物利用度。
结果显示,生长抑素-28经小肠注射200μg/kg,血内浓度低于elisa检测下限。而添加本发明促小肠吸收药物组合物后,生长抑素-28小肠给入的生物利用度可以达到0.40%。
- 还没有人留言评论。精彩留言会获得点赞!